-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Mozková (mikro)cirkulace – základní struktura a funkce
Autori: Jor Ondřej 1; Černý Vladimír 2
Pôsobisko autorov: Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Ostrava 1; Klinika anesteziologie, resuscitace a intenzivní medicíny, Fakultní nemocnice Hradec Králové 2
Vyšlo v časopise: Anest. intenziv. Med., 25, 2014, č. 2, s. 137-139
Kategória: Postgraduální vzdělávání - Kapitoly z klinické fyziologie
Mozkovou cirkulací prochází zhruba 15 % klidového srdečního výdeje. Spotřeba kyslíku mozkovými buňkami je velká, mozek na svá 2 % tělesné hmotnosti spotřebuje 20 % celkové spotřeby kyslíku.
MOZKOVÉ CÉVY
V systémovém oběhu tvoří většinu cévní rezistence drobné arterioly. V mozku představují většinu cévní rezistence větší arterie [1]. Mozková mikrocirkulace zahrnuje piální a penetrující arterioly, kapiláry a venuly (pro ilustraci obrázek 1, který ukazuje mozkovou kapilární síť králíka, obraz získán metodou SDF imaging – vlastní materiál autorů článku). Hlavní funkcí arteriální časti mikrocirkulace je dodávka nutričních substrátů tkáním a regulace průtoku krve. Kapiláry a venuly také významně přispívají k cerebrovaskulární rezistenci, ale jejich role v regulaci průtoku je za fyziologických podmínek minimální [12]. Mozkové cévy lze dělit podle vztahu k mozkovému parenchymu na vnitřní a vnější. Propojení mezi nimi tvoří penetrující arterioly. Mozkové cévy jsou vystaveny menšímu transmurálnímu tlaku než cévy systémové, proto mají tenčí stěnu [1]. Mozkové arterie postrádají vasa vasorum, výživu získávají z cerebrospinálního moku, proto jsou více odolné vůči vlivu hypotenze a ischémie [12]. Hustota kapilární sítě odpovídá metabolickým nárokům tkání. Tyto nároky rostou s počtem synapsí v dané oblasti. Šedá kůra má asi 3krát bohatší kapilární síť než hmota bílá [2].
Obr. 1. Mozková kapilární síť králíka 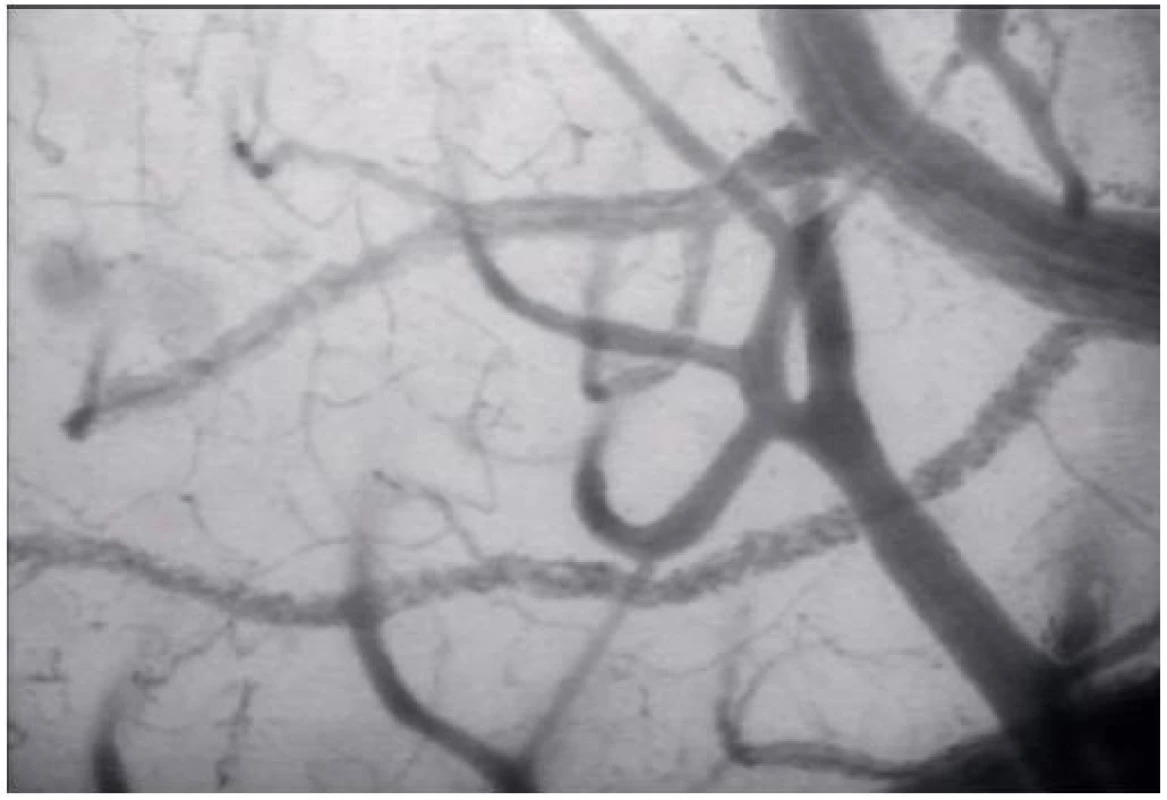
FENOMÉN AUTOREGULACE
Mozkové cévy jsou vybaveny tzv. autoregulační schopností, která zajišťuje udržení konstantního průtoku krve navzdory změnám v perfuzním tlaku. Průtok krve v mozku zůstává konstantní v rozmezí středního arteriálního tlaku 60–140 mm Hg [3]. Hodnota tohoto tlakového rozmezí se posouvá směrem doprava při chronické hypertenzi. Mozek je tak chráněn před zvýšeným systémovým tlakem, ale schopnost autoregulace průtoku za podmínek sníženého arteriálního tlaku je redukovaná. Za podmínek chronické hypertenze dochází ke zbytnění cévní stěny [4, 5]. Uvedené morfologické změny jsou reverzibilní, vyžadují však časový odstup. Tento fakt je třeba brát v úvahu např. při léčbě chronické hypertenze [6].
HEMATOENCEFALICKÁ BARIéRA (HEB)
HEB představuje rozhraní mezi krví a mozkomíšním mokem. Je propustná pro vodu a lipofilní látky, přestup hydrofilních látek (např. aminokyseliny, glukóza) je možný pouze přes specifické transportní molekuly. HEB je tvořena endoteliálními buňkami, bazální membránou, astrocyty a pericyty. Endotelie jsou spojeny pomocí tight junctions, které omezují difuzi nabitých molekul [7]. Astrocyty se podílejí na regulaci průtoku a propustnosti. Cévy v oblastech s menší denzitou astrocytů jsou propustnější [8]. Díky hematoencefalické bariéře mnoho látek s vazoaktivním účinkem neprostupuje do mozkové cirkulace a tím se nepodílí na kontrole průtoku.
REGULACE PRŮTOKU
Na regulaci průtoku krve mozkem se podílejí systémy, které spolu vzájemně spolupracují a doplňují se. Za fyziologických podmínek dominuje metabolická kontrola, kde metabolické nároky tkání určují průtok danou oblastí. Adenosin je pokládán za hlavní metabolit řídící dlouhodobou kontrolu průtoku. Vzniká jako meziprodukt metabolismu ATP za situace, kdy dodávka kyslíku do mozku nestačí k udržení energetických zásob. Působí na receptory v hladké svalovině cév a vyvolává vazodilataci [9]. Dále se na kontrole průtoku podílí vliv hyper - a hypokapnie. Nárůst PaCO2 o 1 mm Hg způsobí zvýšení průtoku o 2–4 % [21]. Mechanismus regulace průtoku hypoxií byl objasněn teprve nedávno. Hypoxie vede ke zvýšení hladiny H2S, které zprostředkovávají vazodilataci prekapilárních arteriol [12].
Zvýšení neuronální aktivity v mozku je spojeno s nárůstem koncentrace kalia v intersticiální tekutině, což vede k vazodilataci [11]. Zdá se, že deriváty kyseliny arachidonové hrají roli v regulaci průtoku krve mozkem během hypotenze. Vliv prostaglandinů na autoregulaci průtoku podporuje zjištění, že indometacin zhoršuje schopnosti autoregulace při hypotenzi [15]. Bradykinin (BK) je silný dilatátor extra - a intraparenchymových mozkových tepen. Vazomotorický účinek BK je zprostředkován receptory beta 2 na endotelových buňkách. Selektivní otevření hematoencefalické bariéry pro malé molekuly bylo zjištěno u koček během intraarteriální aplikace BK. Tento únik je zprostředkován beta 2 receptory pravděpodobně otevřením tight junctions. Vznik otoku mozku byl nalezen po ventrikulo-cisternální nebo intersticiální infuzi BK. To lze vysvětlit zvýšením vaskulární permeability a průtoku krve mozkem v důsledku arteriální dilatace. Zvýšení koncentrace BK v intersticiálním prostoru mozku až do koncentrací, které vyvolávají venodilataci bylo nalezeno u mnoha patologických stavů [23]. Bradykinin přes beta 2 receptory ale rovněž chrání v experimentu endotel mozkových cév prasat před cytotoxickými účinky (např. volných kyslíkových radikálů) a induktory buněčné smrti. Zvýšení hladiny bradykininu vede k expresi cytoprotektivních proteinů COX-2 a Bcl-2 [22]. Na regulaci průtoku se podílejí také astrocyty. Výběžky astrocytů obklopují drobné cévy a účastní se kontroly iontové homeostázy, slouží jako zdroj a regulátor neurotransmiterů. Podílejí se na strukturální a metabolické podpoře neuronů. Každý astrocyt zodpovídá za určitou oblast a reguluje průtok její mikrocirkulací [16]. Studie ukazují, že astrocyty mohou způsobit jak vazokostrikci, tak vazodilataci, záleží přitom na typu stimulace [17]. Astrocyty jsou méně citlivé na hypoxii a hypoglykémii než neurony [12]. Myogenní reflex funguje v systémové a mozkové cirkulaci stejným mechanismem [18]. Zvýšený tlak krve způsobí roztažení cévní stěny, které má za následek kontrakci její hladké svaloviny a zúžení průsvitu cévy. Průtok tím zůstane nezměněn.
Na nervové regulaci průtoku krve mozkem se podílejí nervy sympatické, parasympatické, senzorické a centrální mechanismy. Sympatické nervy pocházející z ganglion cervicale superius a inervují především větší mozkové cévy. Nervy pocházející z locus ceruleus inervují spíše menší arterie a arterioly [19]. Význam adrenergní regulace mozkových cév je daleko menší než u systémových cév. ED50 noradrenalinu je 100krát větší u a. basilaris než u a. saphena [20]. Význam adrenergní regulace klesá se zmenšujícím se průměrem cévy [19]. Sympatická inervace chrání mozek vazokonstrikcí před hypertenzí [24]. Mozkové arterie jsou bohatě inervovány sympatickými nervovými vlákny. Role autonomního nervového systému v kontrole regulace mozkového krevního průtoku však zůstává sporná. Za normálních podmínek (normotenze, normokapnie) má sympatikus na regulaci průtoku nevýznamný vliv, naproti tomu za podmínek hypertenze, hypoxie, hyperkapnie nebo krvácení má aktivace sympatiku na mozkové cévy významný vliv [13]. Stejně jako v ostatní cévách se na regulaci průtoku významně podílí endotel sekrecí vazoaktivních mediátorů. Vazodilatačně působí oxid dusnatý, prostaglandiny PGI2, PGE2, vazokonstrikčně působí především endotelin. Oxid dusnatý je nejvýznamnější mediátorem vedoucí k vazodilataci. Klíčové molekuly v regulaci průtoku jsou adenosin (dlouhodobá regulace), v mikrocirkulaci oxid dusnatý a nově sirovodík.
Ve fyziologii regulace mozkové kapilární sítě je i dnes velké množství neznámých, např. objevení významu molekuly sirovodíku pro endotel (nejenom v mozku) otevírá nové pohledy a přináší řadu nových (někdy až překvapivých) konceptů. Mozková makro - i mikrocirkulace a možnosti jejího ovlivnění představují nadále cíl širokého výzkumu, jehož výsledky mohou být pro náš obor a naše každodenní intervence zcela zásadní.
Body k zapamatování
- Mozkové arterie postrádají vasa vasorum, výživu získávají z cerebrospinálního moku, proto jsou více odolné vůči vlivu hypotenze a ischémie.
- Význam adrenergní regulace mozkových cév je obecně nízký a uplatňuje se převážně za patologických stavů (hypoxie, hyperkapnie).
- Průtok krve v mozku zůstává konstantní v rozmezí středního arteriálního tlaku 60–140 mm Hg, indometacin může potenciálně zhoršit efektivitu mozkové autoregulace.
- Za fyziologických podmínek dominuje v kontrole průtoku krve mozkem metabolická kontrola, kde metabolické nároky tkání určují průtok danou oblastí.
- Nárůst PaCO2 o 1 mm Hg způsobí zvýšení mozkového průtoku o 2–4 %.
Adresa pro korespondenci:
MUDr. Ondřej Jor
ARO
KARIM FN Ostrava
17. listopadu 1790
708 52 Ostrava-Poruba
Prof. MUDr. Vladimír Černý, Ph.D., FCCM
Centrum pro výzkum a vývoj
Fakultní nemocnice Hradec Králové
Klinika anesteziologie, resuscitacea intenzivní medicíny
Sokolská tř. 581
500 05 Hradec Králové
Department of Anesthesia, Pain Management and Perioperative Medicine,
Dalhousie University, Halifax, Nova Scotia, Canada
e-mail: cernyvla1960@gmail.com
Zdroje
1. Baumbach, G. L., Walmsley, J. G., Hart, M. N. Composition and mechanics of cerebral arterioles in hypertensive rats. J. Am. Pathol., 1988, 133, 3, p. 464–471.
2. Woolsey, T. A., Rovainen, C. M., Cox, S. B. et al. Neuronal units linked to microvascular modules in cerebral cortex: response elements for imaging the brain. Cereb. Cortex., 1996, 6, 5, p. 647–660.
3. Faraci, F. M., Heistad, D. D. Regulation of large cerebral arteries andcerebral microvascular pressure . Circ. Res., 1990, 66, 1, p. 8–17.
4. Baumbach, G. L., Heistad, D. D. Effects of sympathetic stimulationand changes in arterial pressure on segmental resistance of cerebral vessels in rabbits and cats. Circ. Res., 1983, 52, 5, p. 527–533.
5. Werber, A. H., Heistad, D. D. Effects of chronic hypertension and sympathetic nerves on the cerebral microvasculature ofstrokeprone spontaneously hypertensive rats. Circ. Res., 1984, 55, 3, p. 286–294.
6. Faraci, F. M., Mayhan, W. G., Heistad, D. D. Segmental vascularresponses to acute hypertension in cerebrum and brain stem. Am. J. Physiol., 1987, 252, 4, 2, p. 738–742.
7. Farkas, E., Luiten, P. G. Cerebral microvascular pathology in aging and Alzheimer’s disease. Prog. Neurobiol., 2001, 64, 6, p. 575–611.
8. Ramsauer, M., Krause, D., Dermietzel, R. Angiogenesis of the blood-brain barrier in vitro and the function of cerebral pericytes. FASEB J., 2002, 16, 10, p. 1274–1276.
9. Ibayashi, S., Ngai, A. C., Meno, J. R., Winn, H. R. Effects of topical adenosine analogs and forskolin on rat pial arterioles in vivo. J. Cereb. Blood Flow Metab., 1991, 11, 1, p. 72–76.
10. Demchenko, I. T., Oury, T. D., Crapo, J. D., Piantadosi, C. A. Regulation of the brain’s vascular responses to oxygen. Circ. Res., 2002, 91, 11, p. 1031 – 1037.
11. Janigro, D., Gasparini, S., D’Ambrosio, R., McKhann, G., DiFrancesco, D. Reduction of K uptake in glia prevents long-term depression maintenance and causes epileptiform activity.J. Neurosci., 1997, 17, 8, p. 2813–2824.
12. Morikawa, T., Kajimura, M., Nakamura, T., Hishiki, T., Nakanishi, T., Yukutake, Y., Nagahata, Y., Ishikawa, M., Hattori, K., Takenouchi, T., Takahashi, T., Ishii, I., Matsubara, K., Kabe, Y., Uchiyama, S., Nagata, E., Gadalla, M. M., Snyder, S. H., Suematsu, M. Hypoxic regulation of the cerebral microcircula-tion is mediated by a carbon monoxide-sensitive hydrogen sulfide pathway. Proc. Natl. Acad. Sci. USA, 2012, 24, 109, 4, p. 1293–1298.
13. Purkayastha, S., Raven, P. B. The functional role of the alpha-1 adrenergic receptors in cerebral blood flow regulation. Indian J. Phar-macol., 2011, 43, 5, p. 502–506. doi: 10.4103/0253-7613.84950.
14. Kulik, T., Kusano, Y., Aronhime, S., Sandler, S. L., Richard, H. Regulation of cerebral vasculature in normal and ischemic brain WinnNeuropharmacology. Author manuscript; available in PMC 2010 July 2. Published in final edited form as. Neuropharmacology, 2008, 55, 3, p. 281–288.
15. Leffler, C. W., Busija, D. W., Beasley, D. G. Effect of therapeutic dose of indomethacin on the cerebral circulation of newborn pigs. Pediatr. Res., 1987, 21, 2, p. 188–192.
16. Volterra, A., Meldolesi, J. Astrocytes, from brain glue to communication elements: the revolution continues. Nat. Rev. Neurosci., 2005, 6, 8, p. 626–640.
17. Zonta, M., Angulo, M. C., Gobbo, S. et al. Neuron-to-astrocyte signaling is central to the dynamic control of brain microcirculation. [see comment]. Nat. Neurosci., 2003, 6, 1, p. 43–50.
18. Harder, D. R. A cellular mechanism for myogenic regulation of cat cerebral arteries. Ann. Biomed. Eng., 1985, 13, 3–4, p. 335–339.
19. Ainslie, P. N., Ashmead, J. C., Ide, K., Morgan, B. J., Poulin, M. J. Differential responses to CO2 and sympathetic stimulation in the cerebral and femoral circulations in humans. J. Physiol., 2005, 566, 2, p. 613–624.
20. Heistad, D. D., Kontos, H. A. Cerebral Circulation. In Handbood of Physiology: The Cardiovascular System. eds Shepherd, J. T., Abboud, F. M., Bethesda, M. D. American Physiological Society, 1983, p. 137–182.
21. Farkas, E., Luiten, P. G. Cerebral microvascular pathology in aging and Alzheimer’s disease. Prog. Neurobiol., 64, 6, p. 575–611.
22. Bovenzi, V., Savard, M., Morin, J., Cuerrier, C. M., Grandbois, M.,Gobeil, F. Jr. Bradykinin protects against brain microvascular endothelial cell death induced by pathophysiological stimuli. J. Cell. Physiol., 2010, 222, 1, p. 168–176. doi: 10.1002/jcp.21933.
23. Wahl, M., Görlach, C., Hortobágyi, T., Benyó, Z. Effects of bradykinin in the cerebral circulation. Acta Physiol. Hung., 1999, 86, 2, p. 155–160.
Štítky
Anestéziológia a resuscitácia Intenzívna medicína
Článek Acidobazická rovnováhaČlánek XX. kongres ČSARIM Brno 2013Článek Oceněné práce 2013Článek Kongresy a konferenceČlánek Právo, etika, náš obor a my
Článok vyšiel v časopiseAnesteziologie a intenzivní medicína
Najčítanejšie tento týždeň
2014 Číslo 2- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Metamizol v liečbe pooperačnej bolesti u opioid-tolerantnej pacientky – kazuistika
- e-Konzilium.cz — Masivní plicní embolie při tromboembolické nemoci
- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
-
Všetky články tohto čísla
- Statické a dynamické testy v řízení volumoterapie
- Ultrazvukové vyšetření aorty v urgentní medicíně
- Současné postupy v porodnické anestezii IV. – anesteziologické komplikace u císařského řezu
- Acidobazická rovnováha
- Mozková (mikro)cirkulace – základní struktura a funkce
- iNO a ARDS: Vyšetřování skončilo, zapomeňme!
-
The Canadian Critical Care Nutrition Guidelines in 2013
An Update on Current Recommendationsand Implementation Strategies - Doporučený postup před odběrem orgánů od zemřelých dárcůpo nevratné zástavě oběhu
- Pojem standardu péče v kontextu reformních změn
-
XX. kongres ČSARIM
Brno 2013 - MUDr. Peter Gašparec (14. 12. 1951 – 29. 11. 2013)
- Zemřel emeritní primář MUDr. Jiří Brabec (31. 8. 1925 – 19. 2. 2014)
- European Association of Cardiothoracic Anaesthesiologists v roce 2014
- Oceněné práce 2013
- Jubilejní XX. kongres České společnosti anesteziologie, resuscitace a intenzivní medicíny
- Kongresy a konference
- Stanovisko výboru ČSARIM k návrhu rozsahu požadovaných kompetencí v ultrazvukových metodách pro lékaře oboru Anesteziologiea intenzivní medicína
- Zamyšlení nad XX. kongresem ČSARIM v Brně
- Extrakorporální membránová oxygenace a respirační selhání
- Právo, etika, náš obor a my
- Fast-track není jen fyziologická anestezie
- Hodnoty diference silných iontů (SID) u kriticky nemocných pacientů s normálními hodnotami arteriálního pH, pCO2, BE a HCO3-a jejich vliv na mortalitu
- Metody mimotělní oxygenacea eliminace CO2 určené primárně k náhradě plicních funkcí
- Anesteziologie a intenzivní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Acidobazická rovnováha
- Statické a dynamické testy v řízení volumoterapie
- Současné postupy v porodnické anestezii IV. – anesteziologické komplikace u císařského řezu
- Extrakorporální membránová oxygenace a respirační selhání
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



