-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Statické a dynamické testy v řízení volumoterapie
Static and dynamic tests for management of volumotherapy
The clinical determination of the intravascular volume can be extremely difficult in critically ill patients. Fluid therapy is the first step in the resuscitation of hemodynamically unstable patients. Both underresuscitation and overresuscitation are associated with increased morbidity and mortality. The resuscitation of the critically ill patient therefore requires an accurate assessment of the patients’ intravascular volume status (cardiac preload) and the ability to predict the hemodynamic response after a fluid challenge (volume responsiveness). Only about half of the critically ill patients exhibit volume responsiveness – defined as the ability to increase stroke volume in response to fluid challenge. Traditional methods of determining preload (static parameters as cardiac filling pressures including the central venous pressure and the pulmonary artery occlusion pressure) have been used to guide fluid management. But now it is known, they are inaccurate and unable to predict fluid responsiveness. Dynamic parameters based on respiratory variations in venous return and subsequently stroke volume, use heart-lung interaction during mechanical ventilation to assess fluid responsiveness and are highly predictive. Especially the pulse pressure variation, stroke volume variation and the systolic pressure variation have high sensitivity and specificity in optimization of preload.
Keywords:
intravascular volume status – preload – volume responsiveness – static parameters – dynamic parameters – heart-lung interaction
Autori: Káňová Marcela 1; Ševčík Pavel 1,2
Pôsobisko autorov: Klinika anesteziologie, resuscitace a intenzivní medicíny FN Ostrava 1; Katedra intenzivní medicíny a forenzních oborů, Lékařská fakulta Ostravské univerzity 2
Vyšlo v časopise: Anest. intenziv. Med., 25, 2014, č. 2, s. 107-116
Kategória: Intenzivní medicína - Přehledový článek
Súhrn
Určení stavu intravazálního objemu u kriticky nemocného pacienta může být velmi nelehký úkol. Podání tekutin bývá prvním krokem resuscitace hemodynamicky nestabilního pacienta. Nedostatečné stejně jako nadměrné podání tekutin je spojeno se zvýšenou morbiditou a mortalitou. Je proto zásadní správné zhodnocení intravazálního objemu (srdeční předtížení) a schopnost předpovědět reakci na objemovou resuscitaci. Pouze polovina pacientů odpoví na tekutinovou výzvu navýšením srdečního výdeje. Tradičně se k řízení terapie tekutinami používají statické testy určení stavu předtížení (plnící srdeční tlaky jako centrální žilní tlak a tlak v zaklínění arterie pulmonalis). V současnosti je zřejmé, že tyto testy neurčují přesně stav předtížení a nejsou schopny předpovědět reakci na tekutinovou výzvu. Naopak vysoce prediktivní jsou dynamické testy založené na respiračních změnách žilního návratu a následně srdečního výdeje v důsledku interakce srdce-plíce během umělé plicní ventilace. Zvláště respirační změny pulzového tlaku (systolicko-diastolického rozdílu), variace systolického tlaku a variace tepového objemu umožní přesnou diagnostiku stavu intravazálního objemu.
Klíčová slova:
intravazální objem – předtížení – odpověď na tekutinovou výzvu – statické testy – dynamické testy – interakce srdce-plíceÚVOD
Stanovení intravazálního volumu může být nelehký úkol jak u kriticky nemocných pacientů, tak u pacientů podstupujících velké chirurgické výkony. Dávkování tekutin zůstává v řadě případů nadále značně empirické. Přitom je nálož tekutin zpravidla prvním krokem terapie hemodynamicky nestabilního pacienta. Očekáváme od ní navýšení srdečního výdeje a následně zvýšení orgánové perfuze.
Multiorgánová dysfunkce (MODS) kriticky nemocných pacientů se rozvíjí jako následek tkáňové hypoxie v souvislosti s neadekvátní (sníženou) dodávkou kyslíku – ↓DO2 (hypovolémie, vazodilatace, myokardiální deprese, porucha mikrocirkulace) a zvýšenou spotřebou kyslíku – ↑VO2 [1, 2, 3]. K dalším příčinám se řadí cytopatická hypoxie v důsledku mitochondriální dysfunkce. Časná agresivní terapie zaměřená na vyrovnání DO2 a VO2 prokazuje jednoznačný přínos pro léčebné výsledky u septických pacientů (koncept Early goal-directed therapy in treatment of severe sepsis and septic shock [4]). Volumoterapie je nedílnou součástí tohoto konceptu. Předpokládáme, že bolus tekutin zvýší předtížení (preload), end-diastolický objem pravé komory (right ventricular end-diastolic volume – RVEDV), následně end-diastolický objem levé komory (left ventricular end-diastolic volume – LVEDV), což vede ke zvýšení tepového objemu (stroke volume – SV) a srdečního výdeje (cardiac output – CO). Nicméně četné studie prokázaly, že pouze cca 50 % hemodynamicky nestabilních pacientů je volum responzibilních, tzn. zareaguje příznivě na dodávku objemu (tab. 1). Preload responzivita je definována jako schopnost srdce zvýšit SV po podání tekutin.
Tab. 1. Počty a poměr pacientů odpovídajících - R a neodpovídajících - NR na objemovou nálož 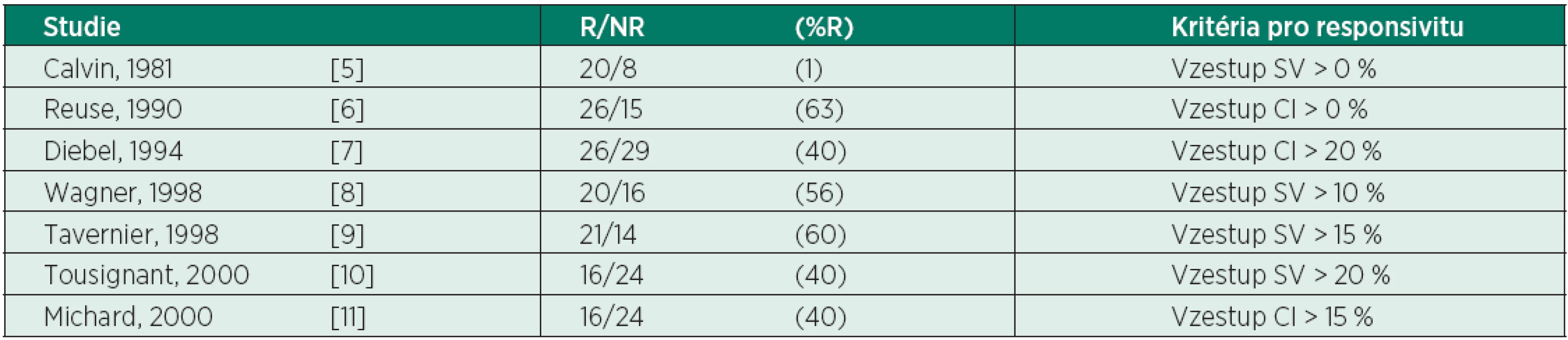
(podle [2]) Jak nedostatečná, tak nadměrná resuscitace tekutinami zhoršují morbiditu a mortalitu kriticky nemocných. Nekorigovaná hypovolémie s neadekvátním užitím vazopresoricky aktivních látek prohlubuje orgánovou hypoperfuzi. Na druhé straně nadměrná nálož tekutin s kumulativní pozitivní bilancí vede ke zhoršení dodávky O2, hemodiluci, rozvoji plicního a intersticiálního edému, zhoršení výměny plynů. Vztah mezi pozitivní vodní bilancí a mortalitou dokazují mnohé studie u pacientů se septickým šokem [12–15].
Z toho plyne potřeba testů, které dokáží předpovědět přínos nálože tekutin u konkrétního pa-cienta a naopak umožní vyvarovat se nadměrnému podávání tekutin se všemi negativními dopady.
JAK TEDY ADEKVÁTNĚ ŘÍDIT VOLUMOTERAPII?
U kriticky nemocného potřebujeme zmapovat nejen stav intravazálního objemu (cardiac pre-load), ale současně i předpovědět hemodynamickou odezvu na podání tekutin (volume responzivita). V praxi máme jednak klinické známky dostatečnosti orgánové perfuze (střední arteriální tlak – mean arterial pressure /MAP/, tepová frekvence, diuréza, kapilární návrat, stav vědomí), laboratorní parametry (laktát, saturace smíšené žilní krve – SvO2 nebo saturace centrální žilní krve – ScvO2, arteriální pH, BE, HCO3-). Dále jsou k dispozici statické a dynamické testy měření stavu preloadu [16, 17, 18].
1. Statické testy
1. 1. Srdeční plnící tlaky (cardiac filling pressures),end-diastolické objemy
Centrální žilní tlak (CVP), tlak v pravé síni (RAP) a tlak v zaklínění arterie pulmonalis (PAOP) se tradičně používaly k řízení volumoterapie. Studie posledních 30 let prokazují, že pomocí měření srdečních plnících tlaků nedokážeme rozlišit mezi pacienty s pozitivní odpovědí na objemovou nálož (responders) a pacienty bez odpovědi na objemovou výzvu (nonresponders) [19, 20]. Nelze je tedy užívat jako indikátory objemové odpovědi. Neříkají nic o pozici na Frankově-Starlingově (F-S) křivce.
1. 2. Frank - Starlingův vztah
Vztah mezi preloadem (volumovou náloží) a SV (stroke volume) není lineární. Z toho plyne, že navýšení preloadu podáním bolusu tekutin povede k navýšení SV jen v případě, pracují-li obě komory na ascendentní části křivky (případ A na obr. 1, responder). Zde podání nálože tekutin a tím navýšení předtížení vede ke vzestupu tepového objemu (SV). U zdravého jedince tento mechanismus zajišťuje funkční reservu srdce pro podmínky akutního stresu.
Obr. 1. Frankův-Starlingův vztah mezi tepovým objemem (stroke volume) a předtížením (preload) 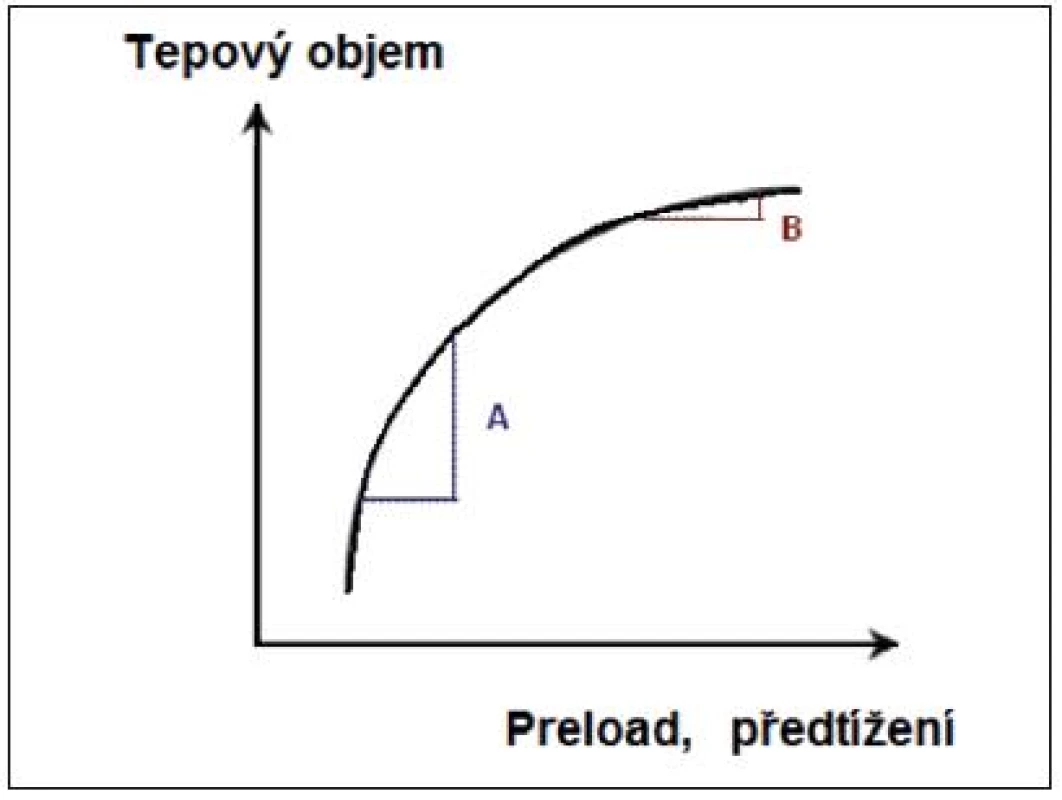
A – preload dependence, B – preload independence (volně podle [2]) Obr. 2. Rozlišný tvar Frank-Starlingovy křivky u zdravého a selhávajícího myokardu 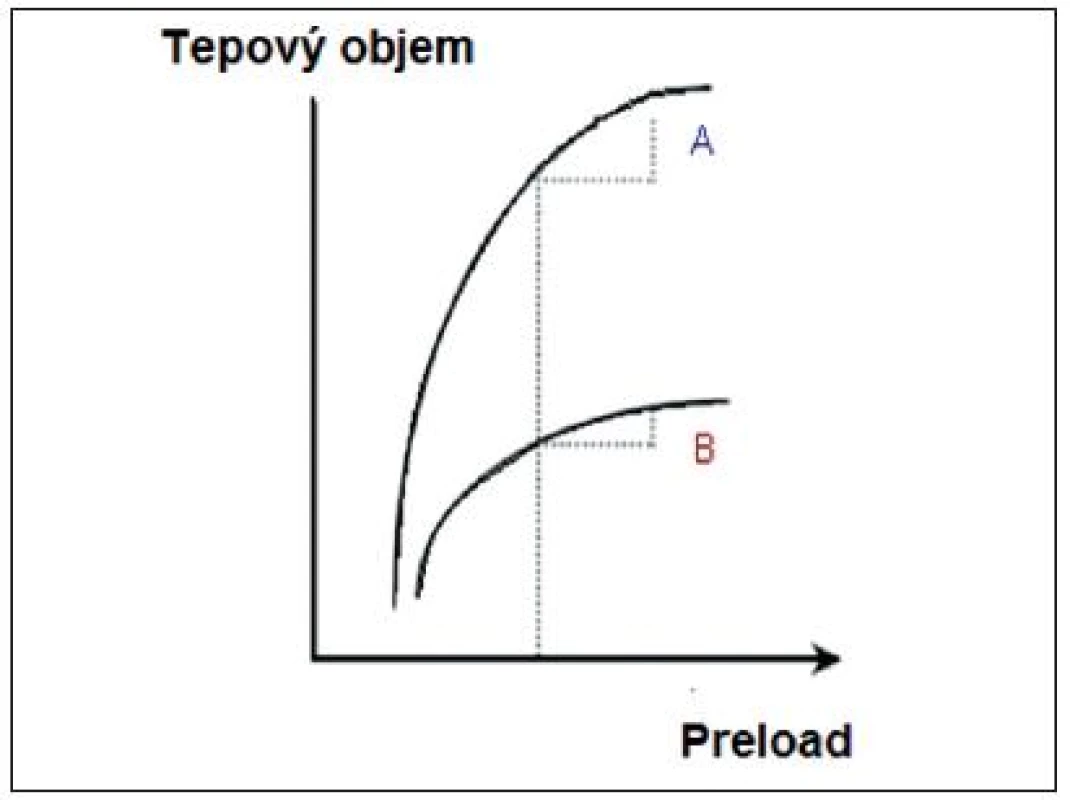
A – preload dependence, B – preload independence (volně podle [2]) Stejné množství tekutin (případ B na obr. 1, nonresponder) nevede k navýšení SV, komory pracují na ploché, horizontální části křivky.
1. 3. Proč statické testy nefungují?
Preload ≠ preload responsiveness [18, 21]. Jinými slovy, změření stavu preloadu neříká nic o tom, jak pacient odpoví na nálož tekutin. Srdeční výdej určují kromě preloadu (předtížení) také kontraktilita (srdeční stažlivost) a afterload (dotížení). CVP, PAOP, RVEDV (end-diastolický objem pravé komory), LVEDA (end-diastolická plocha levé komory), GEDV (celkový end-diastolický objem, všech čtyř srdečních oddílů) jsou pod výrazným vlivem:
- a) transmurálních tlaků, PEEP (pozitivní tlak na konci exspiria), PEEPi (vnitřní PEEP);
- b) poddajnosti (compliance) levé a pravé komory srdeční, často snížené u závažně nemocných pacientů vlivem sepse, ischémie, hypertrofické kardiomyopatie
- c) chlopenních vad, např. trikuspidální regurgitace, která je častá u plicní hypertenze, ARDS (acute respiratory distress syndrom) i u umělé plicní ventilace s vyšším PEEP
- d) kontraktility
- e) poddajnosti a kapacity žilního řečiště.
1.3.1. Centrální žilní tlak
Centrální žilní tlak (CVP) určuje tlak v horní a dolní duté žíle při ústí do pravé síně, lze použít k odhadu RAP (tlak v pravé síni), což je hlavní determinanta pravostranných plnících tlaků.
Časté používání centrálního žilního tlaku k řízení tekutinových náhrad je založeno na dogmatu, že CVP odráží intravazální objem [1, 19, 22]. Tedy, že nízké CVP značí hypohydrataci, vysoké CVP hyperhydrataci. V 70. letech bylo rozšířené pravidlo 2–5 při užití tzv. tekutinové výzvy (fluid challenge testu). CVP se měřilo v 10minutových intervalech za podávání tekutin. Jestliže CVP vzrostlo o < 2 mm Hg, v infuzi se pokračovalo. Došlo-li k navýšení CVP o 2–5 mm Hg, infuze se pozastavila s přeměřením CVP za 10 minut. Došlo-li k vzestupu CVP > 5 mm Hg, podávání tekutin se ukončilo. Vycházelo se z předpokladu, že CVP odráží tlak v pravé síni (right atrial pressure – RAP), následně end-diastolický objem pravé komory (RVEDV) a tím plnící tlaky levého srdce a následně tepový objem levé komory (left ventricular stroke volume – LV SV) [22]. Nebral se však v úvahu výrazný vliv venózního tonu, nitrohrudních tlaků, pravo - a levokomorové compliance, kontraktility a také vliv geometrie komor.
Pacient nemusí odpovídat na nálož tekutin z důvodu vysoké cévní poddajnosti, nízké komorové poddajnosti a/nebo komorové dysfunkce, což je častý nález u kriticky nemocných pacientů.
CVP jako hodnota tlaku tedy slabě odráží RVEDV hodnotu objemu. Tlakově-objemová křivka není lineární. Navíc neurčuje pozici na F-S křivce a neříká nic o jeho objemové rezervě.
Více než stovka studií neprokázala signifikantní vztah mezi CVP jako ukazatelem preloadu a volume responzivitou. Ze systematického přehledu literatury [23] vyplývají tyto korelační koeficienty:
- Korelační koeficient mezi CVP a měřeným objemem krve – 0,16.
- Korelační koeficient mezi CVP a změnou CI – 0,18.
- ROC křivka (receiver-operating characteristic curve, grafický záznam mezi specificitou a senzitivitou) : AUC (area under curve-plocha pod křivkou) – 0,56.
Podobně jsou na tom i další ukazatele plnících tlaků a end-diastolických objemů [3, 19, 20, 24, 25].
1. 3. 2. PAOP (pulmonary artery occlusion pressure)
PAOP je chabým indikátorem preloadu levé komory, měří LVEDP nikoli LVEDV. Vztah mezi tlakem a objemem levé komory ovlivňuje nejen preload, ale i afterload a compliance levé komory. PAOP je vysoce závislý zvláště na levokomorové poddajnosti, která je u kriticky nemocných pacientů často snížena (hypertrofie, myokardiální ischémie, sepse, diabetes, plicní hypertenze s pravostrannou srdeční dysfunkcí, chlopenní poruchy, obezita).
1. 3. 3. LVEDA (left ventricular end-diastolic area)
LVEDA měřena transezofageální echokardiografií (TEE) prokazuje dobrý vztah k nitrohrudnímu objemu krve (intrathoracic blood volume - ITBV), globálnímu end-diastolickému objemu (global end-diastolic volume - GEDV). LVEDA < 55 cm2 byla užívána k diagnostice hypovolémie. Nicméně malá levá komora nemusí vždy značit hypovolémii, může být způsobená restrikcí v plnění vzhledem k hypertrofii, ischémii, akutnímu cor pulmonale, onemocnění perikardu. Zde se plně ukazuje, že preload neznamená preload responsiveness.
1. 3. 4. ITBV (intrathoracic blood volume), GEDV (global end-diastolic volume)
Stejná omezení platí i pro ITBV, GEDV určené metodou transpulmonální termodiluce. GEDV je objemem všech čtyř srdečních oddílů. ITBV zahrnuje jak objem krve v srdci (GEDV), tak objem krve intravazálně v plicích.
2. Dynamické testy
2. 1. Princip, interakce srdce - plíce
Dynamické testy mají výbornou schopnost předpovědět reakci na podání tekutin. Tyto testy monitorují změny SV (CO) po manévrech, které zvyšují nebo snižují venózní návrat (preload), a určují tak pozici na F-S křivce. Zvýšení venózního návratu lze mj. docílit pomocí zvednutí nohou (PLR test – passive leg raising test) nebo bolusem tekutin. Snížení venózního návratu je možné např. použitím PEEP.
PPV (pulse pressure variation – respirační změna pulzového tlaku), SVV (stroke volume variation – respirační změna tepového objemu), SPV (systolic pressure variation - respirační změna systolického tlaku), PLR a další testy jsou velmi přesné v řízení volumoterapie, zjištění responzivity na tekutiny podle změn tepového objemu levé komory během umělé plicní ventilace. Principem jsou tedy hemodynamické změny při UPV, využívající interakcí srdce-plíce. Jimi vyvolané změny preloadua afterloadu pravé a levé komory během respiračního cyklu vyvolají změny tepového objemu.
Obr. 3. Srdeční funkční křivka Vztah mezi srdečním výdejem – CO a centrálním žilním tlakem – CVP 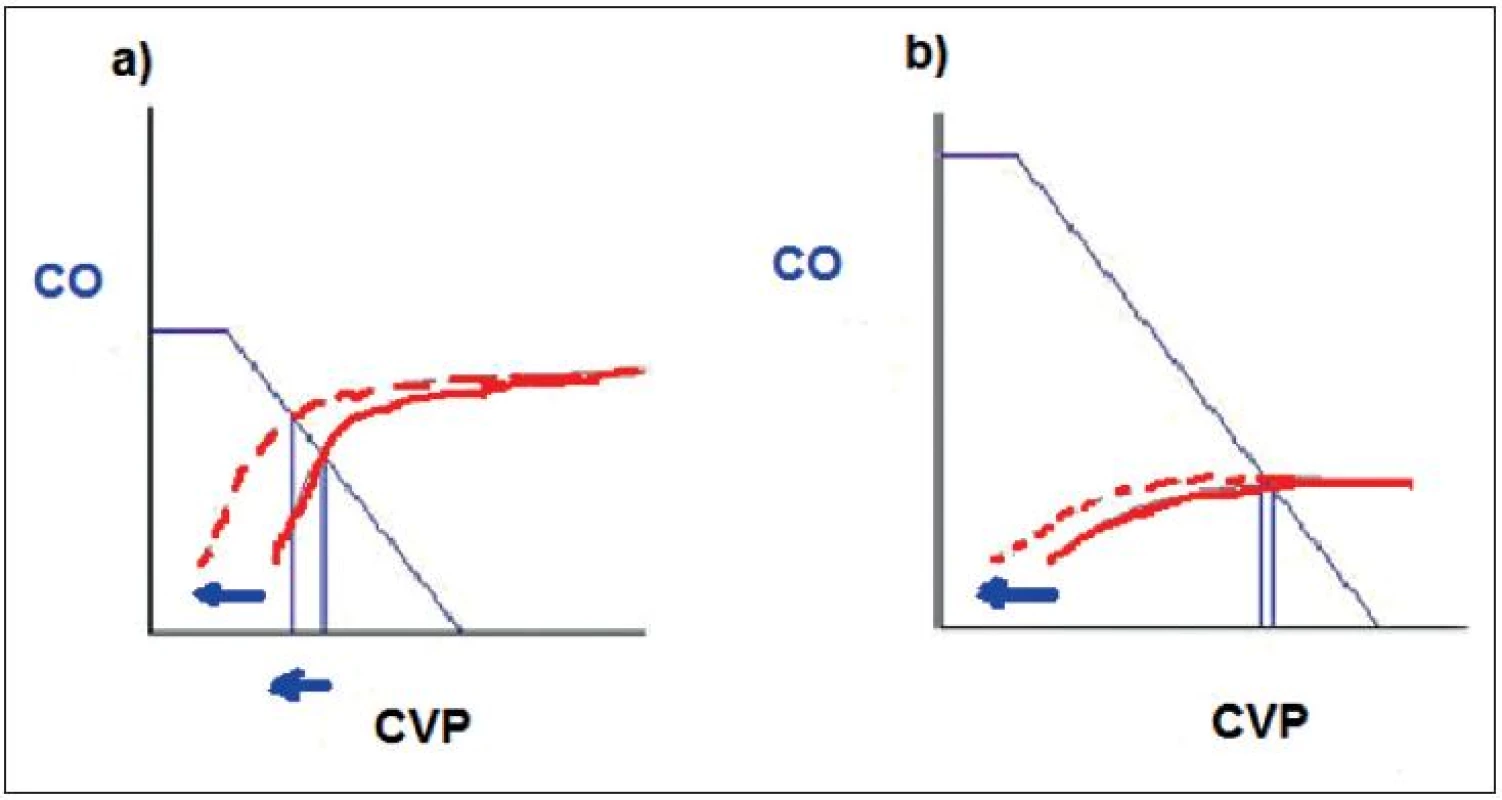
Během spontánní ventilace je kardiální funkční křivka (plná červená) posunuta doleva (přerušovaná červená): a) Pracuje-li myokard na ascendentní části křivky, CVP klesá a CO narůstá. b) Pracuje-li myokard na ploché části křivky, CVP a CO zůstává beze změn. (volně podle [22]) 2. 1. 1. Respirační změny RAP během spontánní ventilace
Při spontánní dechové aktivitě dochází v inspiriu k poklesu pleurálního tlaku, což vede ke snížení centrálního žilního tlaku a tlaku v pravé síni. Ačkoli samotné hodnoty CVP neumožní rozeznat schopnost odpovědi na podané tekutiny (volume responsivitu), jejich změny během respiračního cyklu ano [2, 20, 26].
Inspirační pokles hodnoty CVP umožní rozeznat pacienty, kteří se nacházejí na vzestupné části křivky a mají rezervu pro dodání tekutin (varianta A na obr. 1), od těch, jejichž myokard pracuje na ploché části F-S křivky a hodnota CVP u nich neklesá (varianta B na obr. 1). Inspirační pokles CVP ≥ 1 mm Hg znamená preload responzivitu.
Omezení: Je nutný dostatečný ventilační trig-ger a není-li zaveden plicnicový katétr – PAC, kterým zjistíme pokles PAWP ≥ 2 mm Hg, jedná se o subjektivní hodnocení. Mnoho pacientů léčených na JIP nemá dostatečný inspirační trigger k vyvolání poklesu CVP.
2. 1. 2. Respirační změny tepového objemu levé komory (left ventricular stroke volume – LV SV) během umělé plicní ventilace
Inspirium – mechanická insuflace vede k poklesu preloadu PK (pravé komory) vlivem nárůstu pleurálního tlaku a tím snížení gradientu pro venózní návrat a současně k vzestupu afterloadu PK vlivem vzestupu transpulmonálního tlaku (alveolární – pleurální tlak) [1, 2, 24, 26]. Jak pokles preloadu, tak vzestup afterloadu PK vedou k poklesu tepového objemu pravé komory (right ventricular stroke volume – RV SV) s minimem na konci inspiria.
Pulse pressure MAXIMUM na konci inspiria
U levé komory (LK) vede vzestup transpulmonálního tlaku k vzestupu preloadu a zvýšenípleurálního tlaku vede k poklesu afterloadu, což jsou podmínky pro navýšení LV SV s maximem na konci inspiria (obr. 4).
Obr. 4. Schéma znázornění změn tepového objemu v závislosti na interakcích srdce-plíce během umělé plicní ventilace 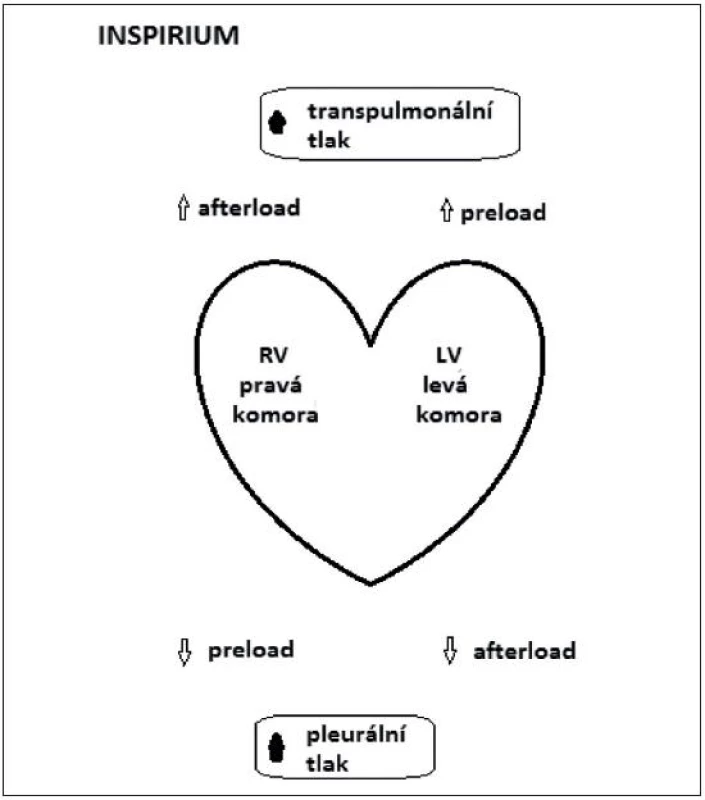
Pulse pressure MINIMUM na konci exspiria
Pokles tepového objemu pravé komory s minimem na konci exspiria se odrazí za 2–3 srdeční stahy (blood transpulmonary transit time) poklesem tepového objemu levé komory.
Cyklické změny tepového objemu pravé i levé komory jsou větší, pracuje-li srdce na ascendentní části F-S křivky, tedy je-li preload dependentní.
Respirační změny v proměnných vycházejících z arteriální křivky:
- PPV – pulse pressure variation
- SPV – systolic pressure variation
- SVV – stroke volume variation
2. 2. Respirační změny pulsového tlaku – pulse pressure variation (PPV)
2. 2. 1. Princip PPV
Během umělé plicní ventilace dochází ke změnám tepového objemu v závislosti na interakcích srdce-plíce. Odrazem změn velikosti tepového objemu levé komory (LV SV) během umělé plicní ventilace s maximem během inspiria a minimem během exspiria je tzv. fenomén reverzního pulsus paradoxus [2, 11, 16, 17, 20, 22, 24, 26–28].
Pulzový tlak – pulse pressure je rozdíl systolického a diastolického tlaku, který je přímo úměrný tepovému objemu LV SV a nepřímo úměrný arteriální poddajnosti.
Obr. 5. Simultánně zaznamenaná křivka tlaku v dýchacích cestách a arteriálního tlaku 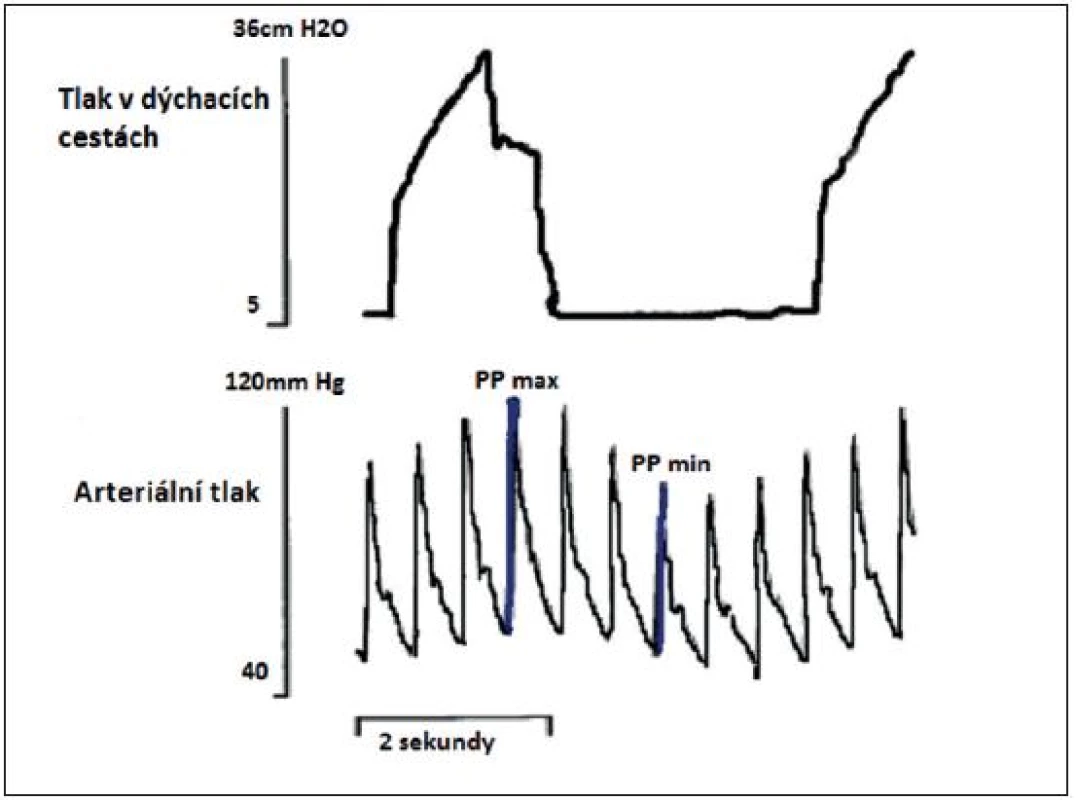
Simultánně zaznamenaná křivka tlaku v dýchacích cestách a arteriálního krevního tlaku. PP – pulse pressure (rozdíl mezi systolickým a diastolickým tlakem), PPV – pulse pressure variation (rozdíl mezi PPmax a PPmin dělen průměrem těchto dvou hodnot, vyjádřeno v procentech) PPmax a PPmin zaznamenáno během jednoho respiračního cyklu. (podle [11]) Obr. 6. Vztah mezi PPV a CI před objemovou expanzí a po objemové expanzi – nahoře a vztah mezi SPV a CI před objemovou expanzí a po ní – dole (podle [11]) ![Vztah mezi PPV a CI před objemovou expanzí a po objemové expanzi – nahoře a vztah mezi SPV a CI před objemovou expanzí a po ní – dole (podle [11])](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/5559621b64c138a0c617d620bb2ceee7.jpg)
Nahoře: vztah mezi PPV před volumexpanzí VE (plná čára) a VE způsobená změna CI (přerušovaná čára). Dole: vztah mezi SPV před volumexpanzí VE (plná čára) a VE způsobená změna CI (přerušovaná čára). Tab. 2. Predikční hodnota jednotlivých statických a dynamických technik k měření odpovědi na podání tekutin 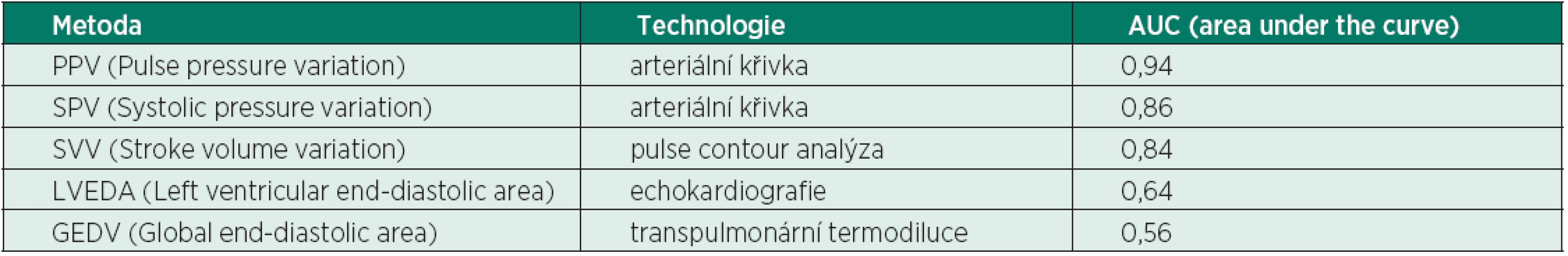
(podle [27]) PPV – pulse pressure variation patří k nejpřesnějším dynamickým testům hodnocení odpovědi na objemovou nálož.
2. 2. 2. Výpočet
Variace pulse pressure vypočítáme:
PPV = (PPmax – PPmin)/(PPmax + PPmin)/2
PPmax – během inspiria
PPmin – během exspiria
2. 2. 3. Výhody a limitace
PPV není přímo ovlivněn změnami pleurálního tlaku. Respektive obě složky jak systolický, tak diastolický tlak, jsou ovlivněny pleurálním tlakem ve stejné míře. PPV přímo ovlivňují pouze změny transmurálního tlaku a tím velikost tepového objemu. To je hlavní rozdíl od systolic pressure variation SPV (variace systolického tlaku), systolický tlak je během umělé plicní ventilace ovlivěn jak pleurálním, tak i transmurálním tlakem.
Pulse pressure variation je metoda s přesnou předpovědí volume responzivity, popisovanou jako navýšení srdečního indexu CI ≥ 15 % po podání tekutin.
Obr. 7. SPV – rozdíl mezi maximální a minimální hodnotou systolického tlaku během jednoho respiračního cyklu 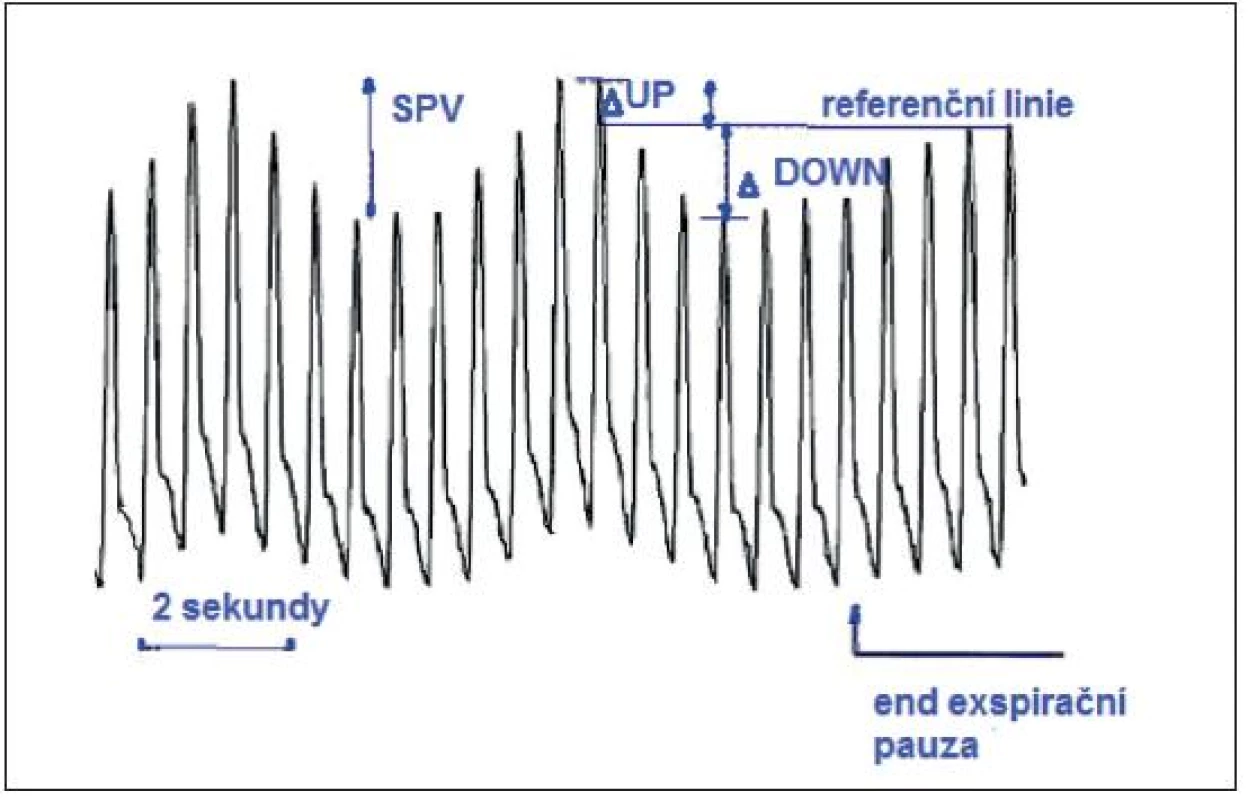
podle [2]) Hodnota PPV ≥ 13 % umožní rozlišení mezi responders vs. nonresponders se senzitivitou 94% a specificitou 96%. To znamená: je-li PPV ≥ 13 %, pak lze očekávat signifikantní nárůst CI po podání tekutin. Opačně, je-li PPV < 13 %, tento efekt je velmi nepravděpodobný. Zde mají místo inotropní a vazopresorické léky.
Existuje téměř lineární vztah mezi PPV (%) a změnou CI (%) na tekutinovou výzvu. Čím vyšší je PPV před bolusem tekutin, tím vyšší je vzestup CI po podání tekutin. Doplňování volémie lze sledovat poklesem hodnoty PPV. PPV je užitečný i v předpovědi hemodynamického efektu PEEP. Čím vyšší je PPV před použitím PEEP, tedy na úrovni nulového PEEP (= ZEEP), tím větší lze předpokládat pokles CI po nastavení PEEP.
Obr. 8. Stroke volume variation ve vztahu k Frank-Starlingově křivce 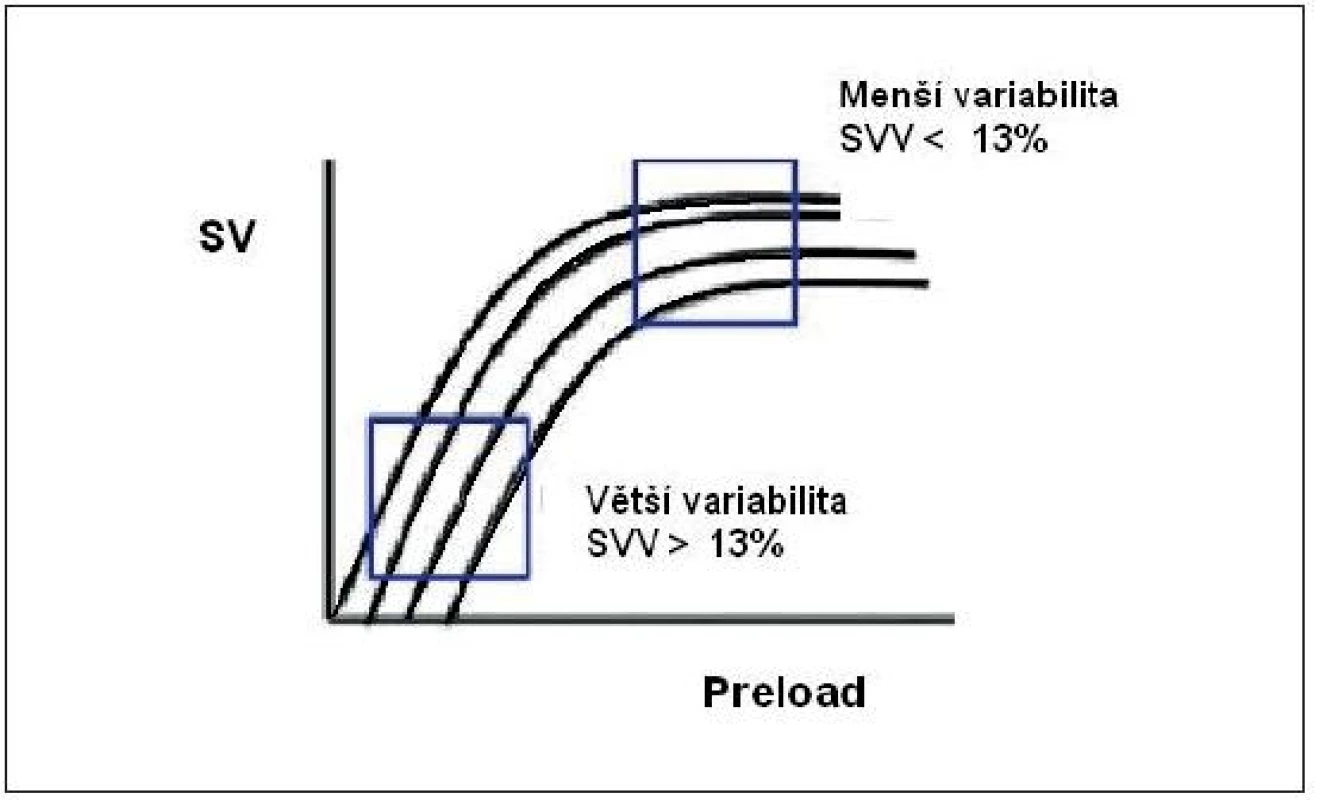
Pozice na Starlingově křivce vycházející z analýzy tvaru arteriální křivky během umělé plicní ventilace. SVV – stroke volume variation 2. 3. Respirační změny systolického tlaku – systolic pressure variation (SPV)
2.3.1. Princip SPV
SPV je dalším dynamickým testem vycházejícím ze změn tepového objemu během respiračního cyklu. Tepový objem levé komory je hlavní determinantou systolického tlaku. Tak se respirační změny tepového objemu promítnou změnami arteriálního tlaku, s maximální hodnotou systolického tlaku během inspiria a s minimální hodnotou systolického tlaku během exspiria.
2. 3. 2. Výpočet
SPV – rozdíl mezi maximální a minimální hodnotou systolického tlaku během jednoho respiračního cyklu. Má dvě komponenty ∆up a ∆down (∆ = delta) počítané od referenční hodnoty systolického tlaku měřeného v end-exspirační pauze.
∆up je rozdíl mezi maximální hodnotou systolického tlaku během jednoho respiračního cyklu a referenční hodnotou. ∆down je rozdíl mezi referenční hodnotou systolického tlaku a jeho minimální hodnotou během jednoho dechového cyklu. ∆up je dán inspiračním vzestupem a ∆down exspiračním poklesem LV SV a tím systolického tlaku [2, 11, 16, 20].
Za normo - a hypovolemických stavů je ∆down hlavní komponentou SPV. ∆down odráží exspirační pokles tepového objemu. Krvácení zvyšuje hodnotu SPV a ∆down komponentu. Během doplňování objemu se ∆down naopak zmenšuje.
Za podmínek dysfunkce levé komory a hypervolémie je hlavní komponentou ∆up, ale současně klesá ∆down, celková hodnota SPV se zmenšuje. Objemové náhrady tedy snižují SPV a ∆down komponentu.
∆down je indikátorem volume responzivity, hodnota 5 mm Hg a více znamená pravděpodobnost pozitivní odpovědi na podané tekutiny. Čím větší je hodnota ∆down před tekutinovým bolusem, tím větší lze očekávat navýšení srdečního indexu (CI) po náloži tekutin.
2. 3. 3. Limitace
SPV jsou méně přesné než PPV, kromě změn transmurálního tlaku a tím tepového objemu levé komory (LV SV) je ovlivněna i extramurálními změnami tlaku (změny pleurálního tlaku). Hodnota SPV je tedy ovlivněna změnami tlaku v dýchacích cestách, hodnotou PEEP.
2. 4. Respirační změny tepového objemu – stroke volume variation (SVV)
2. 4. 1. Princip SVV
Test je založen na stejném principu ovlivnění tepového objemu během umělé plicní ventilace. Vzestup nitrohrudního tlaku v inspiriu vede k poklesu předtížení a následně poklesu srdečního výdeje v exspiriu.
Měření SVV během umělé plicní ventilace díky kontinuální analýze tvaru arteriální křivky (metoda pulse contour analysis) umožňuje přesnou předpověď a monitorování změny CI po podání objemové nálože.
2. 4. 2. Výpočet
SVV (%) = (SV max – SV min)/SV mean
Je - li SVV ≥ 13 %, dá se očekávat vzestup CI po podání tekutin [16–18, 21–24, 26–29].
2. 5. Limitace dynamických testů PPV, SPV, SVV
2. 5. 1. Arytmie
Metody jsou neprůkazné u jiného než sinusového rytmu (SR). Podobně je tomu i při poměru tepová frekvence/dechová frekvence (< 3,6).
2. 5. 2. Dynamické testy ve vztahu k dechovému objemu u pacientů na UPV
PPV i další dynamické testy jsou ovlivněny velikostí dechových objemů. Využívají cyklické změny předtížení a následně tepového objemu levé komory v závislosti na respiračních změnách pleurálního a transpulmonálního tlaku během umělé plicní ventilace. Dechový objem (tidal volume – Vt) pod 8 ml/kg nevyvolá dostatečné změny v plnících tlacích levého srdce a následně v jeho tepovém objemu k identifikaci volume responzivity. To je velmi omezující zvláště ve skupině pacientů s ARDS, velmi citlivých na negativní dopad neadekvátní resuscitace tekutinami.
Z De Bakerovy studie [28] hodnotící 51 pacientů s ARDS, rozdělených na skupiny podle Vt větší a menší než 8 ml/kg vyplývá:
- Při Vt ≥ 8 ml/kg je senzitivita 88%, specificita 89%, pozitivní predikční hodnota 93%, negativní predikční hodnota 80%.
- Při Vt < 8 ml/kg je senzitivita 39%, specificita 65%, pozitivní predikční hodnota 54%, negativní predikční hodnota 50%.
Snížení hranice PPV na 8 % vedlo pouze k nevelkému navýšení senzitivity na 66 %, specificity na 65 %, pozitivní predikční hodnoty na 67 %, negativní predikční hodnoty na 65 %.
Závěr je zřejmý – PPV (a podobně SPV, SVV) je spolehlivým prediktorem hodnocení odpovědi na podané tekutiny u uměle ventilovaných pacientů pouze v případě, je-li dechový objem minimálně 8 ml/kg. Pokud přijímáme premisu protektivní ventilace s Vt 6 ml/kg, je nutné na tuto limitaci dynamických testů pamatovat. Před zahájením dynamického testu zvolíme objemovou ventilaci a přechodně navýšíme Vt na min. 8,5 ml/kg.
2. 5. 3. Plicní hypertenze, pravostranná systolická dysfunkce
Vzestup nitrohrudního tlaku v inspiriu při umělé plicní ventilaci ovlivňuje preload RVa afterload LV u pacientů se selhávajícím myokardem v poněkud jiném dosahu.
Vzestup pleurálního tlaku v inspiriu sníží tlakový gradient pro venózní návrat a tím snížíprealod RV. Rovněž sníží afterload LV, a usnadní tak vyprazdňování levé komory, zvýší ejekční frakci u afterload dependentního myokardu. Obojí snižuje nitrohrudní krevní objem s pozitivním dopadem na selhávající myokard. Také vytlačení krve z přeplněných alveolárních kapilár během inspiria zvyšuje plnění levé komory. Navíc se při umělé ventilaci snižuje dechová práce a požadavky na dodávku kyslíku[30].
Dynamické testy jsou velmi přesné i u pacientů po kardiochirurgických výkonech. Reuter et al. [29] prokazují podobné hodnoty PPV, SVV u pacientů s normální i nízkou EF. Jsou nezávislé na funkci komory. SPV má charakteristicky vyšší ∆up komponentu, celkově v důsledku nižší ∆down má nižší hodnotu.
Nicméně u pacientů se selhávající pravou komorou Mahjoub et al. [31] popisuje falešně pozitivní PPV v porovnání s ECHO kardiografickým nálezem, který známky hypovolémie nepotvrzuje. V případě pochybností lze užít PLR – passive leg raising test, kdy pokles SVV či PPV značí pozitivní odpověď na tekutinovou nálož.
2. 5. 4. Vliv noradrenalinu na statické a hemodynamickéindikátory preloadu
U hemodynamicky nestabilního pacienta podáváme tekutiny často současně s vazopresory. Katecholaminy mají přímý efekt na cévní poddajnost (compliance) a tím interferují s hodnotami SPV a PPV v předpovědi míry hypovolémie. Noradrenalin způsobuje přesun krve z „nestresové do stresové oblasti“, tzn. působí konstrikci kapacitních cév a snižuje splanchnické prokrvení. Vede ke zvýšení preloadu a následně srdečního výdeje s poklesem dynamických parametrů PPV, SPV. Katecholaminy tak maskují skutečný intravazální deficit tekutin. Statické parametry předtížení (plnící tlaky – RAP, PAOP) noradrenalin neovlivňuje. I toto dokazuje malou schopnost statických testů předpovědět reakci na objemovou výzvu [32]. U SPV lze k upřesnění hodnotit ∆up a ∆down komponentu.
Ne všichni hemodynamicky nestabilní pacienti reagují stejně, dochází k jinému ovlivnění venózní kapacitance. Jiná je hypotenze u hemoragického šoku s redukcí venózního rezervoáru vlivem vyplavení endogenních katecholaminů, jiná u septického pacienta, kde je naopak venózní rezervoár navýšen. Za sepse je výrazně snížená adrenergní afinita ke katecholaminům a tím i jiné ovlivnění PPV, SPV [24].
Jak postupovat? Noradrenalin maskuje ztráty tekutin. Snažíme se proto o snížení dávek katecholaminů a podání tekutinové výzvy i v případě „normálních“ hodnot PPV, SPV, SVV.
2. 6. Další nové dynamické testy využívají respirační změny
V současné době se vyvíjí řada dalších dynamických testů využívajících k předpovědi změny CI na tekutinovou výzvu respirační změny tepového objemu [22]. Mezi tyto testy patří např.:
- Měření průměru vena cava inferior (IVC) – měřeno transtorakální echokardiografií (TTE), vena cava suprerior (SVC) – měřeno transezofageální echokardiografií (TEE). Mechanická ventilace vyvolává změny v průměru obou dutých žil.
- Měření rychlosti průtoku aortou ∆V peak (měřeno Doppler US, TEE). Rychlost průtoku aortou je proporcionální tepovému objemu levé komory.
- Pletyzmografické vlny pulzní oxymetrie, pulse oximeter plethysmographic waveform (POP).
2. 7. Passive leg raising test – test pasivního zvednutí dolních končetin
Jednoduchý test k hodnocení hemodynamické odezvy na tekutiny využívá endogenní nálož krve z dolních končetin. Nutností je kontinuální měření nejlépe SV, aby bylo změny možné zachytit. Jeho použití je výhodou u stavů, kde se již nálože tekutin obáváme pro možné objemové přetížení. Zde se využívá reverzibilní efekt s rychlým odezněním po navrácení dolních končetin do horizontální polohy. Navíc je využitelný i u spontánně ventilujících pacientů a pacientů s nepravidelnou srdeční akcí [33, 34].
SHRNUTÍ
Existuje celá řada technik k řízení volumoterapie. Každý z testů má svá pozitiva a limity. Vzhledem k jednoduchosti, přesnosti a minimální invazivitě je vhodné kontinuální monitorování dynamických parametrů (ať již PPV, SVV, SPV u uměle ventilovaných, sedovaných pacientů či PLR testu u pacientů spontánně ventilujících či limitovaných arytmií). Výběr metody v první řadě závisí na stavu pacienta – sedace, spontánní či umělá plicní ventilace, dechový objem, přítomnost sinusového rytmu či mnohočetné arytmie, nitrobřišní hypertenze. Vždy je nutné opět zvážit poměr přínosů a rizika jednotlivých metod – invazivní vs. neinvazivní (krvácení, infekce), zvyklost jednotlivých pracovišť a samozřejmě rozhoduje i cena dané metody. Důležité je znát limitace jednotlivých testů. Stav pacienta se během hospitalizace mění a tomu je nutno přizpůsobit výběr metody k optimalizaci stavu volémie.
Při zvažování, kterou hemodynamickou metodu monitorování použijeme, platí základní principy [35]:
- Žádná hemodynamická monitorovací technika nezlepší outcome pacienta sama o sobě.
- Výsledky musí být dobře interpretovány a musíme na ně adekvátně terapeuticky reagovat.
- Vhodná metoda monitorování se může během času měnit v závislosti na stavu pacienta.
- Často skládáme informace jako puzzle k upřesnění patofyziologického obrazu.
Nejsou žádné optimální parametry ideální pro všechny pacienty. Kardiovaskulární systém se snaží přizpůsobit dodávku kyslíku jeho spotřebě, což je ovlivněno sepsí, sedací, mění se i během krátké doby. Ne vždy je vysoký srdeční výdej a vysoká saturace centrální žilní krve tím nejlepším. Důležité je sledovat odpověď a efektivitu jednotlivých terapeutických kroků.
Seznam zkratek:
- ARDS – syndrom akutní respirační tísně
- AUC – area under the curve (plocha pod křivkou)
- CI – srdeční index
- CO – srdeční výdej
- CVP – centrální žilní tlak
- DO2 – dodávka kyslíku
- F-S křivka – Frankova-Starlingova křivka
- GEDV – globální end-diastolický objem
- IVC – dolní dutá žíla
- LK – levá komora srdeční
- LVEDA – end-diastolická plocha levé komory
- LVEDV – end-diastolický objem levé komory
- LV SV – tepový objem levé komory
- MAP – střední arteriální tlak
- MODS – syndrom multiorgánové dysfunkce
- PAC – plicnicový katétr
- PaO2/FiO2 – oxygenační index
- PAOP = PAWP – tlak v zaklínění
- PAP – tlak v plicnici
- PEEP – pozitivní tlak v dýchacích cestách na konci výdechu
- PK – pravá komora srdeční
- PLR – passive leg raising test (test zvednutí dolních končetin)
- POP – pletyzmografické vlny pulzní symetrie
- PP – pulse pressure (pulzový tlak)
- PPV – pulse pressure variation
- RAP – tlak v pravé síni
- ROC křivka – receiver-operating characteristic curve (grafický záznam mezi specificitou a senzitivitou)
- RVEDV – end-diastolický objem pravé komory
- RV SV – tepový objem pravé komory
- ScvO2 – saturace v duté žíle
- SPV – systolic pressure variation
- SV – stroke volume (tepový objem)
- SVC – horní dutá žíla
- SvO2 – saturace smíšené žilní krve
- SVV – stroke volume variation
- TEE – transezofageální echokardiografie
- TTE – transtorakální echokardiografie
- VO2 – spotřeba kyslíku
- Vt – tidal volume (dechový objem)
- ZEEP – nulový tlak v dýchacích cestách na konci výdechu
Do redakce došlo dne 18. 12. 2013.
Do tisku přijato dne 23. 2. 2014.
Adresa pro korespondenci:
MUDr. Marcela Káňová
ARK FN Ostrava
17. listopadu 1790
708 52 Ostrava-Poruba
e-mail: marcela.kanova@fno.cz
Zdroje
1. Marik, P., Monnet, X., Teboul, J. L. Hemodynamic parameters to guide fluid therapy: Review. Annals of Intensive Care, 2011, 1, 1, p. 1–9.
2. Michard, F., Teboul, J. L. Using heart-lung interactions toassess fluid responsiveness during mechanical ventilation. Crit. Care., 2000, 4, p. 282–289.
3. Marik, P. Hemodynamic Parameters to Guide Fluid Therapy: Trasfusion Alternatives in Transfusion Medicine. 2010, 11, 3, p. 102–112.
4. Rivers, E., Nguyen, B., Havstad, S., Ressler, J., Muzzin, A., Knoblich, B., Peterson, E., Tomlanovich, M. Early goal-directed therapy in the treatment of severe sepsis and septic shock.N. Engl. J. Med., 2001, 345, 19, p. 1368–1377.
5. Calvin, J. E., Driedger, A. A., Sibbald, W. J. The hemodynamic effect of rapid fluid infusion in critically ill patiens. Surgery, 1981, 90, p. 61–76.
6. Reuse, C., Vincent, J. L., Pinsky, M. Measurements of right ventricular volumes during fluid challenge. Chest, 1990, 98, p. 1450–1454.
7. Diebel, L., Wilson, R. F., Heins, J., Larky, H. Enddiastolic volume versus pulmonary artery wedge pressure in evaluating cardiac preload in trauma patiens. J. Trauma, 1994, 37, p. 950–955.
8. Wagner, J. G., Leatherman, J. W. Right-ventricular end-diastolic volume as a predictor of the hemodynamic response to a fluid challenge. Chest, 1998, 113, p. 1048–1054.
9. Tavernier, B., Makhotine, O., Lebuffe, G., Dupot, J., Scherpereel, P. Systolic Pressure Variations as a guide to fluid therapy in patients with sespis-induced hypotension Anesthesiology, 1998, 89, p. 1313–1321.
10. Tousignant, C. P., Walsh, F., Mazer, C. D. The use of transesophageal echocardiography for preload assessment in critically ill patiens. Critical Care and Trauma, Anesth. Analg., 2000, 90, p. 351–355.
11. Michard, F., Boussat, S., Chemla, D., Anguel, N., Mercat, A., Lecarpentier, Y., Richard, Ch., Pinsky, M. R., Teboul, J. L. Relation between Respiratory Changes in Arterial Pulse Pressure and Fluid Responsiveness in Septic Patients with Acute Circulatory Failure. Am. J. Respir. Crit. Care. Med., 2000, 162, p. 134–138.
12. The ARDSNet Group. Comparison of two fluid - management strategies in acute lung Indry. N. Engl. J. Med., 2006, 354, p. 2564–2575.
13. Murphy, C. V., Schramm, G. E., Doherty, J. A., Reichley, R. M.,Gajic, O., Afessa, B. The importance of fluid management in acute lung injury secondary to septic shock. Chest, 2009, 136, p. 102–109.
14. Boyd, J. H., Forbes, J., Nakada, T., Walley, K. R., Russell, J. A.Fluid resuscitation in septic shock: a positive fluid balance and elevated central venous pressure increase mortality. Crit. Care. Med., 2011, 39, 2, p. 1–7.
15. Vincent, J. L., Sakr, Y., Sprung, Ch., Ranieri, M., Reinhart, K., Gerlach, H., Moreno, R., Carlet, J., Gall, J. R., Payen, D. Sepsis in European intensive care units: results of the SOAP study. Crit. Care Med., 2006, 34, 2, p. 344–353.
16. Marik, P., Baram, M. Noninvasive Hemodynamic Monitoring in the Intensive Care Unit. Crit. Care. Clin., 23, 2007, p. 383–400.
17. Pinsky, M. R., Payen, D. Funtional hemodynamic monitoring: Review. Critical Care, 2005, 9, 6, p. 566–572.
18. Pinsky, M. R. Assessment of indices of preload and volume responsiveness. Current Opinion in Critical Care, 2005, 11, p. 235–239.
19. Osman, D., Ridel, Ch., Ray, P., Monnet, X., Anguel, N., Richard, Ch., Teboul, J. L. Cardiac filling pressures are not appropriate to predict hemodynamic response to volume challenge. Crit. Care Med., 2007, 35, 1, p. 1–5.
20. Michard, F., Teboul, J. L. Predicting Fluid Responsiveness in ICU Patients, A Critical Analysis of the Evidence: Critical Care Review. Chest, 2002, 121, 6, p. 2000–2008.
21. Teboul, J.L., Monnet, X. Detecting volume responsiveness and unresponsiveness in intensive care unit patients: two different problems, only one solution: Commentary. Critical Care, 2009, 13, p. 175–176.
22. Shujaat, A., Bajwa, A. A. Optimalization of Preload in Severe Sepsis and Septic Shock: Review article. Critical Care Research and Practice, 2012, article ID 761051, p. 1–14.
23. Marik, P., Baram, M., Vahid, B. Does the central venous pres-sure predict fluid responsiveness? A systemic review of the literature and the tale of seven mares. Chest, 2008, 134, 1, p. 172–178.
24. Nouira, S., Elatrous, S., Dimassi, S., Besbes, L., Boukef, R., Mohamed, B., Abroug, F. Effect of norepinephrine on static and dynamic preload indicators in experimental hemorrhagic shock. Crit. Care. Med., 2005, 33, 10, p. 2339–2343.
25. Kumar, A., Anel, R., Bunnell, E., Habet, K., Zanotti, S., Marshall, S., Neumann, A., Ali, A., Cheang, M., Kavinsky, C., Parrillo, J. E. Pulmonary artery occlusion pressure and central venous pressure fail to predict ventricular filling volume, cardiac performance, or the response to volume infusion in normal subjects. Crit. Care. Med., 2004, 32, p. 691–699.
26. Pinsky, M. R. Heart-Lung interactions. Current Opinion in Critical Care, 2007, 13, p. 528–531.
27. Marik, P., Cavallazzi, R., Vasu, T., Hirani, A. Dynamic changes in arterial waveform derived variables and fluid responsiveness in mechanically ventilated patiens: A systematic review of the literature. Crit. Care. Med., 2009, 37, 9, p. 2642–2647.
28. Baker, D., Heenen, S., Piagnerelli, M., Koch, M.,Vincent, J. L. Pulse pressure variations to predict fluid responsiveness: influence of tidal volume. Intensive Care Med., 2005, 31, p. 517–523.
29. Reuter, D., Felbinger, T., Schmidt, Ch., Kilger, E., Goedje, O., Lamm, P., Goetz, A. Stroke volume variations for assessment of cardiac responsiveness to volume loading in mechanically ventilated patients after cardiac surgery. Intensive Care Med., 2002, 28, p. 392–398.
30. Monnet, X., Teboul, J. L., Richard, Ch. Cardiopulmonary interactions in patiens with heart failure. Current Opinion in Critical Care, 2007, 13, p. 6–11.
31. Mahjoub, Y., Pila, C., Friggeri, A., Zogheib, E., Lobjoie, E., Tinturier, F., Galy, C., Slama, M., Dupont, H. Assessing fluid responsiveness in critically ill patients, false-positive pulse pressure variation is detected by Doppler echocardiographic evaluation of the right ventrikle. Critical Care Medicine, 2009, 37, 9, p. 2570–2575.
32. Sakka, S. G., Hellmann, A. M., Reinhart, K. Do fluid admini-stration and reduction in norepinephrine dose improve global and splanchnic haemodynamics? British Journal of Anesthesia, 2000, 84, 6, p. 758–762.
33. Monnet, X., Teboul, J. L. Passive leg raising: Clinical commentary. Intensive Care Med., 2008, 34, p. 659–663.
34. Cavallaro, F., Sandroni, C., Marano, C., Torre, G., Mannocci, A.,Waure, Ch., Bello, G., Maviglia, R., Antonelli, M. Diagnostic accuracy of passive leg raising for prediction of fluid ressponsiveness: Systemic review and meta-analysis of clinical studies. Intensive Care Med., 2010, 36, p. 1475–1483.
35. Vincent, J. L., Rhodes, A., Perel, A., Martin, G. S., Rocca, G. D., Vallet, B., Pinsky, M. R., Hofer, Ch. K., Teboul, J. L., Boode, W. P., Scolletta, S., Baron, A. V., Backer, D., Walley, K., Maggiorini, M., Singer, M. Clinical review: Update on hemodynamic monitoring – a consensus of 16. Critical Care, 2011, 15, p. 229–236.
Štítky
Anestéziológia a resuscitácia Intenzívna medicína
Článek Acidobazická rovnováhaČlánek XX. kongres ČSARIM Brno 2013Článek Oceněné práce 2013Článek Kongresy a konferenceČlánek Právo, etika, náš obor a my
Článok vyšiel v časopiseAnesteziologie a intenzivní medicína
Najčítanejšie tento týždeň
2014 Číslo 2- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Metamizol v liečbe pooperačnej bolesti u opioid-tolerantnej pacientky – kazuistika
- e-Konzilium.cz — Masivní plicní embolie při tromboembolické nemoci
-
Všetky články tohto čísla
- Statické a dynamické testy v řízení volumoterapie
- Ultrazvukové vyšetření aorty v urgentní medicíně
- Současné postupy v porodnické anestezii IV. – anesteziologické komplikace u císařského řezu
- Acidobazická rovnováha
- Mozková (mikro)cirkulace – základní struktura a funkce
- iNO a ARDS: Vyšetřování skončilo, zapomeňme!
-
The Canadian Critical Care Nutrition Guidelines in 2013
An Update on Current Recommendationsand Implementation Strategies - Doporučený postup před odběrem orgánů od zemřelých dárcůpo nevratné zástavě oběhu
- Pojem standardu péče v kontextu reformních změn
-
XX. kongres ČSARIM
Brno 2013 - MUDr. Peter Gašparec (14. 12. 1951 – 29. 11. 2013)
- Zemřel emeritní primář MUDr. Jiří Brabec (31. 8. 1925 – 19. 2. 2014)
- European Association of Cardiothoracic Anaesthesiologists v roce 2014
- Oceněné práce 2013
- Jubilejní XX. kongres České společnosti anesteziologie, resuscitace a intenzivní medicíny
- Kongresy a konference
- Stanovisko výboru ČSARIM k návrhu rozsahu požadovaných kompetencí v ultrazvukových metodách pro lékaře oboru Anesteziologiea intenzivní medicína
- Zamyšlení nad XX. kongresem ČSARIM v Brně
- Extrakorporální membránová oxygenace a respirační selhání
- Právo, etika, náš obor a my
- Fast-track není jen fyziologická anestezie
- Hodnoty diference silných iontů (SID) u kriticky nemocných pacientů s normálními hodnotami arteriálního pH, pCO2, BE a HCO3-a jejich vliv na mortalitu
- Metody mimotělní oxygenacea eliminace CO2 určené primárně k náhradě plicních funkcí
- Anesteziologie a intenzivní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Acidobazická rovnováha
- Statické a dynamické testy v řízení volumoterapie
- Současné postupy v porodnické anestezii IV. – anesteziologické komplikace u císařského řezu
- Extrakorporální membránová oxygenace a respirační selhání
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



