Echokardiografie u akutních koronárních syndromů
Echocardiography in the acute coronary syndrome
Echocardiography is a non-invasive diagnostic technique that provides information regarding heart function and haemodynamics. It is essential both for diagnosing the acute coronary syndrome, evaluation of the ventricular function and the presence of regional wall motion abnormalities, and for ruling out other etiologies of acute chest pain or dyspnoea. It also provides timely and accurate diagnosis in the haemodynamically unstable patients presenting with myocardial infarction complications including cardiac tamponade, severe mitral regurgitation or ventricular septal defect. This review focuses on the current role of echocardiography in patients with the acute coronary syndrome and its complications.
KEYWORDS:
echocardiography – acute coronary syndrome – myocardial infarction – heart failure
Autoři:
M. Pořízka
Působiště autorů:
Klinika anesteziologie, resuscitace a intenzivní medicíny, 1. lékařská fakulta, Univerzita Karlova v Praze
a Všeobecná fakultní nemocnice v Praze
Vyšlo v časopise:
Anest. intenziv. Med., 27, 2016, č. 5, s. 309-314
Kategorie:
Ultrazvukové metody- Přehledový článek
Souhrn
Echokardiografie představuje neinvazivní diagnostickou metodu, která poskytuje cenné informace o funkci srdce a oběhového systému. Pomáhá v diagnostice akutního koronárního syndromu, při hodnocení globální funkce srdečních komor či přítomnosti regionálních poruch kinetiky. Obecně je součástí diferenciálně diagnostického procesu u pacientů s bolestmi na hrudi a dušností. Přináší též včasnou a přesnou diagnózu u hemodynamicky nestabilních pacientů postižených některou ze závažných mechanických komplikací infarktu myokardu, včetně srdeční tamponády, těžké mitrální regurgitace či defektu septa komor. Tento stručný přehledový článek se zaměřuje na současnou roli echokardiografie v diagnostice u pacientů s akutním koronárním syndromem a jeho komplikacemi.
Klíčová slova:
echokardiografie – akutní koronární syndrom – infarkt myokardu – srdeční selhání
ÚVOD
Echokardiografie má nezastupitelnou roli v diagnóze akutního koronárního syndromu (AKS) u pacientů na urgentním příjmu a jednotkách intenzivní péče. V akutním stadiu u pacienta s bolestmi na hrudi společně s ostatními diagnostickými metodami (elektrokardiografie, srdeční enzymy) pomáhá hlavně v diferenciální diagnostice. Později během následného pobytu v intenzivní péči mohou sériová echokardiografická vyšetření monitorovat efekt reperfuzní léčby či identifikovat příčinu možné oběhové nestability. Pomocí transthorakální echokardiografie (TTE) je možno v akutní fázi zhodnotit globální systolickou a diastolickou funkci srdečních komor, detekovat regionální poruchy kinetiky a případně zachytit mechanické či pozdní komplikace infarktu myokardu (IM). K těm nejzávažnějším patří mitrální regurgitace, defekt komorového septa, srdeční tamponáda či vznik nitrosrdečního trombu [1]. V případě AKS se doporučuje k detekci těchto komplikací provést TTE alespoň jednou během prvních 24–48 hodin [2].
DIAGNOSTIKA AKS
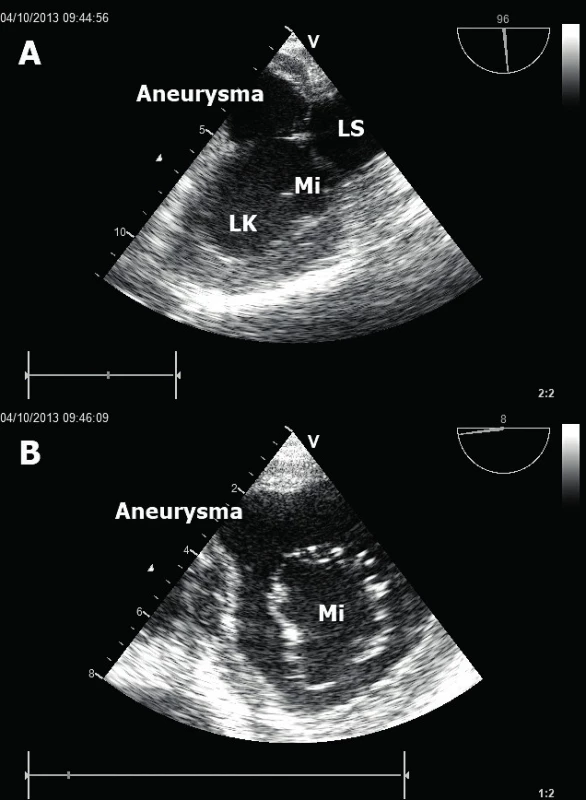
Echokardiografie může výrazně přispět ke správné diagnóze AKS, a to zvláště v nejistých případech s atypickými symptomy či nediagnostickým EKG [3]. Nově vzniklé lokalizované poruchy kinetiky (anglicky „regional wall motion abnormalities“ – RWMA) mohou nejen potvrdit diagnózu AKS, nýbrž i identifikovat tzv. „culprit lézi“, tedy větev koronární arterie, jejíž částečná či úplná okluze je v tu chvíli odpovědná za probíhající ischémii [4]. Při hodnocení RWMA se sleduje kontraktilita myokardu (ztlušťování srdeční stěny během systoly) a pohyb endokardu směrem do nitra srdeční komory [5]. Za normálních okolností se ztlušťuje myokard o více než 30 % počáteční šířky. Během srdeční ischémie dochází k hypokinezi srdečních stěn, tedy poruše jejich ztlušťování. O lehké hypokinezi hovoříme při 10–30% ztlušťování myokardu, o těžké pak pokud je ztlušťování menší než 10 %. Při akinezi (v případě těžké ischémie či již dokonaného IM) se daný segment myokardu nekontrahuje vůbec. Extrémní případ pak představuje dyskineze myokardu, kdy se příslušný segment paradoxně vyklenuje během systoly excentricky, směrem ven od srdečního nitra. Podstatou tohoto jevu je přítomnost jizevnaté tkáně po již proběhlém infarktu myokardu. V tomto případě je echokardiograficky typické ztenčení a hyperechogenita postiženého okrsku svaloviny. V terénu akinetického myokardu často dochází k vytvoření srdečního aneurysmatu, jež je rizikovým faktorem pro vznik nitrosrdečního trombu (obr. 1). Při kompletním TTE vyšetření lze hodnotit každý ze 17 srdečních segmentů levé komory (LK). Dokonalý přehled pak zajistí kombinace apikálních a parasternálních projekcí na krátkou osu. Je nutno mít ovšem na paměti, že tyto RWMA mohou být staršího data, či že se může jednat o postižení v rámci jiných srdečních onemocnění (myokarditida, kardiomyopatie). Je proto vždy nezbytná korelace s klinickým nálezem a ostatními diagnostickými metodami.
Závažným následkem probíhající ischémie či již dokonaného infarktu myokardu je porucha globální systolické funkce LK [6] či pravé komory (PK) [7]. V případě LK hodnotíme celkovou systolickou funkci nejčastěji pomocí stanovení ejekční frakce (EF). To se provádí nejlépe tzv. modifikovanou Simpsonovou metodou sumace disků. V každé ze dvou apikálních projekcí (čtyřdutinová a dvoudutinová) změříme endsystolický (ESV) a enddiastolický (EDV) objem LK a pomocí vzorce
EF = (EDV – ESV/EDV)*100
pak získáme EF LK v procentech. Následně zprůměrováním těchto parametrů z obou projekcí dostaneme finální EF LK. Tak jako každá metoda má i tato svoje limitace. V případě těžké mitrální regurgitace či přítomnosti defektu komorového septa tento parametr značně nadhodnocuje globální systolickou funkci, neboť značná část EDV je během systoly vrácena zpět do levé síně či PK, a stupeň myokardiální dysfunkce je mnohem větší, než se na první pohled zdá. U PK se vzhledem ke komplexnímu tvaru běžně nestanovuje EF, nýbrž se nejčastěji hodnotí longitudinální systolická funkce PK pomocí TAPSE (tricuspid anulus plane systolic excursions) a globální funkce pomocí FAC (fractional area change).
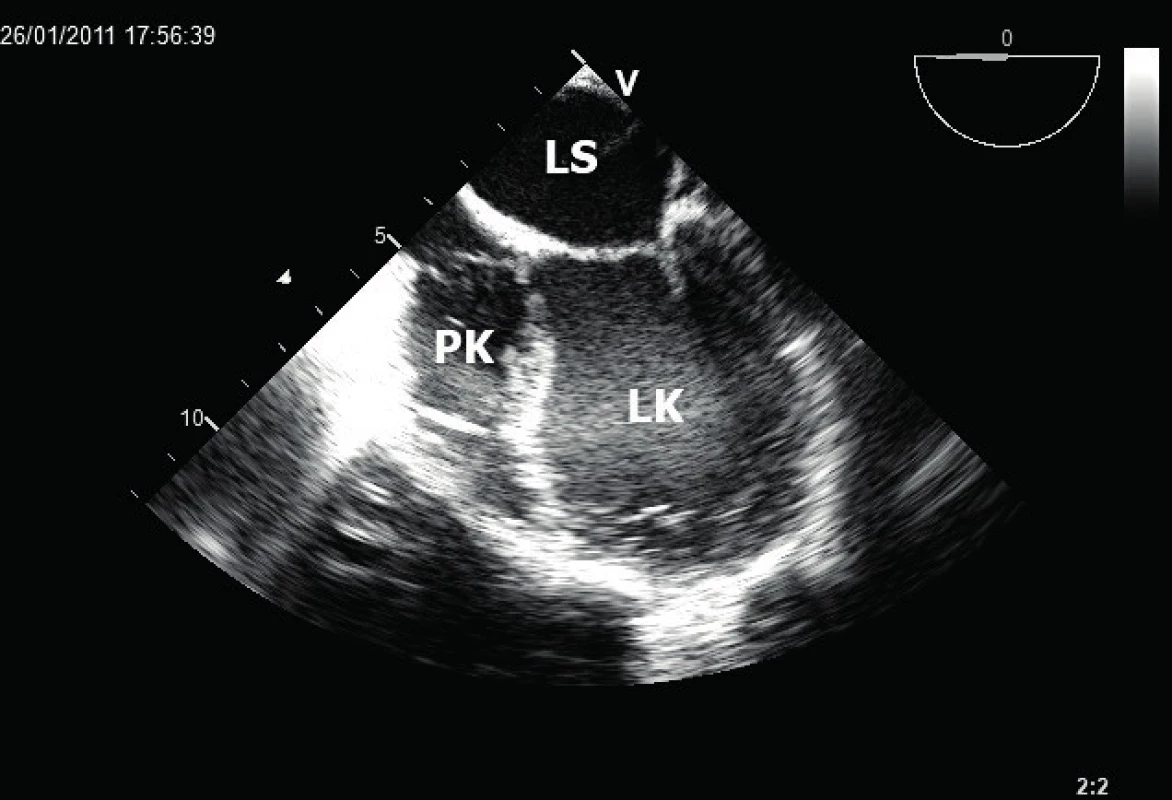
Nedílnou součástí echokardiografického vyšetření zůstává stanovení velikosti srdečních oddílů. Při těžkém ischemickém postižení dochází k dilataci srdečních komor, v případě pokročilé chronické ischemické choroby srdeční je typická tzv. kulovitá, poinfarktová remodelace LK [8] (obr. 2). V tomto případě dochází v řádu týdnů až měsíců od proběhlého IM ke změně tvaru LK z oválného na kulovitý. Během této remodelace dilatují i bazální segmenty včetně mitrálního anulu, čímž se částečně podílí na vzniku ischemické mitrální regurgitace.
Kromě systolické funkce bývá během srdeční ischémie postižena i funkce diastolická, a to dokonce jako nejčasnější parametr. Existují tři stupně diastolické dysfunkce, přitom tzv. restrikce, tedy třetí nejtěžší stupeň, je spojena s rozvojem diastolického srdečního selhání. Podobně jako systolická dysfunkce značně zhoršuje prognózu nemocných, a to i v případě zachovalé EF LK [9]. Restrikci plnění LK spolehlivě identifikujeme vyšetřením transmitrálního proudu pomocí pulzního dopplerovského vyšetření. Typické jsou více než dvojnásobné rychlosti časně diastolické vlny E v poměru k pozdním síňovým vlnám A, charakteristický je rovněž pokles deceleračního času vlny E pod 150 ms.
MECHANICKÉ KOMPLIKACE AKS
Rozsáhlá nekróza myokardu během AKS může způsobit vznik život ohrožujících mechanických komplikací. Mezi katastrofické scénáře patří ruptura volné stěny LK (s progresí do srdeční tamponády či vznik pseudoaneurysmatu LK), defekt komorového septa s rozvojem levo-pravého srdečního zkratu či ruptura papilárního svalu způsobující těžkou mitrální regurgitaci. Jakákoliv hemodynamická nestabilita u pacienta s AKS by nás měla proto vést k provedení urgentního TTE, v optimálním případě i jícnové echokardiografie.
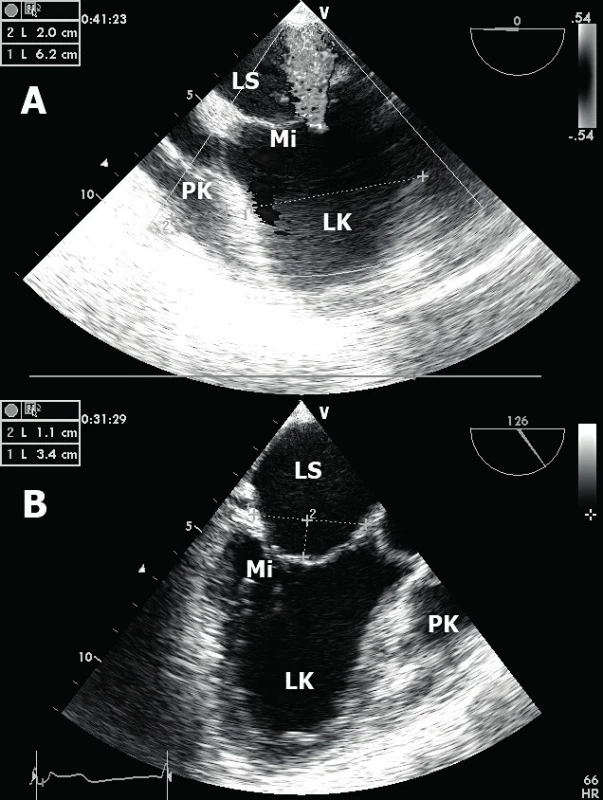
Mitrální regurgitace (MR) – v akutním stadiu je nejčastěji ischemická MR způsobená částečnou či úplnou rupturou papilárního svalu [10]. Typicky bývá postižen především posterome-diální papilární sval při IM spodní a zadní stěny s následným hlubokým prolapsem postiženého mitrálního cípu. Výsledkem je těžká, excentrická regurgitace způsobující plicní edém. Méně obvyklé je postižení anteromediálního papilárního svalu z důvodu zdvojeného koronárního zásobení. V subakutním stadiu je mechanismus poněkud odlišný. Na tzv. funkční ischemické MR se podílí dilatace LK (včetně mitrálního anulu) a tím podmíněný, excentrický posun celého subvalvulárního aparátu (papilární svaly, šlašinky) – obrázek 3A [11]. To vede ke vtahování mitrálních cípů do nitra LK, restrikci pohybu cípů mitrální chlopně a následně zmenšení zóny koaptace. V echokardiografickém obraze pak tento jev připomíná stan (anglicky „tenting“ mitrální chlopně) – obrázek 3B. Výsledná nedomykavost má charakter většinou centrální, vzácněji excentrické regurgitace. Ideální modalitou pro zobrazení je jícnová echokardiografie, kdy kombinací 2D obrazu s barevným dopplerovským mapováním můžeme tuto komplikaci identifikovat.
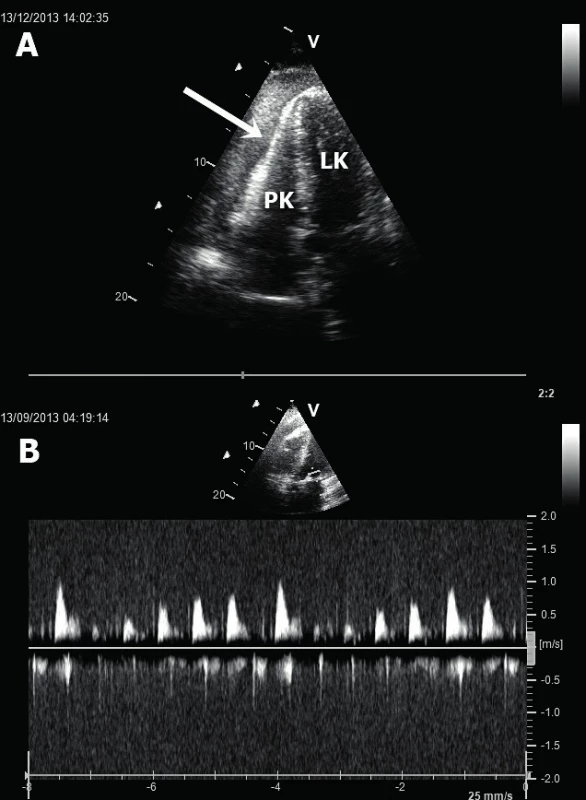
Ruptura volné stěny LK – popisují se dvě fáze možných ruptur volné stěny [12]. V časné fázi (do 72 hod po IM) dochází nejčastěji k ruptuře přední stěny LK při anteroextenzivním IM. Výsledkem je srdeční tamponáda způsobující obstrukční šok (obr. 4A). V pozdní fázi (nad 96 hod) dochází k ruptuře na kterémkoliv místě bez jasné predilekce. V echokardiografickém obraze vidíme typicky hypoechogenní kolekci tekutiny v perikardiální dutině nejlépe v apikálních či subxifoidální projekci. Echokardiografické známky srdeční tamponády zahrnují enddiastolický kolaps volné stěny PK, respirační varianci transmitrálního průtoku nad 25 % (rychlosti vlny E při použití pulzního dopplerovského vyšetření) – obrázek 4B, či typický obrázek tzv. „swinging heart“ (houpavý pohyb srdce komprimovaného perikardiální tekutinou). Velmi vzácně při výskytu perikardiálních adhezí dochází u ruptury stěny LK k vytvoření srdečního pseudoaneurysmatu (obr. 5). Echokardiograficky lze identifikovat krček pseudoanerysmatu. Průměr krčku by neměl přesahovat polovinu průměru samotné pseudovýdutě [13].
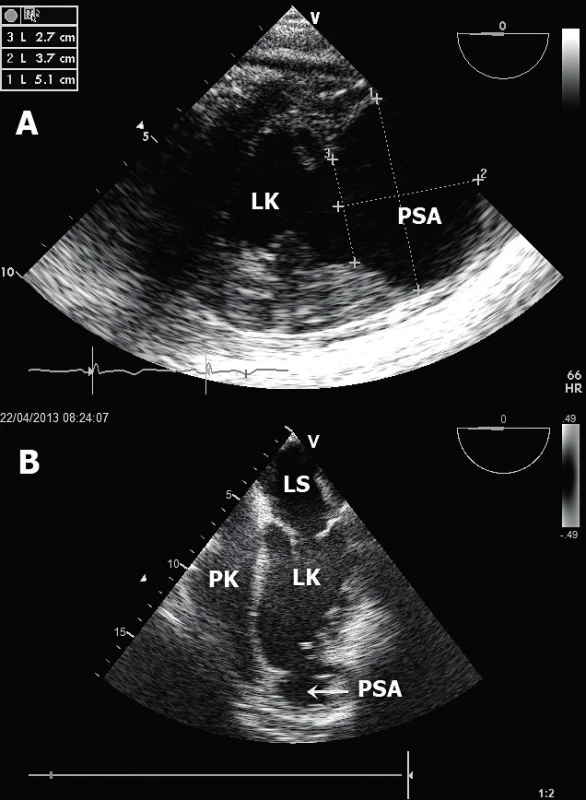
Ruptura mezikomorového septa – tyto ruptury se vyskytují ve dvou charakteristických lokalizacích [14]. Při infarktu myokardu přední stěny a septa se vytvoří trhlina v oblasti apikálního septa (obr. 6A). Tento defekt je nejlépe zobrazitelný v apikální čtyřdutinové a pětidutinové projekci. Naopak při infarktu myokardu spodní stěny dochází k ruptuře v oblasti bazálního septa a nejlepší zobrazení je dosaženo v apikální dvoudutinové a čtyřdutinové projekci. Neocenitelným pomocníkem k identifikaci defektu komorového septa je barevné dopplerovské mapování, které s vysokou senzitivitou potvrdí přítomnost defektu, lokalizuje a kvantifikuje jeho velikost [15]. Ruptura komorového septa (obr. 6B) vede k levo-pravému (L-P) srdečnímu zkratu a následně k objemovému přetížení a selhání PK. Echokardiografický nález tak doplňuje dilatovaná a dysfunkční PK s různým stupněm trikuspidální regurgitace. L-P zkrat lze echokardiograficky kvantifikovat srovnáním výdeje levé a pravé komory (Qp : Qs). Tepový objem LK (Qs) vypočteme vynásobením VTI (velocity-time integral) z výtokového traktu LK (LVOT) pomocí pulzního dopplerovského vyšetření (v apikální pětidutinové projekci) a plochy LVOT (vypočteného z průměru LVOT nejlépe v dlouhé parasternální projekci). Podobným způsobem vypočteme i tepový objem PK (Qp), a to z krátké parasternální projekce v úrovni velkých cév, kdy získáme jak průměr, tak VTI výtokového traktu PK. Významný L-P zkrat je charakterizován hodnotou Qp : Qs větší než 1,5.
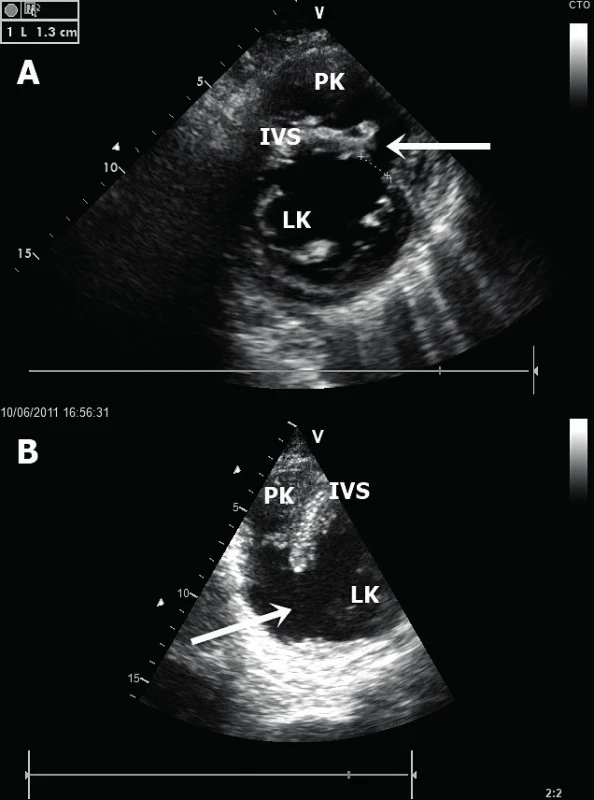
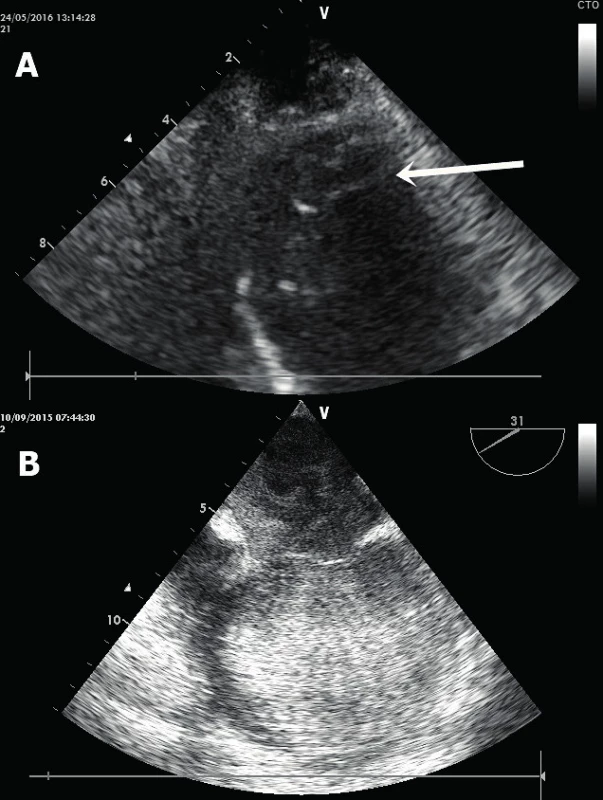
Nitrosrdeční trombus – vzniká na akinetickém či aneurysmatickém segmentu myokardu (nejčastěji v srdečním hrotu) u pacientů s těžkou systolickou dysfunkcí, a to v místě, kde dochází k obleněnému toku až stáze krve [16]. Jedná se buď o široce přisedlý (obr. 7A), či naopak mobilní pendulující hyperechogenní útvar v srdeční dutině. Zejména posledně jmenovaný má maligní charakter s vysokým potenciálem systémové embolizace. Ideální modalitou pro zobrazení apikálního trombu je TTE v apikálních projekcích. Varovným signálem možného vzniku nitrosrdečního trombu je tzv. spontánní echokontrast, kdy v echokardiografickém obraze jsme schopni identifikovat jasně viditelný, vířivý a zpomalený tok krve připomínající víření kouře (obr. 7B).
ZÁVĚR
Echokardiografie zastává významnou roli poprvé v časné fázi akutního koronárního syndromu, a to jak při jeho vlastní diagnostice, tak v detekci závažných mechanických komplikací. Dále v pozdější fázi při monitorování efektu reperfuzní terapie či chirurgické léčby komplikací. V případě rozvoje cirkulačního šoku se jedná o metodu první volby v promptní diagnostice vyvolávající příčiny. Následně umožňuje včasnou a často i život zachraňující intervenci.
Autor prohlašuje, že nemá střet zájmů.
Do redakce došlo dne 20. 6. 2016.
Do tisku přijato dne 2. 7. 2016.
Adresa pro korespondenci:
MUDr. Michal Pořízka, Ph.D., E.D.I.C.
KARIM VFN Praha
U Nemocnice 2
128 08 Praha 2
e-mail: rizko@post.cz
Zdroje
1. Flachskampf, F. et al. Cardiac imaging after myocardial infarction. European Heart Journal, 2011, 32, p. 272–283.
2. Antman, E. et al. 2007 focused update of the ACC/AHA 2004 Guidelines for the Management of Patients With ST-Elevation Myocardial Infarction: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Group to Review New Evidence and Update the ACC/AHA 2004 Guidelines for the Management of Patients With ST-Elevation Myocardial Infarction). J. Am. Coll. Cardiol., 2008, 51, p. 210–247.
3. Kontos, M. et al. Early echocardiography can predict cardiac events in emergency department patients with chest pain. Ann. Emerg. Med., 1998, 31, p. 550–557.
4. Cerqueira, M. et al. Standardized myocardial segmentation and nomenclature for tomographic imaging of the heart. Circulation, 2002, 105, p. 539–542.
5. Schiller, N. et al. Recommendations for quantitation of the left ventricle by two-dimensional echocardiography. J. Am. Soc. Echocardiogr., 1989, 2, p. 358–367.
6. Picard, M. et al. Natural history of left ventricular size and function after acute myocardial infarction. Assessment and prediction by echocardiographic endocardial surface mapping. Circulation, 1990, 82, p. 484–494.
7. Engstrom, A. et al. Right ventricular dysfunction is an independent predictor for mortality in ST-elevation myocardial infarction patients presenting with cardiogenic shock on admission. Eur. J. Heart Fail., 2010, 12, p. 276–282.
8. Cohn, J. et al. Cardiac remodeling – concepts and clinical implications: a consensus paper from an international forum on cardiac remodeling. On behalf of an international forum on cardiac remodeling. J. Am. Coll. Cardiol., 2000, 35, p. 569–582.
9. Moller, J. et al. Independent prognostic importance of a restrictive left ventricular filling pattern after myocardial infarction: an individual patient meta-analysis: meta-analysis research group in echocardiography acute myocardial infarction. Circulation, 2008, 117, p. 2591–2598.
10. Zotz, R. et al. Diagnosis of papillary muscle rupture after acute myocardial infarction by transthoracic and transesophageal echocardiography. Clin. Cardiol., 1993, 16, p. 665–670.
11. Marwick, T. et al. Ischaemic mitral regurgitation: mechanisms and diagnosis. Heart, 2009, 95, p. 1711–1718.
12. Nakatsuchi, Y. et al. Clinicopathological characterization of cardiac free wall rupture in patients with acute myocardial infarction: difference between early and late phase rupture. Int. J. Cardiol., 1994, 47, p. 33–38.
13. Yeo, T. et al. Clinical profile and outcome in 52 patients with cardiac pseudoaneurysm. Ann. Intern. Med., 1998, 128, p. 299–305.
14. Birnbaum, Y. et al. Ventricular septal rupture after acute myocardial infarction. N. Engl. J. Med., 2002, 347, p. 1426–1432.
15. Kishon, Y. et al. Evolution of echocardiographic modalities in detection of postmyocardial infarction ventricular septal defect and papillary muscle rupture: study of 62 patients. Am. Heart J., 1993, 126, p. 667–675.
16. Delewi, R. et al. Left ventricular thrombus formation after acute myocardial infarction. Heart, 2012, 98, 23, p. 1743–1749.
Štítky
Anestéziológia a resuscitácia Intenzívna medicínaČlánok vyšiel v časopise
Anesteziologie a intenzivní medicína

2016 Číslo 5
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- e-Konzilium.cz — Masivní plicní embolie při tromboembolické nemoci
- Kvalita výživy na JIS a následná kvalita života spolu úzko súvisia
- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
Najčítanejšie v tomto čísle
- Hypotenze po úvodu do celkové anestezie: prevalence, význam, rizikové faktory a možnosti prevence
- Polohování pacienta
- Definice sepse 2016 (Sepsis-3)
- Vybrané aspekty anestezie u operačních výkonů z neporodnické indikace v těhotenství
