-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Manažment septickej diseminovanej intravaskulárnej koagulopatie pomocou antitrombínu a heparínu a význam tromboelastometrie v diagnostike heparínovej rezistencie
Management of sepsis-induced disseminated intravascular coagulopathy using antithrombin and heparin, and the use of thromboelastometry in establishing the diagnosis of heparin resistance
Severe sepsis is often accompanied by disseminated intravascular coagulation (DIC) and multiple organ dysfunction. Increased activation of coagulation is characteristic for this syndrome and therefore, from the pathophysiological point of view, it would be logical to intervene at the initiation of coagulation by the administration of antithrombin and heparin. Evidence from randomized studies offering clear instructions on the usage of these drugs is lacking though. In our case report we describe the management of septic DIC with antithrombin and heparin without bleeding complication. We have found that in order to stop the consumption of the coagulation blood components, it is required to maintain antithrombin levels above 90%. Because of the high risk of heparin resistance in sepsis it is appropriate to monitor the level of heparin with anti Xa with the aim of 0.5–0.6.
KEYWORDS:
antithrombin – heparin – heparin resistance – disseminated intravascular coagulation – thromboelastometry
Autoři: M. Durila 1; P. Salaj 2; Helena Součková 3; M. Astraverkhava 1; J. Beroušek 1
Působiště autorů: Klinika anesteziologie, resuscitace a intenzivní medicíny, 2. LF UK a FN Motol, Praha 1; Ústav hematologie a krevní tranfuze, Centrum pro trombózu a hemostázu, Praha 2; Gynekologicko-porodnická klinika, 2. LF UK a FN Motol, Praha 3
Vyšlo v časopise: Anest. intenziv. Med., 27, 2016, č. 6, s. 358-363
Kategorie: Intenzivní medicína - Kazuistika
Souhrn
Ťažký septický stav je často sprevádzaný prítomnosťou diseminovanej intravaskulárnej koagulopatie (DIK) a multiorgánovou dysfunkciou. Pre tento syndróm je charakteristická zvýšená aktivácia koagulácie, a preto z patofyziologického hľadiska by bolo logické zasiahnuť do iniciácie zrážania podaním antitrombínu a heparínu. Avšak nie je dostatok randomizovaných štúdií, ktoré by jednoznačne dávali návod, ako tieto lieky používať. V našej kazuistike popisujeme manažment septickej DIK pomocou antitrombínu a heparínu bez krvácavých komplikácii. Zistili sme, že u danej pacientky k zastaveniu konzumpcie jednotlivých zložiek zrážania krvi bolo nutné udržovať hladinu antitrombínu nad 90 % a pre vysoké riziko heparínovej rezistencie u septického stavu je vhodné monitorovať hladinu heparínu pomocou anti Xa s cieľom 0,5–0,6.
KĽÚČOVÉ SLOVÁ:
antitrombín – heparín – heparínová rezistencia – diseminovaná intravaskulárna koagulopatia – tromboelastometriaÚVOD
Diseminovaná intravaskulárna koagulopatia (DIK) je patofyziologický stav hemokoagulácie, ktorý je sprevádzaný nadmernou konzumpciou zrážacích faktorov a koagulačných inhibítorov. Je spojený s rizikom rozvoja multiorgánového zlyhania a pokiaľ sa nezakročí k adekvátnej terapii, tak vyúsťuje do život ohrozujúceho krvácania. Prvé štádium je nazývané non-overt DIK a druhé štádium overt-DIK. Jednou z častých príčin DIK je aj ťažká infekcia – sepsa. Terapia sepse spočíva v podaní antibiotickej terapie a rovnako aj v terapii koagulopatie, keďže je všeobecne známe, že hemokoagulácia je úzko spätá so zápalovou odpoveďou. Avšak terapia DIK nemusí byť jednoduchá, a to z toho dôvodu, že jednotlivé štádia DIK môžu prebiehať rôzne rýchlo. Autori Levi et al. odporúčajú u pacientov, ktorí nemajú krvácavé prejavy, profylaktické podávanie nefrakcionovaného či nízkomolekulárneho heparínu ako prevenciu tromboembolizmu [1]. U pacientov s rizikom krvácania títo autori odporúčajú substitúciu zrážacích faktorov podávaním čerstvej mrazenej plazmy (ČMP). Úloha antitrombínu (AT) a heparínu je široko diskutovaná a odborné spoločnosti sa pre nedostatok randomizovaných štúdií rozchádzajú v názore, či antitrombín u DIK podávať alebo nie a rovnako je podobný názor aj na aplikáciu heparínu. Napríklad Britská spoločnosť hematológie a Medzinárodná spoločnosť pre trombózu a hemostázu neodporúča všeobecne podávať antitrombín [1], ale na druhej strane Japonská spoločnosť trombózy a hemostázy antitrombín v liečbe DIK odporúča (sila odporúčania B1) [2]. Warren et al. nenašli rozdiel v mortalite u pacientov na JIS s nešpecifickým deficitom AT, ak im bol alebo nebol AT substituovaný. V skupine pacientov so súčasným podávaním AT a heparínu bola zistená zvýšená incidencia krvácania [3]. Na druhej strane Kienast et al. ukázali, že antitrombín je účinný pri non-overt DIK a jeho podanie bez súčasného podávania heparínu viedlo k zníženej mortalite [4].
V našom prípade popisujeme úspešný manažment septickej DIK, ktorá bola liečená podávaním kombinácie antitrombínu a heparínu. Situácia bola komplikovaná rozvojom heparínovej rezistencie diagnostikovanej pomocou ROTEM a potvrdenej aktivitou anti Xa.
POPIS PRÍPADU
Tridsaťštyri ročná pacientka (pacientka dala súhlas k publikácii tejto kazuistiky), ktorá ambulantne podstúpila hysteroskopiu na pracovisku mimo FN Motol, bola vo večerných hodinách pre febrílie a celkovú slabosť, tj. v septickom šoku, dopravená záchrannou službou do FN Motol, kde bola následne prijatá na gynekologické oddelenie (TT 38,6 ˚C, TK 73/53 torr, P 137/min). Laboratórne bola zistená leukocytóza 16,9 x 109/l, CRP 35,7 mg/l a prokalcitonín 75,84 µg/l. Bola nasadená antibiotická terapia a pacientka bola hospitalizovaná na jednotke intenzívnej starostlivosti (JIS). Hodnoty koagulačných testov sú opísané v tabuľke 1 (a rovnako celý vývoj prípadu s komentárom a výkonmi) a boli nasledovné: APTT-r 1,26 (aktivovaný parciálny tromboplastínový čas – ratio), PT-r 1,45 (protrombinový čas – ratio), fibrinogén 2,32 g/l, AT 77%, d-diméry 1250 ng/ml, hemoglobín (Hb) 126 g/l, trombocyty 113 x 109/l. Ráno ale koagulopatia progredovala: APTT-r 1,61, PT-r 1,79, fibrinogén klesol na 1,91 g/l, AT 68%, d-diméry stúpli nad 15 000 ng/ml,Hb poklesol na 117 g/l a trombocyty (Tr) ostali bez zmeny 113 x 109/l. Keďže bolo podozrenie na počínajúci DIK, pacientke bolo podané 500 IU antitrombínu s cieľom zvýšiť hladinu antitrombínu na 80 % podľa vzorca:
[(požadovaná hladina – aktuálna hladina) x hmotnost (kg) x 0,7, t. j. (80–68) x 56 x 0,7= 470 IU]
a preventívna dávka nízkomolekulárneho heparínu-nadroparínu (LMWH) 0,3 ml s.c. Kontrola laboratórnych hodnôt za 6 hodín ukázala, že intervencia antitrombínom a profylaktickou dávkou LMWH nezastavila konzumpciu pri DIK a výsledky boli nasledovné: pokles AT 44 %, Tr 80 x 109/l, fibrinogén 1,46 g/l, APTT-r 2,31, PT-r 2,59, Hb poklesol na 77 g/l, anti Xa 0,13. Pokles hemoglobínu nebol spôsobený hemodilúciou, pretože pacientka dostala medzičasom len 200 ml koloidov a 150 ml kryštaloidov, ale bol pravdepodobne spôsobený hemolýzou (objavila sa slabá hematúria, detekovaný hemoglobin v moči (3x), laktátdehydrogenáza bola zvýšená na 3,2 µkat/l, bilirubín bol zvýšený – 19 µmol/l celkový a konjugovaný 11 µmol/l). Vypočítané skóre DIK malo hodnotu 6 (http://reference.medscape.com/calculator/dic-score).
Keďže pacientka mala zvýšené riziko krvácania (bola po inštrumentálnom výkone v uteru), bolo jej na základe ROTEM podané 3 g fibrinogénu a 2000 IU antitrombínu (vypočítaná dávka bola cielená k dosiahnutiu 100 %) a pacientka bola preložená k ďalšej starostlivosti na Kliniku anesteziologie, resuscitace a intenzivní medicíny s podporou obehu noradrenalínom 0,23 µg/kg/min a hranične respiračne suficientná. Kontrolné laboratórne výsledky boli nasledovné: vzostup Tr 100 x 109/l, AT 109 %, fibrinogén 2,64 g/l, APTT-r 1,99, PT-r 2,13 a Hb spontánne stúpol na 107 g/l. Keďže profylaktická dávka LMWH sa ukázala ako neúčinná v zastavení DIK, rozhodli sme sa pristúpiť ku kontinuálnemu i.v. podávaniu heparínu 600 j/hod. Kontrolný ROTEM-NATEM ukázal dostatočný účinok heparínu (obr. 1a), čo sa odrazilo aj na laboratórnych výsledkoch (vzostup Tr na 102 x109/l, AT na 112 %, APTT-r na 2,81), a preto sme znížili dávku heparínu na 200 j/hod s cieľom APTT-r 2,0. Avšak cca za 10 hodín dochádza znovu k poklesu Tr na 82 x 109/l, AT na 92% a APTT-r klesá na 1,68. Zvyšujeme dávku heparínu na 400 j/hod. Za 6 hodín dochádza k ďalšiemu poklesu Tr na 69 x 109/l a AT klesá na 86 %, APTT-r 1,63. Podávame 1000 IU antitrombínu k zlepšeniu účinnosti heparínu. Zvýšenie dávky heparínu a substitúcia AT ale nemá efekt a DIK pokračuje – Tr 59 x 109/l, APTT-r 1,55. Vyšetrujeme NATEM, a na výsledku nie je viditeľný efekt heparínu (obr. 1b). Máme podozrenie na vznik heparínovej rezistencie a vyšetrujeme hladinu FVIII, ktorá je častou príčinou heparínovej rezistencie, a rovnako vyšetrujeme aktivitu anti Xa. Hladina anti Xa je 0,15 U/ml, čo potvrdzuje heparínovú rezistenciu, hoci hladina FVIII je 95%. Keďže AT je dostatočný (102 %), zvyšujeme dávku heparínu na 600 j/hod s cieľom anti Xa 0,6. Toto zvýšenie ale podľa kontrolných laboratórnych výsledkov nie je dostatočné (tab. 1, 3. deň 22.11 hod). Preto navyšujeme dávku heparínu na 1 200 j/hod. Za 6 hodin je anti Xa 0,6, APTT-r 3,7 a už nedochádza k poklesu Tr a taktiež je vidno efekt heparínu na NATEM (obr. 1c), ktorý je potvrdený heparínázou (obr. 1d). Znižujeme dávku heparínu na 800 j/hod, ale opäť dochádza k poklesu Tr, AT, APTT-r a anti Xa na 0,4. Vraciame dávku heparínu na 1 200 j/hod a pacientku v stabilizovanom stave a bez noradrenalínovej podpory obehu prekladáme na JIS gynekologickej kliniky. Podľa kontrolných laboratórnych výsledkov však pokračuje DIK (tab. 4. deň 17.30 hod), podávame 500 IU antitrombínu (výpočet na 100 % hladiny). Za 6 hodín vidíme dobrý efekt na anti Xa a APTT-r. Pokračujeme v nastavenej terapii. Ďalší deň sa laboratórne parametre znovu zlepšujú (tab. 5. deň 17.18 hod) a pri znížených zápalových parametroch znižujeme dávku heparínu na 800 j/hod. Avšak situácia sa opakuje a klesá anti Xa na 0,17, APTT-r 1,35 a pokles Tr a AT (viz tab. 1, 6. deň 5.11 hod). Keďže leukocyty sú už v norme (7,6 x 109/l), prechádzame na nízkomolekulárny heparín 2 x 0,6 ml s.c. s cieľom anti Xa 0,5-0,6. Na tejto dávke LMWH je anti Xa dostačujúce (0,5-0,53) (tab. 1, deň 7 a 8), dochádza k zlepšeniu laboratórnych parametrov a pacientka je preložená na štandardné oddelenie. Na tejto dávke LMWH je následne prepustená domov.
Obr. 1. ROTEM-NATEM krivky pri terapii heparínom 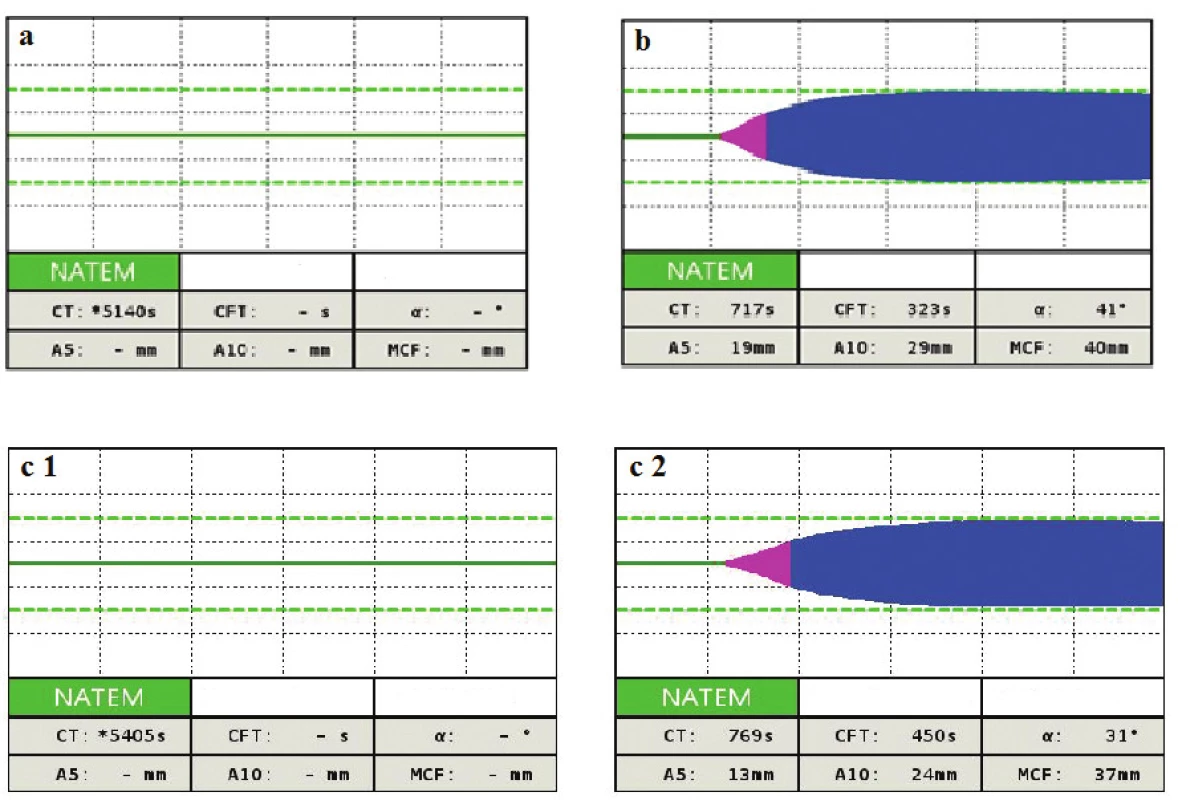
1a – vplyv heparínu na začiatku terapie, nedochádza k zrážaniu krvi 1b – nie je vplyv heparínu napriek kontinuálnemu podávaniu i. v., je podozrenie na vznik rezistencie 1c – znovu je vidno efekt heparínu 1d – efekt heparínu je potvrdený heparinázou (HEPTEM) Tab. 1. Časový vývoj laboratórnych parametrov v priebehu DIK, intervencie a komentáre 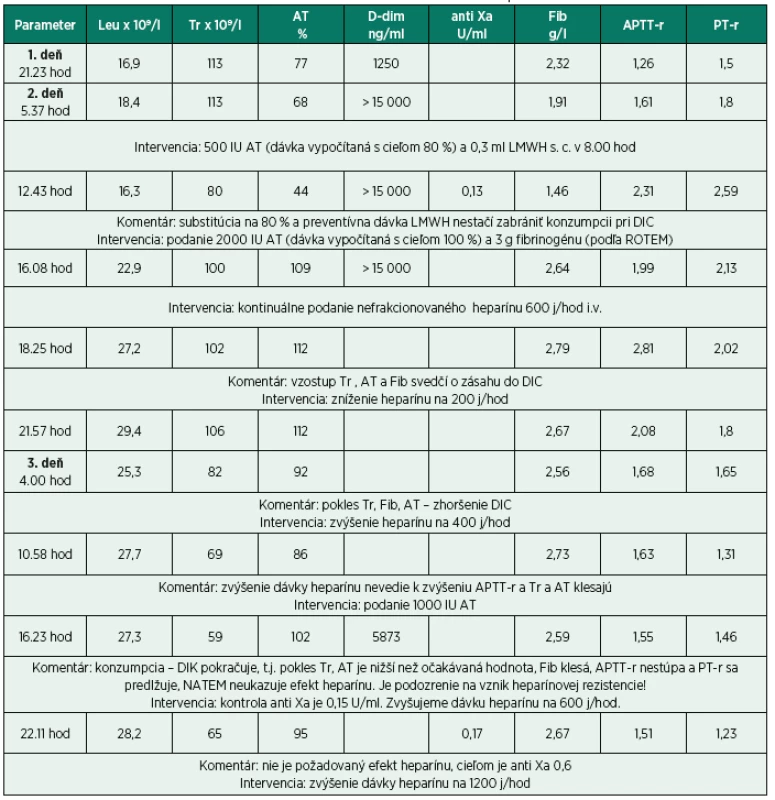

Legenda k tabuľke: Leu – leukocyty, Tr – trombocyty, AT – antitrombín, D-dim – D-diméry, APTT-r – aktivovaný parciálny tromboplastinový čas-ratio (pomer), PT-r – protrombínový čas-ratio (pomer) DISKUSIA
Na tomto prípade chceme poukázať na to, že septická koagulopatia v zmysle konzumpcie zrážacích faktorov a teda rozvoj diseminovanej intravaskulárnej koagulopatie môže byť úspešne liečená kombináciou antitrombínu a heparínu, a to bez krvácavých komplikácií. Podmienkou je, že sa s terapiou musí začať v počiatočnom štádiu, v tzv. non-overt DIK, a terapia musí byť dostatočne intenzívna.
Zaujímavých je niekoľko momentov:
- Anemizácia v zmysle poklesu Hb – tento jav si vysvetľujeme pravdepodobnou hemolýzou, o čom svedčí voľný hemoglobín v moči, vyššia hladina bilirubínu a laktátdehydrogenázy. Zaujímavé je, že Hb po podaní 2 000 IU AT znovu stúpa, čo nevieme dobre vysvetliť, a rovnako stúpli aj trombocyty. Podobný fenomén sme už popisovali v minulej kazuistike (neseptická DIK) [5]. Pravdepodobne došlo k prerušeniu zvýšenej konzumpcie trombocytov a zastaveniu hemolýzy.
- Substitúcia antitrombínu s cieľom dolnej hranice normy (vypočítaná dávka s cieľom 80–85 %) nebola efektívna v terapii DIK a rovnako ani dávka LMWH 0,3 ml s.c. Zdá sa, že v tomto prípade sa hladina antitrombínu musí pohybovať okolo 100 %, aby došlo k zastaveniu DIK (tab. 1. deň 16.08 hod) a nad 90 %, aby bol heparín účinný (4. deň 23.05 hod).
- NATEM môže byť použitý na monitorovanie efektu heparínu a rovnako na detekciu heparínovej rezistencie (viď obr. 1). Parameter APTT je bežne používaný v praxi k monitorovaniu účinku heparínu, ale v praxi často nedochádza k očakávanému predĺženiu i napriek jeho vysokým intravenóznym dávkam. Dôvodom môže byť vznik heparínovej rezistencie spôsobenej napr. vysokou hladinou FVIII (ktorý falošne skráti APTT) alebo prítomnosť proteínov akútnej fázy, ktoré súťažia o väzbu na heparín, napr. vitronectin, na histidin bohatý glykoprotein a PF4 [6].
V našej situácii išlo o druhý prípad, keďže hladina FVIII bola v tom čase 95% a zápal bol veľmi silný, o čom svedčia leukocyty s hodnotou nad 27 x 109/l. V našom prípade sme k nastaveniu hladiny heparínu používali anti Xa (zlatý štandard k monitorovaniu účinnosti heparínu, keďže APTT je ovplyvnené mnohými faktormi napr. deficit FXII, vysoká hladina FVIII... ) s cieľom dolnej terapeutickej hranice 0,5–0,6 [7]. K dosiahnutiu tejto hladiny boli potrebné dávky heparínu 1 200 j/hod po celú dobu sepsy (6 dní) a až pri normálnej hladine leukocytov bolo možné prejsť na LMWH. - V prípade heparínovej rezistencie je výhodné monitorovať účinnosť heparínu pomocou anti Xa s cieľom dolnej hranice terapeutickej dávky, t.j. 0,5–0,6 bez ohľadu na APT T-r. (viď tab. 1). Táto hladina bola nutná k zastaveniu DIK (za podmienky hladiny AT nad 90 %) – viď tab. 1, pretože len čo došlo k poklesu anti Xa pod túto hodnotu, DIK pokračoval.
Vyššie opísané postrehy a fakty môžu vysvetľovať nejednotnosť odborných spoločností na postavenie antitrombínu a heparínu v liečbe DIK. Avšak náš prípad je dôkazom toho, že vychádzajúc z patofyziológie DIK, aj kombinácia antitrombínu a heparínu v terapii DIK môže byť bezpečná a veľmi efektívna.
Minimálnym limitom tejto kazuistiky je fakt, že pacientke boli aplikované počas celého obdobia terapie 2 jednotky ČMP, ktoré boli podané 2. deň terapie vo večerných hodinách, avšak bez zjavného vplyvu na koagulačné testy.
Záverom by sme chceli povedať, že k zastaveniu rozvoja septickej diseminovanej koagulopatie je možné použiť kombináciu terapie antitrombínu a heparínu bez krvácavých komplikácii. Pre vysoké riziko prítomnosti heparínovej rezistencie u septického stavu je vhodné monitorovať hladinu heparínu pomocou anti Xa s cieľom 0,5–0,6 a udržovať hladinu antitrombínu nad 90 %.
Poďakovanie
Podporené projektom (Ministerstva zdravotníctva) koncepčného rozvoja výskumnej organizácie 00064203 (FN MOTOL) a Grantovou Agentúrou Univerzity Karlovy 1318514.
Autoři prohlašují, že nemají střet zájmů.
Do redakce došlo dne 28. 7. 2016.
Do tisku přijato dne 16. 9. 2016.
Adresa pro korespondenci:
MUDr. Miroslav Durila, Ph.D.
Klinika anesteziologie, resuscitace a intenzivní medicíny, 2. LF UK a FN Motol,
Praha
V Úvalu 84
150 06 Praha 5
e-mail: miroslav.durila@fnmotol.cz
Zdroje
1. Levi, M., Toh, C. H., Thachil, J., Watson, H. G. Guidelines for the diagnosis and management of disseminated intravascular coagulation. British Committee for Standards in Haematology. Br. J. Haematol., 2009, 145, p. 24–33.
2. Wada, H., Asakura, H., Okamoto, K. et al. Expert consensus for the treatment of disseminated intravascular coagulation in Japan. Thromb. Res., 2010, 125, p. 6–11.
3. Warren, B. L., Eid, A., Singer, P. et al. Caring for the critically ill patient. High-dose antithrombin III in severe sepsis: a randomized controlled trial. JAMA, 2001, 286, p. 1869–1878.
4. Kienast, J., Juers, M., Wiedermann, C. J. et al. Treatment effects of high-dose antithrombin without concomitant heparin in patients with severe sepsis with or without disseminated intravascular coagulation. J. Thromb. Haemost., 2006, 4, p. 90–97.
5. Durila, M., Teslík, L., Astraverkhava, M., Vymazal, T. Úloha tromboelastometrie a antitrombínu v manažmente počínajúcej diseminovanej intravaskulárnej koagulopatie po peripartálnej hysterektómii. Anest. Intenziv. Med., 2016, 27, 2, p. 75–77.
6. Pecka, M. Laboratorní monitorování antikoagulační léčby. Doporučení pro klinickou praxi. Vydáno 16.3.2006 u příležitosti konání XII. Pařízkových dní. Dostupné na www: http://www.thrombosis.cz/sources/Guidelines-Monitoring_antikoagulace_STH_III062.pdf
7. Hirsh, J., Raschke, R. Heparin and low-molecular-weight heparin: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest, 2004, 126, p. 188–203.
Štítky
Anestéziológia a resuscitácia Intenzívna medicína
Článek ZAJÍMAVOSTI, TIPY A TRIKYČlánek Jmenný a věcný rejstřík
Článok vyšiel v časopiseAnesteziologie a intenzivní medicína
Najčítanejšie tento týždeň
2016 Číslo 6- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Metamizol v liečbe pooperačnej bolesti u opioid-tolerantnej pacientky – kazuistika
- e-Konzilium.cz — Masivní plicní embolie při tromboembolické nemoci
- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
-
Všetky články tohto čísla
- Monitorování hloubky celkové anestezie
- Manažment septickej diseminovanej intravaskulárnej koagulopatie pomocou antitrombínu a heparínu a význam tromboelastometrie v diagnostike heparínovej rezistencie
- Blokáda druhé a třetí větve trigeminu s ultrazvukovou asistencí u geriatrických pacientů
- Regionální anestezie a léky ovlivňující hemokoagulaci – co přináší nejnovější doporučení?
- Preventivní imobilizace krční páteře v přednemocniční neodkladné péči o pacienty s úrazem: aktuální pohled na problematiku
- Trombofilní stavy v těhotenství
- Kritická obstrukce dýchacích cest způsobená masou v mediastinu během celkové anestezie řešená pomocí ECMO a tracheobronchiálního stentu
- Statistika v biomedicínském výzkumu I
-
ATESTAČNÍ OTÁZKY OBORU ANESTEZIOLOGIE A INTENZIVNÍ MEDICÍNA
Péče o pacienta po anestezii - Linezolid, inhibice monoaminoxidázy a klinické konsekvence
- Doporučení pro péči u traumatického poranění mozku, 4. vydání
-
Docent MUDr. Václav Fessl, CSc.
(1932–2016) - ZAJÍMAVOSTI, TIPY A TRIKY
- Jmenný a věcný rejstřík
- Anesteziologie a intenzivní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Monitorování hloubky celkové anestezie
- Trombofilní stavy v těhotenství
- Regionální anestezie a léky ovlivňující hemokoagulaci – co přináší nejnovější doporučení?
- Preventivní imobilizace krční páteře v přednemocniční neodkladné péči o pacienty s úrazem: aktuální pohled na problematiku
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



