Jak správně podávat inhalační anestetika
How to administer inhaled anesthetics correctly
In this review article anaesthesia with low-flow and minimal-flow of fresh gases is defined, its advantages and disadvantages, indications, contraindications and monitoring requirements are presented. Techniques with variable or fixed fresh gas flow and vaporizer settings, anaesthesia maintenance, increasing or decreasing the depth of anaesthesia and its reversal including the technique of coasting are described.
Keywords:
low-flow anaesthesia – sevoflurane – desflurane
Autori:
M. Horáček
Pôsobisko autorov:
Klinika anesteziologie, resuscitace a intenzivní medicíny 2. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice v Motole a Katedra anesteziologie a intenzivní medicíny Institutu postgraduálního vzdělávání ve zdravotnictví, Praha
Vyšlo v časopise:
Anest. intenziv. Med., 31, 2020, č. Supplementum A, s. 26-31
Súhrn
V přehledném článku je uvedena definice anestezie s nízkým/minimálním příkonem čerstvých plynů, jsou představeny její výhody a nevýhody, indikace a kontraindikace, požadavky na monitorování. Jsou popsány techniky s proměnlivým a s pevným nastavením příkonu čerstvých plynů a odpařovače, vedení anestezie, prohloubení či změlčení její hloubky a ukončení anestezie včetně techniky přistávání („coasting“).
Klíčová slova:
anestezie s nízkým příkonem čerstvých plynů – sevofluran – desfluran
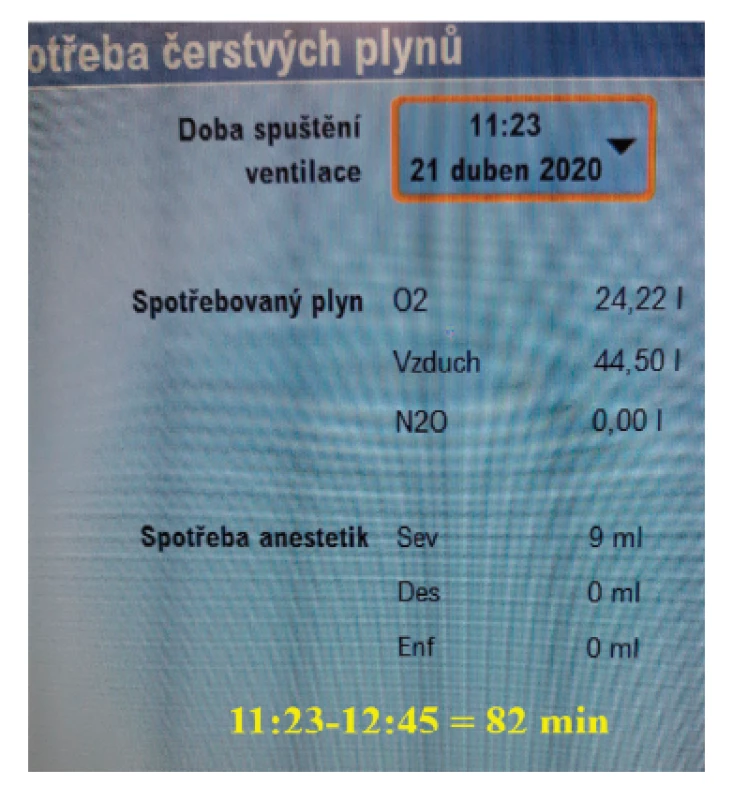
„Musíme šetřit“, vyhlásili premiér Babiš a ministryně financí Schillerová při přípravě státního rozpočtu již v roce 2019,* dlouho před současnými schodky. Platí to i ve zdravotnictví, nepochybně je třeba rozumně alokovat vzácné zdroje. Chcete-li vědět, jak spotřebovat jen 10 ml sevofluranu za hodinu anestezie (obr. 1), vysvětlí Vám to tento článek.
V posledním desetiletí se v ČR každoročně podává asi 825 000 anestezií. Podle údajů získaných v průzkumu Czech Anesthesia Day 2010 (1. 6. 2010 7–24 hod, podle odhadu hlášeno asi 75 % všech anestezií podaných ten den) se u asi 80 % pacientů používá celková anestezie. Naprosto převažuje doplňovaná anestezie s nitrožilním úvodem propofolem a opioidy, případně se svalovými relaxancii (60 %),1 která se následně vede inhalačními anestetiky. Inhalační anestetika tedy každý rok dostane více než 600 000 lidí. Je proto nutné podávat je z klinických, ekonomických i ekologických důvodů správně. V roce 2020 to znamená, jak bude dále vysvětleno, technikou anestezie s nízkým nebo s minimálním příkonem čerstvých plynů (FGF, Fresh Gas Flow), není-li kontraindikace. K dispozici jsou v současnosti jen dvě látky, sevofluran a desfluran, případně oxid dusný, kdežto dříve hojně používaný isofluran již není běžně dostupný.
Současná filosofie celkové doplňované anestezie
Celková doplňovaná anestezie má čtyři složky (hypnóza, resp. amnezie, antinocicepce, svalová relaxace a imobilizace). Hypnotický účinek celkových inhalačních anestetik je vyvolán jejich působením na mozek, imobilizace též jejich účinkem na míchu. Hypnotický účinek je potencován sedativním účinkem opioidů. Jejich spotřebu však ovlivňují nejenom celková anestetika, ale i svalová relaxancia, jsou-li pro výkon potřebná. Dostatečná antinocicepce a případně i dostatečná svalová relaxace zase naopak snižují potřebu celkových anestetik. Jednotlivé složky anestezie tedy nejsou na sobě zcela nezávislé, jak se soudilo dříve, nýbrž všechny na sebe vzájemně působí.
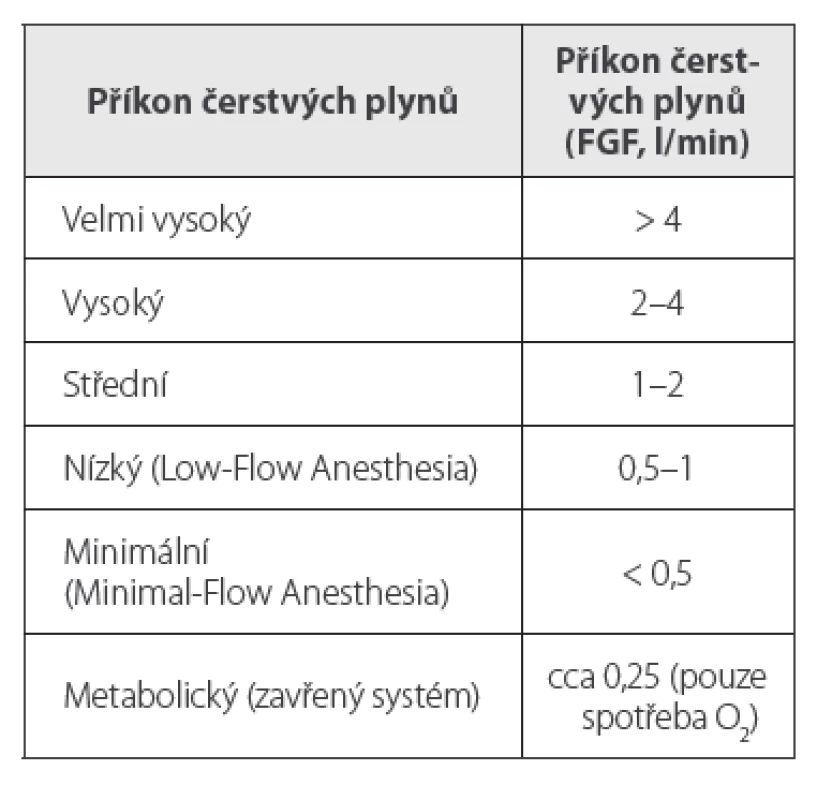
Definice anestezie s nízkým/ minimálním příkonem čerstvých plynů
Anestezie s nízkým FGF, čili low-flow anestezie (LFA) je podle Baxtera jednoduše definována jako technika, při níž je FGF do anesteziologického systému ≤ 1 l/min, minimal-flow anestezie (MFA) jako FGF ≤ 0,5 l/min.2 Podle Bauma je low-flow anestezie technika, při níž je míra zpětného vdechování vydechovaného plynu ≥ 50 % (tab. 1).3 Míru zpětného vdechování lze vypočítat podle vzorce (1 – FGF/MV) * 100 (%), kde MV je minutová ventilace.3
Výhody anestezie s nízkým/ minimálním příkonem čerstvých plynů jsou klinické, ekonomické a ekologické
• Klinické výhody: Vdechování ohřáté a zvlhčené směsi plynů je žádoucí pro prevenci poruch funkce řasinkového epitelu, zejména u dlouhých výkonů, což přispívá ke snížení rizika plicních komplikací. Ztráty tepla a vlhkosti z dýchacích cest pacienta a z anesteziologického systému se snižují se zvyšující se mírou zpětného vdechování. Ohřívání a zvlhčování vdechované směsi plynů napomáhá i reakce pohlcování CO2 v náplni absorbéru, při níž se uvolňuje teplo a voda.
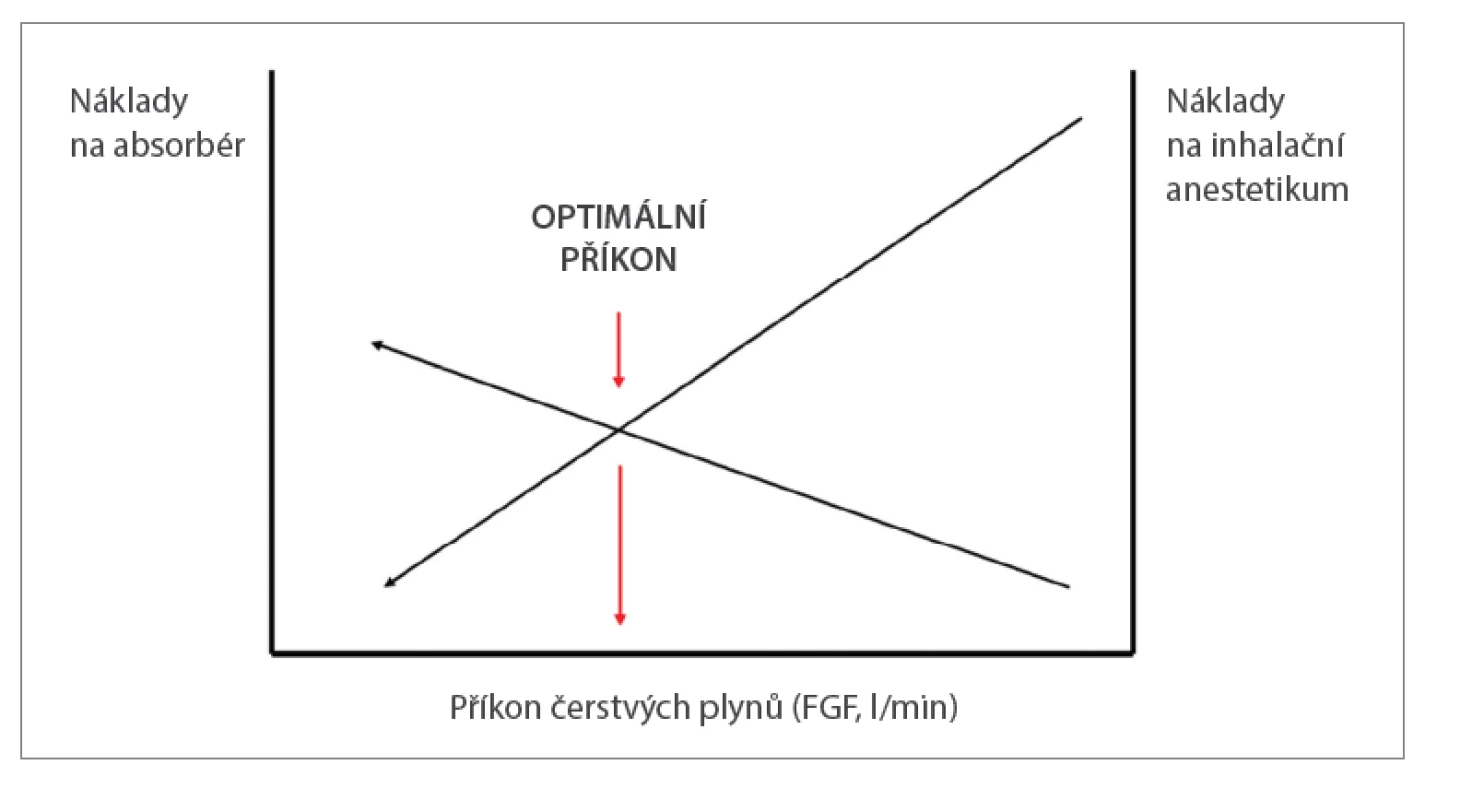
• Ekonomické výhody: Vysoká míra zpětného vdechování snižuje spotřebu anesteziologických plynů a inhalačních anestetik. Inhalační anestetika se podávají v gramových dávkách, metabolizují se však jen málo (sevofluran 2–5 %, desfluran 0,02 % podané dávky), takže vydechnutá lze znovu přivádět pacientovi. Zpětné vdechování vydechované směsi plynů však zvyšuje zátěž pohlcovače (absorbéru), protože vydechovaný CO2 vznikající v metabolismu je třeba ze systému účinně odstraňovat, aby nedocházelo k jeho hromadění a k rozvoji respirační acidózy. Podle místních podmínek (cena anesteziologických plynů, O2, vzduchu či N2O, a inhalačních anestetik na jedné Obr. 1. Příklad skutečné spotřeby anesteziologických plynů při endarterektomii a plastice stehenní tepny u 76letého muže tělesné hmotnosti 82 kg (BMI 27). straně a náplně nebo kazety pohlcovače na druhé straně) tudíž na každém pracovišti existuje jeden ekonomicky optimální příkon čerstvých plynů (obr. 2).4 Studie však ukazují, že při používání sevofluranu a desfluranu klesají se snižujícím se FGF náklady více, než rostou náklady na pohlcovač.
• Ekologické výhody: Jsou důležité jak pro jednotlivé pacienty („klimatizace“ vdechovaných plynů), tak pro ovzduší operačního sálu i pro atmosféru celé Země. Vyšší míra zpětného vdechování znamená nižší znečištění atmosféry operačních sálů, zejména v místech, kde doposud stále není k dispozici centrální odsávání přebytků anesteziologických plynů (např. rentgenová pracoviště). Vysokým zpětným vdechováním se pochopitelně snižuje i znečištění atmosféry Země, do níž systémy odsávání anesteziologických plynů na sálech jejich přebytky vypouštějí. Zdravotnictví jako celek přispívá ke znečištění atmosféry asi 5–10 %, je pátým největším emitentem skleníkových plynů,5 tj. plynů, které v atmosféře absorbují infračervené záření a tím ohřívají planetu. Kromě jiných k nim patří i CO2, N2O a inhalační anestetika. Nižší spotřeba anesteziologických plynů tedy snižuje nejen skleníkový efekt (tabulka 2)6, ale i destrukci ozonové vrstvy účinkem N2O i starších halogenovaných inhalačních anestetik (halotan, enfluran, isofluran).7
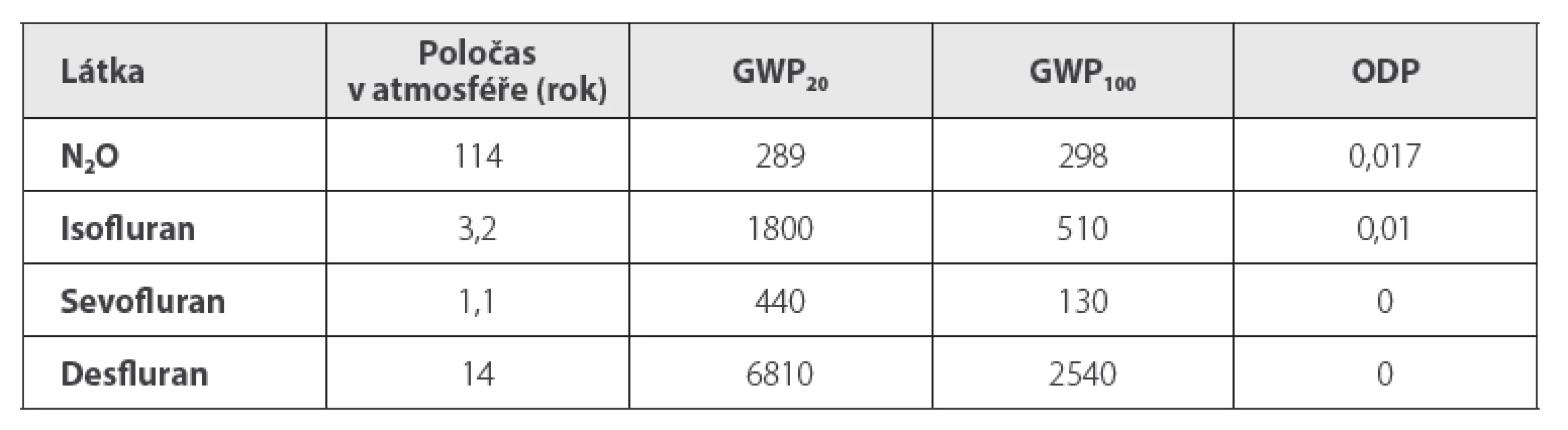
ODP = Ozone Depletion Potential čili potenciál poškození
ozónové vrstvy je definován jako poměr globální
ztráty ozonu v důsledku dané látky ke globální
ztrátě ozonu v důsledku účinku freonu CFC-11 (trichlorfluormetan)
stejné hmotnosti.22
Z hlediska poluce atmosféry je ideální regionální anestezie. Atmosféru přímo neovlivňuje ani totální intravenózní anestezie (TIVA). Při ní však zbývá větší množství nespotřebovaných anestetik než při inhalační anestezii. Jejich nemetabolizované zbytky mohou kontaminovat životní prostředí a jsou toxické pro život ve vodě. TIVA produkuje i více plastových odpadů (injekční stříkačky), a to znamená více CO2.8 Rovněž je náročnější na vybavení (dávkovače).
Nevýhody anestezie s nízkým/minimálním příkonem čerstvých plynů
Za zásadní nevýhodu LFA/MFA většina anesteziologů považuje nedostatek kontroly složení vdechované směsi plynů. Čím nižší je FGF, tím větší jsou rozdíly mezi nastavenými a skutečně vdechovanými koncentracemi plynů a inhalačního anestetika. Při nízkém FGF se více projevuje variabilita mezi pacienty ve spotřebě O2, produkci CO2 a v pohlcování anestetika. Rozdíl mezi nastavenými a vdechovanými koncentracemi anesteziologických plynů zvyšuje nároky při vedení anestezie. Techniky LFA/MFA proto v současnosti bezpodmínečně vyžadují monitorování analyzátorem anesteziologických plynů a vhodně nastavené hodnoty alarmů.
Za další nevýhodu LFA/MFA považují někteří horší řiditelnost anestezie kvůli dlouhé časové konstantě τ. Ta charakterizuje dobu ekvilibrace, během níž se vyrovnají nastavené přiváděné koncentrace čerstvých plynů a anestetika (FGF) s koncentracemi v anesteziologickém systému, které vdechuje pacient. Složení směsi se totiž po změně nastavení nemění lineárně, nýbrž exponenciálně, zpočátku rychle, pak stále pomaleji. Po uplynutí jedné časové konstanty dosáhne koncentrace plynu či anestetika v systému 63 % nastavených hodnot, po uplynutí dalších časových konstant pak postupně 86,5 %, 95 %, 98 % a 99 %. Časová konstanta je přímo úměrná objemu systému (tj. hadic, pohlcovače a vaku, u okruhu pro dospělé obvykle 6 l), zanedbá-li se funkční reziduální kapacita pacienta, a nepřímo úměrná FGF (při konstantním pohlcování plynů a anestetika, Conwayova rovnice, viz rámeček). Záleží na ní rychlost nasycování (wash-in) a vyplavování (wash-out) anestetika z organismu pacienta i rychlost změn hloubky anestezie. Např. při FGF 6 l/min a objemu systému 6 l je τ 1 min, 99% ekvilibrace se tedy dosáhne za 5 min, kdežto při FGF 0,5 l/min je τ 12 min a 99% ekvilibrace se dosáhne za 36 min! Pro rychlejší ekvilibraci je nutné zvýšit FGF, nebo nastavenou koncentraci anestetika. Riziko předávkování lze snížit vhodně nastavenou hodnotou alarmu vdechované koncentrace.
K dalším nevýhodám patří rizika hypoxie při nevhodně nastavené frakci vdechovaného kyslíku (FiO2), hypoventilace při netěsnostech v systému, možnost hromadění cizích plynů jako oxidu uhelnatého, metanu, alkoholu, acetonu, sloučenin vzniklých případnou degradací inhalačních anestetik v pohlcovači.
Kdy používat anestezii s nízkým/minimálním příkonem čerstvých plynů?
Podle současných názorů by se tyto techniky měly používat z klinických, ekonomických i ekologických důvodů vždy, je-li dostupné vybavení a nejsou-li přítomny kontraindikace. Dostupné vybavení znamená mít vhodný anesteziologický přístroj s přesnými rotametry (klasickými či elektronickými), s výkonným a přesným odpařovačem (ideálně umožňujícím nastavit dodávanou koncentraci inhalačního anestetika v krocích po 0,1 %) nebo injektorem inhalačních anestetik a těsný systém (únik < 150 ml/min při tlaku 30 cm H2O).9 Nezbytný je analyzátor anesteziologických plynů (O2, N2O, inhalační anestetika), u něhož je třeba vědět, jaký objem plynů přístroj odebírá k měření koncentrací a zda tento objem vrací, či nevrací zpět do systému. Pulsní oxymetr a kapnometr patří do základního monitorování všech pacientů v anestezii, výhodou je monitor hloubky anestezie. Je etickým závazkem všech anesteziologů minimalizovat škodlivé dopady anesteziologické praxe na udržitelné životní prostředí.10
Kdy nepoužívat anestezii s nízkým/minimálním příkonem čerstvých plynů – kontraindikace?
Techniky LFA/MFA jsou kontraindikovány při nedostupnosti vhodného vybavení, při neznalosti a existuje-li možnost hromadění dalších plynů v systému. Z nich nejdůležitěj-ší v praxi je oxid uhelnatý, který může vznikat v pohlcovačích CO2 s vyschlou náplní, proto je doporučeno měnit pohlcovače v pondělí ráno. CO se rovněž uvolňuje při rozpadu hemoglobinu, např. v důsledku hemolýzy, nebezpečí může existovat i při masivních transfuzích. Dalším plynem je metan, který vzniká ve střevě, páry alkoholu při opilosti, aceton při diabetické ketoacidóze.
Ručně, nebo automatizovaně?
Techniky LFA/MFA lze používat nejenom na nejmodernějších a špičkových anesteziologických přístrojích, ale i na těch méně vybavených. U nich je nutné nastavovat FGF a dodávanou koncentraci anestetika ručně, což vyžaduje pochopení principů technik LFA/MFA a znalost farmakokinetiky inhalačních anestetik. Nicméně moderní inhalační anestetika s nízkou rozpustností v krvi a v tkáních (rozdělovací koeficienty krev/plyn, krev/tkáň) vyžadují jen málo úprav nastavení odpařovače. Nejmodernější anesteziologické přístroje vyšších tříd využívají metody automatizovaného řízení plynů (Automated Gas Control), takže potřebují nastavit jen cílovou koncentraci vdechovaného kyslíku (FiO2) a cílovou koncentraci inhalačního anestetika na konci výdechu (FeA), přičemž velikost FGF řídí přístroj zcela sám. Tyto systémy vedou k vyššímu využívání technik LFA/MFA, snížení nákladů a zátěže pro životní prostředí.11
Jaký nosný plyn používat při anestezii s nízkým/minimálním příkonem plynů?
Jako nosný plyn lze používat buď směs kyslíku se vzduchem, nebo směs kyslíku s oxidem dusným. Podávání směsi kyslíku a vzduchu je jednodušší zejména proto, že není nutné zabývat se denitrogenací či úbytkem plynu v systému v důsledku rychlého pohlcování N2O na začátku anestezie. Naopak k výhodám N2O patří nízký rozdělovací koeficient krev/plyn (0,47), který umožňuje rychlý nástup a rychlé odeznění účinku. Zařazení N2O na pouze konci výkonu může urychlit probouzení, jenže nutnost rychlého nasycení vyžaduje zvýšit FGF, což zvyšuje spotřebu plynů a cenu anestezie. N2O má rovněž analgetický účinek, snižuje potřebné dávky ostatních anestetik, snad pomáhá stabilizovat krevní tlak. K jeho nevýhodám patří riziko nevolnosti a zvracení při delších výkonech a možnost difuzní hypoxie na konci výkonu. Je nutné pamatovat, že je to skleníkový plyn, takže podle nejnovějších názorů (2020) je lépe ho nepoužívat a vyhradit si ho jen pro zvláštní indikace,5 ačkoliv Evropská anesteziologická společnost (ESA) byla ještě nedávno (2015) názoru, že „není důvod N2O nepoužívat, není-li specificky kontraindikován.“12
Technika anestezie s nízkým/ minimálním příkonem plynů
Nejmenší bezpečný FGF přivádí dostatek kyslíku odpovídající jeho spotřebě pacientem (alespoň 250 ml/min) a další objem rovnající se pohlcování anestetika v organismu paci enta a velikosti ztrát plynu v důsledku úniků ze systému a/nebo z analyzátoru anesteziologických plynů.
Spotřebu anesteziologických plynů nejvíce ovlivňuje tzv. nasycovací fáze (wash-in), během níž je potřeba do organismu přivést dostatek inhalačního anestetika. Mírou pohlcování plynů a anestetika v organismu popisují rovnice uvedené v rámečku. Doposud byla publikována celá řada různých technik, jak nasycení zajistit v co nejkratší době. Lze je rozdělit na techniky s proměnlivým, nebo s pevným nastavením FGF a odpařovače.
Při využití technik s proměnlivým nastavením se okamžik přechodu z vysokého FGF na nízký či minimální řídí trváním doby, která uplynula od začátku podávání (20, 15 či 10 min), nebo okamžikem ekvilibrace (hodnota MACage = 0,8, resp. poměr vydechované k vdechované koncentraci anestetika Fet/Fi = 0,8). Je třeba nezapomenout, že mezi dosažením dostatečného parciálního tlaku inhalačního anestetika ve výdechu a hodnotou parciálního tlaku inhalačního anestetika v CNS (na místě účinku) je určitá prodleva, která záleží na velikosti průtoku krve mozkem a na rozpustnosti inhalačního anestetika v mozku (rozdělovací koeficient krev/mozek u N2O 0,49, u desfluranu 0,55, u sevofluranu 1,1). Tato prodleva činí asi 2,5 minuty u sevofluranu, 1,1 minuty u desfluranu.
Techniky s pevným nastavením jsou jednodušší a v současnosti se jim dává přednost, protože u dospělých se úvod do anestezie provádí obvykle nitrožilně a protože moderní, málo rozpustná inhalační anestetika (rozdělovací koeficienty krev/plyn: sevofluran 0,65, resp. desfluran 0,42) umožňují dostatečné nasycení organismu pacienta dostatečně rychle i při nízkém FGF. Zabrání se tím tzv. „údolí bez anestezie“ (obr. 3), tj. možnému znovunabytí vědomí pacienta v období, kdy mohl účinek látek podaných při úvodu odeznít a účinek inhalačního anestetika ještě nestačil nastoupit.
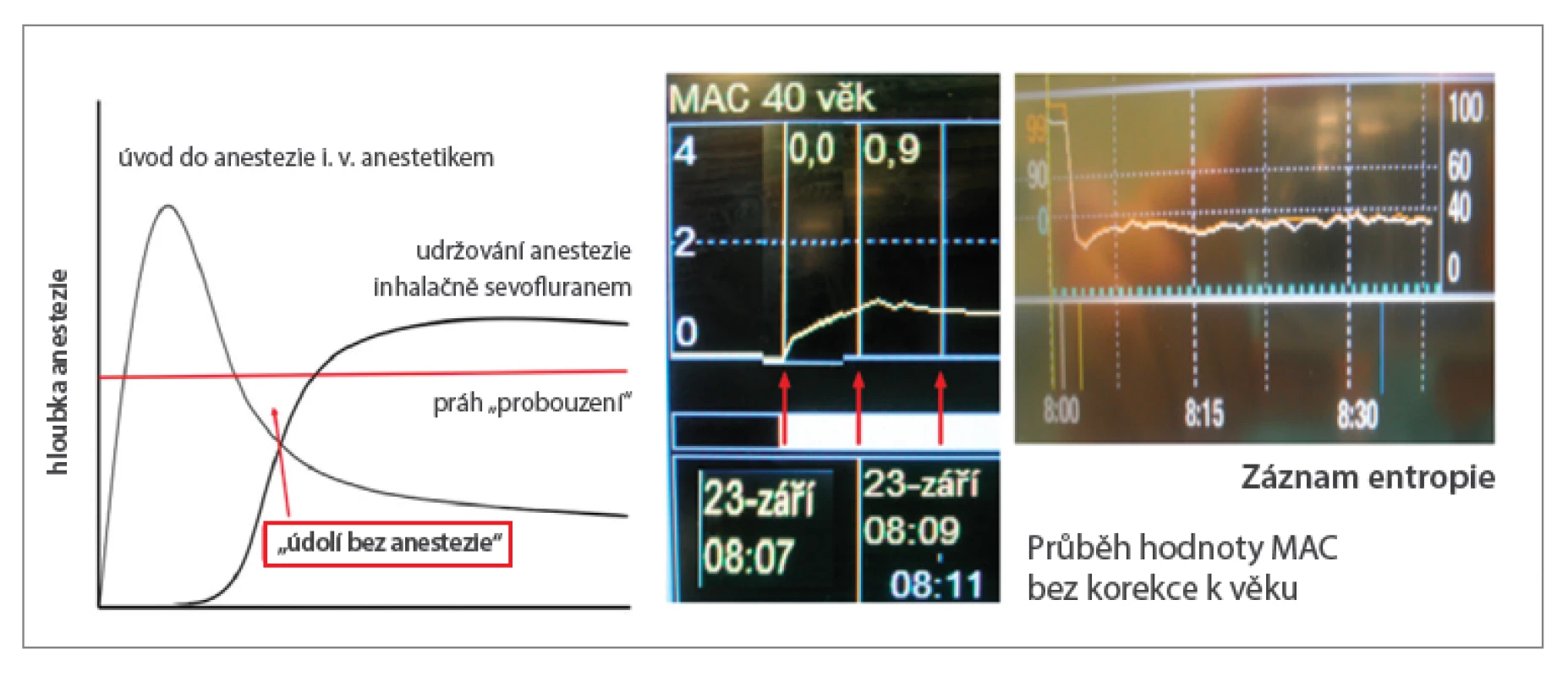
Techniky s pevným nastavením FGF a odpařovače při použití sevofluranu lze charakterizovat většinou jako 1-1-8, tzn. od začátku se přivádí kyslík 1 l/min + vzduch, nebo N2O 1 l/min a odpařovač se nastaví na 8 %. Při tomto schématu se dosáhne alveolární koncentrace sevofluranu 2 % (= 1 MAC, minimální alveolární koncentrace bránící pohybové reakci na kožní řez u 50 % pacientů) za 2 minuty, a to se vzduchem stejně rychle jako s N2O (tabulka 3).14 Pro aplikaci desfluranu existuje podobné schéma 1-1-12, při němž se 6% koncentrace v alveolech (1 MAC) docílí za 4 minuty (tabulka 3).15 Respektuje se přitom pravidlo 24, tzn. že součin FGF a koncentrace desfluranu nastavené na odpařovači nemá překročit hodnotu 24.
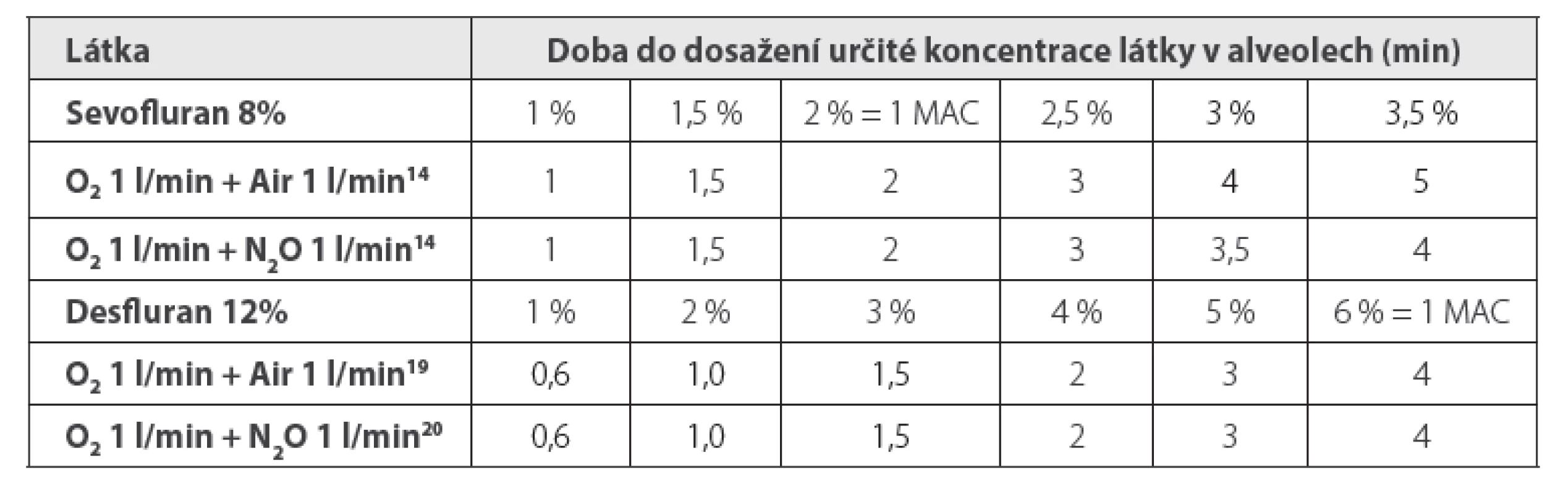
Nicméně, parciálního tlaku inhalačního anestetika v alveolech odpovídajícího hodnotě 1 MAC korigované podle věku (MACage) lze totiž u sevofluranu dosáhnout dostatečně rychle i s FGF jen 1 l/min, a to za 6,2 ± 1,3 minuty při nastavení odpařovače na 6 % (tj. 3× MAC), u desfluranu za 3,7 ± 0,7 minuty při nastavení odpařovače na 18 % (tj. 3× MAC).13 Hodnotu MAC nutnou k zajištění dostatečné hloubky anestezie, nehybnosti v průběhu výkonu a oběhové stability lze navíc ještě snížit opioidy, současnou svodnou anestezií, případně přidáním N2O.
Jakou konkrétní techniku požívám já? Modifikovanou techniku s pevným nastavením odpařovače podle Horwitz(ové) a Jakobssona. 13
• Preoxygenace pacienta podle potřeby. Intravenózní úvod obvyklým způsobem v kombinaci i. v. anestetika a opioidu, případně svalového relaxancia, po úvodu umělá ventilace pacienta vakem rukou podle potřeby.
• Před zavedením laryngeální masky nebo intubací vypnout přívod čerstvých plynů, ale ponechat zapnutý odpařovač, pokud byl těsně po úvodu používán. Tento postup zamezí úniku inhalačního anestetika z dýchacího systému anesteziologického přístroje do ovzduší sálu a snižuje spotřebu inhalačního anestetika. Pokud by se vypnul naopak odpařovač a ponechal se FGF, došlo by k vypláchnutí inhalačního anestetika ze systému do ovzduší sálu a ke zvýšení spotřeby. Po zajištění průchodnosti dýchacích cest zase zapnout FGF a ověřit funkčnost pomůcek ventilací rukou vakem. Nastavit FGF na 1, nebo 0,5 l/min podle toho, za jak dlouho může začít operace.
• Přepnout na umělou ventilaci plic ventilátorem a podle potřeby nastavit ventilační parametry (režim, dechový objem nebo inspirační tlak, frekvenci, Peep). FiO2 nastavit v závislosti na příkonu čerstvých plynů, FGF 1 l/min vyžaduje FiO2 ≥ 40 %, FGF 0,5 l/min ≥ 50 %. Odpařovač nastavit na hodnotu 3× MAC, tj. u sevofluranu ≥ 6 %, u desfluranu 18 %. Zkontrolovat dosahovaný tlak při objemové ventilaci, resp. dechový objem při tlakové ventilaci, posoudit křivky průtoku a tlaku (distenze, atelektáza, úplnost výdechu).
• Nastavit hodnotu MAC korigovanou podle věku pacienta (MACage). Nastavit alarmové hodnoty, tj. alarm nejnižší koncentrace kyslíku ve vdechované směsi na 30 %, alarm nejvyšší vdechované koncentrace inhalačního anestetika u sevofluranu na 3–3,5 %, u desfluranu na 8 %, aby se předešlo příliš hluboké anestezii. Po dosažení hodnoty MACage 0,7–0,8 postupně snižovat koncentraci inhalačního anestetika na odpařovači, počítat přitom s prodlevou mezi hodnotou MAC v plících a hodnotou v mozku, případně pak snížit FGF na 0,5 l/min, na můj obvyklý příkon plynů v průběhu anestezie. Koncentraci na odpařovači upravovat podle potřeby, aby se hodnota MACage udržovala v rozmezí 0,6–1,0.
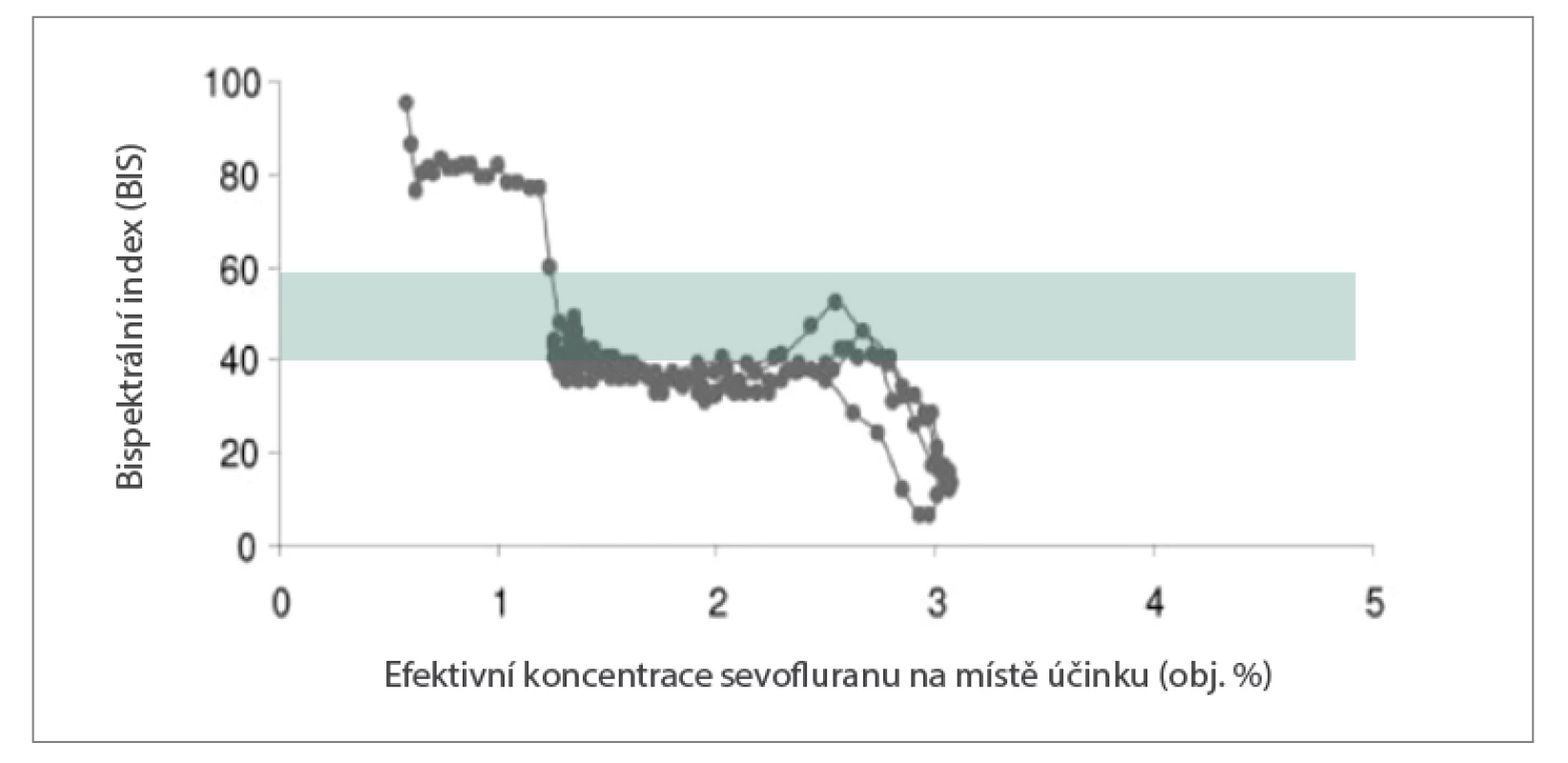
• Hloubka anestezie se nejlépe posuzuje prostřednictvím monitorování EEG. Na rozdíl od MACage, což je vlastně populační hodnota (viz definice MAC), EEG ukazuje reakci mozku jednotlivého pacienta na látky podávané v anestezii (obr. 4) (vliv na EEG mají nejenom celková anestetika, ale i opioidy a svalová relaxancia!). Je nutné posuzovat nejenom index hloubky anstezie (BIS, entropie, PSI Patient State Index aj.), ale alespoň orientačně i „syrové“ křivky EEG (burst supression). Intenzita nocicepce, resp. antinocicepce se hodnotí jako obvykle klinicky, lze využít i další markery z EEG, monitorování SPI (Surgical Pleth Index) z pulsní oxymetrie, pupilometrii, nebo změnu compliance dýchacího systému měřenou ventilátorem („pacient se při bolesti zatíná“).

VN2O = pohlcování N2O [ml/min], t = doba od začátku
anestezie
Časová konstanta τ = objem systému (VS) děleno
rozdílem mezi dodávaným (VD) a pohlcovaným
množstvím anestetika (VU)
VAn = pohlcování inhalačního anestetika [ml/min],
f × MAC = požadovaná vydechovaná koncentrace
anestetika jako funkce minimální alveolární koncentrace
zvoleného anestetika, např. 0,8xMAC, αB/G = rozdělovací
koeficient krev/plyn (blood/gas), CO = srdeční výdej
(cardiac output) [l/min], t je doba od začátku anestezie.
Monitorování v průběhu anestezie s nízkým/minimálním příkonem čerstvých plynů
Sledování a monitorování pacienta v průběhu LFA/MFA se řídí doporučením ČSARIM. Kromě základních parametrů je třeba dále věnovat pozornost těmto ukazatelům:
1. oxygenace: saturace hemoglobinu pulsním oxymetrem, nastavit příslušně práh alarmu, nikdy neohrozit pacienta hypoxií, čím nižší FGF, tím vyšší musí být vdechovaná koncentrace kyslíku!
2. ventilace: koncentrace CO2 na konci výdechu (ETCO2), nastavit příslušně prahy alarmů
3. příkon čerstvých plynů FGF
4. dostatek plynů v anesteziologickém systému podle stoupání vlnovce v okruhu
5. správná funkce pohlcovače CO2: podle vdechované koncentrace CO2 (FiCO2), musí být nižší než 0,5 kPa, jeho teplota, barva indikátoru vyčerpání, okamžik výměny se řídí především podle FiCO2
6. koncentrace kyslíku ve vdechované směsi (FiO2), nastavit práh alarmu na 0,3
7. koncentrace kyslíku ve vydechované směsi plynů (FeO2)
8. spotřeba kyslíku ((MV × (FiO2 – FeO2)) vs. dodávka (MV × FiO2)
9. koncentrace inhalačního anestetika nastavená na odpařovači
10. koncentrace inhalačního anestetika vdechovaná (FiA)
11. koncentrace inhalačního anestetika vydechovaná (FeA)
Vedení anestezie s nízkým/ minimálním příkonem čerstvých plynů – prohloubení, nebo snížení hloubky anestezie
Prohloubení inhalační anestezie při technice LFA/MFA není rychle možné vzhledem k dlouhé časové konstantě systému, která je nepřímo úměrná FGF. Vždy je však nutné uvážit, co je podnětem k prohloubení anestezie, zda nedostatečný hypnotický účinek, nebo zda je to spíše nedostatečná úroveň antinocicepce (častěji). Zasáhnout je třeba kauzálně.
Rychlé prohloubení hypnotického účinku je nejjednodušší přidáním malé dávky propofolu. Jinak lze použít techniku tzv. inhalačního bolusu, tj. přechodně zvýšit FGF a/nebo koncentraci anestetika na odpařovači, např. zvýšit FGF na 4–6 l/min, na odpařovači nastavit trojnásobek MAC (sevofluran 6 %, desfluran 18 %), ponechat po dobu 30–60 sekund, pak opět snížit FGF na původní hodnotu a odpařovač otevřít o něco více než před bolusem.16 Účinek se optimálně sleduje na monitoru hloubky anestezie, nebo podle oběhové odpovědi.
K rychlému snížení hloubky inhalační anestezie se vypne odpařovač a zvýší se příkon čerstvých plynů podle potřeby na 4–6 l/min na dobu, než se projeví žádoucí účinek.
Využití „coastingu“ („přistávání“) na konci výkonu
„Coasting“ je technika, kdy při minimálním příkonu čerstvých plynů, nejlépe při zavřeném okruhu (přívod O2 ve velikosti jeho spotřeby – úplné zpětné vdechování), se vypne přívod málo metabolizovaného inhalačního anestetika (sevofluran, desfluran), takže probíhá jeho redistribuce mezi jednotlivými tělesnými kompartmenty.17 Koncentrace inhalačního anestetika v mozku sice klesá, ale jeho eliminace ze systému je minimální, takže koncentrace v mozku může být po určitou dobu dostatečná k zajištění pokračování anestezie. Tato doba záleží na trvání anestezie, je tím delší, čím delší byla anestezie. Průběh se sleduje na analyzátoru anesteziologických plynů.
Ukončení anestezie s nízkým/minimálním příkonem čerstvých plynů
Ke konci výkonu („coasting“) se podle potřeby vypne odpařovač, na konci se zvýší příkon čerstvých plynů nad úroveň minutové ventilace, aby se předešlo zpětnému vdechování, vyprázdní se a znovu naplní vak (objem 2 l) směsí plynů bez anestetika, pacient se postupně převede na spontánní ventilaci obvyklým způsobem. Reverze účinku svalových relaxancií, pokud byla podána, případně opioidů, podle potřeby. Eliminace anestetika se sleduje na analyzátoru plynů. Ve studii Leijonhufvuda s dvěma různými anesteziologickými přístroji (Flow-i, Maquet Critical Care a Aisys GE Healthcare) a testovou plící se trvání vyplavování sevofluranu ani desfluranu váznamně nezkrátilo příkonem čerstvých plynů vyšším než 4–6 l/min.18
Zdroje
* Kopecký J: Musíme šetřit, vyhlásili Babiš a Schillerová. Navrhli propouštění úředníků. Idnes.cz, 1. 9. 2019. Dostupné z https://www.idnes.cz/zpravy/domaci/ schillerova-rozpocet-2020-statni-zamestnanci. A190201_161738_domaci_kop (poslední přístup 11. 11. 2020).
1. Černý V., Adamus M., Cvachovec K., Ševčík P., Herold I.: Anestezie v České republice 2010 – jednodenní prospektivní observační dotazníková studie. Anest. intenziv. Med 2011; 22(1): 5–12.
2. Baxter AD: Low and minimal flow inhalational anaesthesia. Can J Anaesth 1997; 44(6): 643–653.
3. Baum JA: Low-flow anesthesia: Theory, practice, technical preconditions, advantages, and foreign gas accumulation. J Anesth 1999; 13 : 166-174.
4. Hendrickx J: Getting the most out of the least. How the fraction of rebreathing defines machine, CO2 absorbent and agent use efficiency. Dostupné z http://www.navat.org/videos-2, Videos NAVAt III 2015, nebo https://www.youtube.com/ watch?v=BdBBA8B2alg&feature=emb_logo (poslední přístup 10. 11. 2020).
5. Koch S, Pecher S: Neue Herausforderungen für die Anästhesie durch den Klimawandel. Anaesthesist 2020 Jul; 69(7): 453-462. doi: 10.1007/s00101-020 - 00770-1.
6. Andersen MP, Nielsen OJ, Wallington TJ, Karpachev B, Sander S: Assessing the impact on global climate from general anesthetic gases. Anesth Analg 2012; 114(5): 1081-5. doi: 10.1213/ ANE.0b013e31824d6150.
7. Ishizawa Y: Special article: general anesthetic gases and the global environment. Anesth Analg. 2011 Jan; 112(1): 213-7. doi: 10.1213/ANE.0b013e3181fe02c2.
8. American Society of Anesthesiologists Task Force on Environmental Sustainability Committee on Equipment and Facilities. Greening the Operating Room and Perioperative Arena: Environmental Sustainability for Anesthesia Practice. October 2014. Dostupné z https:// www.asahq.org/about-asa/governance-andcommittees/ asa-committees/committee-on-equipment - and-facilities/environmental-sustainability/ greening-the-operating-room#3gas (poslední přístup 10. 11. 2020).
9. Awati MN, Gurulingappa A. Patil, Fathima A, Samudyatha TJ: Low Flow Anaesthesia. Journal of Evidence Based Medicine and Healthcare 2014; 1(9): 1150-1162.
10. Van Norman GA, Jackson S. The anesthesiologist and global climate change: an ethical obligation to act. Curr Opin Anaesthesiol. 2020 Aug; 33(4): 577-583. doi: 10.1097/ACO.0000000000000887.
11. Tay S, Weinberg L, Peyton P, Story D, Briedis J: Financial and environmental costs of manual versus automated control of end-tidal gas concentrations. Anaesth Intensive Care 2013 Jan; 41(1): 95-101. doi: 10.1177/0310057X1304100116.
12. European Society of Anaesthesiology task force on use of nitrous oxide in clinical anaesthetic practice. The current place of nitrous oxide in clinical practice: an expert opinion-based task force consensus statement of the European Society of Anaesthesiology. Eur J Anaesthesiol 2015; 32 : 517–520.
13. Horwitz M, Jakobsson JG: Desflurane and sevoflurane use during low - and minimal-flow anesthesia at fixed vaporizer settings. Minerva Anestesiol. 2016 Feb; 82(2): 180-5.
14. Tribuddharat S, Sathitkarnmanee T, Vattanasiriporn N, Thananun M, Nonlhaopol D, Somdee W: 1-1 - 8 one-step sevoflurane wash-in scheme for low-flow anesthesia: simple, rapid, and predictable induction. BMC Anesthesiol. 2020 Jan 24;20(1):23. doi: 10.1186/ s12871-020-0940-2.
15. Khetarpal R, Attri JP, Banerjee A, Verma R: Advantages of 1-1-12 Wash in Scheme during Induction with Low Flow Anesthesia with and without Nitrous Oxide. Anesth Essays Res. 2018 Apr-Jun; 12(2): 371 – 376. doi: 10.4103/aer.AER_20_18.
16. Matute E. et al. An Inhalation Bolus of Sevoflurane Versus an Intravenous Bolus of Remifentanil for Controlling Hemodynamic Responses to Surgical Stress During Major Surgery: A Prospective Randomized Trial. Anest Analg 2002; 94 : 1217-1222. doi: 10.1097/00000539-200205000-00031.
17. Hendrickx JF, De Cooman S, Van Zundert AA, Grouls RE, Mortier E, De Wolf AM.: Coasting: worth the effort? Acta Anaesthesiol Belg. 2011; 62(3): 147-50.
18. Leijonhufvud F, Jöneby F, Jakobsson JG: The impact of fresh gas flow on wash-in, wash-out time and gas consumption for sevoflurane and desflurane, comparing two anaesthesia machines, a test-lung study. F1000Res. 2017 Nov 13; 6 : 1997. doi: 10.12688/ f1000research.13064.2.
19. Sathitkarnmanee T, Tribuddharat S, Nonlhaopol D, Thananun M, Somdee W: 1-1-12 one-step wash-in scheme for desflurane low flow anesthesia: performance without nitrous oxide. Drug Des Devel Ther. 2015 Feb 17; 9 : 977-81. doi: 10.2147/DDDT.S78233.
20. Sathitkarnmanee T, Tribuddharat S, Suttinarakorn C, Nonlhaopol D, Thananun M, Somdee W, Theerapongpakdee S: 1-1-12 One-Step Wash-In Scheme for Desflurane-Nitrous Oxide Low-Flow Anesthesia: Rapid and Predictable Induction. Biomed Res Int. 2014; Article ID 867504. doi: 10.1155/2014/867504.
21. Potenciál globálního oteplování. Wikipedie. Dostupné z https://cs.wikipedia.org/wiki/Potenci% C3%A1l_glob%C3%A1ln%C3%ADho_oteplov% C3%A1n%C3%AD (poslední přístup 11. 11. 2020).
22. Potenciál poškození ozonu. Dostupné z https:// cs.qaz.wiki/wiki/Ozone_depletion_potential (poslední přístup 11. 11. 2020).
Štítky
Anestéziológia a resuscitácia Intenzívna medicínaČlánok vyšiel v časopise
Anesteziologie a intenzivní medicína

2020 Číslo Supplementum A
- Realita liečby bolesti v paliatívnej starostlivosti v Nemecku
- MUDr. Lenka Klimešová: Multiodborová vizita je kľúč k efektívnejšej perioperačnej liečbe chronickej bolesti
- Metamizol v liečbe pooperačnej bolesti u opioid-tolerantnej pacientky – kazuistika
- e-Konzilium.cz — Masivní plicní embolie při tromboembolické nemoci
- DESATORO PRE PRAX: Aktuálne odporúčanie ESPEN pre nutričný manažment u pacientov s COVID-19
Najčítanejšie v tomto čísle
- Inhalační anestetika v současné anesteziologické praxi
- Jak správně podávat inhalační anestetika
- Sevofluran
- Desfluran
