-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vzácná diagnóza: CD4⁺56⁺ leukémie z dendritických buněk typu DC2
Rare Diagnosis of CD4⁺56⁺ Leukemia from Dendritic Cells Type DC2
CD4⁺56⁺ hematodermic neoplasm or leukemia from early plasmocytoid dendritic cells type DC2 was recognized by WHO-EORTC classification of cutaneous lymphomas as a separate entity related to the plasmacytoid precursor dendritic cell (pDC). This diagnosis is based on expression of CD4 and CD56 antigens and absence of B, T or myeloid lineage markers. Immunohistochemistry and flow cytometry are the only methods, which allow identification of this disease, either in isolated skin lesions or in a leukemic form. Although the co-expression of CD4 and CD56 is rare and the number of described cases is low, this group bears similar characteristics in a clinical course of disease. It is a very aggressive leukemia/lymphoma, usually with primary skin involvement, in half of the cases infiltrating bone marrow or lymph nodes. Despite high rate of initial response to treatment, early and widespread relapses occur and patients die of disease progression. Although the physiological counterpart of tumour cells was identified, the origin of the disease is still discussed because of aberrant expression of cell markers. Optimal treatment is not known. However, this aggressive disease requires radical approach with intensive chemotherapy regimens, prophylaxis of CNS involvement and early indication of allogeneic bone marrow transplantation. Two case reports are described.
Key words:
CD4⁺CD56⁺ malignancy, DC2 leukemia, hematodermic neoplasm.
Autoři: M. Klabusay 1; M. Pevná 1; J. Kissová 2; M. Doubek 1; M. Heidekerová 1; J. Mayer 1; J. Vorlíček 1
Působiště autorů: interní hematoonkologická klinika LF MU a FN, Brno oddělení klinické hematologie FN, Brno
Vyšlo v časopise: Čas. Lék. čes. 2008; 147: 511-515
Kategorie: Přehledový článek
Souhrn
CD4⁺56⁺ hematodermické neoplazma neboli leukémie z časných plazmocytoidních dendritických buněk typu DC2 bylo uznáno ve WHO-EORTC klasifikaci pro kožní lymfomy za zvláštní jednotku odvozenou z plazmocytoidní prekurzorové dendritické buňky (pDC). Tato diagnóza je postavena na koexpresi CD4 a CD56 a na absenci B-lymfoidních, T-lymfoidních nebo myeloidních buněčných znaků (lineage–) a jedinými diagnostickými metodami umožňujícími odhalení této jednotky jsou imunohistochemická analýza, v případě izolovaného postižení kůže a flowcytometrická analýza při leukemizaci onemocnění. Ačkoliv současná exprese CD4 a CD56 je velmi vzácná, i přes nízký počet popsaných případů bylo shledáno, že tato skupina má charakteristický obraz a průběh onemocnění. Jedná se o velmi agresivní leukémii/lymfom většinou s primárním postižením kůže a v polovině případů i kostní dřeně nebo lymfatických uzlin a přes vysokou iniciální odpověď na léčbu dochází k časnému relapsu, leukemizaci a většina pacientů umírá v progresi onemocnění. Přestože in vitro testy byl identifikován fyziologický protějšek nádorových buněk, ontogenetický původ onemocnění zůstává vzhledem k aberantní expresi buněčných znaků stále diskutovanou otázkou. Rovněž optimální léčba není známa, ale agresivita onemocnění vyžaduje razantní přístup s intenzivními protokoly pro akutní leukémie, profylaxi infiltrace CNS a směrování k alogenní transplantaci kostní dřeně. Závěrem uvádíme dvě kazuistiky nemocných s touto diagnózou.
Klíčová slova:
CD4⁺CD56⁺ malignity, DC2 leukémie, hematodermické neoplazma.CD4+CD56+ hematologické malignity jsou nyní považovány za odlišnou klinicko-patologickou jednotku, která je založena hlavně na koexpresi CD4 a CD56 a na absenci B lymfoidních, T lymfoidních nebo myeloidních buněčných znaků (lineage–). Diagnóza je velmi vzácná, ve světové literatuře bylo popsáno pouze přes 100 případů. Onemocnění se obvykle prezentuje na kůži a polovina pacientů má v úvodu postižení uzlin nebo kostní dřeně. U většiny pacientů pouze s kožními lézemi se rychle rozvíjí postižení kostní dřeně, periferní krve, lymfatických uzlin a extranodálních míst. Od roku 1994, kdy se ojediněle případy s neobvyklou současnou expresí CD4 a CD56 začaly objevovat v literatuře, zůstávalo diskutovanou otázkou správné zařazení jednotky do klasifikace, jelikož trvaly dohady ohledně fyziologického protějšku nádorových buněk, který byl různě připisován jak T, tak NK nebo myelo-monocytární linii (1–3). Petrella et al. (4) v roce 1999 v prvním větším souboru referují o sedmi případech se shodnými klinickými, morfologickými, fenotypickými a genotypickými rysy. Vzhledem k nejasnému původu nádorových buněk navrhují název agranulární CD4+ CD56+ hematodermické neoplazma (HN). V roce 2002 byl poprvé v práci Chaperot et al. (5) in vitro zkouškami identifikován fyziologický protějšek nádorových CD4+CD56+ buněk v prekurzoru plazmocytoidní dendritické buňky (pDC, DC2). Počet referovaných případů stále stoupá a byla identifikována exprese nových aberantních antigenů u některých případů.
Etiologie
Málo je známo o etiologii a patogenezi CD4+CD56+ neoplazmat. EBV a lidský herpesvirus-6 nejsou odhalitelné. Lidský lymfotropní virus T-buněk typu I (HTLV-1) byl zjištěn v jednom případě (6), zatímco jiní (7) tento virus neodhalili. Všeobecně vzato, (latentní) virová infekce patrně nehraje důležitou roli v patogenezi této nemoci.
Klinické rysy
Reimer et al. (8) sumarizují data 91 publikovaných případů a šesti vlastních pacientů. Neoplazmata CD4+CD56+ všeobecně postihují starší pacienty s průměrným věkem 67 let (rozsah 6–89 let). Muži jsou postiženi téměř třikrát více než ženy (poměr muži : ženy – 2,7 : 1). Klinické manifestace této nemoci vykazují charakteristický obraz a průběh. Převážná většina pacientů má původně projevy kožních lézí nespecifické morfologie a distribuce. Při diagnóze se u téměř 80 % pacientů nemoc rozšířila do míst mimo kůži, nejčastěji do kostní dřeně a lymfatických uzlin (> 50 % nemocných), následovala slezina a játra (11–20 % nemocných). Jiné orgány, jako je nosohltan, tonsily, CNS, slzné kanálky, svaly nebo gynekologické orgány, byly napadeny jen sporadicky.
Podle klasifikace Ann Arbor (lze-li ovšem tuto klasifikaci vůbec považovat za vhodnou) jsou pacienti diagnostikováni ve stadiu I (pouze s kožními lézemi), 7 % pacientů ve stadiu II, 2 % pacientů ve stadiu III a 66 % pacientů ve stadiu IV. Na rozdíl od jiných lymfoidních malignit, jsou B symptomy, jako je horečka, noční pocení a ztráta na hmotnosti, vzácné.
Morfologie
Infiltrace maligními buňkami v kožních lézích byla široce popsána v literatuře a vykazuje stejné společné znaky. Maligní buňky připomínají blasty akutní leukémie, jsou malého, středního nebo velkého rozměru (9). Buňky difuzně invadují do dermis, ale epidermis zůstává vždy ušetřena (4). Na rozdíl od zralých NK-buněk u nasal-type lymfomu cytoplazma neobsahuje žádná azurofilní granula a v kožních lézích nejsou známky angiotropismu (4, 9). Cytoplazma je myeloperoxidáza a butyrát-esteráza negativní (1, 4, 9) a ukazuje prominující vakuoly (9), které mohou korespondovat s pinocytárními váčky normálních pDC (10).
Imunofenotyp a ontogeneze
CD4+CD56+ nádorové buňky sdílejí některé znaky s blastickými buňkami akutní leukémie (9). Hladiny exprese CD45 na CD4+CD56+ buňkách jsou vždy nízké, ale znaky vztažené k progenitorům (CD10, CD34, a CD117) jsou negativní (5). Buňky shodně exprimují CD4 a CD56, zatímco (povrchový) CD3 a B markery chybí, HLA-DR je obvykle nalézán (8). Pan-T cell markery CD2, CD5 a CD7 mohou být zřídka exprimovány (5, 8). Prekurzorový marker CD38 bývá exprimován (4, 9, 11) a TdT je sporadicky pozitivní (9, 12).
Dosud bylo identifikováno několik různých podtříd dendritických buněk (DC) – Langerhansovy buňky, myeloidní CD 11c+ (neboli DC1) a plazmocytoidní DC (neboli lymfoidní DC, DC2, interferon produkující buňky) – které mohou být rozlišeny morfologicky, imunofenotypicky a funkčně. Plazmocytoidní dendritické buňky jsou charakterizovány chyběním markerů specifických pro linie (CD3, CD11c, CD14, CD16, CD19 a CD56) a souborem pozitivních znaků (BDCA-2, BDCA-4, CD4, CD45RA, CD68, CD123, a HLA-DR). V roce 2002 byl poprvé v práci Chaperot et al. (5) identifikován fyziologický protějšek nádorových CD4+CD56+ buněk. Exprese CD4, CD45RA, CD123, HLA-DR a ITL3 a absence CD45RO a CD11c na nádorových buňkách vysoce připomíná fenotyp pDC. Pro odvození z této linie svědčí u nádorových buněk in vitro produkce IFNα v odpověď na stimulaci virem, přežití a diferenciace ve funkční dendritické buňky pod vlivem IL-3 a indukce Th2 polarizace při aktivaci IL-3. Také Petrella et al. (11) v roce 2002 srovnali imunofenotyp nádorových buněk 14 pacientů s plazmocytoidními monocyty (starší název pro pDC) získanými od zdravých dobrovolníků, kteří dostávali Flt-3 ligand. Plazmocytoidní monocyty exprimují vysoké hladiny CD123, po stimulaci Flt-3 se v cirkulaci objevily také CD123bright+ lineage– buňky, které současně koexprimují CD56 a mnoho společných markerů s plazmocytoidními monocyty. Tyto CD56+ PM-like buňky koexprimují CD4, CD56, CD68, a HLA-DR, kombinaci markerů, která je uváděna u HN. Dzionek et al. (13) identifikovali dva nové antigeny, které jsou specificky exprimovány na pDC, BDCA-2 (blood dendritic cell antigen-2, CD303) a BDCA-4 (CD304). Pozitivita BDCA-2 byla nalezena na CD4+CD56+ tumorových buňkách, což v souladu s imunofenotypem HN dále podporuje jejich původ v pDC (14). Meyer et al. (15) na CD4+CD56+ tumorových buňkách nalezli expresi CD101, dalšího znaku sdíleného s pDC, který má hlavní úlohu v aktivaci T-lymfocytů dendritickými buňkami. Rozdílem mezi nádorovými buňkami a pDC zůstává exprese CD56, který je klasickým znakem NK-buněk, ale CD56 je také často popsán mimo tuto linii – jako u akutní myeloidní leukémie (16) nebo myelomu (17). Byla však nalezena pozitivita dalších markerů NK-buněk, CD94 a TIA1, na CD4+CD56+ buňkách (12, 18), tyto buňky ale neexprimovaly konvenční markery NK-buněk, jako jsou CD16, CD57 a perforin. Franck et al. (19) sestavili specifický profil DC2 malignit jako CD4+CD56+ CD116– CD123+ CD45RA+ CD45RO–, který nebyl nikdy zaznamenán v jejich sérii pacientů s akutní myeloidní a lymfatickou leukémií nebo myelodysplastickým syndromem.
Další imunofenotypické znaky by mohly nasvědčovat pro myelomonocytární původ nádorových buněk. Častá je exprese monocytárních markerů CD68 (4, 20, 21) a CD 36 (5), ale další monocytární markery CD14 a CD64 chybí a tumorové buňky se v přítomnosti GM-CSF nediferencují v monocyty nebo makrofágy (5). U CD4+CD56+ malignit je referována exprese myeloidního progenitorového markeru CD33, který byl negativní v době diagnózy, ale byl pozitivní při relapsu (9), nebo jeho slabá (dim) exprese v době diagnózy (22). Exprese CD33 byla ale indukována po in vitro kultivaci maligních CD4+CD56+ buněk (5). Dále Garnache-Ottou et al. (23) in vitro kultivací CD4+CD56+CD33+lineage– leukemických buněk (od pacienta s kožními noduly a asociovanou lymfadenopatií a splenomegalií) dosáhli maturace v dendritické buňky, produkce IFNα po stimulaci virem a indukce Th2 polarizace. Slabou expresi CD33 také nalezli na normálních cirkulujících plazmocytoidních dendritických buňkách. Pozitivita myeloidního znaku CD33 tedy nevylučuje diagnózu leukémie z pDC (23). V případě exprese CD33 nebo atypického imunofenotypu nádorových buněk (negativita CD56) pomůže k potvrzení diagnózy a původu nádorových buněk v pDC specifický marker BDCA-2. V několika případech CD4+CD56+ malignit předcházela anamnéza myelodysplastického syndromu anebo byly nalezeny myelodysplastické rysy v kostní dřeni v době diagnózy (9, 24). CD4+CD56+lineage– malignity se mohou sekundárně transformovat v myelomonocytární leukémii (12, 20). Herling et al. (20) osvědčili, že sekundárně transformované myelomonocytární blasty a CD4+CD56+ blasty pocházejí ze společného leukemického klonu, protože obojí exprimují TCL-1 proto-onkogen, který se nevyskytuje u de novo myeloidních leukémií. Chronická myelomonocytární leukémie stejně jako HN může vykazovat CD4+CD56+CD123bright+ fenotyp (11).
Cytogenetika
Ve studii Leroux et al. (25) identifikovali za použití konvenční cytogenetické a 24barevné analýzy FISH šest chromozomálních oblastí postižených u těchto neoplazmat. V jejich sériích docházelo k reprodukovatelné ztrátě chromozomální hmoty na chromozomech 5q, 6q, 9, 12p, 13q a 15q u 14 z 21 pacientů. Opakované chromozomální aberace charakterizující CD4+CD56+ malignitu jsou sdíleny četnými hematologickými malignitami myeloidního nebo lymfoidního původu. Dospěli k závěru, že neexistuje žádná konzistentní chromozomální odchylka, ale že kombinace nebo akumulace jistých genomických nerovnováh by mohla být specifická při malignitě CD4+CD56+.
Léčba
Reimer et al. (8) hodnotili výsledky léčby 91 publikovaných případů a šesti vlastních pacientů. Protože neexistuje shoda pro optimální léčbu u CD4+CD56+ neoplazmat, terapeutické přístupy pro malignitu CD4+CD56+ se široce lišily od ozařovaní v lokalizovaných stadiích až po myeloablativní terapii. Přestože počáteční reakce na léčbu je vysoká, s téměř 70 % kompletních remisí (CR) a 10 % částečných remisí (PR), jen kolem 20 % pacientů vykazuje dlouhodobě udržovanou remisi (průměrná délka pozorování 16 měsíců). U většiny pacientů dochází k relapsu, poté umírají na progredující nemoc. Všeobecně vzato, výsledky léčby jsou špatné, s mediánem celkového přežití 13 měsíců, což odráží agresivní průběh nemoci. Aby se prozkoumal dopad různých terapií na výsledek, autoři léčbu publikovaných případů rozdělili do čtyř skupin dle intenzity chemoterapie:
- skupina A – lokální terapie nebo systémová terapie „slabší než CHOP“,
- skupina B – CHOP (cyklofosfamid, doxorubicin, vincristin a prednison) a CHOPu podobné režimy,
- skupina C – intenzivní protokoly pro akutní leukémie,
- skupina D – myeloablativní terapie.
Celkový poměr léčebné odpovědi (CR a PR po iniciální terapii) je vysoký, bez ohledu na terapii a nevykazuje vyslovené rozdíly v těchto čtyřech skupinách. Na druhé straně, udržení CR je lepší s agresivnější léčbou (skupina A: 7 %, skupina B: 3 %, skupina C: 35 %, skupina D: 50 %). Celkové přežití mezi skupinami C a D bylo podstatně vyšší než u skupin A a B. Sama skupina D významně převyšovala skupiny, A, B a C. Ale věk kolem 60 let byl negativním prognostickým faktorem u CD4+CD56+ neoplazmat, jenž silně ovlivňuje výsledek. Průměrný věk ve skupinách klesal, čím intenzifikovanější terapie byla poskytnuta: 79 let (skupina A), 67,5 roku (skupina B), 52 let (skupina C) a 28,5 roku (skupina D). Starší pacienti přežívali průměrně 9 měsíců (rozsah 2–40 měsíců), ve srovnání s mladšími pacienty s významně delším mediánem přežití 18 měsíců (rozsah 2–84 měsíců). Nejlepší celkové přežití v Kaplan-Meierových křivkách má skupina pacientů po myeloablativním režimu a transplantaci kostní dřeně (skupina D), ale tato léčba je limitována věkem pacienta. Amor et al. (26) referuje první případ úspěšné nemyeloablativní transplantace kostní dřeně u CD4+CD56+ akutní leukémie, jedna pacientka je v remisi 51 měsíců od transplantace.
Kazuistiky
Kazuistika 1
Pacient (nar. 1939) měl iniciálně izolované postižení kůže v roce 2003 a byl léčen chemoterapií (režim CHOP) s efektem první kompletní remise (1. CR). Čtrnáct měsíců od stanovení diagnózy nastal relaps kožních lézí s prudkou progresí a diseminací do kostní dřeně, uzlin, sleziny a měkkých tkaní (obr. 1 a 2). Flowcytometrická analýza periferní krve potvrdila 90 % buněk fenotypu CD4+56+. Záchrannou chemoterapií (režim MINE) bylo dosaženo krátce trvající 2. CR, vzhledem ke komorbiditám však nebylo možné použít intenzivní režimy léčby. Druhý relaps nastal opět na kůži a záhy došlo k diseminaci do kostní dřeně a CNS. Pacient zemřel 22 měsíců od stanovení diagnózy.
Obr. 1. Flowcytometrická analýza nádorové populace CD4+56+ Na horních dvou grafech je zobrazena formou dot-plots flowcytometrická analýza pro kazuistiku 1, na dolních dvou grafech pro kazuistiku 2. Na levých grafech je v gate A zabrána populace všech leukocytů nesoucí znak CD45+ a v gate blast populace lymfocytů, v níž je patrná patologická CD45dim+ populace nádorových buněk. Analýza fluorescence FITC vs. PE z gate A je znázorněna na grafech vpravo, kde je patrná společná populace fenotypu CD4+CD56+. 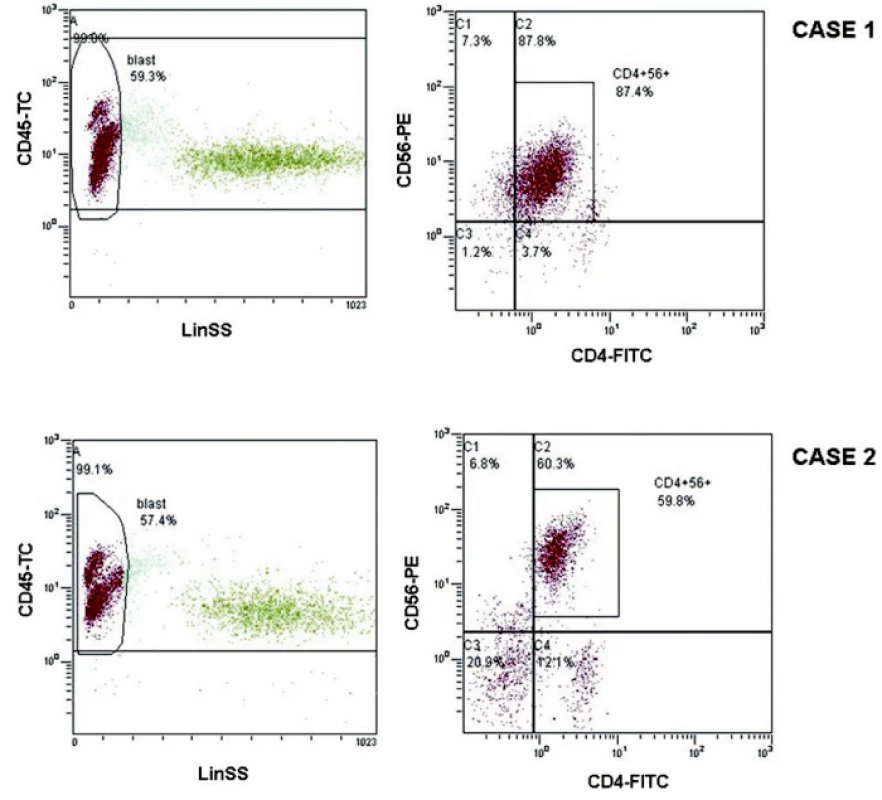
Obr. 2. Nátěr kostní dřeně (kazuistika 1) při leukemizaci onemocnění Uprostřed dva blastické elementy střední velikosti s jemným jaderným chromatinem a patrnými jadérky a objemnější cytoplazmou s četnou vakuolizací. Vpravo dva elementy s výběžky cytoplazmy typu pseudopodií. V dolní části shluk trombocytů. 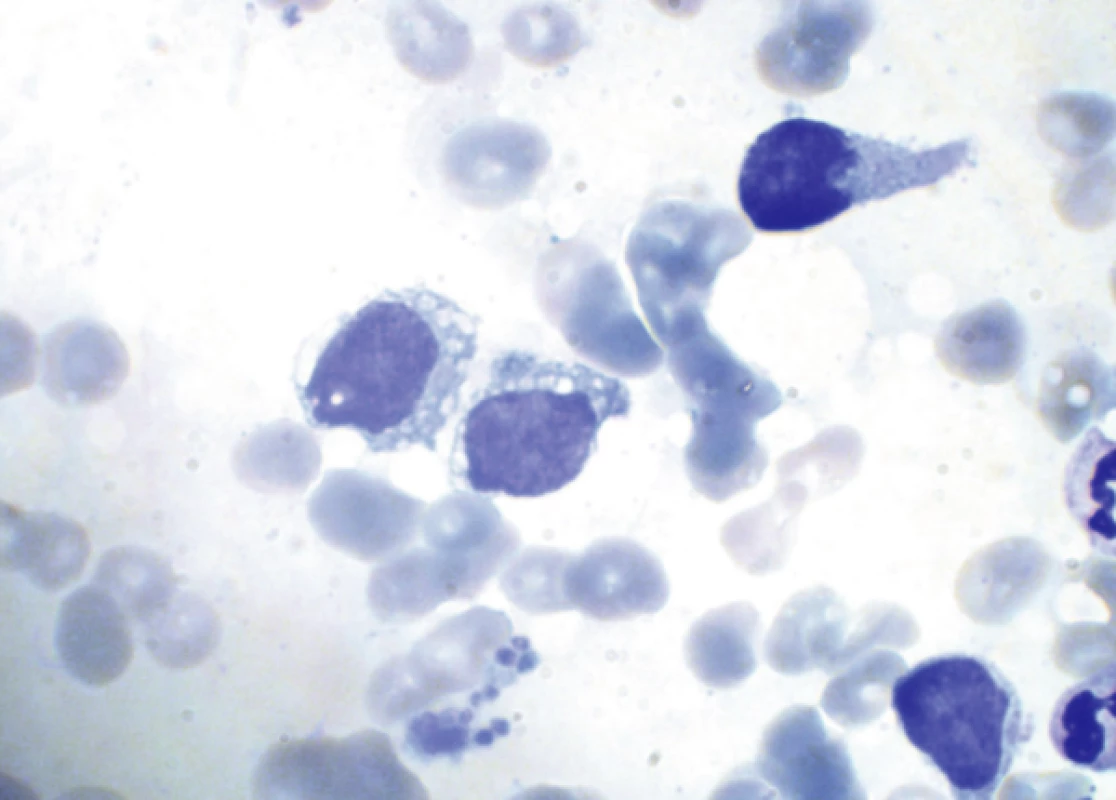
Kazuistika 2
Pacientka (nar. 1988) se prezentovala v roce 2007 akutní leukémií bez kožních ložisek či postižení jiného orgánu. Flowcytometrická analýza periferní krve prokázala 14 % buněk nádorového fenotypu CD4+56+. Léčba zahrnovala chemoterapii (režim CHOP s intrathékální preventivní aplikaci cytostatik) (obr. 1 a 3). Onemocnění se však ukázalo chemorezistentní, proto vzhledem k expresi antigenu CD52 nádorovými buňkami byla zahájena imunoterapie alemtuzumabem. Vzhledem k rychlé progresi v kostní dřeni bylo následně přistoupeno k příbuzenské alogenní transplantaci kostní dřeně, kterou se podařilo navodit 1. CR. Po sedmi měsících však nastal relaps v dutině ústní a kostní dřeni a pacientka zemřela 12 měsíců od stanovení diagnózy.
Obr. 3. Nátěr periferní krve a kostní dřeně (kazuistika 2) a – na nátěru periferní krve jeden blastický element menší velikosti s velkým nukleo-cytoplazmatickým poměrem, jemným chromatinem s několika jadérky, cytoplazma je bazofilní, bez granulace a vykazuje jemnou vakuolizaci a drobný výběžek. b – nátěr kostní dřeně při relapsu po alogenní transplantaci. Blasty s jemnou vakuolizací cytoplazmy připomínající vzhled „perlového náhrdelníku“ podél okraje cytoplazmy. 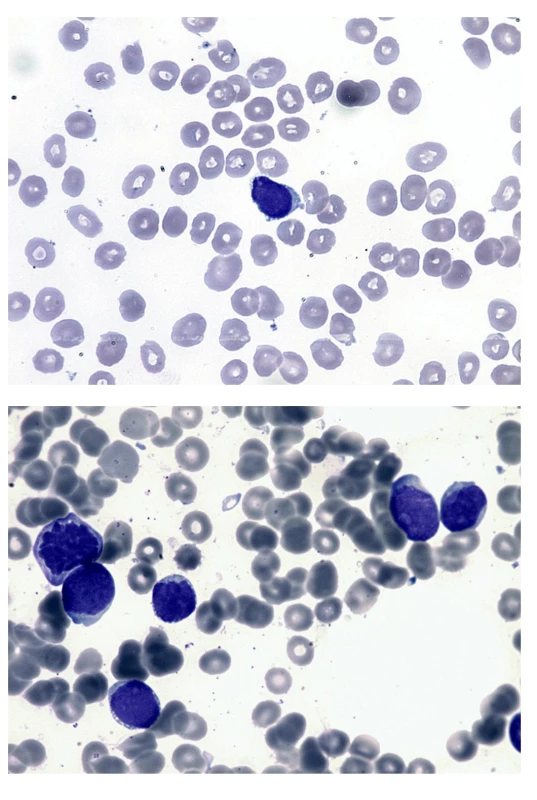
Závěr
CD4+56+ DC2 malignita je raritní nádorové onemocnění, u kterého imunofenotypizace je exkluzivní diagnostickou metodou. Agresivní průběh onemocnění vyžaduje intenzifikaci terapie a vzhledem k možnému postižení CNS i intrathékální preventivní aplikaci cytostatik. Jedinou známou kurativní metodou je alogenní transplantace kostní dřeně. Jsou připojena dvě vlastní pozorování.
Zkratky
CNS – centrální nervová soustava
CR – kompletní remise
DC – dendritická buňka
HN – hematodermické neoplazma
CHOP – režim chemoterapie zahrnující cyklofosfamid, vincristin, doxorubicin a prednison
MINE – režim chemoterapie zahrnující mitoxantron, ifosfamid a etoposid
pDC, DC2 – plazmocytoidní dendritická buňka
PR – parciální remise
Tato práce byla podpořena grantem Interní grantové agentury Ministerstva zdravotnictví ČR číslo NR9023-3.
doc. MUDr. Martin Klabusay, Ph.D.
Interní hematoonkologická klinika FN
Jihlavská 20, 625 00 Brno
fax: +420 532 233 603, e-mail: mklabus@fnbrno.cz
Zdroje
1. Brody, J. P., Allen, S., Schulman, P. et al.: Acute agranular CD4-positive natural killer cell leukemia. Cancer, 1995, 75, s. 2474–2483.
2. DiGiuseppe, J. A., Louie, D. C., Williams, J. E. et al.: Blastic natural killer cell leukemia/lymphoma: a clinicopathologic study. Am. J. Surg. Pathol., 1997, 21, s. 1223–1230.
3. Bagot, M., Bouloc, A., Charue, D. et al.: Do primary cutaneous non-T non-B CD4⁺CD56⁺ lymphomas belong to the myelo-monocytic lineage? J. Invest. Dermatol., 1998, 11, s. 1242–1244.
4. Petrella, T., Dalac, S., Maynadié, M. et al.: CD4⁺ CD56⁺ cutaneous neoplasms: a distinct hematological entity? Am. J. Surg. Pathol., 1999, 23, s. 137–146.
5. Chaperot, L., Bendriss, N., Manches, O. et al.: Identification of a leukemic counterpart of the plasmacytoid dendritic cells. Blood, 2001, 97, s. 3210–3217.
6. Hayashi, K., Nakamura, S., Koshikawa, T. et al.: A case of neural cell adhesion molecule-positive peripheral T-cell lymphoma associated with human T-cell lymphotrophic virus type 1 showing an unusual involvement of the gastrointestinal tract during the course of the disease. Hum. Pathol., 1994, 25, s. 1251–1253.
7. Savoia, P., Fierro, M. T., Novelli M. et al.: CD56-positive cutaneous lymphoma: a poorly recognized entity in the spectrum of primary cutaneous disease. Br. J. Dermatol., 1997, 137, s. 966–971.
8. Reimer, P., Rűdiger, T., Kreamer, D. et al.: What is CD4⁺CD56⁺ malignancy and how should it be treated? Bone Marrow Transplant., 2003, 32, s. 637–646.
9. Feuillard, J., Jacob, M. C., Valensi, F. et al.: Clinical and biologic features of CD4⁺CD56⁺ malignancies. Blood, 2002, 99, s. 1556–1563.
10. Kohrgruber, N., Halanek, N., Groger, M., et al.: Survival, maturation, and function of CD11c – and CD11c+ peripheral blood dendritic cells are differentially regulated by cytokines. J. Immunol., 1999, 163, s. 3250–3259.
11. Petrella, T., Comeau, M. R., Maynadié, M. et al.: ’Agranular CD4⁺ CD56⁺ hematodermic neoplasm (blastic NK-Cell lymphoma) originates from a population of CD56⁺ precursor cells related to plasmacytoid monocytes. Am. J. Surg. Pathol., 2002, 26, s. 852–862.
12. Khoury, J. D., Medeiros, L. J., Manning, J. T. et al.: CD56+ TdT+ blastic natural killer cell tumor of the skin: a primitive systemic malignancy related to myelomonocytic leukemia. Cancer, 2002, 94, s. 2401–2408.
13. Dzionek, A., Fuchs, A., Schmidt, P. et al.: BDCA-2, BDCA-3, and BDCA-4: three markers for distinct subsets of dendritic cells in human peripheral blood. J. Immunol., 2000, 165, s. 6037–6046.
14. Urosevic, M., Conrad, C., Kamarashev, J., et al.: CD4⁺ CD56⁺ hematodermic neoplasms bear a plasmacytoid dendritic cell phenotype. Hum. Path., 2005, 36, s. 1020–1024.
15. Meyer, N., Petrella, T., Poszepczynska-Guigné, E. et al.: CD4⁺ CD56⁺ blastic tumor cells express CD101 molecules. J. Invest. Dermatol., 2005, 124, s. 668–669.
16. Scott, A. A., Head, D. R., Kopecky, K. J. et al.: HLA-DR–, CD33⁺, CD56⁺, CD16 – myeloid/natural killer cell acute leukemia: a previously unrecognized form of acute leukemia potentially misdiagnosed as French-American-British acute myeloid leukemia M3. Blood, 1994, 84, s. 244–255.
17. Van Camp, B., Durie, B. G. M., Spier, C. et al.: Plasma cells in multiple myeloma express a natural killer cell-associated antigen: CD56(NKH-1; Leu-19). Blood, 1990, 76, s. 377–382.
18. Knudsen, H., Gronbaek, K., Straten, P.: et al. A case of lymphoblastoid natural killer (NK)-cell lymphoma: association with NK-cell receptor complex CD94/NKG2 and TP53 intragenic deletion. Br. J. Dermatol., 2002, 146, s. 148–153.
19. Franck, T. et al.: The CD4⁺ CD56⁺ CD116 – CD123⁺ CD45RA⁺ CD45RO – profile is specific to DC2 malignancies. Haematologica, 2007, 88, s. e50–e51.
20. Herling, M., Teitell, M. A., Shen, R. R. et al.: TCL1 expression in plasmacytoid dendritic cells (DC2s) and the related CD4+ CD56+ blastic tumors of skin. Blood, 2003, 101, s. 5007–5009.
21. Ko, Y. H., Kim, S. H., Park, K. et al.: CD4⁺CD56⁺CD68⁺ hematopoietic tumor of probable plasmacytoid monocyte derivation with weak expression of cytoplasmic CD3. J. Korean. Med. Sci., 2002, 17, s. 833–839.
22. Anargyrou, K., Paterakis, G., Boutsis, D. et al.: An unusual case of CD4⁺ CD7⁺ CD56⁺ acute leukemia with overlapping features of type 2 dendritic cell (DC2) and myeloid/NK cell precursor acute leukemia. Eur. J. Haematol., 2003, 71, s. 294–398.
23. Garnache-Ottou, F., Chaperot, L., Biichle, S. et al.: Expression of the myeloid-associated marker CD33 is not an exclusive factor for leukemic plasmacytoid dendritic cells. Blood, 2005, 105, s. 1256–1264.
24. Kazakov, D. V., Mentzel, T., Burg G. et al.: Blastic natural killer-cell lymphoma of the skin associated with myelodysplastic syndrome or myelogenous leukaemia: a coincidence or more? Br. J. Dermatol., 2003, 149, s. 869–876.
25. Leroux, D., Mugneret, F., Callanan, M. et al.: CD4⁺, CD56⁺ DC2 acute leukemia is characterized by recurrent clonal chromosomal changes affecting 6 major targets: a study of 21 cases by the Groupe Franćais de Cytogénétique Hématologique. Blood, 2002, 99, s. 4154–4159.
26. Amor, R. B., Hicheri, Y., Pautas, C. et al.: Successful non-myeloablative allogenic HLA-identical stem cell transplantation for CD4/CD56 positive acute leukemia. Transplant., 2007, 84, s. 1066–1067.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článek Výživa kriticky nemocných endoskopicky zaváděnou trojluminální sondou – retrospektivní analýzaČlánek Atrézie a stenózy duodenaČlánek mikroRNA a rektální karcinomČlánek Nový pohled na protein RasČlánek Čeští lékaři a rok 1968Článek Imunologická paměť bazofilůČlánek Význam DNA polymerázČlánek Postřehy z Mayo ClinicČlánek Spolek lékařů v PlzniČlánek Laureáti Nobelovy ceny
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Vzácná diagnóza: CD4⁺56⁺ leukémie z dendritických buněk typu DC2
- Výživa kriticky nemocných endoskopicky zaváděnou trojluminální sondou – retrospektivní analýza
- Atrézie a stenózy duodena
- Diagnostika a léčba dědičných metabolických poruch
- Sebevražedné pokusy v souboru mladých dospělých – výsledky studie ELSPAC
- Nový pohled na funkce telomeráz
- mikroRNA a rektální karcinom
- Nový pohled na protein Ras
- Průběh těhotenství a porodu při vrozeném deficitu antitrombinu typu II
- Léčba hemosuccus pancreaticus embolizací obou gastrických tepen
- Čeští lékaři a rok 1968
- Imunologická paměť bazofilů
- Význam DNA polymeráz
- Clinical usefulness of fractional exhaled nitric oxide for diagnosing prolonged cough
- Cutoff point of the fraction of exhaled nitric oxide (FeNO) with the off-line method for diagnosing asthma and the effect of smoking on FeNO
- Enalapril-induced cough is associated with non-severe heart failure
- JEDNODENNÍ KONFERENCE O PRENATÁLNÍ DIAGNOSTICE
- Znovu objevený Theodor Boveri a jeho nadčasové úvahy o vzniku maligních nádorů
- World Cancer Congress UICC 2008 – pohledem medika Ženeva, 27.–31. srpna 2008
- Profesor Ivo Hána osmdesátníkem
- Postřehy z Mayo Clinic
- II. mezioborový lékařský kongres DÝCHÁNÍ – PODMÍNKA ŽIVOTA
- Slavnostní seminář k 20. výročí založení obezitologické jednotky
- Spolek lékařů českých v Praze
- Spolek lékařů v Plzni
- Laureáti Nobelovy ceny
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Atrézie a stenózy duodena
- Průběh těhotenství a porodu při vrozeném deficitu antitrombinu typu II
- Výživa kriticky nemocných endoskopicky zaváděnou trojluminální sondou – retrospektivní analýza
- Vzácná diagnóza: CD4⁺56⁺ leukémie z dendritických buněk typu DC2
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



