-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Renin, prorenin a přímý inhibitor reninu aliskiren
Renin, prorenin, and the direct renin inhibitor aliskiren
The renin-angiotensin system plays an important role in various physiological and pathophysiological regulatory mechanisms. Within the past few years, the classical concept of a linear enzymatic cascade has experienced substantial changes. A parallel counter-regulatory axis has been identified which involves the angiotensin converting enzyme homologue ACE2, angiotensin (1–7), and receptors Mas. The research in prorenin and its non-proteolytic activation has greatly advanced after the discovery of cellular receptors (P)RR; binding of renin or prorenin to these receptors not only facilitates angiotensin generation, but at the same time activates specific signal transduction pathways. The long-term search for clinically useful direct renin inhibitors has recently succeeded with the new antihypertensive drug aliskiren. While beneficial effects of aliskiren on some markers of cardiovascular and renal diseases have been proved in large clinical studies, important questions remain to be solved.
Key words:
renin-angiotensin system, ACE2 – angiotensin (1–7) – receptors Mas axis, nonproteolytic activation of prorenin, receptors (P)RR, direct renin inhibitor aliskiren.
Autoři: Adolf Slabý; Aleš Žák
Působiště autorů: Univerzita Karlova v Praze, 1. lékařská fakulta, IV. interní klinika VFN
Vyšlo v časopise: Čas. Lék. čes. 2010; 149: 55-60
Kategorie: Přehledový článek
Souhrn
Systém renin-angiotenzin má významnou úlohu v různých fyziologických a patofyziologických regulačních mechanismech. Během posledních let se klasická koncepce lineární enzymatické kaskády podstatně změnila. K novým objevům patří paralelní kontraregulační osa zahrnující homologický enzym ACE2, angiotenzin (1–7) a receptory Mas. Výzkum proreninu a jeho non-proteolytické aktivace významně pokročil, když byly identifikovány buněčné receptory (P)RR; vazba na tyto receptory nejen zvyšuje katalytickou účinnost reninu a proreninu, ale současně aktivuje specifické intracelulární signální dráhy. Dlouholeté úsilí věnované vývoji přímých inhibitorů reninu bylo završeno syntézou účinného antihypertenziva aliskirenu. Zatímco rozsáhlé klinické studie potvrdily příznivý vliv aliskirenu na některé markery kardiovaskulárních a renálních onemocnění, dosud zůstávají otevřené otázky, na něž bude třeba zaměřit pozornost v další výzkumné práci.
Klíčová slova:
systém renin-angiotenzin, osa ACE2 – angiotenzin (1–7) – receptory Mas, non-proteolytická aktivace proreninu, receptory (P)RR, přímý inhibitor reninu aliskiren.ÚVOD
Výzkum systému renin-angiotenzin má dlouhou historii. Během jednoho století od objevu reninu se badatelům v Evropě, Spojených státech amerických, Kanadě, Latinské Americe i v Austrálii podařilo získat klíčové poznatky o jednotlivých složkách enzymové kaskády a o jejich vzájemných vztazích. Po období relativní stagnace došlo v posledních letech k výraznému vzestupu zájmu o systém renin-angiotenzin, a to zejména díky aliskirenu, prvnímu přímému inhibitoru reninu zavedenému do terapeutické praxe. Cílem tohoto přehledového článku je informovat o několika závažných nových objevech a zařadit je do kontextu dosavadních znalostí.
Jak je dnes všeobecně známo, systém renin-angiotenzin se významně podílí na řízení krevního oběhu a renálních funkcí, které zajišťují homeostázu vody a elektrolytů. Neméně důležitá je jeho účast v patogenezi arteriální hypertenze, chronického srdečního selhání a závažných onemocnění ledvin. Většinu biologických účinků systému renin-angiotenzin zprostředkuje angiotenzin II, a to vazbou na buněčné receptory AT1. V kardiovaskulárním systému působí angiotenzin II vazokonstrikci a má pozitivní inotropní účinky na myokard, v ledvinách vyvolává změny místní hemodynamiky a zvyšuje resorpci sodíku v proximálních tubulech, v kůře nadledvin stimuluje sekreci aldosteronu a kortizolu, v mozku má dipsogenní účinek a zvyšuje aktivitu sympatického nervového systému. Metodami molekulární biologie byly v poslední době získány nové poznatky o úloze angiotenzinu II při řízení růstu, proliferace, diferenciace a přežívání buněk, studují se jeho účinky prokoagulační, prozánětlivé a profibrotické.
Receptory AT1 patří do třídy povrchových buněčných receptorů spojených s G-proteiny; jsou exprimovány ve všech orgánových systémech, v největším počtu v cévách, srdci, ledvinách, nadledvinách a játrech. Po navázání angiotenzinu II na receptor AT1 dochází k tomu, že intracelulárně lokalizované G-proteiny (Gq/11 a Gi/o) aktivují fosfolipázu C, jakož i řetěz proteinkináz a malé G-proteiny vázající GTP (Ras, Rho, Rac), které jsou zapojeny v několika signálních drahách. Aktivované receptory AT1 mohou též transaktivovat receptory pro růstové faktory EGF, PDGF a IGF-1.
Od devadesátých let 20. století se výzkum zaměřuje na tkáňové systémy renin–angiotenzin, které mají povahu parakrinní anebo autokrinní signalizace. V různých tkáních byla prokázána přítomnost jednotlivých komponent systému, přičemž některé (angiotenzinogen, enzym ACE) vznikají přímo v místě, kdežto jiné (renin, prorenin) jsou vychytávány z krevního oběhu. K vyvolání dlouhodobého účinku v tkáních stačí jen malé množství aktivních působků.
Dvě větve enzymové kaskády
Klasické pojetí systému renin-angiotenzin jako endokrinního regulačního mechanismu vychází z kaskády enzymově katalyzovaných reakcí, které probíhají v cirkulaci. Za první limitující krok v této kaskádě zodpovídá renin, specifická aspartylproteáza, která se tvoří v juxtaglomerulárním aparátu kůry ledvin. Renin odštěpuje z glykoproteinu angiotenzinogenu dekapeptid angiotenzinI, z něhož vzniká oktapeptid angiotenzin II, a to převážně působením angiotenzin konvertujícího enzymu (ACE), zčásti též alternativními cestami (1).
Sekrece reninu v ledvinách je řízena několika mechanismy, které se vzájemně ovlivňují. Na lokální úrovni zprostředkují vzestup sekrece reninu jednak receptory v aferentních arteriolách, a to při poklesu perfuzního tlaku, jednak receptory v macula densa, které reagují na zvýšení nálože sodíku v lumen tubulu. Významnou regulační úlohu má sympatický nervový systém. Plazmatická koncentrace angiotenzinu II ovlivňuje sekreci reninu zpětnovazebným mechanismem (2). Farmakologická blokáda systému renin-angiotenzin na kterékoliv úrovni zpětnou vazbu ruší, a proto je vždy provázena vzestupem sekrece reninu a jeho koncentrace v plazmě.
Během posledních několika let byla objevena funkčně významná paralelní větev klasické enzymové kaskády, osa ACE2 – angiotenzin (1–7) – receptory Mas, která má převážně kontraregulační účinky (3, 4). Obě větve systému renin-angiotenzin jsou schematicky znázorněny na obrázku 1.
Obr. 1. Dvě větve enzymové kaskády v cirkulaci (dle 4) 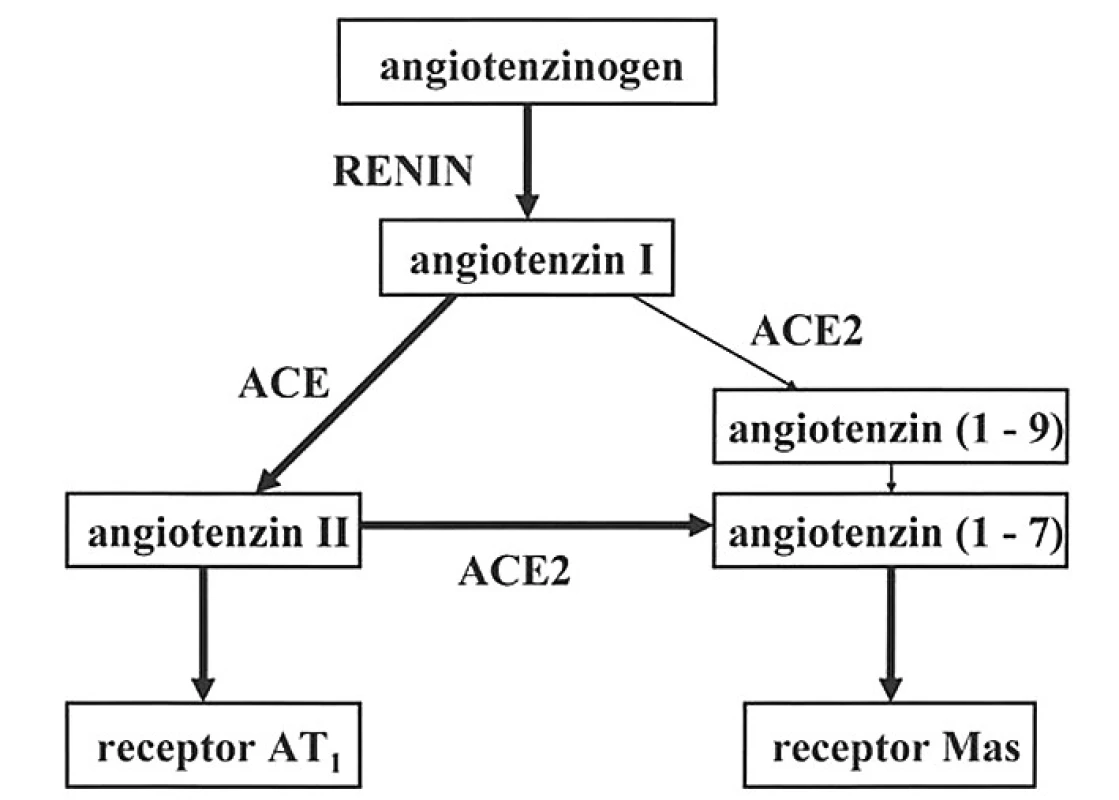
Enzym ACE2 jako homolog enzymu ACE identifikovaly nezávisle na sobě dvě skupiny badatelů v roce 2000 (5, 6). Tento enzym preferenčně štěpí angiotenzin II na heptapeptid angiotenzin (1–7), s menší účinností katalyzuje též hydrolýzu angiotenzinu I a prozánětlivého des-arg2-bradykininu, ale bradykinin neštěpí. Variabilita genu pro ACE2 může mít závažné patogenní důsledky (7), protože aktuální poměr mezi aktivitami enzymů ACE a ACE2 do značné míry rozhoduje o tom, jaký bude výsledný účinek celého systému renin-angiotenzin. Vzestup aktivity ACE je spojen se zvýšenou tvorbou angiotenzinu II a zvýšeným katabolismem angiotenzinu (1–7), naopak relativní převaha ACE2 sníží koncentraci angiotenzinu II v plazmě a zvýší koncentraci angiotenzinu (1–7). Simultánní stanovení aktivit enzymů ACE a ACE2 by mohlo poskytovat cenné informace v preventivní medicíně.
Angiotenzin (1–7), který byl až donedávna považován za inaktivní metabolický produkt, má ve skutečnosti významné fyziologické účinky. Experimenty na zvířatech včetně genetických manipulací prokazují jeho kardioprotektivní působení ve smyslu prevence srdeční remodelace, hypertofie a fibrózy myokardu (8). U lidí stoupá koncentrace angiotenzinu (1–7) v okolí ischemických ložisek v myokardu (9). Mikroinjekce fentomolové dávky angiotenzinu (1–7) do nucleus tractus solitarii potkana vyvolá pokles krevního tlaku (10). V cévách ovlivňuje angiotenzin (1–7) endotelové buňky, v nichž zvyšuje tvorbu oxidu dusnatého a vazodilatačních prostaglandinů a kromě toho brání proliferaci buněk hladké svaloviny (11). Velká pozornost se věnuje protektivním účinkům angiotenzinu (1–7) v glomerulech a v proximálních tubulech ledvin (12), jakož i antifibrotickému působení v játrech. Na hydrolytickém štěpení angiotenzinu (1–7) se v různé míře podílí enzym ACE, a proto inhibitory ACE zvyšují koncentraci a prodlužují poločas tohoto peptidu v cirkulaci (13).
Angiotenzin (1–7) se váže na receptory Mas, které se hojně vyskytují v některých částech mozku, v ledvinách a v myokardu, ale i v jiných tkáních (např. testes). Jsou to receptory spojené s G–proteiny, které mohou vytvářet heteroizomery s receptory AT1, a tím blokovat účinky angiotenzinu II (14). V současné době probíhá výzkum nové terapeutické strategie založené na farmakologické stimulaci receptorů Mas (15, 16).
Aktivace proreninu
Prorenin jako bezprostřední prekurzor reninu vzniká v endoplazmatickém retikulu juxtaglomerulárních buněk a z větší části (75 %) je ihned secernován do krve, kdežto zbývající čtvrtina se skladuje v sekrečních granulech. Zde dochází k přeměně proreninu na renin, po odštěpení N-terminálního prosegmentu složeného ze 43 aminokyselin. Tato proteolytická aktivace proreninu je katalyzována různými proteázami, přičemž optimální kyselé prostředí vytvářejí vakuolární H+-ATPázy (17). Exprese proreninu byla prokázána též mimo ledviny, např. v nadledvinách, v reprodukčních orgánech a v sítnici, kde však ke konverzi na renin nedochází (18). U pacientů po bilaterální nefrektomii klesá plazmatická koncentrace reninu během dvou dní téměř k nule, kdežto koncentrace proreninu se udržuje v rozmezí 30–40 % předoperačních hodnot (19).
Plazmatická koncentrace proreninu několikanásobně převyšuje koncentraci reninu, přičemž obvykle udávaný poměr 9 : 1 (popřípadě 10 : 1) kolísá v závislosti na různých fyziologických a patologických faktorech. Výrazný relativní a zpravidla též absolutní vzestup proreninu v plazmě je charakteristický pro graviditu a pro diabetes mellitus; předpokládá se kauzální vztah proreninu k mikrovaskulárním komplikacím diabetu. U pacientů s diabetem 1. typu korelují hodnoty plazmatické koncentrace proreninu se závažností retinopatie a k jejich vzestupu dochází těsně před manifestací mikroalbuminurie (20). Proliferativní retinopatie se vyznačuje extrémně vysokou koncentrací proreninu ve sklivci.
Se zřetelem na funkci proreninu v tkáních má mimořádný význam poznatek, že prorenin může získat enzymatickou aktivitu také jiným způsobem než proteolytickou přeměnou na renin. Metodami molekulární biologie bylo prokázáno, že aktivní místo, v němž dochází k vazbě a katalytickému štěpení angiotenzinogenu, je v molekule proreninu zpravidla překryto shora zmíněným prosegmentem jako pokličkou (21). Non–proteolytická aktivace spočívá v „odklopení“ prosegmentu, jehož kontinuita s molekulou proreninu zůstává zachována (obr. 2). Příslušnou konformační změnu bylo možno potvrdit navázáním monoklonální protilátky specifické pro aktivní místo reninu.
Obr. 2. Schematické znázornění proteolytické a non-proteolytické aktivace proreninu (dle 21) A – proteolytická aktivace, B – non-proteolytická aktivace Aog – angiotenzinogen, Ang I – angiotenzin I 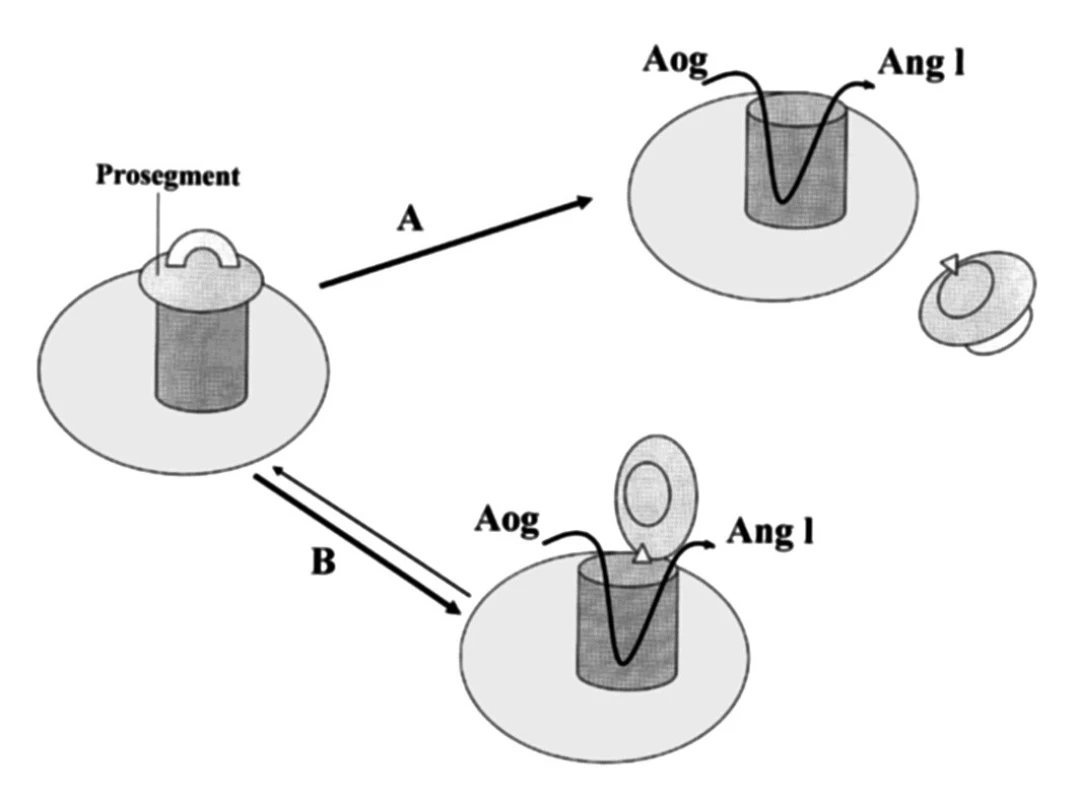
Non-proteolytickou aktivaci proreninu lze in vitro indukovat snížením pH (optimum 3,3) nebo expozicí chladu (kryoaktivace). Za fyziologických podmínek in vivo probíhá v plazmě spontánní non-proteolytická aktivace proreninu, ale jen u malého počtu molekul (méně než 2 %), přičemž mezi neaktivním a aktivním proreninem existuje dynamická rovnováha.
Velký zájem vzbudily práce japonských autorů, kteří prokázali, že při non-proteolytické aktivaci proreninu mají rozhodující úlohu dvě oblasti jeho prosegmentu – gate region a handle region, nověji označované jako decoy peptide region (22). Zanedlouho po tomto objevu byl v téže výzkumné laboratoři syntézován peptid se stejnou strukturou jako handle region (handle region peptide – HRP), který u zvířat s experimentálním diabetem bránil vzniku nefropatie a u spontánně hypertenzních potkanů měl preventivní účinek na rozvoj fibrózy myokardu (23, 24). Příznivé účinky tohoto peptidu se však nepodařilo potvrdit na jiných pracovištích a v současné době se diskutují možné příčiny kontroverzních nálezů (25).
(Pro)reninové receptory
Dosavadní představy o úloze systému renin-angiotenzin v tkáních získaly novou dimenzi, když Geneviève Nguyen v roce 2002 identifikovala povrchové buněčné receptory, které specificky váží prorenin a renin (26). V následujících letech se podařilo objasnit základní morfologické a funkční charakteristiky těchto receptorů, pro něž bylo zvoleno označení (pro)reninové a akronym (P)RR. V centru pozornosti jsou zejména dva souběžné účinky, a to zvýšení enzymatické aktivity navázaného proreninu nebo reninu a intracelulární signalizace nezávislá na angiotenzinu II.
(Pro)reninový receptor má pouze jednu transmembránovou doménu (obdobně jako receptory pro růstové faktory a na rozdíl od receptorů AT1 a AT2) a je spojen s fylogeneticky starým enzymem – vakuolární H+-ATPázou (obr. 3). Gen kódující (P)RR je lokalizován na chromosomu X, p11.4. Receptory (P)RR se vyskytují ve všech tkáních, relativně největší hustota byla zjištěna v mozku a v ledvinách, především v distálních tubulech, ale též v mezangiálních buňkách glomerulů (27). Skutečnost, že exprese receptorů (P)RR je mnohem vyšší během intrauterinního života, svědčí o jejich úloze při vývoji plodu. Receptory, jejichž cytoplazmatická i transmembránová doména je shodná s (P)RR, jsou lokalizovány na intracelulárních membránách a mají důležité homeostatické funkce (28). Povrchové ani intracelulární (pro)reninové receptory se nepodílejí na degradaci reninu.
Obr. 3. Schéma receptoru (P)RR spojeného s vakuolární H+-ATPázou (dle 27) 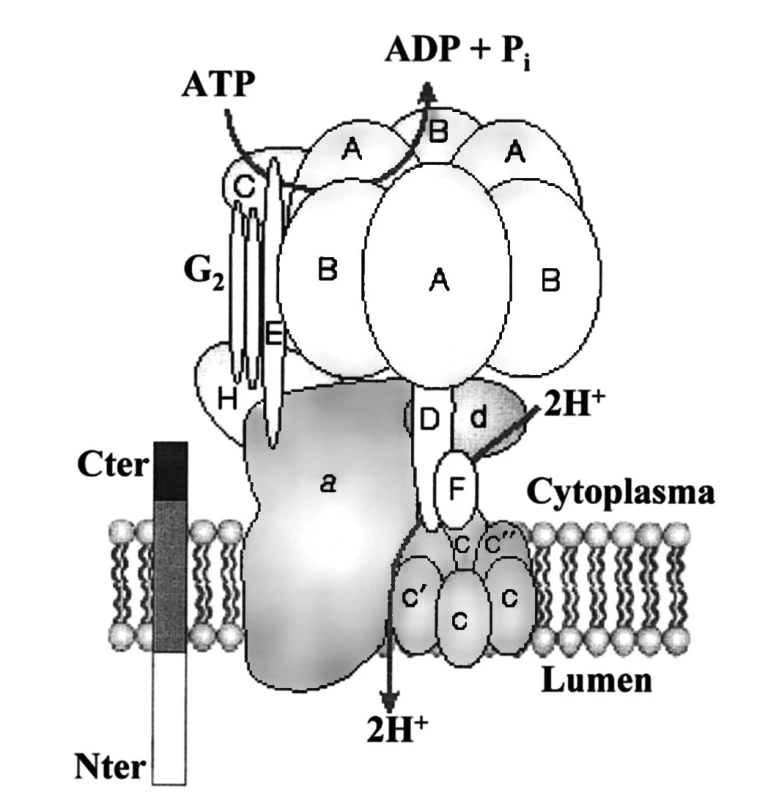
Výsledky experimentálních studií se shodují v tom, že prorenin má vyšší afinitu k receptorům (P)RR než renin, není však dosud známo, jak velké procento receptorů je za různých podmínek in vivo oběma enzymy obsazeno. Po navázání na receptor dochází ke konformační změně proreninu a k jeho non-proteolytické aktivaci. Množství angiotenzinogenu rozštěpeného aktivovaným proreninem plně odpovídá katalytickému účinku reninu, přičemž renin vázaný k receptoru (P)RR vykazuje několikanásobně větší enzymatickou účinnost než volný renin v cirkulaci (29).
Již v prvních pokusech s klonovanými receptory (P)RR bylo zjištěno, že navázání proreninu nebo reninu zahajuje nitrobuněčnou signalizaci s potenciálně negativními metabolickými účinky (26). Fosforylace cytoplazmatické domény receptoru má za následek aktivaci dvou enzymů ze skupiny MAPK (mitogeny aktivovaných kináz), a to ERK1 a ERK2, přičemž se nemění koncentrace kalciových iontů ani cyklického AMP. Postupně se podařilo objasnit interakce mezi komponentami signální dráhy ERK/MAPK (Ras, c-Raf, MEK, transkripční faktory v ribosomech a v buněčném jádru) a její vztah k dráze fosfatidyl-inozitol-3-kinázové (PI3K). K výsledným účinkům, na nichž se podílí uvolněný růstový faktor TGF-beta1, patří proliferace buněk, inhibice apoptózy a stimulace syntézy různých proteinů, včetně PAI1, fibronektinu a kolagenu I. Jako účinný regulační mechanismus byla identifikována krátká negativní zpětná vazba zprostředkovaná transkripčním faktorem PLZF (promyelocytic leukemia zinc factor protein). Přímý kontakt aktivovaného receptoru (P)RR s PLZF je nezbytným předpokladem pro zahájení intracelulární signalizace, ale následně se tento protein přemístí z cytoplazmy do buněčného jádra, kde se naváže na promotorovou oblast genu pro (P)RR a inhibuje jeho transkripci (30).
Vzhledem k obavám z nežádoucích účinků nadměrné stimulace receptorů (P)RR se v současné době zkoumají možnosti jejich farmakologické blokády, popřípadě omezení jejich exprese. V experimentech in vitro byly zkoušeny různé monoklonální protilátky a malé interferující RNA (31). Otázka, zda lze blokovat vazbu proreninu na receptor (P)RR shora zmíněným peptidem HRP, nebyla dosud s konečnou platností zodpověděna (32, 33).
Vliv antihypertenziv na systém renin-angiotenzin
Nejdéle známý je vzestup sekrece reninu vyvolaný diuretiky anebo antihypertenzivy s přímým vazodilatačním účinkem. Beta-blokátory sekreci reninu inhibují (34, 35). Dvě skupiny antihypertenziv, která v současné době zaujímají vedoucí postavení, tj. inhibitory ACE a blokátory receptorů AT1 pro angiotenzin II, ovlivňují systém renin-angiotenzin odlišným způsobem. Inhibice enzymatické aktivity ACE má za následek pokles tvorby angiotenzinu II a jeho plazmatické koncentrace, naproti tomu podávání sartanů je spojeno se zvýšenou koncentrací angiotenzinu II v plazmě i v tkáních, ale jeho účinky zprostředkované receptory AT1 jsou blokovány. V obou případech je utlumen shora zmíněný zpětnovazebný mechanismus, což má za následek značný vzestup sekrece reninu, plazmatické koncentrace reninu a plazmatické reninové aktivity. Během dlouhodobé léčby inhibitorem ACE dochází zpravidla k tomu, že se snížené plazmatické koncentrace angiotenzinu II i aldosteronu postupně vracejí k výchozím hodnotám (tzv. fenomén úniku). Rovněž u pacientů dlouhodobě léčených blokátory receptorů AT1 byl popsán návrat patologických hodnot aldosteronu v plazmě a v moči (36).
Potenciální výhody antihypertenzní léčby založené na přímé inhibici enzymatické aktivity reninu byly zvažovány již před 50 lety, ale k její realizaci vedla dlouhá cesta (37). Renin jako první článek enzymatického řetězce má za fyziologických i patologických situací rozhodující vliv na aktivitu celého systému. Dnes je známo, že přímé inhibitory reninu podstatně snižují koncentraci angiotenzinu I (a tím i angiotenzinu II) v plazmě i v tkáních, takže klesá plazmatická reninová aktivita, která je považována za nezávislý rizikový faktor kardiovaskulárních onemocnění i mikrovaskulárních komplikací diabetu. Jak již bylo uvedeno, tvorba angiotenzinu II ve většině tkání závisí na reninu renálního původu, který je neustále doplňován prostřednictvím krevního oběhu. Jestliže se přímý inhibitor reninu naváže na renin již v cirkulaci, do tkání vstupuje komplex renin-inhibitor reninu, který postupně nahradí aktivní renin. Ve srovnání s inhibitory ACE i s blokátory angiotenzinových receptorů mohou přímé inhibitory reninu ovlivnit koncentraci angiotenzinu II v tkáních dříve, účinněji a na delší dobu. Tato skutečnost má zvláštní význam v léčbě obézních pacientů s diabetem 2. typu. Na rozdíl od inhibitorů ACE neovlivňují přímé inhibitory reninu degradaci bradykininu.
Inhibice enzymatické aktivity reninu aliskirenem
Vzhledem k tomu, že aliskiren byl syntézován na podkladě výsledků krystalografických analýz a molekulárního modelování, optimálně odpovídá aktivnímu místu pro angiotenzinogen v enzymatické štěrbině reninu a vyznačuje se vysokou vazebnou afinitou (38). Stužkový model reninu s aktivním místem, kde se váže aliskiren, je znázorněn na obrázku 4. Aliskiren proniká též k aktivnímu místu spontánně otevřené molekuly proreninu a po navázání nedovolí, aby prosegment enzymatickou štěrbinu uzavřel. Proto se po podání aliskirenu postupně zvyšuje procento non-katalyticky aktivovaných molekul proreninu, které reagují s monoklonálními protilátkami proti aktivnímu místu reninu, jejich enzymatická aktivita však je kompletně blokována.
Obr. 4. Stužkový model reninu s enzymatickou štěrbinou, kde se váže aliskiren (dle 38) 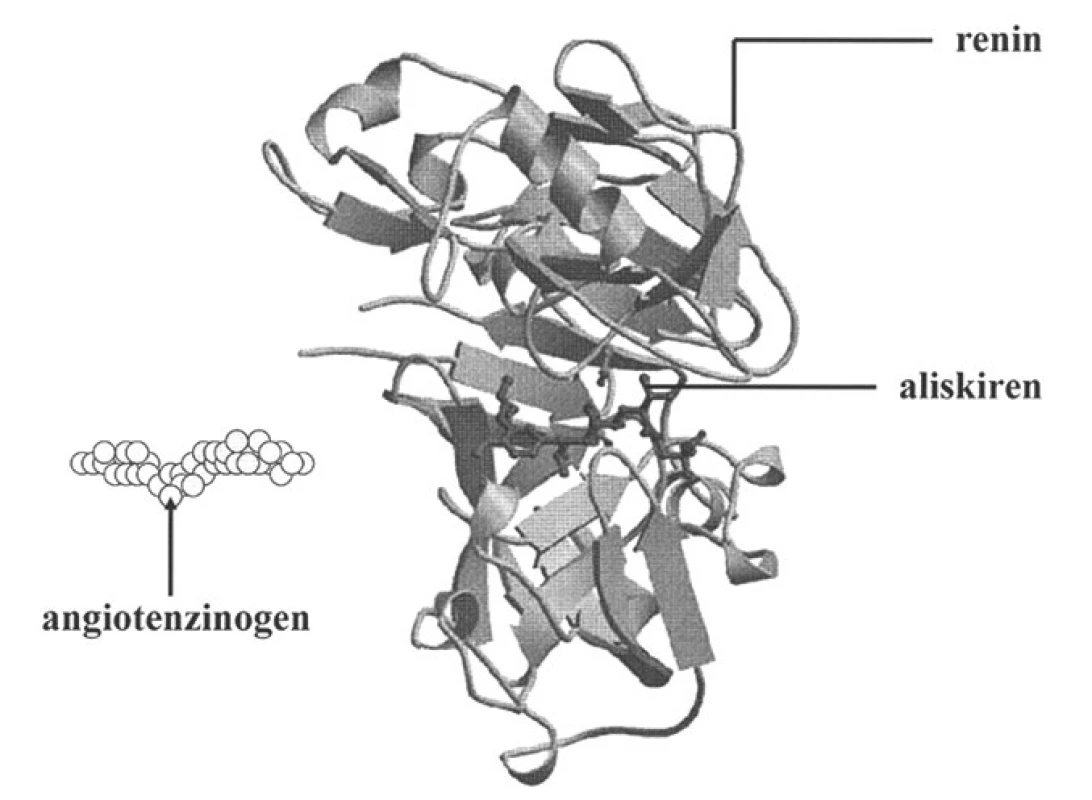
Již v prvních studiích prováděných na zdravých dobrovolnících se potvrdilo, že aliskiren snižuje koncentraci angiotenzinu II v plazmě i plazmatickou reninovou aktivitu (39). Ve srovnání s blokátorem angiotenzinových receptorů valsartanem vyvolal aliskiren větší a prolongovanější pokles aldosteronu, přičemž kombinace obou léků měla na angiotenzin II stejný vliv jako monoterapie aliskirenem (40). Ve velkém souboru pacientů s mírnou až středně závažnou hypertenzí došlo po osmi týdnech podávání aliskirenu k významnému poklesu plazmatické reninové aktivity, a to v závislosti na dávce o 69–75 % (41). Na podkladě analýzy některých klinických studií byla vyslovena domněnka, že reaktivní vzestup plazmatické koncentrace reninu by mohl příznivé účinky aliskirenu zrušit (42). Stechiometrické výpočty však prokázaly, že po běžné terapeutické dávce se v cirkulaci vyskytuje aliskiren v takovém množství, jaké stačí inhibovat enzymatickou aktivitu téměř všech molekul reninu, a to i v případě, že by se jejich koncentrace zvýšila stonásobně (43).
Aliskiren a intracelulární signalizace nezávislá na angiotenzinu II
V současné době se výzkum systému renin-angiotenzin soustřeďuje na otázku, zda vzestup plazmatické koncentrace reninu vyvolaný aliskirenem má negativní metabolické důsledky, které nesouvisejí s angiotenzinem II, nýbrž s intracelulární signalizací zprostředkovanou aktivovanými receptory (P)RR. Recentní studie prokázaly, že aliskiren neinterferuje s vazbou reninu či proreninu na tyto receptory ani neinhibuje signální dráhu, jak se původně předpokládalo (44, 45). Mimořádný zájem vzbudily výsledky experimentů na transgenních potkanech s farmakologicky indukovaným diabetem, které prokázaly, že aliskiren snižuje expresi receptorů (P)RR v glomerulech, tubulech a cévách kůry ledvin. Obdobný účinek se však nepodařilo prokázat v lidských mezangiálních buňkách kultivovaných in vitro (46).
Klinické studie se shodují v tom, že aliskiren zvyšuje plazmatickou koncentraci reninu více než inhibitory ACE a blokátory receptorů AT1 pro angiotenzin II (47). Při interpretaci výsledků imunoradiometrických metod používaných ke stanovení reninu je však třeba vzít v úvahu, že u pacientů léčených aliskirenem mohou být značně nadhodnoceny. Jak již bylo uvedeno, působením aliskirenu stoupá v plazmě podíl non-katalyticky aktivovaných molekul proreninu, na něž se protilátky proti aktivnímu místu reninu rovněž váží, takže je od reninu nelze odlišit. Z kvantitativních údajů o vazebné kapacitě receptorů (P)RR exprimovaných v buňkách hladkého svalu by bylo možné usuzovat, že in vivo dochází k vazbě ligandu na tyto receptory jen zřídka, a to i při vysokých hodnotách plazmatické koncentrace reninu (48). Lokální tkáňové koncentrace reninu a proreninu však nemusejí odpovídat hodnotám v cirkulaci, takže o skutečném počtu aktivovaných receptorů (P)RR v ledvinách, myokardu a dalších orgánech nelze získat spolehlivé informace. Se zřetelem na potenciální negativní účinky intracelulární signalizace je třeba vzít též v úvahu, že díky navázanému aliskirenu mají molekuly reninu a proreninu několikanásobně větší stabilitu (49).
V současné době existuje dostatek důkazů, že aliskiren příznivě ovlivňuje rizikové faktory, které se podílejí na vzniku a rozvoji závažných kardiovaskulárních a renálních onemocnění, a to přinejmenším stejně účinně jako inhibitory ACE a blokátory receptorů AT1. V již citované studii provedené na geneticky modifikovaných potkanech s experimentálním diabetem bránil aliskiren vzniku albuminurie, normalizoval krevní tlak a potlačoval expresi růstového faktoru TGF-beta (46). Podávání aliskirenu králíkům s geneticky podmíněnou hyperlipidémií zvýšilo tvorbu oxidu dusnatého a zmenšilo plochu aterosklerotických plátů v aortě; kombinace aliskirenu s valsartanem měla aditivní účinek (50). V jiné experimentální práci aliskiren snížil inzulínovou rezistenci u transgenních potkanů a zabránil vzniku morfologických změn v pankreatu (51). U myší s vazorenální hypertenzí aliskiren stabilizoval vulnerabilní sklerotické pláty, přičemž ve srovnání s irbesartanem přispěl k úpravě jednotlivých ukazatelů ve stejné nebo větší míře, kdežto podání atenololu nebo amlodipinu bylo v tomto směru zcela neúčinné (52).
Proti obavám z nadměrné stimulace receptorů (P)RR mluví též výsledky velkých klinických studií uskutečněných v rámci programu Aspire Higher (53). Aliskiren významně zmenšil exkreci albuminů močí u pacientů s diabetickou nefropatií již léčených losartanem (studie AVOID), vyvolal regresi hypertrofie levé komory u hypertoniků (studie ALLAY) a snížil hodnoty plazmatické koncentrace natriuretického peptidu NT-proBNP u pacientů s chronickým srdečním selháním (studie ALOFT). O těchto studiích již bylo v české literatuře opakovaně referováno. Další čtyři studie, které dosud probíhají, mají ověřit účinnost aliskirenu v prevenci kardiovaskulárních a renálních komplikací u pacientů s arteriální hypertenzí a diabetem 2. typu.
Závěr
Výsledky experimentálního výzkumu z posledních let přispěly k objasnění patogenetických mechanismů, jimiž systém renin-angiotenzin ovlivňuje vývoj závažných kardiovaskulárních a renálních onemocnění. V tomto směru je zvláště významná úloha angiotenzinu II v aterogenezi a trombogenezi. Ukazuje se, že systém renin-angiotenzin je daleko složitější, než se dříve předpokládalo. Nové objevy rozšířily též dosavadní představy o možnostech terapeutického a preventivního působení antihypertenziv, která tento systém na různých úrovních inhibují. Lze očekávat, že další výzkum přímých inhibitorů reninu přinese cenné poznatky pro klinickou medicínu.
Práce podporována výzkumným záměrem MŠMT ČR MSM 0021620820.
Adresa pro korespondenci:
prof. MUDr. Adolf Slabý, DrSc.
IV. interní klinika 1. LF UK a VFN
U Nemocnice 2, 128 08 Praha 2
fax: +420 224 923 524,
e-mail: adolf.slaby@vfn.cz
Zdroje
1. Horký K. Systém renin-angiotenzin a arteriální hypertenze. In: Marek J, et al. Endokrinní hypertenze. Praha: Galén 2004; 3–45.
2. Slabý A, et al. Aktivita reninu a angiotensináz v krvi z ledvinové žíly po podání angiotensinu. Čas Lék čes 1967; 106 : 232–236.
3. Chappell MC. Emerging evidence for a functional angiotensin-converting enzyme 2 – angiotensin-(1–7) – Mas receptor axis: More than regulation of blood pressure? Hypertension 2007; 50 : 596–599.
4. Santos RAS, et al. Recent advances in the angiotensin-converting enzyme 2 – angiotensin(1–7) – Mas axis. Exp Physiol 2008; 93 : 519–527.
5. Tipnis SR, et al. A human homolog of angiotensin-converting enzyme. Cloning and functional expression as a captopril-insensitive carboxypeptidase. J Biol Chem 2000; 275 : 33238–33243.
6. Donoghue M, et al. A novel angiotensin-converting enzyme-related carboxypeptidase (ACE2) converts angiotensin I to angiotensin 1–9. Circ Res 2000; 87: E1–E9.
7. Lieb W, et al. Association of angiotensin-converting enzyme 2 (ACE2) gene polymorphism with parameters of left ventricular hypertrophy in men. Results of the MONICA Augsburg echocardiographic study. J Mol Med 2006; 84 : 88–96.
8. Santos RAS, et al. Expression of an angiotensin-(1–7)-producing fusion protein produces cardioprotective effects in rats. Physiol Genomics 2004; 17 : 292–299.
9. Averill DB, et al. Cardiac angiotensin-(1–7) in ischemic cardiomyopathy. Circulation 2003; 106 : 2141–2146.
10. Campagnole-Santos MJ, et al. Cardiovascular effects of angiotensin-(1-7) injected into the dorsal medulla of rats. Am J Physiol 1989; 257: H324–H329.
11. Langeveld B, et al. Angiotensin-(1–7) attenuates neointimal formation after stent implantation in the rat. Hypertension 2005; 45 : 1–4.
12. Su Z, et al. Angiotensin-(1–7) inhibits angiotensin II-stimulated phosphorylation of MAP kinases in proximal tubular cells. Kidney Int 2006; 69 : 2212–2218.
13. Allred AJ, et al. Pathways for angiotensin-(1-7) metabolism in pulmonary and renal tissues. Am J Physiol Renal Physiol 2000; 279: F841–F850.
14. Kostenis E, et al. G-protein-coupled receptor Mas is a physiological antagonist of the angiotensin II type 1 receptor. Circulation 2005; 111 : 1806–1813.
15. Soler MJ, et al. Pharmacologic modulation of ACE2 expression. Curr Hypertens Rep 2008; 10 : 410–440.
16. Ferreira AJ, et al. The nonpeptide angiotensin-(1–7) receptor Mas agonist AVE 0991 attenuates heart failure induced by myocardial infarction. Am J Physiol Heart Circ Physiol 2007; 292: H1113–H1119.
17. Schweda F, et al. Renin release. Physiology 2007; 22 : 310–319.
18. Krop M, et al. Circulating versus tissue renin-angiotensin system: On the origin of (pro)renin. Curr Hypertens Rep 2008; 10 : 112–118.
19. Krop M, et al. Renin and prorenin disappearance in humans post-nephrectomy: Evidence of binding? Front Biosci 2008; 13 : 3931–3939.
20. Deinum J, et al. Increase in serum prorenin precedes onset of microalbuminuria in patients with insulin-dependent diabetes mellitus. Diabetologie 1999; 42 : 1006–1010.
21. Derkx FH, et al. Nonproteolytic “activation“ of prorenin by active site-directed renin inhibitors as demonstrated by renin-specific monoclonal antibody. J Biol Chem 1992; 267 : 22837–22842.
22. Suzuki F, et al. Human prorenin has “gate and handle“ regions for its non–proteolytic activation. J Biol Chem 2003; 278: 22217–22222.
23. Ichikara A, et al. Inhibition of diabetic nephropathy by a decoy peptide corresponding to the “handle“ region for nonproteolytic activation of prorenin. J Clin Invest 2004; 114 : 1128–1135.
24. Ichikara A, et al. Nonproteolytic activation of prorenin contributes to development of cardiac fibrosis in genetic hypertension. Hypertension 2006; 47 : 894–900.
25. Danser AHJ, et al. Spotlight on renin: The Renin Academy Summit: Advancing the understanding of renin science. J Renin Angiotensin Aldosterone Syst 2008; 9 : 119–122.
26. Nguyen G, et al. Pivotal role of the renin/prorenin receptor in angiotensin II production and cellular responses to renin. J Clin Invest 2002; 109 : 1417–1427.
27. Nguyen G, et al. Prorenin and (pro)renin receptor: A review of available data from in vitro studies and experimental models in rodents. Exp Physiol 2008; 93 : 557–563.
28. Bader M. Spotlight on renin: The second life of the (pro)renin receptor. J Renin Angiotensin Aldosterone Syst 2007; 8 : 205–208.
29. Campbell DJ. Critical review of prorenin and (pro)renin receptor research. Hypertension 2008; 51 : 1259–1264.
30. Schefe JH, et al. A novel signal transduction cascade involving direct physical interaction of the renin/prorenin receptor with the transcription factor promyelocytic zinc finger protein. Circulation Res 2006; 99: 1355–1366.
31. He M, et al. Inhibition of renin/prorenin receptor attenuated mesangial cell proliferation and reduced associated fibrotic factor release. Eur J Pharmacol 2009; 606 : 155–161.
32. Ichihara A, et al. Drug discovery for overcoming chronic kidney disease (CKD): New therapy for CKD by a (pro)renin-receptor-blocking decoy peptide. J Pharmacol Sci 2009; 109 : 20–23.
33. Danser AHJ. (Pro)renin receptors: Are they biologically relevant? Curr Opin Nephrol Hypertens 2009; 18 : 74–78.
34. Bühler FR, et al. Propranolol inhibition of renin secretion: A specific approach to diagnosis and treatment of renin-dependent hypertensive diseases. N Engl J Med 1972; 287 : 1209–1214.
35. Slabý A, et al. Beta-adrenergic blockade and plasma renin activity in borderline hypertension. Eur J Clin Pharmacol 1973; 6 : 145–149.
36. Yoneda T, et al. Aldosterone breakthrough during angiotensin II receptor blockade in hypertensive patients with diabetes mellitus. Am J Hypertens 2007; 20 : 1329–1333.
37. Staessen JA, et al. Oral renin inhibitors. Lancet 2006; 368 : 1449–1456.
38. Wood JM, et al. Structure-based design of aliskiren, a novel orally effective renin inhibitor. Biochem Biophys Res Commun 2003; 308 : 698–705.
39. Nussberger J, et al. Angiotensin II suppression in humans by the orally active renin inhibitor aliskiren: Comparison with enalapril. Hypertension 2002; 39: e1–e8.
40. Azizi M, et al. Hormonal and hemodynamic effects of aliskiren and valsartan and their combination in sodium-replete normotensive individuals. Clin J Am Soc Nephrol 2007; 2 : 947–955.
41. Nussberger J, et al. Plasma renin and the antihypertensive effect of the orally active renin inhibitor aliskiren in clinical hypertension. Int J Clin Pract 2007; 61 : 1461–1468.
42. Sealey JE, et al. Aliskiren, the first renin inhibitor for treating hypertension: Reactive renin secretion may limit its effectiveness. Am J Hypertens 2007; 20 : 389–391.
43. Danser AHJ, et al. The renin rise with aliskiren: It’s simply stoichiometry. Hypertension 2008; 51: e27–e28.
44. Schefe JH, et al. Prorenin engages the (pro)renin receptor like renin and both ligand activities are unopposed by aliskiren. J Hypertens 2008; 26 : 1787–1795.
45. Feldt S, et al. Prorenin and renin-induced extracellular signal-regulated kinase 1/2 activation in monocytes is not blocked by aliskiren or the handle-region peptide. Hypertension 2008; 51 : 682–688.
46. Feldman DL, et al. Effects of aliskiren on blood pressure, albuminuria, and (pro)renin receptor expression in diabetic TG (mRen-2)27 rats. Hypertension 2008; 52 : 130–136.
47. Campbell DC. Interpretation of plasma renin concentration in patients receiving aliskiren therapy. Hypertension 2008; 51 : 15–18.
48. Batenburg WW, et al. Prorenin and the (pro)renin receptor: Binding kinetics, signalling and interaction with aliskiren. J Renin Angiotensin Aldosterone Syst 2008; 9 : 181–184.
49. Batenburg WW, et al. Aliskiren-binding increases half life of renin and prorenin in rat aortic vascular smooth muscle cells. Arterioscler Thromb Vasc Biol 2008; 28 : 1151–1157.
50. Imanishi T, et al. Renin inhibitor aliskiren improves impaired nitric oxide bioavailability and protects against atherosclerotic changes. Hypertension 2008; 52 : 563–572.
51. Habibi J, et al. Renin inhibition attenuates insulin resistance, oxidative stress, and pancreatic remodeling in the transgenic Ren2 rat. Endocrinology 2008; 149 : 5643–5653.
52. Nussberger J, et al. Renin inhibition by aliskirene prevents atherosclerosis progression: Comparison with irbesartan, atenolol, and amlodipine. Hypertension 2008; 51 : 1306–1311.
53. Sever PS, et al. Managing cardiovascular and renal risk: The potential of direct renin inhibition. J Renin Angiotensin Aldosterone Syst 2009; 10 : 65–76.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článek Střízlivá inteligenceČlánek KnihaČlánek Laureáti Nobelovy cenyČlánek Vybrané souhrnyČlánek Spolek lékařů českýchČlánek AbstraktaČlánek Co vše lze říci o psoriáze
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Vybrané kurzy, stáže a semináře IPVZ – 1. pololetí roku 2010
- JAK SE HLÁSIT NA VZDĚLÁVACÍ AKCE IPVZ
- Střízlivá inteligence
- Kniha
- Laureáti Nobelovy ceny
- Renin, prorenin a přímý inhibitor reninu aliskiren
- Co vše lze říci o psoriáze
- Urokánová kyselina a imunosuprese
- Computed tomography laser mammography
- Pupilometrie jako bioindikátor účinku léčiv
- Možnosti využití stanovení minimální reziduální choroby u adenokarcinomu pankreatu pomocí metodiky real-time RT-PCR – pilotní studie
- Co poradit dospělým dětem rodičů s návykovou nemocí
- Padesát let od vzniku samostatné Farmakologické společnosti v Československu
- Patnáct cigaret stačí k poškození genů aneb jedna mutace průměrně po každé 15. cigaretě
- William Smellie – zakladatel moderního porodnictví
- Vybrané souhrny
- Spolek lékařů českých
- XIV. Novákovy traumatologické dny 2009
- Abstrakta
- Slavnostní seminář u příležitosti 60. výročí založení Kliniky nemocí z povolání Lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Hradec Králové
- 14. česko-slovenský psychiatrický sjezd
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Pupilometrie jako bioindikátor účinku léčiv
- Renin, prorenin a přímý inhibitor reninu aliskiren
- Abstrakta
- Urokánová kyselina a imunosuprese
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



