-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Hypogonadismus u mužů a jeho léčba
Male hypogonadism and its treatment
Male hypogonadism can be of various etiology and that reflects its clinical manifestation, diagnostics and treatment. Male hypogonadism leads not only to decreased fertility, but influences the cardiovascular system, mood changes, bone fragility, lipids and other metabolic functions. Diagnosis of hypogonadism can be cumbersome, as well as the choice of optimal hormonal supplementation. The aim of this article is to summarize the basics from symptoms, diagnosis and treatment of male hypogonadism.
Keywords:
male hypogonadism, testosterone, infertility
Autoři: Václav Hána; Mikuláš Kosák; Václav Hána jr.
Působiště autorů: 3. interní klinika – klinika endokrinologie a metabolismu 1. LF UK a VFN v Praze
Vyšlo v časopise: Čas. Lék. čes. 2017; 156: 258-265
Kategorie: Přehledový článek
Souhrn
Příčiny mužského hypogonadismu jsou různé a tím je dán rovněž jeho rozdílný klinický obraz, diagnostika i léčba. Hypogonadismus u mužů negativně ovlivňuje nejen plodnost, ale též psychiku, kardiovaskulární systém, pevnost skeletu, erytropoezu, proteosyntézu, lipidogram a řadu metabolických funkcí. Diagnostika může být v některých situacích obtížná a stejně tak volba optimálního léčebného preparátu vyžaduje určitou klinickou zkušenost. Cílem tohoto přehledu je poskytnout základy pro porozumění uvedenému tématu od symptomů přes diagnostiku až po léčbu a její přínosy i rizika.
Klíčová slova:
mužský hypogonadismus, testosteron, infertilitaÚVOD
Hypogonadismus je definován jako snížená funkce varlat v oblasti sekrece androgenů nebo spermiogeneze. V klinické praxi je nejčastěji posuzován deficit androgenů. Prevalence symptomatického hypogonadismu bez ohledu na etiologii se odhaduje na 2–13 % v populaci nad 40 let věku a velmi pravděpodobně často ani není diagnostikován (1, 2).
Hypogonadismus zaznamenává zvýšenou pozornost odborné i laické veřejnosti zejména v posledních dvou dekádách, protože deficitu androgenů je přisuzován podíl na projevech stárnutí. Tato myšlenka a možnost vcelku jednoduše testosteron organismu dodávat vedla k obrovskému nárůstu spotřeby testosteronu od konce 20. století, a to především v USA. V letech 2001–2011 došlo v důsledku přímé kampaně farmaceutických firem a zavedení konceptu andropauzy k trojnásobnému vzestupu preskripce testosteronových preparátů v USA (3). Přitom je z některých studií zřejmé, že není vždy laboratorně doložena jasná indikace k substituci androgeny a preskripce je podložena jen nespecifickými symptomy.
Z pohledu laické veřejnosti vede cesta od podezření k nákupu preparátů, avšak z hlediska evidence-based medicine je situace složitější, a to jak z hlediska hodnocení příčiny hypogonadismu, tak i volby odpovídající léčby a potenciálních rizik léčby. Tento článek má poskytnout základní informace o definování hypogonadismu; off-label podávání androgenů není předmětem tohoto sdělení.
ETIOLOGIE HYPOGONADISMU
Rozlišujeme centrální, periferní a smíšené formy hypogonadismu a formy vrozené a získané.
Centrální hypogonadismus
Centrální etiologii lze ještě rozdělit na hypotalamickou a hypofyzární (tab. 1 a 2).
Tab. 1. Vrozené příčiny centrálního hypogonadismu, poruch sekrece a účinků hormonů hypotalamu a hypofýzy 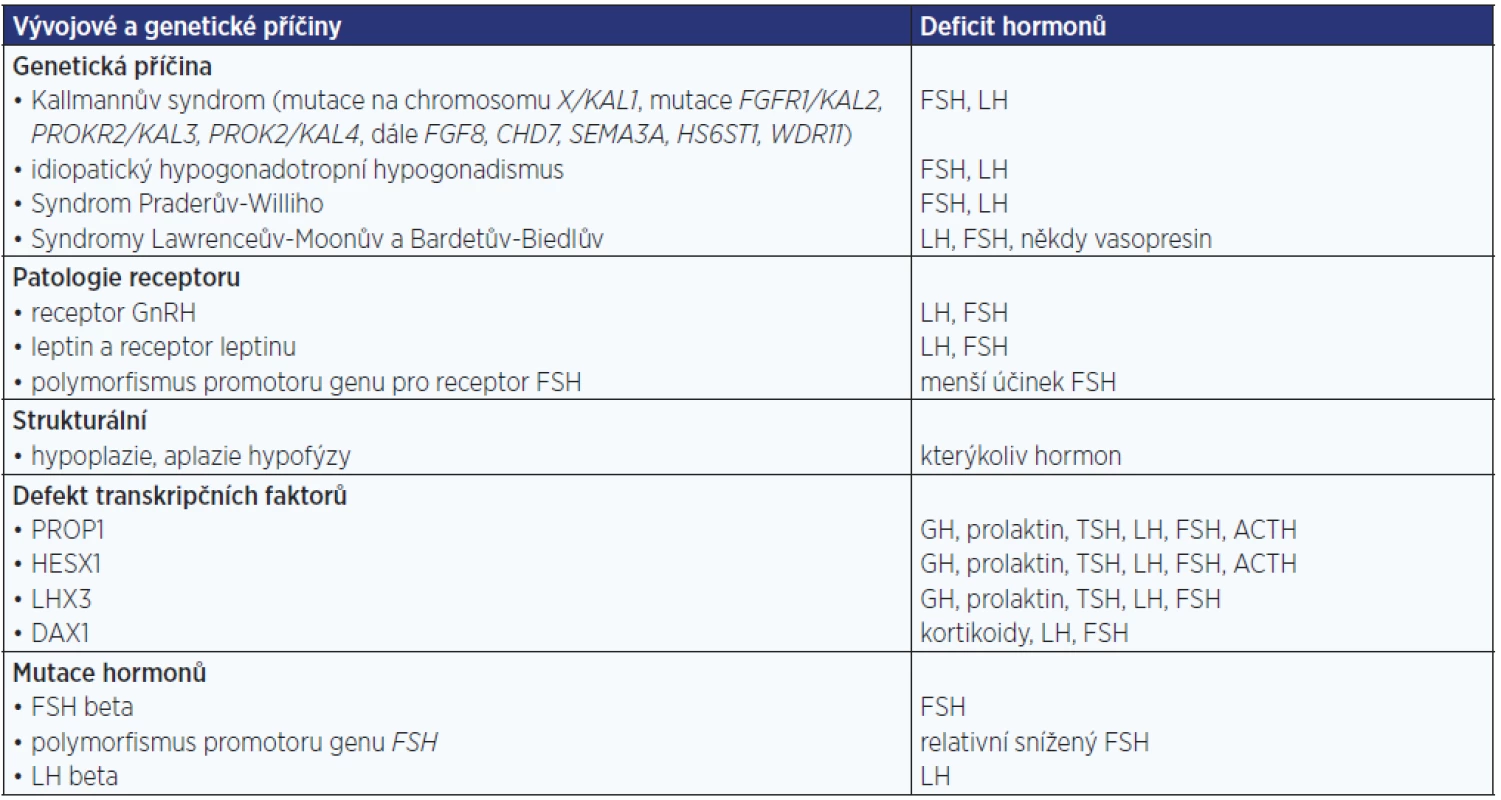
Tab. 2. Získané příčiny hypopituitarismu (modifikováno dle: Hána, 2014 [36]) ![Získané příčiny hypopituitarismu (modifikováno dle: Hána, 2014 [36])](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/d68d81f12a85ef0e959903dc7f79259f.png)
Nejčastější organickou centrální příčinou je hypofyzární adenom a jeho léčba.
Jak je zmíněno i v textu tabulky, velkou skupinu hypogonadismů tvoří funkční poruchy gonadotropní osy spojené s jinými celkovými závažnými onemocněními. Typická je v dnešní době obezita těžšího stupně, která bývá spojena s vyšší konverzí testosteronu aromatázou v tukové tkáni na estradiol a ten na centrální úrovni suprimuje sekreci GnRH a LH a FSH. U obézních se uplatňují i další vlivy jako zvýšení celkových zánětlivých parametrů (např. IL-1β, TNF-α) a leptinu, které též inhibují celou osu (4).
Z klinického hlediska je nejsložitější posuzování snížených koncentrací testosteronu v souvislosti se závažnými komorbiditami (obezita, těžší celkové onemocnění, depresivní stavy a další) a s vyšším věkem. Pokud se hodnotí jen kritéria biochemická (celkový testosteron < 10 nmol/l), pak je zjišťován biochemický hypogonadismus až u 23 % mužů ve věku 40–79 let. Při současném hodnocení biochemických kritérií (celkový testosteron < 8 nmol/l nebo 8–11 nmol/l a současně volný testosteron < 220 pmol/l) i klinických projevů deficitu androgenů, u kterých byla prokázána statisticky významná závislost na hladině testosteronu (pokles libida a ranních erekcí, erektilní dysfunkce), prokazujeme tento hypogonadismus s pozdním nástupem (LOH – late-onset hypogonadism) jen u 2 % neselektovaných mužů v uvedené věkové kategorii. Takto doporučená kritéria pro LOH vyplynula z European Male Aging Study (5)
Periferní hypogonadismus
Příčiny vrozeného i získaného periferního hypogonadismu jsou uvedeny v tab. 3.
Tab. 3. Primární (periferní, hypergonadotropní) hypogonadismus u mužů (modifikováno dle: Hána, 2014 [36]) ![Primární (periferní, hypergonadotropní) hypogonadismus u mužů (modifikováno dle: Hána, 2014 [36])](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/7f3dab25db02eb7510ef95298f80cfa5.png)
Nejčastější příčinou mužského hypogonadismu je Klinefelterův syndrom, jehož prevalence se odhaduje na 1500/1 milion mužů. Některé studie ukazují, že až 2/3 mužů s Klinefelterovým syndromem nejsou diagnostikovány vzhledem k nenápadnému fenotypu, v němž je konstantní jen malá velikost varlat (do 25 mm), a protože se varlata dnes při standardním klinickém vyšetření převážně nevyšetřují.
KLINICKÝ OBRAZ
Klinické projevy hypogonadismu jsou závislé na věku (resp. období prenatálního vývoje), ve kterém porucha vznikla, a na porušení jedné či obou funkcí varlat (produkce spermií a testosteronu). Při kompletním deficitu testosteronu již od prvního trimestru se vyvíjí ženský zevní genitál. Pokud je parciálně zachovaná sekrece testosteronu v prvním trimestru prenatálního vývoje, je projevem neúplná virilizace zevního genitálu – od mikropenisu po hypospadii při pouze mírném deficitu. Pokud vznikne hypogonadismus v dětství, je jeho projevem chybějící nebo inkompletní puberta. Objem testes je menší, penis je kratší, je snížené množství svalové hmoty, nevyvíjí se charakteristické ochlupení a mužská vlasová hranice, je zpomalený růst vousů, nevyvíjí se larynx a tím zůstává i vyšší poloha hlasu. Pro prepubertálně vzniklý hypogonadismus je také charakteristický eunuchoidní habitus s tělesnou disproporcí (výška dolní části těla po pubis je delší než horní část a rozpažené končetiny o více než 5 cm přesahují celkovou tělesnou výšku).
V dospělosti vzniklý hypogonadismus se nejčastěji manifestuje sexuálními poruchami – snížením libida, poruchami erekce (poklesem kvality a frekvence erekce) a infertilitou. Dále se může deficit testosteronu projevit poklesem vitality, dysthymií se sklonem k depresím, zhoršením paměti a schopnosti koncentrace. Pokles objemu svalové hmoty a úbytku vousů (snížená frekvence holení) se vyvíjí nekonstantně a s delší latencí od vzniku deficitu. Manifestace hypogonadismu v dospělosti je také závislá na délce trvání deficitu. Pokles výkonnosti a libida se dostaví již v řádu dnů až týdnů, zatímco úbytek ochlupení, svalové hmoty a kostní denzity vzniká v delším časovém horizontu (řádově roky), přičemž zaleží samozřejmě také na závažnosti deficitu. Návaly horka a pocení se vyskytují jen v některých případech, typicky v počátečních stadiích a při náhlém vzniku (například po kastraci).
Kromě výše dotčených efektů má testosteron řadu metabolických účinků – na erytropoezu, tukovou tkáň, kost, metabolismus lipidů, proteinů i sacharidů. Dlouhodobý deficit tedy vede i k projevům daným absencí těchto účinků, jako je osteoporóza, anemie (normocytární, normochromní), tělesné složení (abdominální obezita) atd. Při fyzikálním vyšetření mužů s hypogonadismem vzniklým v dospělosti můžeme (nekonstantně) zjistit redukci ochlupení. Změna objemu varlat při hypogonadismu vzniklém v dospělosti nastává spíše u primárního hypogonadismu a bývá spojena s postižením semenotvorných kanálků, jež tvoří největší objem testes. U sekundárních poruch je redukce objemu varlat obvykle minimální. Redukce objemu prostaty při hypogonadismu je také nekonstantním nálezem. Gynekomastie jako projev hypogonadismu je typicky spojena s primárním hypogonadismem.
Řada z uvedených symptomů mužského hypogonadismu je poměrně nespecifická. Screeningové vyšetření na nedostatek testosteronu se neukázalo být ekonomicky efektivní. Dle americké Endocrine Society je vhodné pomýšlet na deficit testosteronu v konkrétních situacích (tab. 4) (2).
Pro zhodnocení přítomnosti symptomů mužského late-onset hypogonadismu existuje také řada dotazníků (např. AMS – Aging Male Symptom Score; ADAM – Androgen Deficiency in Aging Male), nicméně pro nízkou specificitu nejsou doporučeny pro používání v praxi (6).
Tab. 4. Stavy spojené s vysokou prevalencí nízkého testosteronu a ve kterých je doporučeno provést stanovení sérového testosteronu. 
LABORATORNÍ DIAGNOSTIKA
Základem diagnostiky mužského hypogonadismu je – vedle rozpoznání klinických příznaků deficitu testosteronu, které jsou však do určité míry nespecifické – laboratorní stanovení. Hlavním biochemickým parametrem je koncentrace celkového testosteronu v krevním séru. Vzhledem k fyziologické diurnální variabilitě jeho sekrece je třeba odběr provést v ranních hodinách (konkrétně mezi 8. a 10. hodinou), kdy sekrece testosteronu fyziologicky dosahuje vrcholu. V případě snížené hladiny testosteronu (< 300 ng/dl = 10,5 nmol/l) je třeba provést minimálně 1, ale lépe 2 kontrolní odběry. Za jednoznačně nízkou hodnotu je považována hodnota celkového testosteronu < 7 nmol/l, naopak hodnota > 12,5 nmol/l s velkou pravděpodobností vylučuje deficit testosteronu (7).
Nezbytnou součástí laboratorního vyšetření při podezření na hypogonadismus je kromě stanovení testosteronu také stanovení hladiny gonadotropinů. To je zásadní k objasnění příčiny – zda jde o primární, nebo sekundární hypogonadismus, přičemž zvýšená koncentrace LH či FSH nad normu dle konkrétní laboratoře (resp. > 8 IU/l) svědčí pro primární (periferní) hypogonadismus, naopak nízká či normální hodnota LH a FSH při nízkém testosteronu svědčí pro sekundární (centrální) příčinu. Stanovení gonadotropinů by mělo být nedílnou součástí vyšetření při podezření na hypogonadismus současně s testosteronem i z toho důvodu, že poměrně velké procento pacientů s Klinefelterovým syndromem má, zejména v nižším věku, normální hladinu testosteronu (v dolní polovině normy) a k diagnóze nás tak přivede právě zvýšená koncentrace gonadotropinů.
Dosud nedořešenou otázkou je problematika norem pro specifické skupiny. Konkrétně zda je pokles testosteronu s věkem fyziologickým jevem, nebo zda je nižší celkový testosteron ve vyšším věku dán komorbiditami. Ve studii Massachusetts Male Aging Study s neselektovanou skupinou náhodně vybraných mužů byly stanoveny dolní hranice pro testosteron (2,5. percentil) dle věkových skupin: 8,7 nmol/l pro muže mezi 40. a 49. rokem, 7,5 nmol/l pro věk 50–59 let, 6,8 nmol/l pro 60–69 let a 5,4 nmol/l pro věkovou skupinu 70–79 let. Na druhou stranu ve stejné kohortě mělo až 50 % mužů ve věku 70–79 let hladinu testosteronu > 15,1 nmol/l (8). Stejně tak není jasné, zda ztráta diurnální variability sekrece testosteronu je fyziologickým projevem stárnutí, či nikoliv. Zdraví jedinci s dobrou fyzickou kondicí totiž mají zachovanou diurnální rytmicitu sekrece testosteronu i v 7. dekádě života.
Celkový sérový testosteron je hlavní sledovaný parametr, nicméně v řadě situací může být hladina celkového testosteronu ovlivněna změnou vazebných proteinů – zejména globulinu vážícího pohlavní hormony (SHBG – sex hormone-binding globulin), na který se váže cca 45 % testosteronu poměrně silnou vazbou na rozdíl od slabší vazby albumin – testosteron, která představuje asi 50 % testosteronu. Volnou frakci tvoří 0,5–3 % celkového testosteronu. Mezi stavy, u kterých dochází ke zvýšení hladiny SHBG, patří: věk, deficit androgenů, léčba estrogeny, tyreotoxikóza, jaterní cirhóza, deficit růstového hormonu. Naproti tomu ke snížení vedou hyperinzulinemie, obezita, léčba androgeny, hypotyreóza, hyperkortisolismus, nefrotický syndrom, akromegalie a vrozené genetické příčiny.
Přesné stanovení volné (biologicky aktivní) frakce testosteronu se provádí pomocí tzv. ekvilibrační dialýzy (která se kombinuje k dosažení přesnosti s metodou LC-MS/MS), což je však pro svoji náročnost postup v praxi nepoužívaný. Běžně dostupné imunoanalytické metody stanovení volného testosteronu mají rozdílnou spolehlivost a jejich přínos při srovnání se stanovením celkového testosteronu je sporný; veškerá existující doporučení tak nedoporučují volný testosteron takto stanovený v klinické praxi využívat.
Alternativně lze stanovovat hladinu „biologicky dostupného testosteronu“ (bioavailable testosterone), tedy volného testosteronu a frakce testosteronu vázaného na albumin. K odhadu volné frakce testosteronu lze také použít různé matematické modely. K těm patří tzv. free androgen (testosteron) index (FAI), který je však poměrně nespolehlivý a má své uplatnění spíše při hodnocení hyperandrogenních stavů u žen. Pokud chceme vypočítat hodnotu volného testosteronu, pak je pro praxi nejvhodnější vzorec vycházející z vazebné konstanty testosteronu k SHBG a albuminu, který dobře koreluje s hladinou volného testosteronu získanou pomocí ekvilibrační dialýzy (9). Výpočet volného testosteronu lze provést řadou dostupných vzorců. Odhad volného testosteronu lze stanovit např. podle tohoto jednouchého vzorce (10):
volný testosteron (% z celkového testosteronu) = 6,11 – 2,38 log10(SHBG)
Komplikovanější výpočet biologicky dostupného a volného testosteronu podle Vermeulenovy rovnice lze provést po zadání hodnoty celkového testosteronu, SHBG a albuminu na volně dostupném on-line kalkulátoru na stránkách International Society for the Study of the Ageing Male (www.issam.ch).
Vedle samotné koncentrace testosteronu v krvi je důležitým faktorem ovlivňujícím účinek testosteronu ve tkáních citlivost androgenního receptoru. To je samozřejmě obtížné kvantifikovat běžnými laboratorními metodami, nicméně jednou z metod hodnocení polymorfismu receptoru pro androgeny je stanovení počtu tripletů CAG, resp. GGC. Dle řady prací existuje negativní korelace mezi počtem tripletů CAG a biologickým účinkem testosteronu včetně efektu substituční léčby.
Kromě hodnocení deficitu testosteronu je nedílnou součástí diagnostiky mužského hypogonadismu i hodnocení fertility. Základem je samozřejmě hodnocení spermiogramu dle kritérií WHO. Zjištěné parametry spermiogramu u konkrétního jedince však, podobně jako koncentrace testosteronu, vykazují intraindividuální variabilitu. K hodnocení mužské fertility pomocí spermiogramu by tak ideálně bylo vhodné vycházet ze 3 vzorků odebraných za definovaných podmínek, přičemž hodnocení by mělo být prováděno ve stejné laboratoři. Kromě klasických parametrů analýzy ejakulátu jsou nově zkoumány např. známky poškození DNA. Existují snahy najít další markery mužské fertility, nicméně například v experimentálních pracích používaný inhibin B nemá v klinické praxi očekávaný přínos.
Genetické vyšetření používáme jednak v diagnostice příčiny hypogonadismu v případě periferního hypogonadismu (vyšetření karyotypu při podezření na Klinefelterův syndrom), jednak při suspekci na geneticky podmíněný hypogonadotropní hypogonadismus (tab. 1).
Tab. 5. Fyziologické hodnoty relevantních hormonů používané na pracovišti autorů 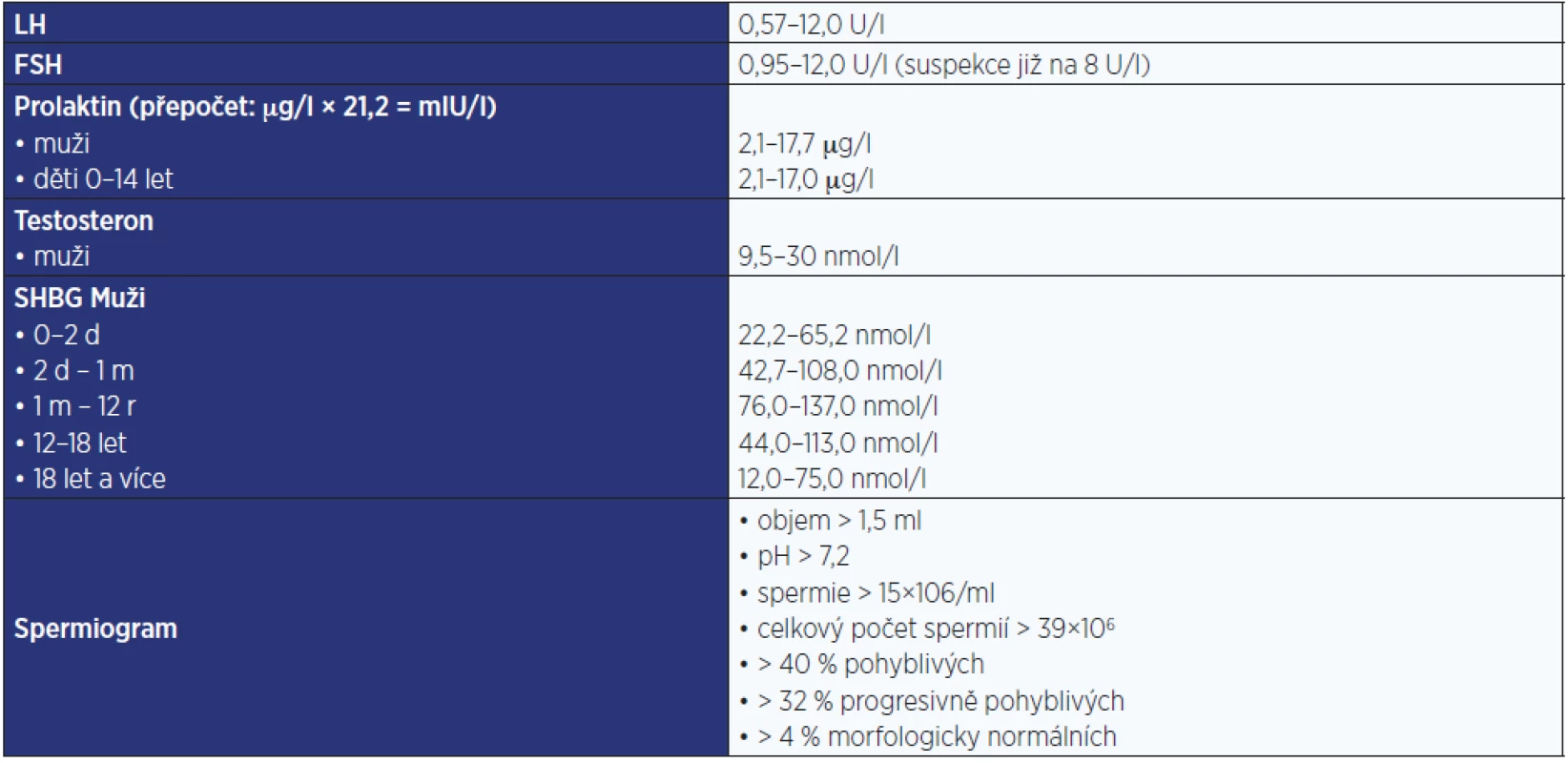
LÉČBA HYPOGONADISMU U MUŽŮ
Cílem léčby mužského hypogonadismu je převážně zajištění substituce androgeny. Méně často je cílem dosažení fertility.
Substituce androgeny
Podávání androgenů je indikované u každého pacienta s prokázaným deficitem androgenů, pokud nelze dosáhnout úpravy hypogonadismu jiným způsobem (například léčbou hyperprolaktinemie D2 agonisty) a pokud nejsou přítomny kontraindikace této léčby. U těžkého deficitu androgenů je obvykle příčina známa. U hypogonadismu s pozdním nástupem (LOH) je indikace k léčbě dána nejen biochemickými kritérii, ale současně i přítomností klinických příznaků, u nichž je prokázaná závislost na koncentracích testosteronu (viz etiologie hypogonadismu výše). U pacientů s hypogonadismem způsobeným závažnými komorbiditami je nutné indikaci k zahájení léčby posoudit v souvislostech se základním onemocněním a tíží deficitu a zvážit hodnocení efektu i délku léčby (např. při onemocnění HIV s hubnutím). Lze-li, je vhodné zaměřit základní léčebná opatření na příčinu – například na léčbu obezity.
Cílem substituční léčby deficitu androgenů je zajištění jejich klinických a metabolických účinků v celém jejich spektru (viz klinické projevy deficitu androgenů), obnovení kvality života a předcházení důsledkům dlouhodobého nedostatku androgenů (osteoporóza a podobně). Přípravky uvedené v tab. 6 jsou k dispozici v České republice.
Jednotlivé formy podání i preparáty mají své výhody a nevýhody. U muskulárně podávaných preparátů, které vyžadují častější aplikaci, se setkáváme s výraznějším kolísáním hladin testosteronu. Nejmenší je u testosteron-undekanoátu aplikovaného i. m. jednou za 3 měsíce, ale vyžaduje podání kvalifikovaným personálem (sestrou) a mimořádně vzácně je popisováno riziko tukové mikroembolizace do plic a anafylaxe. U transdermálních preparátů je výhodná vlastní aplikace pacientem, menší fluktuace hladin testosteronu. Je však potřeba upozornit na možnou významnou variabilitu v transdermální absorpci gelů a dle kontrol koncentrace testosteronu dávkování upravit. Jako nežádoucí účinek se může objevit podráždění pokožky, případně může dojít k přenosu gelu na partnerku.
I když v ČR nejsou na trhu transdermální náplasti, ve světě jsou používány. Je u nich popisována iritace pokožky až u 1/3 pacientů a podobně jako u gelů je potřeba dávkování upravit dle klinického obrazu a koncentrací testosteronu. Na trh přišly nové gelové přípravky s vyšší koncentrací testosteronu a lepší tolerancí (Fortesta 2% gel, Testocur 2,5% gel, Androforte 5), případně testosteron v roztoku k aplikaci axilárně (Axiron). Ve Francii a Belgii je k dispozici gel s dihydrotestosteronem. Perorální preparát testosteron-undekanoátu je potřeba podávat s jídlem s obsahem tuku, aby došlo k lepší resorpci. Ve vývoji je dle literárních zpráv nově upravený preparát testosteron-undekanoátu k perorálnímu podání, který bude zajišťovat vlastní emulgaci.
Dále jsou mimo ČR k dispozici preparáty testosteronu s resorpcí přes sliznici dutiny ústní (Striant).
Tab. 6. Androgeny k substituční léčbě v České republice 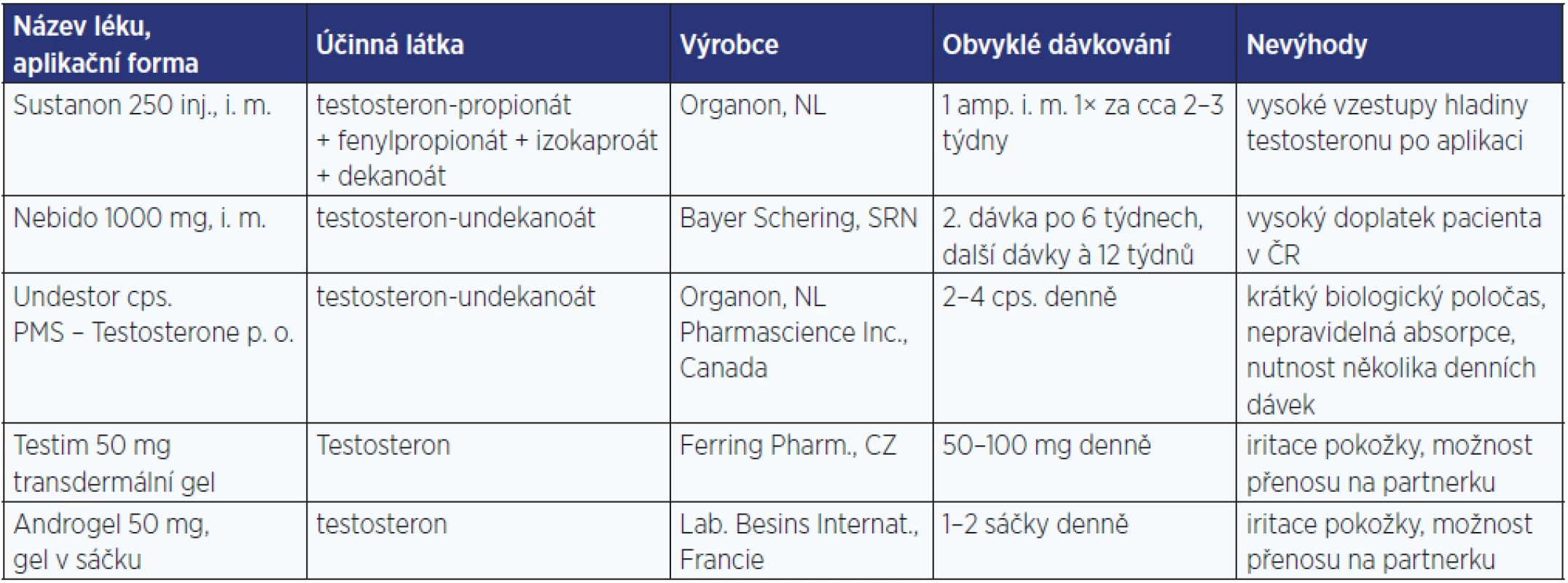
(podle: Hána, 2014 [36]) Léčba infertility
Fertilitu lze farmakologicky indukovat u centrálních forem hypogonadismu. U hypotalamické formy (např. u Kallmannova syndromu) můžeme indukovat spermiogenezi podáváním GnRH nebo preparátů s účinkem LH a FSH. U hypofyzární etiologie lze použít pouze indukci pomocí preparátů s účinkem LH a FSH. V některých případech (spíše při velikosti testes > 8 cm2 a s pozdějším nástupem hypogonadismu) někdy stačí samotný efekt LH. Chceme-li podávat ke stimulaci GnRH, je nutné zajistit podávání pulzatilně pomocí pumpy. V ČR není tolik vhodných pacientů, takže z ekonomických důvodů není možné tuto léčbu GnRH zajistit. Vzácnou indikaci k léčbě FSH představují jedinci s polymorfismem promotoru genu FSH nebo genu pro receptor FSH, kteří mají normální hormonální spektrum, ale na nedostatečné spermiogenezi se uplatňuje nedostatečný efekt „relativně“ nižšího FSH (v pásmu normy) nebo menší efekt FSH a z něho vyplývající snížená spermatogeneze, resp. zhoršená fertilita (11–13).
Léčba preparáty s účinky gonadotropinů vyžaduje dobrou compliance a trpělivost pacienta, protože se aplikují 2–3× týdně, medián délky léčby do dosažení prvních spermií v ejakulátu je cca 7–8 měsíců a do dosažení spontánní gravidity 28,2 měsíce (15). Efektivitu léčby a zkrácení doby do dosažení gravidity lze zlepšit kryokonzervací spermií a využitím metod asistované reprodukce.
K indukci fertility u pacientů s kongenitálním deficitem gonadotropinů se ukazuje jako výhodné předléčení 2 měsíce preparátem s účinkem FSH před zahájením léčby hCG. Tento postup vede k rychlejší indukci Leydigových buněk i spermiogeneze (16).
V tab. 7 jsou uvedeny způsoby léčby fertility. Léčba GnRH, hCG (účinek LH), hMG (účinek FSH + mírně LH), rhFSH, D2 agonisty (při hyperprolaktinemii) mají jednoznačně prokázané pozitivní výsledky u jasných centrálních forem. Léčba selektivními modulátory estrogenních receptorů (SERM) a inhibitory aromatázy (IA) patří do kategorie empirické léčby založené na určitých studiích s pozitivními výstupy a je podávána zejména u idiopatické infertility. U těchto preparátů chybí výsledky dvojitě zaslepených placebem kontrolovaných studií a ve většině případů jde o léčbu off-label (výjimku představuje klomifen, který má schválení v ČR i pro muže, v jiných zemích však nikoliv). Vzhledem k indikaci léčby je pravděpodobné, že nikdy nebude možné uskutečnit zaslepené placebem kontrolované studie na dostatečně velkém vzorku jedinců (odhaduje se, že by bylo potřeba provést studii se 700 pacienty). V praxi jsou i preparáty z těchto skupin podávány a z metaanalýzy studií se SERM autoři došli k závěru, že jako empirická léčba pro idiopatickou mužskou infertilitu mohou zvýšit počet spontánních gravidit, zvýšit koncentraci spermií a motilitu spermií (17). Léčba inhibitory aromatáz je teoreticky indikovaná u pacientů s oligospermií se sníženým poměrem testosteron/estradiol. Placebem kontrolované zaslepené studie v tomto směru však chybí a lze těžko předpokládat, že se je někdy podaří na dostatečně velkém vzorku pacientů uskutečnit.
Tab. 7. Farmakologická léčba infertility (některé dávky modifikovány na podmínky v ČR) 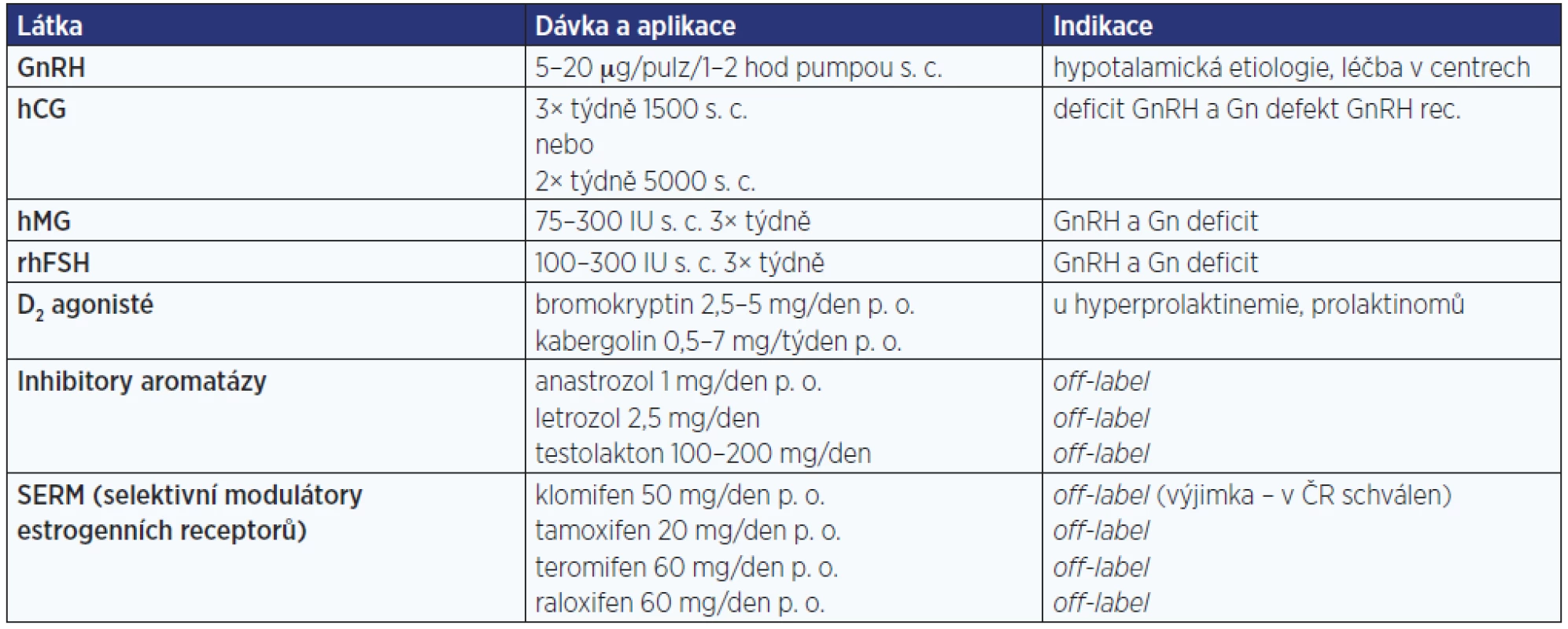
Jestliže se nedaří dosáhnout gravidity přirozenou cestou, bývá indikovaná mikroskopická extrakce spermií a užití dalších metod asistované reprodukce. Před extrakcí spermií je jednoznačně indikované dostatečně dlouhé podávání gonadotropinů u hypogonadotropního hypogonadismu (vývoj spermie trvá téměř 3 měsíce). Na bázi empirie jsou někdy podávány SERM a IA u neobstrukční oligoastenospermie.
Určitým doporučením pro praxi může být publikovaný názor prof. Anawalta na volbu jednotlivých postupů u subfertilních pacientů různých skupin (18): Při deficitu gonadotropinů (nízký testosteron, Gn nízké nebo na dolní hranici normy) je jednoznačné podávání gonadotropinů. Není však indikované u idiopatické infertility nebo periferní léze. U obézních je základem léčby redukce hmotnosti změnou životního stylu, případně s pomocí bariatrické chirurgie. Někdy může být vhodné podání inhibitoru aromatáz u obézních při nižším poměru estradiol/testosteron (19). Potenciálním rizikem IA je pokles estradiolu a možný negativní vliv na skelet, a nedoporučuje se proto podávání IA déle než 1 rok. Při abúzu anabolik po jejich následném vysazení mohou přetrvávat nízké gonadotropiny a zde mohou pomoci gonadotropiny nebo SERM. U iatrogenního Cushingova syndromu nebo při léčbě opioidy, když je není možné vysadit, lze zkusit gonadotropiny, IA či SERM (18)
BENEFITY LÉČBY ANDROGENY U HYPOGONADÁLNÍCH MUŽŮ
Při léčbě androgeny u hypogonadálních mužů lze očekávat zlepšení libida, erektilní funkce, svalové síly a tělesného složení (pokles tukové hmoty, nárůst netukové hmoty, zlepšení kostní denzity), stimulaci erytropoezy a zlepšení psychiky, případně paměti a celkové zlepšení kvality života.
RIZIKA LÉČBY ANDROGENY
Rizika androgenní léčby zahrnují polyglobulii, vzestup prostatického specifického antigenu a zhoršení stávajících onemocnění prostaty (včetně benigní hyperplazie prostaty), gynekomastii, kožní projevy (zvýšená tvorba mazu a akné a podráždění pokožky u transdermálních preparátů), případně zhoršení syndromu spánkové apnoe. Exogenní podávání androgenů vede k útlumu gonadotropní osy a spermiogeneze, a je proto kontraindikované u mužů, jejichž cílem je fertilita.
Nejvíce informací je ze 3 oblastí potenciálních nežádoucích příhod: kardiovaskulárních, prostatických a erytropoezy.
Léčba androgeny a kardiovaskulární účinky
Studie se zdravými muži prokázaly, že vyšší koncentrace endogenního testosteronu je spojena s lepším kardiovaskulárním profilem, jako jsou vyšší hladiny HDL cholesterolu a nižší TK (20). Také metaanalýza studií starších mužů ukázala, že nízké koncentrace endogenního testosteronu jsou asociovány se zvýšeným rizikem kardiovaskulární mortality (22). To potvrdily i další studie.
Před několika lety ovšem byly publikovány studie (23–26), které poukázaly na zvýšené kardiovaskulární riziko u mužů, kterým byl předepsán testosteron. Tyto studie vyvolaly velký ohlas v odborném i v populárním tisku a americký Úřad pro kontrolu léků a potravin (FDA) doplnil k možným rizikům i varování před zvýšeným výskytem kardiovaskulárních onemocnění (včetně infarktu myokardu a cévní mozkové příhody) při léčbě testosteronem a vyhlásil plán zhodnocení kardiovaskulární bezpečnosti při léčbě testosteronem. Tyto studie vyvolaly silnou reakci ze strany oponentů, kteří poukázali na metodologické i statistické nedostatky a zpochybnili jejich závěry (vysoký věk pacientů a závažné komorbidity, malý a nepřesně definovaný soubor pacientů, design studie nebyl zaměřen na KV rizika a další). Podrobná metaanalýza velkého počtu studií ukázala na nezvýšené kardiovaskulární riziko při léčbě testosteronem (27). Na stranu bezpečného KV profilu testosteronových preparátů lze přiřadit i další studie, jež pozorovaly snížení mortality při léčbě testosteronem (28).
V současnosti můžeme shrnout, že nejsou jasné důkazy pro zvýšení kardiovaskulárního rizika při léčbě testosteronem a je potřeba provést dlouhodobou a adekvátně velkou kontrolovanou randomizovanou studii. Než budeme mít k dispozici výsledky takového výzkumu, je zatím vhodné s pacienty tato potenciální rizika diskutovat.
Léčba testosteronem a karcinom prostaty
Prostata je androgen-dependentní tkáň. Vzhledem k vyšším koncentracím dihydrotestosteronu (DHT) v prostatě je DHT považován za hlavní androgen ovlivňující proliferaci prostaty. Tato skutečnost vedla k obavám z možné indukce onemocnění prostaty při léčbě testosteronem. Studie ovšem ukázaly, že léčba hypogonadálních mužů testosteronem nevede k lineárnímu vzestupu PSA v závislosti na dávce, a pokud nejsou koncentrace testosteronu před léčbou extrémně nízké, ani nezvyšuje koncentrace testosteronu a DHT v prostatě. Dále je potřeba si uvědomit, že výskyt karcinomu prostaty stoupá ve vyšším věku, kdy dochází k poklesu koncentrace testosteronu.
Metaanalýzy randomizovaných placebem kontrolovaných studií neprokázaly, že by léčba testosteronem vedla ke vzniku jakéhokoliv onemocnění prostaty včetně karcinomu prostaty nebo benigní hyperplazie prostaty (30).
Není ani prokázáno, že by léčba testosteronem vedla k progresi subklinického karcinomu prostaty v manifestní formu, i když některé kazuistiky tuto možnost naznačovaly (31).
Výskyt karcinomu prostaty byl při užívání testosteronu stejný jako v populaci. Podávání testosteronu však může demaskovat latentní karcinom prostaty, protože PSA stoupá při léčbě testosteronem a to vede k indikaci urologických vyšetření a biopsií prostaty. Podobně léčba testosteronem hypogonadálních pacientů sama o sobě nevede k obstrukčním mikčním obtížím, ale může zvětšit objem prostaty na úroveň eugonadálních mužů.
Můžeme shrnout, že nejsou k dispozici jasné důkazy o tom, že normalizace původně snížené koncentrace testosteronu v séru má nežádoucí důsledky na prostatu.
Jiná je situace v případě lokálně progredujícího nebo celkově progredujícího karcinomu prostaty, kde je prokázáno, že testosteron stimuluje růst a zhoršuje příznaky. Proto je v této situaci testosteron kontraindikovaný a je podávána antiandrogenní léčba.
Polycytemie
Testosteron stimuluje erytropoezu a v období puberty u chlapců stoupá hemoglobin o 15–20 %. Hypogonadismus vede k poklesu v červeném krevním obrazu. Při léčbě testosteronem se může vyvinout polycytemie, zejména u starších mužů při léčbě injekčními preparáty (6). Vyšší riziko je též u pacientů s jinou příčinou sekundární polycytemie, například při CHOPN. Současné studie podporují hypotézu, že riziko polycytemie závisí na formě podání, dávce a farmakokinetice testosteronu, kdy se uplatňuje délka trvání suprafyziologických koncentrací. Nejvyšší výskyt polycytemie (hematokrit > 0,50) je pozorován při léčbě krátkodobě působícími muskulárně podávanými preparáty testosteronu (až 40–67 %), nižší je při aplikaci gelů (12,8 %) nebo dlouhodobě působícího testosteron-undekanoátu podávaného intramuskulárně (7 %) a nejnižší u perorálního testosteron-undekanoátu (0,003 %) (32). Dále byl zjištěn pozitivní vztah mezi senzitivitou androgenního receptoru (vyšší senzitivita při nižším počtu opakování sekvence CAG) a stimulací erytropoezy (33).
Vzestup hematokritu nad normu může vést k zvýšení viskozity a k trombotickým komplikacím, jako jsou CMP, infarkt myokardu, hluboká žilní trombóza nebo plicní embolizace. Dosud však nemáme žádné randomizované prospektivní studie, které by prokázaly přímý vztah mezi testosteronem indukovanou polycytemií a tromboembolickými příhodami. V metaanalýze randomizovaných kontrolovaných studií Corona et al. ve vztahu k léčbě testosteronem a kardiovaskulárnímu riziku uzavřeli, že nyní známá data nepodporují kauzální souvislost mezi substitucí testosteronem a nežádoucími kardiovaskulárními příhodami, když je hypogonadismus řádně diagnostikován a substituční léčba správně podávána (34).
Doporučuje se, aby muži s hematokritem (hct) > 0,50 před zahájením léčby byli podrobněji vyšetřeni, protože u nich je vyšší riziko vzestupu hct nad 0,54 v průběhu léčby. Další rizikové faktory, které přicházejí v úvahu, jsou trombofilní stavy jako leidenská mutace faktoru V, antifosfolipidový syndrom, mutace protrombinového genu, vysoké koncentrace faktoru VIII, případně homocysteinu. U rizikových skupin je indikovaná volba preparátů s nižším rizikem vzestupu hct. Při vzestupu hct nad 0,54 při léčbě se doporučuje léčbu přerušit nebo provést venepunkci, dokud hct neklesne pod 0,50. Následně lze obnovit léčbu v nižších dávkách.
Jsou doporučeny pravidelné kontroly krevního obrazu před léčbou, za 3–4 a 12 měsíců po zahájení léčby a dále 1× ročně.
Syndrom spánkové apnoe
Muži se středně těžkým až těžkým SAS mají podle některých studií na malém souboru zvýšené riziko zhoršení SAS při léčbě zejména suprafyziologickými dávkami testosteronu. Pokud jsou však koncentrace testosteronu udržovány ve středním pásmu normy, nezdá se, že by mělo ke zhoršení SAS dojít (35).
ZÁVĚR
I když obsah tohoto článku není zaměřen na podávání androgenů off-label, je třeba upozornit na vyšší rizika spojená s jejich abúzem. Možnost nákupu přes internet vede k tomu, že si je kupují muži, u nichž není jasně prokázaný hypogonadismus, a ještě vyšší rizika lze předpokládat při abúzu ve vysokých dávkách, například v kulturistice. Rizika abúzu vysokých dávek androgenů zahrnují kardiovaskulární onemocnění, jaterní onemocnění, infertilitu nebo změny nálady (deprese, agresivita). V případě redukce vysokých dávek testosteronu nebo přerušení jeho užívání se mohou rozvinout deprese, podrážděnost, únava, nespavost a pokles libida.
Seznam použitých zkratek:
ACTH adrenokortikotropní hormon
DHT dihydrotestosteron
FAI free androgen index
FSH folikuly stimulující hormon
GH růstový hormon
GnRH gonadotropin uvolňující hormon
hct hematokrit
CHOPN chronická obstrukční plicní nemoc
IA inhibitor aromatázy
LH luteinizační hormon
LOH hypogonadismus s pozdním nástupem
SERM selektivní modulátor estrogenních receptorů
SHBG globulin vážící pohlavní hormony
Adresa pro korespondenci:
prof. MUDr. Václav Hána, CSc.
3. interní klinika – klinika endokrinologie a metabolismu 1. LF UK a VFN
U Nemocnice 1
128 00 Praha 2
Tel.: 224 962 997
e-mail: vhana@lf1.cuni.cz
Zdroje
1. Zarotsky V, Huang MY, Carman W et al. Systematic literature review of the risk factors comorbidities and consequences of hypogonadism in men. Andrology 2014; 2(6): 819–834.
2. Bhasin S, Cunningham GR, Hayes FJ et al. Testosterone therapy in men with androgen deficiency syndromes: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2010; 95(6): 2536–2559.
3. Baillargeon J, Urban RJ, Ottenbacher KJ et al. Trends in androgen prescribing in the United States 2001 to 2011. JAMA Intern Med 2013; 173(15): 1465–1466.
4. Mihalca R, Fica S. The impact of obesity on the male reproductive axis. J Med Life 2014; 7(2): 296–300.
5. Tajar A, Huhtaniemi IT, O’Neill TW et al. Characteristics of androgen deficiency in late-onset hypogonadism: results from the European Male Aging Study (EMAS). J Clin Endocrinol Metab 2012; 97 : 1508 –1516.
6. Wang C, Nieschlag E, Swerdloff R et al. Investigation treatment and monitoring of late-onset hypogonadism in males: ISA, ISSAM, EAU, EAA and ASA recommendations. Eur J Endocrinol 2008; 159(5): 507–514.
7. Diver MJ. Analytical and physiological factors affecting the interpretation of serum testosterone concentration in men. Ann Clin Biochem 2006; 43(Pt. 1): 3–12.
8. Mohr BA, Guay AT, O’Donnell AB, McKinlay JB. Normal bound and nonbound testosterone levels in normally ageing men: results from the Massachusetts Male Ageing Study. Clin Endocrinol (Oxf) 2005; 62(1): 64–73.
9. Vermeulen A, Verdonck L, Kaufman JM. A critical evaluation of simple methods for the estimation of free testosterone in serum. J Clin Endocrinol Metab 1999; 84 : 3666–3672.
10. Nanjee MN, Wheeler MJ. Plasma free testosterone – is an index sufficient? Ann Clin Biochem 1985; 22(Pt. 4): 387–390.
11. Grigorova M, Punab M, Zilaitienė B et al. Genetically determined dosage of follicle-stimulating hormone (FSH) affects male reproductive parameters. J Clin Endocrinol Metab 2011; 96(9): E1534–E1541.
12. Tüttelmann F, Laan M, Grigorova M et al. Combined effects of the variants FSHB -211G>T and FSHR 2039A>G on male reproductive parameters. J Clin Endocrinol Metab 2012; 97(10): 3639–3647.
13. Ferlin A, Vinanzi C, Selice R et al. Toward a pharmacogenetic approach to male infertility: polymorphism of follicle-stimulating hormone beta-subunit promoter. Fertil Steril 2011; 96(6): 1344–1349.
14. Selice R, Garolla A, Pengo M et al. The response to FSH treatment in oligozoospermic men depends on FSH receptor gene polymorphisms. Int J Androl 2011; 34(4): 306–312.
15. Liu PY, Baker HW, Jayadev V et al. Induction of spermatogenesis and fertility during gonadotropin treatment of gonadotropin-deficient infertile men: predictors of fertility outcome. J Clin Endocrinol Metab 2009; 94(3): 801–808.
16. Dwyer AA, Sykiotis GP, Hayes FJ et al. Trial of recombinant follicle-stimulating hormone pretreatment for GnRH-induced fertility in patients with congenital hypogonadotropic hypogonadism. J Clin Endocrinol Metab 2013; 98(11): E1790–E1795.
17. Chua ME, Escusa KG, Luna S et al. Revisiting oestrogen antagonists (clomiphene or tamoxifen) as medical empiric therapy for idiopathic male infertility: a meta-analysis. Andrology 2013; 1(5): 749–757.
18. Anawalt BD. Approach to male infertility and induction of spermatogenesis. J Clin Endocrinol Metab 2013; 98(9): 3532–3542.
19. Roth MY, Amory JK, Page ST. Treatment of male infertility secondary to morbid obesity. Nat Clin Pract Endocrinol Metab 2008; 4(7): 415–419.
20. Barrett-Connor EL. Testosterone and risk factors for cardiovascular disease in men. Diabetes Metab 1995; 21(3): 156–161.
21. Khaw KT, Barrett-Connor E. Blood pressure and endogenous testosterone in men: an inverse relationship. J Hypertens 1988; 6(4): 329–332.
22. Araujo AB, Dixon JM, Suarez EA et al. Clinical review: Endogenous testosterone and mortality in men: a systematic review and meta-analysis. J Clin Endocrinol Metab 2011; 96(10): 3007–3019.
23. Vigen R, O’Donnell CI, Barón AE et al. Association of testosterone therapy with mortality myocardial infarction and stroke in men with low testosterone levels. JAMA 2013; 310(17): 1829–1836.
24. Finkle WD, Greenland S, Ridgeway GK et al. Increased risk of non-fatal myocardial infarction following testosterone therapy prescription in men. PloS One 2014; 9(1): e85805.
25. Basaria S, Coviello AD, Travison TG et al. Adverse events associated with testosterone administration. N Engl J Med 2010; 363(2): 109–122.
26. Xu L, Freeman G, Cowling BJ, Schooling CM. Testosterone therapy and cardiovascular events among men: a systematic review and meta-analysis of placebo-controlled randomized trials. BMC Med 2013; 11 : 108.
27. Morgentaler A, Miner MM, Caliber M et al. Testosterone therapy and cardiovascular risk: advances and controversies. Mayo Clin Proc 2015; 90(2): 224–251.
28. Shores MM, Smith NL, Forsberg CW et al. Testosterone treatment and mortality in men with low testosterone levels. J Clin Endocrinol Metab 2012; 97 : 2050–2058.
29. Cheetham TC, An J, Jacobsen SJ et al. Association of testosterone replacement with cardiovascular outcomes among men with androgen deficiency. JAMA Intern Med 2017; 177(4): 491–499.
30. Fernandez-Balsells MM, Murad MH, Lane M et al. Clinical review 1: adverse effects of testosterone therapy in adult men: a systematic review and meta-analysis. J Clin Endocrinol Metab 2010; 95 : 2560–2575.
31. Loughlin KR, Richie JP. Prostate cancer after exogenous testosterone treatment for impotence. J Urol 1997; 157 : 1845.
32. Ohlander SJ, Varghese B, Pastuszak AW. Erythrocytosis following testosterone therapy. Sex Med Rev 2017 May 16, S2050-0521(17)30041-0, doi: 10.1016/j.sxmr.2017.04.001.
33. Zitzmann M, Nieschlag E. Androgen receptor gene CAG repeat length and body mass index modulate the safety of long-term intramuscular testosterone undecanoate therapy in hypogonadal men. J Clin Endocrinol Metab 2007; 92(10): 3844–3853.
34. Corona G, Maseroli E, Rastrelli G et al. Cardiovascular risk associated with testosterone-boosting medications: a systematic review and meta-analysis. Expert Opin Drug Saf 2014; 13(10): 1327–1351.
35. Calof OM, Singh AB, Lee ML et al. Adverse events associated with testosterone replacement in middle-aged and older men: a meta-analysis of randomized placebo-controlled trials. J Gerontol A Biol Sci Med Sci 2005; 60 : 1451–1457.
36. Hána V. Endokrinologie pro praxi. Maxdorf, Praha, 2014.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka
Článek EditorialČlánek Léčba hypofyzárních adenomů
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- 120 let od narození profesora Josefa Charváta
- Editorial
- Nadměrný růst u dětí a dospělých: nový klinický pohled, nové geny, nové fenotypy
- Diagnostika a další péče o pacienty s tyreoidálními uzly: doporučení American Thyroid Association 2015 modifikované pro podmínky České republiky
- Adrenokortikální insuficience
- Hypogonadismus u mužů a jeho léčba
- Léčba hypofyzárních adenomů
- Biologické aspekty ADHD (hyperkinetické poruchy) a poruch chování v dětském a adolescentním věku, vybrané preventivní aspekty
- Shoda čistě náhodná – Josef Charvát a Ctibor Blattný
- Nikolaj Ivanovič Pirogov: myslitel
- Sto let od narození doc. MUDr. Adolfa Zeleného
- Prof. MUDr. Pavel Mareš, DrSc., osmdesátiletý
- Prof. MUDr. Jaromír Hradec, CSc., sedmdesátníkem
- Přednáškový sál Lékařského domu po rekonstrukci znovu otevřen
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Hypogonadismus u mužů a jeho léčba
- Nadměrný růst u dětí a dospělých: nový klinický pohled, nové geny, nové fenotypy
- Adrenokortikální insuficience
- Diagnostika a další péče o pacienty s tyreoidálními uzly: doporučení American Thyroid Association 2015 modifikované pro podmínky České republiky
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



