-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Metabolické poruchy a spánek
Epidemiologic studies show that both atypical sleep time and obstructive sleep apnea (OSA) are independently associated with higher risk of metabolic disease development, particularly obesity and type 2 diabetes mellitus (T2DM). OSA is an independent risk factor for cardiovascular mortality, which is amongst the most common causes of death in T2DM. It is advisable to screen patients for OSA due to the high prevalence of the disease in T2DM patients. For screening are recommended questionnaires and home sleep monitoring. OSA diagnosis is then verified by home sleep apnea testing (using polygraphy) or by polysomnography.
Positive airway pressure (PAP) is a gold standard in the treatment of moderate and severe OSA. PAP prevents hypoxia and sleep fragmentation, eliminating excessive daytime sleepiness and decreasing the risk of cardiovascular diseases. Studies have not yet shown an effect of PAP treatment on T2DM compensation and glucose metabolism. Despite this a positive effect of PAP on insulin resistance and glucose tolerance has been proven in patients with prediabetes. PAP therapy is advised in obese patients of the central type with OSA, bariatric surgery has been proven to decrease the severity of OSA.
Keywords:
mass screening – obstructive sleep apnea – sleep time – intermittent hypoxia – Glucose metabolism – continuous positive airway pressure – central obesity
Autori: Martin Pretl 1; Zuzana Lattová 2; Andrea Plíhalovájan Polák 3 3,2,3; Kateřina Westlake 2,3,4
Pôsobisko autorov: Inspamed, s. r. o., neurologická ambulance a spánková poradna, Institut spánkové medicíny, Praha 1; Ústav patofyziologie 3. LF UK v Praze 2; 2. interní klinika 3. LF UK a FN Královské Vinohrady, Praha 3; Diabetologická ambulance, Diabetologie Praha, s. r. o. 4
Vyšlo v časopise: Čas. Lék. čes. 2019; 158: 185-192
Kategória: Přehledový článek
Súhrn
Epidemiologické studie ukazují, že jak abnormální doba spánku, tak také jedna z nejčastějších poruch spánku – obstrukční spánková apnoe (OSA) jsou nezávisle asociovány se zvýšeným rizikem rozvoje metabolických onemocnění – především obezity a diabetu mellitu 2. typu (T2DM). OSA je i nezávislým rizikovým faktorem kardiovaskulární mortality, nejčastější příčiny smrti pacientů s T2DM. Vzhledem k vysoké prevalenci OSA u pacientů s T2DM je proto vhodné provádět v této populaci screening OSA. K němu jsou doporučovány dotazníky a domácí monitorování dýchání ve spánku, diagnóza OSA se poté verifikuje polygrafickým či polysomnografickým vyšetřením.
V terapii střední a těžké OSA je metodou první volby léčba přetlakem v dýchacích cestách (PAP). Svými účinky zabraňuje hypoxii a fragmentaci spánku, eliminuje tím nadměrnou spavost a snižuje riziko rozvoje kardiovaskulárních onemocnění. Studie efektu PAP na kompenzaci diabetu a glukózový metabolismus u pacientů s T2DM zatím nepřinesly jednoznačné výsledky. U prediabetiků prokazují pozitivní efekt léčby PAP jak na inzulinovou rezistenci, tak na glukózovou toleranci. Zlepšení kompenzace již rozvinutého diabetu ovšem prokázáno nebylo. Stejně jako u pacientů s T2DM se i u pacientů s centrální obezitou v léčbě OSA uplatňuje terapie PAP, snížení tíže OSA přinášejí bariatrické operace.
Klíčová slova:
doba spánku – obstrukční spánková apnoe – intermitentní hypoxie – glukózový metabolismus – screening – trvalý přetlak v dýchacích cestách – centrální obezita
DÉLKA SPÁNKU A METABOLICKÉ PORUCHY
Spánek patří mezi základní fyziologické potřeby a je rovněž indikátorem celkového zdraví. Nekvalitní spánek významným způsobem ovlivňuje náš život včetně zdravotního stavu. Působí na pracovní i osobní vztahy, na náladu, výkon a je i příčinou vyšší nehodovosti, která může mít v mezních případech (např. v podobě mikrospánku) až fatální důsledky (např. při dopravní nehodě).
Fyziologická potřeba spánku je individuální; je ovlivněna zejména věkem, zdravotním stavem, ale i řadou kulturních, sociálních, psychologických, behaviorálních a environmentálních vlivů. K pocitu dobrého vyspání potřebuje organismus optimální zastoupení a střídání jednotlivých spánkových stadií při dostatečné délce spánku (obr. 1).
Obr. 1. Hypnogram pacienta se spánkovou apnoí a vzorový hypnogram
Horní „vzorový“ hypnogram znázorňuje ideální stav u mladého zdravého člověka – pravidelné střídání spánkových stadií a cyklů během nočního spánku při průměrném trvání spánku 8 hodin. Podíly jednotlivých stadií: NREM 1 = 1 %, NREM 2 = 45–50 %, NREM 3+4 = 20 %, REM = 25 %.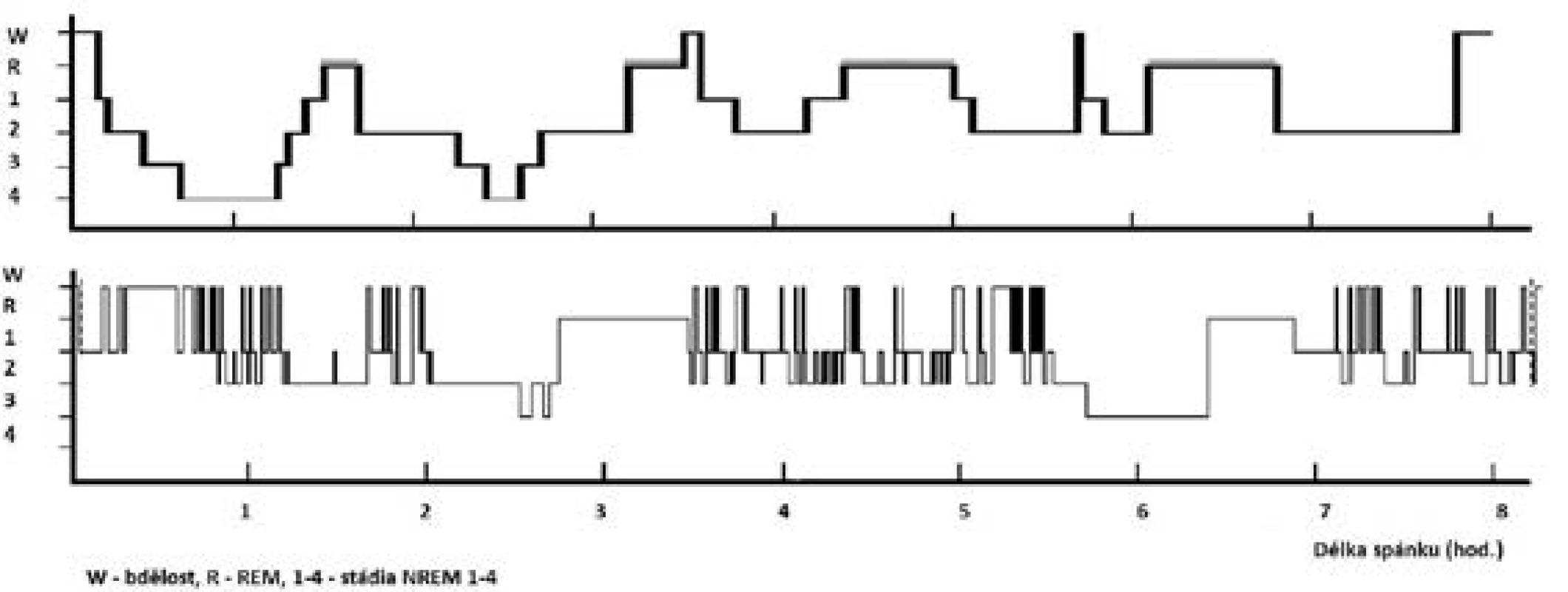
Dolní hypnogram znázorňuje fragmentovaný spánek pacienta s těžkou OSA (AHI = 42) – redukce hlubokého spánku (stadia NREM 3+4 a REM), zmnožení bdělosti a NREM 2 spánku.
Potřeba spánku se v průběhu dětství postupně zkracuje, u dospělých je doporučovaná délka spánku udávána v intervalu 7–8 hodin. Kratší nebo delší spánek významně ovlivňuje náš zdravotní stav (souvisí s vyšším výskytem kardiovaskulárních, metabolických, duševních nemocí ad.) a zvyšuje i mortalitu.
Epidemiologické studie ukazují, že doba spánku je nezávisle asociována s morbiditou i mortalitou. Negativní vliv prokazují jak pro zkrácenou, tak nadměrnou délku spánku, asociace odpovídají křivce ve tvaru písmene U. Tento vztah je prokázán pro obě pohlaví, nezávisle na věku a také napříč různými geografickými lokalitami (1). Mezi onemocnění, jejichž zvýšené riziko je s abnormální délkou spánku spojováno, patří obezita, diabetes mellitus 2. typu (T2DM), ischemická choroba srdeční nebo cévní mozková příhoda.
Metabolický syndrom je obvykle definován jako soubor metabolických poruch zahrnující centrální obezitu, poruchu glukózové tolerance, dyslipidemii a vysoký krevní tlak. Ze studií vyplývá, že existuje vztah mezi rozvojem metabolického syndromu a abnormální délkou spánku, a to jak pro krátkou délku trvání spánku, tak pro nadměrnou délku spánku (asociace ve tvaru písmene U) (2–4).
Studie potvrzují vztah mezi krátkým trváním spánku a obezitou. Itahni et al. ve své metaanalýze referují o zvýšeném riziku obezity u pacientů s délkou trvání spánku méně než 6 hodin (5). Zaznamenány byly mnohé asociace mezi krátkou dobou spánku, vyšším celkovým příjmem energie a vyšším celkovým příjmem tuků i sacharidů. Lidé s krátkou délkou spánku mají častěji nepravidelné stravovací návyky, jsou bdělí delší dobu, mohou i delší dobu přijímat potravu, krátký spánek také zvyšuje jejich chuť k jídlu (6). Nejčastěji jsou tyto nálezy přisuzovány změněným hladinám leptinu a ghrelinu. Data z experimentálních studií nicméně nejsou jednoznačná. Některé studie zaznamenaly po spánkové deprivaci nárůst hladin ghrelinu, jiné jeho nárůst nepotvrzují. U hladin leptinu byl pozorován (a předpokládán) pokles, jiné studie však referují o nezměněných hladinách (16), nebo dokonce o nárůstu hladin leptinu (7, 8).
Data z metaanalýz věnující se dlouhé době trvání spánku a její souvislostí s obezitou obdobně zjistily zvýšené riziko obezity (9). Oproti tomu v kohortě 83 377 amerických mužů a žen mezi 51 a 72 lety nebyla nalezena žádná souvislost mezi delším trváním spánku a obezitou, ačkoli pro krátkou dobu spánku byla tato asociace prokázána (10).
Z publikovaných dat vyplývá, že jak krátká, tak dlouhá doba spánku jsou spojeny se zvýšeným rizikem rozvoje diabetu mellitu 2. typu. Pro vztah mezi krátkou dobou spánku a rozvojem T2DM hovoří výsledky dosavadních rozsáhlých populačních studií (Sleep Heart Health Study) (11) potvrzující tento vztah i pro různé populace, např. obézní adolescenty nebo těhotné ženy. V metaanalýze prospektivních studií byl potvrzen nárůst relativního rizika pro každou hodinu spánku kratšího než 7 hodin (12). Kromě toho byla krátká doba trvání spánku asociována s metabolickými odchylkami typickými pro prediabetes – zvýšený glykovaný hemoglobin, zvýšenou hladinu glukózy nebo zvýšenou hladinu inzulinu (13). V 6týdenní intervenční studií vedlo prodloužení spánku u chronicky deprivovaných zdravých dobrovolníků ke snížení inzulinové rezistence (14).
Také pro vztah mezi dlouhým spánkem a rizikem rozvoje T2DM nacházíme v současné literatuře přesvědčivé důkazy. Metaanalýza prospektivních studií prokázala vyšší relativní riziko T2DM u osob s délkou spánku 8 a více hodin (12).
Na popsaných změnách se může podílet i nediagnostikované základní onemocnění a/nebo zhoršený zdravotní stav. Mezi nejčastěji se vyskytující poddiagnostikované choroby výrazně narušující kvalitu spánku a způsobující nadměrnou denní spavost patří spánková apnoe (viz dále) a poruchy nálady. Deprese se ve své atypické (mírnější, a proto snáze přehlédnutelné) formě může projevovat právě i zvýšenou spavostí. Svou roli může hrát rovněž sedavý způsob života, spojený s nedostatkem fyzické aktivity, která má přímou souvislost se vznikem obezity a rizikem diabetu mellitu. Roli mohou hrát také chronobiologické faktory.
Studií zabývajících se vztahem mezi délkou spánku a dyslipidemií je omezený počet. Krátká doba spánku je udávána jako rizikový faktor rozvoje hypercholesterolemie pro ženy (15), naopak v americké National Health Interview Survey je delší doba spánku u mužů vnímána jako protektivní faktor hypercholesterolemie (16). Novější metaanalýza ovšem tuto souvislost neprokázala (17).
DIABETES MELLITUS 2. TYPU A OBSTRUKČNÍ SPÁNKOVÁ APNOE
Z poruch spánku a bdění se u pacientů s T2DM vyskytuje nejčastěji obstrukční spánková apnoe (OSA). Jedná se o chronické onemocnění projevující se během spánku hlasitým chrápáním a pauzami bezdeší (apnoe, hypopnoe). Přes den dominují stesky vyplývající z fragmentovaného spánku, které ovlivňují kvalitu života jedince. Příznaky OSA shrnuje tab. 1.
Tab. 1. Příznaky obstrukční spánkové apnoe 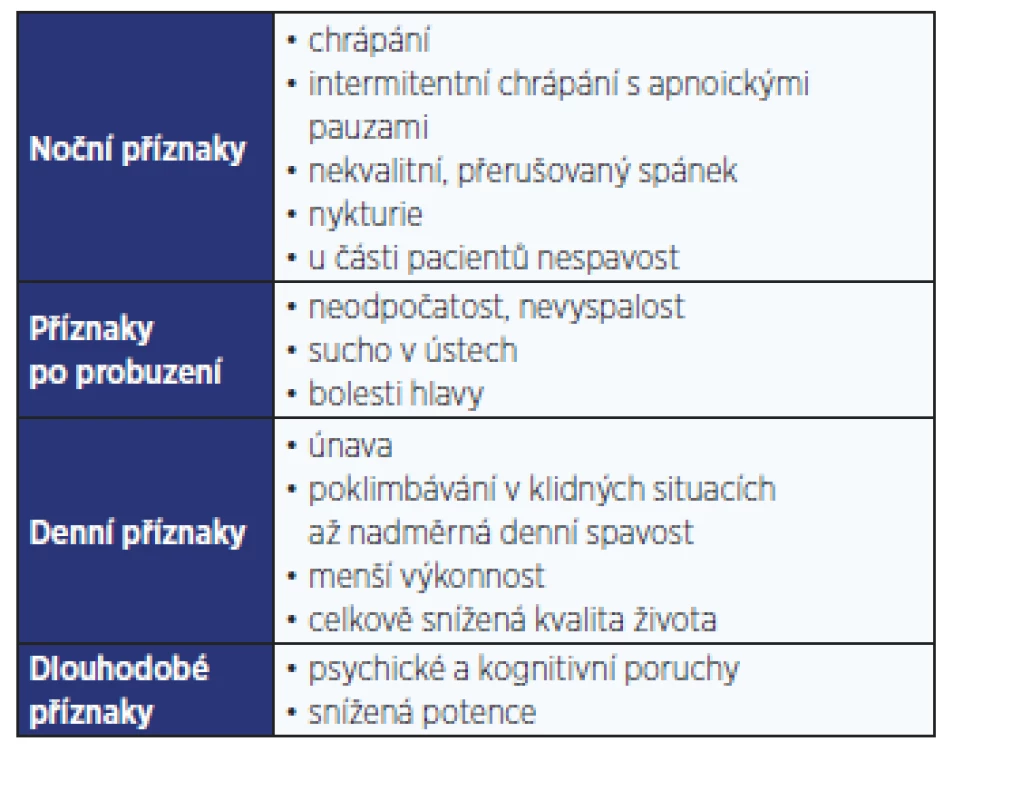
Tíže choroby se určuje podle počtu respiračních událostí (apnoí a hypopnoí) za hodinu spánku, tzv. indexem apnoe/hypopnoe (AHI). Podle něho se rozlišuje lehká (AHI 5–14), střední (AHI 15–29) a těžká (AHI > 30) OSA.
Výskyt OSA v populaci se nejčastěji udává mezi 5 a 10 %. Pro hranici AHI 5 je udáván mezi 9 a 38 %, pro AHI > 15 mezi 6 a 17 %, s častějším postižením mužského pohlaví. Výskyt OSA narůstá s věkem a obezitou (18). OSA je spojována hlavně s chorobami kardiovaskulárními (je nezávislým rizikovým faktorem KV morbidity a mortality) a metabolickými (hlavně T2DM).
Výskyt OSA je u pacientů s T2DM udáván v rozmezí 20–80 %. Středně těžkou či těžkou OSA, která je indikovaná k léčbě nehledě na přítomnost, resp. absenci subjektivních obtíží, trpí podle publikovaných studií cca 25–35 % diabetiků 2. typu, cca 90 % z nich (stejně jako v běžné populaci) si svého onemocnění není vědomo a OSA u nich není diagnostikována (80 % případů). Většinou se jedná o střední a těžkou OSA. Prevalence T2DM je u pacientů s OSA udávána kolem 50 %, prediabetu mezi 20 a 67 % (19–21). Výskyt obou onemocnění je spojen hlavně s centrální obezitou a kardiovaskulárními chorobami. OSA je nezávislým rizikovým faktorem pro rozvoj inzulinové rezistence (IR), glukózové intolerance a T2DM. Studie prokazují souvislost mezi tíží OSA a porušenou glukózovou homeostázou nezávisle na dalších souvisejících rizikových faktorech (obezitě, BMI, pohlaví či věku) (22, 23).
Při OSA dochází ve spánku opakovaně ke kolapsu horních dýchacích cest (apnoe, hypopnoe) na retropalatální a retroglosické úrovni. Na obstrukci dýchacích cest se nejvíce podílejí anatomické změny, hlavně zmnožení měkkých tkání v oblasti uvuly, kořene jazyka a laterální stěny faryngu, eventuálně tonzil. Jedním z hlavních důvodů je ukládání tukových depozit (obezita je nejdůležitějším rizikovým faktorem vzniku OSA). Roli hraje i vyšší kolapsibilita svalstva ve zmíněné oblasti a mužské pohlaví (2–3× častější než u žen) a dále změněné anatomické poměry kraniofaciálního skeletu. Apnoe mohou být vyvolány či akcentovány i medikací (hlavně benzodiazepiny, myorelaxancii, barbituráty) a alkoholem. Respirační události způsobují přerušení proudění vzduchu v dýchacích cestách, které obvykle vede k repetitivním poklesům saturace a spouští tak kaskádu dějů končících mikroprobouzecí reakcí. Spánek se fragmentuje (obr. 1). Intermitentní hypoxie a fragmentovaný spánek jsou nejdůležitějšími faktory v patogenezi onemocnění souvisejících se spánkovou apnoí, tzn. i metabolických vedoucích k ovlivnění glukózové homeostázy (24). Předpokládá se i opačný vztah – T2DM působí na vznik nebo progresi OSA hlavně potencováním obezity a autonomních dysfunkcí.
Přesný patofyziologický mechanismus, kterým vede intermitentní hypoxie a fragmentace spánku k rozvoji popsaných poruch glukózového metabolismu, není dosud plně znám. Předpokládá se multifaktoriální působení několika činitelů, mezi něž patří aktivace sympatického nervového systému, hypotalamo-hypofyzárně-adrenální osy, prozánětlivých drah, dále zvýšená tkáňová produkce reaktivních forem kyslíku a změny v profilu secernovaných hormonů tukové tkáně (adipokinů) (21, 25).
Vliv intermitentní hypoxie na glukózovou homeostázu
Intermitentní hypoxie, jedna ze základních charakteristik OSA, je asociována s inzulinovou rezistencí a metabolickými poruchami. Vliv intermitentní hypoxie na cílové orgány (játra, svaly, tukovou tkáň, pankreas) byl studován jak in vitro, tak na zvířecích modelech a lidských dobrovolnících. Zatímco výzkum in vitro vyžaduje specializované vybavení umožňující rychlé a reproducibilní cyklování pericelulární koncentrace kyslíku na úrovni kultivovaných buněk, experimenty na zvířecích modelech jsou typicky založené na snížení inspirační frakce kyslíku ve vdechovaném vzduchu díky podávání dusíku do chovných nádob nebo do obličejové masky (či kyslíkového stanu) lidským dobrovolníkům (26).
Vliv intermitentní hypoxie na glukózovou homeostázu
Řada studií popisujících vztah mezi intermitentní hypoxií a inzulinovou rezistencí prokázala, že intermitentní hypoxie v myších či potkaních modelech negativním způsobem zasahuje do regulace glukózového metabolismu a vyvolává poruchu glukózové tolerance (27), zvyšuje parametry inzulinové rezistence jako např. index HOMA nebo spotřebu glukózy během hyperinzulinemického klempu (metoda objektivizace inzulinové rezistence na úrovni celého organismu) a snižuje glukózou stimulovanou sekreci inzulinu (28). Důležité je, že řada těchto poruch, konkrétně snížená inzulinová senzitivita a sekrece inzulinu, byla pozorována rovněž u lidí po expozici zdravých dobrovolníků intermitentní hypoxii (26). Přestože jsou účinky expozice intermitentní hypoxii na glukózový metabolismus zjevné, mechanismy, jimiž je tento efekt způsoben, zůstávají objasněné pouze částečně.
Jaterní metabolismus
Vzhledem k centrální roli, kterou játra hrají v regulaci glukózového a lipidového metabolismu, přitahují pochopitelný zájem i v kontextu OSA. Expozice intermitentní hypoxii vedla u zvířat i lidských subjektů k jaternímu poškození doprovázenému zvýšením plazmatických hladin jaterních enzymů (ALT, AST, ALP) (29) a rozvoji jaterní steatózy, nekrózy a neutrofilní infiltrace již po několika týdnech expozice. Delší expozice intermitentní hypoxii, v horizontu několika měsíců, vyústila v pokračující zánětlivou reakci se zvýšenou expresí kolagenu a nadměrnou akumulací kolagenu v jaterním parenchymu. Intermitentní hypoxie také zvýšila expresi enzymů klíčových pro syntézu lipidů v jaterních buňkách (30), pravděpodobně mechanismy, které zahrnují aktivaci hypoxií indukovaného faktoru 1 (HIF-1). S ohledem na glukózový metabolismus bylo zjištěno, že hepatocyty z myší exponovaných intermitentní hypoxii mají zvýšenou expresi enzymů zodpovědných za glukoneogenezi a vyšší výdej glukózy do cirkulace (27), stejně jako zvýšený jaterní obsah glykogenu (31, 32), což nasvědčuje zvýšené produkci a výdeji glukózy z jater, čímž může intermitentní hypoxie přispívat ke zvýšeným hladinám glykemie a rozvoji T2DM.
Molekulární mechanismy, které by mohly přispívat k výše popsaným efektům v játrech, zahrnují například oxidační stres a indukci prozánětlivých cytokinů. Bylo například zjištěno, že intermitentní hypoxie způsobuje snížení aktivity nebo množství enzymů zodpovědných za ochranu před oxidačním stresem (např. superoxiddismutázy, katalázy, glutathionperoxidázy) a zároveň zvýšení množství produktů lipidové peroxidace (33). Dlouhodobější expozice také vedla k aktivaci prozánětlivých cytokinů (IL-1β, IL-6 a makrofágového zánětlivého proteinu MIP-2) a aktivovala transkripční prozánětlivé mechanismy spojené s faktorem NFκB (32).
Kosterní svalovina
Přestože kosterní svalovina představuje rozhodující tkáň pro postprandiální odsun glukózy z cirkulace, znalosti o vlivu hypoxie na molekulární pochody v kosterní svalovině jsou spíše omezené. Bylo zjištěno, že setrvalá hypoxie (např. během cvičení nebo při výstupu do vyšší nadmořské výšky) negativně ovlivnila glukózový metabolismus ve svalu (33). Intermitentní hypoxie snížila glukózový metabolismus ve svalu a vedla ke snížení některých klíčových metabolitů glykolytické dráhy (kreatinfosfátu, citrátu, alfa-ketoglutarátu, glutamátu). Podobně bylo zjištěno, že expozice intermitentní hypoxii vedla ke snížení translokace hlavního glukózového transportéru GLUT4 na plazmatickou membránu a tím pádem k omezení inzulinem stimulovaného transportu glukózy do buněk, což by mohl být jeden z mechanismů vedoucích k navození inzulinové rezistence ve svalu (34).
Beta-buňky pankreatu
Komplexnost regulace sekrece inzulinu jakož i obtíže v jeho studiu jsou pravděpodobně zodpovědné za některé protichůdné či nekonzistentní nálezy. Zatímco některé humánní studie neprokázaly poruchu v sekreci inzulinu v přítomnosti OSA, ostatní poukázaly na nedostatečnou sekreci inzulinu v závislosti na stupni inzulinové rezistence (26). Navíc – alespoň v myším modelu – byla expozice intermitentní hypoxii spojena s indukcí zániku beta-buněk, ale také s jejich replikací (35), což komplikuje vyvození jednoznačných závěrů.
Negativní dopad intermitentní hypoxie je též dokumentován nižším obsahem inzulinu v sekrečních granulích kvůli úbytku klíčových enzymů v syntéze inzulinu (36) nebo snížením glukózou indukované sekrece inzulinu na základě poruch v toku kalcia přes plazmatickou membránu. Podobně jako v jiných orgánech rovněž v pankreatických ostrůvcích byla pozorována vyšší produkce kyslíkových radikálů v souvislosti s expozicí intermitentní hypoxii, navíc beta-buňky patří mezi velmi vnímavé k účinkům oxidačního stresu. Naopak podání antioxidačních činidel (Mito-Tempol) nebo zvýšení exprese enzymů degradujících kyslíkové radikály mělo ochranný účinek (36).
Tuková tkáň
Tuková tkáň sehrává klíčovou úlohu v patogenezi inzulinové rezistence, jednak skrze svou lipolytickou funkci (uvolňováním volných mastných kyselin do cirkulace s jejich negativními účinky a indukcí inzulinové rezistence v játrech i svalu a rozvoji pankreatické endokrinní dysfunkce) (37), jednak díky své endokrinní funkci (syntézou a uvolňováním adipokinů). Na myším modelu bylo prokázáno, že expozice intermitentní hypoxii zvyšuje lipolytickou aktivitu v tukové tkáni a její farmakologická inhibice zabraňuje rozvoji hyperglykemie, inzulinové rezistence i porušení glukózové tolerance (38). Podobně u pacientů s OSA (a srdečním selháním) bylo zjištěno, že v průběhu noci mají zvýšené hladiny volných mastných kyselin, které poklesly po podání suplementace kyslíkem (39). Stejně tak se množí data o endokrinní funkci tukové tkáně a jejím ovlivnění intermitentní hypoxií, jelikož bylo pozorováno snížení produkce adiponektinu (potentního inzulin senzitizujícího hormonu) (40) a na druhé straně zvýšení produkce rezistinu, který je naopak podezírán ze schopnosti indukovat inzulinovou rezistenci a zánětlivou reakci, stejně jako zvýšení řady dalších prozánětlivých adipokinů (TNF-α, IL-6, leptinu).
Diagnostika
Vzhledem k vysoké prevalenci OSA v populaci i závažným důsledkům, jež s sebou nese neléčená OSA (tj. hlavně zvýšení rizika kardiovaskulárních onemocnění jako nejčastější příčiny smrti diabetiků 2. typu a zhoršení inzulinové rezistence, poruchy glukózové tolerance a zvýšení rizika progrese mikrovaskulárních komplikací diabetu) (20, 41), je třeba na diagnostiku OSA myslet již v první linii. Základ k odhalení rizikových pacientů tvoří podrobná anamnéza (dotazy na příznaky spánkové apnoe, výskyt kardiovaskulárních onemocnění či obezity) a fyzikální vyšetření.
Mezinárodní diabetologická federace (IDF) doporučuje u diabetiků 2. typu provádět screening OSA (42). V prvním kroku navrhuje IDF vyplnit screeningový dotazník. U pacientů, kteří byli dotazníkem označeni jako rizikoví, doporučuje ve druhém sledu provedení screeningového monitorování dýchání ve spánku. Mezi nejběžněji používané dotazníky pro screening OSA patří Berlínský dotazník a dotazník STOP, resp. jeho rozšířená forma STOP-BANG. Oba, resp. všechny tři zmíněné dotazníky vyšetřovaného jedince označí jako rizikového stran OSA na základě anamnestických a antropometrických údajů týkajících se přítomnosti známých rizikových faktorů OSA (chrápání, záchytu apnoických pauz, únavy, obezity, hypertenze a u dotazníku STOP-BANG i obvodu krku, věku a pohlaví).
Studie na menších i větších počtech pacientů publikovaly senzitivitu i specificitu dotazníků Berlínského, STOP i STOP-BANG nekonzistentně v širokém rozmezí 30–90 %. V metaanalýze porovnávající uvedené tři dotazníky spolu s Epworthskou škálou spavosti Chiu et al. zjistili, že nejpřesnější nástroj pro detekci mírné, střední a těžké OSA je dotazník STOP-BANG (tab. 2) (43). V České republice provedli Westlake et al. studii, v níž porovnávali spolehlivost všech tří zmíněných dotazníků a zjistili, že se dotazníky ve své spolehlivosti rozpoznat jedince s klinicky závažnou OSA statisticky nelišily a všechny tři vykazovaly relativně nízkou senzitivitu (59–69 %) i specificitu (49–68 %). Dotazník STOP-BANG měl kromě toho významně nižší senzitivitu v ženské než v mužské populaci (44).
Tab. 2. Dotazník STOP-BANG (upraveno dle: 62, 63; zdroj: www.stopbang.ca/translation/pdf/czech.pdf) 
Druhým doporučovaným krokem podle IDF ve screeningu spánkové apnoe u pacientů s T2DM je monitorování dýchání ve spánku v domácím prostředí. Vyšetření má ve srovnání se zmíněnými screeningovými testy významně vyšší senzitivitu i specificitu, přesahující 90 %. Protože v současnosti začíná být dostupné (vzhledem k možnosti nasmlouvání výkonu zdravotními pojišťovnami) jak praktickým lékařům, tak diabetologům, nabízí se jako racionální postup screeningu OSA (alespoň v kardiovaskulárně rizikové populaci s vysokou prevalencí OSA) vynechat krok zahrnující dotazníky a přistoupit rovnou ke screeningovému monitorování dýchání ve spánku.
Dalším faktorem významně ovlivňujícím úspěšnost jakéhokoli screeningového nebo vyšetřovacího programu je ochota pacientů podstoupit vyšetření a následně se dlouhodobě léčit. V práci Westlake et al. (483 oslovených pacientů s diabetem 2. typu) souhlasilo 66 % pacientů se screeningovým vyšetřením monitorování dechu ve spánku. Z pacientů, kterým bylo na základě výsledků doporučeno provedení diagnostické spánkové studie (ambulantní limitované polygrafie), jich s tímto vyšetřením souhlasilo pouze 60 %. Pacienti, kteří léčbu akceptovali, však již měli stejnou adherenci k terapii jako ostatní nemocní léčící se se spánkovou apnoí (45). K úspěšné léčbě OSA jednoho pacienta bylo třeba provést screening domácím monitorováním u dvaceti jedinců s T2DM.
Při vyslovení suspekce na OSA je v nekomplikovaných případech metodou první volby v diagnostice OSA polygrafické vyšetření. Kromě záznamu proudění vzduchu před nosem a ústy a saturace hemoglobinu kyslíkem se monitorují dechové úsilí hrudníku a břicha, jednosvodové EKG, puls, poloha těla a dýchací zvuky. Mezi základní sledované parametry patří AHI, ODI (oxygen desaturation index – index desaturací/hodina), bazální/průměrná saturace a čas strávený v saturaci < 90 % (tzv. t90).
Polysomnografické vyšetření (jako zlatý standard diagnostiky spánkové apnoe) je pro svou vyšší náročnost užíváno hlavně k diferenciální diagnostice poruch dýchání ve spánku jakož i k diagnostice dalších poruch spánku. Toto vyšetření, které se provádí v laboratorních podmínkách, přináší podrobnější data ohledně spánku (kromě parametrů sledovaných u polygrafie možnost stanovení spánkových stadií, informace o trvání a kvalitě spánku) včetně videomonitorování. V polysomnografických záznamech je u pacientů s T2DM přítomna redukce delta a REM spánku a obecně i jeho nižší kvalita.
Součástí vyšetřovacího algoritmu ke stanovení diagnózy OSA jsou dále spirometrické a ORL vyšetření (ověření průchodnosti dýchacích cest), k ověření anatomických abnormit můžeme provést i stomatologické vyšetření s dálkovým snímkem lbi – kraniometrii, eventuálně CT či MRI (24).
Terapie
V terapii OSA jsou samozřejmostí režimová opatření, na prvním místě redukce hmotnosti, zákaz kouření a dostatečná doba spánku.
Léčba pomocí přetlaku v dýchacích cestách (PAP) je metodou první volby při léčbě středně těžké a těžké OSA. Nejčastěji je užíván trvalý PAP (CPAP). Léčba pomocí PAP přináší v první řadě kompenzaci poruchy spánku, která se subjektivně projeví zlepšením kvality života, což samo o sobě může významně napomáhat v léčbě základního onemocnění. Podstatou léčby pomocí PAP je zabránění obstrukce v dýchacích cestách pomocí přístrojem vytvářeného přetlaku, který je pomocí hadice a nosní masky přenášen do dýchacích cest. Při úspěšné terapii mizí fragmentace spánku i desaturace a navrací se původní funkce spánku. V současné době jsou přístroje vybaveny telemetrickým modulem, což významně usnadňuje sledování a spolupráci s pacienty a dále zvyšuje jejich compliance. Kritéria efektivity léčby pomocí PAP uvádí tab. 3 (46). Léčba pomocí PAP je pacienty dobře tolerována, kontraindikace jsou nečetné (tab. 4).
Tab. 3. Kritéria efektivity léčby obstrukční spánkové apnoe při léčbě přetlakem v dýchacích cestách (zpracováno dle: 46) 
Pozn.: OSA – obstrukční spánková apnoe; PAP – přetlak v dýchacích cestách; AHI – index apnoe/hypopnoe; rAHI – reziduální AHI; t90 – % doby spánku, kdy je saturace hemoglobinu kyslíkem < 90. Tab. 4. Kontraindikace léčby přetlakem v dýchacích cestách 
Studie zabývající se efektem PAP na glukózový metabolismus a na diabetes 2. typu zatím nepřinášejí jednoznačné výsledky. Nekontrolované observační studie provedené u diabetiků 2. typu zaznamenaly při nasazení CPAP zlepšení glykemické kontroly během spánku a inzulinové senzitivity, většinou bez vlivu na glykovaný hemoglobin (HbA1c) (20, 47). V práci, kterou publikovali Babu et al., je dokonce referováno snížení hodnot HbA1c a zlepšeni postprandiálních glykemií po 3měsíční léčbě CPAP, přičemž pokles HbA1c koreloval s mírou užívání CPAP (48). Tyto výsledky však nebyly potvrzeny v randomizovaných kontrolovaných pokusech. Studie, které srovnávaly dlouhodobý efekt (3 - a 6měsíční) terapie pomocí CPAP, neprokázaly efekt na inzulinovou senzitivitu ani HbA1c (49, 50). Rovněž výsledky provedených metaanalýz ukazují, že terapie CPAP nevede u pacientů s OSA a T2DM ke snížení HbA1c nebo body mass indexu, může však zlepšit inzulinovou senzitivitu či denní spavost (51, 52). Na druhou stranu randomizované kontrolované studie zkoumající vliv CPAP u prediabetiků s OSA prokazují pozitivní efekt jak na inzulinovou rezistenci, tak na glukózovou toleranci (53, 54), což potvrzuje i provedená metaanalýza (55).
Hlavním faktorem rozhodujícím o tom, do jaké míry může léčba CPAP ovlivnit glykemickou kontrolu, bude zřejmě délka trvání diabetu, respektive zachovaná funkčnost beta-buněk. U pacientů s dlouhotrvajícím diabetem, u kterých již došlo k značnému úbytku funkčních beta-buněk, pravděpodobně CPAP nepovede ke zlepšení HbA1c. Naopak se zdá, že nejvíce by z CPAP mohli profitovat prediabetici a pacienti v raném stadiu diabetu, i když otázkou zůstává, zda časné zahájení léčby CPAP může rozvoji T2DM předejít. Již bylo zjištěno, že u pacientů se středně těžkou až těžkou OSA bylo pravidelné užívání CPAP spojeno s nižší incidencí diabetu mellitu po dobu sledování trvajícího 2,7 roku (21, 56).
DIABETES MELLITUS 2. TYPU A DALŠÍ ONEMOCNĚNÍ
Spánek pacientů s diabetem mellitem může být rušen i bolestivou polyneuropatií, popisován je u nich častější výskyt syndromu neklidných končetin (RLS) a periodických pohybů končetinami ve spánku (PLMS). Narušení spánku přítomné u RLS i PLMS, zejména jeho fragmentace, bývá v experimentálních studiích spojeno s metabolickými účinky.
Ve studii srovnávající glukózový metabolismus s orálním glukózovým testem u různých poruch spánku (spánkové apnoe, insomnie, syndromu neklidných nohou) byla porucha glukózové tolerance zaznamenána u pacientů s OSA a RLS, nikoli ovšem u pacientů s insomnií (57). K obdobným závěrům dospěli i Bosco et al., kteří prováděli orální glukózový test u pacientů s primárním RLS (58). Na opačný vztah, tedy výskyt RLS u pacientů s T2DM, se zaměřuje daleko více pozornosti. Pacienti s T2DM vykazují vyšší prevalenci RLS nezávisle na přítomné polyneuropatii. Navíc léčba RLS u pacientů s T2DM pramipexolem vedla ke zlepšení kontroly glykemie (59).
CENTRÁLNÍ OBEZITA A OSA
Centrální obezita je ve vztahu k poruchám spánku významným epidemiologickým prediktorem obstrukční spánkové apnoe a současně je její nejčastější metabolickou poruchou, jejich ovlivnění je vzájemné. OSA trpí 50–80 % obézních (60–90 % pacientů s OSA má nadváhu), její výskyt je vyšší u mužů, což souvisí s centrálním typem obezity – ukládáním tukových depozit v oblastech hrající roli v patofyziologii OSA (na krku, na visceriích) (60). Redukce hmotnosti vede ke zlepšení spánkové apnoe. Léčba pomocí PAP zlepšuje OSA, zaznamenány při ní byly poklesy hladiny leptinu nebo redukce depozit viscerálního tuku. Operační řešení těžké obezity, bariatrická chirurgie, směřuje k omezení příjmu nebo absorpce potravy, eventuálně oba přístupy kombinuje. Léčba má významný efekt na snížení AHI (50–75 %), reziduální OSA však často zůstává (61).
Obézním pacientům, kteří podstupují jakýkoliv operační zákrok v celkové anestezii, by měla být věnována zvýšená pozornost – zvláště prvních 24 hodin po operaci, a to vzhledem k vyšší kolapsibilitě dýchacích cest a větší náchylnosti k pooperačním komplikacím při jejich častých komorbiditách (monitorování, pozice s mírně elevovaným trupem, opatrnost v podávání opiátů apod.). Léčba pomocí PAP by neměla být v souvislosti s operací přerušována, naopak při plánování bariatrické operace u pacientů s těžkou OSA má být PAP nasazen, byť jen na omezenou dobu.
ZÁVĚR
Stále se zkracující doba spánku jako důsledek moderního života se stává v poslední době spíše normou. Výskyt OSA stejně jako metabolických chorob v populaci stále narůstá. Abnormální doba spánku negativně ovlivňuje morbiditu i mortalitu. Výsledky studií zabývajících se abnormální dobou spánku i efektem léčby OSA (jako nejčastější poruchou spánku) na metabolické choroby v současné době zatím nepřinášejí vždy jednoznačné výsledky. Je proto třeba nadále pokračovat v úsilí, které vede k objasňování zmiňovaných vztahů. Neméně důležitá je i preventivní, diagnostická a léčebná stránka věci v denní praxi, neboť již jen zlepšený spánek přináší pozitivní posun v kvalitě života a tím nezanedbatelně ovlivňuje také naše zdraví.
Adresa pro korespondenci:
MUDr. Martin Pretl, CSc.
Inspamed, s. r. o., neurologická ambulance a spánková poradna
Institut spánkové medicíny
Belgická 20, 120 00 Praha 2
Tel.: 244 470 708
e-mail: martin.pretl@inspamed.cz
Zdroje
-
Cappuccio FP, D’Elia L, Strazzullo P, Miller MA. Sleep duration and all-cause mortality: a systematic review and meta-analysis of prospective studies. Sleep 2010; 33(5): 585–592.
-
Kobayashi D, Takahashi O, Deshpande GA et al. Relation between metabolic syndrome and sleep duration in Japan: a large scale cross-sectional study. Intern Med 2011; 50(2): 103–107.
-
Arora T, Jiang CQ, Thomas GN et al. Self-reported long total sleep duration is associated with metabolic syndrome: the Guangzhou Biobank Cohort Study. Diabetes Care 2011; 34(10): 2317–2319.
-
Ju SY, Choi WS. Sleep duration and metabolic syndrome in adult populations: a meta-analysis of observational studies. Nutr Diabetes 2013; 3: e65.
-
Itani O, Jike M, Watanabe N, Kaneita Y. Short sleep duration and health outcomes: a systematic review, meta-analysis, and meta-regression. Sleep Med 2017; 32 : 246–256.
-
Castro MA, Garcez MR, Pereira JL, Fisberg RM. Eating behaviours and dietary intake associations with self-reported sleep duration of free-living Brazilian adults. Appetite 2019; 137 : 207–217.
-
Calvin AD, Carter RE, Adachi T et al. Effects of experimental sleep restriction on caloric intake and activity energy expenditure. Chest 2013; 144(1): 79–86.
-
Spiegel K, Leproult R, L'hermite-Balériaux M et al. Leptin levels are dependent on sleep duration: relationships with sympathovagal balance, carbohydrate regulation, cortisol, and thyrotropin. J Clin Endocrinol Metab 2004; 89(11): 5762–5771.
-
Jike M, Itani O, Watanabe N et al. Long sleep duration and health outcomes: A systematic review, meta-analysis and meta-regression. Sleep Med Rev 2018; 39 : 25–36.
-
Xiao Q, Arem H, Moore SC et al. A large prospective investigation of sleep duration, weight change, and obesity in the NIH-AARP Diet and Health Study cohort. Am J Epidemiol 2013; 178(11): 1600–1610.
-
Gottlieb DJ, Punjabi NM, Newman AB et al. Association of sleep time with diabetes mellitus and impaired glucose tolerance. Arch Intern Med 2005; 165(8): 863–867.
-
Shan Z, Ma H, Xie M et al. Sleep duration and risk of type 2 diabetes: a meta-analysis of prospective studies. Diabetes Care 2015; 38(3): 529–537.
-
Hancox RJ, Landhuis CE. Association between sleep duration and haemoglobin A1c in young adults. J Epidemiol Community Health 2012; 66(10): 957–961.
-
Leproult R, Deliens G, Gilson M, Peigneux P. Beneficial impact of sleep extension on fasting insulin sensitivity in adults with habitual sleep restriction. Sleep 2015; 38(5): 707–715.
-
Gangwisch JE, Malaspina D, Babiss LA et al. Short sleep duration as a risk factor for hypercholesterolemia: analyses of the National Longitudinal Study of Adolescent Health. Sleep 2010; 33(7): 956–961.
-
Sabanayagam C, Shankar A. Sleep duration and hypercholesterolaemia: Results from the National Health Interview Survey 2008. Sleep Med 2012; 13(2): 145–150.
-
Kruisbrink M, Robertson W, Ji C, Miller MA et al. Association of sleep duration and quality with blood lipids: a systematic review and meta-analysis of prospective studies. BMJ Open 2017; 7(12): e018585
-
Senaratna CV, Perret JL, Lodge CJ et al. Prevalence of obstructive sleep apnea in the general population: A systematic review. Sleep Med Rev 2017; 34 : 70–81.
-
Foster GD, Sanders MH, Millman R et al; Sleep AHEAD Research Group. Obstructive sleep apnea among obese patients with type 2 diabetes. Diabetes Care 2009; 32(6): 1017–1019.
-
Pamidi S, Tasali E. Obstructive sleep apnea and type 2 diabetes: is there a link? Front Neurol 2012; 3 : 126.
-
Plíhalová A, Westlake K, Polák J. Obstrukční spánková apnoe a diabetes mellitus 2. typu. Vnitřní lékařství 2016; 62(11 Suppl. 4): S79–S84.
-
Ip MS, Lam B, Ng MM et al. Obstructive sleep apnea is independently associated with insulin resistance. Am J Respir Crit Care Med 2002; 165(5): 670–676.
-
Seicean S, Kirchner HL, Gottlieb DJ et al. Sleep-disordered breathing and impaired glucose metabolism in normal-weight and overweight/obese individuals: the Sleep Heart Health Study. Diabetes Care 2008; 31(5): 1001–1006.
-
Pretl M. Diabetes mellitus 2. typu a obstrukční spánková apnoe v souvislostech. Česká diabetologie 2018; 4 : 19–24.
-
Drager LF, Jun JC, Polotsky VY. Metabolic consequences of intermittent hypoxia: relevance to obstructive sleep apnea. Best Pract Res Clin Endocrinol Metab 2010; 24(5): 843–851.
-
Louis M, Punjabi NM. Effects of acute intermittent hypoxia on glucose metabolism in awake healthy volunteers. J Appl Physiol 2009; 106(5): 1538–1544.
-
Polák J, Shimoda L, Drager LF et al. Intermittent Hypoxia Impairs Glucose Homeostasis in C57BL6/J Mice: Partial Improvement with Cessation of the Exposure. Sleep 2013; 36(10): 1483–1490.
-
Fenik VB, Singletary T, Branconi JL et al. Glucoregulatory consequences and cardiorespiratory parameters in rats exposed to chronic-intermittent hypoxia: effects of the duration of exposure and losartan. Front Neurol 2012; 3 : 51.
-
Drager LF, Li J, Reinke C et al. Intermittent hypoxia exacerbates metabolic effects of diet-induced obesity. Obesity (Silver Spring) 2011; 19(11): 2167–2174.
-
Savransky V, Nanayakkara A, Li J et al. Chronic intermittent hypoxia induces atherosclerosis. Am J Respir Crit Care Med 2007; 175(12): 290–297.
-
Savransky V, Nanayakkara A, Vivero A et al. Chronic intermittent hypoxia predisposes to liver injury. Hepatology 2007; 45(4): 1007–1013.
-
Savransky V, Bevans S, Nanayakkara A et al. Chronic intermittent hypoxia causes hepatitis in a mouse model of diet-induced fatty liver. Am J Physiol Gastrointest Liver Physiol 2007; 293(4): G871–G877.
-
Holm J, Bjorntorp P, Schersten T. Metabolic activity in rat skeletal muscle. Effect of intermittent hypoxia. Eur J Clin Invest 1973; 3(4): 279–283.
-
Carreras A, Kayali F, Zhang J et al. Metabolic effects of intermittent hypoxia in mice: steady versus high-frequency applied hypoxia daily during the rest period. Am J Physiol Regul Integr Comp Physiol 2012; 303(303): R700–R709.
-
Yokoe T, Alonso LC, Romano LC et al. Intermittent hypoxia reverses the diurnal glucose rhythm and causes pancreatic β-cell replication in mice. J Physiol 2008; 586(3): 899–911.
-
Wang N, Khan SA, Prabhakar NR, Nanduri J. Impairment of pancreatic β-cell function by chronic intermittent hypoxia. Exp Physiol 2013; 98(9): 1376–1385.
-
Delarue J, Magnan C. Free fatty acids and insulin resistance. Curr Opin Clin Nutr Metab Care. 2007; 10(2): 142–148.
-
Weiszenstein M, Shimoda LA, Koc M et al. Inhibition of Lipolysis Ameliorates Diabetic Phenotype in a Mouse Model of Obstructive Sleep Apnea. Am J Respir Cell Mol Biol 2016; 55(2): 299–307.
-
Jun JC, Drager LF, Najjar SS et al. Effects of Sleep Apnea on Nocturnal Free Fatty Acids in Subjects with Heart Failure. Sleep 2011; 34(9): 1207–1213.
-
Fiori CZ, Martinez D, Baronio D et al. Downregulation of uncoupling protein-1 mRNA expression and hypoadiponectinemia in a mouse model of sleep apnea. Sleep Breath 2014; 18(3): 541–548.
-
Tahrani AA. Obstructive sleep apnoea in diabetes: Does it matter? Diab Vasc Dis Res 2017; 14(5): 454–462.
-
Shaw JE, Punjabi NM, Wilding JP et al. Sleep-disordered breathing and type 2 diabetes: a report from the International Diabetes Federation Taskforce on Epidemiology and Prevention. Diabetes Res Clin Pract 2008; 81(1): 2–12.
-
Chiu HY, Chen PY, Chuang LP et al. Diagnostic accuracy of the Berlin questionnaire, STOP-BANG, STOP, and Epworth sleepiness scale in detecting obstructive sleep apnea: A bivariate meta-analysis. Sleep Med Rev 2017; 36 : 57–70.
-
Westlake K, Plíhalová A, Pretl M et al. Screening for obstructive sleep apnea syndrome in patients with type 2 diabetes mellitus: a prospective study on sensitivity of Berlin and STOP Bang questionnaires. Sleep Med 2016; 26 : 71–76.
-
Westlake K, Dostalova V, Plihalova A et al. The Clinical Impact of Systematic Screening for Obstructive Sleep Apnea in a Type 2 Diabetes Population-Adherence to the Screening-Diagnostic Process and the Acceptance and Adherence to the CPAP Therapy Compared to Regular Sleep Clinic Patients. Front Endocrinol (Lausanne) 2018; 9 : 714.
-
Pretl M, Hobzová M, Honnerová M et al. Indikační kritéria pro léčbu poruch dýchání ve spánku pomocí přetlaku v dýchacích cestách u dospělých. Dokument České společnosti pro výzkum spánku a spánkovou medicínu. Neurol Praxi 2013; 14(1): 38–41.
-
Pallayová M, Donic V, Tomori Z. Beneficial effects of severe sleep apnea therapy on nocturnal glucose control in persons with type 2 diabetes mellitus. Diabetes Res Clin Pract 2008; 81(1): e8–e11.
-
Babu AR, Herdegen J, Fogelfeld L et al. Type 2 diabetes, glycemic control, and continuous positive airway pressure in obstructive sleep apnea. Arch Intern Med 2005; 165(4): 447–452.
-
West SD, Nicoll DJ, Wallace TM et al. Effect of CPAP on insulin resistance and HbA1c in men with obstructive sleep apnoea and type 2 diabetes. Thorax 2007; 62(11): 969–974.
-
Shaw JE, Punjabi NM, Naughton MT et al. The Effect of Treatment of Obstructive Sleep Apnea on Glycemic Control in Type 2 Diabetes. Am J Respir Crit Care Med 2016; 194(4): 486–492.
-
Feng Y, Zhang Z, Dong ZZ. Effects of continuous positive airway pressure therapy on glycaemic control, insulin sensitivity and body mass index in patients with obstructive sleep apnoea and type 2 diabetes: a systematic review and meta-analysis. NPJ Prim Care Respir Med 2015; 25 : 15005.
-
Zhu B, Ma C, Chaiard J, Shi C. Effect of continuous positive airway pressure on glucose metabolism in adults with type 2 diabetes: a systematic review and meta-analysis of randomized controlled trials. Sleep Breath 2018; 22(2): 287–295.
-
Pamidi S, Wroblewski K, Stepien M et al. Eight hours of nightly continuous positive airway pressure treatment of obstructive sleep apnea improves glucose metabolism in patients with prediabetes. a randomized controlled trial. Am J Respir Crit Care Med 2015; 192(1): 96–105.
-
Weinstock TG, Wang X, Rueschman M et al. A controlled trial of CPAP therapy on metabolic control in individuals with impaired glucose tolerance and sleep apnea. Sleep 2012; 35(5): 617b–625b.
-
Iftikhar IH, Khan MF, Das A et al. Meta-analysis: continuous positive airway pressure improves insulin resistance in patients with sleep apnea without diabetes. Ann Am Thorac Soc 2013; 10(2): 115–120.
-
Botros N, Concato J, Mohsenin V et al. Obstructive sleep apnea as a risk factor for type 2 diabetes. Am J Med 2009; 122(12): 1122–1127.
-
Keckeis M, Lattová Z, Maurovich-Horvat E et al. Impaired glucose tolerance in sleep disorders. PLoS One 2010; 5(3): e9444.
-
Bosco D, Plastino M, Fava A et al. Role of the Oral Glucose Tolerance Test (OGTT) in the idiopathic restless legs syndrome. J Neurol Sci 2009; 287(1–2): 60–63.
-
Harashima S, Nishimura A, Osugi T et al. Restless legs syndrome in patients with type 2 diabetes: effectiveness of pramipexole therapy. Eur J Neurol 2014; 21(1): 72–78.
-
Pillar G, Shehadeh N. Abdominal fat and sleep apnea: the chicken or the egg? Diabetes Care 2008; 31(Suppl. 2): S303–S309.
-
de Raaff CAL, de Vries N, van Wagensveld BA. Obstructive sleep apnea and bariatric surgical guidelines: summary and update. Curr Opin Anaesthesiol 2018 : 31(1): 104–109.
-
Chung F, Yegneswaran B, Liao P et al. STOP questionnaire: a tool to screen patients for obstructive sleep apnea. Anesthesiology 2008; 108(5): 812–821.
-
Chung F, Subramanyam R, Liao P et al. High STOP-Bang score indicates a high probability of obstructive sleep apnoea. Br J Anaesth 2012; 108(5): 768–775.
Štítky
Adiktológia Alergológia a imunológia Angiológia Audiológia a foniatria Biochémia Dermatológia Detská gastroenterológia Detská chirurgia Detská kardiológia Detská neurológia Detská otorinolaryngológia Detská psychiatria Detská reumatológia Diabetológia Farmácia Chirurgia cievna Algeziológia Dentální hygienistka Interné lekárstvo Praktické lekárstvo pre dospelých
Článek In memoriam: Václav ŠpičákČlánek Zemřel Daniel Callahan
Článok vyšiel v časopiseČasopis lékařů českých
Najčítanejšie tento týždeň
2019 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Ke 150. výročí úmrtí Jana Evangelisty Purkyně
- Spánková medicína v odkazu doc. MUDr. Bedřicha Rotha, DrSc.
- Otorinolaryngologie a poruchy spánku
- Pokroky spánkové medicíny a neinvazivní ventilace v plicním lékařství
- Spánková apnoe a kardiovaskulární onemocnění
- Metabolické poruchy a spánek
- Význam spánku a jeho poruch v psychiatrii
-
Vítězslav Hálek vzpomíná na poslední setkání s J. E. Purkyněm
Ke 150. výročí smrti Jana Evangelisty Purkyně - Docent František Novotný – poslední asistent J. E. Purkyně a „vir infelix“
- Ceny ČLS JEP za nejlepší české publikace v oblasti medicíny za rok 2018
- Cena J. E. Purkyně pro profesora Jana Kvasničku
- Zemřel profesor Josef Marek, nejskromnější Rytíř českého lékařského stavu
- In memoriam: Václav Špičák
- Zemřel Daniel Callahan
- Přednáškové večery spolku českých lékařů v Praze (LISTOPAD – PROSINEC 2019)
- Časopis lékařů českých
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Význam spánku a jeho poruch v psychiatrii
- Otorinolaryngologie a poruchy spánku
- Spánková apnoe a kardiovaskulární onemocnění
- Metabolické poruchy a spánek
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



