-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Dvoudávkové očkovací schéma HPV vakcín u mladých adolescentů
The 2-dose schedule of HPV vaccines in young adolescents
Objective:
To summarize new knowledge about the 2-dose HPV vaccine schedule in young adolescents.Design:
Review article.Setting:
Department of Gynaecology and Obstetrics, First Faculty of Medicine, Charles University and Hospital Na Bulovce in Prague; Oncogynaecological Center, First Faculty of Medicine, Charles University and General University Hospital in Prague.Results:
The goal of immunization programs in many countries is the prevention of cervical cancer using either the bivalent or the quadrivalent HPV vaccine. The vaccines, which were designed to prevent cervical cancer outcomes in adults, need to be administered before the onset of sexual activity. Since the HPV vaccines are among the most expensive of all the widely recommended vaccines, limited financial resources restrain the HPV vaccination in some countries around the word. Higher immunogenicity of both HPV vaccines in young adolescents, as well as potential cost savings, have prompted discussions about the efficacy of the 2-dose HPV vaccine schedule. Results of the immunobridging studies showed that two doses of the bivalent and the quadrivalent HPV vaccine in young girls induced geometric mean antibody titers that were non-inferior to geometric mean antibody titers elicited in older girls and women with three doses of the same vaccine. Non-inferiority for HPV-16, -18, -31 and -45 was obtained for the 2-dose of the bivalent HPV vaccine in girls 9–14 years old in the period of 48 months and for HPV-6, -11, -16 and -18 for the 2-dose of the quadrivalent HPV vaccine in girls 9–13 years old in the period of 36 months.Conclusion:
These results indicate that the bivalent and the quadrivalent vaccine HPV vaccine applied in 2 doses has sufficient immunogenity in young girls.Keywords:
human papillomavirus, cervical cancer, 2-dose schedule of HPV vaccination, bivalent HPV vaccine, quadrivalent HPV vaccine
Autoři: B. Sehnal 1; N. Neumannová 1; Daniel Driák 1
; M. Halaška 1; M. Kotoulová 1; J. Sláma 2
Působiště autorů: Gynekologicko-porodnická klinika 1. LF UK a Nemocnice Na Bulovce, Praha, přednosta prof. MUDr. M. Halaška, DrSc. 1; Onkogynekologické centrum, Gynekologicko-porodnická klinika 1. LF UK a VFN, Praha, přednosta prof. MUDr. A. Martan, DrSc. 2
Vyšlo v časopise: Ceska Gynekol 2015; 80(1): 50-56
Souhrn
Cíl studie:
Přehled nových znalostí o dvoudávkovém očkovacím schématu HPV vakcinace u mladých adolescentů.Typ studie:
Souhrnný přehled.Název a sídlo pracoviště:
Gynekologicko-porodnická klinika, Nemocnice Na Bulovce a 1. LF UK, Praha; Onkogynekologické centrum, Gynekologicko--porodnická klinika Všeobecné fakultní nemocnice a 1. LF UK, Praha.Metodika a výsledky:
Cílem očkovacích programů v mnoha zemích je prevence karcinomu děložního hrdla pomocí bivalentní nebo kvadrivalentní HPV vakcíny. Vakcíny, které byly navrženy pro prevenci karcinomu děložního hrdla u dospělých, je třeba očkovat před začátkem pohlavního života. Protože HPV vakcíny patří mezi nejdražší z plošně doporučovaných vakcín, limitované finanční zdroje omezují HPV vakcinaci v některých zemích světa. Vyšší imunogenita obou HPV vakcín u mladých adolescentů a potenciální snížení finančních nákladů byly podnětem k diskusi o účinnosti dvoudávkového očkovacího schématu. Výsledky studií provedených na základě immunobridgingu ukázaly, že indukované geometrické průměrné titry protilátek jsou po očkování mladých dívek dvěma dávkami bivalentní a kvadrivalentní HPV vakcíny non-inferiorní s indukovanými geometrickými měrnými titry protilátek tvořených u starších dívek a žen se třemi dávkami stejné vakcíny. Non-inferiorita pro HPV 16, 18, 31 a 45 byla zjištěna u dívek ve věku 9–14 s dvoudávkovým schématem bivalentní HPV vakcíny po dobu 48 měsíců a pro HPV 6, 11, 16 a 18 u dívek ve věku 9–13 let s dvoudávkovým schématem kvadrivalentní HPV vakcíny po dobu 36 měsíců.Závěr:
Tyto výsledky ukazují, že bivalentní i kvadrivalentní HPV vakcína aplikovaná ve dvou dávkách má u mladých dívek dostatečnou imunogenitu.Klíčová slova:
lidský papilomavirus, karcinom děložního hrdla, dvoudávkové schéma HPV vakcinace, bivalentní HPV vakcína, kvadrivalentní HPV vakcínaÚVOD
Lidský papilomavirus (HPV, human papillomavirus) postihne alespoň jednou za život 75–80 % sexuálně aktivních lidí, přes malé defekty v epitelu napadá epitel kůže nebo sliznice orofaryngeální a anogenitální oblasti [10, 26]. Životní cyklus viru probíhá v epitelu infikovaného orgánu a není provázen virémií. Většina infekcí je přechodná a nezanechá žádné nebo jen nízké hladiny protilátek, které nechrání proti opakované infekci [3, 29]. Reinfekce, dokonce i stejným genotypem HPV, může probíhat za velmi podobných podmínek, jaké jsou u HPV „naivních“ jedinců [24], někteří infikovaní s perzistující séropozitivitou a vysokými titry protilátek po předchozí infekci mají ale snížené riziko reinfekce [14, 23]. HPV se přenáší nejčastěji během pohlavního styku [26, 28] a HPV infekce je spojena s rizikem rozvoje některých maligních nádorů [6, 16, 27]. Předpokládá se, že přibližně 5,2 % všech lidských karcinomů je způsobeno infekcí lidskými onkogenními papilomaviry [8, 11].
Dosud bylo identifikováno více než 130 HPV genotypů, z toho více než 40 genotypů infikuje anogenitální oblast [27]. Podle místa infekce se lidské papilomaviry dělí na viry rodu alfa, které napadají epitel kůže, a viry rodu beta, které infikují sliznice [10, 32]. Podle potenciálu iniciovat kancerogenezi děložního hrdla se rozlišují nízce-rizikové (low-risk, LR) a vysoce-rizikové genotypy (high-risk, HR) [2, 15]. Světová zdravotnická organizace WHO řadí mezi HR genotypy HPV ve skupině 1 (HPV 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59) a ve skupině 2A (HPV 68). Naopak viry ve skupině 2B (HPV 26, 53, 66, 67, 70, 73, 82), u kterých nejsou přímé důkazy pro kancerogenní potenciál na děložním hrdle, a viry ve skupině 3 (HPV 6, 11) se označují jako LR genotypy. Do skupiny 2B patří také genotypy HPV 5 a HPV 8, které se mohou uplatňovat v etiopatogenezi karcinomů kůže, ale pro toto tvrzení nejsou přesvědčivé důkazy [2]. Podle rozsáhlé epidemiologické studie publikované Muñozovou jsou genotypy HPV 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73, 82 považovány za kancerogenní a genotypy 26, 53, 66 za pravděpodobně kancerogenní [15]. Do skupiny HR HPV je tedy v současnosti řazeno 13–18 genotypů. Za nejdůležitější pro vznik lidských malignit jsou považovány genotypy HPV 16, 18, 31, 33 a 45.
Nejvyšší prevalence HR HPV je prokazována u těžkých dlaždicobuněčných prekaceróz děložního hrdla, kde podle některých údajů dosahuje až 98,5 % [31] a až v 99,7 % dlaždicobuněčných karcinomech děložního hrdla [27]. Také velká část dlaždicobuněčných prekanceróz a karcinomů anu a dolní části ženského genitálu je asociována s infekcí HR HPV. V metaanalýze 93 článků ze čtyř světadílů byla HPV infekce diagnostikována u 93,9 % těžkých prekanceróz anu, u 84,3 % análních karcinomů, u 85,3 % těžkých prekanceróz vulvy, u 40,4 % vulválních karcinomů, u 90,1 % těžkých prekanceróz pochvy a u 69,9 % vaginálních karcinomů, ve všech lézích dominoval genotyp HPV 16 [6].
Poprvé publikoval hypotézu o možné úloze HPV v etiopatogenezi karcinomu děložního hrdlaHarald zur Hausen v roce 1976 [33] a následně v roce 1982 popsal v buňkách karcinomu děložního hrdla objev dvou nových lidských papilomavirů označených jako HPV 16 a HPV 18 [34]. Během 90. let proběhly další molekulárně biologické, imunologické a epidemiologické studie, jejichž výsledky umožnily určit perzistující HPV infekci jako kauzální a nezbytnou podmínku pro kancerogenezi děložního hrdla. V roce 1995 International Agency for Research on Cancer (IARC) uzavřela, že je dostatek důkazů, aby byly genotypy HPV 16 a 18 klasifikovány jako lidské kancerogeny [15]. Objevy, které vedly k určení infekce HPV jako příčiny karcinomu děložního hrdla, umožnily následně identifikovat vztahy mezi HPV infekcí a rozvojem invazivních nádorů dalších orgánů. Profesor Harald zur Hausen obdržel v roce 2008 za své objevy Nobelovu cenu. Na výzkumu etiopatogeneze karcinomu děložního hrdla se významně podílela i československá věda. Vonka a jeho spolupracovníci vyloučili jakýkoli podíl vlivu herpetické infekce (HSV-2, herpes simplex virus 2) na rozvoj cervikálních prekanceróz a cervikálních karcinomů [30].
DVOUDÁVKOVÉ OČKOVACÍ SCHÉMA HPV VAKCINACE
V současnosti jsou k dispozici dvě profylaktické vakcíny proti HPV infekci, obě jsou dostupné i na českém trhu – od 5. prosince 2006 kvadrivalentní vakcína Silgard (Gardasil) a od 20. října 2007 bivalentní vakcína Cervarix. Obě jsou primárně zaměřeny k ochraně proti dvěma nejčastějším vysoce rizikovým genotypům HPV 16 a 18, Silgard dále působí také proti dvěma neonkogenním, nízce rizikovým genotypům HPV 6 a 11. Po intramuskulární vakcinaci dojde k tvorbě typově specifických ochranných protilátek.
Od 1. dubna 2012 je HPV vakcinace hrazena z prostředků veřejného zdravotního pojištění pro dívky ve věku 13 až 14 let, podmínkou je aplikace první dávky v tomto věkovém rozmezí. Očkování před 9. rokem života se nedoporučuje pro absenci informací o bezpečnosti vakcín a pro tento věk nebyla ani prokazována imunogenita. Standardně se obě HPV vakcíny aplikují ve třídávkovém očkovacím schématu, ideálně během 6 měsíců [5, 25]. Obě vakcíny jsou bezpečné, vysoce imunogenní a účinné proti perzistující HPV infekci a HPV asociovaným onemocněním. Základní charakteristiky obou vakcín shrnuje tabulka 1.
Tab. 1. Základní charakteristiky obou registrovaných vakcín 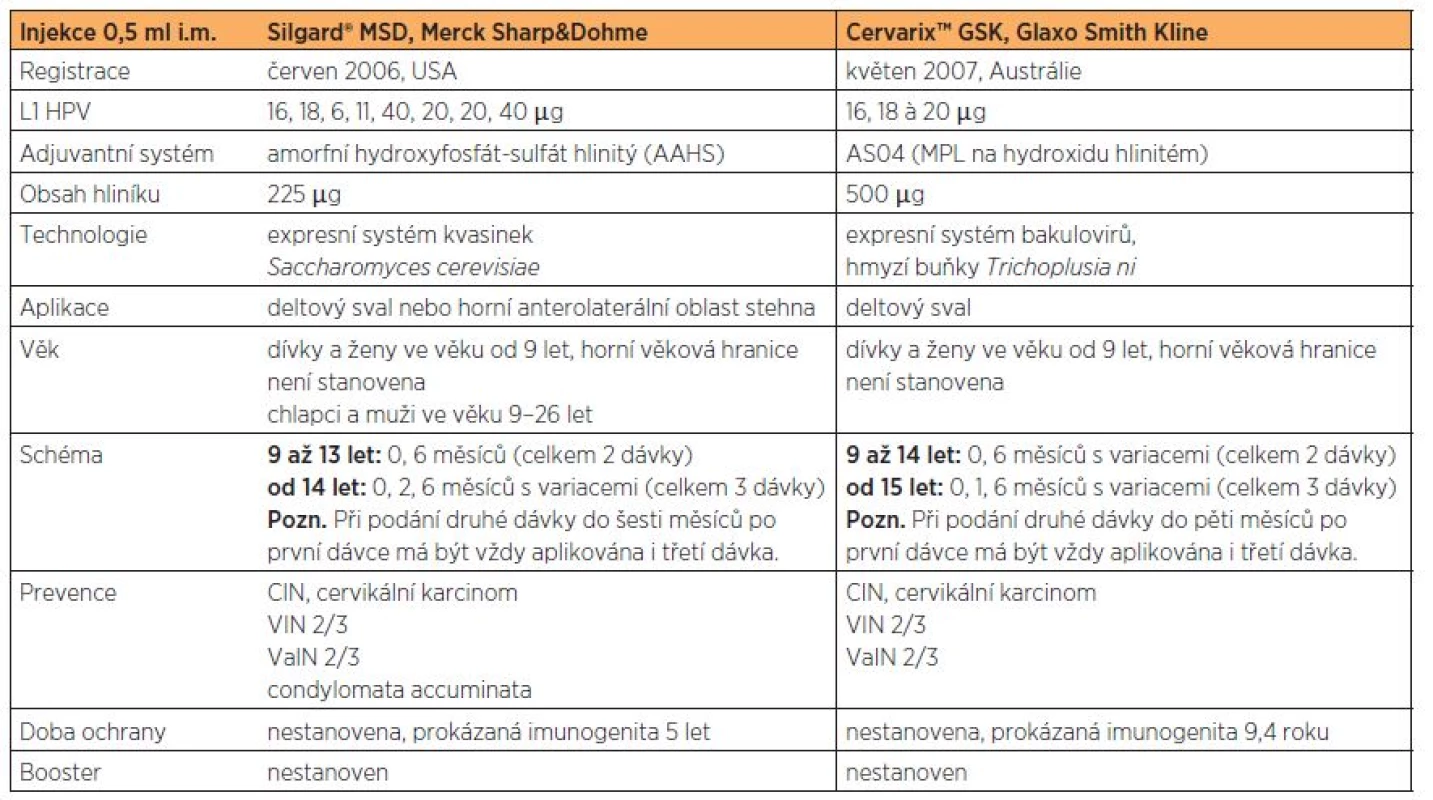
HPV vakcinace patří mezi finančně nejnákladnější očkování doporučená pro široké pokrytí populace, souhrnná cena všech dávek brání v nízko a středně ekonomicky rozvinutých státech realizaci plošného očkování dívčí populace [22]. Ale ani v ekonomicky rozvinutých státech nedokončí všichni doporučené třídávkové schéma. V USA v roce 2012 jen 33,4 % očkovaných obdrželo všechny dávky [7]. I z těchto důvodů se začalo uvažovat o možnosti redukce počtu dávek. Tím by se výrazně snížily náklady na vakcinaci a více očkovaných jedinců by dokončilo doporučené vakcinační schéma.
Studie účinnosti HPV vakcín byly primárně prováděny u mladých jedinců ve věku 15–26 let. Mladší dívky nebyly do těchto studií zahrnuty ze dvou důvodů. Klinickým výstupem těchto studií je diagnostikování prekancerózy, která se u takto mladých dívek může projevit za poměrně dlouhou dobu, a je proto pro studii u této věkové skupiny velmi limitujícím faktorem. Nedílnou součástí follow-up jsou také gynekologická vyšetření, která nejsou u takto mladých dívek eticky akceptovatelná.
Při sledování hladin protilátek po aplikaci tří dávek obou HPV vakcín ve standardním schématu u mladých dívek a chlapců (9–14 let) se zjistilo, že více než 99 % těchto jedinců tvoří 1,7–2krát vyšší hladiny protilátek než očkovaná populace ve věku 15–26 let při stejném režimu aplikace [7, 17, 21]. Tento poznatek se již projevil v klinické praxi. Na základě prokázané vysoké imunogenity u takto mladých jedinců a také kvůli snížení vysokých finančních nákladů zavedly na doporučení místních expertů některé regiony v Kanadě dvoudávkovou aplikaci kvadrivalentní HPV vakcíny v rámci školských plošných HPV očkovacích programů [9]. Nerandomizovaná analýza různě starých žen, které obdržely méně než tři dávky bivalentní HPV vakcíny v klinické studii v Kostarice, ukázala stejnou míru ochrany proti perzistující infekce HPV 16 nebo HPV 18 jako u očkovaných třemi dávkami [12]. Účinnost pro nízké věkové kohorty dívek mezi 9. a 14. rokem života byla odvozena na základě tzv. immunobridgingu, který byl již využit např. u vakcíny proti hepatitidě B [4]. Princip imunobridgingu spočívá ve stanovení postvakcinačních hladin protilátek bez ověření klinického výstupu účinnosti. Pokud titr hladiny protilátek ve studované kohortě je non-inferiorní ve srovnání s titrem hladin protilátek ve skupině, kde již byla účinnost prokázána, předpokládá se obdobná účinnost v obou skupinách. Výraz non-inferiorní se v odborné literatuře používá ve smyslu ekvivalentní, případně srovnatelný nebo obdobný, zejména však vyjadřuje, že nesmí být horší. Non-inferiorní klinické studie mají za úkol posoudit, zda studovaný subjekt není ve sledovaném parametru horší (mimo předem definovanou statisticky malou odchylku zvanou delta) než výchozí subjekt s již známým efektem. Pokud je non-inferiorita potvrzena, měl by studovaný subjekt mít posuzované vlastnosti v porovnání s komparátorem stejné nebo lepší [19].
K ověření dostatečné produkce protilátek, paměťových buněk a ke zhodnocení bezpečnosti HPV vakcín ve dvoudávkovém očkovacím schématu pro dívky ve věku 9–14 let bylo realizováno několik randomizovaných klinických studií [7, 13, 18, 21].
DVOUDÁVKOVÉ OČKOVACÍ SCHÉMA VAKCÍNY SILGARD
Vakcína Silgard (výrobce Merck Sharp & Dohme) je indikována k použití od věku 9 let k prevenci premaligních genitálních lézí (cervikálních, vulválních a vaginálních) a cervikálního karcinomu v příčinné souvislosti s jistými onkogenními typy lidského papilomaviru (HPV) a bradavic genitálu (condylomata accuminata) v příčinné souvislosti se specifickými typy HPV [25]. Vakcína Silgard obsahuje po 20 µg VLP (virus-like particles, viru podobné částice) kapsidového proteinu L1 genotypů HPV 6 a HPV 18 a po 40 µg VLP L1 genotypů HPV 11 a HPV 16, standardně se aplikuje nitrosvalově ve 3 dávkách ve schématu měsíc 0–2–6 s variacemi s maximálním rozptylem 1 rok [25].
Multicentrická studie sledující hladiny protilátek po dvoudávkové aplikaci kvadrivalentní HPV vakcíny proběhla ve třech provinciích Kanady u celkem 830 dívek a mladých žen rozřazených do tří paralelních skupin stratifikovaných ve dvou věkových kohortách [7]. Jednu věkovou kohortu tvořily dívky ve věku 9–13 let a druhou mladé ženy ve věku 16–26 let, které udávaly čtyři nebo méně životních sexuálních partnerů, v době zařazení do studie nebyly gravidní, neměly anamnézu CIN nebo genitálních bradavic. Ženy s pozitivní detekcí protilátek proti HPV 6, HPV 11, HPV 16 nebo HPV 18 byly ze studie vyřazeny. Mladé dívky byly randomizovány do dvou skupin, 259 z nich byla aplikována kvadrivalentní HPV vakcína ve dvoudávkovém schématu (měsíc 0–6) a 261 dívkám pak ve třídávkovém schématu (měsíc 0–2–6). Celkem 310 mladým ženám byla podána vakcína ve standardním třídávkovém schématu očkování (měsíc 0–2–6). Hladiny protilátek proti HPV 6, HPV 11, HPV 16 a HPV 18 byly měřeny ze vzorků séra metodou Luminex imunoassay za 7, 18, 24 a 36 měsíců po aplikaci první dávky. Celou studii dokončilo 675 (81 %) účastnic. Nejčastějším důvodem pro odstoupení ze studie byla absence krevních vzorků a nepokračování ve studii z osobních důvodů. Nebyla hlášena žádná závažná nežádoucí událost [7].
Hlavním cílem studie bylo posoudit non-inferioritu GMT (geometric mean titr, geometrický průměrný titr) protilátek u 9–13letých dívek po dvoudávkové aplikaci ve srovnání s GMT protilátek u mladých 16–26letých žen po třídávkové aplikaci pro hladiny proti HPV 16 a HPV 18 jeden měsíc po aplikaci poslední dávky (7. měsíc studie). Sekundárním cílem bylo sledování hladin protilátek a posouzení non-inferiority do 36. měsíce studie. Non-inferiorita byla potvrzena, pokud dolní limit 95% CI (intervalu spolehlivosti, confident interval) pro GMT protilátek byl při srovnání obou kohort nad 0,5. Poměr GMT byl jeden měsíc po aplikaci poslední dávky non-inferiorní pro dívky se dvěma dávkami ve srovnání s GMT u mladých žen se třemi dávkami pro HPV 16 (2,07; 95% CI: 1,62–2,65) a pro HPV 18 (1,76; 95% CI: 1,41–2,19). Non-inferiorita poměrů hladin GMT sledovaných protilátek proti HPV 6, HPV 11, HPV 16 a HPV 18 u dívek ve věku 9 až 13 let ve srovnání s GMT u mladých žen ve věku 15 až 26 let přetrvávala po celou sledovanou dobu 36 měsíců od aplikace první dávky (tab. 2) [7].
Tab. 2. GMT protilátek proti HPV 6, HPV 11, HPV 16 a HPV 18 ve věkově stratifikovaných kohortách po aplikaci kvadrivalentní HPV vakcíny s různým schématem očkování 36 měsíců po aplikaci první dávky [7] ![GMT protilátek proti HPV 6, HPV 11, HPV 16 a HPV 18 ve věkově stratifikovaných kohortách po aplikaci kvadrivalentní HPV vakcíny s různým schématem očkování 36 měsíců po aplikaci první dávky [7]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/8cabcf4f7656ba6a173a213e6aaebcfa.jpg)
mMU/ml – milli-Merk jednotka na mililitr GMT – geometric mean titr, geometrický průměrný titr GMR – geometric mean ratio, poměr geometrických měrných titrů protilátek NA – not applicable *prokázaná non-inferiorita DVOUDÁVKOVÉ OČKOVACÍ SCHÉMA VAKCÍNY CERVARIX
Vakcína Cervarix (výrobce GlaxoSmithKline) je indikována pro prevenci přednádorových genitálních lézí (cervikálních, vulválních a vaginálních) a karcinomu děložního hrdla, které jsou způsobeny určitými vysoce rizikovými HPV genotypy [5]. Vakcína Cervarix obsahuje po 20 µg VLP (virus-like particles, viru podobné částice) kapsidového proteinu L1 genotypů HPV 16 a HPV 18, je formulována s adjuvantním systémem AS04, který se skládá z monofosforyl lipidu A (MPL) 50 µg adsorbovaného na 500 µg aluminium hydroxidu a standardně se aplikuje nitrosvalově ve třech dávkách ve schématu měsíc 0–1–6 s variacemi s maximálním rozptylem 1 rok [5]. Studie doložily určitou míru zkřížené ochrany i proti některým nevakcinačním HR HPV genotypům. Mechanismus této zkřížené protekce nebyl doposud plně vysvětlen, ale předpokládá se, že souvisí s fylogenetickou příbuzností HPV virů a vysokými titry protilátek indukovaných díky AS04 [1].
Studie sledující hladiny protilátek po dvoudávkové aplikaci bivalentní HPV vakcíny byla multicentrická (21 center v Německu a v Kanadě), částečně dvojitě slepá, randomizovaná a věkově stratifikovaná (rozčlenění na věkové skupiny 9–14 let, 15–19 let a 20–25 let). Do studie bylo zahrnuto 960 zdravých dívek a žen s negativním těhotenským testem, které byly rozčleněny do čtyř skupin. Všem respondentkám byla aplikována bivalentní HPV vakcína, ale v různých dávkách obou HPV antigenů a v různých schématech aplikace. Skupina 240 dívek a žen obdržela 40 µg/40 µg obou HPV antigenů ve schématu měsíc 0–2, jiných 241 dívek dostalo 40 µg/40 µg ve schématu 0–6, dalším 240 bylo aplikováno 20 µg/20 µg ve schématu 0–6 a zbylým 239 bylo podáno 20 µg/20 µg ve schématu měsíc 0–1–6. Respondentky s aplikací dvou dávek vakcíny obdržely místo třetí dávky placebo [21]. Následně byly zjišťovány hladiny protilátek metodou ELISA v měsíci 0, 3, 7, 12, 18, 24, 36 a 48 od aplikace první dávky, celková délka trvání studie je plánována na 60 měsíců (36). Non-inferiorita byla potvrzena, pokud horní limit 95% intervalu spolehlivosti byl pro GMT protilátek u každé věkové skupiny ve srovnání s GMT protilátek indukovaných u 15–25letých dívek a žen se standardním třídávkovým schématem (měsíc 0–1–6) pod 2 [21].
Ve skupinách dívek ve věku 9–14 let vykazovaly obě ramena studie s dvoudávkovou aplikací v měsíci 0–6 a s rozdílnou dávkou antigenů (20 µg/20 µg vs. 40 µg/40 µg) obdobné titry protilátek s výjimkou výrazně vyšších hladin 1 měsíc po aplikaci poslední dávky (7. měsíc studie) u dívek po podání 40 µg/40 µg obou HPV antigenů. Naproti tomu, u stejně starých dívek ve větvi (40 µg/40 µg, měsíc 0–2) byly detekovány vysoké hladiny protilátek jeden měsíc po aplikaci poslední dávky (3. měsíc studie), ale hodnoty postupně klesaly a jejich GMT byl řádově nižší než u ostatních skupin. Hodnoty GMT protilátek proti HPV 16 a HPV 18 za 24 měsíců po aplikaci první dávky ve věkově stratifikovaných kohortách s odlišnou dávkou obou antigenů a různým schématem aplikace shrnuje tabulka 3 [21].
Tab. 3. GMT protilátek proti HPV 16 a HPV 18 ve věkově stratifikovaných kohortách po aplikaci bivalentní HPV vakcíny s odlišnou dávkou obou antigenů a různým schématem očkování 24 měsíců po aplikaci první dávky [21] ![GMT protilátek proti HPV 16 a HPV 18 ve věkově stratifikovaných kohortách po aplikaci bivalentní HPV vakcíny s odlišnou dávkou obou antigenů a různým schématem očkování 24 měsíců po aplikaci první dávky [21]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/00a15482dde7476924e692f643b7f5b1.jpg)
EU/ml – ELISA jednotka na mililitr GMT – geometric mean titr, geometrický průměrný titr GMR – geometric mean ratio, poměr geometrických měrných titrů protilátek NA – not applicable *prokázaná non-inferiorita Také u nevakcinačních genotypů HPV 31 a HPV 45 byla zaznamenána non-inferiorní imunogenita u dívek ve věku 9–14 let s dvoudávkovým schématem aplikace (20/20 µg, měsíc 0–6). GMT protilátek 48 měsíců po aplikaci první dávky byl ve skupině s dvěma dávkami 195 EU/ml (95% CI; 144–263) proti HPV 31 a 156 EU/ml (95% CI; 114–214) proti HPV 45 a v kohortě 15–25letých se standardním třídávkovým schématem byl zjištěn GMT 241 EU/ml (95% CI; 166–350) proti HPV 31 a 147 EU/ml (95% CI; 102–212) proti HPV 45 [20]. Ze závěrů této studie vyplynulo, že protilátková odpověď pro HPV 16, HPV 18, HPV 31 a HPV 45 je po dvoudávkovém očkovacím schématu (měsíc 0–6) u 9–14letých dívek minimálně po dobu 48 měsíců non-inferiorní ve srovnání s hladinami protilátek indukovanými po očkování ve třídávkovém schématu (měsíc 0–1–6) u 15–25letých žen [20].
Výsledky byly částečně potvrzeny studií z Mexika [13]. Celkem 474 dívek ve věku 9–10 let a 500 žen ve věku 18–24 let dostalo tři standardní dávky bivalentní HPV vakcíny (schéma 0–1–6) a 1026 dívek ve věku 9–10 let obdrželo dvě dávky (schéma 0–6). Plán studie počítá u těchto dívek ještě s aplikací třetí dávky 60 měsíců po první dávce [13]. Hladiny protilátek proti HPV 16 a HPV 18 byly měřeny metodou ELISA. Nejvyšší imunogenita byla zjištěna u 9–10letých dívek se standardním schématem (měsíc 0–1–6). Výsledky prokázaly non-inferiorní hladiny protilátek proti HPV 16 a HPV 18 za 21–22 měsíců po aplikaci první dávky ve skupině dívek ve věku 9–10 let s dvoudávkovým schématem aplikace (měsíc 0–6) ve srovnání s hladinami protilátek u žen ve věku 18–24 let po aplikaci tří dávek ve standardním schématu (měsíc 0–1–6) [13].
Do jiné multicentrické studie (Německo, Kanada, Itálie, Thajsko, Tchaj-wan) bylo zahrnuto 1447 dívek a žen [18]. Skupina 550 dívek ve věku 9–14 let obdržela dvě dávky vakcíny Cervarix (měsíc 0–6), dalším 415 stejně starým dívkám byla aplikována vakcína ve dvoudávkovém schématu (měsíc 0–2) a poslední skupinu tvořilo 482 žen ve věku 15–25 let s třídávkovou aplikací (měsíc 0–1–6). Při analýze hladin protilátek 7 měsíců po aplikaci první dávky byla u 9–14letých dívek (schéma 0–6) pro HPV 16 a HPV 18 non-inferiorní protilátková odpověď ve srovnání s 15–25letými ženami (schéma 0–1–6). Také specifická odpověď T - a B-lymfocytů pro tyto genotypy byla ve stejných skupinách non-inferiorní [18].
ZÁVĚR
Karcinom děložního hrdla a některé další karcinomy jsou důsledkem perzistující infekce onkogenními genotypy HPV. Přítomnost neutralizačních protilátek, které jsou indukovány vakcinací, brání přenosu infekce nejčastějšími onkogenními genotypy. Nově se obě HPV vakcíny mohou aplikovat ve dvoudávkovém schématu. Kvadrivalentní vakcína Silgard je ve dvoudávkovém schématu určena pro dívky ve věku 9–13 let ve schématu 0–6 měsíců. Pokud se druhá dávka podá dříve než za 6 měsíců po dávce první, je nutno aplikovat tři dávky. Bivalentní vakcína Cervarix se aplikuje 9–14letým dívkám ve dvou dávkách ideálně ve schématu 0–6 měsíců, druhá dávka se může podat 5–13 měsíců po dávce první. Pokud se druhá dávka podá dříve než za 5 měsíců po dávce první, je nutno aplikovat tři dávky. Non-inferiorní imunogenita byla prokázána u těchto věkových kohort po dobu 36 měsíců pro Silgard a po dobu 48 měsíců pro Cervarix.
Kromě toho byly obě HPV vakcíny u mladých dívek ve dvoudávkovém schématu dobře tolerovány, žádná z dívek ani žen nemusela během 48 měsíců odstoupit ze studie pro závažný nežádoucí účinek a obě ramena vykazovala srovnatelný klinický bezpečnostní profil.
Dvoudávkové očkovací schéma jednoznačně sníží náklady na plošnou HPV vakcinaci a ve větší míře zpřístupní toto očkování i v ekonomicky méně rozvinutých státech. Pravděpodobně také umožní zvýšení počtu jedinců, kteří dokončí doporučené vakcinační schéma, a usnadní tak implementaci HPV vakcinace do očkovacích kalendářů v jednotlivých zemích. Tyto závěry přijala a uveřejnila ve své zprávě Evropská komise pro zdravotnictví EMEA (European Medical Evaluation Agency) a byly uvedeny v SPC obou přípravků.
MUDr. Borek Sehnal
Gynekologicko-porodnická klinika
Nemocnice Na Bulovce
Budínova 2
180 81 Praha 8
e-mail: boreksehnal@seznam.cz
Zdroje
1. Beran, J. Význam adjuvantního systému AS04 ve vakcíně proti lidskému papilomaviru. Vakcinologie, 2013, 7, s. 64–71.
2. Bouvard, V., Baan, R., Straif, K., et al. A review of human carcinogens – Part B: biological agents. Lancet Oncol, 2009, 10(4), p. 321–322.
3. Carter, JJ., Koutsky, LA., Hughes, JP., et al. Comparison of human papillomavirus types 16, 18, and 6 capsid antibody responses following incident infection. J Inf Diseas, 2000, 181(6), p. 1911–1919.
4. Cassidy, WM., Watson, B., Ioli, VA., et al. A randomized trial of alternative two and three-dose hepatitis B vaccination regimens in adolescents: antibody responses, safety and immunologic memory. Pediatrics, 2001, 107, p. 626–631.
5. Cervarix SPC (Summary of Product Characteristics, Souhn údajů o přípravku). Available from: http://www.medicines.org.uk/emc/medicine/20204/SPC/cervarix/
6. De Vuyst, H., Clifford, GM., Nascimento, MC., et al. Prevalence and type distribution of human papillomavirus in carcinoma and intraepithelial neoplasia of the vulva, vagina and anus: a meta-analysis. Int J Cancer, 2009, 124(7), p. 1626–1636.
7. Dobson, SR., McNeil, S., Dionne, M., et al. Immunogenicity of 2 doses of HPV vaccine in younger adolescents vs 3 doses in young women: a randomized clinical trial. JAMA, 2013, 309(17), p. 1793–1802.
8. Driák, D., Sehnal, B. Význam infekcí způsobených lidskými papilomaviry. Čas Lék čes, 2013, 152, s. 15–19.
9. Eggertson, L. Three provinces to study 2-dose HPV vaccine. CMAJ, 2007, 177(5), p. 444–445.
10. Fehrmann, F., Laimins, LA. Human papillomaviruses: targeting differentiating epithelial cells for malignant transformation. Oncogene, 2003, 22, p. 5201–5207.
11. Ferlay, J., Shin, HR., Bray, F., et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer, 2010, 127(12), p. 2893–2917.
12. Kreimer, AR., Rodriguez, AC., Hildesheim, A., et al. Proof-of-principle evaluation of the efficacy of fewer than three doses of a bivalent HPV16/18 vaccine. J Natl Cancer Inst, 2011, 103(19), p. 1444–1451.
13. Lazcano-Ponce, E., Stanley, M., Muñoz, N., et al. Overcoming barriers to HPV vaccination: non-inferiority of antibody response to human papillomavirus 16/18 vaccine in adolescents vaccinated with a two-dose vs. a three-dose schedule at 21 months. Vaccine, 2014, 32(6), p. 725–732.
14. Malik, ZA., Hailpern, SM., Burk, RD. Persistent antibodies to HPV virus-like particles following natural infection are protective against subsequent cervicovaginal infection with related and unrelated HPV. Viral Immunol, 2009, 22(6), p. 445–449.
15. Muñoz, N., Bosch, FX., de Sanjose, S., et al. Epidemiologic classification of human papillomavirus types associated with cervical cancer. N Engl J Med, 2003, 348, p. 518–527.
16. Parkin, DM., Bray, F. The burden of HPV-related cancers. Vaccine, 2006, 24 (Suppl 3), p. 11–25.
17. Pedersen, C., Petaja, T., Strauss, G., et al. Immunization of early adolescent females with human papillomavirus type 16 and 18 L1 virus-like particle vaccine containing AS04 adjuvant.J Adolesc Health, 2007, 40, p. 564–571.
18. Puthanakit, T., Schwarz, T., Esposito, S., et al. Immune response to a 2-dose schedule of the HPV-16/18 AS04–-adjuvanted vaccine in girls (9–14) versus 3 doses in women (15–25): a randomized trial. Abstract. Oral presentation. Eurogin, 2013, 3.–6. 11. 2013, Florencie, Itálie.
19. Ricci, S. What does ‚non-inferior to‘ really mean? A clinician thinking out loud. Cerebrovasc Dis, 2010, 29, p. 607–608.
20. Romanowski, B., Schwarz, T., Ferguson, L., et al. Immune response to the HPV-16/18 AS04-adjuvanted vaccine administered as a 2-dose or 3-dose schedule up to 4 years after vaccination. Abstract. Poster. Eurogin, 2013, 3.–6. 11. 2013, Florencie, Itálie.
21. Romanowski, B., Schwarz, TF., Ferguson, LM., et al. Immune response to the HPV-16/18 AS04-adjuvanted vaccine administered as a 2-dose or 3-dose schedule up to 4 years after vaccination: Results from a randomized study. Hum Vaccin Immunother, 2014, 10(5), p. 1374–1386.
22. Sabin Vaccine Institute. Price is the Main Barrier to Wider Use of Papillomavirus Vaccine. Available from: http://www.sabin.org/updates/news/price-main-barrier-wider-use-papillomavirus-vaccine.
23. Safaeian, M., Porras, C., Schiffman, M., et al. Epidemiological study of anti-HPV16/18 seropositivity and subsequent risk of HPV16 and -18 infections. J Natl Cancer Inst, 2010, 102(21), p. 1653–1662.
24. Schwarz, TF. ASO4-adjuvanted human papillomavirus - 16/18 vaccination: recent advances in cervical cancer prevention. Expert Rev Vaccines, 2008, 7, p. 1465–1473.
25. Silgard, SPC (Summary of Product Characteristics, Souhn údajů o přípravku). Available from: http://www.medicines.org.uk/emc/medicine/19016/SPC/gardasil/
26. Spitzer, M. Human papillomavirus: epidemiology, natural history, and clinical sequelae. OBG Management, 2006, 18, p. S5–S10.
27. Tjalma, WA., Fiander, A., Reich, O., et al. Differences in human papillomavirus type distribution in high-grade cervical intraepithelial neoplasia and invasive cervical cancer in Europe Int J Cancer, 2013, 132, p. 854–867.
28. Trollfors, B. Human papillomavirus vaccines: an outsider´s point of view. Expert Rev Vaccines, 2008, 7, p. 1131–1133.
29. Viscidi, RP., Schiffman, M., Hildesheim, A., et al. Sero-reactivity to human papillomavirus (HPV) types 16, 18, or 31 and risk of subsequent HPV infection: results from a population-based study in Costa Rica. Cancer Epidemiol Biomarkers Prev, 2004, 13(2), p. 324–327.
30. Vonka, V., Kanka, J., Hirsch, I., et al. Prospective study on the relationship between cervical neoplasia and herpes simplex type-2 virus. II. Herpes simplex type-2 antibody presence in sera taken at enrollment. Int J Cancer, 1984, 33(1), p. 61–66.
31. Walboomers, JM., Jacobs, MV., Manos, MM., et al. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide. J Pathol, 1999, 189(1), p. 12–19.
32. White, EA., Sowa, ME., Tan, MJ., et al. Systematic identification of interactions between host cell proteins and E7 oncoproteins from diverse human papillomaviruses. Proc Natl Acad Sci USA, 2012, 109, p.260–7.
33. zur Hausen, H. Condylomata acuminata and human genital cancer. Cancer Res, 1976, 36, p. 794.
34. zur Hausen, H. Human genital cancer: synergism between two virus infections or synergism between a virus infection and initiating events? Lancet, 1982, 2(8312), p. 1370–1372.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článok vyšiel v časopiseČeská gynekologie
Najčítanejšie tento týždeň
2015 Číslo 1- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Ne každé mimoděložní těhotenství musí končit salpingektomií
- Gynekologické potíže pomáhá účinně zvládat benzydamin
- Mýty a fakta ohledně doporučení v těhotenství
-
Všetky články tohto čísla
- Rizikové faktory poškození svalů pánevního dna v souvislosti s vaginálním porodem
- Eklampsie jako příčina sekundární neobstrukční centrální spánkové hypoventilace
- Hyperechogenita intestina jako marker cystické fibrózy u plodu
- Užití transuretrální aplikace polyacrylamid hydrogelu (Bulkamidu®) k léčbě recidivující stresové incontinence moči po selhání efektu páskových operací
- HPV v etiologii orofaryngeálního karcinomu a jeho vztah k sexuální aktivitě
- Vaginální porod s použitím vakuumextraktoru není spojen se signifikantně vyšším výskytem avulzního poranění levátorů
- Bazaliom vulvy u 37leté pacientky
- Přední poševní plastika v lokální anestezii
- Opakované selhání implantace embrya a trombofilie
- Dvoudávkové očkovací schéma HPV vakcín u mladých adolescentů
- Fetálna magnetokardiografia: Sľubný spôsob diagnostiky fetálnych arytmií a štúdia fetálnej srdcovej variability?
- Močová inkontinence indukovaná antidepresivy – kazuistické sdělení
- Peripartální život ohrožující krvácení s nutností provedení hysterektomie jako život zachraňujícího výkonu – kazuistika
- 4G/4G polymorfismus genu pro inhibitor aktivátoru plazminogenu 1 (PAI-1) jako nezávislý rizikový faktor placentární insuficience, způsobující u plodu hemodynamickou centralizaci
- Placenta accreta – kazuistika
- Současné poznatky z XX. sympozia imunologie reprodukce a biologie s mezinárodní účastí
-
Doc. MUDr. Milan Šindlář, CSc.
50 let samostatné klinické činnosti ve zdravotnictví
- Česká gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- 4G/4G polymorfismus genu pro inhibitor aktivátoru plazminogenu 1 (PAI-1) jako nezávislý rizikový faktor placentární insuficience, způsobující u plodu hemodynamickou centralizaci
- Rizikové faktory poškození svalů pánevního dna v souvislosti s vaginálním porodem
- Přední poševní plastika v lokální anestezii
- Užití transuretrální aplikace polyacrylamid hydrogelu (Bulkamidu®) k léčbě recidivující stresové incontinence moči po selhání efektu páskových operací
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



