-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Nízkoobjemové metastatické postižení lymfatických uzlin u karcinomu endometria
Low-volume metastatic nodal disease in endometrial cancer
Aim: To review contemporary knowledge of the low volume metastatic disease in patients with endometrial cancer.
Type of study: A literatue review.
Settings: Department of Obstetrics and Gynecology, University Hospital Olomouc; Department of Clinical and Molecular Pathology, University Hospital Olomouc.
Introduction: The presence of micrometastases or isolated tumor cells in the sentinel node detected by ultrastaging leads to the change of tumor stage. Low volume lymph node involvement represents up to 30% of the affected lymph nodes in patients with endometrial cancer. The enhanced sentinel lymph node investigation aims to more accurately determine the extent of illness from stage I to stage IIIC. Particularly important is the detection of low-volume metastatic nodal involvement in low-risk tumors, because compared with macrometastases, micrometastases may occure earlier in tumours with lower carcinologic aggressiveness.
Conclusion: Detection of low volume metastatic disease decrease the false negativity of nodal involvement and is helpful for adjuvant treatment planning.
Keywords:
endometrial cancer – low-volume disease – metastatic lymphonode involvement – pathological ultrastaging
Autoři: J. Hambálek 1; M. Maděrka 1
; M. Kolečková 2; R. Pilka 1
Působiště autorů: Porodnicko-gynekologická klinika LF UP a FN, Olomouc, přednosta prof. MUDr. R. Pilka, Ph. D. 1; Ústav klinické a molekulární patologie LF UP a FN, Olomouc, přednosta prof. MUDr. Z. Kolář, Ph. D. 2
Vyšlo v časopise: Ceska Gynekol 2019; 84(6): 458-462
Kategorie: Přehledová práce
Souhrn
Cíl studie: Přinést aktuální literární přehled o diagnostickém a terapeutickém významu detekce nízkoobjemového metastatického postižení uzlin u pacientek s karcinomem endometria.
Typ studie: Přehledová práce.
Název a sídlo pracovistě: Porodnicko-gynekologická klinika LF UP a FN Olomouc; Ústav klinické a molekulární patologie LF UP a FN Olomouc.
Úvod: Přítomnost mikrometastáz nebo izolovaných nádorových buněk (ITC) v sentinelové uzlině zjištěné ultrastagingem mění rozsah (stage) onemocnění. Nízkoobjemové metastatické postižení uzlin představuje až 30 % z postižených uzlin u pacientek s karcinomem endometria. Rozšířené vyšetřování sentinelovych uzlin má za cíl přesnější určení rozsahu nemoci ze stadia I na stadium IIIC. Zvláště důležité je odhalení nízkoobjemového metastatického postižení uzlin u low-risk karcinomů, které, jak se zdá, zakládají mikrometastázy dříve.
Závěr: Detekce nízkoobjemového metastatického postižení uzlin snižuje falešnou negativitu uzlinového postižení a umožňuje správné nastavení adjuvantní léčby.
Klíčová slova:
karcinom endometria – nízkoobjemové onemocnění – metastatické postižení uzlin – patologický ultrastaging
ÚVOD
V roce 2018 bylo v Evropě 121 578 nově diagnostikovaných případů zhoubného onemocnění děložní sliznice [13]. V České republice je hlášeno téměř 2000 nově vzniklých případů ročně [30]. Od roku 1988 stále platí FIGO koncept chirurgického stagingu karcinomu endometria, který zahrnuje hysterektomii, oboustrannou salpingo-ooforektomii, pánevní a paraaortální lymfadenektomii a peritoneální laváž [1]. Doporučení ESGO-ESMO-ESTRO skupiny z roku 2018 již nepovažují peritoneální laváž za povinnou součást chirurgického stagingu [14]. I když lymfadenektomie byla doporučenou součástí chirurgického stagingu, indikace k rutinní lymfadenektomii je i po 30 letech praxe předmětem diskusí [4, 5, 16]. Tuto diskusi o přínosu lymfadenektomie podpořily také dvě velké nezávislé randomizované studie, které nepotvrdily pozitivní vliv lymfadenektomie na dobu přežití [3, 19]. Vzhledem k nejednotným výsledkům uváděným v literatuře stále není možné navrhnout konečné doporučení týkající se terapeutického přínosu z disekce lymfatických uzlin [4]. I s ohledem na tuto nejasnot je možné v doporučeních NCCN nalézt heterogenitu v akceptovaných terapeutických postupech u karcinomu endometria [23].
V posledních letech se do popředí zájmu dostává otázka významu detekce a vyšetření sentinelové lymfatické uzliny u karcinomu endometria s ohledem na možnost snížení operační zátěže u pacientek s touto diagnózou. Zcela zásadní u tohoto postupu je úspěšnost detekce, detailní histopatologické zpracování a interpretace výsledků vyšetření sentinelové lymfatické uzliny. Výsledky prací z posledních let ukazují, že disekce sentinelové lymfatické uzliny je relativně spolehlivou metodou k průkazu postižení lymfatických uzlin bez nutnosti provedení systematické lymfadenektomie [27, 28, 32]. Řada retrospektivních studií ukazuje, že doba přežití a onkologické výstupy jsou srovnatelné u obou skupin pacientek [6, 28]. Ultrastaging sentinelové uzliny umožnuje rovněž detekci nízkoobjemového metastatického postižení lymfatických uzlin ve smyslu mikrometastáz (≤ 0,2–2,0 mm) a izolovaných tumorových buněk (ITC) ≤ 0,2 mm). Nicméně prognostický a terapeutický význam přítomnosti mikrometastáz a ITC u karcinomu endometria zatím není dostatečně objasněn [8, 25]. V tomto literárním přehledu přinášíme dosavadní poznatky o významu přítomnosti nízkoobjemového metastatického postižení lymfatických uzlin u karcinomu endometria.
DETEKCE SENTINELOVYCH UZLIN
Děloha má složitou síť odtokových lymfatických cév a drenáž lymfy je komplexním procesem. Existují dvě hlavní odtokové lymfatické cesty. Horní paracervikální cesta (upper paracervical pathway – UPP) běží podél uterinní arterie a drénuje ilické externí a obturatorní uzliny, dolní paracervikální cesta (lower paracervical pathway – LPP) leží na horním okraji sakrouterinního ligamenta mediálně od a. iliaca interna. Touto cestou je odváděna lymfa z nodi lymphatici iliaci interni a z presakrálních uzlin. Obě cesty pokračují do prekaválního a paraaortálního prostoru. Detekována byla ještě třetí odtoková cesta – infundibulopelvická (infundibulo-pelvic pathway – IPP), která běží podél vejcovodu přes ligamentum infundibulopelvicum a drénuje lymfu vysoko do paraaortální oblasti. Tato cesta se zobrazuje po aplikaci značící látky do děložního fundu [15].
Z poslední anatomické studie vyplývá, že optimálně by měla být identifikována alespoň jedna sentinelová uzlina (SLN) z každé odtokové dráhy oboustranně. Podání značicí látky intracervikálně má vyšší úspěšnost v detekci SLN oproti samostatné fundální aplikaci [15]. Úspěšnost oboustranné detekce SLN se zvyšuje použitím methylenové modři v kombinaci s techneciem nebo s použitím indocyaninové zeleně (ICG) [9]. Původní myšlenka lymfatického šíření karcinomu endometria tvrdila, že primárně jsou postiženy lymfatické uzliny pánve a paraaortální lymfatické uzliny až sekundárně [10]. Ve skutečnosti je velká část děložních lymfatik drénovaná přes paracervikální odtokové cesty a zároveň také přímo do paraaortálních uzlin podél infundibulopelvického ligamenta [7]. Úspěšnost detekce paraaortální sentinelové uzliny je vyšší při korporální nebo hluboké intrastromální (3–4 cm) cervikální aplikaci značicí látky [22]. Výskyt izolované pozitivní paraaortální sentinelové lymfatické uzliny je vzácný (< 5% případů) [9].
ULTRASTAGING
Pomocí vyšetření lymfatických uzlin můžeme identifikovat mimoděložní šíření nádoru a správně nastavit další onkologickou léčbu [5]. Ultrastaging spočívá v detailním zpracování lymfatické uzliny za účelem vyhodnocení jejího metastatického postižení. Protokol ke zpracování sentinelové uzliny u karcinomu endometria byl převzat z protokolu zpracování SLN u karcinomu prsu. Standardně kompletně zpracované a sériově prokrájené sentinelové lymfatické uzliny jsou nejdříve vyšetřeny v základním histologickém barvení hematoxylinem a eozinem (obr. 1), které je v případě jakýchkoliv sporných nálezů rozšířeno o potvrzující imunohistochemické vyšetření, např. průkazem exprese cytokeratinu AE1/AE3 nádorovými buňkami (obr. 2). Následný ultrastaging je proveden až v případě, že primární vyšetření neprokázalo metastatické postižení [32]. Tento způsob vyšetření umožňuje odhalit postižení lymfatických uzlin mikrometastázou či výskyt izolovaných nádorových buněk, které mohou být v histologickém vyšetření obtížněji identifikovatelné [21].
Obr. 1. Izolované nádorové buňky v sentinelové lymfatické uzlině po barvení hematoxylinem-eozinem (Ústav klinické a molekulární patologie LF UP a FN Olomouc) 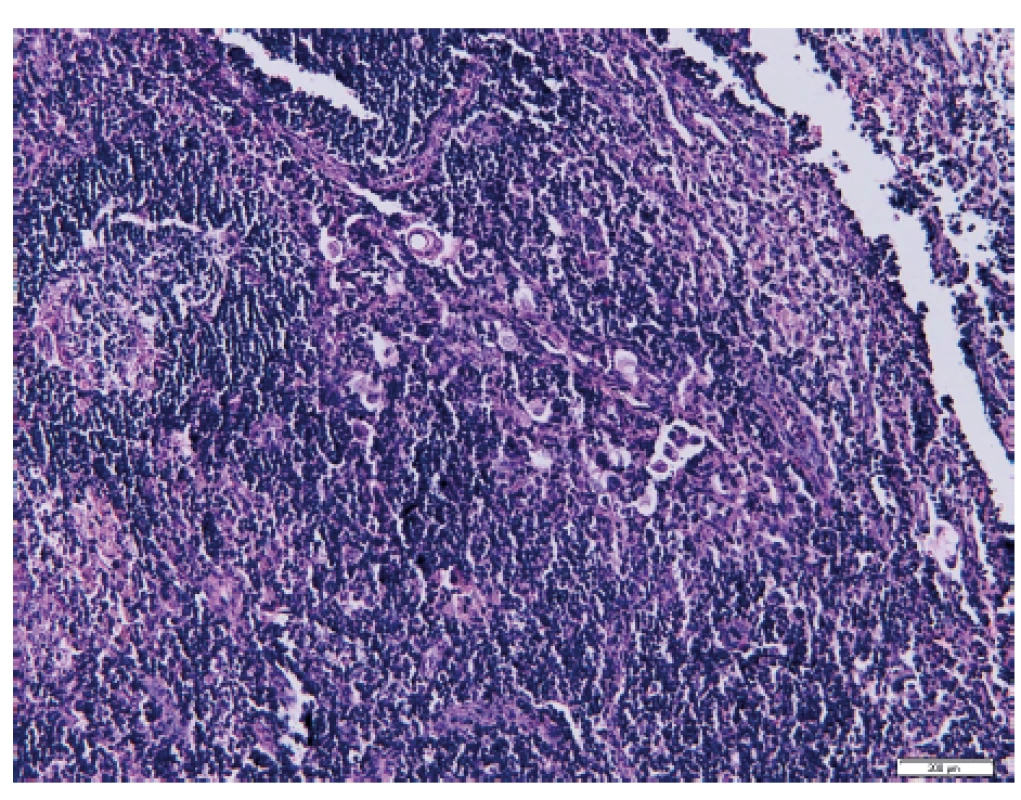
Obr. 2. Izolované nádorové buňky v sentinelové lymfatické uzlině s pozitivním průkazem při imunohistochemickém vyšetření (Ústav klinické a molekulární patologie LF UP a FN Olomouc) 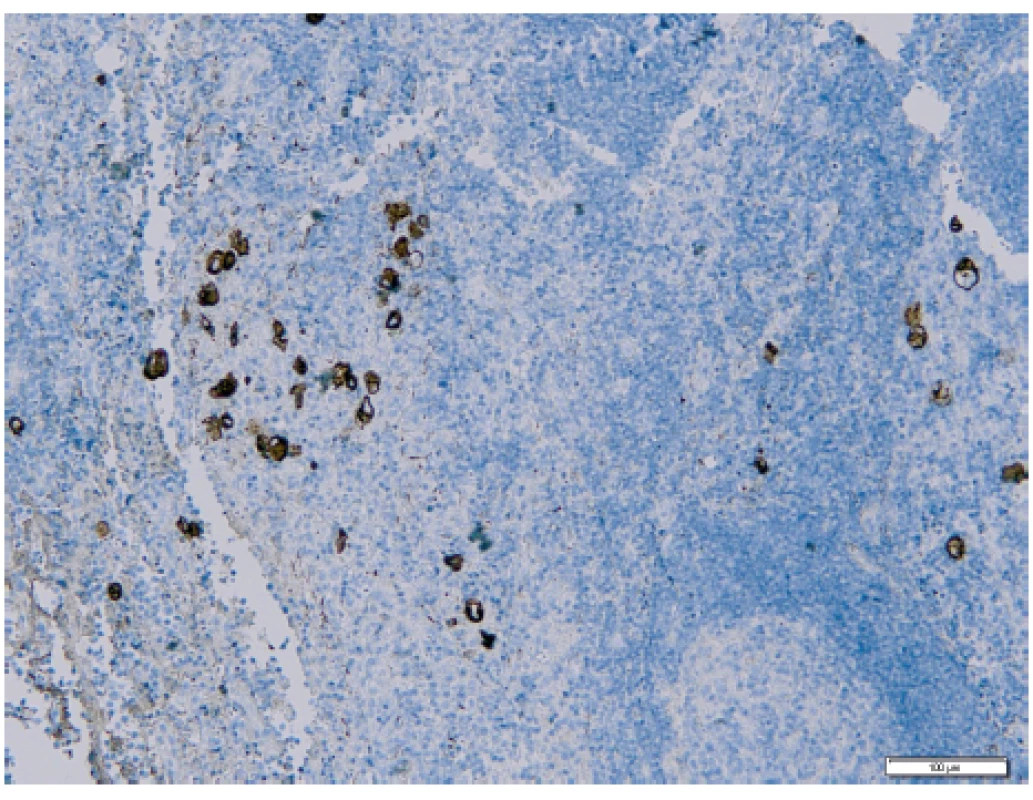
AJCC (American Joint Committee on Cancer) definuje mikrometastázu jako nádorové ložisko velikosti 0,2–2 mm v největším průměru. Shluky ITC jsou jednotlivé nádorové buňky nebo malé shluky buněk do 0,2 mm v největším rozměru, které mohou být detekovány běžným H&E barvením nebo imunohistochemickým vyšetřením. Definice ITC je závislá na lokalizaci nádoru. Jako doplňující kritérium bylo navrženo zahrnout shluky obsahující méně než 200 buněk v jednom histopatologickém řezu [17]. Pro ITC je charakteristické to, že nevykazují známky metastatické aktivity (např. proliferaci či reakci stromatu nebo penetraci skrze stěny cévních a mízních splavů). Případy s ITC v mízních uzlinách či vzdálených lokalizacích by měly být klasifikovány jako pN0(i+) [11, 17]. Ultrastagingové protokoly se na různých pracovištích liší. Pro gynekologickou patologii zatím neexistují doporučené postupy pro ultrastaging SLN. Metastázy do lymfatických uzlin jsou klasifikovány podle nomenklatury převzaté z vyhodnocování nálezů v lymfatických uzlinách u karcinomu prsu. Pokud jsou v uzlině přítomny izolované tumorové buňky bez přítomnosti mikrometastáz a makrometastáz, jedná se o stadium pN0(i+) [11].
NÍZKOOBJEMOVÉ METASTATICKÉ POSTIŽENÍ UZLIN – MIKROMETASTÁZY A IZOLOVANÉ NÁDOROVÉ BUŇKY
Patologický ultrastaging u karcinomů endometria zvyšuje záchyt výskytu mikrometastáz v regionálních lymfatických uzlinách. Prevalence nízkoobjemového metastatického postižení uzlin se v různých studiích liší [27, 28, 32]. V prospektivní studii FIRES byla zjištěna přítomnost metastatického postižení v sentinelové uzlině u 35 pacientek. Přítomnost mikrometastázy nebo ITC bylo přítomno u 21 pacientek, z toho u dvou pacientek byla v SLN nalezena mikrometastáza spolu s makrometastázou a u 19 pacientek jenom mikrometastáza nebo ITC. U těchto 19 pacientek (tedy 54 % případů) bylo nízkoobjemové metastatické postižení uzlin identifikováno jenom díky ultrastagingovému vyšetření (vyšetření hematoxylinem-eozinem bylo negativní) [27]. V devíti případech (47 %) se pak jednalo o mikrometastázu, ve zbylých 10 případech (53 %) o ITC. Prevalence nízkoobjemového metastatického postižení uzlin je v této studii 54 % [27].
Kolektiv autorů Plante et al. provedl mapování sentinelové lymfatické uzliny u celkem 519 pacientek, z toho v 85 případech (16 %) s pozitivním průkazem metastastatického postižení do regionálních lymfatických uzlin. Metastáza o rozměru větším než 2 mm byla u analyzovaného souboru přítomna ve 43 případech (51 %), mikrometastáza v 11 (13 %) a ITC v 31 (36 %) případech. Prevalence nízkoobjemového metastatického postižení lymfatických uzlin byla v této studii 49 % [26].
Kim et al. ve své studii popisují data 635 nemocných léčených pro karcinom endometria. U 80 % (508 žen) byla detekována SLN. U 64 (12,6 %) nemocných byla zjištěna pozitivní lymfatická uzlina. Rutinním (H&E) vyšetřením bylo detekováno 35 (6,9 %) postižených uzlin. Dalších 23 (4,5 %) uzlin bylo detekováno pouze pomocí ultrastagingu. Ty se při H&E vyšetření jevily negativní (4 mikrometastázy a 19 ITC). Dále šest pacientek (1,2 %) mělo postiženu jinou než sentinelovou uzlinu. Incidence nízkoobjemového metastatického postižení uzlin u pacientů s EC grade I, II a III byla 3,8 %, 3,4 % a 6,9 %. Přítomnost nízkoobjemového metastatického postižení uzlin vzhledem k hloubce myoinvaze 0, méně než 50 % a více než 50 % byla 0,8 %, 8,0 % a 7,4 % [18].
Sérii případů 350 pacientek, které podstoupily roboticky asistovaný staging pro karcinom endometria popisují Clinton et al. U 187 pacientek (53 %) byla detekována sentinelová uzlina a u 24 z nich (13 %) bylo nalezeno její mestastatické postižení. Makrometastáza byla detekována u 12 (50 %), mikrometastáza u 3 (13 %) a ITC u 9 (38 %) pacientek. Prevalence nízkoobjemového metastatického postižení uzlin byla v této studií 50 % [8]. Přítomnost mikrometastázy nebo izolované nádorové buňky v uzlině mění staging onemocnění ze stadia I na stadium IIIC. Z uvedených dat vyplývá, že více než 30 % pacientek by bylo bez ultrastagingového vyšetření podstážováno a následně neadekvátně léčeno.
Retrospektivní studie potvrzují, že počty pacientek se stadiem nemoci IIIC se při zavedení ultrastagingu zvyšují [6, 12, 28, 32]. Rovněž se v porovnání s konvenční lymfadenektomií zvyšuje záchyt mimoděložního šíření nemoci [32]. Potvrzuje to studie Budy et al., která předkládá výsledky záchytu pozitivní uzliny při mapování sentinelové uzliny v porovnání s provedením konvenční lymfadenektomie (4,1 % vs. 1,5 %) [6]. Je známo, že makrometastázy jsou častěji přítomny v sentinelových uzlinách než v uzlinách nesentinelových. Zda toto tvrzení platí i v případě nízkoobjemového metastatického postižení uzlin, není zatím známo. Proto je potřeba dalších studií s ultrastagingovým vyšetřením všech uzlin. V tuto chvíli není v literatuře dostatek validních dat a studie ve výsledcích nejsou jednotné [2, 24].
Práce Koskase et al. naznačuje, že vlastnosti a charakteristiky primárního nádoru u pacientů s mikrometastázami lymfatických uzlin a makrometastázami jsou výrazně odlišné. Užitím pravděpodobnostního nomogramu autoři argumentují, že mikrometastázy se vyskytují v uzlinách dříve než makrometastázy. Stejně tak mikrometastázy nalezneme v uzlinách dříve u primárních tumorů s nízce agresivním chováním [20]. Je vysoce pravděpodobné, že právě mikromestastázy a ITC stojí za zvýšeným množstvím neočekávaných relapsů nemoci u pacientek ve stadiu I a II [31]. Terapeutický a prognostický význam přítomnosti mikrometastázy nebo izolované nádorové buňky v sentinelové uzlině není zatím dostatečně prokázán. Proto dodnes neexistují guidelines stanovující optimální management léčby pacientek s nízkoobjemovým postižením uzlin.
Další důležitou otázkou, která vyvstává z přítomnosti nízkoobjemového metastatického postižení uzlin, je případná potřeba adjuvantní léčby. V souboru nemocných s ITC, které sledovali Plante et al., bylo zaznamenáno tříleté období bez progrese onemocnění (PFS) u 95,5 % případů, u pacientek s mikromestastázou v 85,5 % a u negativní SLN v 87,6 % případů. Signifikantní rozdíl je u pacientek s přítomností makrometastázy (58,5 %). Je nutno konstatovat, že v této studií nebylo postižení uliny ve smyslu přítomnosti ITC považováno za pozitivní [26]. Zatím největší kohortu pacientek publikovali St. Clair et al. Pacientky PFS, u kterých bylo nalezeno metastatické postižení uzlin (makrometastázy, mikrometastázy nebo ITC), byly ve stagingu zařazovány do stadia IIIC s adjuvantní léčbou. Ve skupině 44 žen s nízkoobjemovým postižením lymfatických uzlin, které podstoupily adjuvantní léčbu, se recurrence rate (RR) blíží výsledkům u pacientek bez postižení uzlin, tedy 6,2 %. Recurrence rate u pacientek s ITC byl 8,7 %, u pacientek s mikrometastázou 9,5 %. U makrometastatického postižení uzlin je RR 34,8 % [29]. U mikrometastatického postižení se nodální i vzdálená recidiva objevila ve stejné míře, a to v 4,7 %. Odlišné výsledky byly zaznamenány u pacientek s izolovanými nádorovými buňkami, kde se nodální recidiva nevystkytla a vzdálená recidiva nastala v 8,7 % případů. Je-li velikost metastázy v SLN ≤ 2 mm (ITC nebo mikrometastáza), riziko postižení další regionální lymfatické uzliny je 5 % s negativní prediktivní hodnotou 95 % [26]. Ke stanovení optimálního managementu léčby těchto pacientek je potřeba dalších studií.
ZÁVĚRY
Přijetím konceptu mapování sentinelových uzlin se zvyšuje záchyt metastatického postižení uzlin. Prospektivní studie ukazují, že nízkoobjemové metastatické postižení uzlin představuje až 30 % metastáz do regionálních lymfatických uzlin u pacientek s karcinomem endometria. Zvláště důležité je odhalení nízkoobjemového metastatického postižení uzlin u low-risk karcinomů, které, jak se zdá, zakládají mikrometastázy dříve. U těchto pacientek obvykle není podávána adjuvantní terapie. Ukazuje se, že pacientky s mikrometastatickým postižením uzlin by mohly z adjuvantní léčby profitovat. K potvrzení těchto dat je však ještě potřeba dalších studií.
Podpořeno MZ ČR – RVO (FNOl, 00098892).
MUDr. Jozef Hambálek
Porodnicko-gynekologická klinika
LF UP a FN
I. P. Pavlova 6
775 00 Olomouc
e-mail: jozev.hambalek@gmail.com
Zdroje
1. Practice Bulletin No. 149: Endometrial cancer. Obstet Gynecol, 2015, 125(4), p. 1006–1026.
2. Altgassen, C., Muller, N., Hornemann, A., et al. Immunohistochemical workup of sentinel nodes in endometrial cancer improves diagnostic accuracy. Gynecol Oncol, 2009, 114(2), p. 284–287.
3. Benedetti Panici, P., Basile, S., Maneschi, F., et al. Systematic pelvic lymphadenectomy vs. no lymphadenectomy in early-stage endometrial carcinoma: randomized clinical trial. J Natl Cancer Inst 2008, 100(23), p. 1707–1716.
4. Bogani, G., Dowdy, SC., Cliby, WA., et al. Management of endometrial cancer: issues and controversies. Eur J Gynaecol Oncol, 2016, 37(1), p. 6–12.
5. Bogani, G., Dowdy, SC., Cliby, WA., et al. Role of pelvic and para-aortic lymphadenectomy in endometrial cancer: current evidence. J Obstet Gynaecol Res, 2014, 40(2), p. 301–311.
6. Buda, A., Di Martino, G., Restaino, S., et al. The impact on survival of two different staging strategies in apparent early stage endometrial cancer comparing sentinel lymph nodes mapping algorithm and selective lymphadenectomy: An Italian retrospective analysis of two reference centers. Gynecol Oncol, 2017, 147(3), p. 528–534.
7. Burke, TW., Levenback, C., Tornos, C., et al. Intraabdominal lymphatic mapping to direct selective pelvic and paraaortic lymphadenectomy in women with high-risk endometrial cancer: results of a pilot study. Gynecol Oncol, 1996, 62(2), p. 169–173.
8. Clinton, LK., Kondo, J., Carney, ME., et al. Low-volume lymph node metastases in endometrial carcinoma. Int J Gynecol Cancer, 2017, 27(6), p. 1165–1170.
9. Cormier, B., Rozenholc, AT., Gotlieb, W., et al. Sentinel lymph node procedure in endometrial cancer: A systematic review and proposal for standardization of future research. Gynecol Oncol, 2015, 138(2), p. 478–485.
10. Creasman, WT., Morrow, CP., Bundy, BN., et al. Surgical pathologic spread patterns of endometrial cancer. A Gynecologic Oncology Group Study. Cancer, 1987, 60(8), Suppl., p. 2035–2041.
11. Doll, KM., Tseng, J., Denslow, SA., et al. High-grade endometrial cancer: revisiting the impact of tumor size and location on outcomes. Gynecol Oncol, 2014, 132(1), p. 44–49.
12. Ducie, JA., Eriksson, AGZ., Ali, N., et al. Comparison of a sentinel lymph node mapping algorithm and comprehensive lymphadenectomy in the detection of stage IIIC endometrial carcinoma at higher risk for nodal disease. Gynecol Oncol, 2017, 147(3), p. 541–548.
13. European Cancer Information System. Estimates of cancer incidence and mortality in 2018. In: https://ecis.jrc.ec.europa.eu/explorer.php?$0-0$1-AEE$4-2$3-All$6-0,14$5-2008,2008$7-7$2-All$CEstByCancer$X0_8-3$CEstRelativeCanc$X1_8-3$X1_9-AE28; 2019.
14. European Society of Gynaecological Oncology. Endometrial Cancer Guidelines based on ESMO-ESGO-ESTRO Consensus Conference on Endometrial Cancer. In: https://www.esgo.org/media/2015/12/Endometrial_broz_A6_b.pdf: European Society of Gynaecological Oncology. p.
15. Geppert, B., Lonnerfors, C., Bollino, M., et al. A study on uterine lymphatic anatomy for standardization of pelvic sentinel lymph node detection in endometrial cancer. Gynecol Oncol, 2017, 145(2), p. 256–261.
16. Henley, SJ., Miller, JW., Dowling, NF., et al. Uterine cancer incidence and mortality – United States, 1999–2016. MMWR Morb Mortal Wkly Rep, 2018, 67(48), p. 1333–1338.
17. James, D., Brierley, MKG., Wittekind, C. TNM Klasifikace zhoubných novotvarů. 8.ed. Praha: Ústav zdravotnických informací a statistiky České republiky, 2018, 266 s.
18. Kim, CH., Soslow, RA., Park, KJ., et al. Pathologic ultrastaging improves micrometastasis detection in sentinel lymph nodes during endometrial cancer staging. Int J Gynecol Cancer, 2013, 23(5), p. 964–970.
19. Kitchener, H., Swart, AM., Qian, Q., et al. Efficacy of systematic pelvic lymphadenectomy in endometrial cancer (MRC ASTEC trial): a randomised study. Lancet, 2009, 373(9658), p. 125–136.
20. Koskas, M., Chereau, E., Ballester, M., et al. Accuracy of a nomogram for prediction of lymph-node metastasis detected with conventional histopathology and ultrastaging in endometrial cancer. Br J Cancer, 2013, 108(6), p. 1267–1272.
21. McCready, DR., Yong, WS., Ng, AK., et al. Influence of the new AJCC breast cancer staging system on sentinel lymph node positivity and false-negative rates. J Natl Cancer Inst, 2004, 96(11), p. 873–875.
22. Multinu, F., Casarin, J., Mariani, A. Point/Counterpoint: Is lymphadenectomy required in endometrial cancer for adequate surgical staging? Oncology (Williston Park), 2017, 31(5), p. 390–391, 401.
23. National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology. Version 4.2019. Uterine Neoplasms. In: https://www.nccn.org/professionals/physician_gls/pdf/uterine.pdf; 2019.
24. Niikura, H., Okamoto, S., Yoshinaga, K., et al. Detection of micrometastases in the sentinel lymph nodes of patients with endometrial cancer. Gynecol Oncol, 2007, 105(3), p. 683–686.
25. European Society of Gynaecological Oncology. Endometrial Cancer Guidelines based on ESMO-ESGO-ESTRO Consensus Conference on Endometrial Cancer. In: https://www.esgo.org/media/2015/12/Endometrial_broz_A6_b.pdf: European Society of Gynaecological Oncology.
26. Plante, M., Stanleigh, J., Renaud, MC., et al. Isolated tumor cells identified by sentinel lymph node mapping in endometrial cancer: Does adjuvant treatment matter? Gynecol Oncol, 2017, 146(2), p. 240–246.
27. Rossi, EC., Kowalski, LD., Scalici, J., et al. A comparison of sentinel lymph node biopsy to lymphadenectomy for endometrial cancer staging (FIRES trial): a multicentre, prospective, cohort study. Lancet Oncol, 2017, 18(3), p. 384–392.
28. Schlappe, BA., Weaver, AL., Ducie, JA., et al. Multicenter study comparing oncologic outcomes between two nodal assessment methods in patients with deeply invasive endometrioid endometrial carcinoma: A sentinel lymph node algorithm versus a comprehensive pelvic and paraaortic lymphadenectomy. Gynecol Oncol, 2018, 151(2), p. 235–242.
29. St Clair, CM., Eriksson, AG., Ducie, JA., et al. Low-volume lymph node metastasis discovered during sentinel lymph node mapping for endometrial carcinoma. Ann Surg Oncol, 2016, 23(5), p. 1653–1659.
30. Ústav zdravotnických informací a stastistiky ČR. Novotvary 2016, komplet. In: www.uzis.cz/system/files/novotvary2016.pdf. Ústav zdravotnických informací a stastistiky ČR.
31. Yabushita, H., Shimazu, M., Yamada, H., et al. Occult lymph node metastases detected by cytokeratin immunohistochemistry predict recurrence in node-negative endometrial cancer. Gynecol Oncol, 2001, 80(2), p. 139–144.
32. Zahl Eriksson, AG., Ducie, J., Ali, N., et al. Comparison of a sentinel lymph node and a selective lymphadenectomy algorithm in patients with endometrioid endometrial carcinoma and limited myometrial invasion. Gynecol Oncol, 2016, 140(3), p. 394–399.
Štítky
Detská gynekológia Gynekológia a pôrodníctvo Reprodukčná medicína
Článok vyšiel v časopiseČeská gynekologie
Najčítanejšie tento týždeň
2019 Číslo 6- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Ne každé mimoděložní těhotenství musí končit salpingektomií
- Gynekologické potíže pomáhá účinně zvládat benzydamin
- Mýty a fakta ohledně doporučení v těhotenství
-
Všetky články tohto čísla
- Výskyt gestačního diabetes mellitus před zavedením a po zavedení HAPO diagnostických kritérií
- Laparoskopická sakrokolpopexe pomocí materiálu Seratex Slimsling: pilotní studie
- Molární těhotenství z pohledu patologa a klinika
- Prenatálně diagnostikovaný perzistující urachus s pupečníkovou cystou a časným chirurgickým řešením
- Laparoskopická hysterosakropexe s následným těhotenstvím ukončeným císařským řezem: kazuistika s krátkodobým follow-up
- Izolovaný ascites plodu
- Hyperreactio luteinalis – dva náhodné nálezy pri cisárskom reze
- Těžká akutní forma imunitní trombocytopenické purpury u nezletilé těhotné
- Vliv fyzioterapeutických postupů na zatížení plosky a bolesti zad v těhotenství
- Nízkoobjemové metastatické postižení lymfatických uzlin u karcinomu endometria
- Lactobacillus iners-dominantní vaginální mikrobiota v těhotenství
- Katolicismus a antikoncepce
- XXV. jubilejní sympozium imunologie a biologie reprodukce 24.–25. 5. 2019, Liblice
- Zápis z jednání volební komise pro volby výboru Sekce gynekologie dětí a dospívajících České gynekologické a porodnické společnosti ČLS JEP
- Česká gynekologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Molární těhotenství z pohledu patologa a klinika
- Prenatálně diagnostikovaný perzistující urachus s pupečníkovou cystou a časným chirurgickým řešením
- Výskyt gestačního diabetes mellitus před zavedením a po zavedení HAPO diagnostických kritérií
- Vliv fyzioterapeutických postupů na zatížení plosky a bolesti zad v těhotenství
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



