-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Malé molekuly RNA a jejich význam v imunitní odpovědi organismu
Micro RNAs and their significance in the immune response
Micro RNAs (miRNAs) are a group of short, approximately 22nt long, single-stranded, endogenous and evolutionarily conserved non-coding RNAs. These molecules postranscriptionally regulate the expression of structural genes. By a mechanism termed RNA interference (RNAi) they modulate stability and translational efficiency of target messenger RNAs and thus the intracellular protein levels. MiRNAs can be found in various species, they make up 1–2% of eukaryotic genomes, and regulate expression of about one-third of protein-coding genes. MiRNAs participate in regulation of key biological processes (cell growth, differentiation, proliferation, and apoptosis). Recent findings highlight the crucial importance of miRNAs in development, homeostasis and function of innate and adaptive immunity. Deregulation of miRNA expression is involved in pathogenesis of malignancies, heart diseases, neurodegenerative and inflammatory autoimmune disorders and infections. In systemic autoimmune diseases, miRNAs play a key role in the regulation of major pathogenic molecules (TNFα), central signaling pathways (IFN type I) and critical immunoregulatory cells (regulatory T cells). MiRNA molecules have a considerable potential as a new class of therapeutic targets and diagnostic biomarkers. This article gives a brief overview of miRNA molecules, their role in the immune response and their relation to systemic autoimmune diseases.
Key words:
epigenetic modifications, micro RNA, RNA interference, immune response, systemic autoimmune diseases
Autori: M. Škoda 1; P. Novota 1; M. Remáková 1; M. Faustová 1; J. Vencovský 2
Pôsobisko autorov: Laboratoř molekulární biologie a imunogenetiky, 2Vědeckovýzkumné centrum, Revmatologický ústav Praha 1
Vyšlo v časopise: Čes. Revmatol., 19, 2011, No. 2, p. 56-64.
Kategória: Přehledné články
Súhrn
Micro RNA (miRNA) patří do skupiny malých, přibližně 22 nukleotidů dlouhých, jednovláknových, endogenních, evolučně konzervovaných a nekódujících RNA. Tyto molekuly posttranskripčně regulují expresi strukturních genů. Mechanismem RNA interference (RNAi) ovlivňují stabilitu a translační účinnost cílových mRNA a tím i hladiny proteinů v buňkách. Jsou nalézány u většiny organismů, tvoří 1–2 % eukaryotických genomů a řídí expresi až 1/3 protein kódujících genů. Podílejí se na regulaci klíčových biologických procesů (buněčný růst, diferenciace, proliferace, apoptóza). Recentní nálezy zdůrazňují zásadní význam miRNA ve vývoji, homeostáze a funkci vrozené i adaptivní imunity. Deregulace exprese miRNA je součástí patogeneze malignit, srdečních, neurodegenerativních, autoimunitních zánětlivých onemocnění a infekcí. U systémových autoimunitních chorob hrají miRNA klíčovou úlohu v regulaci hlavních, v patogenezi zapojených molekul (TNFα), centrálních signálních drah (IFN I. typu) a kritických imunoregulačních buněk (regulační T buňky). Molekuly miRNA mají značný potenciál jako nová třída terapeutických cílů a diagnostických biomarkerů. Článek podává stručný přehled o molekulách miRNA, jejich roli v imunitní odpovědi a souvislosti se systémovými autoimunitními onemocněními.
Klíčová slova:
epigenetické modifikace, micro RNA, RNA interference, imunitní odpověď, systémová autoimunitní onemocněníÚvod
Systémové autoimunitní choroby jsou multifaktoriální, polygenně podmíněná onemocnění. Vědecké a klinické studie z nedávné doby ukazují, že kromě strukturních genů se na etiopatogenezi těchto chorob významně podílejí i tzv. epigenetické modifikace. Tyto procesy lze definovat jako dědičné změny genové exprese, při kterých nedochází k alteraci nukleotidové sekvence (1). Přestože nejsou fixovány v sekvenci DNA, mohou přetrvávat po celý život a mohou být ovlivněny např. individuálními rozdíly životního stylu (2, 3). Mezi nejvýznamnější epigenetické děje asociované s chronickým zánětem patří metylace DNA, posttransplantační modifikace proteinů (acetylace histonů, ubiquitinace, SUMOilace (small ubiquitin modifiers) a též RNA interference (RNAi). RNA interference je proces, který formou posttranskripčního utlumení genové exprese reguluje translaci a vnitrobuněčnou expresi genu. Zásadní podíl na potlačení překladu mRNA mají malé, nekódující, evolučně konzervované RNA molekuly, které jsou na základě několika klasifikačních kritérií (struktura, biogeneze, funkce) děleny do tří tříd: miRNA (micro RNA), siRNA (small interacting RNA), piRNA (Piwi interacting). Regulační dráhy těchto RNA molekul tvoří navzdory odlišnému charakteru vzájemně propojený systém (4).
Micro RNA je rodina krátkých (18–24nt), nekódujících, jednořetězcových RNA molekul, které posttranskripčně upravují stabilitu a translační účinnost cílových mRNA. První miRNA – lin-4, objevili roku 1993 Ambros, Lee et al. při studiu postembryonálního vývoje háďátka (Caenorhabditis elegans) (5). V roce 1998 popsali Fire a Mello jev RNA interference, za což obdrželi Nobelovou cenu (2006). Až roku 2000 byla odhalena druhá miRNA – let-7, opět u C. elegans (6). Brzy poté byla identifikována ortologní role let-7 u různých mnohobuněčných druhů. Od té doby se miRNA problematika stala předmětem intenzivních studií. Micro RNA tvoří cca 1–2 % eukaryotických genomů a regulují asi 1/3 protein kódujících genů (7). V současnosti je známo přes 1000 zralých humánních miRNA sekvencí, přičemž celkový počet v lidském genomu se na základě bioinformatických analýz odhaduje na 1500 (8). Mechanismus účinku spočívá v miRNA/mRNA interakci, tzn. párování miRNA s komplementární sekvencí cílového mRNA transkriptu a potlačení jeho translace (umlčení genu, gene silencing). Regulační síť v tomto systému je složitá: každá miRNA může zaměřit desítky až stovky mRNA cílů a zároveň jedna mRNA je schopna vázat různé molekuly microRNA. Expresní profily miRNA jsou tkáňově a buněčně specifické a podléhají přísné kontrole (9). Evoluční konzervovanost miRNA sekvencí naznačuje zapojení do základních fyziologických procesů. Molekuly miRNA modulují embryogenezi, organogenezi, proliferaci, apoptózu, stres a imunitní odpověď. Klíčovou roli hrají také ve vrozené i adaptivní imunitě, včetně řízení diferenciace jednotlivých podskupin imunitních buněk a jejich funkcí. Aberantní miRNA exprese je asociována s vývojem malignit, srdečních, neurodegenerativních, autoimunitních zánětlivých onemocnění a infekcí (10). U systémových autoimunitních chorob jsou abnormální expresní vzory spojené s nadprodukcí prozánětlivých cytokinů a patologickou biologií regulačních T a B lymfocytů (11).
Biogeneze a funkce molekul miRNA
Asi 70 % lidských miRNA genů je přepisováno z intronů či exonů, 30% se nalézá v oblastech mezi strukturními geny. Geny pro miRNA disponují vlastními regulačními oblastmi a nacházejí se v mono - či polycistronních konfiguracích. Většina je v genomu izolovaná, některé jsou sdruženy v klastrech a koordinovaně přepisovány a exprimovány (12). Kódující geny pro jednotlivé molekuly miRNA jsou mnohem delší (stovky až tisíce nukleotidů) než finální zralé miRNA. Transkripce je obvykle regulována promotory typu Pol II (DNA dependentní RNA polymeráza typu II) za účasti běžných transkripčních faktorů (13). Biogeneze probíhá ve vícestupňovém procesu. Začíná v buněčném jádře, pokračuje a končí v cytoplazmě. V jádře jsou miRNA geny obvykle přepsány do tzv. pri-miRNA transkriptu (primární transkript miRNA). Ten je upraven sestřihem, opatřen 5’7-methylguanosinovou čapkou (M7) a 3’poly (A) koncem. Vyznačuje se dvouvláknovou „kmen-smyčka“ strukturou a jeho délka může kolísat od dvouset do několika tisíc nukleotidů. Pri-miRNA je následně zpracována multiproteinovým komplexem Microprocessor, který obsahuje dvě hlavní složky: RNAzu III zvanou Drosha a jaderný protein DGCR8 (DiGeorge syndrom critical region 8). Microprocessor štěpí pri-miRNA do cca 65–100nt dlouhé prekurzorové pre-miRNA, která tvoří vlásenku s fosfátem na 5’konci a dvounukleotidovým přesahem na 3‘ zakončení (transportní funkce). V této podobě je pre-miRNA pomocí systému Exportin 5-Ran-GTP exportována do cytoplazmy. V cytoplazmě pak podstupuje štěpení RNAzou III – DICER, který odstraní vlásenkovou smyčku a vytvoří nestabilní, 19-22-nt dlouhý, asymetrický miRNA/miRNA* duplex. Jedno z vláken je tzv. guide vlákno, které slouží jako funkční, zralá microRNA a které bude začleněno do tzv. RISC (RNA induced silencing complex) komplexu – viz dále. Druhé vlákno, známé jako tzv. passenger vlákno, je v konečné fázi miRNA maturace degradováno. Mechanismus selekce aktivního (guide) vlákna z dsRNA není doposud plně objasněn, zdá se, že záleží především na lokální termodynamické stabilitě duplexu (14,15). Vlákno s méně stabilním 5´koncem dozrává a spojuje se s Ago2 – členem proteinové rodiny Argonaut, hlavní složkou RISC (DICER / Ago / miRNA) komplexu. RISC hraje zásadní roli v procesu tlumení (silencingu) genové exprese.
Poté co je zralá ss-miRNA selektivně vložena do RISC, interaguje komplex s komplementární sekvencí ve 3´ UTR (nepřekládané oblasti) cílových mRNA. MiRNA/mRNA vazby se zpravidla účastní pouze evolučně konzervovaná, 7 – až 8-nt dlouhá „seed“ (jádrová) sekvence, nacházející se mezi druhým a devátým nukleotidem každé microRNA. Stupeň komplementarity “seed“ sekvence s cílovou mRNA určuje typ mechanismu post-transkripční regulace (úplná komplementarita, neúplná komplementarita). Úplná komplementarita je typičtější pro rostliny a má za následek přímou degradaci mRNA. U savců, se nedokonalé (neúplné) párování bazí vyskytuje častěji a RISC pak uplatní své účinky regulací stability cílové mRNA nebo blokací jejího překladu. Potlačené mRNA se hromadí v cytoplazmatických ohniscích tzv. GW/ P-tělíscích, známých místech destabilizace RNA (16). Komplementarita 6 nukleotidů sekvence miRNA dostačuje k zajištění regulační funkce. Jedna miRNA tak může komunikovat s několika stovkami cílových mRNA, a každá mRNA může být terčem několika miRNA. Tato široká rozmanitost možných interakcí zesiluje složitost regulace protein-kódujících genů.
Nedávné výzkumy odhalily alternativní cestu miRNA biogeneze. Kromě standardních miRNA byly nejprve u Drosophily melanogaster, C. elegans a později též u savců objeveny intronické miRNA prekurzory, které obcházejí zpracování enzymem Drosha. Tyto takzvané mirtrony reprezentují speciální typ miRNA lokalizovaný v intronech genů pro mRNA. Poté co podstoupí sestřih, nastupují již jako pre-miRNA další cestu miRNA zpracování (17).
Navzdory narůstajícím znalostem zůstává mnoho aspektů mechanismu miRNA zprostředkovného silencingu nepostiženo. Vedle výše zmíněné, kanonické role miRNA jako inhibitoru translace byla popsána i zcela protikladná, alternativní funkce. V reakci na buněčnou deprivaci (stres, hladovění) může být s RISCem spárovaná mRNA osvobozena a dokonce přednostně přeložena (aktivace translace) (18). Předpokládá se, že k potlačení či snížení miRNA exprese dochází mutacemi, epigenetickou aktivací miRNA genů, chybným biogenetickým zpracováním či transkripční downregulací. Hyperexpresi způsobují genové amplifikace, mutace v promotorové oblasti či transkripční nadregulace, případně mutace v 3´UTR cílové mRNA nebo jejího genu (19). Hlavní vazebné cíle představují transkripční faktory, kofaktory a modifikátory chromatinu. Současné studie usilují o identifikaci cílových mRNA a rovněž transkripčních faktorů iniciujících miRNA expresi.
Regulační mechanismy sítě miRNA ovlivňují ontogenezi a maturaci imunitního systému
Molekuly miRNA představují významný regulátor vývoje imunitního systému a imunitní odpovědi. Četné studie informují o jejich účasti v krvetvorbě, T a B buněčném vývoji, TLR signalizační kaskádě, produkci cytokinů, izotypovém přesmyku či prezentaci antigenu. Většina poznatků však pochází z in vitro a zvířecích modelových studií a vyžaduje konfirmaci v humánním systému. Významná role v regulaci imunitní odpovědi je v současnosti přiznávána pouze malému počtu miRNA typů. Přehled nejdůležitějších miRNA, které sehrávají roli v imunitních procesech uvádí tabulka 1.
Tab. 1. Přehled nejdůležitějších miRNA, které se významným způsobem účastní regulace imunitní odpovědi. 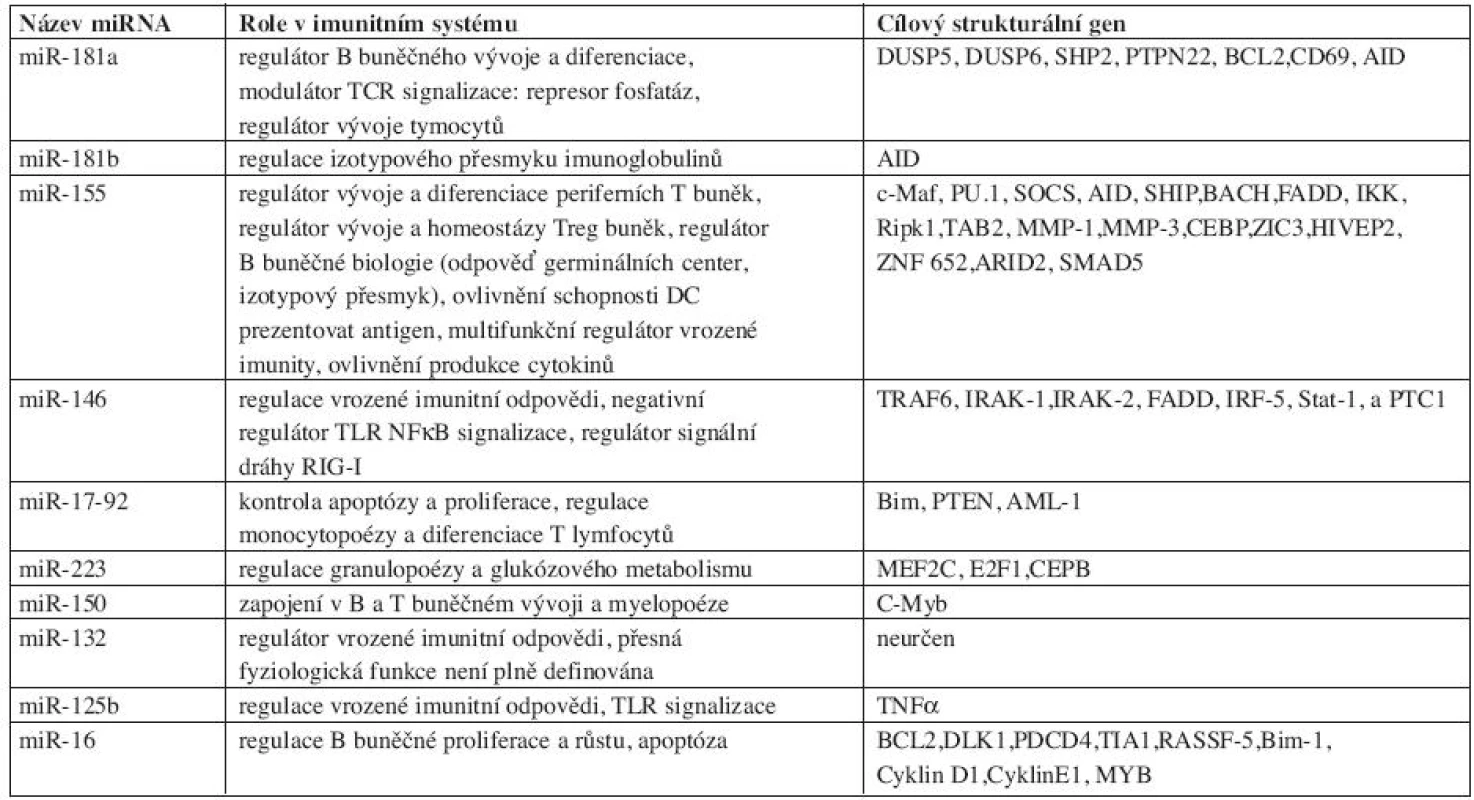
AID:activation-induced cytidine deaminase; AML-1:acute myeloid leukemia gene 1; ARID2:AT rich interactive domain 2; BACH-1:BTB and CNC homology 1: basic leucine zipper transcription factor1; BCL-2:B-cell lymphoma 2; Bim-1:BCL2-like 1, CD 69: cluster of differenciation 69; CEBP:CCAAT/enhancer binding protein; DLK1: delta-like1 homolog; DUSP: dual-specificity protein phosphotase, E2F1:E2Ftranscription factor1; FADD:Fas-associated protein with death domain; HIVEP2:human immunodeficiency virus type I enhancer binding protein 2; IKK:I kappaB kinase; IRAK:IL-1 receptor activated kinase; IRF:Interferon regulatory factor; MMP:matrix metalloproteinase; MEF2C:MADS box transcription enhancer factor 2;MYB: Myb proto/ oncogene protein; PDCD: programmed cell death protein 4; PTEN: phosphatase and tensin homolog; PTPN22, protein tyrosine phosphatase, non-receptor type 22; PU.1:spleen focus forming virus(SFFV) proviral integration oncogene spi1; RASSF5: Ras association domain family member5; RIPK: receptor-interacting serine/threonine kinase 1; SHP2: SH2-domain-containing protein tyrosine phosphatase 2; SOCS-1, suppressor of cytokine signaling 1; STAT: signal transducer and activator of transcription; SMAD5; E2F1:E2Ftranscription factor 1; TIA1:T cell-restricted intracellular antigen-1; TNFα: tumor necrosis factor alfa; TRAF: TNF receptor associated factor; ZIC3:Zic family member 3; ZNF652:zinc fingerprotein 652 První miRNA zahrnutou v regulaci hematopoezy a ontogenezi imunitních buněk (miR-181a) popsali Chen et al. (20). Experimenty na myším modelu odhalily silnou expresi miR-181a v brzlíku, mozku a plicích, slabší pak v srdci, lymfatických uzlinách a kostní dřeni. Zralé B lymfocyty kostní dřeně exprimují signifikantně vyšší množství této miRNA než pro-B lymfocyty. Ektopická in vivo exprese v kmenových a progenitorových buněčných liniích vedla k nárůstu CD19+ B buněk a poklesu počtu CD8+ T lymfocytů. Zmíněná fakta naznačují, že miR-181a funguje jako pozitivní regulátor B buněčného vývoje. Li et al. navíc shledali, že miR-181a moduluje TCR signalizaci potlačením několika fosfatáz a tím reguluje pozitivní a negativní selekci. Toto zjištění svědčí o významu miR-181a při navození autotolerance (21).
Značnou úlohu v imunitních dějích hraje miR-155. Vysoké expresní hladiny této miRNA bývají asociovány s lidskými B buněčnými lymfomy a dalšími malignitami. Transgenní myši s indukovanou hyperexpresí miR-155 v B buňkách rozvinuly polyklonální B typ pre-leukemie (22). Modely deficientní pro miR-155 vykazují poškozenou T a B buněčnou odpověď a dysfunkci dendritických buněk (23, 24). Knockout miR-155 omezuje počet germinálních center, snižuje produkci cytokinů (TNFα) a narušuje afinitní maturaci B buněk. Podíl miR-155 na aktivaci T-lymfocytů je realizován vazbou na transkripční faktor c-Maf – aktivátor transkripce IL-4, který podporuje diferenciaci imunitní odpovědi do Th2 fenotypu (23, 25). K potvrzeným cílům miR-155 patří transkripční faktor PU.1 – klíčový regulátor ontogeneze myeloidní linie, AID (activation-induced cytidine deaminase) – zapojený v afinitní maturaci a diverzifikaci imunoglobulinů, antionkogen SHIP1 (SH2 domain-containing inositol-5’-phosphatase 1) či transkripční faktor BACH (BTB and CNC homolog 1) – blokátor buněčné proliferace.
Obr. 1. Schéma biogeneze miRNA (upraveno dle Furer et al. (10)) 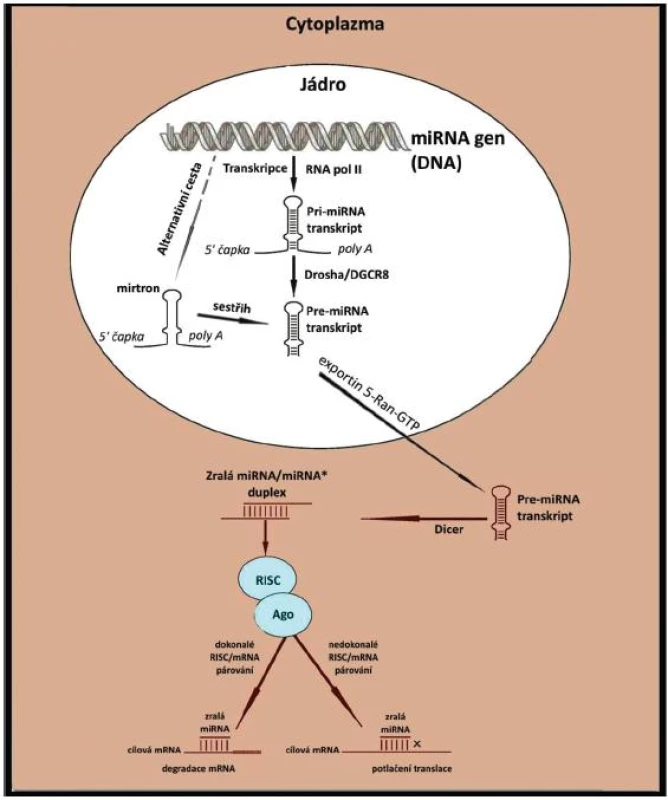
Exprese miRNA je časově a místně určena: závisí na buněčném typu, vývojovém stadiu buňky a signálech z prostředí. Regulace probíhá ve třech úrovních: transkripce, posttranskripční zpracování, translokace mRNA/RISC do cytoplazmatických organel. V iniciální fázi je přepis miRNA řízen transkripčními faktory. Přepisem za pomoci RNA polymerázy II vzniká primární pri-miRNA, která je upravena a přeměněna v prekurzorovou pre-miRNA. Tohoto procesu se účastní široká škála proteinů: Drosha, DGCR 8 (Di-George syndrome critical region gene 8), LIN 28, KSRP (KH-type splicing regulatory protein), ARS2 (arsenate resistance protein, SMAD, p53, ADAR (adenosine deaminase acting on RNA). Exprese některých z nich je zpětně ovlivňována zánětem. Pre-miRNA je Exportinem 5 dopravena do cytoplazmy, kde je štěpena enzymem DICER. MiRNA duplex je rozpleten a vedoucí (guide) vlákno inkorporováno do RISC komplexu. Tento je Importinem 8 transportován k cílové mRNA, která je následně štěpena či blokována (represe translace). MRNA/RISC komplex může být umístěn do specifických cytoplazmatických organel (GW/P-bodies, stress granules). Důležitý podíl v regulaci vývoje imunitních buněk připadá na soubor šesti miRNA (miR-17, miR-18a, miR-19a,miR-20a, miR-19b a miR-92a) označovaný jako klastr miR-17-92. Jejich hyperexprese vede k nadměrné aktivaci B buněk, expanzi CD4+ T lymfocytů, poruchám periferní tolerance a rozvoji lymfoproliferativních chorob a autoimunity (26). Dva členové klastru - miR-17-5p a miR-20a zároveň kontrolují monocytopoezu. Vazbou na AML-1, aktivátor transkripce M-CSFR (macrophage colony stimulating factor receptor) inhibují diferenciaci monocytů a jejich dozrávání (27). Dalšími cíly miR-17-92 jsou dva význačné tumor supressory: proapoptotický protein BIM a kontrolor buněčné proliferace PTEN (phosphatase and tensin homolog).
Zapojení další miRNA v T a B lymfopoéze myši popsali Zhou et al. (28). Jedná se o miR-150, která je přednostně exprimována ve slezině a lymfatických uzlinách a silně nadregulována během dozrávání B a T lymfocytů. Ektopická exprese miR-150 v progenitorech hematopoetických kmenových buněk blokovala B buněčný vývoj a mírně podpořila T buněčnou lymfopoézu a myelopoézu. Knockout miR-150 vede ke zmnožení B buněk a zvýšené produkci protilátek. Kritickým cílem miR-150 je transkripční faktor a buněčný protoonkogen c-Myb, jehož hladiny negativně korelují s intenzitou exprese miR-150 (29).
Významnou roli v ontogenezi imunitních buněk zastává i miR-223. Ta je přednostně exprimována v myeloidní buněčné linii a reguluje proliferaci granulocytů (30). Její přepis podléhá kontrole dvou myeloidních transkripčních faktorů: PU.1a C/EBPβ. Potvrzeným cílem je Mef2c (myocyte-specific enhancer factor 2C), transkripční faktor, který v krvetvorné tkáni zajišťuje granulopoézu. MiR-223 snižuje jeho expresi a ovlivňuje tak počet granulocytů.
Molekuly miRNA zastávají důležitou roli v regulaci imunitní odpovědi
Vrozená imunitní odpověď
Aktivace vrozené imunitní odpovědi mění expresi molekul miRNA. Bakteriální či virové ligandy a prozánětlivé cytokiny indukují soubor specifických miRNA. Taganov et al. pozorovali hyperexpresi tří miRNA (miR-146a/b, miR-132, miR-155) v monocytech stimulovaných lipopolysacharidem (signalizace skrze TLR4) (31). Expozice peptidoglykanům a flagelinu způsobuje zvýšení exprese miR-146 v buňkách myeloidní linie (signalizace skrze TLR2 a TLR5). Jako cílové geny posttranskripční represe miR-146 byly označeny IRAK1 a TRAF6, klíčové aktivátory NFκB (nuclear factor kappa B). Taganovem navržený model předpokládá, že bakteriální indukce NFκB nadreguluje miR-146, která inhibicí IRAK1 a TRAF6 brzdí zánětlivou odpověď (31). V lidských epiteliálních buňkách plicních sklípků se miR-146a/b podílejí na negativní zpětnovazebné regulaci IL-1B vyvolaném zánětu (32). Teprve vysoká koncentrace IL-1B dokázala v experimentech vyvolat dostatečnou expresi miR-146. Nadregulace miR-146 posléze reprimovala prozánětlivé cytokiny (IL-8, RANKL), což naznačuje, že zmíněný mechanismus slouží k potlačení intenzivních zánětlivých stavů. Nedávná studie identifikovala miR-146 jako inhibitor signální dráhy RIG-I (retinoic acid inducible gene I) zapojené v odpovědi na virovou infekci (33).
Výše zmiňovaná miR-155 je multifunkční regulátor vrozené imunity. K zvýšení exprese dochází v odezvě na TLR3, TLR7 a TLR9 aktivací široké škály infekčních agens či prozánětlivých cytokinů (IFN, TNF) (34,35). Existuje předpoklad, že miR-155 tlumí několik cílových genů s účastí v odpovědi na lipopolysacharid (LPS): FADD (Fas associated-death domain protein), IKK (IκB kinase), Ripk1 (receptor interacting threonine kinase). Ceppi et al. zmiňují úlohu miR-155 v modulaci IL-1 dráhy lidských DC. Stejní autoři vyslovují hypotézu, že miR-155 může participovat v negativní zpětnovazebné smyčce kontrolující IL-1B a další zánětlivé cytokiny produkované během LPS zprostředkované aktivace dendritických buněk (34).
V protikladu k nadregulaci miR-146a/b, miR-132 a miR-155 je exprese miR-125b u makrofágů vystavených LPS snížena (35). Předpokládá se, že snížení exprese miR-125b umožňuje LPS indukovanou produkci TNFα, který je cílovou molekulou této miRNA.
Získaná imunitní odpověď
Jednotlivé vývojové etapy T lymfocytů vykazují rozdíly v kvantitě i typologii miRNA exprese. Tento fakt dokumentuje rozsáhlá analýza myších T buněk, která ukázala, že během antigen-specifické diferenciace T lymfocytů dochází k dynamickým změnám miRNA exprese u efektorových a paměťových CD8+T lymfocytů (36). MiR-181a je vysoce exprimována v CD4+CD8+ stadiu vývoje T buněk a může reprimovat molekuly Bcl-2, CD69 a TCR, zahrnuté v pozitivní selekci. Hyperexprese miR-181a ve zralých buňkách posiluje citlivost T buněčných receptorů, snížení její exprese v nezralých thymocytech snižuje senzitivitu k peptidovým antigenům a poškozuje negativní i pozitivní selekci (37). Mir-181a posiluje TCR signalizaci potlačením několika fosfatáz – negativních regulátorů T buněčné aktivace antigenem (SHP2, PTPN22, DUSP5, DUSP6). Tímto mechanismem ovlivňuje pozitivní a negativní selekci a podílí se tak na činnosti adaptivní imunity.
Na periferii regulují miRNA různé podskupiny Th lymfocytů (38). Tkáňově specifická, experimentální delece DICER v myších T lymfocytech vede k defektnímu vývoji T buněk, aberantní diferenciaci směrem k Th1 profilu a produkci cytokinů (39). Několik prací studovalo význam miRNA ve vývoji, homeostáze a funkci T regulačních buněk (Treg) (40, 41). Treg slouží k potlačení imunitní odpovědi, udržují homeostázu a toleranci k autoantigenům. Přirozené T regulační buňky (Treg) vykazují v porovnání s naivními CD4+ T buňkami značně odlišnou miRNA expresi. Expresní profil aktivovaných CD4+ T lymfocytů je expresnímu profilu Treg podobnější, hladiny několika miRNA (miR-223, miR-146) se však výrazně liší (jsou nadexprimovány v Treg). T regulační lymfocyty tak vykazují jedinečný miRNA fenotyp (42). Zásadní význam miRNA pro vývoj a funkci Treg buněk potvrdily genetické studie. Podmíněná delece DICER či Drosha (miRNA deficience) v Treg linii myšího modelu způsobila poruchy diferenciace a dysfunkce na periferii, centrální buňky zůstaly intaktní. DICER deficientní periferní Treg vykazovaly nestabilitu a abnormality v genové expresi, včetně postižení Foxp3 (forkhead box P3), hlavního regulátoru těchto buněk. Ztráta supresorické funkce vedla k rychlému rozvoji systémové autoimunity s fatálním zakončením (43). Klinický obraz se podobal chorobě, kterou onemocněly myši s vyřazeným Foxp3 genem, u kterých Treg buňky chybí. Funkce jednotlivých miRNA typů v T regulačních buňkách nejsou prozatím zmapovány. Popsána je účast již dříve zmiňované miR-155 v udržování homeostázy Treg. MiR-155 reguluje adaptivní imunitní odpověď i dalšími mechanismy. Vazbou na AID (activation-induced cytidine deaminase) ovlivňuje izotypový přesmyk imunoglobulinů, inhibicí PU.1 dává vznik vysokoafinitní IgG1 protilátce (25). Zvýšená exprese miR-155 podporuje tvorbu paměťových B buněk, produkci některých cytokinů (IL-2, IFNgama, TNFα) a schopnost dendritických buněk prezentovat antigen T lymfocytům.
Na řízení izotypového přesmyku imunoglobulinů v aktivovaných B lymfocytech se podílí taktéž miR-181b (44). Exprese miR-181b snižuje translaci AID (activation-induced cytidine deaminase), enzymu s DNA mutační aktivitou zapojeném v diversifikaci protilátek a iniciaci přesmyku.
Role miRNA v etiopatogenezi systémových autoimunitních onemocnění
Exprese miRNA odráží alteraci imunitních procesů. Podstata regulačních pochodů a přesná patogenetická úloha miRNA však zůstávají neobjasněny. Aberantní expresní vzory vykazují revmatoidní artritida, systémový lupus erytematodes, Sjögrenův syndrom a psoriáza, profily ostatních chorob nebyly dosud stanoveny. Dosavadní nálezy zdůrazňují zapojení miRNA v modulaci hlavních patogenních molekul, centrálních signálních drah a kritických imunoregulačních buněk.
Regulace TNFα
TNFα je pleiotropní prozánětlivý cytokin, kritický mediátor několika autoimunitních onemocnění (revmatoidní artritida, ankylozující spondylitida, psoriáza). Ústřední úloha v řízení prozánětlivé cytokinové kaskády z něj činí atraktivní terapeutický cíl, jehož význam vzrostl s úspěchem TNFα blokátorů. Exprese TNFα je složitě kontrolována, jeden z mechanismů představuje regulace skrze tzv. ARE sekvence (motivy bohaté na adenosin a uridin, AU rich elements). Mediátorová RNA genu TNFα obsahuje ve své 3´UTR oblasti ARE sekvence - místa vazby regulačních molekul (miRNA, proteiny), které ovlivňují stabilitu transkriptu. Za fyziologických podmínek převažuje destabilizační funkce ARE, vedoucí k urychlenému odbourávání mRNA (44). 3´UTR TNFα je vazebným cílem čtyř microRNA: miR-16, miR-125-b, miR-369-3 a miR-155. MiR-16 v procesu ARE zprostředkované degradace výrazně zkracuje poločas rozpadu reportérového genu obsahujícího TNFα ARE. Rovněž miR-125b inhibuje překlad TNFα mRNA. Protikladnou funkci vykazují miR-369-3 a miR-155. Mir-369-3 působí v rozporu s kanonickou rolí miRNA jako aktivátor translace. V podmínkách potlačujících buněčný růst spojuje specifické proteiny (AGO, FXR1) s ARE sekvencemi a zvyšuje tak expresi TNFα (18). Mir-155 podporuje produkci TNFα neznámým mechanismem (11). Situace je značně komplikovaná, protože expresi TNFα ovlivňuje pestrá škála funkčně protikladných molekul. Mechanismy vzájemné interakce a míra zapojení jednotlivých regulátorů v kontrole hladin TNFα za fyziologických i patologických podmínek zůstává nejasná a vyžaduje další šetření.
Interferon (IFN) I. typu
Výzkumy posledních let zdůrazňují význam IFN I. typu v patogenezi systémového lupus erytematodes. IFN I. typu je produkován plazmatickými dendritickými buňkami (DC) a řídí zrání a aktivaci myeloidních DC. Ty vyvolávají expanzi a diferenciaci autoreaktivních CD4+ a CD8+ T lymfocytů a též proměnu autoreaktivních B buněk v buňky produkující protilátky. Zvýšené uvolňování autoantigenů a protilátek podporuje tvorbu imunitních komplexů, která skrze TLR signalizaci aktivuje plazmatické DC, zesiluje tvorbu IFN I a tím i celý patogenní kruh (45). Členem signální sítě IFN I. typu je miR-146a. MiR-146a byla potvrzena jako regulátor signalizace meziproduktů signální dráhy prozánětlivého TLR-myD88: IRAK1, IRAK2, TRAF6 a IRF5. Další cílovou molekulou miR-146a zapojenou v IFN I signalizaci je STAT (46). Všechny zmíněné cíle účinkují ve stejné pozitivní zpětnovazebné smyčce mezi TLR a IFN I-signálními kaskádami. Indukce miR-146a tak může kumulativním potlačením množství proteinů účinkovat jako negativní zpětnovazebný regulátor IFN dráhy I. typu.
TCR signalizace, PTPN22 (protein tyrosine phosphatase, non-receptor type 22)
Přesné stanovení TCR signalizačního prahu v selekci autoreaktivních klonů zabraňuje vzniku autoimunity. Zvířecí studie ukazují, že k vývoji systémových autoimunitních onemocnění vede neefektivní negativní výběr. Molekula miR-181a posiluje u zralých T buněk TCR signalizaci potlačením několika fosfatáz (viz text výše). Vyšší exprese miR-181a tak koreluje s vyšší TCR senzitivitou. Významným cílem miR-181a je PTPN22 mRNA, jejíž gen je silně asociován s mnoha autoimunitními chorobami např. s revmatoidní artritidou, systémovým lupus erytematodes či diabetes mellitus I. typu (47). PTPN 22 kóduje Lyp – lymfocytární intracelulární tyrosin fosfatázu. Ta v komplexu s kinázou Csk inhibuje další z kaskády kináz Lck (obě kinázy patří do skupiny protein kináz klíčových pro zprostředkování TCR signalizace). PTPN22 tedy plní funkci negativního regulátoru aktivace T buněk v imunitním systému člověka. Predisponující alela 620W PTPN22 genu kóduje variantu s vyšší katalytickou aktivitou a silnější negativní regulací. Předpokládá se, že posílení Lyp aktivity zvyšuje signalizační práh potřebný pro negativní selekci vyvíjejících se autoreaktivních T buněk a vede k vycestování patogenních klonů na periferii (11).
Proliferace, apoptóza, Bim, PTEN a soubor miR-17-92
Rovnováha mezi proliferací a apoptózou kontroluje homeostázu imunitního systému. Stimulace antigenem způsobuje množení a diferenciaci naivních lymfocytů do efektorových populací. Tento proces je spojen s nadregulací proapoptotických molekul (BIM, Fas, FasL). Jejich absence způsobuje závažné lymfoproliferativní syndromy podobající se systémovému lupus erytematodes (48). Nedostatek Bim vede k zhoršení kloubního zánětu u experimentální artritidy. Fosfatázový a tensinový homolog PTEN, je tumor supresorový gen, inhibitor fosfatidyl-3-OH kinázové signální dráhy, která kontroluje buněčnou proliferaci a přežití. Mutace PTEN vedou k rozvoji autoimunity a lymfomů, defekty mohou přispívat i k invazivitě a destruktivitě synoviálních fibroblastů u revmatoidní artritidy (RASF) (49). Zesílená PTEN exprese pomáhá zlepšit kolagenem indukované artritidy u potkanů. Bim a PTEN byly identifikovány jako cíle souboru miR-17-92 (50). Vzhledem k jejich úloze v inhibici a translaci proapoptotického transkripčního faktoru E2F1, se dá předpokládat, že miR-17-92 synergistickým účinkem reguluje rovnováhu mezi proliferací a apoptózou.
Regulace T buněčných populací zapojených v revmatických chorobách
ThF buňky představují nově identifikovanou skupinu CD4+ pomocných T lymfocytů. Nalézají se uvnitř B buněčných folikulů sekundárních lymfoidních orgánů a zprostředkovávají antigen specifickou aktivaci naivních či paměťových B buněk. Důkaz o zapojení ThF v patogenezi autoimunitních onemocnění podali Vineusa et al (51). Při zkoumání mutantního myšího kmene sanroque bylo nalezeno nadměrné množství ThF a spontánní tvorba germinálních center (GC). Sanroque myši jsou náchylné k vývoji syndromu podobnému systémovému lupus erytematodes a autoimunitně zprostředkované artritidě. Následné studie ukázaly, že tyto patologie jsou GC dependentní a řízené ThF buňkami. Yu et al. dále zjistili, že hromadění a poruchy diferenciace ThF lymfocytů způsobuje missense mutace v Roquin genu, který se podílí na regulaci (degradaci) ICOS (inducible T-cell co-stimulator). ICOS je kostimulační molekula z rodiny CD 28 uplatňující se ve vývoji ThF buněk a tvorbě GC. Nadměrná exprese ICOS však přispívá k rozvoji výše zmíněných chorobných stavů. Pro Roquin zprostředkovanou degradaci ICOS je vyžadována miR-101. Mutace vazebných míst miR-101 v 3’UTR ICOS mRNA narušily represivní činnost Roquin a vedly k hromadění ThF buněk a vzniku autoimunity (52).
Závěr
Regulační síť malých molekul RNA, zvláště pak miRNA je velice komplikovaná a zároveň komplexní. Molekuly miRNA se na nejnižší regulační úrovni zúčastňují všech buněčných procesů a zároveň regulace funkce celých systémů v organismech. Jsou také nedílnou součástí regulace imunitní odpovědi u člověka. Důsledné studium jejich obecné funkce, jakož i funkce spjaté s regulací imunitní odpovědi umožňuje jejich lepší poznání a potenciální využití v terapii. Pro svou stabilitu, malou velikost a zásadní význam v regulaci imunitních procesů se stávají molekuly miRNA pro budoucnost ideálním terapeutickým cílem při léčení závažných poruch imunitní odpovědi, poruchy způsobující systémové autoimunitní onemocnění nevyjímaje.
Seznam zkratek:
- AGO – protein rodiny argonaut
- AID – activation-induced cytidine deaminase
- ARE – motivy bohaté na adenosin a uridin, AU rich elements
- BACH – transkripční faktor, BTB and CNC homolog 1
- B-buňka (lymfocyt) – buňka imunitního systému zodpovědná především za specifickou, protilátkami zprostředkovanou imunitní odpověď
- Bcl-2 – protoonkogen blokující apopotózu
- CD – rozlišovací shluk (cluster of differenciation)
- Csk – c-src tyrosine kinase
- DC – dendritické buňky, (dendritic cells)
- DGCR8 – DiGeorge syndrom critical region 8
- DNA – deoxyribonukleová kyselina
- dsRNA – dvouvláknová RNA
- DUSP – dual-specificity protein phosphotase
- FADD – Fas associated-death domain protein
- Fas – povrchová buněčná molekula, její aktivace vede k apoptóze buňky
- FasL – Fas ligand
- Foxp3 – forkhead box P3
- FXR 1 – fragile X mental retardation syndrome-related protein 1
- GC – zárodečné centrum (germinal center)
- HCS – hematopoetic stem cells
- ICOS – inducible T-cell co-stimulator
- IFN – interferon
- IκB – inhibitor NFκB
- IKK – I kappa B kinase
- IL – interleukin
- IRAK – interleukin receptor activated kinase
- Lck – lymphocyte specific protein tyrosine kinase
- LPS – lipopolysacharid
- M-CSFR – macrophage colony stimulating factor receptor
- Mef2c – myocyte-specific enhancer factor 2C
- miRNA – micro ribonukleová kyselina (micro ribonucleic acid)
- MMP – matrixová metaloproteináza (matrix metalloproteinase)
- mRNA – informační ribonukleová kyselina (messenger ribonucleic acid)
- NFκB – jaderný transkripční faktor κB (nuclear transcripting factor κB)
- piRNA – Piwi interacting RNA
- Pol II – DNA dependentní RNA polymeráza typu II
- pre-miRNA – prekurzorová miRNA (precursor miRNA)
- pri-miRNA – primární transkript miRNA
- PTEN – phosphatase and tensin homolog
- PTPN22 – protein tyrosine phosphatase non-receptor type 22
- PU.1 – spleen focus forming virus (SFFV) proviral integration oncogene spi1
- RA – revmatoidní artritida
- RANKL – receptor activator of nuclear factor kappa B ligand
- RASF – synoviální fibroblasty pacientů s revmatoidní artritidou (rheumatoid arthritis synovial fibroblasts)
- RIG-I – retinoic acid inducible gene I
- Ripk1 – receptor interacting threonine kinase
- RNAi – interference ribonukleových kyselin
- SHIP1 – SH2 domain-containing inositol-5’-phosphatase 1
- SHP2 – SH2-domain-containing protein tyrosine phosphatase 2
- siRNA – small interacting RNA
- SLE – systémový lupus erythematodes
- STAT – přenašeč signálu a aktivátor transkripce (signal transducer and activator of transcription)
- SUMO – small ubiquitin modifiers
- TCR – receptor T-lymfocytů (T-cell receptor)
- Th-lymfocyt – pomocný T lymfocyt (T helper)
- ThF – pomocný folikulární T lymfocyt (follicular helper T cell)
- TLR – Toll-like receptor
- TNFα – tumor nekrotizující faktor α (tumor necrosis factor α)
- TNFR – receptor pro tumor nekrotizující faktor (tumor necrosis factor receptor)
- TRAF – faktor asociovaný s TNFR (TNFR associating factor)
- Treg – T regulační lymfocyty
- UTR – nepřekládaná oblast kódující sekvence mRNA
RNDr. Peter Novota, Ph.D
Revmatologický ústav
Na Slupi 4
128 50 Praha 2
e-mail: novota@revma.cz
Zdroje
1. Strietholt S, Maurer B, Peters MA, Pap T, Gay S. Epigenetic modifications in rheumatoid arthritis. Arthritis Res Ther 2008; 10 : 219.
2. Sedivy, JM, Banumathy G, Adams PD. Aging by epigenetics - a consequence of chromatin damage? Exp Cell Res 2008; 314 : 1909-17.
3. Yung RL, Julius A. Epigenetics, aging, and autoimmunity. Autoimmunity 2008; 41 : 329-335.
4. Ghildiyal M, Zamore PD. Small silencing RNAs: an expanding universe. Nat Rev Genet 2009; 10 : 94-108.
5. Lee RC, Feinbaum RL, Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. Cell 1993; 75 : 843–854.
6. Reinhart BJ, Slack FJ, Basson M, Pasquinelli AE, Bettinger JC, Rougvie AE, Horvitz HR, Ruvkun G. The 21-nucleotide let-7 RNA regulates developmental timing in Caenorhabditis elegans. Nature 2000; 403 : 901–906.
7. Rajewsky N, Socci ND. Computational identification of microRNA targets, Dev Biol 2004; 267 : 529-35.
8. Duroux-Richard I, Presumey J, Courties G, Gay S, Gordeladze J, Jorgensen C, Kyburz D, Apparailly F. MicroRNAs as new player in rheumatoid arthritis. Joint Bone Spine. In press 2010.
9. Liang Y, Ridzon D, Wong L, Chen C. Characterization of microRNA expression profiles in normal human tissues. BMC Genomics 2007; 8 : 166.
10. Furer V, Greenberg JD, Attur M, Abramson SB, Pillinger MH, The role of microRNA in rheumatoid arthritis and other autoimmune diseases. Clin Immunol 2010; 136 : 1-15.
11. Luo X, Tsai LM, Shen N, Yu D. Evidence for microRNA-mediated regulation in rheumatic diseases. Ann Rheum Dis 2010; 69 (Suppl 1): i30-36.
12. Kim, VN, Nam JW. Genomics of microRNA. Trends Genet 2006; 22 : 165-73.
13. Friard O, Re A, Taverna D, De Bortoli M, Corá D. CircuitsDB: a database of mixed microRNA/transcription factor feed-forward regulatory circuits in human and mouse. BMC Bioinformatics 2010; 11 : 435.
14. Khvorova A, Reynolds A, Jayasena SD. Functional siRNAs and miRNAs exhibit strand bias. Cell 2003; 115 : 209-16.
15. Schwarz DS, Hutvágner G, Du T, Xu Z, Aronin N, Zamore PD. Asymmetry in the assembly of the RNAi enzyme complex. Cell 2003; 115 : 199-208.
16. Weil D. GW bodies and stress granules, two cytoplasmic structures for mRNA degradation and storage in mammalian cells. J Soc Biol 2007; 201 : 349-58.
17. Berezikov E, Chung WJ, Willis J, Cuppen E, Lai EC. Mammalian mirtron genes. MolCell 2007 Oct 26; 28 : 328-36.
18. Vasudevan S, Tong Y, Steitz JA. Switching from repression to activation: microRNAs can up-regulate translation. Science 2007; 318 : 1931-4.
19. Sonkoly E, Pivarcsi A. Advances in microRNAs: implications for immunity and inflammatory diseases. J Cell Mol Med 2009; 13 : 24-38.
20. Chen CZ, Li L, Lodish HF, Bartel DP, MicroRNAs modulate hematopoietic lineage differentiation. Science 2004; 303 : 83-6.
21. Li QJ, Chau J, Ebert PJ, Sylvester G, Min H, Liu G, Braich R, Manoharan M, Soutschek J, Skare P, Klein LO, Davis MM, Chen CZ. miR-181a is an intrinsic modulator of T cell sensitivity and selection. Cell. 2007; 129 : 147-61.
22. Costinean S, Zanesi N, Pekarsky Y, Tili E, Volinia S, Heerema N, Croce CM. Pre-B cell proliferation and lymphoblastic leukemia/high-grade lymphoma in E(mu)-miR155 transgenic mice. Proc Natl Acad Sci U S A. 2006; 103 : 7024-9.
23. Rodriguez A, Vigorito E, Clare S, Warren MV, Couttet P, Soond DR, van Dongen S, Grocock RJ, Das PP, Miska EA, Vetrie D, Okkenhaug K, Enright AJ, Dougan G, Turner M, Bradley A. Requirement of bic/microRNA-155 for normal immune function. Science 2007; 316 : 608-11.
24. Thai TH, Calado DP, Casola S, Ansel KM, Xiao C, Xue Y, Murphy A, Frendewey D, Valenzuela D, Kutok JL, Schmidt-Supprian M, Rajewsky N, Yancopoulos G, Rao A, Rajewsky K. Regulation of the germinal center response by microRNA-155. Science 2007; 316 : 604-8.
25. Vigorito E, Perks KL, Abreu-Goodger C, Bunting S, Xiang Z, Kohlhaas S, Das PP, Miska EA, Rodriguez A, Bradley A, Smith KG, Rada C, Enright AJ, Toellner KM, Maclennan IC, Turner M. microRNA-155 regulates the generation of immunoglobulin class-switched plasma cells. Immunity 2007; 27 : 847-59.
26. Xiao C, Srinivasan L, Calado DP, Patterson HC, Zhang B, Wang J, Henderson JM, Kutok JL, Rajewsky K. Lymphoproliferative disease and autoimmunity in mice with increased miR-17-92 expression in lymphocytes. Nat Immunol 2008; 9 : 405-14.
27. Fontana L, Pelosi E, Greco P, Racanicchi S, Testa U, Liuzzi F, Croce CM, Brunetti E, Grignani F, Peschle C. MicroRNAs 17-5p-20a-106a control monocytopoiesis through AML1 targeting and M-CSF receptor upregulation. Nat Cell Biol 2007; 9 : 775-87.
28. Zhou B, Wang S, Mayr C, Bartel DP, Lodish HF. miR-150, a microRNA expressed in mature B and T cells, blocks early B cell development when expressed prematurely Proc Natl Acad Sci U S A. 2007; 104 : 7080-5.
29. Xiao C, Calado DP, Galler G, Thai TH, Patterson HC, Wang J, Rajewsky N, Bender TP, Rajewsky K. MiR-150 controls B cell differentiation by targeting the transcription factor c-Myb. Cell 2007; 131 : 146-59.
30. Johnnidis JB, Harris MH, Wheeler RT, Stehling-Sun S, Lam MH, Kirak O, Brummelkamp TR, Fleming MD, Camargo FD. Regulation of progenitor cell proliferation and granulocyte function by microRNA-223. Nature 2008; 451 : 1125-9.
31. Taganov KD, Boldin MP, Chang KJ, Baltimore D. NF-kappaB-dependent induction of microRNA miR-146, an inhibitor targeted to signaling proteins of innate immune responses. Proc Natl Acad Sci U S A. 2006; 103 : 12481-6.
32. Perry MM, Moschos SA, Williams AE, Shepherd NJ, Larner-Svensson HM, Lindsay MA. Rapid changes in microRNA-146a expression negatively regulate the IL-1beta-induced inflammatory response in human lung alveolar epithelial cells. J Immunol 2008; 180 : 5689-98.
33. Hou J, Wang P, Lin L, Liu X, Ma F, An H, Wang Z, Cao X. MicroRNA-146a feedback inhibits RIG-I-dependent Type I IFN production in macrophages by targeting TRAF6, IRAK1, and IRAK2. J Immunol 2009; 183 : 2150-8.
34. Ceppi M, Pereira PM, Dunand-Sauthier I, Barras E, Reith W, Santos MA, Pierre P. MicroRNA-155 modulates the interleukin-1 signaling pathway in activated human monocyte-derived dendritic cells. Proc Natl Acad Sci U S A. 2009; 106 : 2735-40.
35. Tili E, Michaille JJ, Cimino A, Costinean S, Dumitru CD, Adair B, Fabbri M, Alder H, Liu CG, Calin GA, Croce CM. Modulation of miR-155 and miR-125b levels following lipopolysaccharide/TNF-alpha stimulation and their possible roles in regulating the response to endotoxin shock. J Immunol. 2007; 179 : 5082-9.
36. Wu H, Neilson JR, Kumar P, Manocha M, Shankar P, Sharp PA, Manjunath N. miRNA profiling of naēve, effector and memory CD8 T cells. PLoS One. 2007; 2: e1020.
37. Li QJ, Chau J, Ebert PJ, Sylvester G, Min H, Liu G, Braich R, Manoharan M, Soutschek J, Skare P, Klein LO, Davis MM, Chen CZ. miR-181a is an intrinsic modulator of T cell sensitivity and selection. Cell 2007; 129 : 147-61.
38. Lu LF, Liston A. MicroRNA in the immune system, microRNA as an immune system. Immunology 2009; 127 : 291-8.
39. Muljo SA, Ansel KM, Kanellopoulou C, Livingston DM, Rao A, Rajewsky K. Aberrant T cell differentiation in the absence of Dicer. J Exp Med 2005; 202 : 261-9.
40. Liston A, Lu LF, O’Carroll D, Tarakhovsky A, Rudensky AY. Dicer-dependent microRNA pathway safeguards regulatory T cell function. J Exp Med 2008; 205 : 1993–2004.
41. Zhou X, Jeker LT, Fife BT, Zhu S, Anderson MS, McManus MT, Bluestone JA. Selective miRNA disruption in T reg cells leads to uncontrolled autoimmunity. J Exp Med 2008; 205 : 1983-91.
42. Cobb BS, Hertweck A, Smith J, O’Connor E, Graf D, Cook T, Smale ST, Sakaguchi S, Livesey FJ, Fisher AG, Merkenschlager M. A role for Dicer in immune regulation. J Exp Med 2006; 203 : 2519-27.
43. Pauley KM, Cha S, Chan EK. MicroRNA in autoimmunity and autoimmune diseases. J Autoimmun 2009; 32 : 189-94.
44. Jing Q, Huang S, Guth S, Zarubin T, Motoyama A, Chen J, Di Padova F, Lin SC, Gram H, Han J. Involvement of microRNA in AU-rich element-mediated mRNA instability. Cell 2005; 120 : 623-34.
45. Baechler EC, Batliwalla FM, Karypis G, Gaffney PM, Ortmann WA, Espe KJ, Shark KB, Grande WJ, Hughes KM, Kapur V, Gregersen PK, Behrens TW. Interferon-inducible gene expression signature in peripheral blood cells of patients with severe lupus. Proc Natl Acad Sci U S A. 2003; 100 : 2610-5.
46. Tang Y, Luo X, Cui H, Ni X, Yuan M, Guo Y, Huang X, Zhou H, de Vries N, Tak PP, Chen S, Shen N. MicroRNA-146A contributes to abnormal activation of the type I interferon pathway in human lupus by targeting the key signaling proteins. Arthritis Rheum 2009; 60 : 1065-75.
47. Gregersen PK, Lee HS, Batliwalla F, Begovich AB. PTPN22: setting thresholds for autoimmunity. Semin Immunol 2006; 18 : 214-23.
48. Nagata S. Human autoimmune lymphoproliferative syndrome, a defect in the apoptosis-inducing Fas receptor: a lesson from the mouse model. J Hum Genet 1998; 43 : 2-8.
49. Pap T, Franz JK, Hummel KM, Jeisy E, Gay R, Gay S. Activation of synovial fibroblasts in rheumatoid arthritis: lack of Expression of the tumour suppressor PTEN at sites of invasive growth and destruction. Arthritis Res 2000; 2 : 59-64.
50. Xiao C, Srinivasan L, Calado DP, Patterson HC, Zhang B, Wang J, Henderson JM, Kutok JL, Rajewsky K. Lymphoproliferative disease and autoimmunity in mice with increased miR-17-92 expression in lymphocytes. Nat Immunol 2008; 9 : 405-14.
51. Vinuesa CG, Cook MC, Angelucci C, Athanasopoulos V, Rui L, Hill KM, Yu D, Domaschenz H, Whittle B, Lambe T, Roberts IS, Copley RR, Bell JI, Cornall RJ, Goodnow CC. A RING-type ubiquitin ligase family member required to repress follicular helper T cells and autoimmunity. re. 2005; 435 : 452-8.
52. Yu D, Tan AH, Hu X, Athanasopoulos V, Simpson N, Silva DG, Hutloff A, Giles KM, Leedman PJ, Lam KP, Goodnow CC, Vinuesa CG. Roquin represses autoimmunity by limiting inducible T-cell co-stimulator messenger RNA. Nature 2007; 450 : 299-303.
Štítky
Dermatológia Detská reumatológia Reumatológia
Článok vyšiel v časopiseČeská revmatologie
Najčítanejšie tento týždeň
2011 Číslo 2- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
-
Všetky články tohto čísla
- Malé molekuly RNA a jejich význam v imunitní odpovědi organismu
- Příspěvky z kongresu Biologická léčba
- Existují prediktivní ukazatele úspěšnosti biologické léčby?
- Jak vybrat preparát mezi biologickými léky?
- Jak se dívat na strukturální progresi u biologické léčby?
- Mimokloubní projevy revmatických onemocnění a možnosti jejich ovlivnění biologickou léčbou
- Výskyt infekcí při léčbě antagonisty TNF alfa v registru ATTRA
- Biologická léčba revmatoidní artritidy a riziko nádorových onemocnění
- Biologická léčba a speciální situace (těhotenství, kojení, vakcinace a perioperační období)
- Česká revmatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Biologická léčba a speciální situace (těhotenství, kojení, vakcinace a perioperační období)
- Mimokloubní projevy revmatických onemocnění a možnosti jejich ovlivnění biologickou léčbou
- Biologická léčba revmatoidní artritidy a riziko nádorových onemocnění
- Výskyt infekcí při léčbě antagonisty TNF alfa v registru ATTRA
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



