-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Diagnostika a liečba pacientov s Peutz-Jeghersovým syndrómom
Diagnosis and treatment of patients with Peutz - Jeghers syndrome
Peutz-Jeghers syndrome is a rare autosomal dominant inherited disease characterized by hamartomatous polyps of the gastrointestinal tract, by mucocutaneous pigmentations and an increased risk of intestinal and extraintestinal tumours. Diagnosis of Peutz-Jeghers syndrome requires mucocutaneous lesions, histological finding of typical hamartomas and genetic analysis. Mutation of gene STK 11, a tumour suppressor gene coding protein serine/threonine kinase 11, is the only known cause of Peutz-Jeghers syndrome. 145 mutations of the gene have been described so far, which is probably the reason for the large phenotypic variability. The treatment strategy is based on regular endoscopic or surgical polypectomy and a special oncological screening programme to prevent severe complications of polyposis and the development of an advanced form of malignancies.
Key words:
phenotype – genotype – hamartomatous polyp – cancer – STK 11/LKB 1 – gene coding serine/threonine kinase – Peutz--Jeghers
Autoři: E. Kresanová 1; T. Hlavatý 1
; M. Huorka 1; Z. Homérová 1; J. Payer 1; D. Ilenčíková 2
Působiště autorů: V. interná klinika LF UK a FNsP, Bratislava 1; Oddelenie onkologickej genetiky, Národný onkologický ústav, Bratislava 2
Vyšlo v časopise: Gastroent Hepatol 2010; 64(2): 14-21
Kategorie: IBD: Aktuální přehled
Souhrn
Peutz-Jeghersov syndróm je vzácne autozomálne dominantne dedičné ochorenie charakterizované hamartomatóznymi polypmi tráviaceho traktu, mukokutánnymi pigmentáciami a zvýšeným rizikom malígneho ochorenia. Diagnostika sa opiera o prítomnosť mukokutánnych pigmentácii, histologické vyšetrenie polypov s nálezom typických hamartómov a o genetickú analýzu. Mutácia tumorsupresorového génu STK11 kódujúci serín-treonín kinázu 11 je zatiaľ jedinou známou príčinou Peutz-Jeghersovho syndrómu. Doposiaľ bolo popísaných vyše 145 typov mutácií tohto génu pravdepodobne zodpovedných za veľkú variabilitu jeho fenotypového prejavu. Liečba ochorenia spočíva v pravidelnom endoskopickom alebo chirurgickom odstraňovaní polypov a v špecifickom onkologickom screeningu v snahe znížiť riziko vzniku závažných komplikácií polypózy a zabrániť rozvoju pokročilých foriem onkologických ochorení.
Kľúčové slová:
fenotyp – genotyp – hamartomatózny polyp – karcinóm – STK 11/LKB 1 – gén kódujúci serín-treonín kinázu – Peutz--JeghersÚvod
Peutz-Jeghersov syndróm (P-J syndróm) patrí medzi vzácne autozomálne dominantne dedičné polypózy tráviaceho traktu. Charakterizovaný je prítomnosťou polypov typu hamartómov, mukokutánnymi pigmentáciami najčastejšie v oblasti pier a bukálnej sliznice. Napriek tomu, že polypy sú väčšinu benígne hamartómy, pacienti s P-J syndrómom majú až 15násobne zvýšené riziko rozvoja intestinálnych ako i extraintestinálnych malígnych nádorov v porovnaní s bežnou populáciou. Ochorenie je približne 10krát zriedkavejšie ako familiárna adenomatózna polypóza. Výskyt ochorenia vo svete nie je dostatočne zmapovaný, napr. vo Fínsku sa incidencia udáva na 1 : 50 000 obyvateľov za rok, v USA 1 : 100 00 obyvateľov za rok bez rozdielu pohlaví, rasovej či etnickej skupiny [1]. Epidemiológia tohto ochorenia na Slovensku nie je zatiaľ zhodnotená.
Syndróm bol prvýkrát popísaný v roku 1945 holandským lekárom J. L. A. Peutzom (1886–1957), ktorý zaznamenal vzťah medzi intestinálnou polypózou a mukokutánnymi škvrnami na perách a bukálnej sliznici jednej holandskej rodiny [2]. Familiárny výskyt pigmentácii pier bol zaznamenaný už v roke 1896 na jednovaječných dvojčatách, jedno z nich neskôr zomrelo na črevnú intususcepciu. V roke 1945 francúzsky profesor dermatovenerológie H. Touraine (1883–1961) uviedol tento vzácny syndróm do francúzskej literatúry pod názvom „Syndróm de Peutz (lentigo – polyposis digestive)“ a o štyri roky neskôr Harold Jeghers (1904–1990), americký lekár, ho v rozsiahlej práci definoval ako „generalizovanú intestinálnu polypózu a melanínové škvrny orálnej mukózy, pier a prstov“ [3–4]. Ochorenie je preto vo svetovej literatúre uvádzané aj pod názvom Peutz-Touraine-Jeghers syndróm. Genetické pozadie ochorenia, mutáciu génu STK 11 zvaného taktiež LKB1 prvýkrát popísali v roku 1998 Hemminki et al [5] a Jenne et al [6]. Z dostupnej československej literatúry zisťujeme zmienku o Peutz-Jeghersovom syndróme v roku 1958 [7].
Vek nástupu klinických prejavov ochorenia je veľmi variabilný. Prvé prejavy sa manifestujú väčšinou už v detskom veku najčastejšie v 1.–3. dekáde života pod obrazom únavového syndrómu, chronickej sideropenickej anémie a recidivujúcich epizód abdominálnej bolesti (23 %) nezriedka záverovaných ako funkčná dyspepsia. Medián veku prvých symptómov spojených s obštrukciou tenkého čreva je podľa Amosa 10 rokov, priemerný vek prvej polypektómie je 13 rokov [8]. Podľa ďalšej štúdie na 37 deťoch s P-J syndrómom urgentnú operáciu pre ileus podstúpilo 30 % vo veku pod 10 rokov a 68 % pod 18 rokov veku [9]. Menej častými prejavmi ochorenia sú enteroragia (14 %) a rektálny prolaps (7 %). Vzácne sa môže vyskytovať u mužov gynekomastia pri endokrinne aktívnom tumoru semenníkov – CST (Calcifying Sertolliho cell tumor of testes) alebo nepravidelná menštruácia, eventuálne predčasná puberta u žien pri hyperestrogenizme a sekrečnom nádore ovária – SCTAT (Ovarial sex cord tumor with annular tubules) [10–12]. Zaujímavým a charakteristickým fenotypovým prejavom ochorenia sú mukokutánne pigmentácie (obr. 1). Sú to ploché pigmentované lézie hnedej až hnedočiernej farby makroskopicky podobné pehám. V mikroskopickom obraze je charakteristická hyperpigmentácia v bazálnej vrstve epidermis spôsobená nakupením melanocytov s dlhými pigmentovanými dendritmi. Elektrónová mikroskopia lézií získaných z oblasti prstov poukazuje na blokádu pri premene pigmentu z melanocytov do keratinocytov [13]. Pigmentácie začínajú byť viditeľné po prvém roku života, do piateho rokov sa ich počet zvyšuje. V období puberty môžu blednúť až úplne vymiznúť, väčšinou však pretrvávajú po celý život. Vyskytujú sa najčastejšie na perách, periorálnej a bukálnej sliznici, podnebí. Menej častou lokalizáciou sú očné viečka, spojovky, plantárne a palmárne časti prstov a genitálie [1].
Obr. 1. Mukokutánne pigmentácie pacienta s P-J syndrómom geneticky vyšetreného na odd. klinickej genetiky NOÚ, Klenova, Bratislava. Fig. 1. Mucocutaneous pigmentation of a patient with P-J syndrome, who was genetically tested at the Department of Clinical Genetics at the National Oncological Institute in Klenova Street in Bratislava. 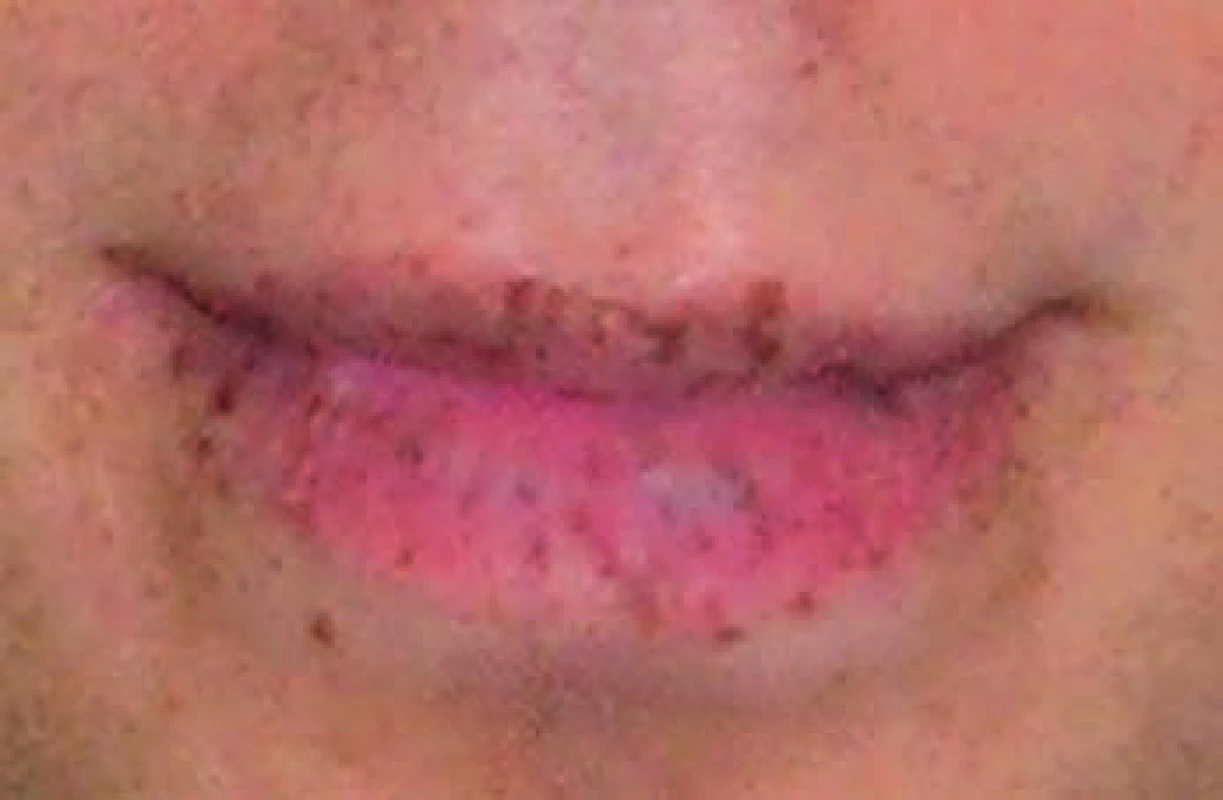
Polypóza
Polypy sa vyskytujú v počte niekoľko desiatok (vzácne stoviek) od žalúdka až po konečník. Dominantnou lokalizáciou je oblasť tenkého čreva (96 %) v poradí výskytu jejunum – duodenum – ileum. Žalúdok (24 %), hrubé črevo (27 %) a rektum (24 %) sú postihnuté v menej než jednej tretine prípadov. Taktiež bol popísaný i solitárny výskyt veľkého polypu Peutz-Jeghersovho typu [14–15]. V posledných štúdiach je zdokumentovaný i výskyt hamartomatóznych polypov v oblasti nazálnych dutín, ureteru, žlčových ciest a tonzíl [16–18].
Polypy bývajú makroskopicky rôzneho vzhľadu od veľkých stopkatých polypov rôzneho tvaru dorastajúcich do veľkosti niekoľko centimetrov až po drobné sesilné lézie (obr. 2). Mikroskopicky patria polypy medzi hamartómy so špecifickým histopatologickým obrazom (obr. 3). Hamartóm je definovaný ako neneoplastická lézia pozostávajúca z nadmerného abnormálne rozmiestneného tkaniva, ktoré sa za normálnych okolností na danom mieste vyskytuje. U P-J syndrómu je charakteristická vrstva tenkého svalstva vetviaca sa z lamina muscularis mucosae do polypu ako kmeň a vetvy stromu. Polyp je pokrytý dobre diferencovaným epitelom, i keď architektúra krýpt môže byť mierne atypická. 10 % polypov vykazuje znaky tzv. „pseudo-invázie“ so zasahovaním normálne diferencovaného epitelu do oblasti submukózy až celej črevnej steny pripomínajúcu malígnu inváziu [19–20]. Konkomitantne môžu byť prítomné v menšom množstve i adenómy či adenokarcinómy [1,21].
Obr. 2. 3. Histologický obraz polypu Peutz-Jeghresovho typu pacienta XY dispenzarizovaného na 5. internej klinike lF UK a FNsP Ružinov s charekteristickým vetvením svalových vláken do polypu ako kmeň a vetvy stromu. Fig. 2,3. Histological profile of a Peutz-Jeghers polyp in patient XY in the dispensary care of the 5th Clinic of Internal Medicine at the Charles University Faculty of Medicine and of the University Hospital and Health Centre Ružinov, with the characteristic branching of muscle fibres into the polyp similar to the trunk and branches of a tree. 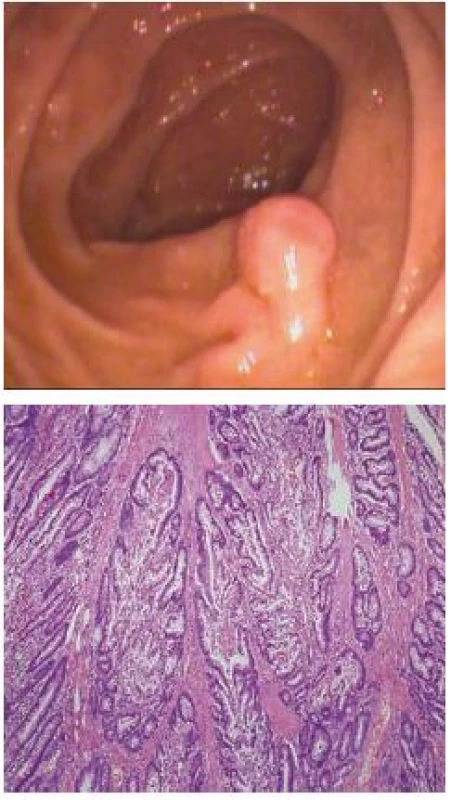
Diagnostika
Na stanovenie diagnózy P-J syndrómu boli vypracované viaceré diagnostické kritériá opierajúce sa o prítomnosť popísaných pigmentácií, nález polypózy tráviaceho traktu charakteru hamartómu P-J typu, pozitívnej rodinnej anamnézy a analýzy mutácie génu STK 11 [22] (tab. 1).
Tab. 1. Diagnostické kritéria pre Peutz-Jeghersov syndróm modifikované podľa odporúčaní Mayo Clinic USA [1]. Tab. 1. Diagnostic criteria for Peutz-Jeghers syndrome; modified as recommended by the Mayo Clinic in the USA [1]. ![Diagnostické kritéria pre Peutz-Jeghersov syndróm modifikované podľa odporúčaní Mayo Clinic USA [1].
Tab. 1. Diagnostic criteria for Peutz-Jeghers syndrome; modified as recommended by the Mayo Clinic in the USA [1].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/92bf779d5308b756370850267c6178c2.jpeg)
Genetická analýza
Ďalším krokom dopľňajúcim diagnostiku ochorenia je genetická analýza prítomnosti mutácie STK 11/LKB 1 u pacienta a jeho rodiny, ktorá je v súčasnosti možná a dostupná i na Slovensku [23–24]. Mutácia tohto génu sa považuje zatiaľ za jedinú známu príčinu P-J syndrómu. Až v 50 % prípadov sa jedná o mutáciu vzniknutú „de novo“. STK 11/LKB 1 patrí medzi tumorsupresorové gény. Kóduje serín-treonín proteinovú kinázu 11 [25]. Predpokladá sa, že mutácia STK 11 prispieva k tumorigenéze prostredníctvom viacerých mechanizmov: indukciou angiogenézy, supresiou ukončenia bunkového cyklu, supresiou apoptózy cestou proteínu p53, či stratou bunkovej polarity [26–28]. V roku 2006 bolo v Human Genom Database evidovaných viac než 145 rôznych typov mutácií tohto génu. Jedná sa väčšinou (60–70 %) o „truncated1“ kmeňové mutácie typu nonsense1a, missence2, in-frame delécie3 a splice site mutácie4 detekovatelné metódou sekvenčnej analýzy5 [23].
Približne 30–35 % mutácií spôsobujú rozsiahle delécie tohto génu, ktoré je možné zachytiť metódou MLPA (multiple ligand-dependent probe assay). Podľa výsledkov Aretzovej štúdie z roku 2005 sa tak zvyšuje možnosť detekcie mutácie STK11/LKB 1 až na 94 % [29]. U pacientov s negatívnym výsledkom genetického testovania, ale s klinickými príznakmi P-J syndrómu sa za pravdepodobnú príčinu predpokladá mutácia na inom, doposiaľ nezistenom géne. Negatívny výsledok na mutáciu STK 11 preto diagnózu P-J nevylučuje, a tým ani nemení manažment a liečbu ochorenia.
Diferenciálna diagnostika
Diferenciálne diagnosticky pripadajú do úvahy iné dedičné polypózy tráviaceho traktu (tab. 2). Z adenomových polypóz je to predovšetkým familiárna adenomatózna polypóza a atenuovaná familiárna adenomatózna polypóza. Z hamartomových polypóz treba vylúčiť Cowdenov syndróm a syndróm juvenilnej polypózy. Od P-J syndrómu sa líšia predovšetkým chýbaním typickej histologickej štruktúry hamartómu P-J typu. Pacienti s Cowdenovým syndrómom majú taktiež kožné keratómy, papilómy v oblasti tváre, axily, genitálií, čo môže imitovať kožné zmeny u P-J syndrómu. Ochorenie je taktiež asociované so zvýšeným výskytom nádorov mammy, štítnej žľazy, pľúc a iných. Syndróm je popisovaný v súvislosti s mutáciou PTEN onkogénu [30–31]. Ďaľšou autozomálne dedičnou hamartomatóznou polypózou tráviaceho traktu je syndróm juvenilnej polypózy (JPC). Diagnostika sa opiera o prítomnosť viacerých juvenilných polypov špecifického vzhľadu. Polypy sa môžu vyskytovať v ktoromkoľvek veku (medián rozvoja klinických príznakov je 20 rokov). Nachádzame ich v celom tráviacom trakte, dominantne však v rekte, v hrubom čreve, menej často i v žalúdku či tenkom čreve. Histologicky sa jedná o hamartómový polyp primitívnej štruktúry s cysticky dilatovanými tubulmi vyplnenými hlienom a so zmoženou laminou propriou mucosae [33]. Syndróm je asociovaný s mutáciami rôznych génov (SMAD4, BMPR1A, and ENG – kódujúce rôzne proteíny zasahujúce do signálnej cesty rastového faktoru TGF-β a taktiež je spojený s vyšším rizikom rozvoja gastrointestinálnych malignít [32].
Tab. 2. Diferenciálna diagnostika familiárnych polypóz tráviaceho traktu [32–33]. Tab. 2. Differential diagnostics of familial polyposis of the digestive tract [32–33]. ![Diferenciálna diagnostika familiárnych polypóz tráviaceho traktu [32–33].
Tab. 2. Differential diagnostics of familial polyposis of the digestive tract [32–33].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/e1f7e73ee3b5f8d2d96fe9c022bf0f19.jpeg)
PJS – Peutz-Jeghers syndróm, JPC – syndróm juvenilnej polypózy, FAP – familiárna adenomatózna polypóza Nádorové riziko
Výskyt jednotlivých typov nádorov a nádorové riziko boli analyzované vo viacerých štúdiách [34–37], z nich zatiaľ najväčšia je Hearleho štúdia z roku 2006 na súbore 416 pacientov [38].
V porovnaní s bežnou populáciou sa u týchto pacientov popisuje až 15násobne zvýšené riziko vzniku malígneho ochorenia. Z Hearleho práce vyplýva, že až 1/2 pacientov zomiera na onkologické ochorenie do 57. roku života. Priemerný vek diagnostikovania malignity je 43 rokov. Kumulatívne riziko nádoru v 70 rokoch je až 85 %, v bežnej populácii rovnakého veku je to 18 %. Karcinómy môžu vzniknúť kdekoľvek v tráviacom trakte bez závislosti od lokalizácie hamartómov. Najčastejšie sú popisované predovšetkým v oblasti hrubého čreva, žalúdka, tenkého čreva, pažeráka. Z extraintestinálnych nádorov dominuje u žien adenokarcinóm prsníka (53 %), karcinóm pankreasu (38 %), krčku maternice (9 %), endometria (10 %) a bronchogénny karcinóm pľúc (15 %). Menej častými sú benígne aj malígne nádory štítnej žľazy, žlčníka a žlčových ciest. Zo vzácnych tumorov reprodukčných orgánov typicky združených s týmto syndrómom treba spomenúť testikulárne a ovariálne nádory zo skupiny „sex cord“ tumorov, u mužov kalcifikujúci tumor zo Sertolliho buniek – SCT (Calcifying Sertolliho cell tumor of testes), u žien sekrečný nádor ovária – SCTAT (Ovarial sex cord tumor with annular tubules). Výskyt týchto vzácnych tumorov je až v 1/3 prípadov asociovaný s P-J syndrómom. 10 % žien vyžaduje chirurgické riešenie nádoru. U P-J syndrómu bývajú tieto nádory multifokálne, mikroskopické, niekedy endokrinne aktívne spôsobujúce predčasnú pubertu, nepravidelnú menštruáciu, u mužov gynekomastiu [10–12]. Inou malignitou reprodukčních orgánov združenou s PJS je malígny adenóm krčku maternice, vo svetovej literatúre nazývaný tiež ako „minimal deviation adenocarcinoma“. Jedná sa o dobre diferencovaný adenokarcinóm z endocervikálnych žliaz v 10 % asociovaný s PJS [39–40].
Manažment
Základom starostlivosti o pacientov s P-J syndrómom je ich dôsledná dispenzarizácia. Je zameraná predovšetkým na prevenciu komplikácií polypózy, včasný záchyt a liečbu onkologických ochorení ako i aktívne vyhladávanie rizikových príbuzných prostredníctvom genetického poradenstva.
Za týmto účelom boli vypracované špeciálne dispenzarizačné programy s rôznymi modifikáciami podľa klinického pracoviska [1,22,41–43]. Kolonoskopické vyšetrenie sa doporučuje od veku 15–18 rokov v intervale 2–3 roky. Gastroskopia v prípade preukázanej polypózy každé 2 roky od 10.–15. roku veku. V manažmente pacientov s P-J syndrómom je klúčové vyšetrenie tenkého čreva. U detí s preukázanou mutáciou STK 11 génu je doporučované vyšetrenie tenkého čreva už od 8. roku veku, v prípade klinických príznakov i skôr. U detí sa odporúča najmä kapsulová enteroskopia alebo magnetická rezonancia s použitím orálneho kontrastu pre ich vysokú senzitivitu, toleranciu a bezpečnosť [44]. V liečbe a profylaxii sa využíva jejunálna enteroskopia, dvojbalónková enteroskopia (DBE) a intraoperačná endoskopia. Polypy by mali byť odstránené predtým, než spôsobia intususcepciu, eventuálne obštrukciu alebo dosiahnu veľkosť s nemožnosťou ich odstránenia tradičnou endoskopiou [1,45].
Dvojbalónková enteroskopia je v poslednej dobe upredňostňovaná nad intraoperačnou endoskopickou polypektómiou pre jej nižšiu invazivitu, lepšiu toleranciu a porovnatelnú terapeutickú efektvivitu [46–47]. Komplikácie sú vzácne. Z výsledkov restrospektívnej štúdie z roku 2007 sa udáva riziko komplikácii 0,8 % pri diagnostickej procedúre, v rámci terapeutickej DBE sa riziko komplikácii zvyšuje na 4,3 %, žiadna z komplikácii nebola fatálna [48]. U niektorých pacientov po opakovaných operáciach môže byť toto vyšetrenie limitované prítomnosťou intraabdominálnych adhézií. Laparoskopická alebo otvorená intraoperačná endoskopická polypektómia je indikovaná pri nemožnosti znesenia polypu hore uvedenými metódami alebo v rámci abdominálnej operácie z inej indikácie. Doporučuje sa kompletné prešetrenie tenkého čreva s polypektómiou, tzv. „total polyp clearence“ [49]. Existujú viaceré retrospektívne štúdie potvrdzujúce významný prínos intraoperačnej endoskopie ako i DBE na zníženie výskytu komplikácií u pacientov s P-J sydrómom [42,45].
Dispenzarizačný program zahŕňa i multiorgánové sledovanie zamerané na včasný záchyt onkologického ochorenia [1,43,45,50] (tab. 3). Väčšinou je zahájené od 18–25 rokov veku a obsahuje pravidelnú mamografiu, rontgen hrudníka, cytologické vyšetrenie krčka maternice (PAP test), abdominálnu ultrasonografiu, vaginálnu sonografiu, sonografiu semenníkov, vyšetrenie onkomarkerov Ca125, Ca 19-9. Niektoré kliniky v USA, ako i práca Canta et al z roku 2004, odporúčajú zahŕňať do dispenzarizačného programu endosonografiu pankreasu, počítačovú tomografiu alebo magnetickú rezonanciu abdomenu [1,51]. Podobne ako u Lynchovho syndrómu sa v rámci prevencie gynekologických malignít doporučuje ženám nad 35 rokov a po ukončení reprodukcie profylaktická hysterektómia a bilaterálna salpingooforektómia [52].
Tab. 3. Dispenzarizačný program pre pacientov s Peutz-Jeghersovým syndrómom (modifikované podľa odporúčaní Amos et al 2006 [32], Bordman et al 2002 [34], Kopáčová et al 2009 [45]). Tab. 3. Dispensary care program for patients with Peutz-Jeghers syndrome (modified as recommended by Amos et al [32], Bordman et al [34], Kopáčová et al [45]). ![Dispenzarizačný program pre pacientov s Peutz-Jeghersovým syndrómom (modifikované podľa odporúčaní Amos et al 2006 [32], Bordman et al 2002 [34], Kopáčová et al 2009 [45]).
Tab. 3. Dispensary care program for patients with Peutz-Jeghers syndrome (modified as recommended by Amos et al [32], Bordman et al [34], Kopáčová et al [45]).](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/bce36e3135a5a94aae9d22bb3317df29.jpeg)
1Skôr u symptomatických pacientov. 2V prípade prítomnosti polypov raz ročne, v prípade neprítomnosti predľženie intervalu. Do preventívneho programu pacientov s P-J syndrómom patrí aktívne vyhľadávanie rizikových príbuzných a genetické poradenstvo v postihnutej rodine vrátane genetického vyšetrenia všetkých príbuzných prvého stupňa a v prípade pozitivity mutácie STK 11 génu s odporúčaním ich zaradenia do preventívneho programu [32].
Chemoprevencia (chemoprofylaxia)
Podobne ako u familiárnej adenomatóznej polypózy, kde bol preukázaný efekt podávania inhibítorov cyklooxygenázy 2 (COX 2) na rast adenómov v oblasti kolorekta, je v súčasnosti skúmaná i otázka chemoprevencie u P-J syndrómu. Pôsobenie COX 2 inhibítorov, napr. Celekoxibu, bolo skúmané na experimentálnych modeloch, kde u LKB1 +/ - myší, ktorým podávali celekoxib, popisovali zníženú formáciu nových polypov, ako i rast starších. V ďalšej štúdii boli liečení šiesti pacienti s P-J syndrómom celekoxibom v dávke 2 × 200 mg denne. Po šiestich mesiacoch na kontrolnej gastroskopii u dvoch zo šiestich pacientov zachytili signifikantné zníženie počtu žalúdočných polypov [53–54]. Chemoprevencia COX 2 inhibítormi u P-J syndrómu však nie je zatiaľ všeobecne doporučovaná vzhľadom k absencii väčšieho množstva dát, ktoré by jednoznačne preukazovali ich pozitívny vplyv na klinické prejavy ochorenia a boli by nadradené nad endoskopickú liečbu a nežiadúce účinky COX 2 inhibítorov na kardiovaskulárny systém [55].
Od roku 2009 prebieha štúdia s liekom rapamycín (everolimus) patriaci medzi imunosupresíva. Cestou inhibície mTOR aktivity potláča neskoršiu fázu T bunkovej odpovede a zasahuje do procesov bunkového delenia a proliferácie. Zvýšená mTOR signalizácia je popisovaná u P-J syndrómu in vitro, taktiež experimentálne modely na P-J myšiach LKB1 +/ - podporujú významný vplyv rapamycínu na redukciu rastu hamartómov [56]. Liek je zatiaľ používaný v liečbe angiofibrómov a sarkómov u tuberóznej sklerózy [1].
Genotypovo fenotypové korelácie
V porovnaní s ostatnými hereditárnymi ochoreniami tráviaceho traktu je u P-J syndrómu zaujímavá vysoká variabilita fenotypového prejavu (nástup prvých príznakov, veľkost, počet a lokalizácia polypov, výskyt malignít v postihnutých rodinách). V niektorých rodinách sa ochorenie manifestuje typicky črevnou invagináciou už v rannom detstve. Nositelia mutácie jednej rodiny podstupujú častejšie polypektómie a reoperácie pre rýchly rast polypov ako iné rodiny, ktoré sú naopak zaťažené zvýšeným výskytom malignít. Objasnenie súvislostí medzi mutáciou génu STK 11/LKB1 a klinickými prejavmi ochorenia, a tým zlepšenie manažmentu pacientov s týmto syndrómom je veľkým záujmom genetického výskumu. Výsledky doposiaľ realizovaných štúdií sú však značne nesúrodé, čo je pravdepodobne spôsobené analýzou nízkeho počtu pacientov. Z väčších štúdií treba spomenúť prácu Schumachera z roku 2005, ktorej cieľom bolo nájsť vzťah medzi typom a lokalizáciou mutácie génu STK 11 a výskytom nádoru v rodine. Nositelia „truncation1“ mutácie, ktoré spôsobujú zastavenie čítacieho rámca a stratu funkčnosti proteinu a „missence2“ mutácie meniace zmysel kodónu, a tým i možnú zmenu v biologickej aktivite proteínu, mali častejší výskyt malignít ako nositelia „in-frame delécie3“ či „splice-site“ mutácie4 [57]. S vyšším nádorovým rizikom boli v tejto práci asociované „missence2“ mutácie vedúce k poškodeniu proteinu v mieste substrátovej väzbovej jednotky v porovnaní s „missence“ mutáciami postihujúcimi doménu zodpovednú za väzbu katalýzy a ATP. Amos v roce 2004 [8] dával „missence mutácie“ do súvislosti s neskorším nástupom ochorenia. V nedávnej štúdii Sallona s 31 pacientami sa nositelia truncating mutácie génu STK 11 vyznačovali väčším počtom polypov, chirurgickými intervenciami a výskytom karcinómov, preto na základe týchto výsledkov sa v práci odporúča zaradiť deti s preukázanými truncating mutáciami do dispenzarizačného programu už od ôsmeho roku života [58]. Naopak rozsiahlejšia Hearleho štúdia z roku 2006 nepotvrdila signifikantný vzťah typu a lokalizácie mutácií s nádorovým rizikom. Korelácia „truncating a notruncating“ mutácií s výskytom malignít bola na hranici štatistickej významnosti. Taktiež sa nepotvrdil signifikantný rozdiel vo výskyte malignít u pacientov s preukázanou mutáciou STK 11 génu a bez nej, ako i medzi familiárnym a sporadickým výskytom ochorenia [59–60].
Záver
Peutz-Jeghersov syndróm patrí medzi raritné dedičné ochorenia, kde napriek pomerne typickému klinickému priebehu je diagnostika ochorenia často podcenená a oneskorená. Skorou diagnostikou, dôslednou dispenzarizáciou a genetickým testovaním rizikových príbuzných tak môžeme zabrániť vzniku jeho závažných akútnych komplikácií, ako i rozvoju pokročilých foriem onkologických ochorení. Optimálna by bola preto koncentrácia týchto pacientov do špecializovaných centier so zabezpečením multidisciplinárneho prístupu, podobne ako je tomu vo vyspelých krajinách. V súčasnosti na našom pracovisku dispenzarizujeme viacerých pacientov s Peutz–Jeghersovým syndrómom s možnosťou ich komplexného vyšetrenia a v spolupráci s Odd. klinickej genetiky NOÚ, Klenova v Bratislave i s možnosťou genetickej analýzy na mutáciu STK 11 a genetické poradenstvo v postihnutej rodine.
Vysvetlenie pojmov molekulárnej genetiky
- 1. Truncating mutácie – vedúce k zmene čítacieho rámca, a tým ku skráteniu proteínu predčasným ukončením translácie. Sú to rozsiahle zmeny vedúce takmer vždy k syntéze nefunkčného proteínu. Sú to tieto mutácie:
- 1a. Nonsense mutácie – mutácie bez zmyslu – zmena kodónu pre niektorú aminokyselinu za STOP kodón (UAG, UAA alebo UGA) spôsobí predčasné ukončenie translácie na ribozóme.
- 1b. Frame-shift delécie – posunové delécie – sú špeciálnym typom mutácií, ktorých podstatou je inzercia alebo delécia takého počtu nukleotidov, ktorý nie je násobkom troch, vedúca k posunu čítania kodónov na ribozóme, následkom čoho nastáva zaradenie úplne odlišných aminokyselín od miesta mutácie.
- 2. Missense mutácie – meniace zmysel kodónu – dôsledkom je aminokyselinová zámena, ktorá niekedy môže spôsobiť zmenu v biologickej aktivite proteínu.
- 3. Delécie – vloženie alebo strata jedného alebo i rádovo miliónov nukleotidov v DNA. Dôsledky týchto mutácii závisia na počte a umiestení odstránených alebo včlenených nukleotidov, ale často môžu meniť biologickú aktivitu postihnutého proteínu.
- 4. Splice-site mutácie – sú mutácie v nekódujúcich sekvenciách priamo v zostrihovom mieste vedúce k nesprávnemu zostrihu DNA s patogénnym dopadom.
- 5. Sekvenčná analýza – metóda molekulárnej genetiky využívaná na zistenie presného poradia nukleotidov vo vyšetrovanom úseku DNA (sekvencie DNA), a tým i diagnostiku rôznych typov špecifických mutácií daného génu.
MUDr. Ema Kresanová
V. interná klinika LF UK a FNsP
Ružinovská 6, 820 26 Bratislava, SK
ema.kresanova@gmail.com
Zdroje
1. Douglas Riegert-Johnson DG, Westra WT, Hefferon LM et al. Peutz-Jeghers Syndrome. Familial Cancer Syndromes. 2009; Volume 1.
2. Peutz JLA. Very remarkable case of familial polyposis of mucous membrane of intestinal tract and nasopharynx accompanied by peculiar pigmentations of skin and mucous membrane. Nederl Maandschr Geneesk 1922; 10 : 134–146.
3. Touraine H. C.T. Syndrome de Peutz (lentigo-polypose digestive). Annales de dermatologie et de syphilographie. Paris 1945 [cited 5 313].
4. Jeghers H, McKusick KV, Katz KH. Generalized intestinal polyposis and melanin spots of the oral mucosa, lips and digits; a syndrome of diagnostic significance. N Engl Med 1949; 241(26): 1031–1036.
5. Hemminki A, Markie D, Tomlinson I et al. A serine/threonine kinase gene defective in Peutz-Jeghers syndrome. Nature 1998; 391(6663): 184–187.
6. Jenne DE, Reimann H, Nezu W et al. Peutz-Jeghers syndrome is caused by mutations in a novel serine threonine kinase. Nat Genet 1998; 18(1): 38–43.
7. Paroubek E. Familial occurrence of small intestine polyposis with pigmentation of lips (Peutz-Jeghers syndrome). Rozhl Chir 1958; 37(2): 118–129.
8. Amos CI, Keitheri-Cheteri MB, Sabripour M et al. Genotype-phenotype correlations in Peutz-Jeghers syndrome. J Med Genet 2004; 41(5): 327–333.
9. Hinds R, Philp C, Hyer W et al. Complications of childhood Peutz-Jeghers syndrome: implications for pediatric screening. J Pediatr Gastroenterol Nutr 2004; 39(2): 219–220.
10. Young RH, Scully RE. Ovarian sex cord-stromal tumors: recent progress. Int Gynecol Pathol 1982; 1(1): 101–123.
11. Ulbright TM, Amin MB, Young RH. Intratubular large cell hyalinizing sertoli cell neoplasia of the testis: a report of 8 cases of a distinctive lesion of the Peutz-Jeghers syndrome. Am J Surg Pathol 2007; 31(6): 827–835.
12. Rodu B, Martinez MG Jr. Peutz-Jeghers syndrome and cancer. Oral Surg Oral Med Oral Pathol 1984; 58(5): 584–588.
13. Yamada K, Matsukawa A, Hori Y et al. Ultrastructural studies on pigmented macules of Peutz-Jeghers syndrome. J Dermatol 1981; 8(5): 367–377.
14. Nakayama H, Fujii M, Kimura A et al. A solitary Peutz-Jeghers-type hamartomatous polyp of the rectum: report of a case and review of the literature. Jpn J Clin Oncol 1996; 26(4): 273–276.
15. Suzuki S, Hirasaki S, Ikeda F et al. Three cases of Solitary Peutz-Jeghers-type hamartomatous polyp in the duodenum. World J Gastroenterol 2008; 14(6): 944–947.
16. Jancu J. Peutz-Jeghers syndrome. Involvement of the gastrointestinal and upper respiratory tracts. Am Gastroenterol 1971; 56(6): 545–549.
17. Sommerhaug RG, Mason T. Peutz-Jeghers syndrome and ureteral polyposis. JAMA 1970; 211(1): 120–122.
18. Wada K, Tanaka M, Yamaguchi K. Carcinoma and polyps of the gallbladder associated with Peutz-Jeghers syndrome. Dig Dis Sci 1987; 32(8): 943–946.
19. Petersen VC, Sheehan AL, Bryan RL et al. Misplacement of dysplastic epithelium in Peutz-Jeghers Polyps: the ultimate diagnostic pitfall? Am J Surg Pathol 2000; 24(1): 34–39.
20. Bolwell JS, James PD. Peutz-Jeghers syndrome with pseudoinvasion of hamartomatous polyps and multiple epithelial neoplasms. Histopathology 1979; 3(1): 39–50.
21. Ichiyoshi Y, Yao T, Nagasaki S et al. Solitary Peutz-Jeghers type polyp of the duodenum containing a focus of adenocarcinoma. Ital J Gastroenterol 1996; 28(2): 95–97.
22. Giardiello FM, Trimbath D. Peutz-Jeghers syndrome and management recommendations. Clin Gastroenterol Hepatol 2006; 4(4): 408–415.
23. Bartosova Z, Zavodna K, Krivulcik T et al. STK11/LKB1 germline mutations in the first Peutz-Jeghers syndrome patients identified in Slovakia. Neoplasma 2007; 54(2): 101–107.
24. Ušák J, Kružliak T, Ušáková V et al. Peutz - Jeghersov syndróm (PJS) – ochorenie geneticky diagnostikované na prelome 21. storočia. Interná med 2006; 6(11): 627–630.
25. Hernan I, Roig I, Martin B et al. De novo germline mutation in the serine-threonine kinase STK11/LKB1 gene associated with Peutz-Jeghers syndrome. Clin Genet 2004; 66(1): 58–62.
26. Forcet C, Etienne-Manneville S, Gaude H et al. Functional analysis of Peutz-Jeghers mutations reveals that the LKB1 C-terminal region exerts a crucial role in regulating both the AMPK pathway and the cell polarity. Hum Mol Genet 2005; 14(10): 1283–1292.
27. Karuman P, Gozani O, Odze RD et al. The Peutz-Jegher gene product LKB1 is a mediator of p53-dependent cell death. Mol Cell 2001; 7(6): 1307–1319.
28. Tiainen M, Vaahtomeri K, Ylikorkala A et al. Growth arrest by the LKB1 tumor suppressor: induction of p21(WAF1/CIP1). Hum Mol Genet 2002; 11(13): 1497–1504.
29. Aretz S, Stienen D, Uhlhaas S et al. High proportion of large genomic STK11 deletions in Peutz-Jeghers syndrome. Hum Mutat 2005; 26(6): 513–519.
30. Vasovcak P, Krepelova A, Puchmajerova A et al. A novel mutation of PTEN gene in a patient with Cowden syndrome with excessive papillomatosis of the lips, discrete cutaneous lesions, and gastrointestinal polyposis. Eur J Gastroenterol Hepatol 2007; 19(6): 513–517.
31. Puchmajerova A, Vasovcak P, Krepelova A et al. Cowden syndrome. Klin Onkol 2009; 22 Suppl: S56–57.
32. McGarrity TJ, Ward MG, Howett MK. Peutz-Jeghers syndrom. GeneReviews, PUBMed, 2007/5.
33. Finan MC, Ray MK. Gastrointestinal polyposis syndromes. Dermatol Clin 1989; 7(3): 419–434.
34. Boardman LA, Thibodeau SN, Schaid DJ et al. Increased risk for cancer in patients with the Peutz-Jeghers syndrome. Ann Intern Med 1998; 128(11): 896–899.
35. McGarrity T, Amos C. Peutz-Jeghers syndrome: clinicopathology and molecular alterations. Cell Mol Life Sci 2006; 63(18): 2135–2144.
36. Lim W, Olschwang S, Keller JJ et al. Relative frequency and morphology of cancers in STK11 mutation carriers. Gastroenterology 2004; 126(7): 1788–1794.
37. Lim W, Hearle N, Shah B et al. Further observations on LKB1/STK11 status and cancer risk in Peutz-Jeghers syndrome. Br J Cancer 2003; 89(2): 308–313.
38. Hearle N, Schumacher V, Menko FH et al. Frequency and spectrum of cancers in the Peutz-Jeghers syndrome. Clin Cancer Res 2006; 12(10): 3209–3215.
39. Fujiwaki R, Takahashi K, Kitao M. Adenoma malignum of the uterine cervix associated with Peutz-Jeghers syndrome: Int J Gynaecol Obstet 1996; 53(2): 171–172.
40. Tsuruchi N, Tsukamoto N, Kaku T et al. Adenoma malignum of the uterine cervix detected by imaging methods in a patient with Peutz-Jeghers syndrome. Gynecol Oncol 1994; 54(2): 232–236.
41. Dunlop MG. Guidance on gastrointestinal surveillance for hereditary non-polyposis colorectal cancer, familial adenomatous polypolis, juvenile polyposis, and Peutz-Jeghers syndrome. Gut 2002; 51 Suppl 5: V21–27.
42. Bourke B, Broderick A, Bohane T. Peutz-Jeghers syndrome and management recommendations. Clin Gastroenterol Hepatol 2006; 4(12): 1550; author reply 1550.
43. Puchmajerova A, Vasovak P, Krepelova A. Peutz-Jeghers syndrome. Klin Onkol 2009; 22 Suppl: S36–37.
44. Caspari R, von Falkenhausen M, Krautmacher C et al. Comparison of capsule endoscopy and magnetic resonance imaging for the detection of polyps of the small intestine in patients with familial adenomatous polyposis or with Peutz-Jeghers‘ syndrome. Endoscopy 2004; 36(12): 1054–1059.
45. Kopacova M, Tacheci I, Rejchrt S et al. Peutz-Jeghers syndrome: diagnostic and therapeutic approach. World J Gastroenterol 2009; 15(43): 5397–5408.
46. Kopacova M, Bures A, Ferko I et al. Comparison of intraoperative enteroscopy and double-balloon enteroscopy for the diagnosis and treatment of Peutz-Jeghers syndrome. Surg Endosc 2010 Jan 28.
47. Sunada K, Yamamoto H. Double-balloon endoscopy: past, present, and future. J Gastroenterol 2009; 44(1): 1–12.
48. Mensink PB, Haringsma T, Kucharzik C et al. Complications of double balloon enteroscopy: a multicenter survey. Endoscopy 2007; 39(7): 613–615.
49. Oncel M, Remzi FH, Church JM et al. Benefits of ‚clean sweep‘ in Peutz-Jeghers patients. Colorectal Dis 2004; 6(5): 332–335.
50. Giardiello FM, Trimbath JD. Peutz-Jeghers syndrome and management recommendations. Clin Gastroenterol Hepatol 2006; 4(4): 408–415.
51. Canto MI. Strategies for screening for pancreatic adenocarcinoma in high-risk patients. Semin Oncol 2007; 34(4): 295–302.
52. Schmeler KM, Lynch HT, Chen LM et al. Prophylactic surgery to reduce the risk of gynecologic cancers in the Lynch syndrome. N J Engl Med 2006; 354(3): 261–269.
53. McGarrity TJ, Peiffer LP, Amos CI et al. Overexpression of cyclooxygenase 2 in hamartomatous polyps of Peutz-Jeghers syndrome. Am J Gastroenterol 2003; 98(3): 671–678.
54. Udd L, Katajisto P, Rossi D et al. Suppression of Peutz-Jeghers polyposis by inhibition of cyclooxygenase-2. Gastroenterology 2004; 127(4): 1030–1037.
55. Solomon SD, McMurray JJ, Pfeffer MA et al. Cardiovascular risk associated with celecoxib in a clinical trial for colorectal adenoma prevention. N Engl J Med 2005; 352(11): 1071–1080.
56. Wei C, Amos CI, Zhang N et al. Suppression of Peutz-Jeghers polyposis by targeting mammalian target of rapamycin signaling. Clin Cancer Res 2008; 14(4): 1167–1171.
57. Schumacher V, Vogel T, Leube B et al. STK11 genotyping and cancer risk in Peutz-Jeghers syndrome. J Med Genet 2005; 42(5): 428–435.
58. Salloch H, Reinacher-Schick A, Schulmann K et al. Truncating mutations in Peutz-Jeghers syndrome are associated with more polyps, surgical interventions and cancers. Int J Colorectal Dis 2010; 25(1): p. 97-107.
59. Hearle N, Schumacher V, Menko FH et al. Frequency and spectrum of cancers in the Peutz-Jeghers syndrome. Clin Cancer Res 2006; 12(10): 3209–3215.
60. Mehenni H, Resta N, Guanti G et al. Molecular and clinical characteristics in 46 families affected with Peutz-Jeghers syndrome. Dig Dis Sci 2007; 52(8): 1924–1933.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2010 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Diagnostika a liečba pacientov s Peutz-Jeghersovým syndrómom
- Výsledky prospektívneho sledovania slizničných zmien v tenkom čreve kapsulovou enteroskopiou u pacientov s Crohnovou chorobou liečených biologickou liečbou
- 5. ECCO kongres, Kongresové centrum v Praze, 25.–27. 2. 2010
- Hepatologický dodatek ke článku: Doporučení pro vakcinaci a profylaxi infekčních chorob u nemocných s Crohnovou chorobou a ulcerózní kolitidou léčených imunosupresivy a biologickou léčbou (Česká a slovenská gastroenterologie a hepatologie 2010; 64(1): 40–
- Redukce příjmu kuchyňské soli ve stravě – účinný a levný prostředek ke zlepšení zdraví a prodloužení věku
-
Ctirad John. Zrcadlo mých lásek aneb vzpomínky.
Vyvolal a sestavil František Houdek. Praha: Galén 2009. 334 stran. - Za docentem MUDr. Jaroslavem Šetkou, CSc. (20. 8. 1925–10. 11. 2009)
- Za prof. MUDr. Zdeňkem Mařatkou, DrSc.(27. 6. 1914–24. 3. 2010)
- Zřízení nové sekce IBD v našem časopise
- Ohlédnutí za IV. kongresem ČGS
- Standardy – jak dále? (Projekt Mzd ČR)
- Mycobacterium avium subsp. paratuberculosis, etiologický faktor u Crohnovy choroby?
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Diagnostika a liečba pacientov s Peutz-Jeghersovým syndrómom
- Mycobacterium avium subsp. paratuberculosis, etiologický faktor u Crohnovy choroby?
- Za docentem MUDr. Jaroslavem Šetkou, CSc. (20. 8. 1925–10. 11. 2009)
- Výsledky prospektívneho sledovania slizničných zmien v tenkom čreve kapsulovou enteroskopiou u pacientov s Crohnovou chorobou liečených biologickou liečbou
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



