-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Sérové hladiny infliximabu a protilátok proti infliximabu, prínos pre prax
Serum levels of infliximab and antibodies to infliximab, clinical using
Timely diagnosing, precise treatment and the individual approach are needed for complex management of patients with inflammatory bowel diseases. The goal of the complex and individual approach is to achieve and maintain the remission and to minimize the complications. Tumor necrosis factor alpha (TNF-α) is the key cytokine of the chronic bowel inflammation. Infliximab is the longest used biologic compound. Infliximab reduces TNF-α levels, regulates inflammation and induces remission. Monitoring of the infliximab levels and antibodies to infliximab can contribute to optimalization of the biological therapy and tailoring to individual cases. Loss of response can be also caused by undetectable levels or positive antibodies to infiximab.
Key words:
infliximab – Crohn’s disease – ulcerative colitis – pharmacokinetics
Autoři: L. Gombošová 1; M. Zakuciová 1; E. Barlová 2; L. Novotná 2; E. Veseliny 1
Působiště autorů: I. interná klinika, LF UPJŠ a UNLP Košice, 2Oddelenie laboratórnej medicíny, lekárska imunológia, UNLP Košice 1
Vyšlo v časopise: Gastroent Hepatol 2012; 66(1): 32-36
Kategorie: IBD: přehledová práce
Souhrn
V rámci komplexného manažmentu pacienta s chronickými črevnými zápalmi je nutná včasná diagnostika, dôkladná liečba a individuálny prístup. Cieľom komplexného a individuálneho prístupu je dosiahnutie a udržanie remisie, minimalizovanie komplikácií. Tumor necrosis faktor alfa (TNF-α) je kľúčový cytokín chronických črevných zápalov. Najdlhšie používaným biologikom je infliximab, ktorý redukuje TNF-α hladiny, reguluje zápal a navodzuje remisiu choroby. Monitorovanie hladín infliximabu a protilátok proti infliximabu môže prispieť k optimalizácii biologickej liečby a ušitia liečby na mieru. Strata odpovede na liečbu môže byť spôsobená nedostatočnými hladinami alebo pozitívnymi protilátkami proti infliximabu.
Kľúčové slová:
infliximab – Crohnova choroba – ulcerózna kolitída – farmakokinetikaCrohnova choroba (CD) a ulcerózna kolitída (UC) patria medzi imunitne mediované zápalové choroby. Ich etiopatogenéza spočíva v prelínaní genetických, imunitných a environmentálnych faktorov s významným podielom črevnej baktériovej flóry. Kľúčové postavenie v kaskáde množstva cytokínov má „tumor necrosis factor alfa (TNF-α)“, ktorého minimalizácia tvorby a vyblokovanie jeho účinkov je cieľom biologickej liečby. TNF-α blokátor infliximab (IFX) patrí do armamentária biologickej liečby u pacientov s nedostatočnou efektivitou konvenčnej terapie. Je určený na liečbu stredne ťažkej a ťažkej formy CD a UC. Dlhoročné skúsenosti potvrdzujú efekt antiTNF-α liečby s minimalizáciou zápalu, navodením remisie a slizničného hojenia. Liečba infliximabom môže byť spojená s tvorbou protilátok proti infliximabu ATI (antibodies to infliximab), ktoré môžu znížiť efektivitu liečby. Monitorovanie hladín infliximabu a protilátok môže prispieť k optimalizácii liečby a vysvetleniu straty odpovede na liečbu. Na základe monitorovania hladín IFX a ATI je možné upraviť dávky lieku, alebo meniť režimy podávania.
Strata odpovede na biologickú liečbu
Monitorovanie hladín IFX a ATI môže parciálne prispieť k ozrejmeniu straty odpovede na liečbu. Definície straty odpovede (loss of response) sú nejednotné. Je nutné rozlišovať zhoršenie klinického stavu v širšom ponímaní a pravú stratu odpovede na antiTNF-α liečbu. ECCO definuje stratu odpovede ako znovuobjavenie sa symptómov, vzostup napr. CDAI indexu o 70 bodov, nutnosť ukončenia liečby či eskalácie dávky alebo chirurgické riešenie. Celkovo 2–40 % pacientov stratí odpoveď na liečbu, ročne je to asi 13 % pacientov [1]. Primárny nonresponder je pacient, u ktorého nie je prítomná žiadna odpoveď na konci indukčnej liečby. Sekundárny nonresponder stráca odpoveď na liečbu po predošlej dobrej odpovedi. U sekundárneho nonrespondera máme možnosť zmeny liečebnej stratégie so 40–60% úspešnosťou [2]. Existujú neimunologické a imunologické faktory spojené so stratou odpovede. Medzi neimunologické faktory patria komplikácie choroby, interkurentné infekcie, fajčenie pri Crohnovej chorobe, stres, interakcia lieku s inými liekmi. Imunologické faktory sú: vysoká aktivita choroby s mohutnou tvorbou TNF-α, tvorba protilátok proti biologiku, paradoxná exacerbácia autoimunitnej choroby počas biologickej liečby, shift z TNF-α na iné mediátory zápalu v rámci chronickej choroby, tvorba autoprotilátok a agregácia s reumatoidným faktorom [3].
Infliximab, farmakokinetika a farmakodynamika
Infliximab (IFX) je chimérická monoklonálna protilátka IgG1 proti TNF-α, má vysokú molekulovú hmotnosť 149,1 kD. Skladá sa z myšej variabilnej časti (25 %) a zo stabilnej humánnej časti (75 %), ktoré sú spojené disulfidovými väzbami. Distribučný objem lieku je malý, predstavuje ho len intravaskulárny priestor (3–6 l), eliminačný polčas je 7–12 hod a čas zotrvania v obehu je 12–17 dní [5]. Systémový klírens je veľmi nízky, okolo 11–15 ml/hod. IFX je eliminovaný z organizmu po degradácii rôznymi nešpecifickými endogénnymi proteázami. Eliminácia závisí od funkcie pečene, obličiek a monocyto-makrofágového systému [1,3].
IFX s vysokou afinitou viaže solubilný aj membránový TNF-α. Následne dochádza k downregulácii lokálnych aj systémových prozápalových cytokínov, zníženej migrácii leukocytov a lymfocytov do miesta zápalu. IFX indukuje apoptózu aktivovaných monocytov a T-lymfocytov, zvyšuje hladiny inhibítora nukleárneho faktora κβ, redukuje expresiu endotelových adhéznych molekúl a znižuje hladiny proteínov akútnej fázy. Malíčková et al sledovali vplyv albuminémie na farmakokinetiku infliximabu u pacientov s črevnými zápalmi. Zistili štatisticky významnú pozitívnu koreláciu sérových hladín IFX a albumínu. V priebehu biologickej liečby IFX stúpajú hladiny lieku a dochádza k nárastu hladín albumínu, čo súvisí s jej efektivitou. Pri nižších hladinách albumínu dochádza k rýchlejšej degradácii IFX, distribúcii v kompartmentoch alebo stratám do tretích priestorov. Významnú úlohu majú scavenger receptory, ktoré vychytávajú proteíny určené na degradáciu v bunkách retikuloendotelového systému [6].
V praxi sa používajú indukčné a udržiavacie režimy IFX (Remicade). Bežná dávka IFX je 5 mg/kg hmotnosti. Liek je podávaný v infúzii fyziologického roztoku. Indukčný režim podávania je 0. – 2. – 6. týždeň. Udržiavací režim je 5 mg/kg v infúzii každých 8 týždňov. Pacienti s CD odpovedajú na liečbu v zmysle zlepšenia alebo navodenia remisie v 39–45 % v 54. týždni liečby podľa štúdie ACCENT I. Pri fistulujúcich formách je kompletná absencia fistúl v 36 % 54. týždeň liečby (ACCENT II). U pacientov s UC je klinická odpoveď v 69 % v 8. týždni liečby a 45 % v 54. týždni liečby (ACT I). Približne 20 % pacientov dosiahne trvalú klinickú remisiu. Pri strate odpovede je možné eskalovať dávku na 10 mg/kg, alebo skrátiť intervaly podávania na každých 4 alebo 6 týždňov. Nástup a trvanie klinickej odpovede môže byť ovplyvnené mnohými faktormi, ale môže súvisieť aj s perzistenciou cirkulujúceho IFX v krvnom obehu [1].
Protilátky proti infliximabu
Pri dlhšom podávaní a hlavne pri epizodickom podávaní IFX môže organizmus tvoriť ATI. Väčšinou ide o protilátky typu IgG1, v menšej miere a pri opakovaných podaniach sa tvoria protilátky IgG4. Protilátky sa tvoria proti Fab aj proti Fc fragmentu monoklonovej protilátky. Tvorba protilátok môže mať za následok včasnú alergickú reakciu, nejedná sa však o IgE mediovanú reakciu, ako by sa predpokladalo [7]. Môže vzniknúť aj reakcia typu sérovej choroby, ktorá znižuje efektivitu lieku. ATI zvyšujú klírens lieku, podieľajú sa na formovaní imunokomplexov. Protilátky tvoriace sa proti Fab fragmentu majú za následok imunogenicitu lieku. Fc fragment monoklonovej protilátky môže indukovať tvorbu allotypových protilátok [8,9].
Hladiny IFX a protilátok
Existuje málo štúdií, ktoré by sledovali hladiny IFX a hladiny protilátok proti IFX. Zatiaľ neexistujú jednoznačné usmernenia týkajúce sa sledovania hladín IFX či ATI. K dispozícii sú výsledky prác špecializovaných pracovísk, ich skúsenosti, či metaanalýzy. Po podaní infúzie s infliximabom sú priemerné peak hladiny okolo 18 ug/ml, môžu byť však oveľa vyššie. Vo farmakokinetike IFX existujú veľké interindividuálne rozdiely. V klinickej praxi sa monitorujú udržiavacie alebo najnižšie hladiny lieku vyšetrované tesne pred podaním ďalšej infúzie. Sú to tzv. „trough levels“. Hladiny lieku a protilátok sa bežne vyšetrujú ELISA metódou, ktorá je však menej senzitívna ako RIA metóda. ELISA kity sú komerčne dostupné. Pri vyšetrovaní ELISA metódou môže byť niekedy výsledok falošne pozitívny, ale aj falošne negatívny. Falošne negatívny výsledok môže byť pri tvorbe IgG4 protilátok proti IFX, čo je spôsobené nižšou senzitivitou metodiky oproti RIA metodike. Falošná negativita môže byť aj pri interferencii ATI s IFX, pri strate epitopov na lieku (epitop alebo antigénny determinant je oblasť antigénu, na ktorú sa viažu protilátky), pri tzv. „matrix efekte“ v rámci ELISA metodiky (blokuje sa interakcia antigénu a protilátky) [10]. Falošná pozitivita môže byť pri formovaní neoepitopov na lieku, pri agregácii lieku, v prítomnosti reumatoidného faktora (viaže sa na Fc fragment infliximabu) alebo pri naviazaní aktivovaného komplementu na Fc fragment. Aj v prítomnosti vyššieho titra heterofilných protilátok môže byť falošná pozitivita ATI (heterofilné protilátky sú nešpecifické protilátky tvorené B-lymfocytmi napr. po vakcinácii, pri užívaní onkologických liekov či antiTNF blokátorov, pri autoimunitných chorobách, po podaní kontrastnej látky atď. [11,12].
Pri monitorovaní hladín IFX je nutné vedieť, že môžu byť prítomné veľmi nízke až nedetekovateľné hladiny pri negatívnych hladinách protilátok ATI. Môže to spôsobiť vysoká tvorba TNF počas zápalu a vyviazanie celého podaného množstva IFX, alebo tzv. „fenomén okna“ (window phenomenon), keď všetky protilátky ATI vyviaže podaný IFX a tie sú tým pádom negatívne, nedetekovateľné [8]. Monitorovanie hladín IFX a ATI je možné v praxi využiť pri strate odpovede na liečbu, pri vzniku alergickej reakcie. Hladiny je možné využiť v predikcii efektivity lieku. Škandinávski autori prezentovali svoje výsledky výskumu pri sledovaní najnižších hraničných hodnôt, kedy je ešte liečba antiTNF-α efektívna. Zistili, že hladiny IFX nad 0,5 ug/ml a hladiny ATI do 10 U/ml sú efektívne (senzitivita 81 %, špecificita 94 %). Hladiny IFX > 0,5 mg/ml v porovnaní s nedetekovateľnými sú spojené so signifikantne vyššou klinickou remisiou (69 vs 28 %; p < 0,01). Efektivita lieku významne klesá pri poklese hladiny IFX pod 1 ug/ml [13]. Je potrebných viacero štúdií a dát, ktoré by spresnili úlohu a význam monitorovania hladín antiTNF liekov a ich protilátok v manažmente jednotlivých pacientov. Často je citovaná práca amerických autorov z Mayo Clinic, poukazujúca na význam merania hladín IFX a ATI. V kohorte 155 pacientov s IBD demonštrujú 92 % liečebnú odpoveď pri zmene liečby na iný antiTNF liek pri pozitivite ATI. U pacientov s nízkou hladinou IFX eskalovali dávku s 86% zlepšením a odpoveďou na liečbu. Pacienti s dobrou hladinou IFX pokračovali v liečbe ďalej so 70% zlepšením a odpoveďou na liečbu [4].
Naše skúsenosti s monitorovaním hladín IFX a ATI
V našom centre pre biologickú liečbu sme zisťovali priemerné hladiny IFX a prítomnosť protilátok ATI vo vzťahu k remisii a strate odpovede na liečbu. Vyšetrili sme hladiny IFX a ATI u 36 pacientov s CD a 40 pacientov s UC. Všetci pacienti mali úvodne indukčný režim podávania 5 mg/kg 0. – 2. – 6. týždeň s pokračovaním v udržiavacom režime 5 mg/kg každých 8 týždňov. Krvné vzorky boli odoberané až po ukončení indukčného režimu, t. j. pred prvým podaním udržiavacieho režimu a neskôr. Hladiny IFX a ATI boli vyšetrované štandardizovanou súpravou Q-INFLIXI a Q-ATI Matriks Biotek ELISA.
V skupine s CD bol priemerný vek 34,4 roka a priemerný počet podaní infúzií IFX bol 9. Klinická a laboratórna remisia bola pozorovaná u 81 % pacientov, z toho slizničné hojenie u 24 %. 19 % pacientov malo chronickú aktivitu. V skupine s UC bol priemerný vek 41 rokov, priemerný počet podaní bol 8. 71 % pacientov bolo v klinickej a laboratórnej remisii, z toho 12 % pacientov malo slizničné hojenie. 29 % pacientov malo chronickú aktivitu. 14 pacientov s CD mali perianálnu fistulujúcu formu, počas liečby došlo k 50% uzavretiu fistúl (1 pacient mal skrátené intervaly na každé 4 týždne, 1 pacient mal dávku 10 mg/kg).
Zistili sme, že priemerné hladiny IFX v skupine s CD boli 2,8 ug/ml. Priemerné hladiny IFX v skupine s UC boli 2,17 ug/ml. Žiaden pacient nemal hladiny pod 0,5 ug/ml. Pozitívne ATI malo 7 pacientov z každej vyšetrovanej skupiny. Priemerné hodnoty protilátok boli 122 U/ml v skupine s CD a 21,2 U/ml v skupine s UC. 4 pacienti z každej skupiny mali v liečbe aj azatioprin. 5 pacientov s CD s pozitívnymi ATI malo chronickú aktivitu choroby, 2 pacienti dosiahli klinickú a laboratórnu remisiu aj napriek pozitívnym protilátkam. U 3 pacientov s CD (z toho u dvoch fistulujúca forma) sme eskalovali dávku s dobrou klinickou a laboratórnou odpoveďou. 10 pacientov s UC nereagovalo na liečbu, z toho 7 malo pozitívne ATI. 2 pacienti boli definitívne riešení pankolektómiou s vytvorením pouchu. U 2 pacientov sme eskalovali dávku, avšak bez klinického efektu. Závažnú alergickú reakciu sme zaznamenali u 2 pacientov (1 s CD a 1 s UC). Z toho 1 pacient (UC) mal vysoko pozitívne ATI. 2 pacienti mali psoriatiformnú kožnú reakciu, ATI mali negatívne.
Žiaden pacient nemal nedetekovateľné hladiny IFX. Zistili sme, že aj pri tzv. detekovateľných hladinách 0,5–0,6 ug/ml je možné dosiahnuť laboratórny, klinický aj morfologický efekt liečby IFX. Prehľad výsledkov viď aj v tab. 1–3 a v grafe 1.
Tab. 1. Demografické údaje a rozdelenie podľa aktivity choroby. Tab. 1. Demographic datas and dividing by disease activity. 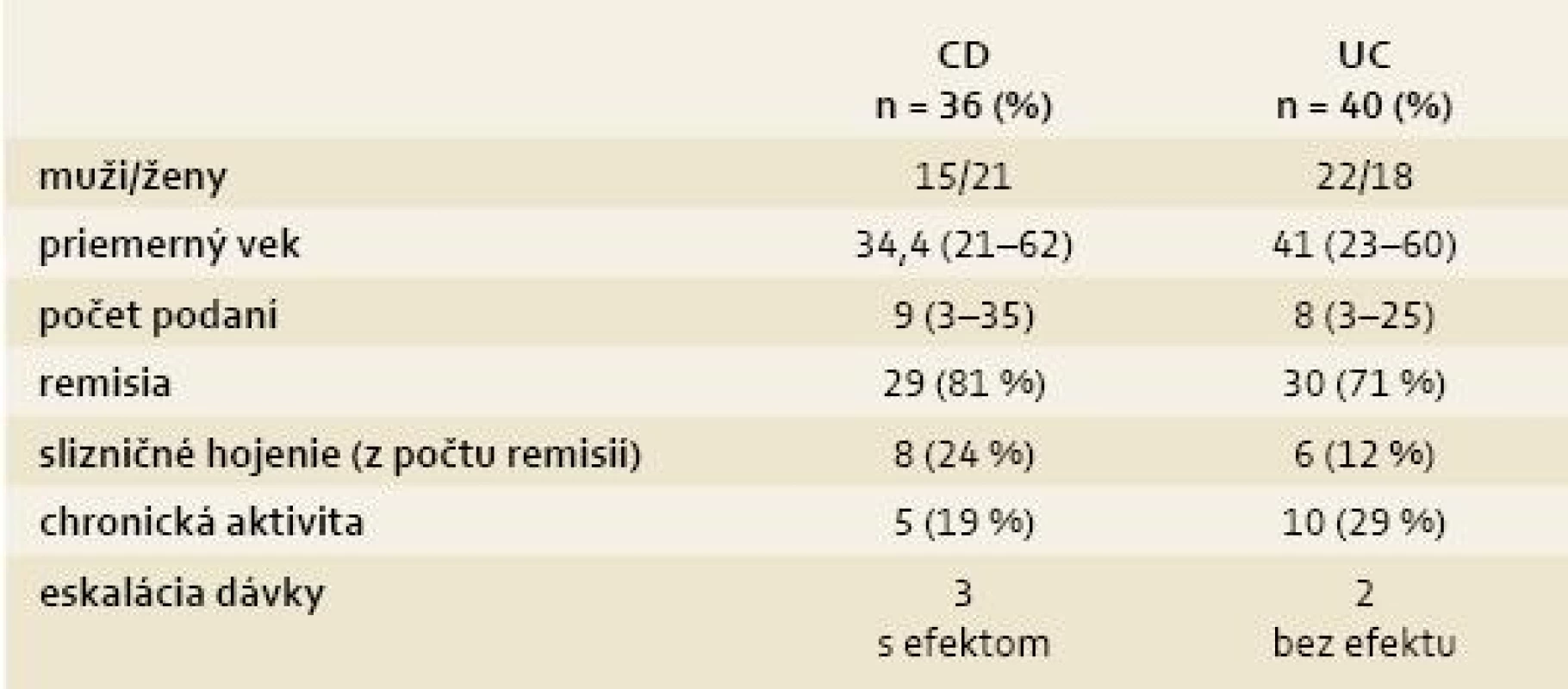
Tab. 2. Rozsah postihnutia ochorenia v jednotlivých skupinách liečených infliximabom. Tab. 2. Extent of disease affect in separate groups treated with infliximab. 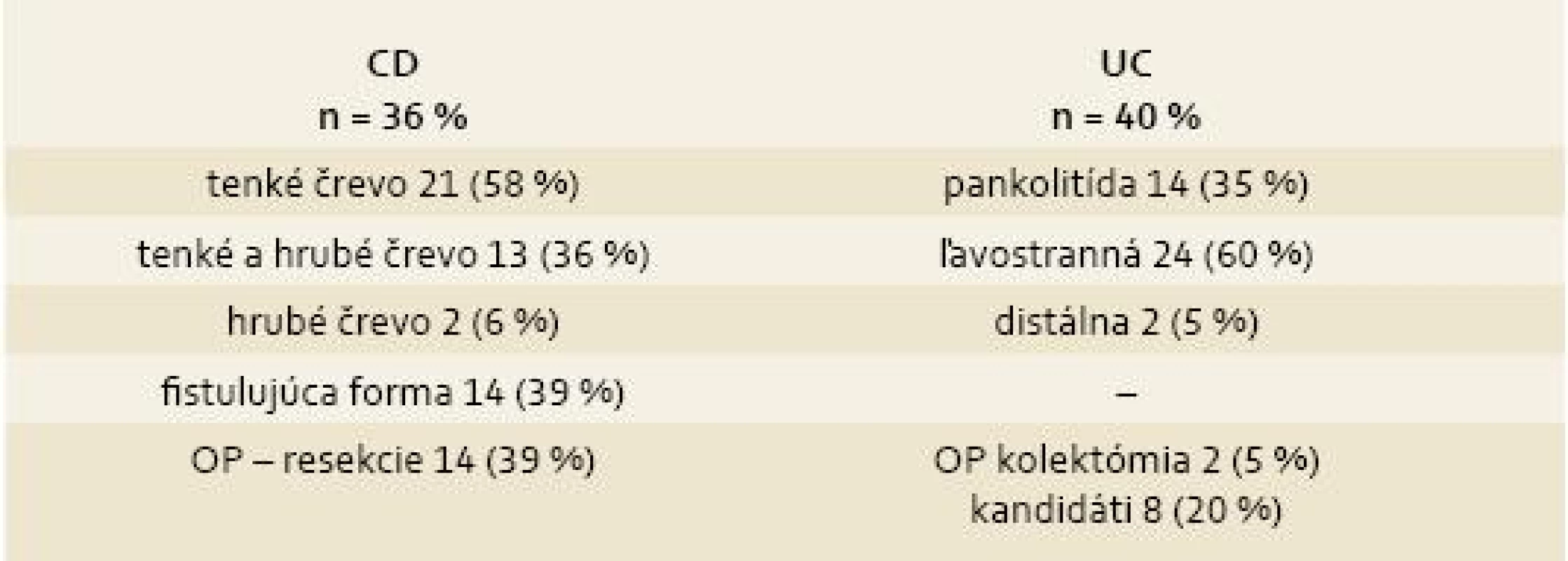
Tab. 3. Priemerné hladiny infliximabu a protilátok ATI v jednotlivých skupinách. Tab. 3. Average levels of infliximab and antibodies to infliximab in separate groups. 
Graf 1. Rozloženie hodnôt infliximabu v sledovaných skupinách. Graph 1. Spread of infliximab levels in followed groups. 
Záver
Biologická liečba predstavuje významný pokrok v liečbe chronických črevných zápalov. Neustále objavovanie novších mechanizmov etiopatogenézy prispieva k zdokonaľovaniu manažmentu a liečby pacientov s možnosťou individuálneho prístupu. Kľúčovým cytokínom v zápalovej kaskáde IBD je TNF-α, ktorý je cieľom biologickej liečby. Najdlhšie a najväčšie skúsenosti sú s antiTNF blokátorom infliximabom, ktorý sa v liečebnej praxi používa od roku 1999. V posledných rokoch je možnosť monitorovania hladín IFX a ATI, ktoré prispievajú k individualizácii prístupu k pacientovi a možnosti „ušitia liečby na mieru“. V oblasti monitorovania hladín IFX, farmakokinetiky a farmakodynamiky je ešte mnoho nejasností. Pri hodnotení hladín IFX aj ATI je nutné brať do úvahy veľké inter-, ale aj intraindividuálne rozdiely, falošnú pozitivitu aj falošnú negativitu výsledkov. Neexistujú veľké štúdie, ale skúsenosti z renomovaných pracovísk a metaanalýzy rôznych reportov dokladujú prínos sledovania hladín. Na základe zistených hladín či prítomnosti protilátok je možné upraviť liečbu v zmysle eskalácie dávky či skrátenia intervalu, je možné meniť jednu antiTNF modalitu za inú a je možné opodstatnene pokračovať v liečbe, eventuálne ju ukončiť. Ak má pacient počas biologickej liečby závažnú alergickú reakciu, je možné ďalšie rozhodovanie podporiť výsledkami monitorovania IFX či ATI. Mnohí autori sledovaním a vlastnými štúdiami určili hraničné, event. najnižšie hodnoty IFX, pri ktorých je ešte liečba efektívna. Sú to tzv. detekovateľné hladiny, ktoré by nemali klesnúť pod 0,5 ug/ml. Aj pri pozitivite ATI boli odhadnuté hladiny, kedy ATI do 10 U/ml neovplyvňuje efektivitu liečby. Daná oblasť liečby chronických črevných zápalov vyžaduje väčšie, presne dizajnované štúdie, aby bolo možné postupovať na základe dôkazov a národných odporučení. Aj každodenná klinická prax v nemalej miere overuje mnohé teoretické predpoklady a úvahy.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Doručeno/Submitted: 19. 1. 2012
Přijato/Accepted: 11. 2. 2012
MUDr. Laura Gombošová, PhD.
I. interná klinika, Univerzitná
nemocnica L. Pasteura
Tr. SNP č. 1
040 01 Košice
lauragombosova@yahoo.com
Zdroje
1. Miheller P, Kiss SL, Lorinczy K et al. Anti-TNF trough levels and detection of antibodies to anti-TNF in inflammatory bowel disease: are they ready for everyday clinical use? Expert Opin Biol Ther 2012; 12(2): 179–192.
2. Ben-Horin S, Chowers Y. Review article: loss of response to anti-TNF treatments in Crohn’s disease. Alimetn Pharmacol Ther 2011; 33(9): 987–995.
3. Danese S, Fiorino G, Reinisch W et al. Review article: causative factors and the clinical management of patients with Crohn’s disease who lose response to anti-TNF-α therapy. Aliment Pharmacol Ther 2011; 34(1): 1–10.
4. Afif W, Loftus EV, Faubion WA et al. Clinical Utility of Measuring Infliximab and Human Anti-Chimeric Antibody Concentrations in Patients With Inflammatory Bowel Disease. Am J Gastroenterol 2010; 105(5): 1133–1139.
5. Klotz U, Teml A, Schwab M. Clinical Pharmacokinetics and Use of Infliximab. Clin Pharmacokinet 2007; 46(8): 645–660.
6. Malíčková K, Bortlík M, Ďuricová D et al. Vliv albuminemie na farmakokinetiku infliximabu u nemocných s idiopatickými střevními záněty. Gastroent Hepatol 2011; 65(2): 70–74.
7. Steenholdt C, Svenson M, Bendtzen K et al. Acute and delayed hypersensitivity reactions to infliximab and adalimumab in a patient with Crohn's disease. JCC 2012; 6(1): 108–111.
8. Steenholdt C, Svenson M, Bendtzen K et al. Severe infusion reactions to infliximab: aetiology, immunogenicity and risk factors in patients with inflammatory bowel disease. Aliment Pharmacol Ther 2011; 34(1): 51–58.
9. Svenson M, Geborek P, Saxne T et al. Monitoring patients treated with anti-TNF-a biopharmaceuticals: assessing serum infliximab and anti-infliximab antibodies. Rheumatol 2007; 46(12): 1828–1834.
10. Bendtzen K, Ainsworth M, Steenholdt C et al. Individual medicine in inflammatory bowel disease: Monitoring bioavailability, pharmacokinetics and immunogenicity of anti-tumour necrosis factor-alpha antibodies. Scand J Gastroenterol 2009; 44(7): 774–781.
11. van den Bemt BJF, den Broeder AA, Wolbink GJ et al. Anti-infliximab antibodies are already detectable in most patients with rheumatoid arthritis halfway through an infusioncycle: an open-label pharmacokinetic cohort study. BMC Musculoscelet dis 2011; 12(12): 1–6.
12. Bendtzen K, Steenholdt C, Ainsworth M et al. Comment on ‘Predicting the response to infliximab from trough serum levels’. Gut 2010; 59(9): 1298–1299.
13. Steendoldt C, Bendtzen K, Brynskov J et al. Cut-off levels and diagnostic accuracy of infliximab trough levels and, anti-infliximab antibodies in Crohn’s disease. Scand J Gastroenterol 2011; 46(3): 310–318.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článek Gastrokolická fistulaČlánek Ohlédnutí za Václavem HavlemČlánek Novinky ze světa IBDČlánek Správná odpověď na kvízČlánek Obzretie sa za Gastrofórom
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2012 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
-
Kvíz – případ z klinické praxe
Selhání biologické léčby u nemocného s ulcerózní kolitidou - Slovo k novým předplatitelům časopisu – členům České hepatologické společnosti ČLS JEP
- Guidelines for the administration of biological therapy in patients with inflammatory bowel diseases: 2nd edition
- Nízká aktivita sérové deoxyribonukleázy-I je u nemocných s idiopatickými střevními záněty spojena se vznikem kožních nežádoucích účinků při antiTNF-alfa léčbě
- Sérové hladiny infliximabu a protilátok proti infliximabu, prínos pre prax
- Význam vitamínu D pri nešpecifických črevných zápalových ochoreniach
- Matrixové metaloproteinázy a jejich tkáňové inhibitory v korelaci s proliferativními a klasickými nádorovými markery během chirurgické léčby jaterních metastáz
- Gastrokolická fistula
- Endoskopická submukózní disekce časného karcinomu žaludku
- Příprava střeva ke kolonoskopii
- Ohlédnutí za Václavem Havlem
- Co udělal Václav Havel pro nás a co my můžeme udělat pro jeho odkaz?
-
Jak důležitá je multidisciplinární péče o pacienty s kolorektálním karcinomem?
Zpráva z 1. národního kongresu o kolorektálním karcinomu/1. postgraduálního kurzu SGO - Správná odpověď na kvíz
- Nové standardy v léčbě Crohnovy nemoci
- Journal at the beginning of 66th annual volume: the current state and perspectives
- Obzretie sa za Gastrofórom
- Mutaflor – Escherichia coli kmen Nissle 1917, sérotyp O6:K5:H1
- Novinky ze světa IBD
-
Kvíz – případ z klinické praxe
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Příprava střeva ke kolonoskopii
- Gastrokolická fistula
- Sérové hladiny infliximabu a protilátok proti infliximabu, prínos pre prax
- Význam vitamínu D pri nešpecifických črevných zápalových ochoreniach
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



