-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Histopatologická diagnóza hepatocelulárního karcinomu
Autoři: E. Honsová
Působiště autorů: Pracoviště klinické a transplantační patologie, Transplantcentrum IKEM, Praha
Vyšlo v časopise: Gastroent Hepatol 2012; 66(2): 93-98
Kategorie: Hepatologie: doporučené postupy
Z pohledu každodenní praxe patologa nepředstavuje hepatocelulární karcinom (HCC) jenom izolovanou problematiku proliferujících uzlů s různým biologickým chováním v cirhóze. Podle histogeneze zahrnují primární maligní nádory jater u dospělých pouze tři skupiny onkologických diagnóz (HCC, cholangiocelulární karcinom a vaskulární tumory, zvl. epiteloidní hemangioendoteliom). Mohlo by se zdát, že diferenciální diagnostika mezi třemi kategoriemi bude velmi snadná, opak je ale pravdou, protože v játrech vstupují do onkologické diferenciální diagnózy metastázy tumorů z nejrůznějších primárních lokalit. Obecně vzato nejčastějším nádorem jater jsou metastázy. Je tedy zřejmé, že v játrech patolog v onkologické diagnostice zvažuje prakticky jakýkoli tumor, od metastáz z GIT a mammy, přes neuroendokrinní nádory, hematologické malignity, germinální i mezenchymové tumory, po melanom. K tomu je třeba přidat fakt, že HCC je morfologicky extrémně pleomorfní a že je téměř pravidlem, že v jednom nádorovém ložisku je několik zcela odlišných histologických typů, včetně odlišné diferenciace, což může diagnostiku dále komplikovat. Stejnou heterogenitu vykazuje HCC na úrovni genomických, genetických a epigenetických studií, proto dosud neexistuje subklasifikace na molekulární úrovni.
Přístup patologa k diagnóze nádoru v játrech se bude lišit podle toho, jaký typ vzorku vyšetřuje (resekát jater nebo jehlová biopsie) a také podle základní morfologie vyšetřovaného ložiska. V případě punkční/jehlové biopsie je vždy velmi omezené množství tkáně a tomu se musí přizpůsobit výběr vyšetření s racionálním využitím limitovaného počtu řezů.
Podle histopatologických znaků řeší patolog diagnostiku:
- Nádor je hepatocelulární a jde o určení jeho biologické povahy (dysplastický nodulus v cirhóze vs časný HCC, adenom vs HCC).
- Nádor má hepatocelulární a tubulární/cholangiocelulární diferenciaci (jak klasifikovat takové nádory).
- Nádor netypické histologické varianty nebo s několika histologickými typy. Otázkou je, zda jde o HCC, cholangiocelulární karcinom nebo metastázu.
Technická komponenta diagnózy nádoru v jehlové biopsii
Klíčem k úspěšné diagnóze nádoru v jehlové biopsii je kromě odbornosti a zkušenosti patologa také technika zpracování bioptického vzorku s optimálním využitím limitovaného množství tkáně. Technicky je situace obdobná jiným lokalitám, s výjimkou neobvykle širokého spektra možností onkologických diagnóz, které lze v jaterní biopsii zachytit. V praxi se obvykle využívá jeden z následujících postupů:
- a) Nejprve se ukrojí řezy pouze na 1–2 skla a na základě morfologických znaků se rozhodne o výběru dalších imunohistochemických průkazů.
- b) Ukrojí se série řezů, které se v pásce uloží, z nich se vyberou okrajové řezy a řezy z centra a na základě morfologických znaků se pokračuje stejně jako v předchozím. Tato praxe se většinou používá v zahraničí, je totiž náročnější na prostor (skladování), na druhé straně šetří čas i materiál při dalším vyšetření, protože se krájí pouze jednou a pro imunohistochemické průkazy lze cíleně využít okolní řezy.
Nádor je hepatocelulární a jde o určení jeho biologické povahy (dysplastický nodulus v cirhóze vs časný HCC, adenom vs HCC)
Shrnutí problematiky dobře diferencovaného časného HCC v cirhóze je součástí doporučeného postupu. Současná klasifikace zpřesnila definice některých znaků, přidala imunohistochemické markery, a tím významně snížila počet problematických případů hodnocených v rutinním bioptickém provozu, a to i mezi pravidelně velmi obtížnou diagnostickou uzlů s high-grade dysplazií a dobře diferencovaným HCC [1].
Základní znaky, které zlepšují v praxi histopatologickou diagnózu HCC jsou:
- stromální invaze
- nepárové arterie
- pozitivní průkaz glypicanu-3 (GPC3)
Stromální invaze charakterizuje časný HCC a představuje stav, kdy jednotlivé trámce nádorových hepatocytů pronikají do stromatu původních portálních polí nebo vazivových sept (obr. 1). Stromální invaze se posuzuje podobně jako v jiných oblastech onkologické diagnostiky, kde se hodnotí prorůstání nádoru do pouzdra. Protože stromální invaze je dokladem invazivního růstu, stala se nejdůležitějším morfologickým znakem, který umožňuje rozlišení high-grade dysplastického uzlu od časného dobře diferencovaného HCC. Diagnostickou limitací je fakt, že okrsky stomální invaze se vyskytují fokálně a v jehlové biopsii nemusí být zastiženy.
Obr. 1. HCC se stromální invazí. V těsné blízkosti žlučovodu (žlutě) je trámec nádorových buněk (červeně). Barvení HE, zvětšení objektiv 40× Fig. 1. HCC with morphological features of stromal invasion (the cells of HCC marked in red, bile duct marked yellow); H&E, high power field. 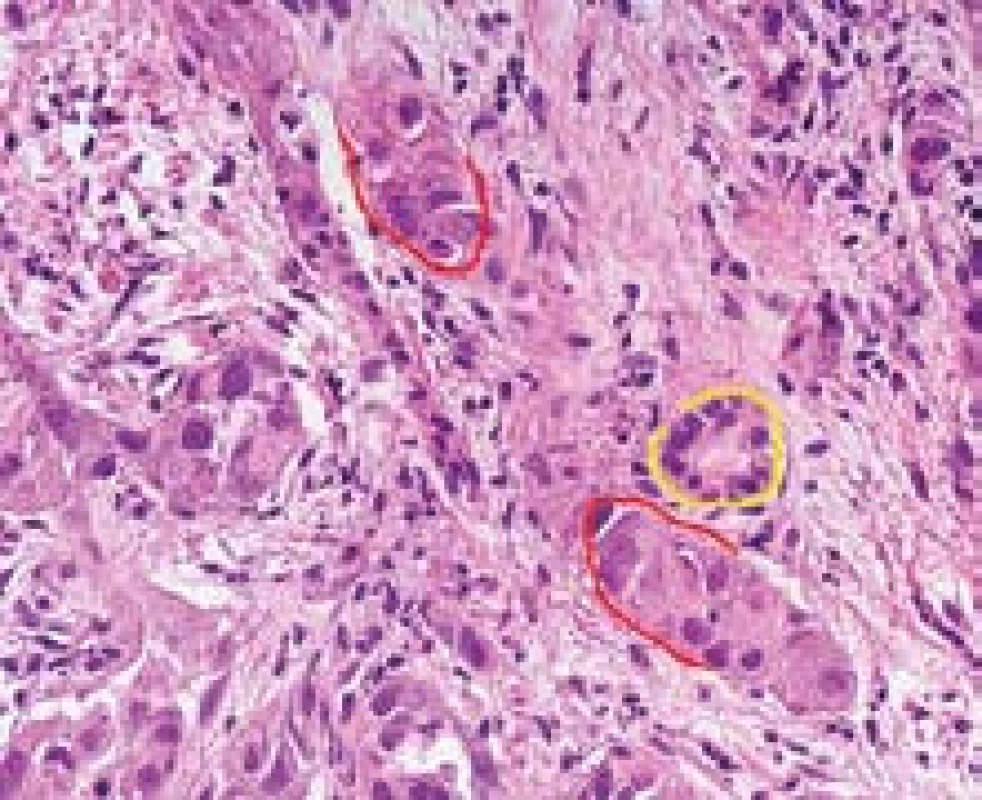
Nepárové arterie jsou arterie, které jsou zastiženy v jaterní tkáni izolovaně mezi hepatocyty. Jsou tedy lokalizované mimo portální pole, kde normálně doprovází žlučovod a jsou vlastně histologickým korelátem neovaskularizace, která představuje hlavní diagnostický znak HCC v průběhu zobrazovacích metod (obr. 2). Nepárové arterie se na rozdíl od stromální invaze mohou vyskytovat i v benigních lézích (adenom) nebo v dysplastických nodulech.
Obr. 2. Nepárové arterie (hnědě) v HCC. Arterie leží samostatně v nádorové tkáni. Imunohistochemický průkaz hladkosvalového aktinu, zvětšení objektiv 40×. Fig. 2. HCC with unpaired arteries (brown) which are not accompanied by bile ducts as in portal tracts of normal liver. Detection of alfa-smooth muscle actin, high power field. 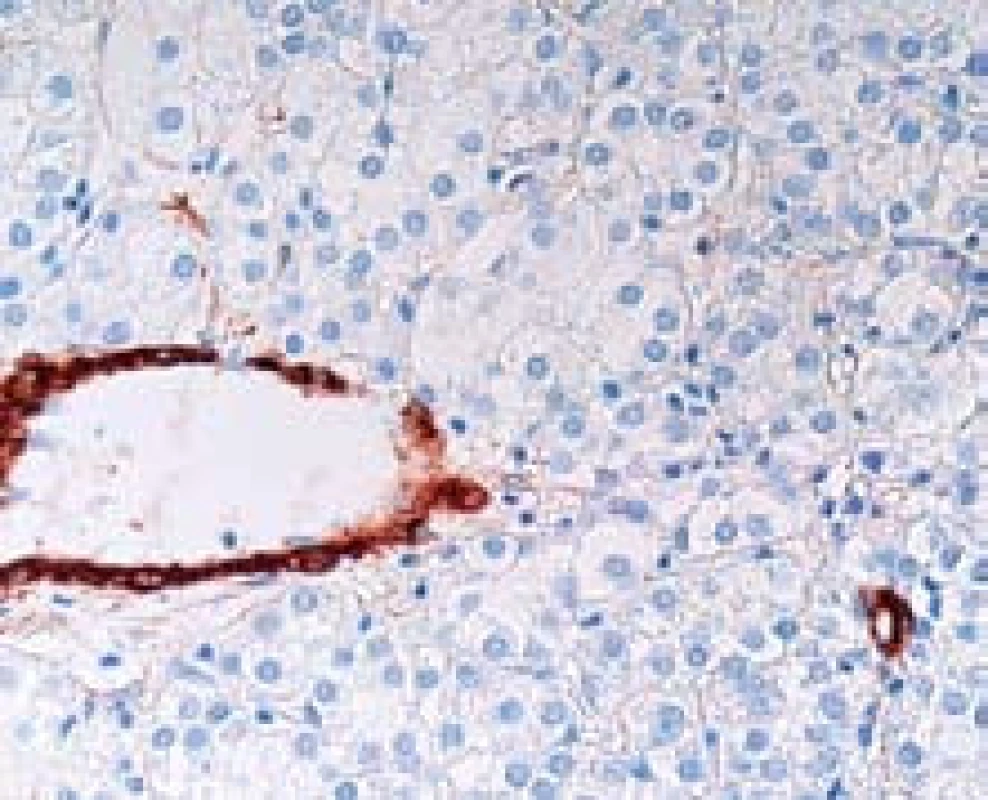
Imunohistochemický průkaz glypicanu-3 znamená téměř revoluci v diagnostice HCC. GPC3 je onkofetální protein ovlivňující morfogenezi a kontrolující růst, který je vysoce exprimován v játrech a střevě během fetálního vývoje [2]. U dospělých v normálních játrech exprimován není. Jeho exprese se znovu objevuje v buňkách HCC a může být cytoplazmatická, membránová nebo kanalikulární (obr. 3). Prakticky ve všech případech je fokální a má různou intenzitu. Průkaz GPC3 má vysokou senzitivitu (77 %) a především specificitu (96 %), pozitivní výsledek s vysokou pravděpodobností predikuje maligní nádor z hepatocytů. Největší limitací průkazu GPC3 je jeho fokální exprese, která může vést k negativnímu výsledku, a také to, že průkaz je citlivý na fixaci [3]. Pouze zřídka byl zjištěn pozitivní průkaz GPC3 v jiných maligních tumorech, např. v melanomu, nádoru ze žloutkového váčku [4].
Obr. 3. Imunohistochemický průkaz glypicanu-3. Na snímku je membránová i cytoplazmatická pozitivita v nádorových buňkách, úsek cirhotického uzlu vlevo je negativní, zvětšení objektiv 40×. Fig. 3. Positive glypican-3 immunostaining with membrane and cytoplasmatic positive detection in the HCC cells. Negative staining of cirrhotic nodule on the left side; high power field. 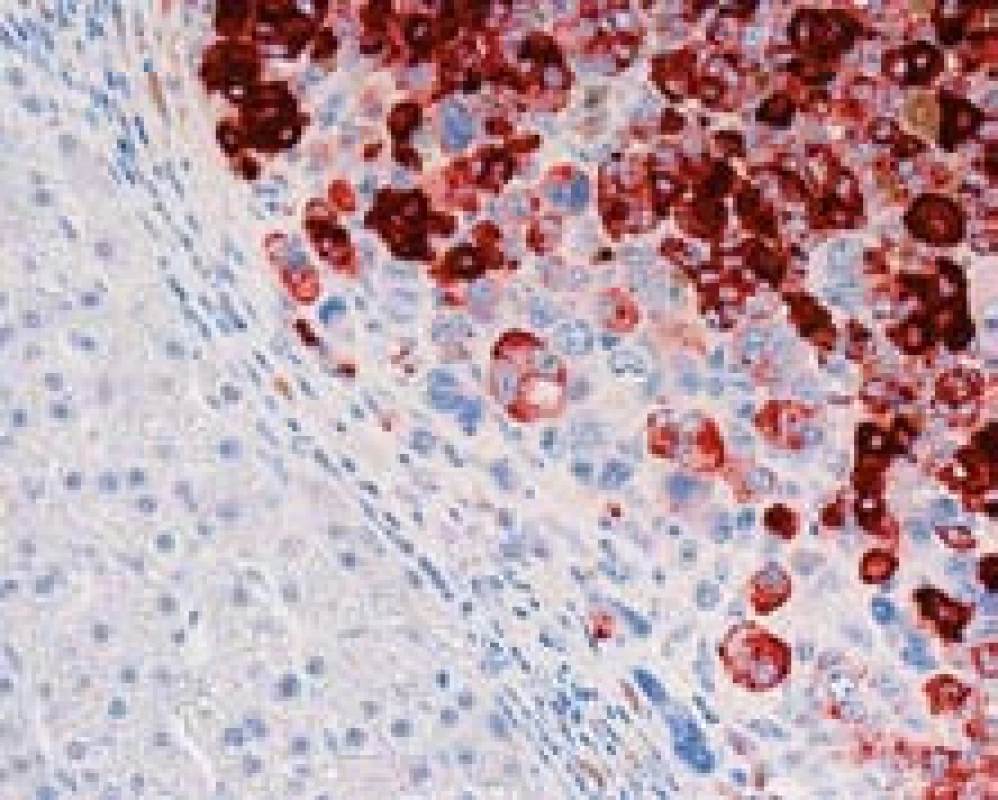
Další imunohistochemické markery
Další doporučované imunohistochemické znaky mají většinou významná omezení.
Alfa-fetoprotein je sérologickým markerem pro pokročilé HCC. Časné HCC nemají obvykle zvýšené hladiny v séru a v histologii průkaz alfa-fetoproteinu nepomůže, protože má velmi nízkou senzitivitu.
Pro pozitivní průkaz CD34 na endotelu sinusoid se používá termín kapilarizace. Exprese CD34 se zvyšuje v místech, kde je převážně arteriální cévní zásobení, a proto je častěji pozitivní v HCC. Časné HCC, které ještě obsahují portální pole, jsou zásobeny vedle arteriálního novotvořeného oběhu také portálním oběhem, proto budou mít průkaz CD34 v různém rozsahu negativní. Na druhé straně adenomy a fokální nodulární hyperplazie (která pravděpodobně představuje reakci na vaskulární abnormalitu) budou mít fokálně pozitivní průkaz CD34. Pozitivní průkaz CD34 je třeba hodnotit v kontextu dalších morfologických znaků, sám o sobě neindikuje maligní proces.
Hep-Par1 je velmi užitečný, pokud potřebujeme rozlišit HCC od metastázy jiného karcinomu, ale nepomůže v odlišení benigního a maligního tumoru z hepatocytů (Hep-Par1 je monoklonální protilátka, která reaguje s epitopem jaterních mitochondrií).
Glutamin syntetáza (GS) katalyzuje syntézu glutaminu, který je hlavním zdrojem energie pro nádorové buňky. V normálních játrech je GS exprimovaná v hepatocytech v okolí terminálních venul. V cirhotických játrech bývá pozitivních cca 10 % hepatocytů. Změna v rozsahu pozitivního průkazu GS (> 50 % nádorových buněk) je zaznamenána v případech tumorů jater s mutací βcateninu (GS je cílovým genem βcateninu); tj. cca v 10 % adenomů a 20–34 % HCC.
Heat shock protein 70 (HSP70) se účastní v procesech tumorigeneze ovlivněním regulace buněčného cyklu a apoptózy a představuje významný antiapoptotický faktor. Chronické infekce HCV a HBV, které vedou ke vzniku cirhózy a HCC, vedou také k syntéze HS70. Pozitivní imunohistochemický průkaz HS70 (obvykle jaderný i cytoplazmatický) je fokální a lze ho pozorovat u časných i plně vyvinutých HCC.
Jak již řečeno v úvodu, genetické/proteomické studie dosud neumožňují změny v diagnostice HCC. I když se v posledních dvou letech objevily práce, které ukazují, že podle výsledků molekulární diagnostiky bude pravděpodobně možné odlišit více či méně agresivní nádory, a tím také vybrat pacienty, kteří budou indikováni k resekci nebo transplantaci jater [5].
V podstatě lze shrnout, že typické HCC lze diagnostikovat na úrovni základního barvení HE. Komplikované případy vyžadují imunohistochemickou verifikaci, kdy diagnosticky nejpřínosnější je imunohistochemický průkaz glypicanu-3.
V případě diferenciálně diagnostické rozvahy mezi hepatocelulárním adenomem (HCA) a HCC do diagnostiky vstupuje ještě požadavek rozlišení adenomů s vysokým, nebo nízkým rizikem přechodu do HCC.
Hepatocelulární adenomy jsou relativně vzácné tumory, které se nejčastěji objevují u žen v souvislosti s antikoncepcí. Podle současných znalostí představují HCA nesourodou skupinu tumorů, které lze zařadit do jedné ze 4 skupin:
- H-HCA (hepatocelulární adenom definovaný aktivací HNF1 tj. Hepatocyte Nuclear Factor1) představuje 35–40 % všech HCA a objevuje se téměř výlučně u žen. Raritně tyto tumory doprovázejí familiární DM (diabetes mellitus), kde mohou být mnohočetné (MODY3). V biopsiích je obvykle steatóza, bez zánětu a bez cytologických atypií. To, že nádorové buňky neexprimují L-FABP, lze využít v diagnostice. L-FABP je protein, který ovlivňuje metabolizmus mastných kyselin a v normálních hepatocytech je L-FABP exprimován.
- I-HCA (HCA se zánětlivou celulizací) představuje 50 % HCA, nemocní jsou často obézní muži, kuřáci, s kladným vztahem k alkoholu. Jde o nejčastější variantu HCA vyskytující se u mužů. Zánět v histopatologii doprovází overexprese reaktantů akutní fáze včetně SAA, který lze prokázat imunohistochemicky a lze ho diagnosticky využít.
- β-HCA (HCA s aktivací βcateninu) představuje cca 10 % adenomů. Aktivace βcateninu se nejsnadněji dokazuje imunohistochemickým průkazem glutamin syntetázy (glutamin syntetáza katalyzuje syntézu glutaminu, který je hlavním zdrojem energie pro nádorové buňky. V β-HCA je difuzní pozitivita glutamin syntetázy). Existuje též možnost imunohistochemického průkazu βcateninu. Tyto tumory jsou častější u mužů, v histopatologii jsou cytologické abnormality, což s sebou nese rozpaky v hodnocení biologického chování. Současně β-HCA mají vysoké riziko maligního zvratu. V poslední době se objevují studie ukazující, že většina těchto tumorů představuje spíše dobře diferencované HCC než adenomy. V této oblasti je nezbytný další výzkum k objasnění toho, zda vůbec jde o dvě rozdílné onkologické kategorie [6].
- HCA bez bližšího určení, zde jsou zařazeny nádory, které nesplňují kritéria žádné z předchozích kategorií. Jde o malou skupinu cca 5 % HCA.
Kromě typu HCA je zvl. u mužů nutné brát v úvahu také velikost ložiska, protože riziko maligního zvratu stoupá s velikostí, a to bez ohledu na celkový počet ložisek v játrech. Kritickou velikost mají ložiska velikosti přesahující 4 cm [7].
Nádor má hepatocelulární a tubulární/cholangiocelulární diferenciaci (jak klasifikovat takové nádory)
Více než 90 % cholangiocelulárních karcinomů (CC) vzniká v hilu (tzv. Klatskinův tumor), zbývající postihují primárně nitrojaterní nebo extrahepatální žlučovody. V histopatologii je klasický cholangiocelulární karcinom charakterizovaný tubulárními strukturami (pozitivními CK7 a CK19) a nápadnou fibroprodukcí (obr. 4). Tato typická morfologie je snadno odlišitelná od klasického HCC (pozitivní Hep--Par1), který až na fibrolamelární variantu nemá vazivové stroma. CC mají nepříznivé biologické chování a jejich diagnóza představuje ve většině center kontraindikaci k transplantaci jater. Naproti tomu HCC, pokud nepřesahují definovaná kritéria, jsou naopak indikací k transplantaci. Proto rozlišení obou typů nádorů má závažné následky. V posledních letech jsou publikovány studie o zvyšující se incidenci intrahepatálních CC v cirhóze. Odlišení CC od běžně přítomné reaktivní duktulární proliferace v jizvení (tj. v často se vyskytujících plošných jizvách při změnách prokrvení v cirhóze) může být velmi obtížné, protože nejsou známé žádné proteiny, které by měly rozdílnou expresi v nenádorovém a maligním biliárním epitelu.
Obr. 4. Typická morfologie cholangiocelulárního karcinomu; jde o tubulární adenokarcinom s nápadnou fibroprodukcí. Barvení HE, zvětšení objektiv 20×. Fig. 4. Typical morphological features of cholangiocellular carcinoma; tubular adenocarcinoma with prominent desmoplastic stroma. H&E. 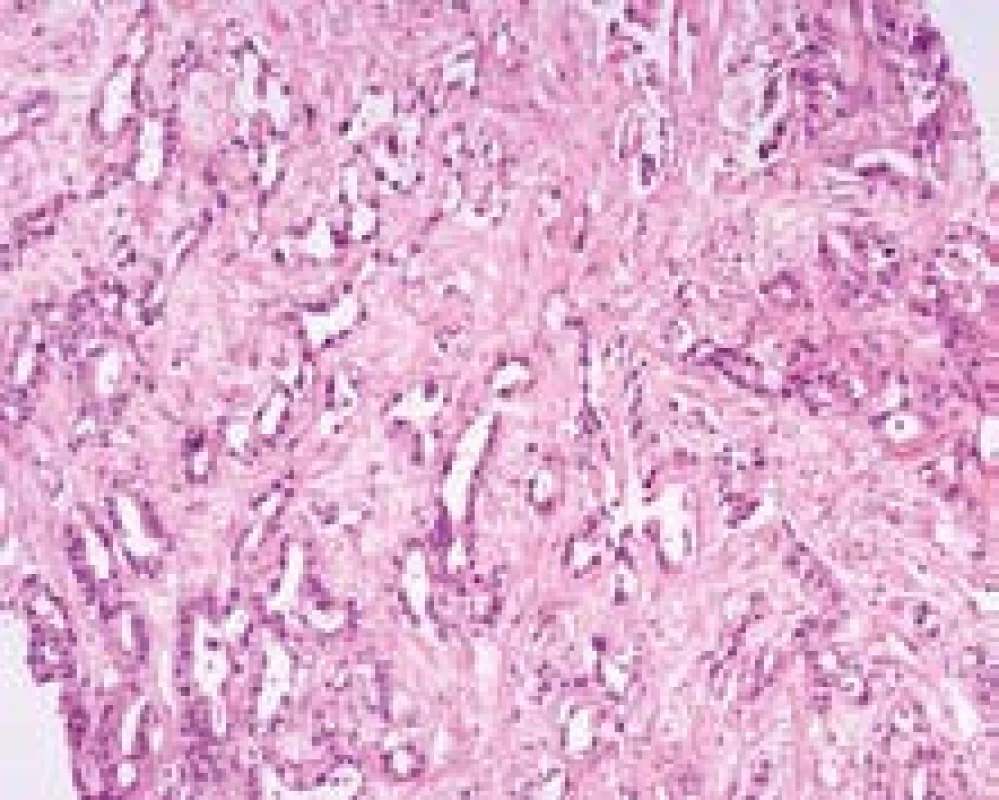
Rutinní používání imunohistochemických průkazů cytokeratinů exprimovaných v duktálním (zde biliárním) epitelu (CK19, CK7) odkrylo část HCC s okrsky drobných nezrale vypadajících nádorových buněk (progenitorové buňky) často s různým stupněm tubulárních struktur a s pozitivním průkazem CK7 a CK19. To postavilo histopatologickou diagnostiku před problém, jak zařadit takové nádory. Otázek je mnoho, např. kde leží kritéria pro identifikaci biliární komponenty? Průkaz cytokeratinů (CK7, CK19) je pozitivní i v hepatocytech v cholestatických lézích. Proto nemůže být izolovaný průkaz CK7 anebo CK19 v okrscích nádorových buněk považován za průkaz biliárního/cholangiocelulárního karcinomu. Markery progenitorových buněk jsou též současně exprimovány v hepatocytech i v biliárním epitelu a v rozhodování nepomohou. K tomu je třeba přidat fakt, že neexistují definovaná kritéria, kdy by měl být nádor klasifikován jako smíšený HCC-CC. To vede k tomu, že každé centrum používá vlastní kritéria. Většinová shoda je v tom, že typické HCC a CC lze odlišit na základě morfologických znaků. V praxi panuje shoda, že kombinované HCC-CC by měly být diagnostikovány pouze v případě, že nádor obsahuje plně vyvinutou komponentu CC, včetně fibroprodukce a tubulární architektury. Typické HCC s fokálně pozitivním průkazem CK7 a nebo CK19 jsou klasifikovány většinou jako HCC.
Nádor netypické histologické varianty nebo s několika histologickými typy. Otázkou je, zda jde o HCC, cholangiocelulární karcinom nebo metastázu
HCC je extrémně pleomorfní tumor, což spolu s tím, že do jater mohou metastazovat tumory v podstatě jakékoli histogeneze a z jakékoli primární lokality, přináší do diferenciální diagnostiky nepřeberné množství možností. Podle základní struktury lze ve většině případů odlišit mezenchymové, epitelové, event. hematologické malignity. Další diferenciálně diagnostická rozvaha směřující k výběru imunohistochemických, event. molekulárně genetických průkazů je závislá na histologické struktuře. Extrémně širokou diferenciální diagnostiku může značně ovlivnit anamnestická klinická informace o předchozích diagnózách maligních onemocnění. V textu i v tab. 1 shrnujeme pouze nejběžnější metastatické tumory jater a diferenciální diagnostiku epiteloidního hemangioendoteliomu.
Tab. 1. Metastázy nádorů, které běžně postihují játra (mimo lymfomy). Tab. 1. Metastases of tumours commonly affecting the liver (except for lymphomas). 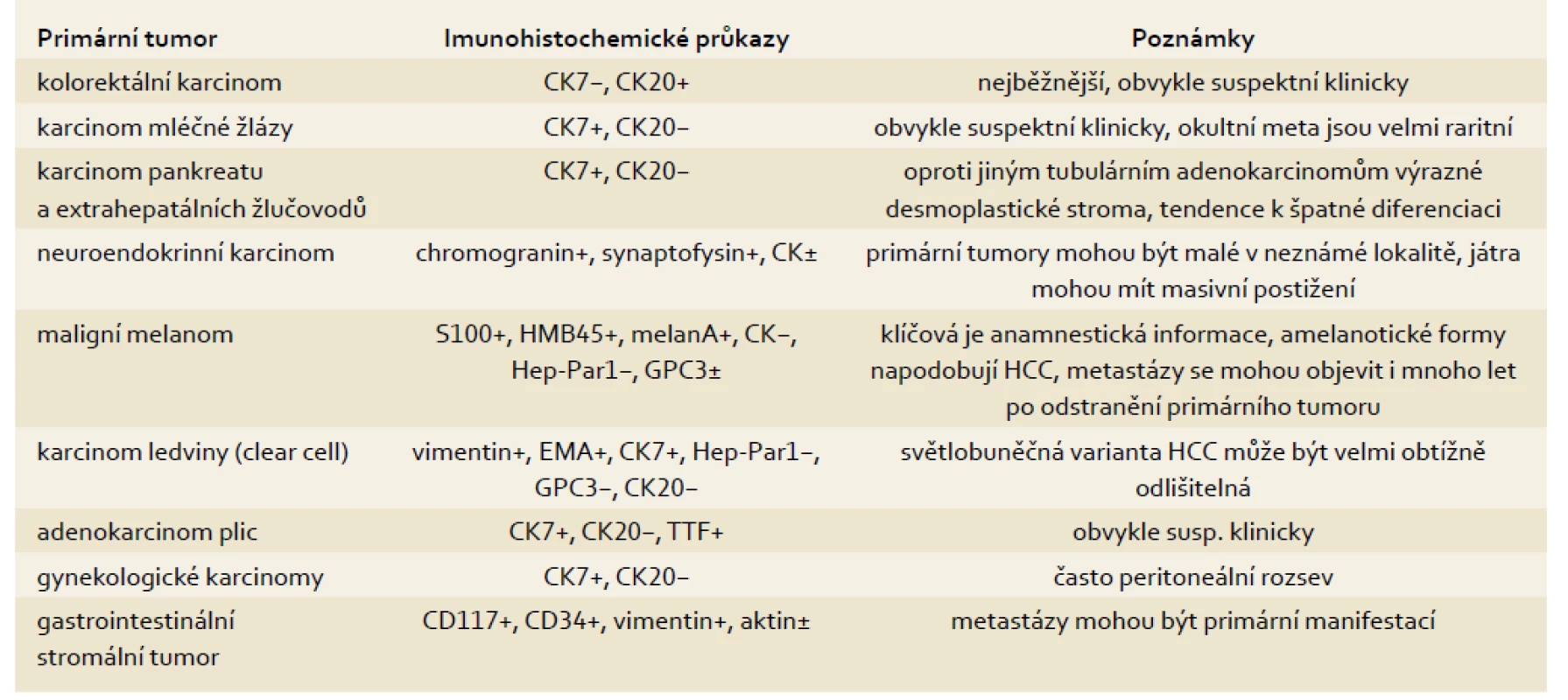
CK – cytokeratin; GPC3 – glypican-3; EMA – epiteloidní membránový antigen; TTF – thyroidní transkripční faktor Potřebuje-li patolog rozlišit HCC od metastázy jiného tumoru, je velmi užitečný imunohistochemický průkaz Hep-Par1. Průkaz ale nepomůže v odlišení benigního a maligního tumoru z hepatocytů. Navíc Hep-Par1 může být negativní v relativně běžných světlobuněčných variantách HCC.
Dalším markerem pozitivním téměř výlučně v HCC je glypican-3 (viz dg. HCC).
Komplikovaná situace nastává, jsou-li zachyceny struktury tubulárního adenokarcinomu vývodového typu, kdy je v diferenciální diagnóze cholangiokarcinom nebo metastázy, nejčastěji karcinomu pankreatu nebo kolorektálního karcinomu. Extrahepatální žlučovody a pankreatické vývody mají společný vývojový základ a dosud není znám žádný marker, který by umožnil jejich odlišení. Cholangiocelulární tumory mají nápadnou fibroprodukci a často jsou špatně diferencované. V případě nejčastějších metastáz kolorektálního tubulárního adenokarcinomu lze vedle morfologie použít k podpoře diagnózy detekci různých typů cytokeratinů (kolorektální karcinom: CK20+, CK7-).
Tubulární struktury může svým typem růstu napodobit epiteloidní hemangioendoteliom. Jde o cévní nádor, který roste pomalu a vytváří jeden nebo více různě velikých bledých tuhých uzlů. Imunohistochemicky jsou nádorové buňky pozitivní v průkazech CD31, CD34, faktor VIII. V histopatologii se nádorové buňky šíří sinusy, hepatocyty mezi sinusy atrofují a centrum ložiska se jizví. Nádor má zonální uspořádání s vazivem centrálně a dalším růstem na periferii. Růst nádoru ovlivňuje okolní hepatocyty, které mohou vytvářet reaktivní kanalikulární struktury, které budou imunohistochemicky pozitivní v průkazech CK7 a CK19. To může vést k tomu, že tyto reaktivní struktury jsou hodnoceny jako nádor (cholangiocelulární tubulární adenokarcinom) a jednotlivé nádorové buňky v sinusech uniknou pozornosti (obr. 5, 6). Že jde o komplikovanou diagnózu, ukázalo několik zahraničních studií, kde pouze 25–40 % epiteloidních hemangioendoteliomů bylo diagnostikováno při prvním histopatologickém vyšetření [8,9].
Obr. 5. Epiteloidní hemangioendoteliom, nádorové buňky šířící se sinusy a reaktivní změny hepatocytů. Na úrovni HE je velmi obtížné rozpoznat, které elementy jsou vlastně nádorové. Barvení HE, zvětšení objektiv 40×. Fig. 5. Epithelioid hemangioendothelioma, tumor cells in the sinusoids and reactive changes of hepatocytes are shown. There is difficult to recognize the tumor cells in the H&E stain. 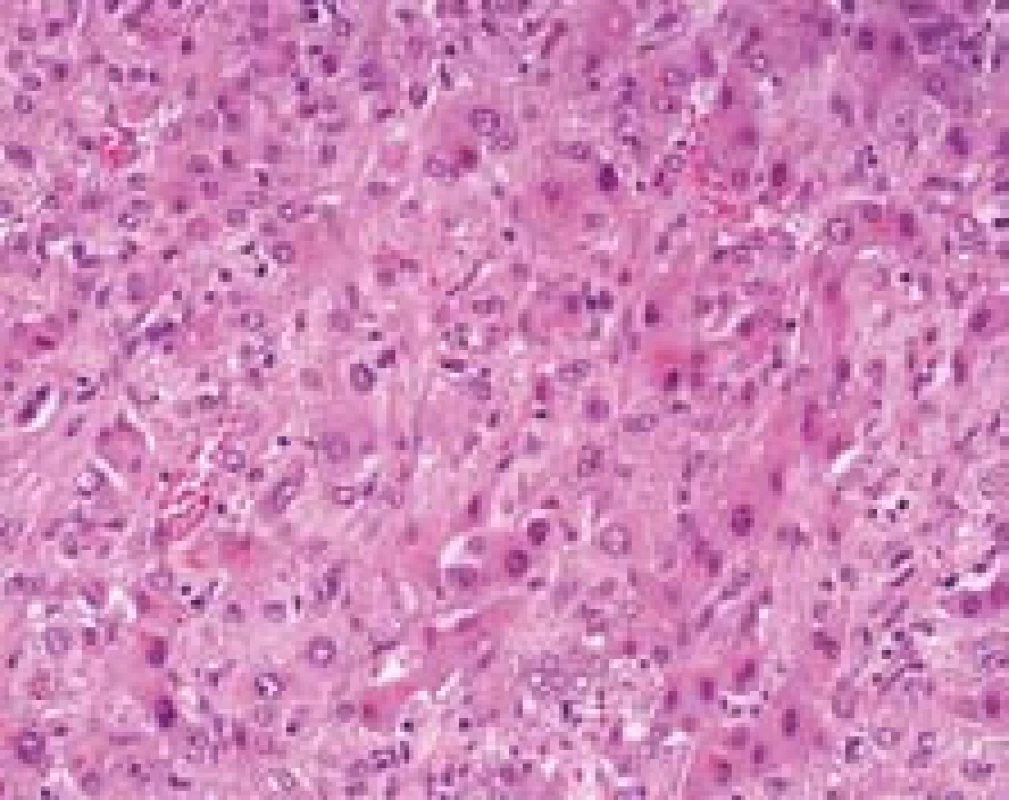
Obr. 6. Epiteloidní hemangioendoteliom, imunohistochemický průkaz CD34 verifikuje endotel sinusů (nenádorový i nádorový), s pozitivními elementy šířícími se sinusy. Současně jsou dobře patrné cytologické reaktivní změny hepatocytů. Zvětšení objektiv 40×. Fig. 6. Epithelioid hemangioendothelioma, immunoperoxidase detection of CD34 with positive staining in the endothelium (benign and malignant) with tumor cells spreading in the sinusoids. Reactive changes of hepatocytes are also shown, high power field. 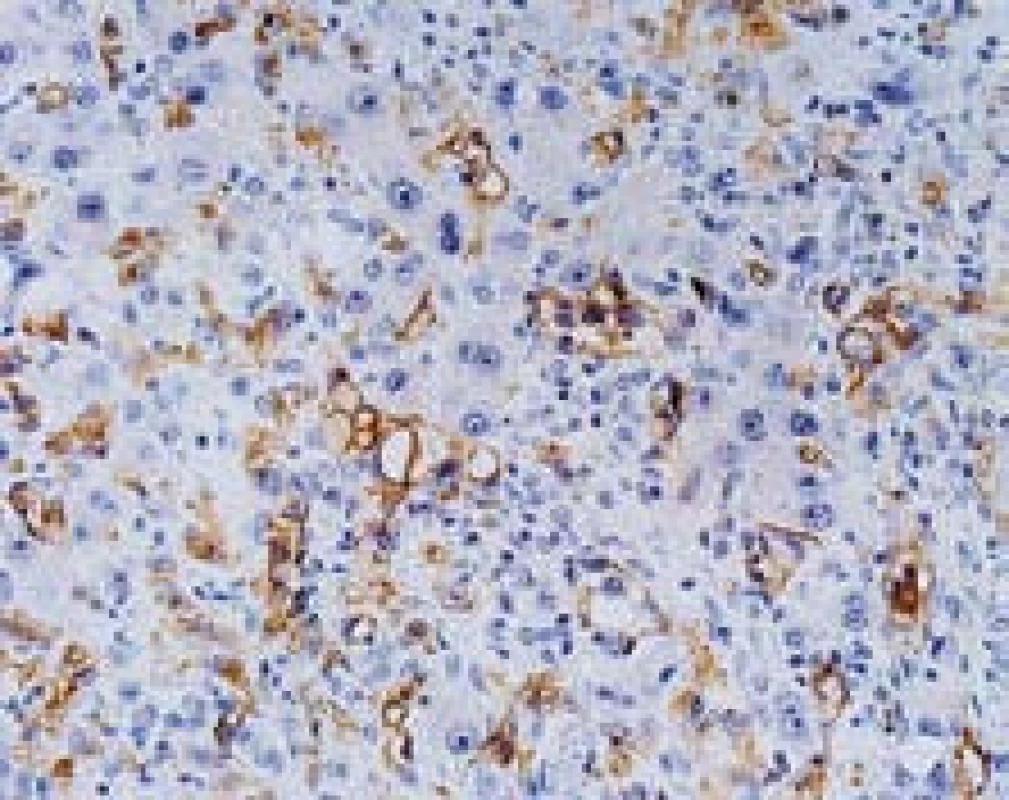
Velmi často do jater metastazují neuroendokrinní nádory (NET). V klinickém obraze jde většinou o náhodný nález vícečetných ložisek v játrech. Nalezení primárního tumoru není vždy jednoduché. Primární nádory mohou být v různých lokalitách v GIT a může jít o malá ložiska. Diagnózu NET podporuje pozitivní imunohistochemický průkaz chromograninu a synaptofyzinu (obr. 7). Proliferační aktivita ani stupeň diferenciace nemusí odpovídat biologickému chování. V játrech lze diagnostikovat velmi dobře diferencované tumory s nízkou proliferační aktivitou, a přesto jde téměř vždy o metastázy.
Obr. 7. Metastáza neuroendokrinního karcinomu. Pozitivní imunohistochemický průkaz chromograninu A (hnědě) v nádorových buňkách, hepatocyty jsou negativní. Zvětšení objektiv 40×. Fig. 7. Metastasis of neuroendocrine carcinoma with positive detection of chromogranin A (brown). Hepatocytes are negative; high power field. 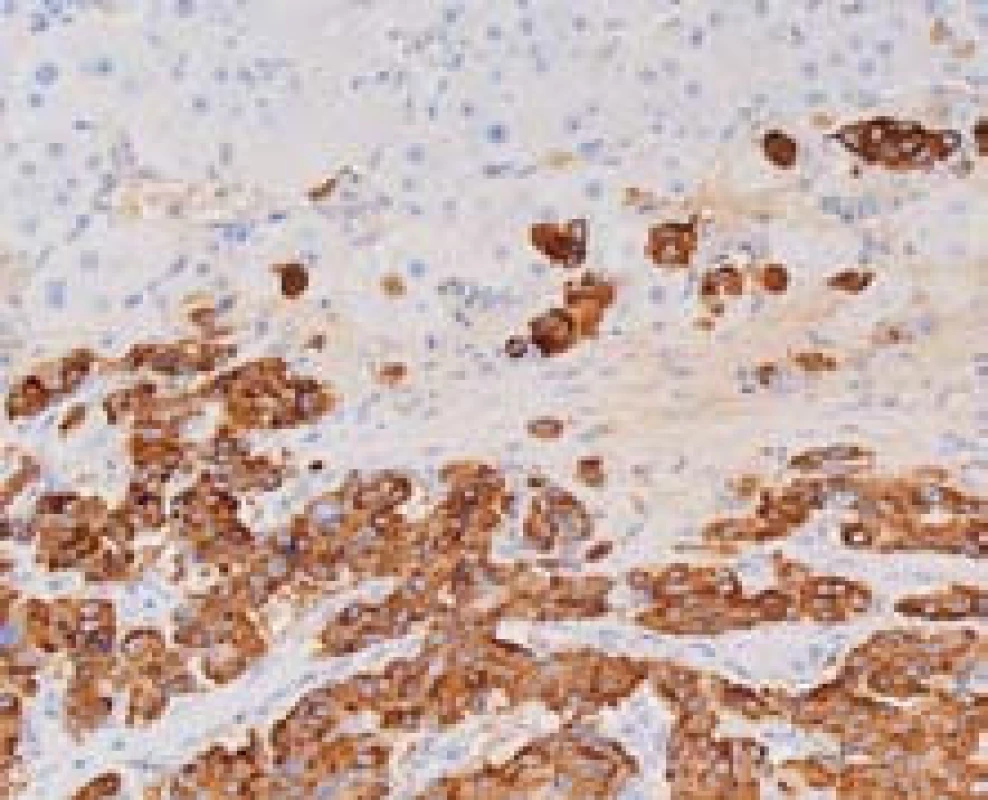
Stejně komplikovaná může být diagnóza metastázy maligního melanomu, zvl. když patolog neví, že pacient měl melanom již diagnostikovaný, anebo když biopsie z jater je prvním záchytem již generalizovaného tumoru. Melanom ne vždy zachovává typické solidně alveolární uspořádání a ne vždy je v nádorových buňkách přítomná produkce pigmentu.
Z mezenchymových nádorů jsou nejčastěji v biopsiích jater zastiženy metastázy gastrointestinálních stromálních tumorů (GIST). I zde může jít o první diagnostický záchyt, protože primární ložisko může být asymptomatické. Diagnostický je průkaz CD117, který je pozitivní ve více než 95 % GIST.
Závěrem lze shrnout, že histopatologická diagnostika nádorů v játrech se řadí především díky širokému spektru nejrůznějších metastáz k velmi komplikovaným diagnózám. V možnostech rozlišení HCC a benigních afekcí z hepatocytů přineslo značné zlepšení použití imunohistochemického průkazu glypicanu-3. Intrahepatální cholangiocelulární karcinomy klasické morfologie nečiní diagnostický problém, ale skupina nádorů s fenotypem progenitorových buněk je naopak velmi problematická. Nejen pokud jde o jejich klasifikaci, ale především pokud jde o terapeutické rozhodnutí o případné transplantaci jater.
Autorka deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 1. 3. 2012
Přijato: 15. 3. 2012
MUDr. Eva Honsová, Ph.D.
Pracoviště klinické a transplantační patologie
Transplantcentrum IKEM
Vídeňská 1958/9, 140 21 Praha 4
eva.honsova@ikem.cz
Zdroje
1. International Consensus Group for Hepatocellular Neoplasia. Pathologic diagnosis of early hepatocellular carcinoma: a report of the international consensus group for hepatocellular neoplasia. Hepatology 2009; 49(2): 658–664.
2. Filmus J. Glypican in growth control and cancer. Glycobiology 2001; 11(3): 19–23.
3. Takai H, Kato A, Ishiguro T et al. Optimization of tissue processing for immunohitochemistry for the detection of human glypican-3. Acta Histochem 2010; 112(3): 240–250.
4. Zynger DL, Everton MJ, Dimov ND et al. Expression of glypican-3 in ovarian and extragonadal germ cell tumors. Am J Clin Pathol 2008; 130(2): 224–230.
5. Schwartz M, Dvorchik I, Roayaie S et al. Liver transplantation for hepatocellular carcinoma: extensity of indications based on molecular markers. J Hepatol 2008; 49(4): 581–588.
6. Walther Z, Jain D. Molecular Pathology of hepatic neoplasms: classification and clinical significance. Patholog Res Int 2011 : 403929.
7. Bioulac-Sage P, Blanc JF, Rebouissou S et al. Genotype phenotype classification of hepatocellular adenoma. World J Gastroenterol 2007; 13(19): 2649–2654.
8. Makhlouf HR, Ishak KG, and Goodman ZD. Epitheloid hemangioendothelioma of the liver. Cancer 1999; 85(3): 562–582.
9. Mehrabi A, Kashfi A, Fonouni H et al. Primary malignant hepatic epitheloid hemangioendothelioma. A comprehensive review of the literature with emphasis on the surgical therapy. Cancer 2006; 107(9): 2108–2121.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článek Dobré zprávyČlánek Správná odpověď na kvíz
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2012 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
-
Všetky články tohto čísla
- Hepatorenálny syndróm u pacientov s akútnou alkoholovou hepatitídou
- Správná odpověď na kvíz
- Graft vs host disease jako neobvyklá komplikace po transplantaci jater
- Liečba achalázie – súčasný prístup a vlastné skúsenosti
- Analýza těkavých plynů ve vydechovaném vzduchu u nemocných s idiopatickými střevními záněty
- Súčasný prístup k anémii u pacientov s nešpecifickými črevnými zápalmi
- Mezinárodní konsenzus ke sledování aktivity nemoci u pacientů s Crohnovou chorobou: Výsledky projektu IBD AHEAD 2011
- XVIst Hradec days of gastroenterology and hepatology
- Prof. Jiří Nevoral on the occasion of his 70th birthday
- 20 let členem výboru České gastroenterologické společnosti (ČGS)
- Esomeprazol – první inhibitor protonové pumpy „druhé“ generace
- Dobré zprávy
- Doporučený postup pro léčbu a diagnostiku hepatocelulárního karcinomu
- Histopatologická diagnóza hepatocelulárního karcinomu
- Nález v distálnom duodene, ktorý by nemal prekvapiť
- Rotorův syndrom podmiňuje porucha jaterního vychytávání konjugovaného bilirubinu
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Hepatorenálny syndróm u pacientov s akútnou alkoholovou hepatitídou
- Súčasný prístup k anémii u pacientov s nešpecifickými črevnými zápalmi
- Liečba achalázie – súčasný prístup a vlastné skúsenosti
- Prof. Jiří Nevoral on the occasion of his 70th birthday
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



