-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Vzácné mykotické komplikace po transplantaci jater
Rare mycotic complications following liver transplant
A total of 420 liver transplants were carried out at the transplant centre in Brno between 2 February 1983 and 31 December 2011. We observed an unusual and serious mycotic infection, which was not caused by candida or aspergillus, in a total of five patients. We found one case each of Cladophialophora bantiana and Fonsecaea compacta infection. In three cases the infection was caused by Cryptococcus neoformans. Three patients (3/5 = 60%) died of the aforementioned infection. The authors describe the case of a 44-year old man with abscesses of the lungs and brain, caused by black fungus (Cladophialophora bantiana). Despite the application of the full spectrum of antimycotic therapy and surgical procedures, the infection continued to progress, resulting in the death of the patient. The second patient, a 54-year old woman, had developed recidivising skin infiltrations, which were examined from a histological, microscopic and cultivatory point of view, with the presence of Fonsecaea compacta demonstrated. While repeated surgical interventions were required to remove deposits following recidivism, only the introduction of antimycotic therapy led to its complete disappearance. The patient has shown no signs of infection for seven years. The authors further describe the case of a 56-year old man with a haematogenic spread of mycotic infection of the skin caused by Cryptococcus neoformans. In this case, the surgical removal of skin deposits and long-term antimycotic therapy led to the regression of the infection and stabilisation of the patient. In the fourth case study, the authors describe the case of a 56-year old man after orthotopic liver transplantation and with early onset encephalitis, bilateral bronchial pneumonia, which led to the death of the patient on the 40th day following transplant. The etiology of the infection (Cryptococcus neoformans) was demonstrated following post mortem microscopic examination. The fifth patient was a 31-year old man with primary biliary cirrhosis, on whom a liver transplant was performed, accompanied by the reconstruction of the biliary tracts using a Roux loop. The operation and early post-operative period passed without complications. From the 12th day following surgery the patient suffered loss of consciousness and Cryptococcus neoformans was found in the lumbar puncture. Despite the introduction of therapy, the patient died of brain oedema within three months.
Key words:
mycotic infections – liver transplantation
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
18. 7. 2012Accepted:
24. 9. 2012
Autoři: L. Husová 1; I. Kocmanová 2; V. Žampachová 3; R. Pařízková 4; V. Mejzlík 1; M. Kuman 1; S. Štěpánková 1; P. Němec 1
Působiště autorů: Centrum kardiovaskulární a transplantační chirurgie Brno 1; Oddělení klinické mikrobiologie, FN Brno 2; I. patologicko-anatomický ústav LF MU a FN u sv. Anny v Brně 3; Klinika infekčních chorob, LF MU a FN Brno 4
Vyšlo v časopise: Gastroent Hepatol 2012; 66(6): 482-488
Kategorie: Hepatologie: kazuistika
Souhrn
Od 2. 2. 1983 do 31. 12. 2011 bylo v transplantačním centru v Brně provedeno celkem 420 transplantací jater. Neobvyklé a závažné mykotické infekce, nezpůsobené kandidami či aspergily, jsme pozorovali celkem u pěti pacientů. Po jednom případě šlo o infekci Cladophialophora bantiana a Fonsecaea compacta. Ve třech případech byla infekce vyvolána Cryptococcus neoformans. Tři pacienti na uvedenou infekci zemřeli (3/5 = 60 %). Autoři popisují případ 44letého muže s mozkovými a plicními abscesy způsobenými černou plísní (Cladophialophora bantiana). I přes veškerou terapii antimykotickou a operační došlo k progresi infekce a následné smrti pacienta. U druhé nemocné, 54leté ženy, došlo ke vzniku recidivujících kožních infiltrátů, které byly histologicky, mikroskopicky a kultivačně vyšetřeny s průkazem Fonsecaea compacta. Ložiska byla pro recidivu opakovaně chirurgicky odstraněna, ale až zavedení antimykotické terapie vedlo k jejich definitivnímu vymizení. Pacientka je sedm let bez známek infekce. Autoři dále popisují případ 56letého muže s kožním hematogenním rozsevem mykotické infekce způsobené Cryptococcus neoformans. V tomto případě chirurgické odstranění kožních ložisek a dlouhodobá antimykotická terapie vedly k regresi infekce a stabilizaci pacienta. Ve čtvrtém případě autoři popisují případ 56letého muže po ortotopické transplantaci jater s časnou encefalitidou, bilaterální brochopneumonií, které vedly ke smrti pacienta 40. den po transplantaci. Etiologie infekce (Cryptococcus neoformans) byla prokázána post mortem mikroskopickým vyšetřením. Pátý nemocný byl 31letý muž s primární biliární cirhózou, pro kterou byla provedena transplantace jater s rekonstrukcí žlučových cest s Roux kličkou. Operace i časný pooperační průběh byly bez komplikací. Od 12. dne došlo ke ztrátě vědomí, v provedené lumbální punkci byl prokázán Cryptococcus neoformans a pacient přes zavedenou terapii za tři měsíce zemřel pod obrazem mozkového edému.
Klíčová slova:
mykotické infekce – transplantace jater
Infekce představují jednu z nejzávažnějších komplikací všech orgánových transplantací a významně se podílejí na morbiditě a mortalitě pacientů po transplantaci jater. Imunosuprese zvyšuje riziko tkáňové invaze, diseminace a superinfekce, ale zároveň maskuje projevy nemoci. Jedním ze základních cílů transplantační medicíny je prevence infekcí, odhalování atypických projevů onemocnění a jejich léčba v co nejčastějších stadiích choroby. Potransplantační období rozdělujeme z hlediska infekcí na časné (0–30 dnů), střednědobé (31–180 dnů) a pozdní (více než 180 dnů). Dále infekce po transplantaci dělíme dle specifických patogenů. Většina invazivních mykotických infekcí se objevuje během prvních dvou měsíců po transplantaci a jejich výskyt je spojen s vysokou mortalitou dosahující v průměru 50 % (30–100 %). Mezi rizikové faktory invazivních mykotických infekcí patří retransplantace, potřeba většího množství krevních derivátů, fulminantní jaterní selhání, ikterus s hladinou bilirubinu nad 180 µmol/l, choledochojejunoanastomóza, předoperační hospitalizace (zejména pobyt na jednotce intenzivní péče), předoperační použití širokospektrých antibiotik a kolonizace sputa, moči, žluči nebo rány během prvních tří dnů po transplantaci [1,2,12]. Etiologicky se většinou jedná o infekce způsobené Candida spp. (70–80 %) a Aspergillus spp. (10–15 %). Po ortotopické transplantaci jater (OTJ) je vyšší incidence kandidových infekcí na rozdíl od transplantací plic, kdy je vyšší riziko aspergilových infekcí [10]. Mykotické infekce provázející transplantace solidních orgánů jsou častou příčinou morbidity a mortality. Jejich incidence po transplantaci ledvin je kolem 5 % oproti 40 % po jaterní transplantaci. V 80 % jsou etiologickým agens kandidy a aspergily a více než 80 % vzniká do dvou měsíců po transplantaci [11]. Mezi méně časté etiologické agens patří Cryptococcus neoformans, Blastomyces dermatitis, Coccidioides iritis, Histoplasma capsulatum, Pneumocystis jitroveci [1,2]. Cladophialophora bantiana a Fonsecaea compacta jsou velmi vzácnými příčinami těžkých mykotických infekcí, které jsme diagnostikovali u dvou našich pacientů po OTJ. Cladophialophora bantiana způsobuje nejčastěji mozkovou infekci, může postihovat rovněž plíce a kůži. U většiny nemocných infekce plic předchází infekci mozku nebo jsou infekce obou orgánů současně. Při postižení mozku dochází k tvorbě černých, nekrotických ložisek v mozku, tvorbě černého hnisu a černého mozkomíšního moku. Patogeny se do mozku dostanou obvykle krví nebo lymfatickým systémem, možné je i přímé šíření. Klinicky se postižení projevuje hemiparézou, způsobuje tonické křeče, bolest hlavy, horečku a dokonce se mohou vyskytnout i změny chování nebo meningeální příznaky, pokud jsou postiženy plíce, tak může být přítomen kašel, dušnost a bolest na hrudi [3,9]. Pro diagnostiku bývá nejdůležitější průkaz z bioptického vzorku s histologickým obrazem granulomatózního zánětu, velkobuněčné vaskulitidy a nálezu částí hub. Černé houby můžeme z bioptického vzorku rovněž vykultivovat (obr. 1). Ložiska v plicích a mozku lze prokázat výpočetní tomografií (CT). Neléčená infekce vede ke smrti během několika týdnů, měsíců nebo vzácně i během několika let. Terapie je založena na kombinaci antimykotik, chirurgické intervenci a snížení imunosupresivní léčby [3]. V literatuře bylo dosud popsáno více než 70 případů invazivních infekcí způsobených Cladophialophora bantiana [3–8]. Patogen se vyskytuje na celém světě, i když infekce jsou častěji v subtropických oblastech [3]. Asi u poloviny nemocných jde o jinak zdravé jedince, častěji byla černá plíseň popsána u mladých mužů [3,4]. U druhé poloviny jde o nemocné s jiným onemocněním, jako například maligní onemocnění, stav po transplantaci solidních orgánů, poruchy imunity primární i sekundární, uživatele drog, pacienty po operaci hlavy a páteře [3,5,8]. V antimykotické léčbě je ke zvýšení efektu možná kombinace antimykotik, v publikovaných experimentálních pracích byly použity kombinace terbinafinu s azolovými antimykotiky, echinokandinu s amfotericinem B nebo azolovými antimykotiky, flucytosin v kombinaci s amphotericinem B, introconazolem nebo posaconazolem [3].
Obr. 1. Cladophialophora bantiana – vpichová kultura a mikrokultura na Sabouraudově agaru. Fig. 1. Cladophialophora bantiana – the puncture culture on the Sabouraud´s soil. 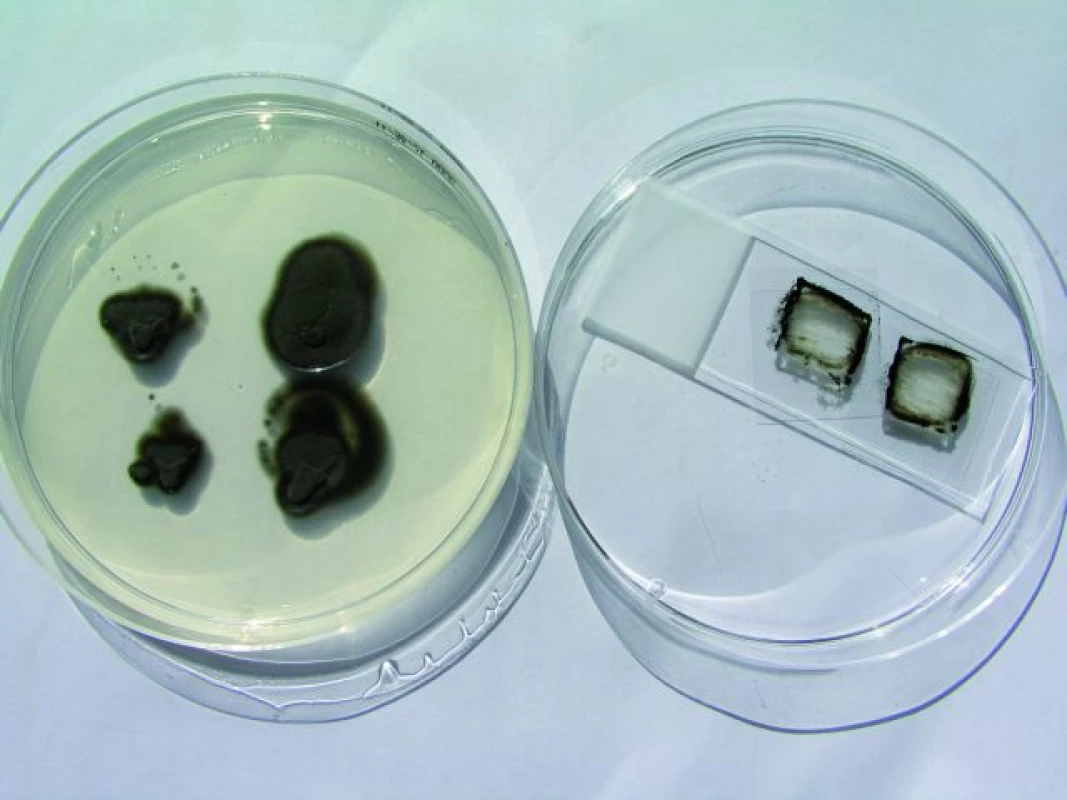
Chromoblastomykóza je lokalizovaná podkožní mykóza, která je způsobená některými houbami obsahujícími melaninový typ pigmentu. Většinou se vyskytuje v tropických a subtropických klimatech. Nejčastěji se objevuje na dolních končetinách ve formě verukózních lézí či vředů. Chromatoblastomykóza byla poprvé popsána v Brazílii roku 1914 německým lékařem Maxem Rudolfem. Chromatoblastomykózu způsobuje několik druhů hub, mezi něž patří nejčastěji: Fonsecaea pedrosoi, Phialophora verrucosa, Cladophialophora carrionii, Fonsecaea compacta. Léčba zahrnuje jak chirurgickou intervenci, tak celkovou antimykotickou terapii. V terapii bývá doporučován voriconazol, posaconazol, itraconazol samostatně nebo v kombinaci s flucytosinem či kombinace flucytosinu s amphotericinem B [14].
Kryptokokóza je infekce způsobená houbou Cryptococcus neoformans. Infekce se vyskytuje celosvětově a častěji postihuje osoby s porušenou imunitou. Predilekčně postihuje plíce, hematogenním rozsevem se může šířit do mozku, kostí a kůže. U imunokompromitovaných pacientů bývá příčinou meningoencefalitidy, která má vysokou mortalitu. K diagnostice postižení mozku přispívá magnetická rezonance mozku, ale definitivní potvrzení je izolace houby v mozkomíšním moku či krvi a průkaz kryptokokového antigenu [15,18].
Popis případů
U 44letého muže byla v březnu 2010 provedena OTJ pro postupně progredující steatohepatitidu. Nemocný byl poprvé hospitalizován pro krvácení z jícnových varixů v roce 2007, kdy byla stanovena diagnóza jaterní cirhózy, pro recidivu krvácení byla provedena transjugulární portosystémová spojka (TIPS) a transjugulární biopsie jater s nálezem malouzlové cirhózy s těžkou difuzní steatohepatitidou. V potransplantačním období se stav komplikoval dvěma epileptickými paroxysmy (CT mozku bez ložiskových změn) a vzestupem obstrukčních jaterních enzymů v důsledku choledocholitiázy a benigní stenózy Vaterské papily. Při endoskopické retrográdní cholangiografii (ERCP) byla provedena papilosfinkterotomie a extrakce choledocholitiázy. Následně se stav komplikoval třemi kortikosenzitivními rejekcemi v průběhu osmi měsíců po OTJ. Byla upravena imunosupresivní terapie přidáním sirolimu (hladiny 6 µg/l) ke stávající imunosupresivní terapii tacrolimem (hladiny 6 µg/l), mycofenolát mofetilem a glukokortikosteroidy. Jako komplikace vznikl u pacienta steroidní diabetes mellitus, který si vyžádal inzulinoterapii. Osmý měsíc po transplantaci utrpěl pacient poranění pravé horní končetiny popálením chemickými postřiky s rozvojem hlubokých nekróz s následnou bakteriální infekcí a nutností antibiotické terapie. Rok po OTJ byla pro vzestup jaterních testů provedena biopsie s nálezem steatohepatitidy s těžkou makrovezikulární steatózou. Po 13 měsících od OTJ dochází k nechutenství, kašli a průjmům provázenými febrilním stavem a úbytkem na váze (3 kg/3 týdny). V laboratorním vyšetření byl diagnostikován vzestup C-reaktivního proteinu (229 mg/ml), pozitivita protilátek proti cytomegaloviru – anti-CMV IgG, IgM, a na CT byla prokázána lymfadenopatie mediastina a plicních hilů s diseminovaným ložiskovým procesem plic nejasné etiologie. Po zavedení kombinované terapie amoxicilin, aciklovir a fluconazol došlo k poklesu C-reaktivního proteinu a zlepšení klinického stavu. V den vysazení antibiotické terapie vznikla u nemocného těžká pravostranná hemiparéza. Provedené vyšetření (CT) prokázalo vícečetný ložiskový proces mozku (abscesy – největší ložisko parietálně parasagitálně vlevo 30 mm, okcipitálně vpravo 8 mm, vlevo temporálně 8 mm). Zavedená terapie v kombinaci cotrimoxazol, cefotaxim, metronidazol a fluconazol nevedla k regresi mozkového ani plicního nálezu. Proto byla za 14 dní provedena stereotaktická evakuace a biopsie mozkového abscesu s mikroskopickým a kultivačním průkazem Cladophialophora bantiana (obr. 2,3). Stejný patogen byl prokázán i v provedené biopsii ložiskového plicního procesu. Následně byla zavedena léčba voriconazolem a antiedematózní léčba glukokortikosteroidy. Minimální inhibiční koncetrace pro vorikonazol byla 0,125 mg/l, pro amfotericin 0,5 mg/l a pro posakonazol 0,012 mg/l). Ze sérologických markerů byl u pacienta vysoce pozitivní 1, 3-beta-D-glukan (panfungální antigen) – 1 550, 1 596 a 996 pg/ml. Rovněž byla pozitivní tekutina z BAL (108 pg/ml). Imunosupresivní terapie byla redukována na podávání tacrolimu s glukokortikosteroidy. I přes zavedenou léčbu došlo k progresi abscesových ložisek jak v plicích, tak v mozku. Proto byla u pacienta po dvou měsících změněna antimykotická terapie, byl podáván po dobu dalších dvou měsíců v kombinované terapii amphotericin B (čtyři týdny konvenční a následně lipozomální amphotericin B) a posaconazol. Stav si vyžádal další stereotaktickou punkci mozkových abscesů. Následně provedené CT plic prokázalo výraznou regresi plicních ložisek a regresi lymfadenopatie. Nález na magnetické rezonanci mozku byl hodnocen s regresí ložiska parietálně vlevo a se stacionárním obrazem ostatních ložiskových lézí mozku. Funkce jaterního štěpu i při minimální imunosupresi a výše uvedené antimykotické terapii byla dobrá. Pacient byl po necelých pěti měsících hospitalizace propuštěn do domácího ošetření se zajišťovací terapií posaconazolem. Klinicky přetrvávala lehká pravostranná hemiparéza, pacient rehabilitoval chůzi s pomocí. Po dalším měsíci se objevil epileptický paroxysmus se zhoršením pravostranné hemiparézy. Pacient byl opět hospitalizován, byla potvrzena progrese abscesových ložisek mozku. Proto bylo přistoupeno ke třetí stereotaktické punkci a následné drenáži mozkových abscesů a opětovnému zavedení kombinované antimykotické terapie – amphotericin B a posaconazol. Stav se však komplikoval mykotickou sepsí, na kterou pacient zemřel 21 měsíců po transplantaci jater a po osmi měsících terapie mykotické infekce. Pitevní nález potvrdil progresi mykotické infekce v plicích i mozku (obr. 4).
Obr. 2. Cladophialophora bantiana – nativní preparát, zvětšení 10 × 20. Fig. 2. Cladophialophora bantiana – the native preparation, magnification 10 × 20. 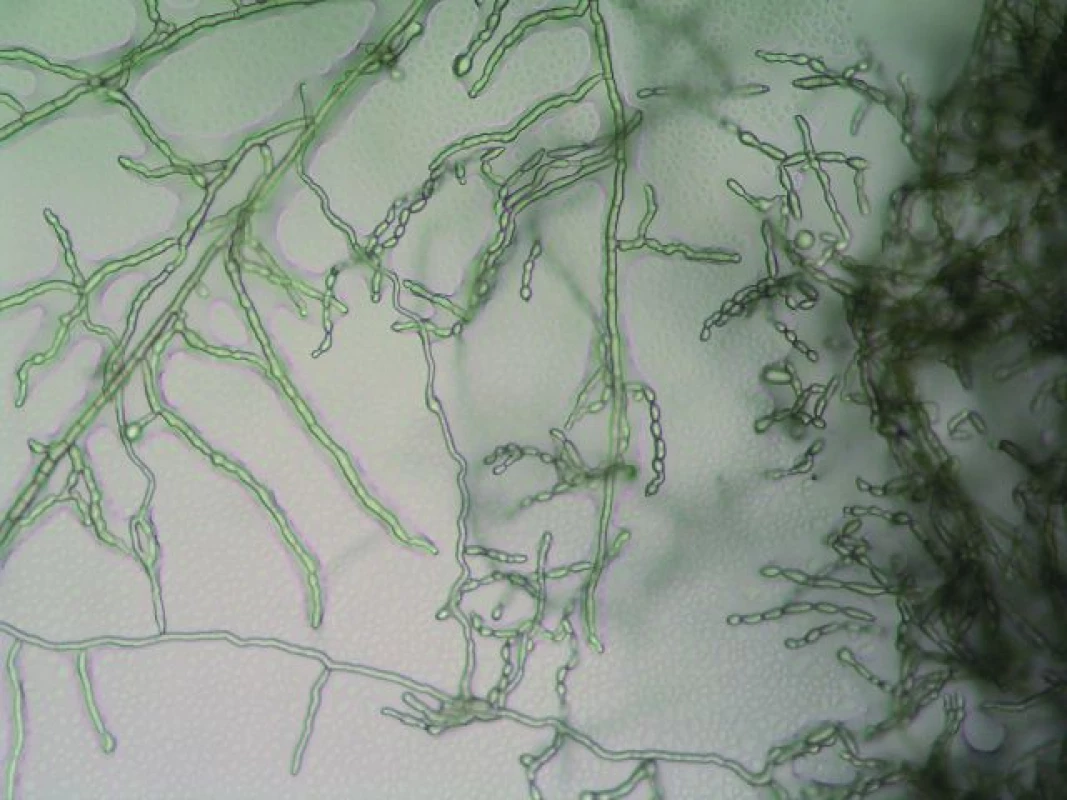
Obr. 3. Cladophialophora bantiana – bioptický vzorek nekrotické mozkové tkáně se strukturami cladophialophor (stříbření plísní dle Grocotta 400×, označeno šipkami). Fig. 3. Cladophialophora bantiana – biopsy specimen of the brain necrotic tissue with cladophiaphor´s pattern (arrows). Grocott´s silver staining, magnification 400×. 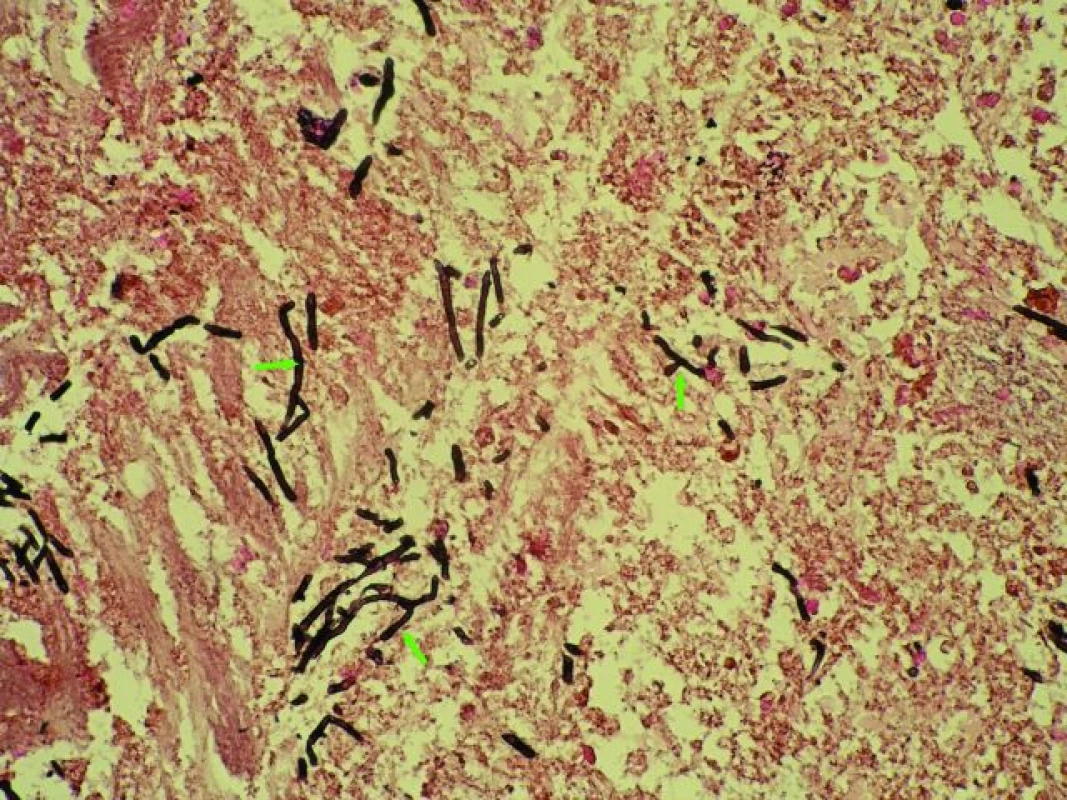
Obr. 4. Cladophialophora bantiana – makroskopický autoptický nález mozku s mykotickými abscesy (označeno šipkou) a okolními regresivními změnami tkáně hemisfér. Fig. 5. Fonsecaea compacta – the giant cells granuloma with brownish structure of Fonsecaea (arrows). Staining: hematoxilin and eosin, magnification 400×. 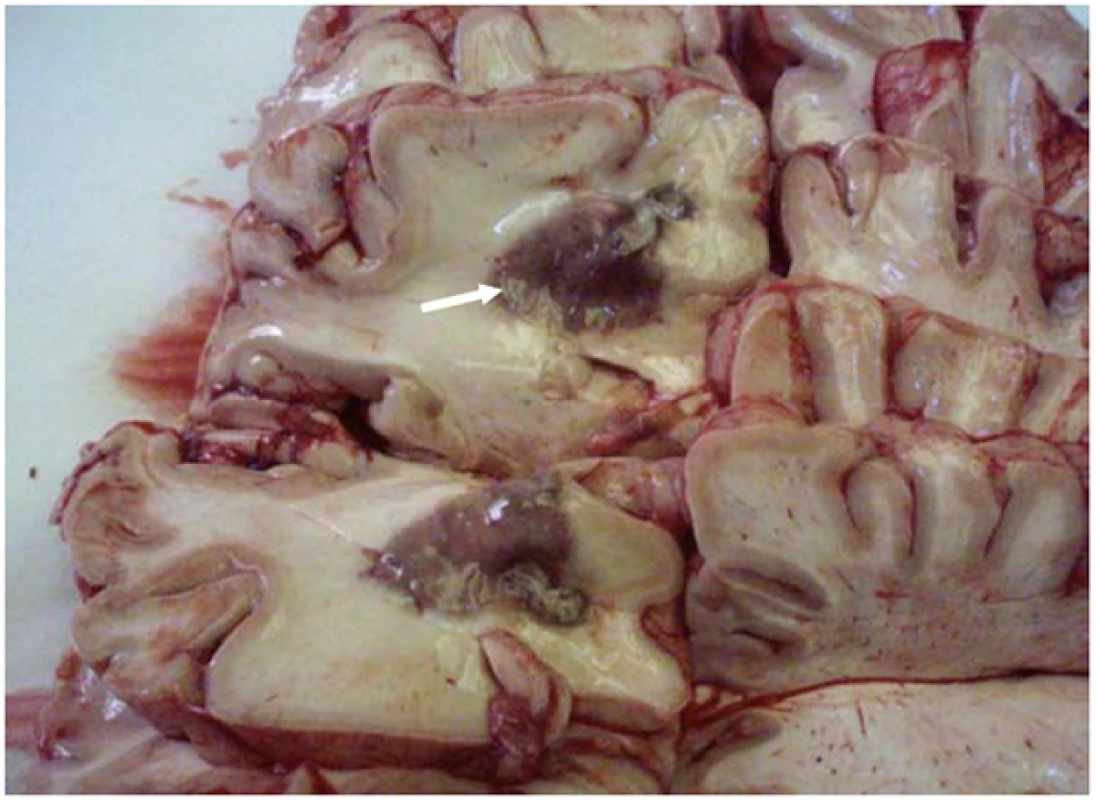
Druhá nemocná, 54letá žena, byla urgentně transplantována pro fulminantní průběh autoimunní hepatitidy v únoru 2004. Pacientka byla léčena metylprednisolonem v dávce 60 mg/den po dobu tří týdnů před transplantací. U nemocné se desátý den po transplantaci rozvinula rejekční, kortikosenzitivní epizoda. Potransplantační průběh byl komplikován nutností dlouhodobé řízené ventilace pro respirační insuficienci. Sedm měsíců po transplantaci se objevily na zevní straně pravého bérce, nad zevním kotníkem, červenofialové infiltráty. Byla provedena biopsie s histologickým nálezem suspektním pro chromoblastomykózu: kůže s uzlovitě nakupenými ložiskovitě purulentně kolikvovanými epiteloidními granulomy se strukturami plísní hnědého zbarvení (obr. 5). Následně byla provedena chirurgická exstirpace těchto infiltrátů. Mikroskopicky a kultivačně byla prokázána Fonsecaea compacta. Po dvou měsících však u pacientky došlo k recidivě těchto infiltrátů na bérci pravé dolní končetiny, rovněž byla provedena exstirpace těchto infiltrátů. K další recidivě došlo za čtyři měsíce, následovala exstirpace a systémová antimykotická terapie fluconazolem po dobu tří měsíců. Po dobu sedmi let již k další recidivě nedošlo a pacientka je i v současné době zcela bez potíží a bez známek infekce.
Obr. 5. Fonsecaea compacta – obrovskobuněčný granulom s nahnědlými strukturami fonsacey (HE 400×, označeny šipkami). Fig. 5. Fonsecaea compacta – the giant cells granuloma with brownish structure of Fonsecaea (arrows). Staining: hematoxilin and eosin, magnification 400×. 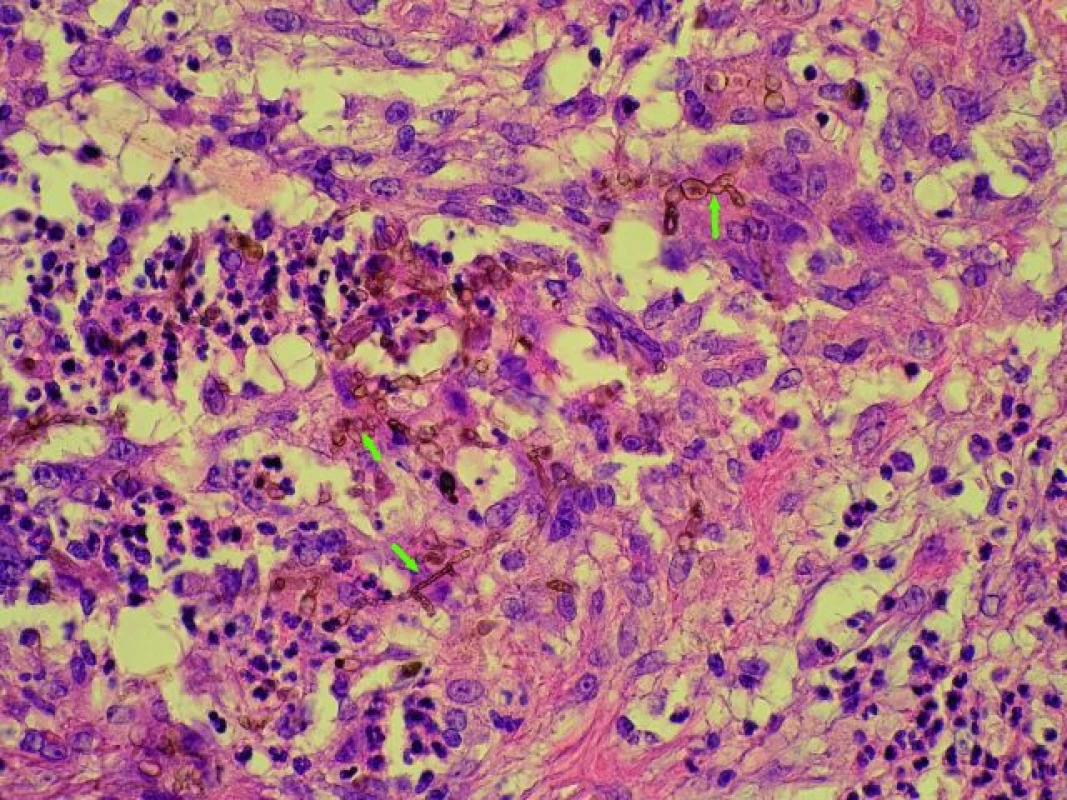
U 56letého muže byla v červnu 2010 provedena provedena OTJ. U pacienta byla v roce 2008 diagnostikována a biopticky ověřena nealkoholická steatohepatitida, která postupně progredovala do jaterní cirhózy. V časném pooperačním období prodělal dvakrát kortikosenzitivní rejekci, proto byl ke stávající imunosupresivní terapii (tacrolimus + mykofenolát mofetil + + glukokortikosteroidy) přidán sirolimus (hladina 6 µg/l). V potransplantačním období se u pacienta rozvinul steroidní diabetes mellitus s nutností inzulinoterapie. Po dobu tří měsíců po transplantaci byla zavedena profylaktická terapie ganciclovirem u anti--CMV IgG negativního příjemce. Za 14 dní po ukončení terapie se u pacienta objevil průjem, teplota, pocení a váhový úbytek (5 kg/3 týdny). V laboratorním obraze byl stav provázen anémií s hemoglobinem 84 g/l a leukopenií 3,5 × 109/l, pozitivitou CMV RNA metodou polymerázové řetězové reakce (PCR). U pacienta byl opět zaveden v terapii ganciclovir a redukována imunosuprese (vysazen sirolimus). Za šest měsíců po OTJ (2/2011) vznikl u nemocného podkožní infiltrát o velikosti 50 mm pod pravým kolenem, který byl excidován. Z histologického vyšetření byla stanovena diagnóza hluboké kožní mykózy. Další podkožní infiltrát se objevil na pravé straně zad za další čtyři měsíce (6/2011). Uzel byl excidován a histologickým vyšetřením byla stanovena diagnóza makrofagicko--purulentního zánětu dermis a podkoží s kolonizací kvasinkovými mikroorganizmy. Mikroskopickým vyšetřením byl diagnostikován Cryptococcus neoformans. Ve stejné době u nemocného vzniklo ještě několik podkožních infiltrátů na bércích dolních končetin. Po provedené punkci s mikroskopickým a kultivačním vyšetřením byl opět potvrzen Cryptococcus neoformans (obr. 6). Pro kožní formu kryptokokózy s možnou hematogenní diseminací byla zahájena terapie lipozomálním amphotericinem B v kombinaci s fluconazolem podobu 30 dnů. Kožní infiltráty zcela regredovaly a pacient byl propuštěn do domácího ošetření na zajišťovací terapii fluconazolem. Za další čtyři měsíce (11/2011) vznikla hluboká žilní trombóza levé dolní končetiny s nutností antikoagulační léčby s následnou rekanalizací žilního řečiště. Funkce transplantovaných jater byla a je zcela v normě, nové kožní infiltráty se neobjevily, terapie fluconazolem pokračuje. I při zajišťovací terapii byl slabě pozitivní kryptokokový antigen v séru (latexovou aglutinací) až do dubna 2012, nyní je již opakovaně negativní.
Obr. 6. Cryptococcus neoformans – kvasinkovité struktury kryptokoků s PAS + hlenovou kapsulou (barvení PAS 400×, označeny šipkami). Fig. 6. Cryptococcus neoformans – yeast like cryptococcus pattern with PAS positivity and mucus capsule (arrows). Staining: PAS, magnification 400×. 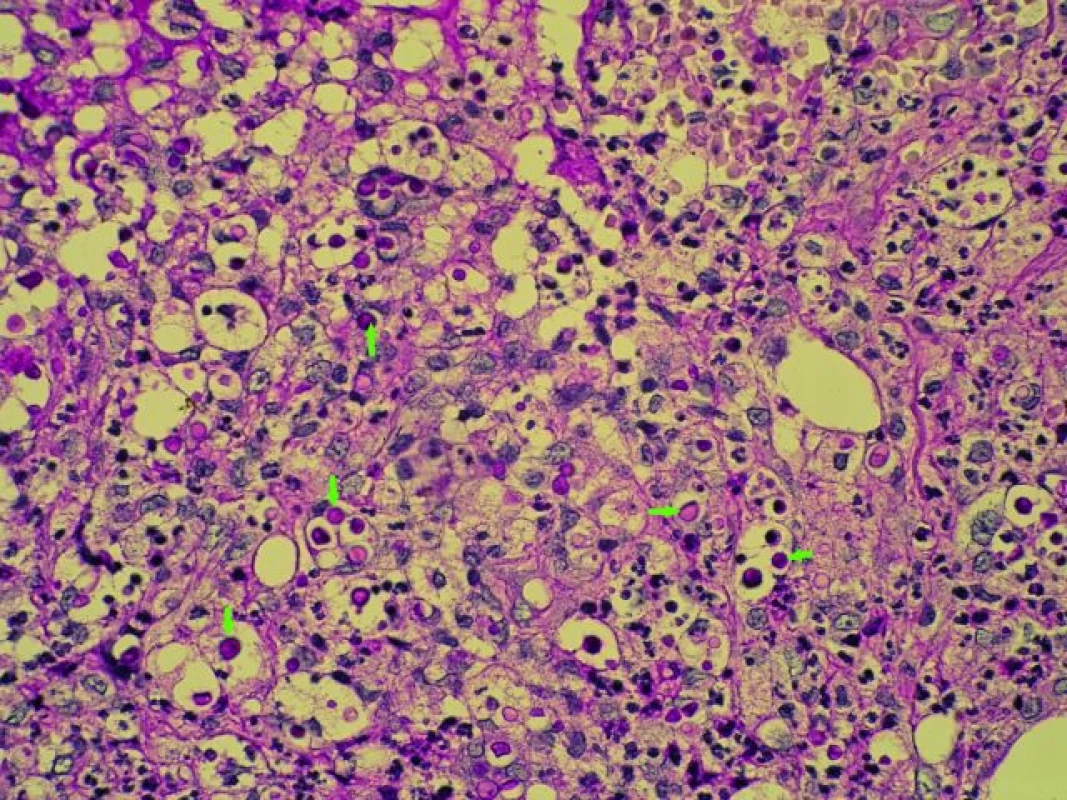
Ve čtvrtém případě šlo o 56letého muže, který byl od roku 1998 sledován pro primární biliární cirhózu. Postupná progrese onemocnění vedla u nemocného k opakovanému krvácení z jícnových varixů s nutností založení TIPS v březnu roku 2001. Tento výkon byl komplikován perforací jaterní žíly s nutností operační revize. Následně pro opakované krvácení z jícnových varixů byl u nemocného zaveden TIPS v květnu 2001. Vzhledem k progresi základního onemocnění byla u pacienta v říjnu 2001 provedena OTJ. Pooperační průběh byl zcela bez komplikací a pacient byl 24. den propuštěn do domácího ošetření. Od 28. pooperačního dne se rozvíjel subfebrilní stav, zmatenost a následně vznikl epileptický záchvat, pro který byl pacient hospitalizován. U pacienta byla pomocí rentgenologických vyšetření stanovena diagnóza oboustranné bronchopneumonie a na základě výsledku magnetické rezonance mozku bylo vysloveno podezření na neuroinfekci, diferenciálně diagnosticky byla zvažována virová encefalitida. Provedená virologická vyšetření však diagnózu nepotvrdila. Stav nemocného i přes antibiotickou a antivirovou terapii postupně progredoval do septického šoku a pacient zemřel 40. den po OTJ. Na základě patologicko-anatomické pitvy, resp. mikroskopického vyšetření mozku post mortem, byla stanovena diagnóza kryptokokové infekce. V mozku a plicích byly nalezeny buněčné elementy, leukocyty, četné opouzdřené blastospory svědčící pro kryptokokovou infekci.
Pátý nemocný, 31letý muž, byl transplantován pro progresi jaterní cirhózy při primární sklerotizující cholangitidě. V časném pooperačním průběhu byl pacient bez komplikací s dobrou funkcí štěpu. K náhlému zhoršení (porucha vědomí – koma) došlo 12. den po transplantaci. Byla provedena lumbální punkce s prokázanou infekci Cryptococcus neoformans (likvor PCR pozitivní – 100% homologie, biopsie z 3. komory – histologicky prokázány mykotické organizmy). V terapii byl podán fluconazol a amphotericin B. Opakované vyšetření likvoru bylo již bez průkazu mykotické infekce. Na CT mozku byl obraz hydrocefalu, proto byla provedena zevní komorová drenáž. Přetrvávalo hluboké koma, které neurolog zhodnotil jako horní mesencefalopontinní syndrom kraniokaudální deteriorace s hlubokým komatem, kvadruplegií a decerebračními křečemi. Pacient zemřel čtvrtý měsíc po transplantaci pod obrazem edému mozku.
Diskuze
Incidence mykotických infekcí je obecně u příjemců transplantovaných jater vyšší než u příjemců jiných orgánů a pohybuje se mezi 14 a 42 % [1,2]. U pacientů po transplantaci orgánů je velmi obtížné infekci rozpoznat, neboť příznaky infekce u imunosuprimovaných pacientů mohou být mitigovány, stejně jako mohou být projevem jiné komplikace [16]. Mykotické infekce po OTJ jsou život ohrožující komplikace. Candida spp. bývá příčinou mykotických invazivních infekcí v 60–90 %, následuje Aspergilus spp. v 5–20 % a Cryptococcus neoformans méně než 3 % [17]. U pacientů s OTJ je poměrně vysoká incidence infekce Pneumocystis jiroveci, a to 4–10 % [17]. Reed et al sledovali 232 pacientů po OTJ, u 58 podali profylaxi amphotericinem B a 174 pacientů ponechali bez profylaxe. Mykotická infekce vznikla u tří transplantovaných (5,17 %) s profylaxí a u 28 pacientů bez profylaxe (16,09 %; p = 0,0432). U pacientů bez antibiotické profylaxe bylo čtyřikrát vyšší riziko mykotické infekce než u pacientů s antibiotickou profylaxí [12].
Léčba mozkových abscesů způsobených Cladophialophora bantiana spočívá v chirurgické intervenci a kombinaci antimykotik. Levin et al popisují případ kombinované terapie lipozomálním amphotericinem B, voriconazolem a flucytosinem s fatálním koncem po 45 dnech. V článku dokumentují od roku 1966 osm případů mozkových abscesů po orgánové transplantaci (dle databáze MEDLINE) – dva u příjemců srdce, čtyři u ledvin, jeden u jater a jeden u kombinované transplantace srdce a plíce. Průměrný věk byl 41 let, čas vzniku od transplantace 9–120 měsíců. V pěti případech byl součástí terapie neurochirurgický výkon. Všichni až na jednoho pacienta byli léčeni amphotericinem B, tři pacienti měli kombinovanou léčbu s itraconazolem nebo voriconazolem s flucytosinem. Mortalita byla 71 % [13].
Bohužel neexistují žádné testy, které určí riziko infekce po transplantaci. Riziko infekce po transplantaci se mění v čase, a to zejména s úpravami imunosuprese. Vždy je nutné zhodnotit riziko infekce a zároveň riziko rejekce transplantovaného orgánu [16]. Incidence invazivních mykotických infekcí u pacientů bez profylaktické terapie je popisována od 5–42 %, v průměru kolem 15 % [17]. Ke snížení invazivní mykotické infekce vede profylaxe fluconazolem, amphotericinem B nebo cotrimoxazolem [17]. Perioperační profylaxe je určena k prevenci postoperační infekce. Selektivní dekontaminace střeva se používá k potlačení aerobní gramnegativní bakteriální populace a plísní v trávicím ústrojí v prevenci pooperačních infekcí. Její nevýhodou je zvýšené riziko grampozitivních bakteriálních infekcí a možný vznik rezistence při dlouhodobém podávání. Dlouhodobá profylaxe je určena ke snížení rizika vzniku závažných komplikací především v prvním půl roce po transplantaci. V prevenci Pneumocystis jiroveci je účinnou a bezpečnou profylaxí podávání cotrimoxazolu [1,2]. Na našem pracovišti podáváme k dekontaminaci střevní v preoperační profylaxi rifaximin v kombinaci s ketoconazolem perorálně v jedné dávce. V dlouhodobé profylaxi podáváme cotrimoxazol perorálně a clotrimoxazol lokálně do dutiny ústní mezi jídly po dobu třech měsíců.
Závěr
Mykotické infekce u orgánových transplantací se vyznačují velmi obtížnou diagnostikou, jsou obtížně léčitelné a mají vysokou mortalitu. Je tedy nutné časné stanovení diagnózy a neprodlené zahájení účinné terapie a zvážení možnosti redukce imunosupresivní terapie. Profylaktická terapie snižuje výskyt mykotických infekcí. Její nevýhodou je možnost zvýšeného výskytu grampozitivních bakteriálních infekcí a možný vznik rezistence při dlouhodobém podávání. Proto jde o kontroverzní téma a jednotlivá transplantační střediska mají odlišná doporučení.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 18. 7. 2012
Přijato: 24. 9. 2012
MUDr. Libuše Husová, Ph.D.
Centrum kardiovaskulární a transplantační chirurgie
Pekařská 53,
65691 Brno
libuse.husova@cktch.cz
Zdroje
1. Drastich P. Infekční komplikace po transplantaci jater. In: Trunečka P, Adamec L. Transplantace jater. Praha: Karolinum 2009 : 196–206.
2. Alexander BD, Hanson K. Infections in the transplant recipient. In: Killenberg PG, Clavien PA. Liver transplant patient. Blackwell publishing 2006 : 439–459, 3rd edition.
3. Li DM, De Hoog GS. Cerebral phaeohyphomycosis-a cure at what lengths? Lancet Infect Dis 2009; 9(6): 376–383.
4. Horré R, De Hoog GS. Primary cerebral infections by melanized fungi: a review. Stud Mycol 1999; 43 : 176–193.
5. Al-Abdely HM, Alkhunaizi AM, Al-Tawfiq JA et al. Successful therapy of cerebral phaeohyphomycosis due to Ramichloridum mackenziei with the new triazole posaconazole. Med Mycol 2005; 43(1): 91–95.
6. Delfino D, De Hoog GS, Polonelli L et al. Survival of a neglected case of brain abscess caused by Cladiophialophora bantiana. Med Mycol 2006; 44(7): 651–654.
7. Harrison DK, Moser S, Palmer CA. Central nervous system infections in transplant recipients by Cladiophialophora bantiana. South Med J 2008; 101(3): 292–296.
8. Takei H, Goodman JC, Powell SZ. Cerebral phaeohyphomycosis caused by Cladiophialophora bantiana and Fonsecaea monophora. Report of three cases. Clin Neurophatol 2007; 26(1): 21–27.
9. Osiyemi OO, Dowdy LM, Mallon SM et al. Cerebral phaeophyphomycosis due to a novel species: report of case and review of the literature. Transplantation 2001; 71(9): 1343–1346.
10. Silveira FP, Husain S. Fungal infections in solid organ transplantation. Med Mycol 2007; 45(4): 305–320.
11. Paya CV. Fungal infections in solid – organ transplantation. Clin Infect Dis 1993; 16(5): 677.
12. Reed A, Herndon JB, Ersoz N et al. Effect of prophylaxis on fungal infection and cost for high – risk liver transplant recipients. Liver Transplantation 2007; 13(12): 1743–1750.
13. Levin PL, Baty DE, Fekete T et al. Cladophialophora bantiana brain absces in solid-organ transplant recipient: case report and review of the literature. J Clin Micro 2004; 42(9): 4374–4378.
14. Pradeep B, Raghavendra T, Chandramohan K et al. Multiple asymptomatic verrucous plaques over the legs. Indian J Dermatol Venerol Leprol 2010; 76(1): 86.
15. Wu B, Liu H, Huang J et al. Pulmonary cryptococcosis in non-AIDS patients. Clin Invest Med 2009; 32(1): E70–77.
16. Fishman J. Infection in Solid Organ Transplant Recipients. Medical Progress. N Engl J Med 2007; 357(25): 2601–2614.
17. Akamatsu N, Sugawara Y, Kanwko S et al. Preemptive treatment of fungal infection based on plasma (1–3) ß-D-glucan levels after liver transplantation. Infection 2007; 35(5): 346–351.
18. Chen SF, Lu CH, Lui CC et al. Acute//subacute cerebral infarction (ASCI) in HIV--negative adults with cryptococcal meningoencephalitis (CM): a MRI-based follow-up study and a clinical comparison to HIV-negative CM adults without ASCI. BMC Neurol 2011; 11 : 12.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článek Kongresový podzimČlánek Somatostatin a jeho využitíČlánek Večer s géniemČlánek Správná odpověď na kvízČlánek OmeprazolČlánek Poděkování recenzentům
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2012 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Kongresový podzim
- Idiopatické střevní záněty v Karlových Varech 2012
- Report from 7th CEURGEM (Central European Gastroenterology Meeting)
- Ohlédnutí za UEGW 2012: Evropská gastroenterologická federace je úspěšný projekt
- OESO – 11th world conference, COMO, Italy, September 1–4th 2012
- EURO-NOTES 2012, August 4–6th 2012, Prague
- VI. beskydský endoskopický workshop
- Epidemiológia infekcie Helicobacter pylori infection v Slovenskej republike
- Clostridium difficile – narastajúca hrozba?
- Změny tělesné hmotnosti a stravovacích zvyklostí obézních pacientů po tubulizaci žaludku – pilotní studie
- Cestování a imunosuprese – na co je také třeba myslet...
- Vybrané gastrointestinálne choroby a nutričné poruchy asociované s osteoporózou
- Somatostatin a jeho využití
- Rozšíří golimumab spektrum anti-TNF léčiv pro idiopatické střevní záněty?
- Porovnání tolerance a kvality přípravy střeva před kolonoskopií pomocí pikosulfát/citrátu hořečnatého nebo polyetylenglykolu v různém dávkování
- První „POEM“ (perorální endoskopická myotomie) v České republice
- Spontánny intramurálny hematóm tenkého čreva ako komplikácia antikoagulačnej liečby
- Vzácné mykotické komplikace po transplantaci jater
- Občanské sdružení pacientů s idiopatickými střevními záněty – Pacienti IBD
- P. Mľkvý, I. Čavarga, A. Mateášik. Endoskopická ablatívna liečba rektosigmoideálnych prekanceróz – pilotná štúdia. Gastroenterol Hepatol 2012; 66(5): 357–363.
- Druhý ročník Ceny prof. Evžena Kasafírka
- Večer s géniem
- 30 rokov od prvej endoskopickej papilosfinkterotómie na území vtedajšieho Československa
- Správná odpověď na kvíz
- Waye JD, Mařatka Z, Armenglo Miró JR. DIGESTIVE ENDOSCOPY: Terminology with definitions and classification of diagnosis and therapy
- Omeprazol
- Poděkování recenzentům
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Somatostatin a jeho využití
- Omeprazol
- Clostridium difficile – narastajúca hrozba?
- Vybrané gastrointestinálne choroby a nutričné poruchy asociované s osteoporózou
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



