-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Experimentální model perianální píštěle na malém laboratorním zvířeti
Experimental model of perianal fistula in a small laboratory animal
Perianal fistula is a common disease usually requiring surgical interventions. New alternative therapeutic methods (stem cells transplantation, fibrin glue, fistula plug) are currently investigated. A suitable animal model is needed to evaluate the effect of these techniques in an experimental study. The aim of this study was to create a clinically adequate model of perianal fistula applicable in the evaluation of new therapeutic methods.
Methods:
Axial caecostomy with 2.5 cm subcutaneous channel was performed in 30 Wistar rats. After the 40-day follow-up, the animals were randomized into three groups. The first group was treated with suture to the fistula opening the second group by fistula tract ligation, and the third was a control group without intervention.Results:
The model was technically feasible in all animals with an average operating time 22 (± 5.1) mins. During the 40-day observation two animals (7%) died on the first and fifth postoperative day, and one animal (3%) had spontaneous fistula healing. In total, 27 animals were randomized. In groups with opening suture (n = 9), tract ligation (n = 12) and in control group (n = 8) fistula healing was observed in three (33%), six (50%) and 0 (0%) animals. Results in interventional groups were in agreement with results of clinical trials.Conclusion:
A clinically adequate model of perianal fistulas suitable for the evaluation of new treatment techniques was created.Keywords:
perianal fistula – an animal model – rat
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
13. 7. 2013Accepted:
7. 8. 2013
Autori: O. Ryska 1; Z. Šerclová 1; O. Měšťák 2; E. Matoušková 3; P. Veselý 2
Pôsobisko autorov: Chirurgická klinika 2. LF UK a ÚVN, Praha 1; Klinika plastické chirurgie 1. LF UK a Nemocnice Na Bulovce, Praha 2; Klinika popáleninové medicíny 3. LF UK, Praha 3
Vyšlo v časopise: Gastroent Hepatol 2013; 67(4): 298-302
Kategória: Klinická a experimentální gastroenterologie: původní práce
Súhrn
Perianální píštěl je časté onemocnění vyžadující chirurgickou intervenci. V současné době jsou předmětem výzkumu nové alternativní terapeutické metody (transplantace mezenchymálních buněk, aplikace fibrinových lepidel nebo zátek – plugů). K ověření účinnosti těchto technik v experimentu je potřebný vhodný model na laboratorním zvířeti. Cílem práce bylo vytvořit klinicky adekvátní model perianální píštěle umožňující hodnocení nových terapeutických metod.
Metody:
U 30 potkanů kmene Wistar byla provedena axiální cékostomie s protažením céka 2,5 cm dlouhým podkožním kanálem simulujícím trakt píštěle. Po 40denním sledování byla zvířata randomizována do tří skupin. V první skupině byla píštěl ošetřena pomocí sutury ústí, ve druhé skupině pomocí podvazu traktu píštěle, třetí skupina byla kontrolní bez intervence.Výsledky:
Model byl technicky proveditelný u všech zvířat v průměrném operačním čase 22 (± 5,1) min. Během 40denního sledování dvě zvířata (7 %) uhynula první a pátý den po založení cékostomie a u jednoho zvířete (3 %) došlo ke spontánnímu zhojení píštěle. Randomizováno bylo tedy celkem 27 zvířat. Ve skupinách se suturou ústí (n = 9), podvazem traktu píštěle (n = 12) a kontrolní skupině (n = 6) došlo ke zhojení u tří (33 %), šesti (50 %) a 0 (0 %) zvířat. Výsledky v intervenčních skupinách jsou ve shodě s výsledky klinických studií.Závěr:
V experimentální práci byl vytvořen klinicky adekvátní model perianální píštěle vhodný pro hodnocení nových léčebných metod.Klíčová slova:
perianální píštěl – zvířecí model – laboratorní potkan
Perianální píštěle jsou frekventním onemocněním s předpokládanou incidencí 1–2,3 na 10 000 obyvatel [1]. Píštěl tvoří vnitřní ústí v oblasti anorekta, trakt procházející perianální či perirektální oblastí a zevní perianální ústí. Právě komunikace se zažívacím traktem vede k přetrvávající sekreci.
Léčba perianální píštěle vyžaduje většinou opakované chirurgické intervence s rozdílnou úspěšností. V 80 % případů se jedná o píštěle kryptoglandulární etiologie, které se obvykle primárně manifestují vznikem perianálního abscesu [2]. Po jeho evakuaci je trakt píštěle drénován trasovací nebo elastickou ligaturou. Po regresi zánětu je možný pokus o eradikaci píštěle. K nejjednodušším metodám eradikace patří sutura vnitřního ústí, fistulotomie nebo fistulektomie, případně postupné vyhojení traktu fistuly dotahováním elastické ligatury. Tyto metody jsou rezervované pouze pro povrchové píštěle nebo píštěle transfinkterické, postihující pouze malou část svěrače (maximálně distální třetinu svěrače) [3]. U ostatních typů píštělí je po této léčbě vysoké riziko inkontinence 6–25 % [4].
Mezi sfinkter šetřící metody léčby patří ošetření vnitřního ústí překrytím slizničním lalokem (rectal advancement flap – RAF) nebo relativně nová jednodušší technika intersfinkterického podvazu traktu píštěle (ligation of the intersphincteric fistula tract – LIFT) [5,6]. Obě metody dosahují dlouhodobého zhojení mezi 40 a 90 %. Jedná se však o techniky výrazně „expert dependentní“ [5,7]. Komplikovanější je hojení v případě perianální Crohnovy nemoci, při které jsou pacienti významně ohroženi inkontinencí a trvalým střevním vývodem. Kombinace konzervativní a chirurgické léčby je u těchto pacientů efektivní asi ve 40–60 % a recidiva píštělí se vyskytuje až u 50 % pacientů [8].
Dalšími metodami jsou alternativní uzávěry traktu píštěle pomocí zátek z biologických materiálů či lepidel (anal fistula plug, fibrinová lepidla) s frekvencí zhojení 40–60 % a v případě Crohnovy kolem 35 % [9–11].
V posledních letech se objevilo i několik studií zabývajících se léčbou pomocí lokálního podání mezenchymálních zárodečných buněk (mesenchymal stem cells – MSCs) [12]. Přítomnost těchto buněk v oblasti píštěle má imunomodulační a protizánětlivý efekt, což může vést k jejímu zhojení [13]. Možným zdrojem MSCs je tuková tkáň. Po purifikaci mohou být zárodečné buňky aplikovány do perifistulární tkáně nebo do traktu píštěle autologně, tedy bez nutnosti imunosuprese [14].
Léčba perianálních píštělí je obtížná a stále se zkoušejí nové techniky a jejich kombinace ve snaze zvýšit jejich úspěšnost. K experimentálnímu hodnocení a vývoji nových metod je nezbytný klinicky adekvátní model píštěle. Tento model by měl být jednoduchý, snadno reprodukovatelný a zatížený minimální morbiditou a mortalitou. Píštěl musí mít vnitřní ústí v zažívacím traktu, vlastní trakt a zevní ústí. Vytvořená píštěl by neměla přerušit kontinuitu zažívacího traktu, i když s ním musí komunikovat, a nemělo by docházet k jejímu spontánnímu zhojení [15]. Píštěl musí být snadno vyšetřitelná. Poloha a trakt píštěle by měly umožňovat aplikaci zátek (plugu) nebo suspenze (fibrin, buněčná suspenze MSCs) do lumina, resp. do perifistulární tkáně. U experimentálního modelu perianální píštěle by mělo po běžně používaném chirurgickém ošetření docházet ke zhojení ve frekvenci obdobné jako v klinické praxi.
Cílem práce bylo vytvořit experimentální model perianální píštěle, který umožňuje hodnocení nových terapeutických metod (transplantace MSCs). Sekundárním cílem bylo ověřit klinickou adekvátnost modelu.
Materiál a metoda
K experimentu bylo použito celkem 30 potkanů kmene Wistar váhy 250–350 g.
Zvířata byla sedována a relaxována intramuskulárním podáním tiletamin hydrochloridu, zolazepam hydrochloridu (Zoletil, Virbac, ČR) s xylazinem (Rometar, Bioveta, a. s., ČR) ve směsi Zoletil 5 ml + Rometar 2% 7 ml + fyziologický roztok (8 ml) v dávce 0,1 ml/200 g váhy zvířete vždy minimálně 30 min před začátkem operace. Po fixaci na zádech a přípravě operačního pole byla provedena krátká (2,5–3cm) střední laparotomie. Slepá část céka byla protažena fascií a svalem do podkoží cca 0,5 cm laterálně od laparotomie. Cékum pak bylo protaženo 2,5 cm dlouhým podkožním kanálem, simulujícím trakt píštěle, do vzdálenosti 3 cm od laparotomie, kde bylo kožní incizí vytaženo ven, otevřeno a fixováno jednotlivými stehy ke kůži (Vicryl, 4/0) jako axiální cékostomie. Po kontrole krvácení byla laparotomie uzavřena po vrstvách (obr. 1).
Obr. 1. Otevřená píštěl v kontrolní skupině (14. pooperační den). Šipka znázorňuje podkožní trakt píštěle směrem od céka k zevnímu ústí. Fig. 1. Open fistula in the control group (14th postoperative day). The arrow shows the subcutaneous fistula tract from caecum to the external opening. 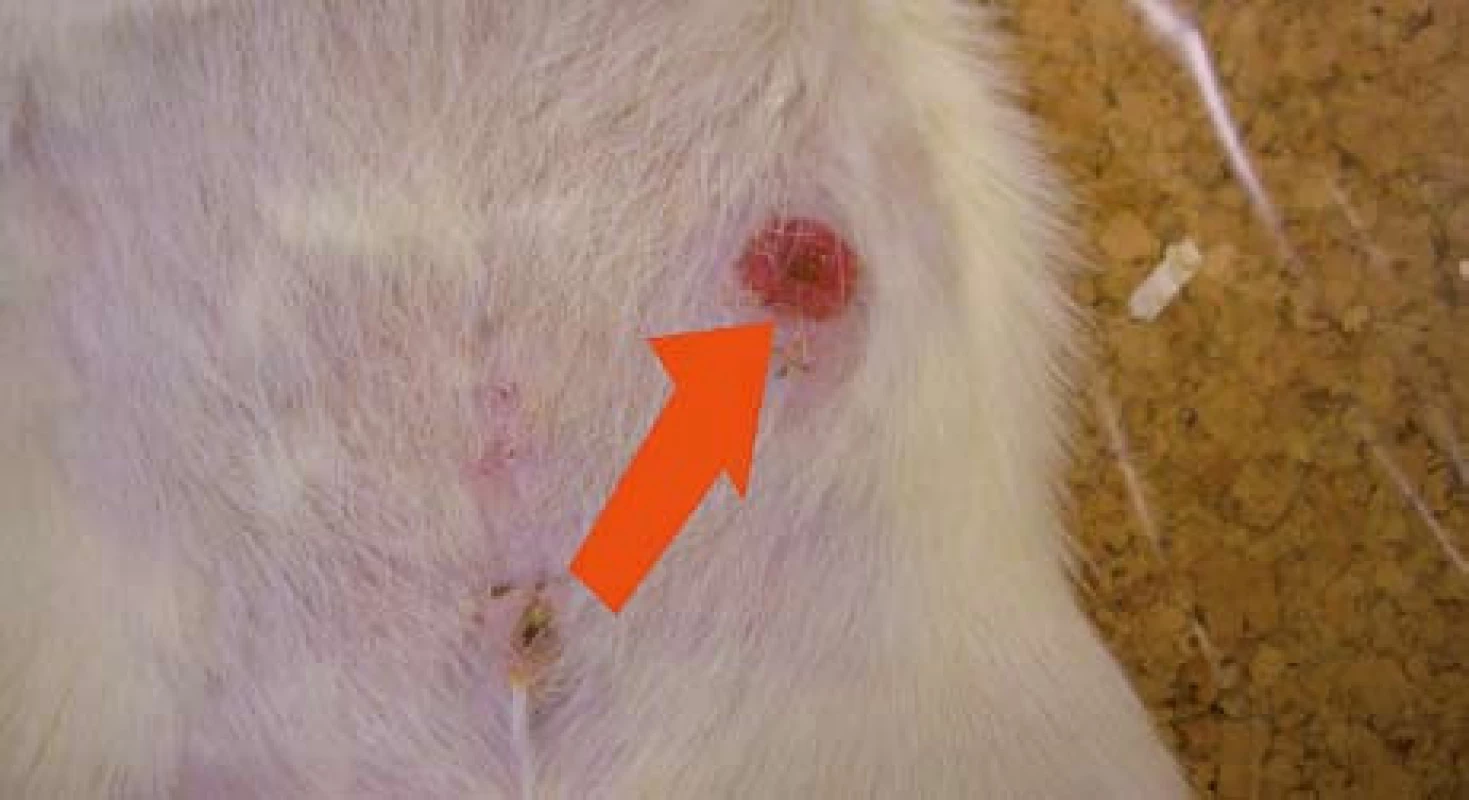
Zvířata byla uložena zpět do chovné nádoby s neomezeným přísunem vody a krmiva. Tímto způsobem byla vytvořena samostatná skupina modelu perianální píštěle.
Po 40 dnech byli potkani vyšetřeni a celkem 27 z nich (dvě zvířata zemřela, jednou došlo ke spontánnímu zhojení viz níže) bylo randomizováno do tří skupin. V první skupině byla u devíti zvířat provedena prostá sutura ústí píštěle jednotlivými stehy (Vicryl, 3/0) (obr. 2). Ve druhé skupině byla u 12 zvířat podvázána píštěl pomocí opichu jednoduchým stehem (Vicryl 3/0) v polovině podkožního traktu (simulace metody LIFT) (obr. 3). Třetí skupina (šest potkanů) byla kontrolní, bez intervence.
Obr. 2. Píštěl ošetřená suturou ústí. Pooperační stav. Fig. 2. Fistula treated by suture of external opening – postoperative finding. 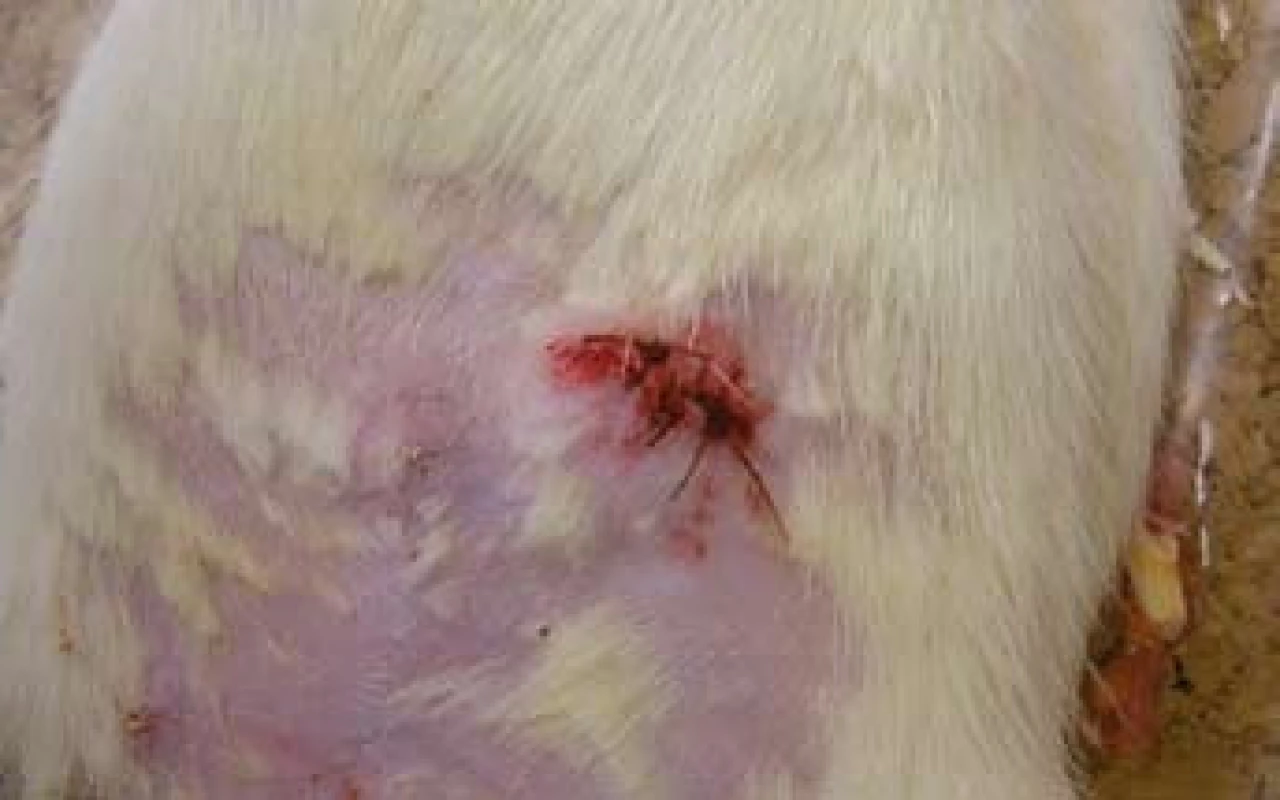
Obr. 3. Píštěl ošetřená podvazem traktu. Stav po operaci. Fig. 3. Fistula treated with fistula tract ligation – postoperative finding. 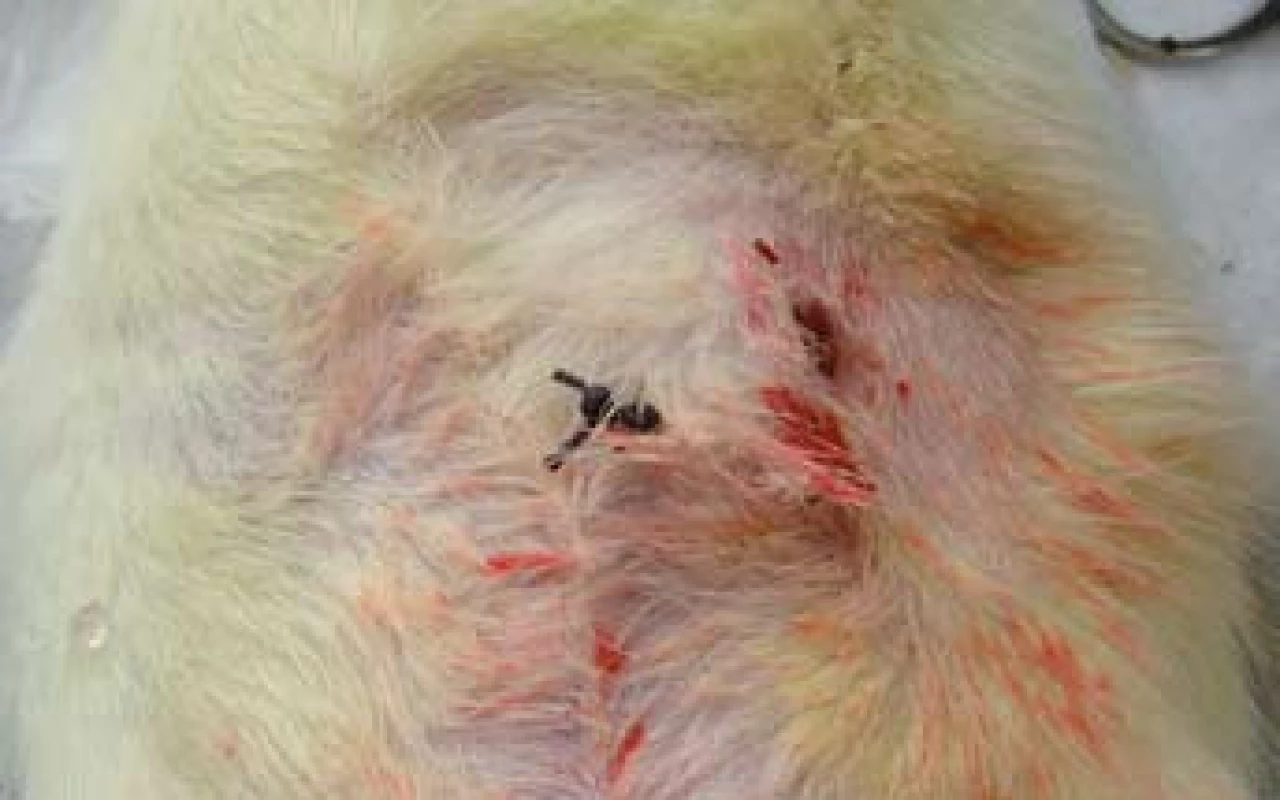
Hodnocení zhojení píštěle probíhalo v krátké celkové inhalační anestezii (Isoflurene, Piramal Healthcare, UK) podle kritérií Americké gastroenterologické asociace (AGA). Sterkorální nebo purulentní sekrece ze zevního ústí při kompresi byla považována za otevřenou píštěl [16]. U dvou zvířat byla provedena fistulografie k ověření kontinuity zažívacího traktu.
Po ukončení follow-up byla zvířata utracena podáním letální dávky Thiopentalu (PharmaSwiss, ČR).
Pokusy probíhaly v Institutu klinické a experimentální medicíny v Praze po schválení etickou komisí v souladu se Zákonem č. 246/1992 Sb., Na ochranu zvířat proti týrání. Intervenční skupiny byly srovnány s kontrolní skupinou pomocí Fischerova exaktního testu.
Výsledky
Model píštěle byl technicky proveditelný u všech 30 operovaných zvířat. Operační výkon trval průměrně 22 (± 5,1) min. Celkem dvě (7 %) zvířata uhynula první, resp. pátý pooperační den. Ostatní zvířata prospívala a přibývala na váze. U jednoho (3 %) zvířete došlo ke spontánnímu zhojení píštěle. Ostatní píštěle zůstaly otevřené a průchodné pro sondu. Střední délka follow-up byla u modelové skupiny 41 dnů (23–98). Fistulografie provedená měsíc od vytvoření modelu potvrdila průchodnost píštěle se zachovanou kontinuitou zažívacího traktu (obr. 4).
Obr. 4. Fistulografie provedená 30. pooperační den u kontrolní skupiny. Zobrazena délka traktu píštěle a cékum se zachovanou kontinuitou střevní pasáže. Fig. 4. Fistulography (30th postoperative day) in the control group. The length of the fistula tract and the continuity of the gastrointestinal tract is visible. 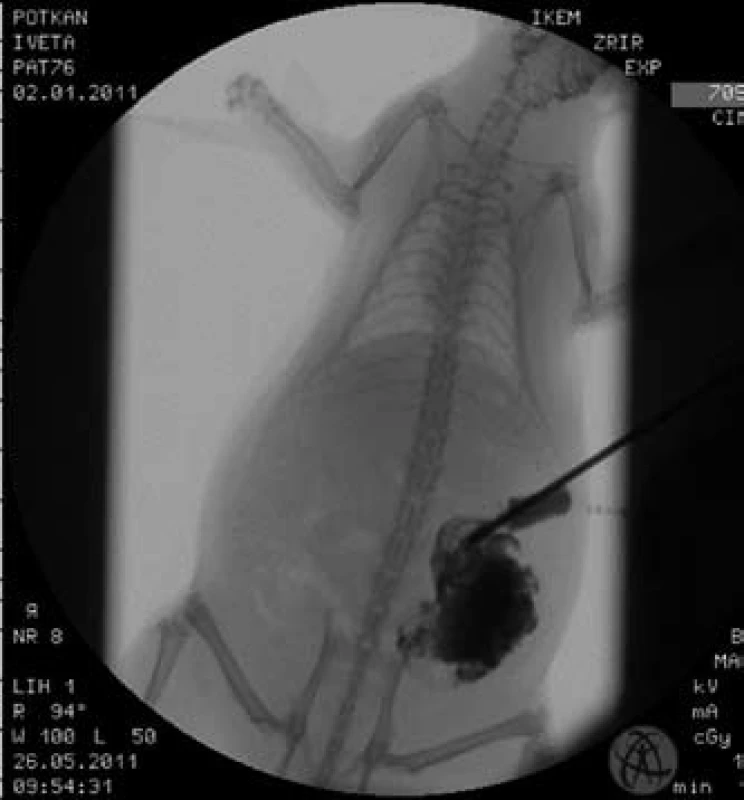
Po vytvoření modelu se u zvířat intermitentně objevil odchod řídké stolice píštělí. Kůže v okolí zevního ústí byla přechodně macerovaná.
Po vyloučení zmíněných tří zvířat bylo randomizováno celkem 27 potkanů. Ve skupině s jednoduchou suturou ústí (n = 9) se píštěl zhojila ve třech případech (33 %). Ve skupině s podvazem píštělového kanálu (n = 12) došlo ke zhojení u šesti (50 %) zvířat (obr. 5). Po intervenci neuhynulo ani jedno ze zvířat. V kontrolní skupině (n = 6) nedošlo ani v jednom z případů ke zhojení píštěle nebo k úmrtí. Frekvence zhojení píštěle byla vyšší v intervenčních skupinách ve srovnání s kontrolní skupinou, tento rozdíl byl u potkanů po podvazu traktu píštěle na hranici signifikantnosti (p = 0,05) (tab. 1).
Obr. 5. Zhojená píštěl 62. den po podvazu fistulárního traktu. Fig. 5. Healed fistula 62nd after fistula tract ligation. 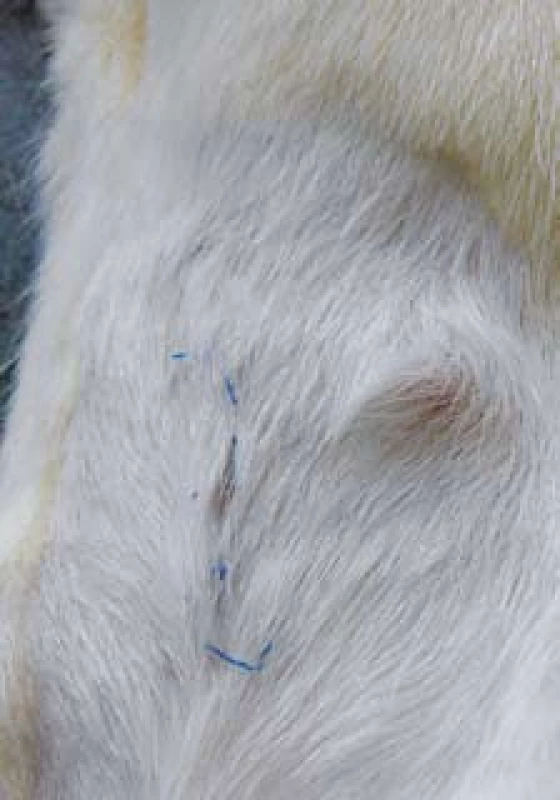
Tab. 1. Souhrn výsledků ve skupině modelu píštěle a jednotlivých intervenčních skupinách a kontrolní skupině po randomizaci. Tab. 1. Summary of the results in the group with fistula model and each intervention groups and control group after randomization. 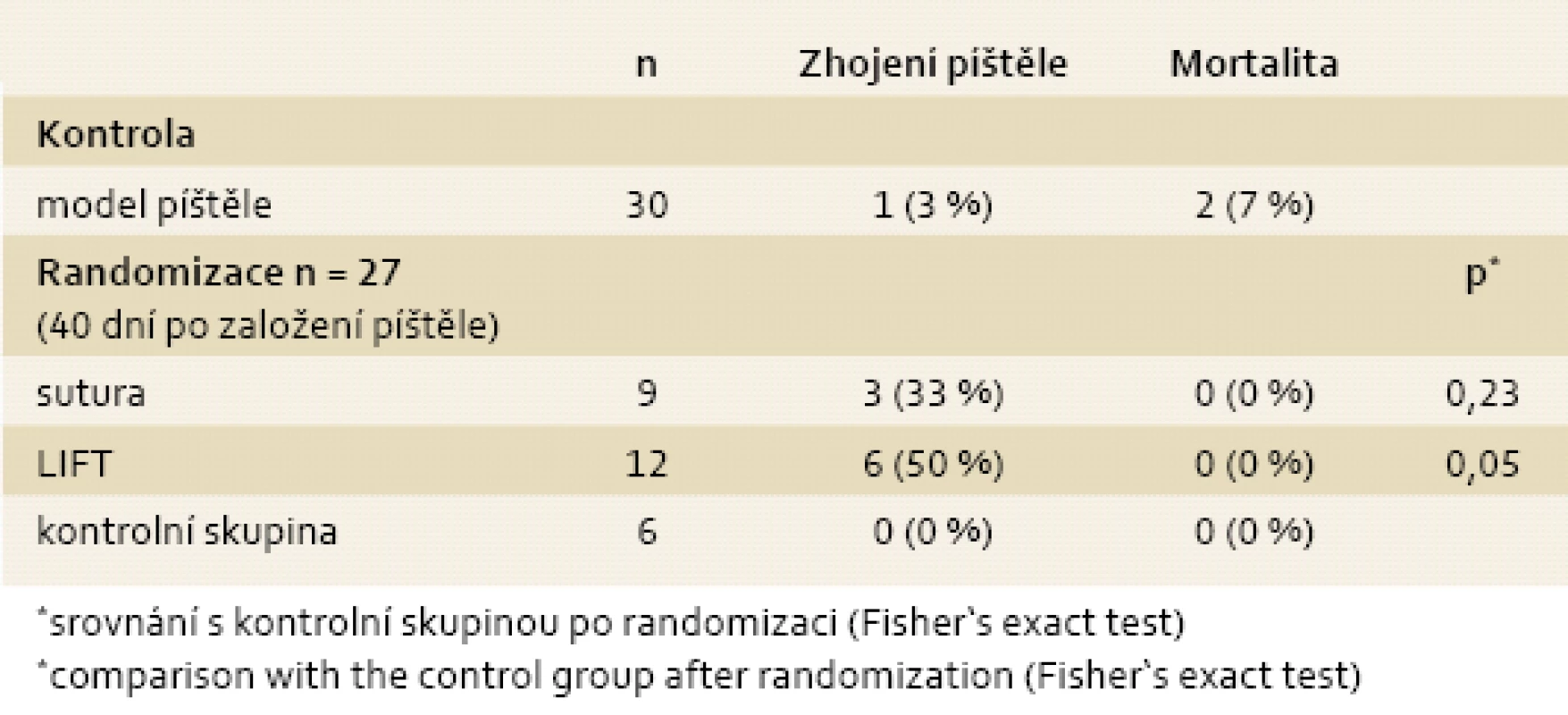
Medián follow-up po randomizaci byl 39 (14–62) dnů. Při pozitivním testu píštěle podle kritérií AGA byl při kompresi nejčastěji pozorován odchod stolice s purulentní příměsí.
Diskuze
Předmětem současného výzkumu jsou nové metody léčby perianálních píštělí jako intrafistulární aplikace zátek (plugů) nebo transplantace MSCs. Druhá zmíněná metoda byla publikována jako první fáze klinického hodnocení v rámci multicentrické prospektivní studie (200 nemocných), ve které bylo prokázáno zhojení píštěle u 50 % pacientů jeden rok po aplikaci buněk v kombinaci s fibrinovým lepidlem [12].
Vzhledem k ne zcela přesvědčivým výsledkům by měly následovat další spíše experimentální studie, které by pomohly popsat proces hojení píštěle po transplantaci mezenchymálních buněk a případně zkoumat modifikace techniky. Jde především o délku přežití MSCs in vitro a in vivo, jejich diferenciaci a eventuální redistribuci do okolí píštěle, případně vhodné způsoby aplikace.
Podrobné funkční a morfologické vyšetření umožňuje pouze zvířecí model. Publikovány byly experimentální modely perianální píštěle na velkých a středních laboratorních zvířatech (prase, králík). Nejčastěji užívanou technikou je perforace anorekta směrem ven s vytvořením transsfikterického kanálu s následným zavedením a ponecháním drénu [17,18]. Tyto modely jsou klinicky adekvátní, nicméně manipulace s velkými zvířaty a časté anestezie při evaluaci píštěle jsou technicky náročné a nákladné a neumožňují vytvořit dostatečně velké skupiny zvířat. V případě hodnocení efektu transplantace MSCs je problematické i zajištění inbredních kmenů nebo adekvátní imunosuprese. Vzhledem k nutnosti většího počtu subjektů v intervenčních skupinách potřebných pro statistické zpracování se naopak jeví výhodné zvolit jako subjekt malé laboratorní zvíře (potkan), které bylo použito i v této práci.
V první fází experimentu byl technicky vytvořen vlastní model píštěle. Celkem bylo zařazeno 30 zvířat tak, aby tuto skupinu bylo možné použít i v dalších studiích při sledování efektu léčby. Ve druhé části pokusu byly po randomizaci použity běžné výše popsané chirurgické techniky k uzávěru píštěle v intervenčních skupinách k ověření klinické relevance modelu. Cílem bylo dosažení obdobně nízké frekvence zhojení, která je po intervenci popisována u pacientů s perineální píštělí. Splnění tohoto cíle bylo podmínkou uznání adekvátnosti modelu.
Bültmann et al [15] k modelu střevní píštěle použili dvě různé techniky (s evertovaným okrajem / bez evertovaného okraje) provedení cékostomie u potkana. Autoři popsali nulovou mortalitu a ani u jednoho ze zvířat nedošlo ke spontánnímu zhojení píštěle. Intermitentní odchod průjmovité stolice stomií byl pozorován v pooperačním období ve shodě s prezentovaným modelem. Tato píštěl však byla popisována jako enterální a nebylo uvažováno o jejím možném využití k experimentálnímu zkoumání hojení perianálních píštělí. Hodnocení míry klinické korelace pomocí efektu ošetření jednoduchými chirurgickými technikami (sutura ústí, podvaz traktu píštěle) nebylo v této studii provedeno. Autoři model doporučují vzhledem k technicky jednoduchému provedení bez další specifikace. Možnou alternativou je vyvedení cékostomie pomocí speciálně upravené kanyly [19]. Jedná se o model sice technicky jednodušší, ale jeho využitelnost je omezená k odběrům vzorků stolice. K hodnocení metod léčby píštěle je pro ponechanou kanylu zcela nevhodný.
Námi prezentovaný model cékostomie (skupina 30 potkanů) splňuje požadovaná kritéria. Je snadno reprodukovatelný, zatížený nízkou mortalitou (7 %) a spontánně dochází ke zhojení píštěle výjimečně (3 %). Není porušena kontinuita zažívacího traktu, všechna zvířata měla střevní pasáž a přijímala potravu, a píštěl je tudíž teoreticky zhojitelná. Přitom byla vytvořena permanentní komunikace píštěle se zažívacím traktem, což znesnadňuje hojení stejně jako u perianálních píštělí. Vytvořená modelová píštěl má vnitřní a zevní ústí a vlastní trakt. Trakt zůstává průchodný v dostatečné šířce i délce, což umožňuje využití k testování intraluminálních technik (plugů). Okolí traktu a zevní ústí píštěle je dobře přístupné k aplikaci buněčné suspenze do perifistulárního prostoru. Vnitřní ústí píštěle je dostupné transkutánně či pomocí sondy, není však možné hodnotit techniky, které se používají při transanálním ošetření vnitřního ústí (RAF), což je jedinou nevýhodou modelu. Trakt modelové píštěle je vystlán intestinálním epitelem. Tento faktor je považován za jednu z příčin perzistence perianální píštěle u pacientů s idiopatickým střevním zánětem [20].
V rámci hodnocení míry klinické korelace byla píštěl ošetřena dvěma základními chirurgickými technikami. Při prosté sutuře ústí píštěle dochází v klinické praxi ke zhojení ve 40–60 %. Hojení je výrazně horší u píštělí vzniklých na podkladě Crohnovy choroby [21,22]. Tomu odpovídá i výsledek v prezentované intervenční experimentální skupině, kde došlo po sutuře ústí ke zhojení pouze u třetiny zvířat. Metoda podvazu traktu píštěle (LIFT) vede ke zhojení průměrně u 60 % pacientů [6,7,23]. V hodnocené experimentální skupině to bylo u 50 % zvířat, což je vzhledem k velikosti souboru odpovídající. Do skupiny s plánovaným podvazem traktu bylo primárně zařazeno více zvířat pro předpokládanou nižší úspěšnost této léčby. Proto vznikly početně rozdílné skupiny. I když frekvence zhojení v intervenčních skupinách byla vyšší než ve skupině bez intervence, chirurgická eradikace píštěle nebyla uspokojivá (33–50 %) stejně jako v humánní medicíně.
S ohledem na tyto výsledky lze model označit za klinicky adekvátní ke zkoumání metod léčby perianálních píštělí. Vzhledem k přítomnosti intestinálního epitelu v traktu píštěle a horší tendenci k hojení může model simulovat i perianální postižení u pacientů s Crohnovou chorobou.
Závěr
V experimentální studii byl vytvořen jednoduchý model perianální píštěle na malém laboratorním zvířeti. Tento model je vhodný pro hodnocení nových technik léčby, jako jsou transplantace MSCs, aplikace fibrinového lepidla nebo plugu. Klinický korelát modelu byl ověřen ošetřením základními chirurgickými technikami s výsledky odpovídajícími klinické praxi.
Podpořeno grantem IGA: NT 13708.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 13. 7. 2013
Přijato: 7. 8. 2013
MUDr. Ondřej Ryska
Chirurgická klinika
2. LF UK a ÚVN, Praha
U Vojenské nemocnice 1200
160 00 Praha 6
ondrejryska@centrum.cz
Zdroje
1. Dudukgian H, Abcarian H. Why do we have so much trouble treating anal fistula? World J Gastroenterol 2011; 17(28): 3292–3296.
2. Davies M, Harris D, Lohana P et al. The surgical management of fistula-in-ano in a specialist colorectal unit. Int J Colorectal Dis 2008; 23(9): 833–838.
3. Malik AI, Nelson RL. Surgical management of anal fistulae: a systematic review. Colorectal Dis 2008; 10(5): 420–430.
4. Vial M, Parés D, Pera M et al. Faecal incontinence after seton treatment for anal fistulae with and without surgical division of internal anal sphincter: a systematic review. Colorectal Dis 2010; 12(3): 172–178.
5. Soltani A, Kaiser AM. Endorectal advancement flap for cryptoglandular or Crohn's fistula-in-ano. Dis Colon Rectum 2010; 53(4): 486–495.
6. Rojanasakul A, Pattanaarun J, Sahakitrungruang C et al. Total anal sphincter saving technique for fistula-in-ano; the ligation of intersphincteric fistula tract. J Med Assoc Thai 2007; 90(3): 581–586.
7. Yassin NA, Hammond TM, Lunniss PJ et al. Ligation of the intersphincteric fistula tract in the management of anal fistula. A systematic review. Colorectal Dis 2013; 15(5): 527–535.
8. Mizrahi N, Wexner SD, Zmora O et al. Endorectal advancement flap: are there predictors of failure? Dis Colon Rectum 2002; 45(12): 1616–1621.
9. Johnson EK, Gaw JU, Armstrong DN. Efficacy of anal fistula plug vs. fibrin glue in closure of anorectal fistulas. Dis Colon Rectum 2006; 49(3): 371–376.
10. Ky AJ, Sylla P, Steinhagen R et al. Collagen fistula plug for the treatment of anal fistulas. Dis Colon Rectum 2008; 51(6): 838–843.
11. McGee MF, Champagne BJ, Stulberg JJ et al. Tract length predicts successful closure with anal fistula plug in cryptoglandular fistulas. Dis Colon Rectum 2010; 53(8): 1116–1120.
12. Herreros MD, Garcia-Arranz M, Guadalajara H et al. Autologous expanded adipose-derived stem cells for the treatment of complex cryptoglandular perianal fistulas: a phase III randomized clinical trial (FATT 1: fistula Advanced Therapy Trial 1) and long--term evaluation. Dis Colon Rectum 2012; 55(7): 762–772.
13. Puissant B, Barreau C, Bourin P et al. Immunomodulatory effect of human adipose tissue-derived adult stem cells: comparison with bone marrow mesenchymal stem cells. Br J Haematol 2005; 129(1): 118–129.
14. Zuk PA, Zhu M, Ashjian P et al. Human adipose tissue is a source of multipotent stem cells. Mol Biol Cell 2002; 13(12): 4279–4295.
15. Bültmann O, Philipp C, Ladeburg M et al. Creation of a caecostoma in mice as a model of an enterocutaneous fistula. Res Exp Med 1998; 198(4): 215–228.
16. Sandborn WJ, Fazio VW, Feagan BG et al. AGA technical review on perianal Crohn’s disease. Gastroenterology 2003; 125(5): 1508–1530.
17. Buchanan GN, Sibbons P, Osborn M et al. Experimental model of fistula-in-ano. Dis Colon Rectum 2005; 48(2): 353–538.
18. Aungst MJ, Fischer JR, Bonhage MR et al. Rectovaginal fistula model in the New Zealand white rabbit. Int Urogynecol J 2010; 21(7): 885–888.
19. Kloots WJ, van Amelsvoort JM, Brink EJ et al. Technique for creating a permanent cecal fistula in the rat. Lab Anim Sci 1995; 45(5): 588–591.
20. Lunniss PJ, Sheffield JP, Talbot IC et al. Persistence of idiopathic anal fistula may be related to epithelialization. Br J Surg 1995; 82(1): 32–33.
21. Schwandner O, Stadler F, Dietl O et al. Initial experience on efficacy in closure of cryptoglandular and Crohn's transsphincteric fistulas by the use of the anal fistula plug. Int J Colorectal Dis 2008; 23(3): 319–324.
22. Chung W, Ko D, Sun C et al. Outcomes of anal fistula surgery in patients with inflammatory bowel disease. Am J Surg 2010; 199(5): 609–613.
23. Abcarian AM, Estrada JJ, Park J et al. Ligation of intersphincteric fistula tract: early results of a pilot study. Dis Colon Rectum 2012; 55(7): 778–782.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2013 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Letní gastroenterologický koktejl
- Kvíz – známá osobnost
- Manometrie jícnu
- Vzácný typ achalázie jícnu III. typu řešený perorální endoskopickou myotomií (POEM)
- Biopsie nejsou dostatečné pro přesnou diagnostiku neoplazie u pacientů s Barrettovým jícnem
- Úspěšná endoskopická léčba makroskopicky pokročilého adenokarcinomu jícnu u rizikového pacienta
- Etiopatogeneze chronické pankreatitidy
- Inhibitory protonové pumpy: vedlejší účinky a interakce
- Experimentální model perianální píštěle na malém laboratorním zvířeti
- Guidelines for the administration of biological therapy in patients with inflammatory bowel diseases – the amendment to the 2nd editon
- Současnost a budoucnost v léčbě Crohnovy nemoci
- Ulcerózní kolitida komplikovaná tromboembolizmem a toxickým megakolon – existuje souvislost toxického megakolon s antikoagulační terapií?
- Léčba těžké ataky ulcerózní kolitidy – komentář ke kazuistice dr. Mokré
- Problém nemusí být tak jednoduchý, jak se na první pohled jeví – komentář k Doporučení ČGS pro podávání antiagregační terapie kyselinou acetylsalicylovou
- Májové hepatologické dny
- Ostrava Live Endoscopy (OLE) 2013
- Správná odpověď na kvíz
- Autodidaktický test: klinická a experimentální gastroenterologie
- Pentasa Sachet 2 g
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Manometrie jícnu
- Pentasa Sachet 2 g
- Inhibitory protonové pumpy: vedlejší účinky a interakce
- Vzácný typ achalázie jícnu III. typu řešený perorální endoskopickou myotomií (POEM)
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



