-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Hereditárny angioedém ako príčina bolestí brucha
Hereditary angioedema as a cause of abdominal pain
Hereditary angioedema is a rare disease that may have potentially fatal consequences. Despite the fact that recently there is a deeper understanding of the pathophysiology of the disease, it is still a diagnostic challenge. The average time from the start of symptoms to the diagnosis is in avarage 10 to 25 years. The problem is the wide variety of clinical symptoms affecting various organ systems, the progress of the disease in attacks, and also a lack of awaraness of this disease in medical professionals. The aim of this article is to review the pathofysiology, the clinical picture and briefly the current treatment options. The authors also present a case report of a young female patient with a typical clinical picture of hereditary angioedema.
Key words:
hereditary angioedema – C1 inhibitor – edema
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
20. 1. 2014Accepted:
8. 3. 2014
Autoři: K. Hrubišková; P. Jackuliak; J. Payer
Působiště autorů: V. interná klinika LF UK a UN Bratislava, SR
Vyšlo v časopise: Gastroent Hepatol 2014; 68(2): 149-153
Kategorie: Klinická a experimentální gastroenterologie: přehledová práce
Souhrn
Hereditárny angioedém je zriedkavé ochorenie, ktoré môže mať potenciálne fatálne následky. Aj napriek pokrokom v dnešnej dobe, kedy sme sa priblížili k podstate ochorenia, predstavuje ochorenie diagnostický problém. Priemerná doba od začiatku príznakov do stanovenia diagnózy je podľa literárnych údajov 10–25 rokov. Problémom je široké spektrum klinických príznakov postihujúcich rôzne orgánové systémy, priebeh ochorenia v atakoch, pričom mimo ataku patologický nález nenachádzame (okrem laboratórneho nálezu) a tiež minimum informácií o ochorení aj u odbornej verejnosti. Cieľom tohto článku je previesť čitateľa patofyziológiou, klinickým obrazom a stručne súčasnými liečebnými možnosťami. Na záver je prezentovaná kazuistika mladej pacientky s typickým priebehom ochorenia.
Kľúčové slová:
hereditárny angioedém – C1 inhibítor – opuchHereditárny angioedém (HAE) patrí do širokej skupiny vrodených, teda primárnych, imunodeficiencií. Podstatou ochorenia je porucha funkcie C1 inhibítora (C1INH) alebo mutácia faktora XII (Hagemanov faktor). Funkciou C1 inhibítora je inhibícia serínových proteáz. C1INH je hlavným regulačným proteínom klasickej cesty aktivácie komplementu (obr. 1) a pod jeho vplyvom sú aj serínové proteázy MASP-1 a MASP-2. Okrem toho C1INH blokuje kalikreín a faktor XII v kontaktnom systéme, faktor XI a trombín v koagulačnej kaskáde a aktivátor tkanivového plazminogénu a plazmín vo fibrinolytickom systéme (obr. 2) [1]. C1INH sa viaže na reaktívne miesto C1r a C1s, čím ich odštiepuje z väzby na C1q. Blokuje tým štiepenie C4 a C2, a tým aj vznik konvertázy C4b2a a vznik C2 kinínov [2]. Pri chýbaní C1INH dochádza k spontánnej aktivácii C1 zložky komplementu a k nekontrolovanému štiepeniu C4 a C2 a k nadmernej tvorbe C2 kinínov, ktoré zvyšujú cievnu permeabilitu. Nedostatok C1INH vedie aj k zvýšenej tvorbe plazmínu a k následnému uvoľneniu a zvýšeniu koncentrácie bradykinínu. Dnes sa za hlavného mediátora hereditárneho angioedému pokladá práve bradykinín [3]. Podľa najnovších zistení môže byť nadprodukcia bradykinínu spôsobená aj poruchou koagulačného faktora XII, ktorá je podľa súčasných vedomostí podmienená dvoma mutáciami jeho génu [4].
Obr. 1. Cesty aktivácie komplementu [11]. Fig. 1. Activation of the complement [11]. ![Cesty aktivácie komplementu [11].
Fig. 1. Activation of the complement [11].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/061c2c2739c951f8bd016784bcf527f5.jpg)
Obr. 2. Účinky C1 inhibítora [12]. Fig. 2. Effect of C1 inhibitor [12]. ![Účinky C1 inhibítora [12].
Fig. 2. Effect of C1 inhibitor [12].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/6cc09b701e90b1bcc477f12d096bc4af.jpg)
Bradykinín sa viaže na receptory B1 a B2 v cievnom endoteli a táto väzba spôsobuje rozvoľnenie tesných spojení (tight junctions) medzibunkových priestorov a následné uvoľnenie tekutiny z ciev do tkanív. Výsledkom je zvýšená cievna permeabilita a vznik opuchu. B2 receptory sa nachádzajú na všetkých tkanivách tela a zúčastňujú sa procesu bronchokonstrikcie, vazodilatácie a zvýšenej cievnej permeability. Bradykinín je katabolizovaný enzýmami karboxypeptidázou, aminopeptidázou, neuropeptidázou a ACE (angiotenzín konvertujúci enzým) [1].
HAE je autozomálne dominantné ochorenie, gén pre C1INH sa nachádza na 11. chromozóme a gén pre faktor XII na 5. chromozóme. Ochorenie postihuje všetky rasy bez sexuálnej predominancie. Až 25 % mutácií vzniká de novo [5]. Doteraz je známych zhruba 200 druhov mutácií, ktoré zahŕňajú delécie, inzercie alebo poruchy transkripcie [1]. Potomok rodiča, chorého na HAE, má 50 % riziko, že ochorie tiež.
Výskyt HAE sa donedávna udával v pomere 1 : 150 000, v súčasnej dobe, kedy sa zlepšila diagnostika, sa aj výskyt zvýšil na 1 : 10–50 000. Podľa typu poruchy rozlišujeme HAE asociovaný s deficitom C1 inhibítora a HAE s normálnym C1 inhibítorom [4]. Typ I predstavuje ochorenie, kedy na podklade genetickej mutácie vzniká kvantitatívna porucha C1INH s jeho zníženou hladinou v krvi, pri type II sa proteín vytvára v dostatočnom množstve, ale je nefunkčný. Typ III sa označuje aj ako HAE s normálnym C1 inhibítorom a je spôsobený mutáciami Hagemanovho faktora. HAE typ I postihuje 85 % chorých [6].
Klinický obraz
Hlavným príznakom hereditárneho angioedému je opuch. Býva lokalizovaný subkutánne kdekoľvek na tele alebo submukózne v tráviacom, respiračnom alebo urogenitálnom trakte. Opuch je typicky bledý, ohraničený, nesvrbí ani nebolí, nie je asociovaný s koprivkou, vyvoláva pocit napätia (obr. 3). Symptómy sa rozvíjajú postupne v priebehu jednej až niekoľkých hodín, trvajú 48–72 hod a pokiaľ nie sú liečené, po tomto čase odznievajú samovoľne.
Obr. 3. Typický obraz angioedému na tvári (pacientka z ambulancie V. internej kliniky, publikované so súhlasom pacientky). Fig. 3. Clinical picture of angioedema on the face (5. Dpt of Internal Medicine, with agreement of the patient). 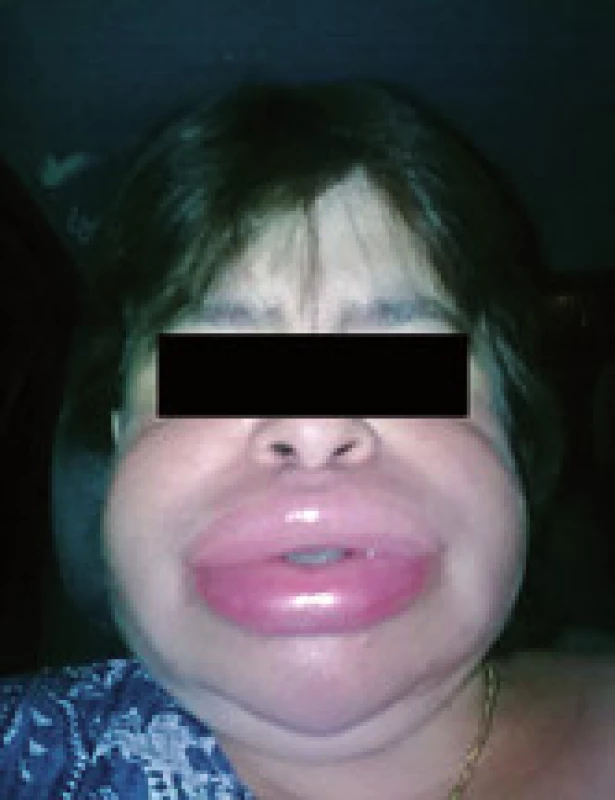
Spúšťačom ataku angioedému môže byť infekcia, mechanický podnet, hormonálne zmeny, stres, operačný výkon, stomatologický výkon, endoskopické vyšetrenie [5]. Mechanický podnet (napr. úder, tlak na jedno miesto) vyvolá angioedém takmer u všetkých postihnutých. Vyskytujú sa aj prodromálne príznaky, ako je pocit napätia alebo mravenčenie v mieste budúceho angioedému. Prvé príznaky HAE sa začínajú objavovať typicky počas puberty, ale nie sú zriedkavé ani u malých detí. Asi 5 % pacientov s laboratórne dokázaným HAE je asymptomatických. Pre tretí typ angioedému je typické, že príznaky sa rozvíjajú neskôr (začiatok väčšinou až v druhej dekáde života). Medzi postihnutými výrazne dominujú ženy, predpokladá sa, že estrogény majú významnú úlohu v ovplyvnení fenotypu ochorenia [4].
Pri postihnutí kože sa môžu opuchy objaviť kdekoľvek na tele, predilekčnými miestami postihnutia sú však končatiny, tvár a genitál. Na koži má angioedém typický obraz popísaný vyššie a je veľmi dôležité odlíšiť ho od iných typov angioedému – predovšetkým od angioedému mediovaného mediátormi z mastocytov. Kardinálnym príznakom tretieho typu angioedému je opuch lokalizovaný predovšetkým v tvári.
Opuch v dýchacích cestách môže viesť k ich úplnej obštrukcii a spôsobiť udusenie. Väčšina dokumentovaných úmrtí u pacientov s HAE vzniká práve na podklade asfyxie v rámci akútneho ataku v horných dýchacích cestách a aj v dnešnej dobe sa HAE spája s úmrtnosťou 15–33 % [7]. Nebezpečný je z tohto hľadiska vznik ataku počas spánku, kedy si pacient neuvedomí prodromálne príznaky ako sú pocit cudzieho telesa, sťažené dýchanie, zhoršenie prehĺtania, chrapot, stridor alebo viditeľný opuch jazyka.
Najväčším diagnostickým problémom bývajú opuchy lokalizované v sliznici tráviaceho traktu. Až jedna tretina pacientov s nediagnostikovaným HAE podstúpila počas života exploratívnu laparotómiu pre podozrenie na náhlu príhodu brušnú [8]. Vznik ataku v GIT sa prejavuje bolesťami brucha, nauzeou, vracaním, hnačkou. Veľký únik tekutiny do GIT môže viesť ku kolapsu. Niekedy je opuch sliznice taký výrazný, že spôsobí až črevnú nepriechodnosť. Diagnostický problém predstavuje fakt, že mimo ataku väčšinou žiadnu patológiu v tráviacom trakte nenájdeme. Pacienti často podstupujú diagnostické endoskopie, ktoré samé o sebe môžu byť spúšťacím faktorom ataku. Často sa týmto pacientom prisudzujú diagnózy rôznych funkčných alebo psychosomatických porúch. Počas ataku je možné zobrazovacím vyšetrením zachytiť prítomnosť voľnej tekutiny alebo obraz opuchu črevnej steny. Vzniká podozrenie na náhlu brušnú príhodu, s ktorou však nekorešponduje negatívny laboratórny nález (negatívne zápalové parametre) a netypický klinický obraz. Závažný problém vzniká, ak náhla brušná príhoda je vyvolávateľom akútneho ataku angioedému alebo naopak – angioedém spôsobí náhlu príhodu brušnú.
Vyskytujú sa aj menej typické prejavy hereditárneho angioedému, ktoré vyplývajú z postihnutia rôznych iných orgánových systémov – rinorea pri opuchu v nosohltane, dysfágia pri opuchu v pažeráku, pleurálny výpotok, pľúcny edém, retencia moču pri opuchu sliznice močového mechúra, parestézie až prechodné parézy pri edéme v CNS, edém papily až amauróza pri edéme nervus opticus [8].
Diagnostika a liečba
Diagnostika a liečba patria do rúk klinického imunológa, preto ich uvedieme iba v prehľade.
Podozrenie na HAE by malo vzniknúť pri typickej anamnéze recidivujúcich bledých nesvrbivých opuchov na koži alebo pri nevysvetliteľných a opakujúcich sa záchvatoch bolestí brucha a „dyspeptických ťažkostí“. Pri postihnutí dýchacích ciest býva diagnostika rýchlejšia, keďže stav si vyžaduje urgentnú intervenciu lekára. Základným screeningovým vyšetrením je vyšetrenie hladiny C4 zložky komplementu, ktorá je takmer vždy znížená, a to aj mimo ataku. Diagnózu a typ HAE potvrdí vyšetrenie hladiny a funkcie C1inhibítora (tab. 1). V anamnéze sa zameriavame na typické príznaky, výskyt ochorenia a náhle úmrtia v rodine. Vyšetrenie môžeme doplniť genetickým vyšetrením, ktoré potvrdí mutáciu v géne pre C1INH alebo v géne pre Hagemanov faktor. Pri pochybnostiach alebo nejednoznačných nálezoch diagnostický algoritmus zopakujeme počas ataku angioedému. Pri treťom type angioedému poruchu funkcie C1 inhibítora nenájdeme a diagnózu potvrdí až genetické vyšetrenie mutácií faktora XII.
Tab. 1. Laboratórne nálezy typické pre hereditárny angioedém. Tab. 1. Laboratory findings typical for hereditary angioedema. 
V ostatných rokoch sa terapeutické možnosti výrazne zlepšili, čo určite súvisí aj s objasnením patogenézy ochorenia. Liečebné intervencie môžeme rozdeliť na liečbu akútneho ataku a dlhodobú profylaxiu. Samostatnú skupinu tvorí profylaxia pred plánovanými operačnými alebo intervenčnými výkonmi (krátkodobá profylaxia). V akútnom ataku máme k dispozícii liečbu inhibítorom bradykinínových receptorov (icatibant, Firazyr), liečbu inhibítorom plazmatického kalikreínu (ecallantide, Kalbitor) alebo substitúciu samotného C1INH.
V prípade, že pri akútnom ataku nemáme žiadnu z týchto terapeutických modalít k dispozícii, je možné podať aj čerstvú mrazenú plazmu, ktorá je zdrojom C1INH, avšak súčasne obsahuje aj iné zložky komplementu a kalikreín, ktoré môžu priebeh ataku zhoršiť. Cieľom je, aby boli pacienti edukovaní v samostatnom použití liečby akútneho ataku a aby táto liečba bola podávaná čím skôr. Akútnou medikáciou má byť zabezpečený aj doteraz asymptomatický pacient, keďže vznik prvého ataku a jeho závažnosť sa nedá dopredu predpovedať [9].
Dlhodobá profylaktická liečba je indikovaná ak sa závažný atak u pacienta vyskytuje raz mesačne a častejšie, pacient má atak viac ako 24 dní v roku, alebo akútna medikácia nie je dostatočne účinná, prípadne nie je k dispozícii [5,9]. Kandidátmi na dlhodobú profylaxiu sú aj pacienti s nedostupnou možnosťou akútneho ošetrenia lekárom [7]. Kľúčovým bodom v rozhodovaní sa pre dlhodobú profylaxiu je prevaha benefitu liečby nad očakávanými možnými nežiadúcimi účinkami [9]. Na dlhodobú profylaxiu používame atenuované androgény (danazol, Anargil), antifibrinolytiká (kyselina tranexámová, Exacyl) alebo dlhodobú substitúciu C1 inhibítorom.
U pacientov s HAE je absolútne kontraindikované podávanie ACE inhibítorov a neodporúča sa ani liečba estrogénmi. Pri aktivátoroch plazminogénu je predpoklad, že benefit, ktorý ich podanie prinesie, vždy prevládne nad rizikom z podania pri angioedéme [5]. V akútnom ataku sú kortikoidy, antihistaminiká a adrenalín neúčinné [10].
Kazuistika
Dvadsaťšesťročná pacientka pochádza z rodiny, kde je výskyt angioedému dokumentovaný v piatich generáciách – ochorením trpel pacientkin otec, traja príbuzní zo strany starého otca pacientky a otcova stará matka. Otec pacientky zomrel náhle ako 56-ročný, pričom nemožno vylúčiť, že úmrtie súviselo s angioedémom, keďže pitevný nález bol „nejasný“ (podľa anamnézy).
Diagnóza hereditárneho angioedému bola u našej pacientky stanovená vo veku 18 rokov, na základe nízkej hladiny C1 inhibítora a jeho nízkej funkčnej aktivity sme HAE zaradili do typu I – výsledky laboratórnych vyšetrení sú v tab. 2. Diagnóze zodpovedá aj nízka hladina C4 zložky komplementu a nízka hemolytická aktivita klasickej cesty aktivácie komplementu. Ataky sa u pacientky objavujú zhruba 4–5× ročne a väčšinou majú uniformný priebeh. Ako provokujúci moment spúšťajúci atak sama pacientka vypozorovala prebiehajúcu infekciu, výraznejšie stresové situácie a menštruáciu. Niekedy sa provokujúci moment nedá identifikovať. Atak sa začína kŕčovitými bolesťami brucha, ktoré bývajú lokalizované spočiatku v epigastriu, neskôr v celom bruchu. Po niekoľkých hodinách sa k bolestiam pridružuje vracanie, pocit nafúknutého brucha, zastavenie odchodu vetrov a rozvoj subileózneho stavu. Zvykne pociťovať slabosť, počas celého ataku nedokáže prijímať potravu a tekutiny môže piť len po dúškoch. Neliečený atak trvá 3–5 dní. Podľa dostupnej dokumentácie bola za ostatných sedem rokov života deväťkrát hospitalizovaná na rôznych pracoviskách – interných klinikách, chirurgických klinikách a gynekologickej klinike. Väčšinou bola v dutine brušnej verifikovaná voľná tekutina v Douglasovom priestore alebo medzikľučkovo, opakovane suponovaná akútna apendicitída alebo akútna adnexitída, resp. ruptúra ovariálnej cysty. Na našej ambulancii sme jedenkrát počas ataku sonograficky zachytili zhrubnutie steny črevnej kľučky v hypogastriu, mimo ataku bol v uvedenej oblasti sonografický nález normálny. Pri endoskopii hornej časti GIT sa počas ataku našlo zúženie výtokovej časti žalúdka a zhrubnutie pyloru s tenkým lemom tekutiny (USG).
Tab. 2. Prehľad laboratórnych výsledkov (pacientka z kazuistiky). Tab. 2. Laboratory tests and results (patient from the case report). 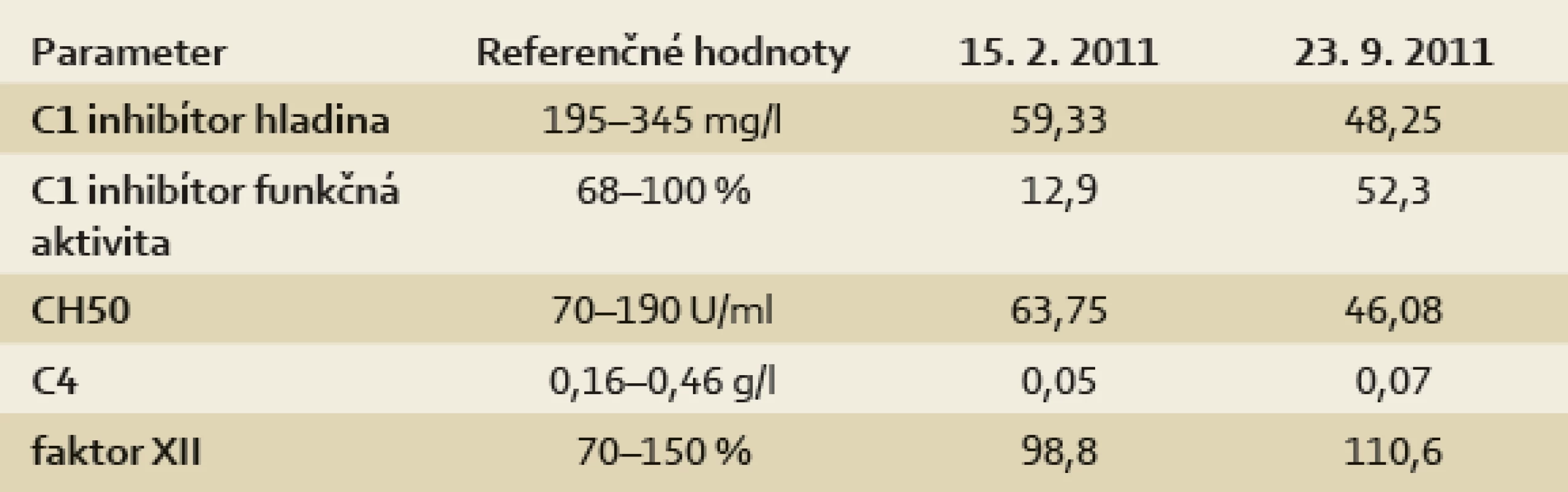
Od novembra 2011 sme pacientku zabezpečili on demand liečbou icatibantom (inhibítor bradykinínových receptorov – Firazyr), ktorý sme podávali pri akútnom ataku. Po podaní injekcie zhruba do 30 minút ustupujú všetky príznaky vrátane bolestí brucha, vracania a pocitu „plnosti brucha“, obnovuje sa perorálny príjem. Liečba je spojená len s minimálnymi lokálnymi nežiadúcimi účinkami – začervenaním v mieste aplikácie a miernou bolestivosťou pri rýchlejšej aplikácii. Od júna 2012 sa frekvencia atakov zvýšila (brušný atak jedenkrát mesačne) a prvýkrát sme zaznamenali aj počínajúci opuch laryngu. Ten sa prejavil pocitom cudzieho telesa v hrdle a sťaženým dýchaním. Z uvedeného dôvodu sme indikovali dlhodobú profylaktickú liečbu. K podávaniu atenuovaných androgénov má pacientka negatívny postoj. Po zohľadnení tejto skutočnosti, ako aj po zohľadnení fertilného obdobia života sme sa rozhodli pre dlhodobú profylaxiu kyselinou tranexámovou (Exacyl). Po dvojmesačnom skúšobnom období liečby (liek je v SR viazaný na individuálny dovoz povolený MZ SR), kedy pacientka nemala žiaden atak, sme sa rozhodli v liečbe pokračovať dlhodobo.
U pacientky sme vykonali aj genetické vyšetrenie, ktorým bola identifikovaná mutácia c.1220delA v heterozygotnom stave, ktorá vedie k vzniku predčasného stop kodónu a k produkcii skráteného proteínu C1 inhibítora. V literatúre nebola táto mutácia ešte popísaná.
Záver
Hereditárny angioedém je zriedkavé ochorenie, prejavujúce sa vznikom edému v podkoží alebo na slizniciach respiračného, tráviaceho alebo urogenitálneho traktu. Z toho vyplýva aj široký a rozmanitý klinický obraz. Vzhľadom na časté postihnutie práve tráviaceho traktu je potrebné u pacientov s nevysvetlenými atakmi bolestí brucha myslieť práve na túto diagnózu a cielene pátrať po symptómoch vyplývajúcich z angioedému v iných orgánoch. HAE je ochorenie, ktoré vyžaduje multidisciplinárny prístup v diagnostike a liečbe, a preto zvýšenie informovanosti gastroenterológov a chirurgov môže prispieť k častejšej diagnostike a úspešnej liečbe tohto ochorenia.
Použité skratky
C1INH – inhibítor C1 zložky komplementu
C4 – C4 zložka komplementu
CH50 – hemolytická aktivita klasickej cesty aktivácie komplementu
GIT – gastrointestinálny trakt
HAE – hereditárny angioedém
MASP – serínová proteináza asociovaná s manózu viažucim lektínom
MBP – manózu viažuci peptid
USG – ultrasonografia
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 20. 1. 2014
Přijato: 8. 3. 2014
MUDr. Katarína Hrubišková
V. interná klinika LF UK a UN
Ružinovská 6, 826 06 Bratislava
khrubiskova@yahoo.com
Zdroje
1. Cugno M, Zanichelli A, Foieni F et al. C1-inhibitor deficiency and angioedema: molecular mechanisms and clinical progress. Trends Mol Med 2009; 15(2): 69–78. doi: 10.1016/j.molmed.2008.12.001.
2. Hanzlíková J. Hereditární angioedém. [online]. Dostupné z: www.euni.cz.
3. Buc M. Komplementárny systém. In: Buc M. Základná a klinická imunológia. Bratislava: Univerzita Komenského v Bratislave 2009.
4. Bork K, Wulff K, Hardt J et al. Hereditary angioedema caused by missense mutations in the factor XII gene: clinical features, trigger factors, and therapy. J Allergy Clin Immunol 2009; 124(1): 129–134. doi: 10.1016/j.jaci.2009.03.038.
5. Bowen T, Cicardi M, Farkas H et al. 2010 International consensus algorithm for the diagnosis, therapy and management of hereditary angioedema. Allergy, Asthma Clin Immunolog 2010; 6(1): 24. doi: 10.1186/1710-1492-6-24.
6. Zuraw BL. Clinical practice. Hereditary angioedema. N Engl J Med 2008; 359(10): 1027–1036. doi: 10.1056/NEJMcp0803977.
7. Dagen C, Craig TJ. Treatment of Hereditary Angioedema: items that need to be addressed in practice parameter. Allergy Asthma Clin Immunol 2010; 6(1): 11. doi: 10.1186/1710-1492-6-11.
8. Craig T, Riedl M, Dykewicz MS et al. When is prophylaxis for hereditary angioedema necessary? Ann Allergy Asthma Immunol 2009; 102(5): 366–372. doi: 10.1016/S1081-1206(10)60506-6.
9. Cicardi M, Bork K, Caballero T et al. Evidence-based recommendations for the therapeutic management of angioedema owing to hereditary C1 inhibitor deficiency: consensus report of an International Working Group. Allergy 2012; 67(2): 147–157. doi: 10.1111/j.1398-9995.2011.02751.x.
10. Zuraw BL. HAE therapies: past present and future. Allergy Asthma Clin Immunol 2010; 6(1): 23. doi: 10.1186/1710-1492-6-23.
11. Cook HT, Botto M. Mechanisms of Disease: the complement system and the pathogenesis of systemic lupus erythematosus. Nat Clin Pract Rheumatol 2006; 2(6): 330–337.
12. Weiler CR, van Dellen RG. Genetic test indications and interpretations in patients with hereditary angioedema. Mayo Clinic Proc 2006; 81(7): 958–972.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článek Správná odpověď na kvízČlánek Projekt RISING STARSČlánek MUDr. Boris Pekárek (1978)Článek OznámeníČlánek OmluvaČlánek Kvíz
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2014 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Léčba portální hypertenze pomocí transjugulární intrahepatální portosystémové spojky – prvních 1 000 výkonů ve FN Hradec Králové
- 1 000 TIPS ve FN Hradec Králové: indikace a přežívání nemocných
- Budd-Chiari syndrom a TIPS – 21 let zkušeností
- Transjugulární intrahepatální portosytémová spojka v terapii refrakterního ascitu: současný pohled jednoho pracoviště
- Dispenzarizace nemocných po zavedení transjugulární intrahepatální portosystémové spojky – diagnostika dysfunkce zkratu a možnosti intervence
- Transplantace jater pro hepatocelulární karcinom, dlouhodobé přežití a faktory ovlivňující rekurenci tumoru (zkušenosti jednoho centra)
- Využití EUS navigované choledochoduodenostomie v léčbě biliární obstrukce
- Hereditárny angioedém ako príčina bolestí brucha
- Malígny melanóm konečníka – zriedkavá kazuistika a prehľad literatúry
- Moderní diagnostika Lynchova syndromu
- Správná odpověď na kvíz
- Diskusia k príspevku „Moderní diagnostika Lynchova syndromu“
- Projekt RISING STARS
- doc. MUDr. Jan Martínek, Ph.D., AGAF (1969)
- MUDr. Ondřej Ryska, Ph.D. (1981)
- MUDr. Sylvia Dražilová (1972)
- MUDr. Boris Pekárek (1978)
- EUS workshop v Jablonci nad Nisou
- 13th Czech-Slovak IBD symposium
- 9th Congress of ECCO, Copenhagen, Denmark
- Oznámení
- Omluva
- Nový člen výkonné redakční rady
- Remsima™ – první biosimilární infliximab
- Autodidaktický test: hepatologie
- Hepatologie nejen z Hradce Králové
- Kvíz
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- doc. MUDr. Jan Martínek, Ph.D., AGAF (1969)
- MUDr. Sylvia Dražilová (1972)
- MUDr. Ondřej Ryska, Ph.D. (1981)
- Budd-Chiari syndrom a TIPS – 21 let zkušeností
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



