-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Současné principy screeningu kolorektálního karcinomu – od oportunního k populačnímu screeningovému programu
Current principles of colorectal cancer screening – from opportunistic screening to a population-based screening program
Colorectal cancer (CRC) is the second leading cause of death from malignancy all over the world. Annually, approximately 8,000 patients are newly diagnosed with this cancer and about 4,000 patients die because of this disease in the Czech Republic. Due to the nature of the disease, it can be prevented by various screening methods. The National Czech CRC screening program has been running since 2000 and is focused on asymptomatic individuals aged over 50 years. In 2014, the program began to send personal invitations to the CRC screening target population. The basic screening methods include the fecal occult blood test and colonoscopy. While colonoscopy is considered to be the gold standard, compliance in asymptomatic individuals for this procedure is less than the recommended 50%. One reason for this might be the invasiveness of this examination. Therefore, non-invasive fecal occult blood tests are used. New alternative screening methods are being sought that are less invasive with high sensitivity and adequate acceptance by the general population. Such methods are DNA stool tests, sigmoidoscopy, computed tomography colonography, and capsule colonoscopy. In this article, CRC epidemiology, alternative screening examinations, and the results of the national CRC screening program (including personal invitations) are discussed.
Key words:
colorectal cancer – epidemiology – interval cancer – population screening – colonoscopy – fecal occult blood test – CT colonography – capsule colonoscopy
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
5. 9. 2016Accepted:
3. 10. 2016
Autori: T. Grega 1; O. Májek 2; O. Ngo 2; N. Král 3; B. Seifert 3; L. Dušek 2; M. Zavoral 1; Š. Suchánek 1
Pôsobisko autorov: Interní klinika 1. LF UK a ÚVN – VFN v Praze 1; Institut biostatistiky a analýz, LF a PřF MU, Brno 2; Ústav všeobecného lékařství, 1. LF UK v Praze 3
Vyšlo v časopise: Gastroent Hepatol 2016; 70(5): 383-392
Kategória: Gastrointestinální onkologie: přehledová práce
doi: https://doi.org/10.14735/amgh2016383Súhrn
Kolorektální karcinom (CRC – colorectal cancer) je druhou nejčastější příčinou úmrtí na maligní onemocnění ve světě. Ročně je v ČR nově diagnostikováno přibližně 8 000 pacientů s tímto karcinomem a kolem 4 000 nemocných na něj zemře. Vzhledem k povaze onemocnění lze jeho vzniku účinně předcházet pomocí screeningových vyšetření. Národní screeningový program CRC v ČR probíhá již od roku 2000 a je zaměřen na asymptomatické jedince ve věku nad 50 let. V roce 2014 bylo zavedeno adresné zvaní cílové populace na screening CRC. Mezi základní screeningové metody patří testy na okultní krvácení do stolice (TOKS) a kolonoskopie. I když je kolonoskopie považována za zlatý standard vyšetření tlustého střeva, compliance asymptomatických jedinců k tomuto vyšetření je nižší než doporučovaných 50 %. Jednou z příčin může být invazivita tohoto vyšetření. Z toho důvodu jsou s výhodou využívány neinvazivní TOKS. V současnosti jsou dále hledány další alternativní screeningové metody – méně invazivní, s vysokou senzitivitou a akceptované širokou veřejností. Patří mezi ně DNA testování stolice, sigmoideoskopie, CT kolonografie a kapslová kolonoskopie. V článku je souhrnně představen vývoj epidemiologie CRC, alternativní možnosti screeningového vyšetření a výsledky Národního screeningového programu CRC vč. adresného zvaní.
Klíčová slova:
kolorektální karcinom – epidemiologie – intervalový karcinom – populační screening – kolonoskopie – testy na okultní krvácení do stolice – CT kolonografie – kapslová kolonoskopieÚvod
Kolorektální karcinom (CRC – colorectal cancer) patří celosvětově mezi maligní onemocnění s vysokou incidencí, každoročně postihuje přibližně 1,23 mil. jedinců na celém světě a tvoří téměř 10 % všech nádorů [1]. Incidence zůstává vysoká zejména v oblastech střední Evropy. V roce 2012 bylo v ČR diagnostikováno 8 336 nových případů CRC a 3 628 osob na toto onemocnění zemřelo [2]. U mužů je incidence i mortalita CRC vyšší než u žen. Onemocnění typicky postihuje muže i ženy v produktivním věku, mezi 55 a 75 let věku. Mezi nejčastější ovlivnitelné rizikové faktory patří špatné stravovací návyky a nízká fyzická aktivita s nadměrnou tělesnou hmotností [3]. Hlavním neovlivnitelným rizikovým faktorem je věk nad 50 let. Mezi další neovlivnitelné rizikové faktory patří pozitivní rodinná anamnéza, přítomnost hereditárních polypózních syndromů a nespecifických střevních zánětů. Naprostou většinu všech CRC (cca 80–85 %) tvoří sporadická forma onemocnění způsobená akumulací genetických mutací v epitelových buňkách tlustého střeva. Proces kancerogeneze probíhá nejčastěji cestou adenomového polypu a vznik invazivního karcinomu touto cestou trvá přibližně 8–10 let. Odhaduje se, že přibližně 2,6–5,6 % pokročilých adenomů ročně progreduje do CRC [4]. Kromě konvenční adenomové cesty může vznik CRC probíhat i cestou pilovitých lézí (tzv. serrated polypů), které mají jiné biologické vlastnosti a jsou zodpovědné za 20–30 % případů CRC. Vzhledem k tomu, že nejsilnějším rizikovým faktorem CRC zůstává věk, probíhá v ČR Národní program screeningu CRC, který je zaměřen na bezpříznakové jedince ve věku nad 50 let.
Epidemiologie CRC
Státy střední Evropy vykazují celosvětově nejvyšší hodnoty incidence a mortality CRC, přičemž ČR obsazuje dlouhodobě přední příčky. Zatímco v letech 2010–2011 obsazovala ČR druhé místo v incidenci CRC v Evropě, dle nejnovějších dat z roku 2012 došlo k posunu ČR na páté místo v incidenci za Slovenskem, Maďarskem, Dánskem a Nizozemskem (graf 1) [1]. Tento pozitivní jev je bezpochyby také důsledkem efektivního screeningového programu CRC v ČR.
Graf 1. Porovnání incidence CRC v Evropě dle [1]. Graph 1. Comparison of the CRC incidence in Europe according to [1]. ![Porovnání incidence CRC v Evropě dle [1].
Graph 1. Comparison of the CRC incidence in Europe according to [1].](https://pl-master.mdcdn.cz/media/image/d4f5ff869221ab21fc8575d3d235960b.jpg?version=1537797096)
Dalším pozitivním důsledkem screeningu je zlom v narůstající incidenci CRC v ČR, která měla stoupající tendenci až do roku 2003 [5]. V období 2003–2013 pozorujeme postupný pokles incidence CRC o 2,2 %. Ještě větší rozdíl je patrný v poklesu mortality CRC v ČR, kdy v letech 2003–2013 došlo k poklesu o 17,5 % (graf 2). S tímto pozitivním trendem souvisí kontinuální nárůst prevalence (počet žijících osob s CRC), která dosáhla v roce 2013 hodnoty kolem 55 000 jedinců (nárůst o 49,3 % v porovnání s rokem 2003). Prevalence kontinuálně narůstá a předpokládá se, že v roce 2020 bude představovat hodnotu 75 000 osob.
Graf 2. Epidemiologie CRC v ČR dle [2]. Graph 2. Epidemiology of CRC in the Czech Republic according to [2]. ![Epidemiologie CRC v ČR dle [2].
Graph 2. Epidemiology of CRC in the Czech Republic according to [2].](https://pl-master.mdcdn.cz/media/image/ffa08ccb35e779fc0ca67138f5717faa.jpg?version=1537797830)
Nepříznivé výsledky zůstávají v zastoupení jednotlivých stadií CRC. Poslední data z roku 2013 naznačují setrvale vysokou incidenci CRC ve stadiu III a IV (více než 50 % všech případů) (graf 3) [5]. K lepším výsledkům léčby CRC přispívá nejen časný záchyt, ale i úspěšnější péče o diagnostikované pacienty – zatímco v letech 1995–1999 dosahovalo pětileté relativní přežití u pacientů s CRC ve stadiu I 75 %, dosahuje současné pětileté relativní přežití v období 2010–2013 téměř 91 % [6]. Dále se objevuje nový trend rostoucí incidence CRC jako dalšího primárního nádoru u onkologických pacientů, což naopak systém péče o tyto pacienty významně zatěžuje a představuje další velkou výzvu pro systém časného záchytu. Zatímco v období do roku 1990 představovaly další primární nádory 6–7 % z celkového počtu CRC, v období 2004–2013 je to již 17,3 % ze všech diagnostikovaných CRC [2].
Graf 3. Podíl klinických stadií CRC. Graph 3. Clinical stages of CRC. 
Screening CRC
Sporadický CRC se vyznačuje dlouhou dobou vývoje s progresí od nezhoubného časného adenomu do invazivního karcinomu v trvání přibližně 8–10 let. Díky této charakteristice představuje screening CRC nejvýhodnější nástroj k ovlivnění incidence a zejména mortality tohoto onemocnění. V ČR je screening CRC zaměřen na asymptomatické jedince ve věku nad 50 let s negativní rodinnou nebo osobní anamnézou CRC, bez dědičných polypózních syndromů a bez chronických zánětlivých střevních onemocnění. K dispozici jsou různé možnosti screeningového testování.
Screeningové metody
Existuje mnoho screeningových metod, které můžeme rozdělit na dva hlavní typy – testování stolice anebo provedení endoskopického, případně radiologického vyšetření. Testování stolice zahrnuje kromě konvenčních testů na okultní krvácení do stolice (TOKS; guajakové (gTOKS) nebo imunochemické (FIT – faecal immunochemical tests)) také nové testy na přítomnost DNA mutací ve stolici (DNA fekální testy). Tyto DNA testy jsou založené na detekci specifických změn v DNA buněk, které se do stolice uvolňují z prekancerózních nebo nádorových lézí [7]. Endoskopické a radiologické screeningové metody zahrnují optickou kolonoskopii, flexibilní sigmoideoskopii (FS), CT kolonografii a v poslední době také kapslovou kolonoskopii. Tyto metody jsou založené na přímé nebo radiografické vizualizaci sliznice tlustého střeva.
Guajakové testy na okultní krvácení
Tyto testy jsou zaměřené na detekci krve ve stolici prostřednictvím peroxidázové reakce s hemoglobinem (Hb). Po mnoho let byly gTOKS jedinou screeningovou metodou CRC. Efekti - vita této screeningové metody byla podpořena silnými důkazy z prospektivní randomizované kontrolované studie (Minnesota Colon Cancer Control Study), kdy při jednoletém intervalu používání gTOKS došlo ke snížení mortality na CRC o 33 % a při dvouletém intervalu o 15–21 % [8]. Metaanalýza tří randomizovaných studií prokázala snížení mortality při opakovaném použití gTOKS o 16 % [9]. Kromě toho, snížení úmrtnosti při užívání gTOKS je výraznější u mužů než u žen [10]. Mezi hlavní výhody těchto testů patří nízká cena, jednoduchá distribuce, snadné použití a stabilita v suchém stavu. Mezi hlavní nevýhody gTOKS patří nízká senzitivita (cca 28–30 %) a nutnost odebrání aspoň tří různých vzorků stolice [9]. Další potenciální nevýhodou gTOKS je skutečnost, že hem není specifický pouze pro člověka. Vzhledem k tomu může být přítomna falešně pozitivní peroxidázová reakce s hemem obsaženým v živočišné potravě nebo při krvácení z horní části trávicího traktu. Současně může být přítomna i falešně negativní peroxidázová reakce po užití vitaminu C nebo jiných antioxidantů. Nicméně, dle nových randomizovaných studií porovnávajících gTOKS a FIT ve screeningových podmínkách byla prokázána podobná míra falešně pozitivních výsledků pro obě metody [11,12]. Je to způsobeno tím, že gTOKS mají téměř nulovou falešnou pozitivitu, ale nízkou senzitivitu (cca 30 %). Problémem kvalitativních FIT je nižší specificita, která je ale vyvážena vyšší senzitivitou a vyšší compliance pacientů. Zahájením kvantitativních FIT s měřením koncentrací Hb ve stolici lze dosáhnout srovnatelné specificity v porovnání s gTOKS při vyšší senzitivitě (čím vyšší cut-off, tím vyšší specificita). Rutinní provádění gastroskopie u pacientů s pozitivním gTOKS a negativní kolonoskopií není doporučováno [13].
Imunochemické testy na okultní krvácení
Jedná se o testy na bázi protilátek, které se cíleně vážou na globinovou složku Hb. Na trhu jsou k dispozici jak kvantitativní testy, tak kvalitativní FIT. Kvalitativní testy poskytují pozitivní nebo negativní výsledek testu, zatímco kvantitativní testy dokážou poskytnout aktuální koncentraci Hb ve vzorku stolice, což umožňuje stanovení hodnoty cut-off vhodné pro organizaci populačního screeningu, proto je tato metoda v evropských doporučených postupech preferovaná. Mezi jejich výhody patří zejména vyšší senzitivita při obdobné specificitě v porovnání s gTOKS. V americké metaanalýze zahrnující 19 randomizovaných prospektivních studií s FIT byla prokázána jejich senzitivita 79 % a specificita 94 % [14]. Vzhledem k tomu, že globin je specifická bílkovina pro lidský Hb, odpadá riziko falešné pozitivity při reakci s krví zvířecího původu z potravy. Kromě toho globin pocházející z horní části trávicího traktu je rychle degradován pasáží gastrointestinálním traktem, a proto je jeho přítomnost ve stolici specifická pro krvácení z tlustého střeva. Mezi další výhody FIT patří jednoduchost testu a vyšší compliance cílové populace. Ve dvou randomizovaných studiích z Nizozemska byla prokázána vyšší účast screeningové populace u jedinců s FIT o 13–15 % oproti jedincům s gTOKS [11,12]. I přes jejich výhodný profil mají tyto testy i určité nevýhody:
- Existuje mnoho typů FIT s rozličným firemním nastavením cut-off (pozitivní hodnota Hb ve stolici indikující kolonoskopii). Mezi jednotlivými FIT existuje heterogenita (kvalitativní, semikvantitativní, kvantitativní testy), a tím značné rozdíly v jejich senzitivitě a specificitě. Kvalitativní FIT mají obecně nižší senzitivitu a specificitu v porovnání s kvantitativními FIT. Stanovení cut-off hodnoty ovlivňuje senzitivitu a specificitu FIT. Čím je cut-off vyšší, tím je senzitivita nižší, ale specificita testu vyšší.
- Vzhledem k postupné degradaci globinu z orální části trávicího traktu může mít FIT menší senzitivitu pro léze v proximální části tlustého střeva. V německé prospektivní studii byla prokázána vyšší senzitivita (33 %) pro levostranné léze v porovnání s pravostrannými lézemi (33 vs. 20 %; p = 0,04) [15].
- Výsledky FIT jsou závislé na teplotě okolního prostředí a době přesunu do laboratoře. Dle některých autorů může dojít ke ztrátám až 70 % Hb během 24 hod při teplotě 30 °C [16].
- Další nevýhodou je jejich cena a nedostatečná standardizace cut-off mezi různými FIT testy. Většina studií preferuje cut-off hodnotu v rozmezí 75–100 ng/l [17].
DNA fekální testy
Testování nádorové DNA ve stolici představuje atraktivní screeningovou metodu pro detekci CRC a jeho prekurzorů (adenomů). Na rozdíl od detekce intermitentního skrytého (okultního) krvácení z pokročilé kolorektální neoplazie (podstata TOKS) jsou tyto DNA testy zaměřené na detekci abnormálních změn v DNA buněk ve vzorku stolice, které jsou asociovány s výskytem kolorektální neoplazie. Základem tohoto testování je předpoklad, že se na vzniku CRC podílí akumulace genetických mutací. V letech 2004 a 2008 proběhly dvě velké studie [18,19] porovnávající DNA testování stolice s TOKS na detekci kolorektální neoplazie, které ukázaly jen slabou senzitivitu DNA testů. Významným pokrokem bylo zavedení stabilizačních pufrů, využití kombinace jednotlivých genetických markerů a senzitivnějších analytických metod, které vedly ke zvýšení senzitivity DNA testů na detekci kolorektální neoplazie [20]. V současnosti jsou v USA k dispozici kombinované testy DNA ve stolici, tzv. multitarget stool DNA tests, hodnotící více genetických markerů vč. imunochemického měření množství lidského Hb ve stolici při jednom vyšetření. Mezi hlavní monitorované genetické změny patří aberantně metylované promotorové oblasti genů BMP3 a NDRG4, mutace genu KRAS a β-actin (referenční gen pro množství lidské DNA). Před odběrem vzorku stolice není nutná speciální dieta nebo omezení medikace. Stolice se po odebrání musí v laboratoři homogenizovat spolu se stabilizačním pufrem a následně zmrazit na –80 °C ihned po obdržení.
V roce 2014 byla publikovaná další americká studie porovnávající kombinovaný DNA test stolice s FIT v detekci kolorektální neoplazie ve screeningové populaci [19]. Do studie bylo zapojeno 9 989 pacientů s běžným rizikem kolorektální neoplazie. Byla prokázána vyšší senzitivita DNA testů v detekci jak CRC (92,3 vs. 73,8 %), tak pokročilé kolorektální neoplazie; adenom s vysokým stupněm dysplazie (HGD – high-grade dysplazia) (69,2 vs. 46,2 %) nebo pilovitý přisedlý adenom ≥ 1 cm (42,4 vs. 5,1 %). Nicméně specificita DNA testů byla nižší v porovnání s FIT testy (86,6 vs. 94,9 %). Senzitivita DNA testů byla vyšší v porovnání s FIT u CRC prvních tří stadií, která jsou považována za potenciálně kurabilní (93,3 vs. 73,3 %). Senzitivita DNA testů pozitivně korelovala s velikostí kolorektální léze a byla vyšší u pokročilých kolorektálních lézí v distální části tlustého střeva.
Kombinovaný „multitarget“ test stolice zahrnující DNA testování vč. imunochemického měření Hb ve stolici má vyšší senzitivitu pro detekci CRC nebo pokročilé kolorektální neoplazie než komerčně používaný FIT u screeningové populace. Nevýhodou je nižší specificita tohoto testování. Důvodem nižší specificity DNA testů je pravděpodobně to, že tyto testy reflektují přítomnost i malých (diminutivních) adenomů, které nejsou při kolonoskopii detekované. Jako další vysvětlení nízké specificity DNA testů je inverzní korelace specificity s věkem pacientů. Ve studii prof. Imperiale se specificita DNA testů pohybovala od 91,5 % (u jedinců ve věku 50–64 let) do 83,7 % (u jedinců starších 65 let) [19]. Příčinu lze hledat v přehlédnutých lézích při kolonoskopii u starších jedinců nebo ve změnách aktivity DNA metylace u starších jedinců. Mezi nezanedbatelné nevýhody této metody patří vyšší cena a složitější transport do laboratoře.
Kolonoskopie a intervalové karcinomy
Kolonoskopie je vyšetřovací metoda, která je považována za zlatý standard v diagnostice CRC. Její hlavní výhodou je schopnost vizualizace sliznice tlustého střeva v reálním čase a možnost přímého odstranění kolorektální neoplazie. Kolonoskopie je používaná jako primární screeningová metoda v některých zemích (tzv. screeningová kolonoskopie (SK)), např. v USA, Kanadě, Německu nebo Polsku [21]. Její hlavní nevýhodou je však invazivita vyšetření spojená s dyskomfortem pacientů, která může vést k nízké adherenci populace ke screeningu. Ve většině zemí je využíván dvoustupňový screening, kdy je kolonoskopie provedena po pozitivním TOKS (tzv. TOKS pozitivní kolonoskopie). Podstoupení TOKS jako metody první volby je z kapacitních a ekonomických důvodů méně náročné v porovnání s provedením kolonoskopie jako první vyšetřovací metody. Mezi další nevýhody kolonoskopie patří nutnost střevní přípravy. Adekvátní střevní očista je esenciální při provádění první (tzv. indexové) kolonoskopie, od které se odvíjí další dispenzární kontroly. Nejsilnější důkazy o účinnosti kolonoskopie ve screeningu pochází z velké americké studie (National Polyp Study), která prokázala, že kolonoskopie s odstraněním adenomu sníží incidenci CRC o 76–90 % [22].
Významný problém jakéhokoli screeningového programu, vč. programů zahrnujících kolonoskopii, představuje riziko intervalových karcinomů (karcinom diagnostikovaný před plánovanou dispenzární kolonoskopií nebo příštím termínem screeningu). V americké studii zahrnující pacienty po endoskopické resekci adenomů byl diagnostikován CRC u přibližně 0,5 % pacientů během tříletého intervalu [23]. Mezi příčiny intervalových karcinomů patří zejména přehlédnutí adenomů nebo nekompletní endoskopická resekce kolorektální neoplazie. Odhaduje se, že asi 2 % adenomů > 1 cm a až 26 % adenomů ≤ 5 mm v průměru může být přehlédnuto při kolonoskopické vyšetření, zejména v případě neadekvátní střevní přípravy [24]. Dalším rizikovým faktorem intervalových karcinomů jsou ploché pilovité léze v pravém tračníku, které jsou obtížně vizualizovatelné v bílém světle.
Výskyt intervalových karcinomů zdůrazňuje potřebu zajištění adekvátní kontroly kvality kolonoskopického vyšetření. Bylo prokázáno, že riziko CRC po preventivní kolonoskopii je nepřímo úměrné tzv. míře detekovaných adenomů (ADR – adenoma detection rate) [25], která závisí na zkušenostech endoskopisty a kvalitě střevní přípravy. Tato asociace vedla k určení indikátorů kvality kolonoskopie, které jsou definovány dle Evropských doporučení [28]: stupeň střevní přípravy, ADR, počet detekovaných pokročilých adenomů (aADR – advanced adenoma detection rate), počet detekovaných polypů (PDR – polyp detection rate), počet pilovitých polypů (SDR – serrated polyp detection rate), intubace céka (CIR – caecal intubation rate) a komplikace kolonoskopie (perforace, závažné krvácení).
Sigmoideoskopie
FS představuje vyšetření distálního tračníku a konečníku, kde se vyskytuje přibližně 60 % všech CRC. V porovnání s totální kolonoskopií je FS rychlejší, s menším rizikem komplikací a lépe tolerovaná pacientem. Analgosedace není obvykle nutná a příprava spočívá v lokální aplikaci klyzmat. V případě nálezu adenomu velikosti ≥ 10 mm, při přítomnosti vilózní složky nebo při výskytu více než tří adenomů je indikována totální kolonoskopie [26]. Většina guidelines akceptuje používání sigmoideoskopie jako alternativní screeningové metody s intervalem kontrol každých pět let v případě negativního nálezu [27,28]. Velké randomizované prospektivní studie zahrnující screeningovou populaci ve věku 55–64 let s průměrným sledováním kolem 11 let prokázaly po jednorázové screeningové FS pokles incidence CRC o 31–33 % a pokles mortality CRC o 38–43 % v porovnání s jedinci, kteří nepodstoupili žádný screening [29,30]. Tyto studie prokázaly, že jednorázové použití FS jako screeningové metody vede k přibližně dvojnásobné redukci mortality CRC v porovnání s gTOKS ve dvouletých intervalech.
Kapslová kolonoskopie
Kapslová kolonoskopie v současnosti využívá technologicky vylepšenou druhou generaci kapsle (PillCam COLON 2, Given Imaging Ltd, Yoqneam, Israel). Kapsle je opatřena dvěma kamerami na obou koncích, které obsáhnou téměř 360° zorného pole. Mezi její další výhody patří schopnost automaticky měnit počet fotek za minutu, tzv. adaptive frame rate, kdy se v případě zastavení kapsle sníží počet pořizovaných obrázků z 35/min na 4/min. Tím dochází k šetření baterie kapsle a zároveň se zvyšuje pravděpodobnost, že kapsle vyšetří celé tlusté střevo a konečník. Pozitivní efekt kapslové kolonoskopie ve screeningové populaci byl prokázán v irské prospektivní studii, kdy senzitivita a specificita v detekci kolorektální neoplazie dosahovala 89, resp. 96 %, a použití kapslové kolonoskopie snížilo nutnost optických kolonoskopií až o 71 % [31]. Podobných výsledků dosáhla česká multicentrická prospektivní studie probíhající v letech 2011–2014, která prokázala vysokou specificitu a dostatečnou senzitivitu v detekci klinicky relevantní kolorektální neoplazie ve screeningové populaci (99, resp. 88 %) [32]. Recentně publikovaná americká prospektivní studie zahrnující 884 asymptomatic-kých jedinců prokázala 88% senziti - vitu a 82% specificitu v detekci adenomů ≥ 6 mm ve screeningové populaci [33]. Určitou limitací kapslové kolonoskopie je absence randomizovaných studií zaměřených na detekci pilovitých lézí.
Indikace k provedení kapslové kolonoskopie nejsou v současnosti standardizované. K širšímu rozšíření této metody jako screeningového vyšetření brání zejména vyšší cena (cca 12 000 Kč/kapsle). V USA se kapslová kolonoskopie doporučuje v případech nekompletní kolonoskopie nebo při neochotě pacienta podstoupit optickou kolonoskopii [33].
CT kolonografie
CT kolonografie (virtuální kolonoskopie) je radiografické vyšetření tlustého střeva pomocí speciálního softwaru a počítačové tomografie. Je indikována u pacientů s nekompletní kolonoskopií nebo při odmítnutí kolonoskopie pacientem. Americké sdružení gastroenterologů (ACG – American College of Gastroenterology) doporučuje v případě CT kolonografie jako scree - ningové metody optimální screeningový interval pět let [27]. Naproti tomu sdružení amerických specialistů (USPSTF – US Preventive Health Task Force) se k tomuto intervalu screeningu vyjadřuje zdrženlivě vzhledem k nedostatečným důkazům v rámci medicíny založené na důkazech (Evidence-based medicine). Kolonoskopie by měla být indikována v případě nálezu léze ≥ 10 mm anebo při nálezu více než tří lézí > 5 mm [34]. Francouzská multicentrická studie zahrnující 845 pacientů, kteří podstoupili screeningovou CT kolonografii a následně kolposkopii, prokázala 69% senzitivitu a 91% specificitu při detekci polypů > 6 mm [35]. CT kolonografie byla schopna detekovat 90 % lézí > 10 mm. Mezi nevýhody CT kolonografie patří radiační zátěž, nemožnost biopsie a častý nález benigních incidentalomů, které můžou vést ke zdlouhavému vyšetřování.
Organizovaný screeningový program
Nepříznivé ekonomické a sociální následky CRC lze ovlivnit správným screeningovým programem. Dle Evropských doporučení je nezbytné ke správnému fungování screeningu CRC zavedení organizovaného screeningového programu s určením screeningových intervalů a indikátorů kvality screeningového programu. Mezi krátkodobé indikátory kvality patří např. celkové pokrytí cílové populace a záchyt adenomů (karcinomů) v rámci screeningu [28]. Obecně se uvádí, že účast cílové populace na screeningu CRC by měla být 45–65 %. Mezi dlouhodobé indikátory kvality patří snížení celkové incidence a mortality tohoto onemocnění a snížení výskytu intervalových karcinomů. Screeningový program CRC může mít formu oportunní nebo organizovanou [36]. Oportunní forma screeningu CRC znamená, že iniciativa k provedení screeningu CRC závisí na každém jednotlivci a vychází od motivovaného lékaře, naopak organizovaný screening vychází z národní veřejně-zdravotnické politiky. Nejvyšší forma organizovaného screeningového programu je tzv. populační screening, kdy je vyžadováno, aby každá osoba splňující kritéria pro zařazení do screeningu byla identifikována a adresně pozvána ke screeningovému vyšetření ve stanoveném intervalu.
Screening CRC v ČR – od oportunního k populačnímu programu
V ČR byl v roce 2000, v pořadí druhý na světě, zahájen Národní program screeningu CRC u asymptomatických jedinců ve věku nad 50 let. Jednalo se o oportunní screeningový program, do kterého byla zapojena část praktických lékařů a gynekologů. Díky zapojení gynekologů do screeningu CRC došlo k vzestupu celkového počtu provedených TOKS. Od roku 2006 byl zaveden Registr SK (ve správě Institutu biostatistiky a analýz Masarykovy univerzity v Brně), který slouží k monitoraci kvality screeningového programu. Do registru jsou zadávány informace o provedené preventivní kolonoskopii lékaři v Centrech pro SK. Jedná se o demografické informace o pacientovi, indikace ke kolonoskopii (TOKS pozitivní nebo screeningová) a základní data o vyšetření samotném vč. mikroskopických a makroskopických nálezů. V roce 2010 byl definitivně etablován nový design Národního programu screeningu CRC ve Věstníku Ministerstva zdravotnictví (MZ) ČR č. 3/2010 Sb., kde byl stanoven obsah a časové rozmezí preventivních prohlídek. Dle této vyhlášky zahrnuje screeningové vyšetření CRC TOKS od 50 let 1× ročně a v případě pozitivního výsledku následuje TOKS pozitivní kolonoskopie. Od 55 let se můžou jedinci rozhodnout buď pro pokračování v absolvování TOKS ve dvouletém intervalu, nebo přímo absolvování SK, která je v případě negativního nálezu zopakována v 10letém intervalu. Toto doporučení neplatí pro jedince s familiárním výskytem CRC, který nesplňuje kritéria hereditárních syndromů. Jedná se o jedince s rodinnou anamnézou CRC nebo pokročilého adenomu u příbuzného prvního stupně ve věku pod 60 let, kdy je doporučována SK od 40 let věku nebo 10 let před diagnózou u jejich příbuzného. Začátkem roku 2013 došlo k postupnému nahrazování gTOKS za FIT, které jsou v současnosti dominantně využívány. Zavedením imunochemických testů, SK a zapojením ambulantních gynekologů došlo v roce 2013 k vzestupu pokrytí cílové populace na 26,5 %, nicméně v dalším průběhu byla pozorována stagnace participace jedinců na screeningu CRC.
Problémem oportunního screeningového programu bylo pouze částečné pokrytí cílové populace. Největší podíl pacientů odeslaných na screeningové vyšetření byl od praktických lékařů. Participace gynekologů na screeningu byla pouze částečná. Navíc, někteří jedinci nechodí k praktickému lékaři nebo ho vůbec nemají. Ve snaze o zvýšení adherence cílové populace ke screeningu byl v lednu 2014 změněn stávající screeningový program na populační, zavedením státem organizovaného přímého adresného zvaní. Občané jsou svými zdravotními pojišťovnami korespondenčně vyzýváni k participaci na screeningu CRC, ženy k participaci na screeningu nádorů hrdla děložního a nádorů prsu. Program zvaní je koordinován MZ ČR ve spolupráci s plátci zdravotní péče a s odbornými lékařskými společnostmi. Pojištěnec ve věku 50–70 let je zván k účasti na kolorektálním screeningu, pokud splňuje následující požadavky – nebyl léčen pro CRC, neabsolvoval v posledních třech letech TOKS či v posledních pěti letech preventivní kolonoskopii, nebyl u něj v minulosti (či min. v posledních čtyřech letech) vykázán terapeutický endoskopický či chirurgický výkon a je pojištěncem dané zdravotní pojišťovny alespoň čtyři roky. Pokud se zvaný pojištěnec do screeningu nezapojil (tzn. nebyl u něj vykázán příslušný screeningový kód), byl pozván opakovaně. Další inovací programu, zavedenou od roku 2015, byla změna úhrady preventivních kolonoskopií (zvýšení ocenění výkonu a režie, úhrada nad rámec regulace a prodloužení času screeningového výkonu).
Výsledky populačního screeningového programu
Během prvního roku působení pilotního projektu populačního screeningu CRC bylo osloveno 1 500 897 jedinců (52,7 % cílové populace). Na pozvání k účasti na screeningovém programu odpověděla téměř pětina osob (17,3 %) absolvováním TOKS či kolonoskopie. V druhé polovině roku 2014 obdrželo 95 097 pojištěnců druhý zvací dopis, na základě kterého se více než desetina (11,8 %) dostavila k vyšetření. Mezi faktory, které byly spojeny s nižší adherencí, patřilo mužské pohlaví a mladší věk. Zavedením adresného zvaní došlo k významnému vzestupu pokrytí cílové populace na 30,8 % (nárůst o 4,3 % oproti roku 2013) (graf 4). Díky adresnému zvaní došlo k nárůstu počtu vyšetření TOKS o 30 % a SK až o 85 % v porovnání s rokem 2013. Tento nárůst vyšetření se projevil zvýšením detekce adenomů o 42 % a karcinomů o 20 % v porovnání s rokem 2013. První fáze adresného zvaní vyvolala pozitivní odezvu v cílové populaci a vedla ke zvýšenému záchytu kolorektální neoplazie ve screeningové populaci.
Graf 4. Celkové pokrytí cílové populace screeningem (muži a ženy ≥ 50 let). Graph 4. Total screening coverage of the target population (men and women ≥ 50 years). 
* Od roku 2009 je pro věkovou skupinu 50–54 let uvažován jednoletý screeningový interval TOKS. V roce 2014 tvořilo cílovou populaci 3 955 968 osob. Zdroj dat: Národní referenční centrum. Od zavedení Národního registru SK v roce 2006 do března 2016 bylo v rámci screeningu CRC do registru zadáno 211 380 kolonoskopií (tab. 1), přičemž 169 070 bylo TOKS pozitivních a 42 310 SK. Počet zadaných kolonoskopií v Registru SK lze porovnat s reálnou situací pomocí údajů ze zdravotních pojišťoven. Dle posledních dat z roku 2014 počty SK souhlasí s údaji pojišťoven velmi dobře. Otazníkem zůstává diskrepance mezi počty pozitivních TOKS a TOKS pozitivních kolonoskopií (počet pozitivních TOKS dle dat z pojišťoven převyšuje počet TOKS pozitivních kolonoskopií zadaných v Registru SK). V současnosti nelze konkluzivně říct, zda se jedná o pacienty podstupující kolonoskopii mimo systém doporučených poskytovatelů (Center pro SK) nebo se tito pacienti ztrácí ze screeningového procesu. U TOKS pozitivní kolonoskopie činil ADR v celém uvedeném období 37,0 % (celkem 62 539 jedinců s adenomy) a 27,2 % u SK (celkem 11 517 jedinců). V průběhu let došlo k postupnému zvyšování ADR u TOKS pozitivních kolonoskopií (z 29,6 % v roce 2006 na 37,0 % v roce 2016). Tento ukazatel je příznivým faktorem redukce intervalových karcinomů. Dle Evropských doporučení by ADR nemělo být nižší než 20 %. U 7 143 pacientů (3,4 %) byl v rámci screeningového programu nalezen karcinom. V detekci karcinomů, na rozdíl od adenomů, je patrný sestupný trend. Dochází ke snížení podílu pacientů s CRC z 6,3 % v roce 2006 na 2,6 % v roce 2015. Tabulka 2 znázorňuje porovnání detekce adenomů a CRC v rámci českého screeningového programu s mezinárodními doporučeními [28].
Tab. 1. Výsledky Národního screeningového programu CRC v letech 2006-2016 Tab. 1. Results of the CRC National Screening Programme in 2006-2016 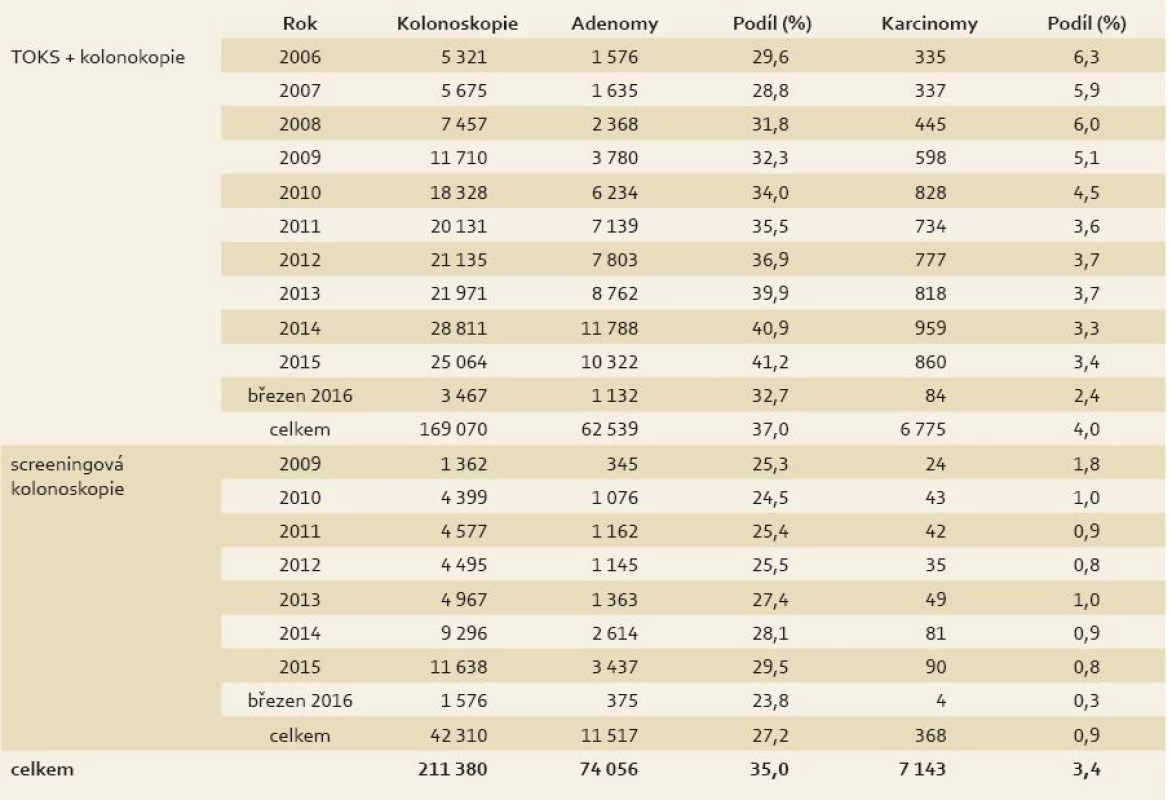
Zdroj dat: Registr screeningových kolonoskopií. Tab. 2. Srovnání detekce adenomů a CRC v rámci českého screeningového programu s doporučeními EU (2006-2014). Tab. 2. Comparison of detection of adenomas and CRC in the Czech screening programme with EU recommendations (2006-2014). 
EU – Evropská unie, CRC – kolorektální karcinom Zdroj dat: Registr screeningu CRC a Evropská doporučení pro screening CRC [28]. Z ostatních indikátorů kvality kolonoskopie je nutno zmínit, že procento úspěšných celkových kolonoskopií (caecal intubation rate) je u TOKS pozitivních kolonoskopií 95,6, resp. 97,8 % u SK. V letech 2006–2015 bylo hlášeno 158 případů perforace (0,08 % všech vyšetření) a 781 závažných krvácení (0,8 % ze všech polypektomií). Tyto výsledky jsou obdobné jako v ostatních evropských zemích [28] a odpovídají vysoké kvalitě kolonoskopických vyšetření.
Horní věková hranice screeningu CRC
Ve světle prodlužujícího se věku patří mezi diskutovanou problematiku scree - ningových programů stanovení horní věkové hranice screeningu. Organizovaný screening CRC u seniorů (≥ 75 let) je kontroverzní a není zahrnut v doporučení Rady EU, jelikož pro tuto věkovou kategorii nejsou k dispozici jednoznačné výsledky klinických studií. Starší jedinci jsou ve vyšším riziku vzniku CRC, nicméně mají také vyšší riziko komplikací souvisejících s výkonem a střevní přípravou (dysbalance vnitřního prostředí, ledvinné nebo srdeční selhání). Nezanedbatelným faktorem je také vyšší podíl neadekvátní střevní přípravy, riziko arytmií a útlumu dechového centra během premedikace. Dle Evropských doporučení je horní věkový limit pro ukončení screeningu nastaven na 75 let, ale definitivní rozhodnutí závisí na přání pacienta a jeho komorbiditách [28]. Naproti tomu, Americké sdružení odborníků USPSTF doporučuje individualizaci screeningu v péči o seniory [37]. Základními faktory, které je nutné zvážit před podstoupením seniora do screeningu, jsou předpokládaná střední délka života, komorbidity a schopnost podstoupit léčbu v případě výskytu CRC.
Závěr
Organizace screeningu CRC a zvyšování jeho dostupnosti a kvality v ČR je spojeno s postupným snižováním incidence a mortality tohoto onemocnění. Zavedením adresného zvaní došlo meziročně k vyššímu záchytu adenomů o 42 % a karcinomů o 20 %. Rozvojem screeningových vyšetřovacích metod dochází ke zvyšování záchytu prekancerózních lézí a ke zvyšování účasti cílové populace. Kromě klasického TOKS a endoskopických metod lze uvažovat o alternativních screeningových modalitách, jakými jsou kapslová kolonoskopie či CT kolonografie. Zavádění těchto metod v organizovaném screeningu CRC není zatím dostatečně podloženo vědeckými důkazy, dosavadní studie však naznačují jejich potenciální význam v diagnostice CRC, a tedy i ve screeningovém procesu.
Práce byla podpořena granty PRVOUK-P27/LF1/1 a MO 1012.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 5. 9. 2016
Přijato: 3. 10. 2016
MUDr. Tomáš Grega
Interní klinika 1. LF UK a ÚVN – VFN v Praze
U Vojenské nemocnice 1200
169 02 Praha 6
tomas.grega@uvn.cz
Zdroje
1. Ferlay J, Soerjomataram I, Dikshit R et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer 2015; 136 (5): E359–E386. doi: 10.1002/ijc. 29210.
2. Dušek L, Májek O, Mužík J et al. Epidemiologie a populační screening nádorů tlustého střeva a konečníku v České republice na podkladě nově dostupných dat. Gastroent Hepatol 2015; 69 (6): 509–517. doi: 10.14735/amgh2015509.
3. Boyle T, Keegel T, Bull F et al. Physical activity and risks of proximal and distal colon cancers: a systematic review and meta-analysis. J Natl Cancer Inst 2012; 104 (20): 1548–1561. doi: 10.1093/jnci/djs354.
4. Brenner H, Hakulinen T. Maximizing the benefits of model-based period analysis of cancer patient survival. Cancer Epidemiol Biomarkers Prev 2007; 16 (8): 1675–1681.
5. Dušek L, Mužík J, Kubásek M et al. Epidemiologie zhoubných nádorů v České republice [online]. Dostupné z: www.svod.cz.
6. Pavlík T, Májek O, Büchler T et al. Trends in stage-specific population-based survival of cancer patients in the Czech Republic in the period 2000–2008. Cancer Epidemiol 2014; 38 (1): 28–34. doi: 10.1016/j.canep.2013.11.002.
7. Carroll MR, Seaman HE, Halloran SP. Tests and investigations for colorectal cancer screening. Clin Biochem 2014; 47 (10–11): 921–939. doi: 10.1016/j.clinbiochem.2014. 04.019.
8. Mandel JS, Bond JH, Church TR et al. Reducing mortality from colorectal cancer by screening for fecal occult blood. Minnesota Colon Cancer Control Study. N Engl J Med 1993; 328 (19): 1365–1371.
9. Hewitson P, Glasziou P, Irwig L et al. Screening for colorectal cancer using the faecal occult blood test, Hemoccult. Cochrane Database Syst Rev 2007; 1: CD001216.
10. Shaukat A, Mongin SJ, Geisser MS et al. Long-term mortality after screening for colorectal cancer. N Engl J Med 2013; 369 (12): 1106–1114. doi: 10.1056/NEJMoa1300720.
11. van Rossum LG, van Rijn AF, Laheij RJ et al. Random comparison of guaiac and immunochemical fecal occult blood tests for colorectal cancer in a screening population. Gastroenterology 2008; 135 (1): 82–90. doi: 10.1053/j.gastro.2008.03.040.
12. Hol L, van Leerdam ME, van Ballegooijen M et al. Screening for colorectal cancer: randomised trial comparing guaiac-based and immunochemical faecal occult blood testing and flexible sigmoidoscopy. Gut 2010; 59 (1): 62–68. doi: 10.1136/gut.2009.177089.
13. Allard J, Cosby R, Del Giudice ME et al. Gastroscopy following a positive fecal occult blood test and negative colonoscopy: systematic review and guideline. Can J Gastroenterol 2010; 24 (2): 113–120.
14. Lee JK, Liles EG, Bent S et al. Accuracy of fecal immunochemical tests for colorectal cancer: systematic review and meta-analysis. Ann Intern Med 2014; 160 (3): 171. doi: 10.7326/M13-1484.
15. Haug U, Kuntz KM, Knudsen AB et al. Sensitivity of immunochemical faecal occult blood testing for detecting left - vs right-sided colorectal neoplasia. Br J Cancer 2011; 104 (11): 1779–1785. doi: 10.1038/bjc.2011.160.
16. Guittet L, Guillaume E, Levillain R et al. Analytical comparison of three quantitative immunochemical fecal occult blood tests for colorectal cancer screening. Cancer Epidemiol Biomarkers Prev 2011; 20 (7): 1492–1501. doi: 10.1158/1055-9965.EPI-10-0594.
17. Nakama H, Zhang B, Zhang X. Evaluation of the optimum cut-off point in immunochemical occult blood testing in screening for colorectal cancer. Eur J Cancer 2001; 37 (3): 398–401.
18. Ahlquist DA, Sargent DJ, Loprinzi CL et al. Stool DNA and occult blood testing for screen detection of colorectal neoplasia. Ann Intern Med 2008; 149 (7): 441–450.
19. Imperiale TF, Ransohoff DF, Itzkowitz SH et al. Fecal DNA versus fecal occult blood for colorectal-cancer screening in an average-risk population. N Engl J Med 2004; 351 (26): 2704–2714.
20. Itzkowitz S, Brand R, Jandorf L et al. A simplified, noninvasive stool DNA test for colorectal cancer detection. Am J Gastroenterol 2008; 103 (11): 2862–2870. doi: 10.1111/j.1572-0241.2008.02088.x.
21. Kaminski MF, Regula J, Kraszewska E et al. Quality indicators for colonoscopy and the risk of interval cancer. N Engl J Med 2010; 362 (19): 1795–1803. doi: 10.1056/NEJMoa0907667.
22. Winawer SJ, Zauber AG, Ho MN et al. Prevention of colorectal cancer by colonoscopic polypectomy. The National Polyp Study Workgroup. N Engl J Med 1993; 329 (27): 1977–1981.
23. Robertson DJ, Greenberg ER, Beach M et al. Colorectal cancer in patients under close colonoscopic surveillance. Gastroenterology 2005; 129 (1): 34–41.
24. van Rijn JC, Reitsma JB, Stoker J et al. Polyp miss rate determined by tandem colonoscopy: a systematic review. Am J Gastroenterol 2006; 101 (2): 343–350.
25. Rogal SS, Pinsky PF, Schoen RE. Relationship between detection of adenomas by flexible sigmoidoscopy and interval distal colorectal cancer. Clin Gastroenterol Hepatol 2013; 11 (1): 73–78. doi: 10.1016/j.cgh.2012.08.002.
26. Kuipers EJ, Rösch T, Bretthauer M. Colorectal cancer screening – optimizing current strategies and new directions. Nat Rev Clin Oncol 2013; 10 (3): 130–142. doi: 10.1038/nrclinonc.2013.12.
27. El Zoghbi M, Cummings LC. New era of colorectal cancer screening. World J Gastrointest Endosc 2016; 8 (5): 252–258. doi: 10.4253/wjge.v8.i5.252.
28. Segnan N, Patnick J, von Karsa L et al. European guidelines for quality assurance in colorectal cancer screening and diagnosis. 1st ed. Luxembourg: Publications Office of the European Union 2010.
29. Atkin WS, Edwards R, Kralj-Hans I et al. Once-only flexible sigmoidoscopy screening in prevention of colorectal cancer: a multicentre randomised controlled trial. Lancet 2010; 375 (9726): 1624–1633. doi: 10.1016/S0140-6736 (10) 60551-X.
30. Segnan N, Armaroli P, Bonelli L et al. Once-only sigmoidoscopy in colorectal cancer screening: follow-up findings of the Italian Randomized Controlled Trial – SCORE. J Natl Cancer Inst 2011; 103 (17): 1310–1322. doi: 10.1093/jnci/djr284.
31. Holleran G, Leen R, O’Morain C et al. Colon capsule endoscopy as possible filter test for colonoscopy selection in a screen - ing population with positive fecal immunology. Endoscopy 2014; 46 (6): 473–478. doi: 10.1055/s-0034-1365402.
32. Zavoral M, Májek O, Tachecí I et al. Porovnání účinnosti kolonické kapslové endoskopie a kolonoskopie v detekci polypů a karcinomů tlustého střeva a konečníku – multicentrická, prospektivní, cross-over studie. Gastroent Hepatol 2014; 68 (3): 218–224.
33. Rex DK, Adler SN, Aisenberg J et al. Accuracy of capsule colonoscopy in detecting colorectal polyps in a screening population. Gastroenterology 2015; 148 (5): 948–957. doi: 10.1053/j.gastro.2015.01.025.
34. Gandon Y. Screening for colorectal cancer: the role of CT colonography. Diagn Interv Imaging 2014; 95 (5): 467–474. doi: 10.1016/j.diii.2014.03.012.
35. Heresbach D, Djabbari M, Riou F et al. Accuracy of computed tomographic colonography in a nationwide multicentre trial, and its relation to radiologist expertise. Gut 2011; 60 (5): 658–665. doi: 10.1136/gut.2010.225623.
36. Zavoral M, Suchanek S, Zavada F et al. Colorectal cancer screening in Europe. World J Gastroenterol 2009; 15 (47): 5907–5915.
37. Wilson JA. Colon cancer screening in the elderly: when do we stop? Trans Am Clin Climatol Assoc 2010; 121 : 94–103.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecná
Článek Gastrointestinální onkologieČlánek Zpráva z odborné stážeČlánek Ursodeoxycholová kyselinaČlánek Správná odpověď na kvíz
Článok vyšiel v časopiseGastroenterologie a hepatologie
Najčítanejšie tento týždeň
2016 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Gastrointestinální onkologie
- Vzácná komplikace ulcerózní kolitidy
- Současné principy screeningu kolorektálního karcinomu – od oportunního k populačnímu screeningovému programu
-
Mezioborová spolupráce ve screeningu kolorektálního karcinomu
Čekací doba na kolonoskopii - „Full-thickness“ endoskopická resekce lokální reziduální neoplazie v hepatální flexuře – videokazuistika
- Dlouhodobé výsledky po radikálních resekcích pro adenokarcinom žaludku
- SOUTĚŽ O DVĚ NEJLEPŠÍ PŮVODNÍ PRÁCE 2016
- Totální pankreatektomie a její současné místo v léčbě onemocnění pankreatu
- Modifikovaný FOLFIRINOX v léčbě karcinomu pankreatu – účinnost a toxicita
- Metastazující maligní melanom do trávicího traktu bez známého primárního ložiska
- „Watermelon stomach” jako první příznak cirhózy jater
- Vzácná komplikace koloskopie – cholelitiáza s komplikacemi
- Prehepatální portální hypertenze
- Extraezofageální a gastroezofageální reflux – vztah k astma bronchiale
- 48th Annual Meeting of the European Pancreatic Club in Liverpool, 6–9th July 2016
- Zpráva z odborné stáže
- Výběr z mezinárodních časopisů
- Kreditovaný autodidaktický test: gastrointestinální onkologie
- Ursodeoxycholová kyselina
- Správná odpověď na kvíz
- Gastroenterologie a hepatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Modifikovaný FOLFIRINOX v léčbě karcinomu pankreatu – účinnost a toxicita
- Prehepatální portální hypertenze
- Extraezofageální a gastroezofageální reflux – vztah k astma bronchiale
- Totální pankreatektomie a její současné místo v léčbě onemocnění pankreatu
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



