Naše zkušenosti s léčbou masivního krvácení u Crohnovy nemoci pomocí anti-TNF terapie
Experience in the treatment of severe bleeding in Crohn’s disease with anti-TNF therapy
Massive bleeding into the gastrointestinal tract (enterorrhagia) is a rare and life-threatening complication of Crohn’s disease (CD) and occurs in up to 4% of patients. The most common cause of enterorrhagia is a deep ulceration caused by inflammation of a part of the gastrointestinal tract. Risk factors for enterorrhagia have not yet been identified. Determination of the source of the bleeding and the extent of the inflammatory disorder are vital for successful treatment. Based on the results of examinations, a decision on the optimal treatment can be made. In this work, we describe two CD cases who were hospitalized at our workplace in 2016–2017. The first case was a patient who required hospitalization because of CD relapse in the colon area. The patient did not respond to conventional therapy and did not enter remission. Despite treatment, enterorrhagia propagated. The second case was a patient with massive enterorrhagia that appeared as the primary manifestation of CD relapse in the terminal ileum and colon. Conventional therapy did not lead to cessation of bleeding or remission. Instead, enterorhagia propagated. Using these selected case studies, we aim to demonstrate the efficacy of anti-TNF therapy in preventing gastrointestinal bleeding in CD patients. We note that anti-TNF therapy has the advantage of rapid onset in cases where conventional therapy has failed or in cases where other therapeutic methods such as mini-invasive procedures or surgical treatment cannot be used due to the high risk of “short-bowel syndrome”.
Key words: Crohn’s disease – enterorrhagia – anti-TNF – infliximab
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Submitted: 29. 1. 2018
Accepted: 24. 4. 2018
Autoři:
J. Ulbrych 1; K. Šlapalová 1; A. Ondrejková 1; J. Drábková 2; J. Vaníček 2; Bohuslav Kianička 1
Působiště autorů:
II. interní klinika LF MU a FN U sv. Anny v Brně
1; Klinika zobrazovacích metod LF MU a FN u sv. Anny v Brně
2
Vyšlo v časopise:
Gastroent Hepatol 2018; 72(3): 251-256
Kategorie:
IBD: kazuistika
prolekare.web.journal.doi_sk:
https://doi.org/10.14735/amgh2018251
Souhrn
Masivní krvácení do gastrointestinálního traktu (enteroragie) je vzácnou komplikací Crohnovy nemoci (CD – Crohn’s disease) vyskytující se přibližně u 4 % pacientů. Nejčastější příčinou bývají hluboké ulcerace v zánětem postižené části gastrointestinálního traktu. Dosud nebyly identifikovány rizikové faktory masivního krvácení. Předpokladem úspěšné léčby je určení zdroje krvácení a rozsahu zánětlivého postižení. Na základě výsledků vyšetřovacích metod pak můžeme udělat rozhodnutí o optimálním léčebném postupu. V této práci popisujeme případy dvou pacientek s CD hospitalizovaných na našem pracovišti v letech 2016–2017. V prvním případě se jedná o pacientku, jejíž relaps CD v oblasti tlustého střeva si vyžádal hospitalizaci. V průběhu hospitalizace však konvenční terapie nevedla k navození remise a i přes tuto léčbu se objevila významná enteroragie. V druhém případě se masivní enteroragie objevila jako prvotní manifestace relapsu CD v oblasti terminálního ilea a tlustého střeva. Konvenční terapie nevedla k zástavě krvácení a navození remise. Naopak, i přes tuto léčbu enteroragie výrazně progredovala. Na těchto vybraných kazuistikách chceme demonstrovat účinnost anti-TNF léčby při zástavě krvácení do gastrointestinálního traktu u pacientů s CD. Chceme poukázat na výhodu rychlého nástupu účinku této léčby při neúčinnosti konvenční terapie či nemožnosti (rizikovosti) jiných terapeutických metod (miniinvazivní přistupy, chirurgická léčba) při rozsáhlém zánětlivém postižení trávicího traktu.
Klíčová slova:
Crohnova nemoc – enteroragie – anti-TNF – infliximab
Úvod
Crohnova choroba (CD – Crohn’s disease) je chronické zánětlivé onemocnění postihující segmentálně či plurisegmentálně kteroukoli část gastrointestinálního traktu (GIT). Nejčastějšími lokálními komplikacemi CD jsou perforace, píštěle, abscesy, stenózy. Masivní krvácení je poměrně vzácnou komplikací CD a patří, i v dnešní době, mezi život ohrožující stavy. Příčinou krvácení u CD může být zánětlivý pseudopolyp, fistulace do větších cév (aorty), solitární ulcerace v oblasti střeva či žaludku, vícečetné ulcerace nebo difuzní zánětlivé postižení. Mezi konkrétní úkony, které poskytují informace potřebné k rozhodnutí o výběru nejvhodnějšího terapeutického postupu, patří lokalizace zdroje krvácení, posouzení rozsahu a aktivity zánětlivého postižení GIT, posouzení dosavadního průběhu CD a reakcí pacienta na již v minulosti prodělanou léčbu, a hlavně na celkový stav pacienta a očekávanou kvalitu životu.
Kazuistika 1
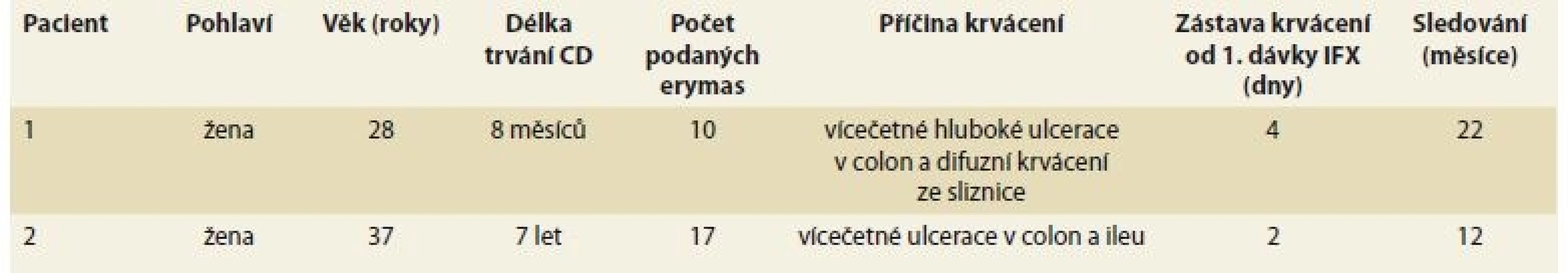
Žena, 28 let, s anamnézou primární hypotyreózy, asthma bronchiale a polyvalentní alergií byla léčena od srpna 2015 pro CD s postižením tlustého střeva. V počátcích onemocnění se povedlo navodit remisi kombinací kortikoidu a mesalazinu. Zahájená imunomodulační léčba azathioprinem musela být ukončena pro lehkou pankreatitidu již v 1. týdnu užívání. Od podzimu 2015 do jara 2016 u pacientky přetrvávala remise na terapii mesalazinem v dávce 4,0 g denně. Koncem března 2016 nastal relaps onemocnění manifestovaný průjmy a bolestmi břicha. Ambulantně zahájená léčba kortikoidy (prednison 40 mg denně) nevedla ke zlepšení klinického stavu pacientky, který si vyžádal hospitalizaci na jednotce intenzivní metabolické péče.
Při přijetí pacientka udávala průjmovité stolice (až 10× denně) s příměsí jasně červené krve a váhový úbytek cca 3 kg v posledním týdnu. Ve vstupním laboratorním vyšetření byl zvýšený C reaktivní protein (CRP) na hodnotu 17,3 mg/l, počet leukocytů 8,9 × 109/l a hodnota hemoglobinu (Hb) 139 g/l, ostatní výsledky byly v mezích normy. Zahájená léčba zahrnovala podávání kortikoidů parenterálně (metylprednisolon 60 mg denně) a bowel-rest formou enterální výživy. Při této terapii se klinický stav pacientky zlepšil jen přechodně. Druhý týden hospitalizace došlo ke zhoršení stavu – objevily se subfebrilie, bolesti břicha, nárůst frekvence stolic se zvyšující se přítomností krve. Laboratorně došlo k vzestupu leukocytů na 17,2 × 109/l a CRP na 72 g/l a poklesu Hb na 115 g/l. Kultivace stolice i průkaz klostridiového toxinu byly negativní. Provedená vyšetření – CT břicha a enterografie využívající magnetické rezonance (MR) – prokázaly postižení tračníku s maximem zánětlivých změn v oblasti colon transversum a descendens, volnou tekutinou parakolicky vlevo a v malé pánvi, bez jasného zdroje krvácení na zobrazovacích metodách. Následně provedená totální koloskopie prokázala segmentální kolitidu s četnými hlubokými, rozsáhlými ulceracemi v terénu zánětlivě změněné sliznice, sliznice v terminálním ileu byla intaktní. Zdroj krvácení ošetřitelný endoskopicky patrný nebyl, předpokládaným zdrojem bylo difuzní krvácení z vícečetných ulcerací a zánětlivě změněné sliznice. Přidání antibiotik k terapii (metronidazol a ciprofloxacin parenterálně) a převedení na totální parenterální výživu byly bez efektu. Pokračující krvácení si vyžádalo podání osmi krevních transfuzí během 4 dnů (nejnižší hodnota Hb 66 g/l), další dvě erymasy dostala v následujícím průběhu hospitalizace. Osmnáctý den hospitalizace byl podán infliximab (Remicade®) v dávce 10 mg/kg. To vedlo k rychlému zlepšení stavu pacientky, již 2. den od podání léku došlo jak ke snížení četnosti stolic, tak i přítomnosti krve ve stolici. Od 4. dne již příměs krve nebyla patrná. Vysazování kortikoterapie jsme zahájili týden od podání anti-TNF terapie současně s přechodem na enterální výživu, kdy jsme snížili dávku 60 mg metylprednisolonu podávanou parenterálně na 48 mg perorálně. Dále jsme kortikoidy snižovali o 8 mg týdně. Druhou dávku infliximabu jsme podávali v dávce 5 mg/kg 2. týden dle standardního dávkování iniciační léčby [1]. Při koloskopickém vyšetření provedeném před dimisí, 7. den od podání druhé dávky infliximabu, byly patrné reparativní změny sliznice bez známek aktivního zánětu. Pacientka byla propouštěna z hospitalizace s hodnotou Hb 121 g/l, počtem leukocytů 12,1 × 109/l a CRP 2,2 mg/l. Další aplikace anti-TNF terapie již pokračovala ambulantně ve standardním schématu, tedy 5 mg/kg 6. týden a dále à 8 týdnů. Od relapsu v dubnu 2016 je pacientka v remisi. Léčba anti-TNF byla ukončena v létě 2017 ve 2. trimestru gravidity. Porod v říjnu 2017 proběhl per vias naturales a bez komplikací. Pacientka je 6 měsíců od porodu bez známek relapsu CD či recidivy krvácení.
Kazuistika 2
Žena, 37 let, byla léčená pro ulcerózní kolitidu od roku 2009, kdy se tato choroba manifestovala enteroragií. Diagnóza byla stanovena na základě histologického nálezu. Léčba mesalazinem vedla k remisi. V květnu 2010 byl popisován koloskopický nález bělavých jizev po zhojených ulceracích v oblasti colon transversum, descendens a sigmoideum. Remise trvala až do prosince 2016, kdy se objevily krvavé stolice. Při parciální koloskopii provedené na spádové gastroenterologické ambulanci byla popisována sliznice normálního vzhledu do 20 cm od anu, dále orálně vícečetné okrouhlé ulcerace velikosti asi 10 mm obklopené makroskopicky nezánětlivou sliznicí. Pacientka byla přijata k hospitalizaci na spádovém interním oddělení, kde zahájili systémovou léčbu kortikoidy (prednison v dávce 20 mg/den) a mesalazinem (3,2 g/den) a antibiotickou terapii (ciprofloxacin s metronidazolem). Po částečném klinickém zlepšení byla pacientka propuštěna, avšak přetrvávající enteroragie si vyžádala brzkou rehospitalizaci na původním pracovišti. Prednison byl navýšen na 40 mg denně, ostatní léčba byla ponechána.
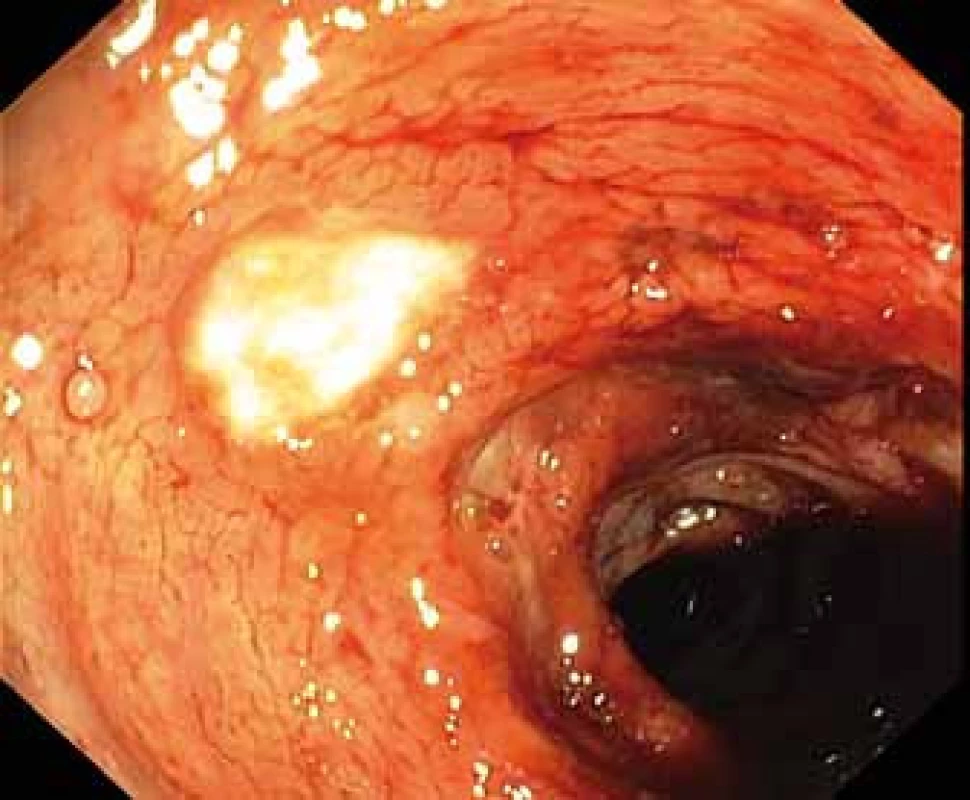
V lednu 2017 byla pacientka přijata na naši kliniku. Vstupně dominovala výrazná zánětlivá aktivita s CRP 172 mg/l, anémie s Hb 96 g/l, celkový váhový úbytek od začátku potíží činil 10 kg. I přes zavedenou komplexní terapii – totální parenterální výživa, intravenózní kortikoidy (metylprednisolon 60 mg), antibiotika (metronidazol 750 mg/den, ciprofloxacin 400 mg/den) – došlo k významné anemizaci. Pokles Hb (min. hodnota Hb 52 g/l) si vyžádal podávání 3–4 erymas denně a mražené plazmy (celkem podáno 17 erymas během 5 dnů a 12 jednotek mražené plazmy). Koloskopie prokázala aktivní krvácení s hojnou přítomností krve a koagul v lumen. Zdrojem bylo krvácení z mnohočetných okrouhlých ulcerací v rozsahu od 20 cm od anu orálně až na dno céka, přítomny byly ulcerace i v terminálním ileu (obr. 1–3). Endoskopicky ošetřitelný zdroj krvácení nebyl patrný. Zdroj aktivního krvácení neobjasnila ani provedená CT angiografie. Histologické vyšetření vzorků odebraných při koloskopii odpovídalo těžké chronické aktivní enteritidě/kolitidě s rysy favorizujícími diagnózu CD. V některých histologických vzorcích byly popsány známky vaskulitidy. Pro možnost systémové vaskulitidy (v diferenciální diagnostice zvažována např. Behcetova nemoc) však nesvědčila imunologická laboratorní vyšetření, a zejména absence klinických projevů (např. ulcerace v dutině ústní, kožní projevy apod.).
Fig. 1. Terminal ileum with blood and fibrin on ulceration.
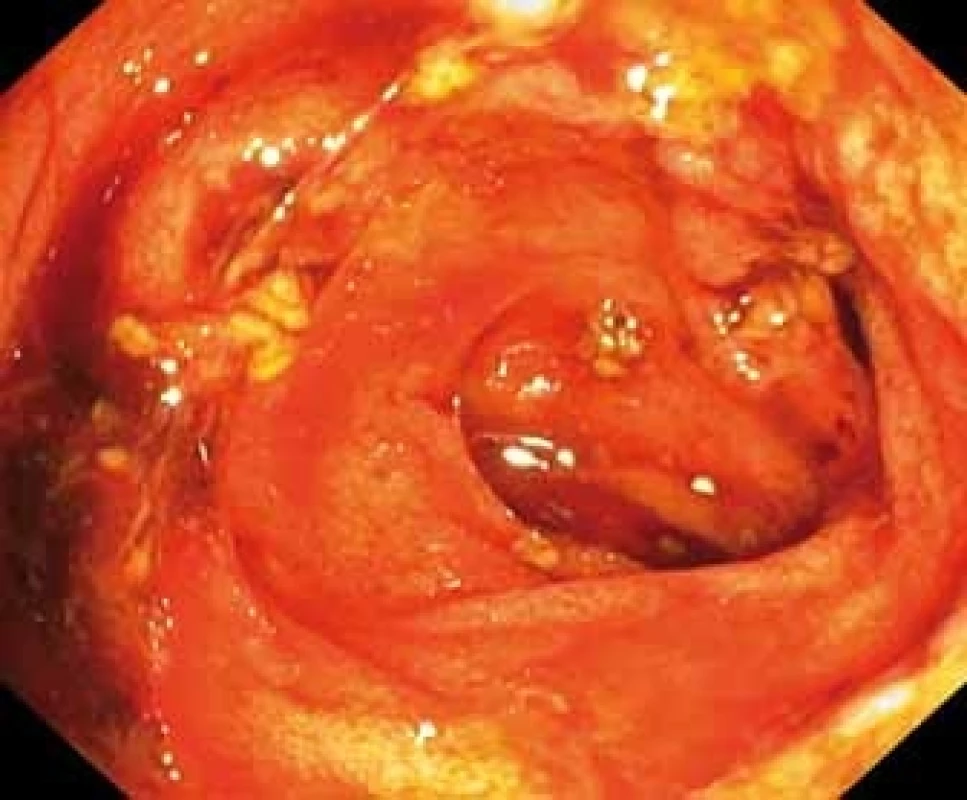
Fig. 2. Lumen of the ascending colon – completely filled with blood and coagulum.
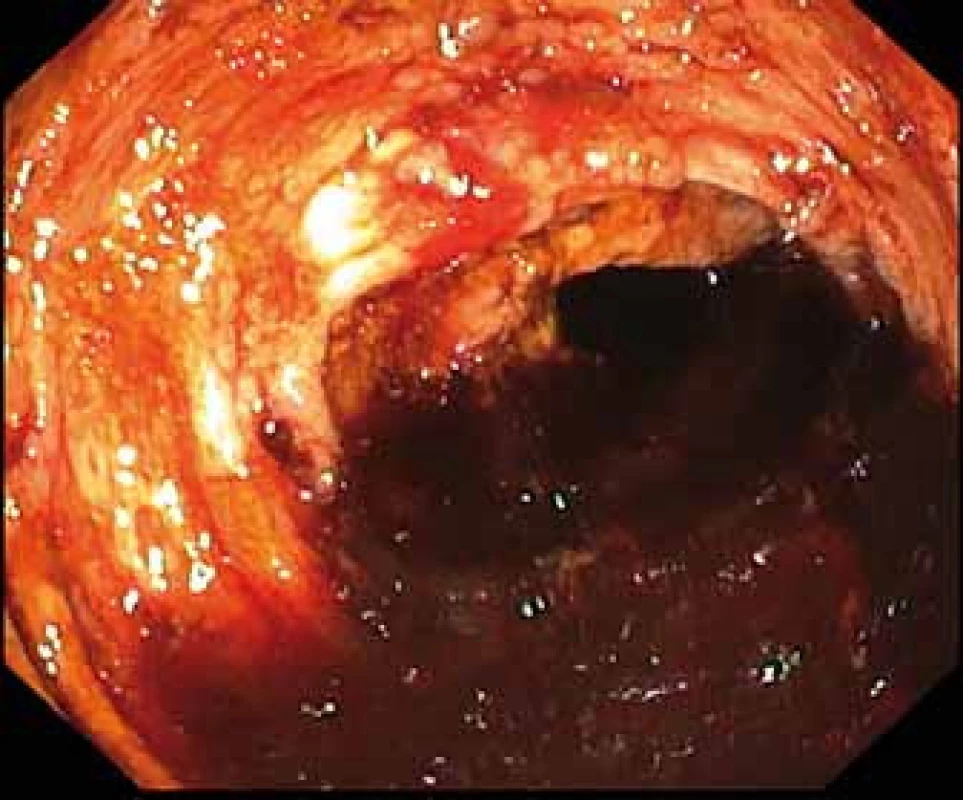
Fig. 3. Round ulceration with fibrin on the surface in the descending colon.
Vzhledem k pokračující anemizaci byla zvažována chirurgická léčba či podání systémového hemostatika – rekombinantního faktoru VIIa. Sedmý den hospitalizace po doplnění nezbytných vyšetření jsme zahájili záchrannou biologickou léčbu – anti-TNF – infliximab (Remicade®) v dávce 10 mg/kg s promptním efektem. Již 2. den po podání vymizela příměs krve ve stolici. Pacientka byla postupně převedena na enterální výživu a posléze na normální stravu, parenterální kortikoterapie na perorální formu a dávka postupně redukována. Jednadvacátý den jsme pacientku propouštěli z hospitalizace s hodnotou Hb 114 g/l a CRP 1,0 mg/l.
Do srpna 2017 pokračovala ambulantní léčba infliximabem v dávce 5 mg/kg à 8 týdnů a mesalazinem v dávce 3,2 g/den. V této době pacientka referovala mírné zhoršení klinického stavu ve dnech těsně před aplikací infliximabu. Při kontrolní koloskopii byly patrné aktivní zánětlivé změny v oblasti terminálního ilea, Bauhinské chlopně a colon sigmoideum, s nálezem četných aft a drobných ulcerací. Do medikace byl přidán azathioprin a vzhledem k výsledku laboratorních odběrů (hladina infliximabu před aplikací < 0,4 mg/l, protilátky proti infliximabu negativní) eskalována léčba infliximabem na 10 mg/kg à 8 týdnů. V současné době je pacientka bez klinických potíží, s 1–2 formovanými stolicemi, bez recidivy krvácení.
Diskuze
CD je často spojena s mírným gastrointestinálním krvácením, masivní krvácení je však vzácnou komplikací. V publikovaných souborech je hlášen výskyt závažného krvácení u CD v rozmezí od 0,6 do 4 % [2].
Zdrojem krvácení bývají nejčastěji ulcerace erodující větší cévy ve střevní stěně. Popisovány jsou i hemoragie z pseudopolypů či fistulací [3,4]. Rizikové faktory v současnosti nejsou známy – v dosud publikovaných souborech pacientů s masivním krvácením do GIT při CD nebyl nalezen statisticky významný rozdíl ve věku, délce trvání CD, pohlaví či medikaci [5].
Základem úspěšné léčby je určení zdroje krvácení a posouzení celkové aktivity nemoci a rozsahu zánětlivého postižení. Vzhledem k závažnosti této komplikace využíváme kombinace dostupných diagnostických modalit zahrnujících endoskopii trávicího traktu, vč. enteroskopie, sonografické vyšetření, radionuklidové vyšetření krvácení, mezenterickou angiografii, enterografii pomocí CT či MR a endoskopii kapslí [6–11].
Léčba masivního krvácení při CD nabízí možnosti konzervativní, miniinvazivní a chirurgické. Miniinvazivní terapeutické techniky vyžadují jednoznačné určení zdroje krvácení pomocí endoskopických či radiologických metod. Endoskopické možnosti stavění krvácení zahrnují standardní mechanické či termokoagulační techniky. U radiologických intervencí lze užít mikrokatetrů či embolizačních látek, při krvácení z difuzních lézí se využívá intraarteriální aplikace vazopresinu. Nevýhodou radiologických invazivních metod je riziko ischemického postižení střeva.
Chirurgická léčba je nedílnou součástí léčby CD. Při nedostatečné předoperační lokalizaci krvácení může být nevýhodou delší doba operačního výkonu v důsledku hledání zdroje krvácení a také nadbytečný rozsah resekčního výkonu. Dalšími riziky chirurgického výkonu jsou, kromě operačních a pooperačních komplikací, syndrom krátkého střeva či stomie (ať již dočasné či trvalé).
Konzervativní farmakologická léčba zahrnuje obecnou intenzivní léčbu (katecholaminy, krystaloidy, krevní deriváty apod.) a konvenční léčbu CD – kortikoidy, imunosupresiva. Ačkoli efekt konvenční léčby dosahuje až 80 %, nese s sebou vysoké riziko relapsu krvácení (až u 40 % pacientů) [5]. K zástavě masivního krvácení je kazuisticky popsána i účinnost rekombinantního faktoru VIIa [12]. Publikovány jsou i práce prokazující efekt podání thalidomidu [13].
Anti-TNF protilátky jsou již 20 let součástí konzervativní farmakologické léčby idiopatických střevních zánětů (IBD – inflammatory bowel disease). Efekt anti-TNF na hojení sliznic je rychlý a vede k endoskopickému zhojení ulcerací během prvních dnů po podání infliximabu [14]. Poprvé bylo použití tohoto efektu při léčbě masivního krvácení u CD publikovaného týmem belgických autorů v roce 2002 [15]. Od té doby přibývá publikací dokazujících efekt anti-TNF terapie na zástavu krvácení při CD [16–22]. Ve většině případů došlo k zástavě krvácení v prvních 4 dnech od podání infliximabu (tab. 1). Užití infliximabu nevedlo jen k zástavě krvácení, ale i ke snížení rizika opětovného krvácení. Riziko recidivy krvácení je v éře před anti-TNF terapií uváděno 19–41 % [2]. Riziko opětovného krvácení při léčbě infliximabem na základě dostupných dat je 9,1 % [22].
Tab. 1. Patients with severe enterorrhagia in Crohn’s disease successfully treated with infiximab (previously published case reports).
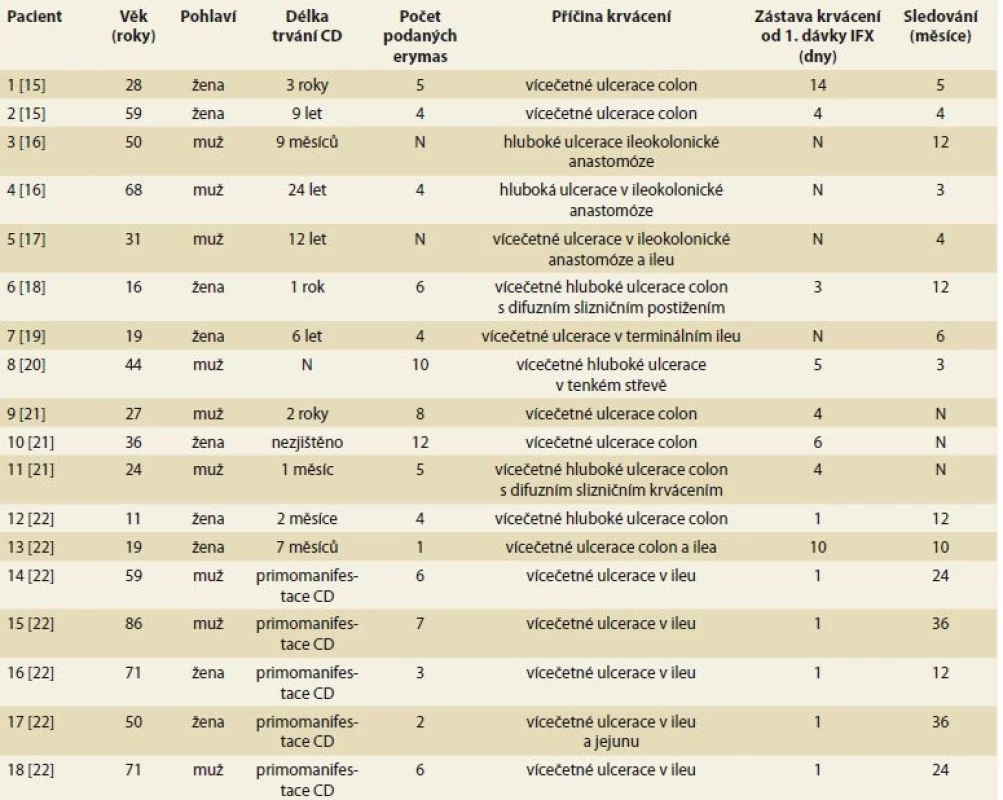
V dosud publikovaných kazuistikách bylo při léčbě použito standardní dávkování infliximabu pro léčbu CD – iniciační léčba v dávce 5 mg/kg v intervalu 0., 2., a 6. týden. V případě našich kazuistik jsme použili úvodní dávku 10 mg/kg užívanou jako záchrannou léčbu při fulminantně probíhající ulcerózní kolitidě [1]. Tento postup jsme zvolili s přihlédnutím k celkovému stavu pacientek, vysoké spotřebě krevních derivátů a rozsahu zánětlivého postižení, který neumožňoval využití minimálně invazivních metod. Chirurgické řešení by u obou pacientek jistě vedlo k rozsáhlému resekčnímu výkonu. Předpokládali jsme vyšší účinnost oproti dávce 5 mg/kg. U obou pacientek jsme tedy zahájili léčbu infliximabem v dávce 10 mg/kg a dále pak pokračovali ve standardním dávkování 5 mg/kg ve 2., 6. týdnu a dále à 8 týdnů. Použitím vyšší úvodní dávky infliximabu se lišíme oproti dosud publikovaným kazuistickým sdělením [15–22]. Efekt na zástavu krvácení byl u obou pacientek rychlý a odpovídá i reakci na podání infliximabu v dosud publikovaných kazuistikách, kde pouze u jedné pacientky došlo k zástavě krvácení až po podání druhé dávky infliximabu. Srovnatelného efektu jsme dosáhli i udržovací léčbou infliximabu. Ani u jedné z pacientek uvedených v tomto sdělení nedošlo k recidivě masivního krvácení po dobu sledování (tab. 2). Podaná vyšší dávka infliximabu nevedla k žádným komplikacím.
Tab. 2. Characteristics of two patients treated with infliximab for massive enterorrhagia in Crohn’s disease.
Nelze posoudit, zda by reakce na nižší dávku infliximabu (5 mg/kg) byla srovnatelná s námi podanou dávkou 10 mg/kg. Ke zhodnocení účinnosti jednotlivých dávek infliximabu by při řešení této komplikace CD pomohly srovnávací studie. Vzhledem k nízkému výskytu masivního krvácení při CD však nelze očekávat možnost srovnání pomocí randomizovaných studií.
Závěr
Masivní krvácení u CD je vzácnou akutní komplikací tohoto chronického onemocnění. Dle zkušeností plynoucích z našich kazuistik i dle publikované literatury by lékem první volby měla být léčba pomocí anti-TNF protilátek, a to zejména v případě krvácení, které neumožňuje minimálně invazivní terapii, či tam, kde není efekt konvenční farmakologické léčby. Možnost užití anti-TNF terapie v této indikaci by mohlo vést ke zkrácení délky hospitalizace, snížení spotřeby krevních derivátů a nutnosti chirurgického řešení.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 29. 1. 2018
Přijato: 24. 4. 2018
MUDr. Jan Ulbrych
II. interní klinika LF MU a FN u sv. Anny v Brně
Pekařská 664/ 53 656 91 Brno
Zdroje
1. Bortlík M, Ďuricová D, Kohout P et al. Doporučení pro podávání biologické terapie u idiopatických střevních zánětů: třetí, aktualizované vydání. Gastroent Hepatol 2016; 70 (1): 11–26. doi: 10.14735/amgh201611.
2. Podugu A, Tandon K, Castro FJ. Crohn’s disease presenting as acute gastrointestinal hemorrhage. World J Gastroenterol 2016; 22 (16): 4073–4078. doi: 10.3748/wjg.v22.i16.4073.
3. Kim JH, Kim WH, Choi CH et al. A case of Crohn‘s disease with iliac arterio-enteric fistulae. Korean J Gastroenterol 2003; 42 (1): 77–80.
4. Belaiche J, Louis E, D’Haens G et al. Acute lower gastrointestinal bleeding in Crohn’s disease: characteristics of a unique series of 34 patients. Belgian IBD Research Group. Am J Gastroenterol 1999; 94 (8): 2177–2181. doi: 10.1111/j.1572-0241.1999.01291.x.
5. Kim KJ, Han BJ, Yang SK et al. Risk factors and outcome of acute severe lower gastrointestinal bleeding in Crohn’s disease. Dig Liver Dis 2012; 44 (9): 723–728. doi: 10.1016/j.dld.2012.03. 010.
6. Falt P et al. Doporučené postupy České gastroenterologické společnosti ČLS JEP pro diagnostickou a terapeutickou koloskopii. Gastroent Hepatol 2016; 70 (6): 523–538. doi: 10.14735/amgh2016csgh.info19.
7. Yamaguchi T, Manabe N, Hata J et al. The usefulness of transabdominal ultrasound for the diagnosis of lower gastrointestinal bleeding. Aliment Pharmacol Ther 2006; 23 (8): 1267–1272.
8. Olds GD, Cooper GS, Chak A et al. The yield of bleeding scans in acute lower gastrointestinal hemorrhage. J Clin Gastroenterol 2005; 39 (4): 273–277.
9. Fidler JL, Goenka AH, Fleming CJ et al. Small bowel imaging: computed tomography enterography, magnetic resonance enterography, angiography, and nuclear medicine. Gastrointest Endosc Clin N Am 2017; 27 (1): 133–152. doi: 10.1016/j.giec.2016.08.008.
10. Vaníček J, Hruška L, Kianička B. Vyšetření tenkého střeva pomocí magnetické rezonance. Vnitř Lék 2015; 61 (2): 125–128.
11. Tachecí I, Lata J, Rejchrt S et al. Standard ČGS pro kapslovou endoskopii tenkého střeva. Gastroent Hepatol 2011; 65 (4): 195–201.
12. Girona E, Borrás-Blasco J, Conesa-García V et al. Successful treatment of severe gastrointestinal bleeding secondary to Crohn disease with recombinant factor VIIa. South Med J 2007; 100 (6): 601–604. doi: 10.1097/SMJ.0b013e 31804859a4.
13. Bauditz J. Effective treatment of gastrointestinal bleeding with thalidomide – chances and limitations. World J Gastroenterol 2016; 22 (11): 3158–3164. doi: 10.3748/wjg.v22.i11.3158.
14. D‘Haens G, Van Deventer S, Van Hogezand R et al. Endoscopic and histological healing with infliximab anti-tumor necrosis factor antibodies in Crohn‘s disease: a European multicenter trial. Gastroenterology 1999; 116 (5): 1029–1034.
15. Belaiche J, Louis E. Severe lower gastrointestinal bleeding in Crohn‘s disease: successful control with infliximab. Am J Gastroenterol 2002; 97 (12): 3210–3211. doi: 10.1111/j.1572-0241.2002.07143.x
16. Papi C, Gili L, Tarquini M et al. Infliximab for severe recurrent Crohn‘s disease presenting with massive gastrointestinal hemorrhage. J Clin Gastroenterol 2003; 36 (3): 238–241.
17. Tsujikawa T, Nezu R, Andoh A et al. Inflixmab as a possible treatment for the hemorrhagic type of Crohn’s disease. J Gastroenterol 2004; 39 (3): 284–287.
18. Ando Y, Matsushita M, Kawamata S et al. Infliximab for severe gastrointestinal bleeding in Crohn‘s disease. Inflamm Bowel Dis 2009; 15 (3): 483–484. doi: 10.1002/ibd.20635.
19. Meyer MM, Levine EJ. Acute hemorrhagic Crohn’s disease controlled with infliximab. Inflamm Bowel Dis 2009; 15 (10): 1456–1457. doi: 10.1002/ibd.20840.
20. Julián Gómez L, Atienza R, Barrio J et al. Infliximab treatment of severe bleeding complicating Crohn’s disease. Rev Esp Enferm Dig 2010; 102 (1): 57–58.
21. Alcalde Vargas A, Justiniano JM, Carnerero EL et al. Utility of infliximab therapy in severe enterorrhagia associated with Crohn’s disease. Report of three cases. Gastroenterol Hepatol 2011; 34 (1): 24–28. doi: 10.1016/j.gastrohep.2010.09.004.
22. Aniwan S, Eakpongpaisit S, Imraporn B et al. Infliximab stopped severe gastrointestinal bleeding in Crohn’s disease. World J Gastroenterol 2012; 18 (21): 2730–2734. doi: 10.3748/wjg.v18.i21.2730.
Štítky
Detská gastroenterológia Gastroenterológia a hepatológia Chirurgia všeobecnáČlánok vyšiel v časopise
Gastroenterologie a hepatologie
2018 Číslo 3
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Kombinace paracetamolu s kodeinem snižuje pooperační bolest i potřebu záchranné medikace
Najčítanejšie v tomto čísle
- Vistaprep – standard přípravy střeva před koloskopickým vyšetřením
- Tumorózní atrioezofageální píštěl jako neobvyklý zdroj sepse
- Intoxikácia Amanita phalloides – stále aktuálny problém?
- Naše zkušenosti s léčbou masivního krvácení u Crohnovy nemoci pomocí anti-TNF terapie
