-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Biopsie mozku v deseti bodech – co může neurolog očekávat od neurochirurga a neuropatologa?
Brain biopsy in 10 key points – what can a neurologist expect from the neurosurgeon and the neuropathologist?
Brain biopsy represents an important technique in the verification of focal brain processes. Nowadays, either framebased or frameless stereotactic biopsies are performed. Open biopsy from a craniotomy is reserved for cases of non-conclusive stereotactic biopsy that demand histological verification of the process which would change the treatment strategy or in case when there is a need for sample for histological examination, i.e. cortical vessel or dura mater. The risk of biopsy is not zero. Therefore, we should always consider the indication for biopsy. Primary biopsy of spinal cord is not indicated.
Key words:
brain biopsy – frambased biopsy – frameless biopsy – histology
Autoři: O. Bradáč; A. Štekláčová; F. Kramář; D. Netuka; V. Beneš
Působiště autorů: Neurochirurgická a neuroonkologická klinika 1. LF UK a ÚVN Praha
Vyšlo v časopise: Cesk Slov Neurol N 2018; 81(2): 229-234
Kategorie: Neuropatologické okénko
prolekare.web.journal.doi_sk: https://doi.org/10.14735/amcsnn2018229Souhrn
Biopsie mozku je jednou z významných technik používaných k ověření ložiskového postižení mozku. Ve většině případů se v dnešní době provádí buď rámová nebo bezrámová stereotaktická biopsie. Otevřená biopsie z kraniotomie se provádí v případech nejasných nálezů při stereotaktické biopsii a nutnosti histologické verifikace ložiska nebo v případech, kdy je třeba odebrat mimo mozku i např. kortikální tepnu nebo tvrdou plenu. Rizika výkonu nejsou nulová. Proto je třeba vždy indikaci k biopsii mozku zvažovat v kontextu přínosu biopsie a změny léčebné strategie. Primární biopsie míchy se neprovádí.
Klíčová slova:
mozková biopsie – rámová biopsie – bezrámová biopsie – histologieÚvod
Biopsie mozkových patologií se v současnosti provádějí na všech neurochirurgických pracovištích. Nejčastěji se jedná o bioptické ověření – histologickou typizaci mozkových tumorů. Menší podíl biopsií připadá na nejasná mozková zánětlivá onemocnění vč. autoimunitních, abscesy a degenerativní onemocnění. Účelem textu je seznámit neurologa s indikacemi, technickým provedením, výsledky a komplikacemi v současnosti nejužívanějších forem biopsií, zejména stereotaktických.
1. Kdo indikuje biopsii mozku a její způsob provedení?
Biopsii mozku indikuje neurochirurg, který po dohodě s neurologem, neuroradiologem a pacientem určí rozsah výkonu v závislosti na mnoha parametrech. Nejčastěji se jedná o biopsii z expanzivního ložiska podezřelého z nádorového procesu. Typickými nálezy jsou gliomy, metastázy a primární lymfomy CNS (obr. 1).
Obr. 1. Typický nález glioblastoma multiforme (a), metastáza karcinomu rekta (b), primární lymfom CNS (c). Fig. 1. A typical image of glioblastoma multiforme (a), metastasis of carcinoma of rectum (b), primary CNS lymphoma (c). 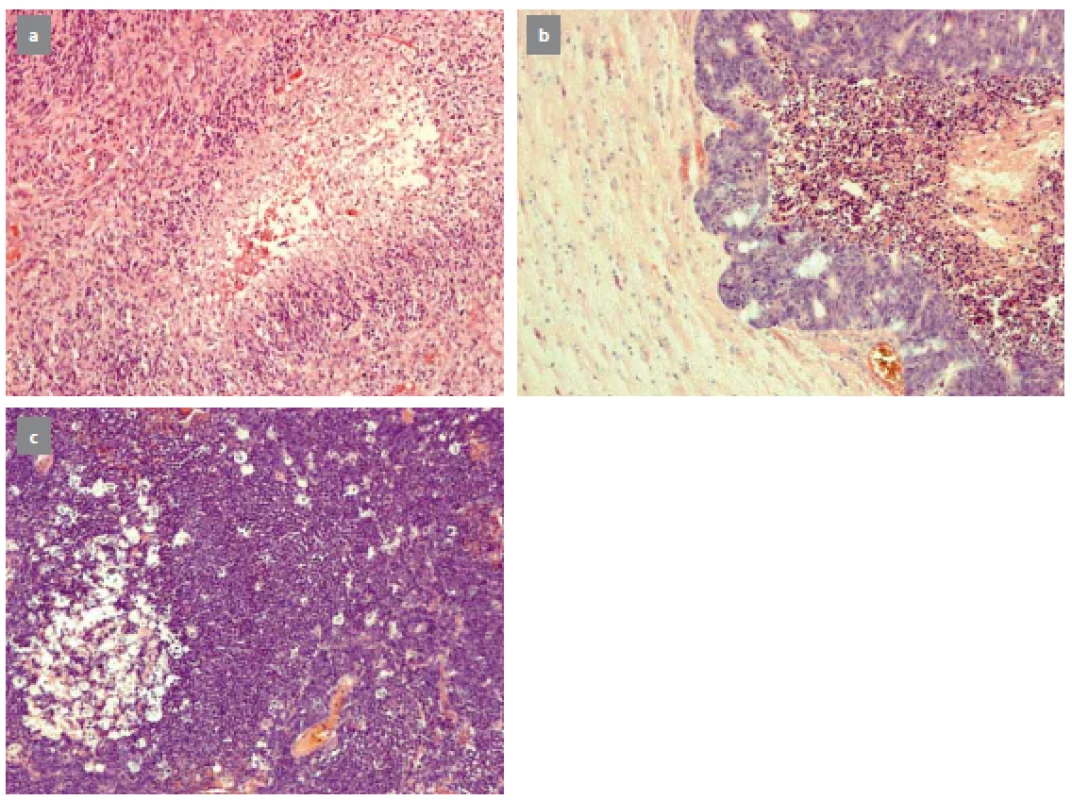
2. U kterých lézí je stereotaktická biopsie nutná, u kterých vhodná a proč?
Obecně lze říci, že stereotaktická biopsie je u tumorů indikována v případě, že je tumor vzhledem ke své lokalizaci neresekovatelný nebo by případná resekce přinášela neakceptovatelná rizika anebo pacientova neurologická či interní kondice je nedostatečná pro otevřený resekční výkon. Nemalou roli hraje samozřejmě posouzení snímkové dokumentace, která v mnoha případech napovídá druh patologie. To platí zejména pro gliální nádory mozku a z nich nejčastější vysokostupňové gliomy.
V případě suspekce na metastatické postižení vždy nejprve pátráme po primárním ložisku. Biopsie z ložiska intrakraniálního přichází v úvahu v momentě, kdy se primární nádor nedaří nalézt a histologická typizace intrakraniálního ložiska může přispět k dalšímu léčebnému postupu, a to zejména u nádorů, u nichž existují možnosti tzv. cílené biologické léčby. Histopatologický nález je pak zásadní pro rozhodnutí o dalším léčebném postupu (observace, resekční výkon, radioterapie, radiochirurgie, chemoterapie).
Diagnostická výtěžnost je definována jako „Pravděpodobnost, že dané vyšetření/ procedura poskytne informaci potřebnou ke stanovení diagnózy“. Tato definice však nezohledňuje přesnost diagnózy. V případě biopsií mozkových procesů můžeme ve shodě s Khatabem et al [1] rozdělit výsledky histologických vyšetření bioptických vzorků do tří skupin:
- Konkluzivní – takové, kde je v případě tumoru s jistotou určen histologický typ i grade dle klasifikace WHO. V případě non-neoplastické léze je vyšetření diagnostické ve smyslu určení konkrétní diagnózy (infekce, autoimunitní proces). V současnosti se zejména u gliálních nádorů či metastáz přidává i možnost molekulárně patologické analýzy.
- Nekonkluzivní – takové, kde nelze v případě tumoru jednoznačně určit typ či grade nádorového procesu a v případě non-neoplastické léze je histopatologická diagnóza nejednoznačná, bez možnosti přesnějšího zařazení zánětlivého často autoimunitního onemocnění.
- Nediagnostické – vzorky bez známek tumoru či non-neoplastické léze, často obsahují jen reaktivní změny. Nejpravděpodobnější příčinou je chyba v zásahu při odběru.
Většina publikovaných prací zabývajících se diagnostickou výtěžností neuvádí jeho přesnou definici. Na základě review analýzy celkem 1 628 pacientů získávají Khatab et al [1] průměrnou referovanou diagnostickou výtěžnost 93,8 %, rozsah 87 – 100 %. Ve své vlastní sestavě čítající 235 procedur uvádí konkluzivní výsledek biopsie v 72,8 %, nekonkluzivní potom v dalších 21,7 %. V naší sestavě 101 procedur bezrámových stereotaktických biopsií byla konkluzivní diagnostická výtěžnost u 79 % pacientů, nekonkluzivní potom ve 13 % případů [2].
Navrhované metody pro zvýšení diagnostické výtěžnosti jsou: provádění peroperačního histologického vyšetření [3], cílení biopsie dle metabolické aktivity procesu hodnocené dle PET [4], či spektroskopické MR [5], event. kombinace těchto metod [6]. V naší rutinní praxi používáme intraoperační MR k ověření místa odběru a vyloučení chirurgických komplikací (obr. 2).
Obr. 2. Peroperační MR kontrola, T1 vážení s kontrastem. Šipkou označen bioptický kanál končící v ložisku. Bez krvácivé komplikace. Fig. 2. Intraoperative MRI, T1 image with contrast. Channel after biopsy runs into the lesion (arrow). No postoperative bleeding. 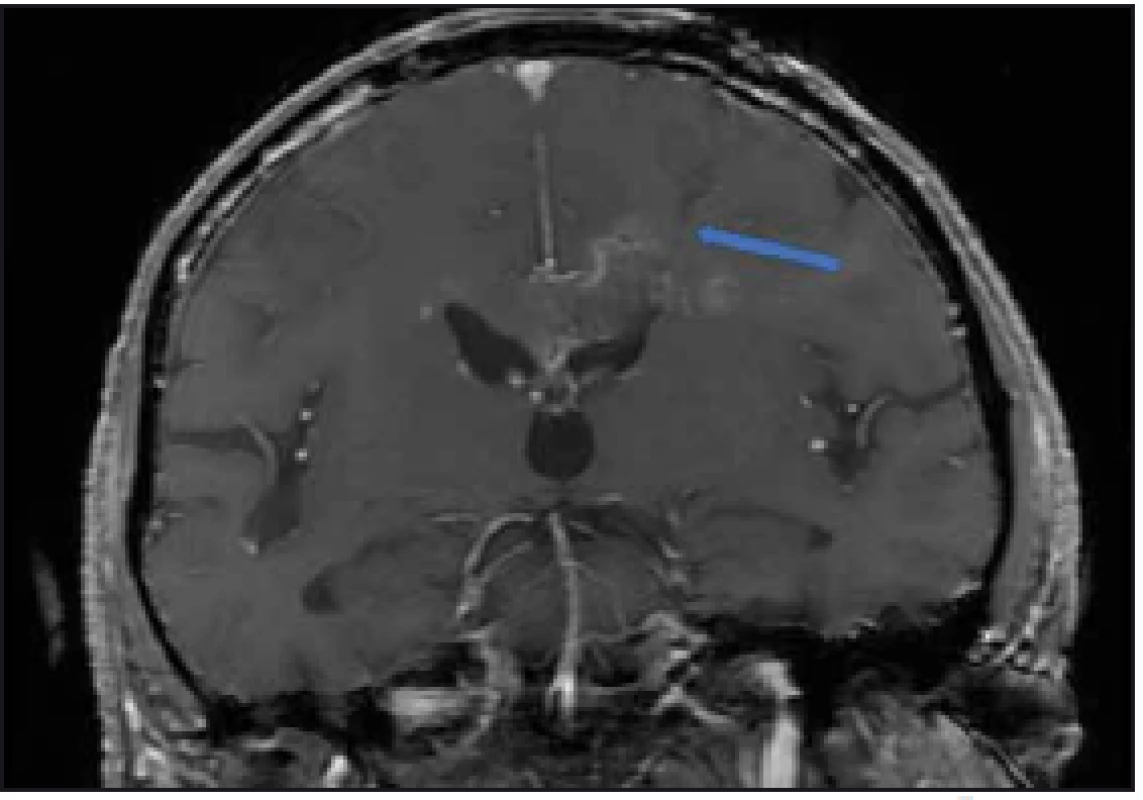
Na obr. 3 je zobrazen typický vzorek, který je odebrán při stereotaktické biopsii.
Obr. 3. Odebrané bioptické vzorky. Fig. 3. Bioptic samples. 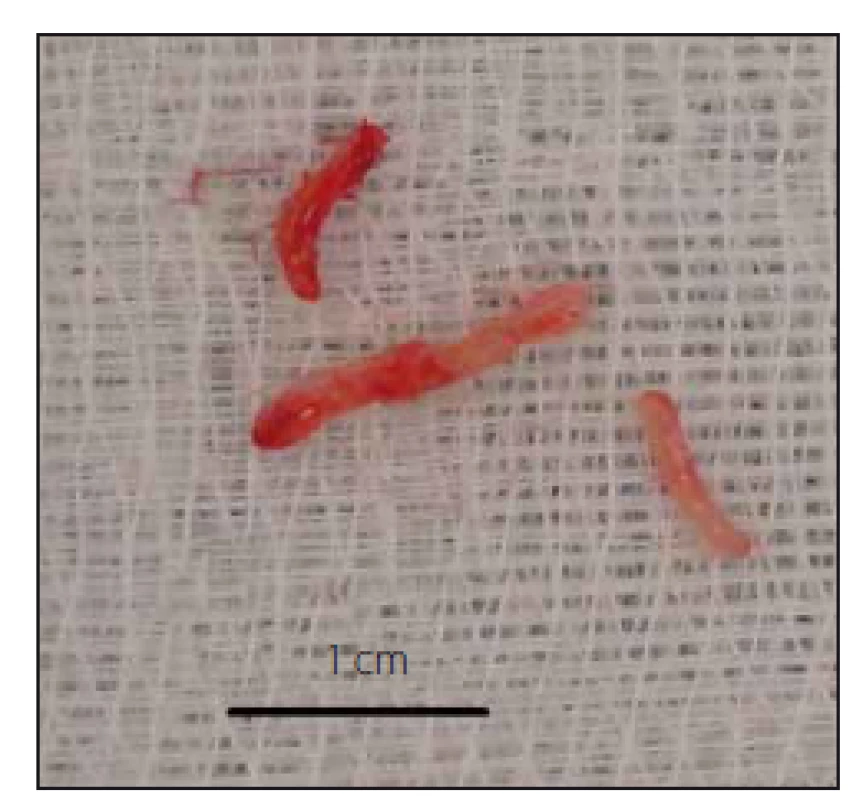
3. Kdy je lepší provést stereotaktickou biopsii?
Ve většině případů se v dnešní době provádí stereotaktická biopsie punkční jehlou pouze z návrtu vzhledem k tomu, že tento výkon je méně invazivní než biopsie z kraniotomie. Ve všech případech je standardem užití obrazové navigace, nejčastěji na podkladě předoperačního navigačního vyšetření MR, alternativně CT.
Rámová stereotaxe
Obecným principem stereotaxe je přesné zacílení bodu v intrakraniu po předem zvolené trajektorii. Toho je v případě rámové stereotaxe dosaženo upevněním stereotaktického koordinačního rámu, nejčastěji čtyři šrouby k hlavě pacienta (obr. 4). Rám definuje kartézskou soustavu souřadnou, a tedy každý bod v prostoru (pochopitelně nás zajímají zejména body v intrakraniu – uvnitř rámu) lze zapsat pomocí svých koordinát X, Y, Z vzhledem k rámu. Následně je provedeno lokalizační grafické vyšetření – nejčastěji MR či CT, které dá do pevného vztahu souřadnicový systém rámu a provedené grafické vyšetření. Souřadnice každého bodu na vyšetření tak lze zapsat v souřadnicích rámu. V dedikovaném software je potom možné naplánovat samotnou trajektorii, tedy místo vstupu a místo cíle. Software poté vypočítá nastavení stereotaktického operačního systému (v našem případě CRW Frame, Integra LifeSciences Corporation, Ohio, USA) (obr. 5) tak, aby cílové místo bylo ve středu systému, dva úhly nastavené na obloucích rámu (polární souřadnice) potom určují místo vstupu, a tak je dokonale určena trajektorie. Samotná operace poté sestává z adjustace operačního systému a uchycení systému k rámu. Skrze držák instrumentů poté provedeme návrt a následně samotný odběr.
Obr. 4. Stereotaktický koordinační rám připevněný k hlavě pacienta. Finální poloha na operačním sále. Na boku rámu patrný souřadný systém. Fig. 4. Stereotactic frame attached to the head of the patient. Final surgical positioning. Coordinate system on the side of the frame. 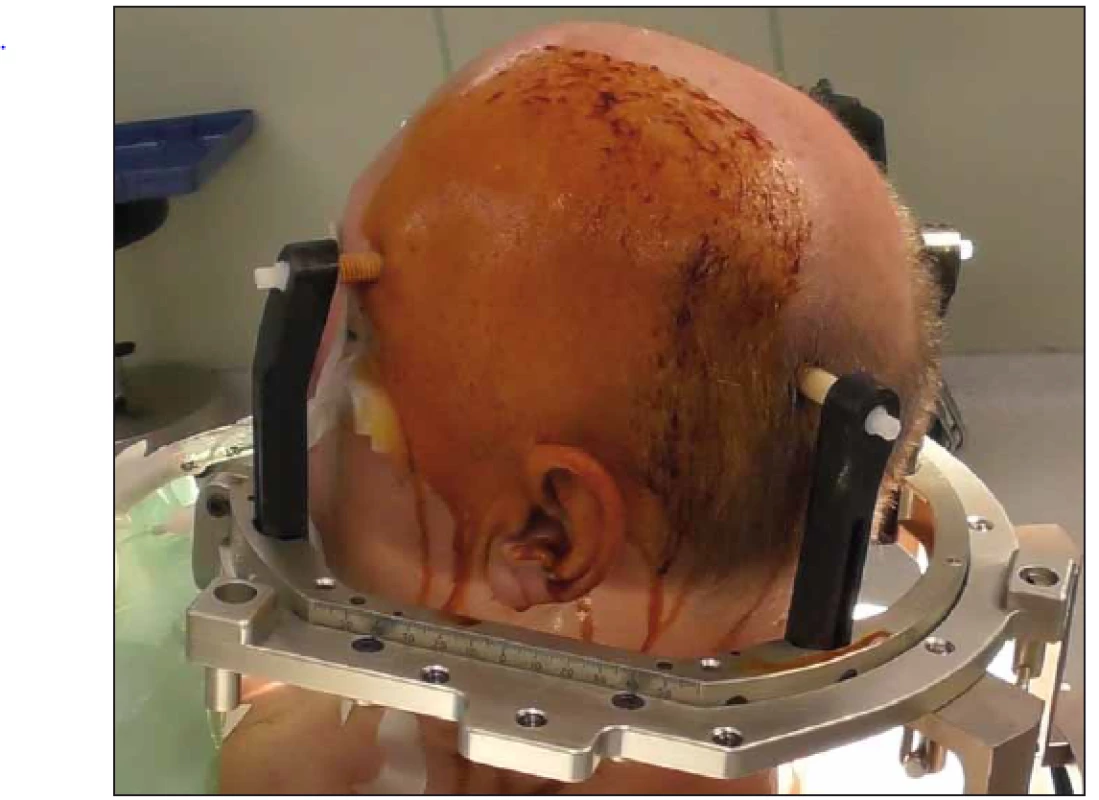
Obr. 5. Sestavený CRW frame firmy Integra. Fig. 5. CRW system by Integra. 
Bezrámová stereotaxe
V souvislosti s rychlým rozvojem zobrazovacích technik v 90. letech 20. století byly vyvíjeny i systémy obrazové navigace založené na prostorové registraci polohy hlavy pacienta vzhledem ke 3D modelu založenému na softwarově zpracovaném předoperačním vyšetření CT či MR. Ruku v ruce s rozvojem obrazové navigace šel i vývoj bezrámových stereotaktických systémů. Postupně bylo uvedeno mnoho přístrojů, jejichž úlohou je držet bioptickou jehlu v předem připravené trajektorii [7 – 9]. Bezrámové varianty stereotaktických mozkových procedur se staly často využívanou alternativou klasické rámové stereotaxe [9 – 11]. Na našem pracovišti rutinně používáme systém VarioGuide (BrainLab AG, Feldkirchen, SRN) [12] společně s navigačním software iPlan Cranial (Brainlab AG, Feldkirchen, SRN) (obr. 6 a 7).
Obr. 6. Adjustovaný systém Varioguide nad operačním polem. Zavádění bioptické jehly dle připravené trajektorie. Fig. 6. Adjusted Varioguide system during surgery. Biopsy needle insertion according to planned trajectory. 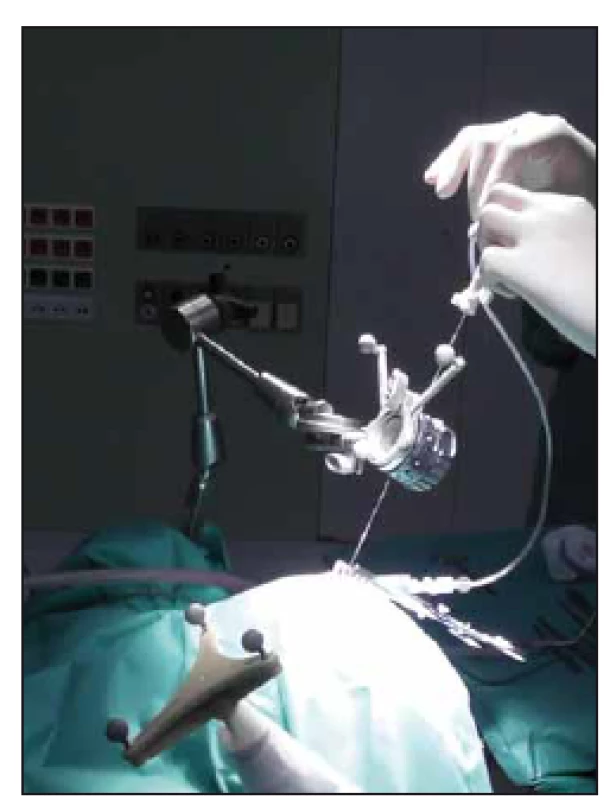
Obr. 7. Tři naplánované trajektorie v prostředí iPlan pro odběr vzorků z více míst rozsáhlého tumoru pravé hemisféry s využitím bezrámové stereotaxe. Fig. 7. Three different stereotactic biopsy trajectories in a large right hemispheric tumor planned in iPlan using frameless stereotaxy. 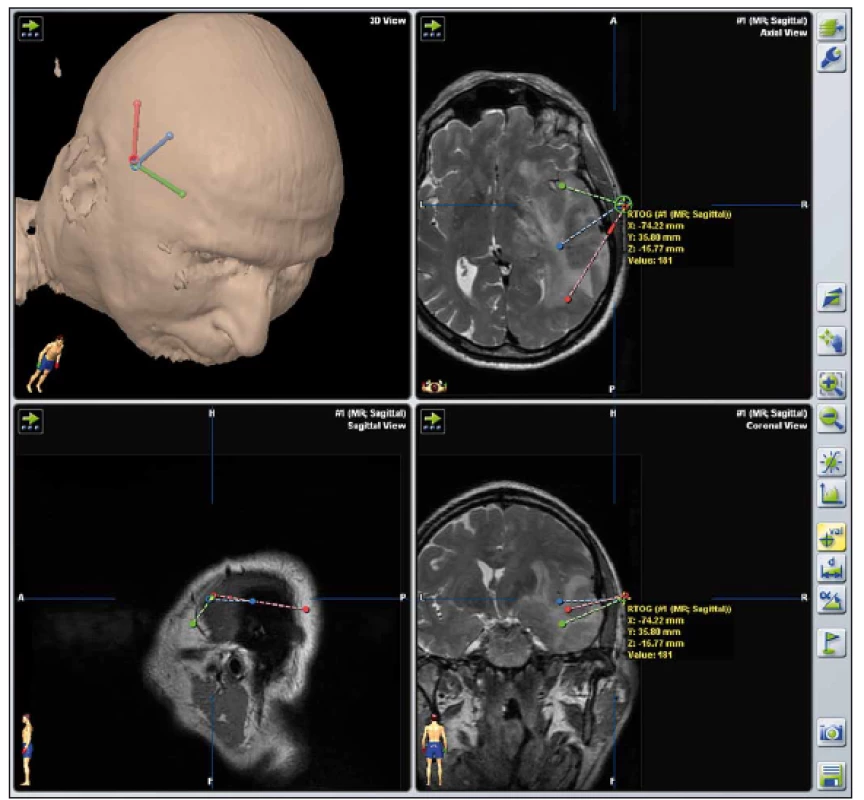
4. V čem spočívá přínos otevřené biopsie?
Mozkovou biopsii lze též provést otevřeně z malé kraniotomie. Tento výkon je indikován, pokud je třeba odebrat i jiné tkáně než samotný mozek. Například u podezření na primární vaskulitidu CNS se odebírá i tvrdá plena a kortikální céva, což nelze provést cestou stereotaktické metody. Dále může být otevřená biopsie indikována u nejasných nálezů, kdy je třeba odebrat větší vzorek tkáně k histopatologickému vyšetření či pro účely molekulárně patologické analýzy.
5. Provádí se biopsie mozku v lokální nebo v celkové anestezii; jaká je příprava na biopsii a jak je dlouhá hospitalizace?
Standardně provádíme stereotaktickou mozkovou biopsii v celkovém znecitlivění. Pacient proto musí podstoupit předoperační vyšetření. V některých případech, kdy je riziko celkové anestezie vysoké, lze po dohodě s pacientem provést stereotaktickou biopsii v lokálním znecitlivění či v analgosedaci, zde je ovšem nutností dobrá spolupráce pacienta.
Pacienty na antikoagulační terapii warfarinem či novými antikoagulancii převádíme před výkonem na nízkomolekulární heparin v terapeutické dávce, kterou peroperačně ještě redukujeme.
U pacientů se suspekcí na primární lymfom CNS a autoimunitní zánětlivé onemocnění (zejména primární vaskulitidy CNS) preferujeme provádění biopsie bez terapie kortikoidy. Je dobře známým faktem, že kortikoterapie významně snižuje populaci zánětlivých i nádorových lymfoidních elementů, navozuje nekrózu nádorových elementů a významně tak snižuje výtěžnost biopsií u lymfomů [13,14], ale zásadně též modifikuje možnosti histopatologické detekce zánětlivých změn v mozku. Recentně se ukazuje, že před biopsií by z důvodu maximalizace výtěžnosti neměla být kortikoterapie delší než 1 týden [15]. U těchto pacientů doporučujeme kortikoterapii vysadit na alespoň 1 týden a poté opakovat MR vyšetření k zacílení odběrového místa.
U stereotaktických biopsií je pacient v případě nekomplikovaného průběhu propuštěn do domácího ošetření či přeložen druhý až třetí pooperační den, u biopsií otevřených ponecháváme pacienta na lůžku o den déle.
6. Jaká jsou rizika, komplikace a kontraindikace biopsie mozku?
Hlavním rizikem provádění mozkových biopsií je pooperační krvácení, které se vyskytuje dle publikovaných sestav u 1 – 9 % provedených procedur [3,16 – 19]. Problematická je definice krvácivé komplikace, která zůstává v mnoha případech klinicky němá a je pouze nalezena jako drobný hematom v místě odběru na rutinním kontrolním grafickém vyšetření. Frekvence symptomatických krvácení je dle Grossmana et al 3,6 % v sestavě 355 případů [20]. Práce Aliho et al udává nový neurologický deficit u 6 (7,7 %) ze 78 pacientů [21].
V naší sestavě 101 výkonů jsme zaznamenali celkovou těžkou morbiditu 2 % a mortalitu též 2 % [2]. V naší sestavě byl prokázán významný efekt perioperačního podání nízkomolekulárního heparinu v terapeutické dávce na frekvenci krvácivých komplikací. U neantikoagulovaných pacientů první pooperační den podáváme nízkomolekulární heparin v profylaktické dávce. Tento postup vede k podstatnému snížení výskytu hluboké žilní trombózy [22].
Kontraindikace biopsie jsou vzácné. Pokud není pacient schopen podstoupit výkon v celkové anestezii pro interní morbiditu, lze provést výkon v lokální anestezii.
7. Jaký je přínos biopsie mozku u jiných onemocnění než jsou tumory nebo podezření na tumor?
Biopsie mozku bývá někdy zvažována z diagnostických rozpaků u pacientů s neurčenou diagnózou jako diagnostické ultimum refugium. To však není správná indikace k biopsii, zejména pokud MR nezobrazí ložiskový proces. Senzitivita otevřené mozkové biopsie u rychle progredující demence bez nálezu expanzivního procesu na MR nepřesahuje 35 %, nejčastějším bioptickým nálezem bývají Creutzfeldtova-Jakobova nemoc a amyloidová angiopatie [23].
K biopsii musí tedy být jasný důvod, jasná klinická otázka a hypotéza léčitelného onemocnění (např. potvrzení diagnózy primární vaskulitidy CNS v případě podloženého klinického podezření a negativního nálezu na angiografii, nebo v případě vzácnějšího intravaskulárního lymfomu mozku s negativní stereotaktickou biopsií z ložiska). Pokud nelze očekávat, že by výsledek histopatologického vyšetření mohl vést ke změně léčebného postupu, tak by se biopsie provádět neměla.
8. Má smysl zopakovat biopsii, pokud byl první odběr tkáně nevýtěžný?
Pokud je jasná klinická otázka, je vhodné biopsii opakovat. Je doplněna kontrolní MR, případně lze zaměřit místo odběru tkáně dle MR spektroskopie nebo PET. Dále je možné zvážit provedení otevřené biopsie z kraniotomie, aby bylo získáno více materiálu na histopatologické zpracování.
9. Jak dlouho trvá, než získáme neuropatologický nález, a existuje možnost peroperační biopsie?
Obvyklá doba do získání základního neuropatologického nálezu činí 3 – 5 dnů. Pokud se provádějí série speciálních vyšetření, tak se tato doba může značně prodloužit. U lézí, kde se využívá i vyšetření ve specializovaných centrech (přesná subtypizace lymfomu, molekulárně-patologické analýzy), může definitivní výsledek trvat významně déle.
Peroperační biopsii provést lze, zejména u biopsií indikovaných pro podezření na mozkový nádor. Vzhledem k malé velikosti vzorku je třeba mít realistická očekávání od peroperační biopsie. Peroperační biopsie může odpovědět na otázku, zda je nádor v biopsii vůbec zastižen, jsou-li nádorové elementy vitální, případně je možné orientačně posoudit, zda se jedná o primární nádor CNS nebo metastázu. Detailní rozbor však peroperační biopsie neumožnuje, teoreticky může i interferovat s celkovou výtěžností biopsie vzhledem k tomu, že k jejímu provedení je potřeba poměrně významné množství odebrané tkáně a může též omezovat následná speciální vyšetření nutná ke stanovení definitivní diagnózy.
10. Je možné bioptovat i míchu?
Biopsie míchy pro vysoká rizika výkonu není primárně indikována. Při nádorovém postižení míchy je indikován resekční výkon nebo observace. Na druhou stranu je možné, že dle výsledku peroperačního histopatologického vyšetření se v průběhu operačního výkonu ustoupí od resekce nádoru míchy a je provedena pouze biopsie.
Závěr
Stereotaktické biopsie mozkových tumorů je bezpečná metoda zjištění histologických charakteristik tumorů s poměrně vysokou výtěžností. Preferovanou metodou je biopsie stereotaktická, ať už klasická, s použitím stereotaktického rámu, či bezrámová. Otevřená biopsie je rezervována pro případy snadno dosažitelných lézí či lézí neohraničených, v případě podezření na autoimunitní a zánětlivá onemocnění, kde je navíc požadavek na větší objem bioptického materiálu i se zachycením reprezentativního množství tkáně mozkových obalů a relevantních cévních struktur.
Tento článek byl podpořen granty AZV 15-31379A, MO 1012 a Progres Q 25.
Děkujeme prim. MUDr. Petru Hrabalovi za poskytnutí histologických nálezů. Děkujeme doc. MUDr. Radoslavu Matějovi, Ph.D. a doc. MUDr. Robertu Rusinovi, Ph.D. za cenné konzultace.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 24. 10. 2017
Přijato do tisku: 1. 2. 2018
doc. MUDr. David Netuka, Ph.D.
Neurochirurgická a neuroonkologická klinika
1. LF UK a ÚVN Praha
U vojenské nemocnice 1200
169 02 Praha 6
e-mail: david.netuka@uvn.cz
Zdroje
1. Khatab S, Spliet W, Woerdeman PA. Frameless image-guided stereotactic brain biopsies: emphasis on diag-nostic yield. Acta Neurochir (Wien) 2014; 156(8): 1441 – 1450. doi: 10.1007/ s00701-014-2145-2.
2. Bradac O, Steklacova A, Kramar F et al. Stereotaktické biopsie mozkových patologií systémem Varioguide – zkušenosti ze 101 výkonů. Cesk Slov Neurol N 2016; 79(5): 579 – 584. doi: 10.14735/ amcsnn2016579.
3. Dammers R, Haitsma IK, Schouten JW et al. Safety and efficacy of frameless and frame-based intracranial biopsy techniques. Acta Neurochir (Wien) 2008; 150(1): 23 – 29. doi: 10.1007/ s00701-007-1473-x.
4. Gempt J, Buchmann N, Ryang YM et al. Frameless image-guided stereotaxy with real-time visual feedback for brain biopsy. Acta Neurochir (Wien) 2012; 154(9): 1663 – 1667. doi: 10.1007/ s00701-012-1425-y.
5. Bradac O, Vrana J, Jiru F et al. Recognition of anaplastic foci within low-grade gliomas using MR spectroscopy. Br J Neurosurg 2014; 28(5): 631 – 636. doi: 10.3109/ 02688697.2013.872229.
6. Widhalm G, Minchev G, Woehrer A et al. Strong 5-aminolevulinic acid-induced fluorescence is a novel intraoperative marker for representative tissue samples in stereotactic brain tumor biopsies. Neurosurg Rev 2012; 35(3): 381 – 391. doi: 10.1007/ s10143-012-0374-5.
7. Patil AA. A modified stereotactic frame as an instrument holder for frameless stereotaxis: Technical note. Surg Neurol Int 2010; 1 : 62. doi: 10.4103/ 2152-7806.70957.
8. Fukaya C, Sumi K, Otaka T et al. Nexframe frameless stereotaxy with multitract microrecording: accuracy evaluated by frame-based stereotactic X-ray. Stereotact Funct Neurosurg 2010; 88(3): 163 – 168. doi: 10.1159/ 000313868.
9. Sutherland GR, Wolfsberger S, Lama S et al. The evolution of neuroArm. Neurosurgery 2013; 72 (Suppl 1): 27 – 32. doi: 10.1227/ NEU.0b013e318270da19.
10. Amin DV, Lozanne K, Parry PV et al. Image-guided frameless stereotactic needle biopsy in awake patients without the use of rigid head fixation. J Neurosurg 2011; 114(5): 1414 – 1420. doi: 10.3171/ 2010.7.JNS091493.
11. Bekelis K, Radwan TA, Desai A et al Frameless robotically targeted stereotactic brain biopsy: feasibility, diagnostic yield, and safety. J Neurosurg 2012; 116(5): 1002 – 1006. doi: 10.3171/ 2012.1.JNS111746.
12. Ringel F, Ingerl D, Ott S et al. VarioGuide: a new frameless image-guided stereotactic system-accuracy study and clinical assessment. Neurosurgery 2009; 64 (5 Suppl 2): 365 – 371. doi: 10.1227/ 01.NEU.0000341532.15867.1C.
13. Geppert M, Ostertag CB, Seitz G et al. Glucocorticoid therapy obscures the diagnosis of cerebral lymphoma. Acta Neuropathol 1990; 80(6): 629 – 634.
14. Herrlinger U, Schabet M, Bitzer M et al. Primary central nervous system lymphoma: from clinical presentation to diagnosis. J Neurooncol 1999; 43(3): 219 – 226.
15. Manoj N, Arivazhagan A, Mahadevan A et al. Central nervous system lymphoma: patterns of incidence in Indian population and effect of steroids on stereotactic biopsy yield. Neurol India 2014; 62(1): 19 – 25. doi: 10.4103/ 0028-3886.128272.
16. Dorward NL, Paleologos TS, Alberti O et al. The advantages of frameless stereotactic biopsy over frame-based biopsy. Br J Neurosurg 2002; 16(2): 110 – 118.
17. Gralla J, Nimsky C, Buchfelder M et al. Frameless stereotactic brain biopsy procedures using the Stealth Station: indications, accuracy and results. Zentralbl Neurochir 2003; 64(4): 166 – 170.
18. Woodworth GF, McGirt MJ, Samdani A et al. Frameless image-guided stereotactic brain biopsy procedure: diagnostic yield, surgical morbidity, and comparison with the frame-based technique. J Neurosurg 2006; 104(2): 233 – 237.
19. Shooman D, Belli A, Grundy PL. Image-guided frameless stereotactic biopsy without intraoperative neuropathological examination. J Neurosurg 2010; 113(2): 170 – 178. doi: 10.3171/ 2009.12.JNS09573.
20. Grossman R, Sadetzki S, Spiegelmann R et al. Haemorrhagic complications and the incidence of asymptomatic bleeding associated with stereotactic brain biopsies. Acta Neurochir (Wien) 2005; 147(6): 627 – 631.
21. Ali Z, Prabhakar H, Bithal PK et al. A review of perioperative complications during frameless stereotactic surgery: our institutional experience. J Anesth 2009; 23(3): 358 – 362. doi: 10.1007/ s00540-009-0759-y.
22. Salmaggi A, Simonetti G, Trevisan E et al. Perioperative thromboprophylaxis in patients with craniotomy for brain tumours: a systematic review. J Neurooncol 2013; 113(2): 293 – 303. doi: 10.1007/ s11060-013-1115-5.
23. Schott JM, Reiniger L, Thom M et al. Brain biopsy in dementia: clinical indications and diagnostic approach. Acta Neuropathol 2010; 120(3): 327 – 341. doi: 10.1007/ s00401-010-0721-y.
Štítky
Detská neurológia Neurochirurgia Neurológia
Článek EditorialČlánek AtaxieČlánek Komentář autorůČlánek Komentář redakceČlánek Antikoagulačná liečba u pacientov s fibriláciou predsiení a cerebrálnou amyloidovou angiopatiouČlánek Antikoagulačná liečba u pacientov s fibriláciou predsiení a cerebrálnou amyloidovou angiopatiouČlánek Recenze knih
Článok vyšiel v časopiseČeská a slovenská neurologie a neurochirurgie
Najčítanejšie tento týždeň
2018 Číslo 2- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Neuromultivit v terapii neuropatií, neuritid a neuralgií u dospělých pacientů
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
-
Všetky články tohto čísla
- Editorial
- Ataxie
- Dopis redakci časopisu Česká a slovenská neurologie a neurochirurgie
- Dopis redakci časopisu Česká a slovenská neurologie a neurochirurgie
- Komentář autorů
- Komentář redakce
- Antikoagulačná liečba u pacientov s fibriláciou predsiení a cerebrálnou amyloidovou angiopatiou
- Antikoagulačná liečba u pacientov s fibriláciou predsiení a cerebrálnou amyloidovou angiopatiou
- Antikoagulační léčba u pacientů s fibrilací síní a cerebrální amyloidovou angiopatií
- Fabryho choroba, přehled problematiky a nejčastější neurologické projevy
- Je amyloid podstatný pro senilní demenci?
- Syndrom GLUT-1 deficience – expandující klinické spektrum léčitelného onemocnění
- Syndrom karpálního tunelu v kontextu funkčních poruch pohybového systému
- Identifikace dětských pacientů s farmakorezistentní epilepsií a výběr kandidátů nefarmakologické terapie
- Lehké řetězce neurofilament v séru a mozkomíšním moku a stav hematolikvorové bariéry u vybraných neurologických onemocnění
- Fyzioterapie u Parkinsonovy nemoci v České republice – demografická studie
- Hladiny anti-Mülleriánského hormonu v séru při roztroušené skleróze – multicentrická případová kontrolní studie
- Follow-up pacientů s idiopatickou poruchou chování v REM spánku – fenokonverze do parkinsonského syndromu a demence
- Pilotní studie Edinburské kognitivně-behaviorální zkoušky pro amyotrofickou laterální sklerózu na české populaci
- Akutní myelitida u dětí – soubor 20 pacientů
- Invazivní primarně intracerebrální infekce u žen způsobené Streptococcus intermedius a manifestující se jako purulentní meningitida a intracerebrální absces
- Nádor z granulárních buněk stopky hypofýzy
- Maligní melanotický schwannom obratlového těla u pacienta s Carneyho komplexem
- Biopsie mozku v deseti bodech – co může neurolog očekávat od neurochirurga a neuropatologa?
-
Analýza dat v neurologii LXVIII.
Úvod do korelační analýzy - Účast českého neurochirurga při umírání Stalina a Gottwalda
- Recenze knih
- Prof. MUDr. Pavel Haninec, CSc. slaví 60 let
- Česká a slovenská neurologie a neurochirurgie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Ataxie
- Biopsie mozku v deseti bodech – co může neurolog očekávat od neurochirurga a neuropatologa?
- Fabryho choroba, přehled problematiky a nejčastější neurologické projevy
- Prof. MUDr. Pavel Haninec, CSc. slaví 60 let
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



