-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
KRÁTKODOBÉ ONKOLOGICKÉ VÝSLEDKY PO RADIKÁLNÍ PROSTATEKTOMII S ROZŠÍŘENOU PÁNEVNÍ LYMFADENEKTOMIÍ A S NÁLEZEM UZLINOVÝCH METASTÁZ. LZE POMÝŠLET NA ÚSPĚCH BEZ SYSTÉMOVÉ LÉČBY?
RADICAL PROSTATECTOMY WITH EXTENDED PELVIC LYMPH NODE DISSECTION: SHORT-TERM ONCOLOGICAL OUTCOMES IN PATIENS WITH NODAL METASTASES. IS CURE POSSIBLE WITHOUT SYSTEMIC TREATMENT?
Radical prostatectomy with extended pelvic lymph node dissection: short-term oncological outcomes in patiens with nodal metastases. Is cure possible without systemic treatment?
Aims:
Lymph node metastasis is an unfavorable prognostic factor in prostate cancer. The benefit of pelvic lymph node dissection remains controversial. The aim of our study was to evaluate three-year oncological results and assess the potential of locoregional therapy consisting of radical prostatectomy (RP) with extended pelvic lymph node dissection (ePLND). We also evaluated the 3-year survival rate in patients without androgendeprivation therapy (ADT).Methods:
Eighty-six patients (64 MOÚ, 22 Mostiště) with nodal metastases who underwent RP + ePLND between August 2007 and March 2014 were included in this study. ePLND included a minimum of external iliac, obturator and internal iliac node dissection. Adjuvant or early salvage RT was performed in 69 (80 %) patients. Median follow-up was 30 months. The Kaplan-Meier model was used to evaluate the survival rate.Results:
Stages pT2, pT3a, pT3b and pT4 were seen in 20 %, 23 %, 55 % and 2 % of the patients respectively. The median PSA was 14 ng/ml (IQR 8–23). The median number of removed and metastatic lymph nodes was 18 (IQR 14–22) and 2 (range 1–9) respectively. Three-year overall and cancerspecific survival was 93 % and 97 %. The proportion of patients without biochemical recurrence and with delayed ADT after three years was 66 % and 64 % respectively. Postoperatively, median PSA was 0,029 (IQR 0,007–0,135). A maximum of two positive lymph nodes (p = 0,048) and a postoperative PSA lower than 0,01 ng/ml (p = 0,018) were significantly associated with the risk of biochemical recurrence.Conclusion:
Patients with nodal metastases comprise a heterogeneous group. In a subset with minimal nodal involvement, the locoregional treatment may be curative. The results imply that a substantial number of patients may benefit through delay in the biochemical recurrence and the need for ADT. Further studies are needed to better define the need for RT and ADT in this group of the patients.Key words:
Antineoplastic agents-hormonal, lymph node excision, prostatic neoplasms, radiotherapy.
Autoři: Michal Staník 1; Jan Doležel 1,2; Ivo Čapák 1; Daniel Macík 1; Jiří Jarkovský 3; Eva Lžičařová 4; Marcela Vagundová 5; Martin Šustr 1; David Miklánek 1
Působiště autorů: Oddělení onkourologie, MOÚ Brno 1; Centrum robotické chirurgie Vysočina, Nemocnice sv. Zdislavy, Mostiště 2; Institut biostatistiky a analýz, Brno 3; Oddělení onkologické a experimentální patologie, MOÚ Brno 4; Cedelab, Laboratoř patologie a klinické cytologie, Nemocnice sv. Zdislavy, Mostiště 5
Vyšlo v časopise: Ces Urol 2015; 19(2): 137-144
Kategorie: Původní práce
Souhrn
Krátkodobé onkologické výsledky po radikální prostatektomii s rozšířenou pánevní lymfadenektomií a s nálezem uzlinových metastáz. Lze pomýšlet na úspěch bez systémové léčby?
Cíl:
Uzlinové metastázy u karcinomu prostaty jsou nepříznivým prognostickým faktorem. Přínos regionální léčby v těchto případech zůstává kontroverzní. Cílem studie bylo posoudit tříleté onkologické výsledky a možnosti lokoregionální léčby sestávající z radikální prostatektomie (RP) a rozšířené pánevní lymfadenektomie (rPLAE). Hodnotili jsme také tříleté přežití bez nutnosti nasazení systémové léčby – androgen-deprivační terapie (ADT).Soubor pacientů a metoda:
Do retrospektivní studie bylo zařazeno 86 pacientů (64 MOÚ, 22 Mostiště) s uzlinovými metastázami, u kterých byla provedena RP a rPLAE v období 8/2007–3/2014. rPLAE zahrnovala minimálně zevní ilické, obturatorní a vnitřní ilické uzliny. Adjuvantní nebo časnou záchrannou radioterapii podstoupilo 69 (80 %) pacientů. Medián sledování byl 30 měsíců. K analýze přežití pacientů jsme použili Kaplan-Meierovy křivky.Výsledky:
Stadia pT2, pT3a, pT3b a pT4 byla zastoupena ve 20 %, 23 %, 55 %, resp. 2 % a medián PSA před operací byl 14 ng/ml (interkvartilový rozptyl (IQR) 8–23). Medián odstraněných a postižených uzlin byl 18 (IQR 14–22), resp. 2 (rozsah 1–9). Tříleté celkové a nádorově-specifické přežití dosáhlo 93 %, resp. 97 %. Bez biochemické progrese a bez nasazené ADT bylo po třech letech 66 %, resp. 64 % pacientů. Pooperačně byl medián PSA 0,029 ng/ml (IQR 0,007–0,135). Riziko biochemické progrese bylo signifikantně nižší při počtu pozitivních uzlin ≤ 2 (p = 0,048) a hodnoty pooperačního PSA < 0,01 (p = 0,018).Závěr:
Pacienti s uzlinovými metastázami tvoří heterogenní skupinu a u části z nich, zejména s minimálním postižením uzlin, může lokoregionální léčba vést k remisi onemocnění, nebo alespoň k oddálení doby do biochemické progrese. Další studie jsou nutné k určení přesnějších indikací radioterapie a ADT u této skupiny pacientů.Klíčová slova:
Hormonální léčba, lymfadenektomie, nádory prostaty, radioterapie.ÚVOD
Nález uzlinových metastáz při radikální prostatektomii je nepříznivým prognostickým faktorem (1). I když neexistuje konsenzus ohledně optimální léčebné strategie u těchto pacientů, většinovým názorem je nutnost zahájení androgen-deprivační terapie (ADT) po operaci, jelikož uzlinové metastázy jsou považovány za projev systémového onemocnění. Oprávněnost ADT u těchto pacientů je zdůvodňována výsledky jedné randomizované studie, která prokázala zlepšení přežití při okamžité ADT ve srovnání s odloženou léčbou (2). V této studii však byla odložená ADT zahájena až při klinické progresi, což nemusí odrážet současný stav, kdy je k dispozici citlivý marker PSA a ADT se obvykle zahajuje již při biochemické progresi. Jiné retrospektivní studie naopak prokázaly, že pacienti s minimálním uzlinovým postižením mají příznivou prognózu a není nutné nasadit ADT okamžitě po operaci (3, 4). ADT může být navíc spojena s výskytem závažných vedlejších účinků při dlouhodobé léčbě (5).
PLAE se dlouhou dobu považovala pouze za stagingovou operaci, v současnosti přibývají důkazy, že minimálně část pacientů může být vyléčena samotnou chirurgií, zatímco jiní profitují z multimodální léčby (3, 6). Mapovací studie popsaly oblasti primární lymfatické drenáže, což musí být respektováno při definování rozsahu PLAE. Minimem je rozšířená PLAE v rozsahu zevních ilických, obturatorních a vnitřních ilických uzlin, kde odstraníme přes 80 % uzlinových metastáz (7).
Prognosticky nepříznivými jsou také některé charakteristiky primárního nádoru jako např. invaze semenných váčků nebo Gleasonovo skóre (GS) 8–10 (1). Tři nedávné randomizované studie prokázaly, že u pacientů s lokálně pokročilým karcinomem prostaty bez uzlinových metastáz prodlužuje adjuvantní radioterapie (RT) v kombinaci s chirurgickou léčbou čas do biochemické progrese a v jedné z nich bylo dosaženo i zlepšení celkového přežití (8–10). Postavení RT u pacientů s uzlinovými metastázami není jasně stanoveno.
V naší práci jsme zhodnotili krátkodobé onkologické výsledky u pacientů s uzlinovými metastázami, kteří podstoupili maximální lokoregionální léčbu, a u nichž jsme preferovali odloženou ADT až v případě biochemické progrese.
SOUBOR PACIENTŮ A METODA
Do retrospektivní studie bylo zařazeno 86 pacientů (64 MOÚ, 22 Mostiště) s uzlinovými metastázami, u kterých byla provedena radikální prostatektomie a rPLAE v období 8/2007–3/2014. rPLAE zahrnovala minimálně zevní ilické, obturatorní a vnitřní ilické uzliny. Navíc 44 pacientů podstoupilo i vyšetření sentinelové uzliny pomocí techneciem značeného radiokoloidu aplikovaného do prostaty, které umožňuje zachytit také metastázy mimo oblast rPLAE a důkladnějším histopatologickým vyšetřením vede k vyššímu záchytu uzlinových metastáz (7).
Adjuvantní nebo časnou salvage RT podstoupilo 69 (80 %) pacientů. Předpokladem adjuvantní RT byla nízká hodnota PSA za dva měsíce po operaci (≤ 0,05 ng/ml). Za záchrannou RT jsme považovali indikaci při stoupajícím PSA v pooperačním období, nebo při pooperační hladině PSA vyšší než 0,05 ng/ml. Ozařovaný objem a dávka záření závisely na rozvaze radiačního onkologa, obvykle se jednalo o 66 Gy, z toho 44 Gy na oblast malé pánve s potencionálním ozářením primárních oblastí lymfatické drenáže prostaty. V počáteční fázi jsme indikovali adjuvantní RT při nálezu některé z prognosticky nepříznivých charakteristik (pT3, pN1, GS 8–10) nebo pozitivním chirurgickém okraji. Později jsme se řídili zejména pooperační kinetikou PSA a preferovali jsme záchrannou RT. V případě rozsáhlého uzlinového postižení, vysoké pooperační hodnoty PSA nebo krátké doby zdvojení PSA jsme přistupovali k časné ADT, nejčastěji formou LHRH analoga.
Medián sledování byl 30 měsíců (rozsah 3–83). Biochemická progrese byla definována jako hodnota PSA vyšší než 0,2 ng/ml nebo nasazení ADT. U pacientů, kteří pro biochemickou recidivu podstoupili časnou záchrannou RT jsme za biochemickou progresi považovali první hodnotu vyšší než 0,2 ng/ml po ozařování. Spojité proměnné byly charakterizovány pomocí průměru s rozsahem nebo mediánu a interkvartilového rozsahu. K analýze přežití pacientů jsme použili Kaplan-Meierovy křivky, rozdíly v přežití byly hodnoceny pomocí log rank testu.
VÝSLEDKY
Charakteristika souboru je uvedena v tabulce 1. Kategorie pT2, pT3a, pT3b a pT4 byla zastoupena ve 20 %, 23 %, 55 %, resp 2 % a medián PSA před operací byl 14 ng/ml (IQR 8–23). V definitivní histologii mělo 81 % pacientů dominantní Gleasonův stupeň 4, nejčastěji bylo zastoupeno GS 4+3 (n = 36; 42 %). Pouze 18 % mělo nález GS 3+4 a v jednom případě bylo zachyceno jenom ložisko GS 3+3. Medián odstraněných a postižených uzlin byl 18 (IQR 14–22; rozsah 7–40), resp 2 (rozsah 1–9). Nejvíce pacientů mělo minimální uzlinové postižení: 42 % mělo zachyceno pouze jednu uzlinovou metastázu (tabulka 2). Medián velikosti uzlinových metastáz byl 2,5 mm (IQR 1–4; rozsah 0,1–16).
Tab. 1. Charakteristika souboru pacientů Table 1. Patient characteristics 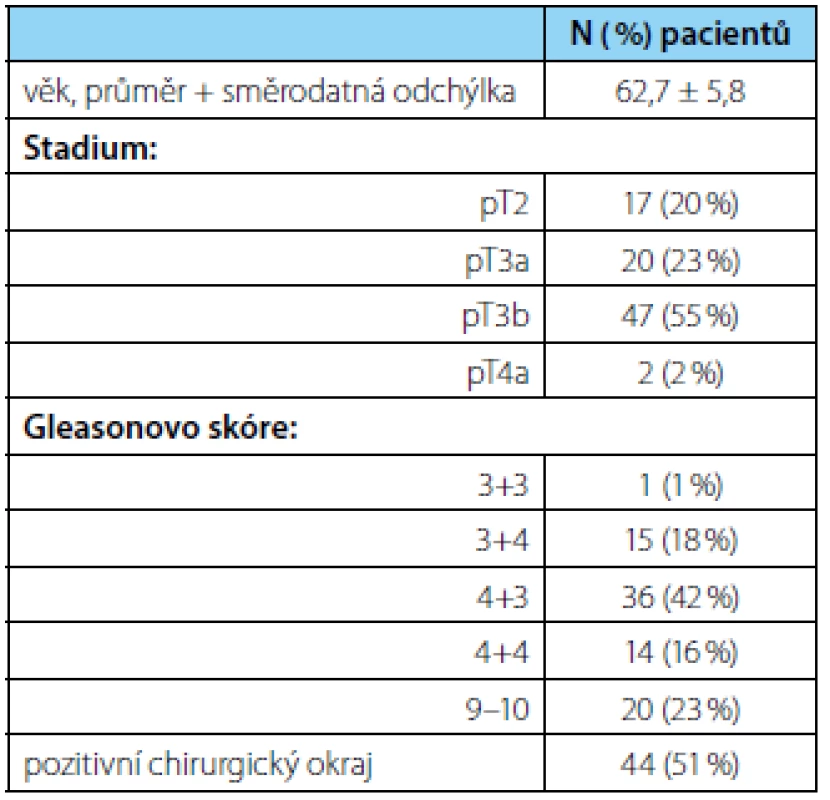
Tab. 2. Charakteristika rozsahu uzlinového postižení Table 2. Extent of nodal involvement characteristics 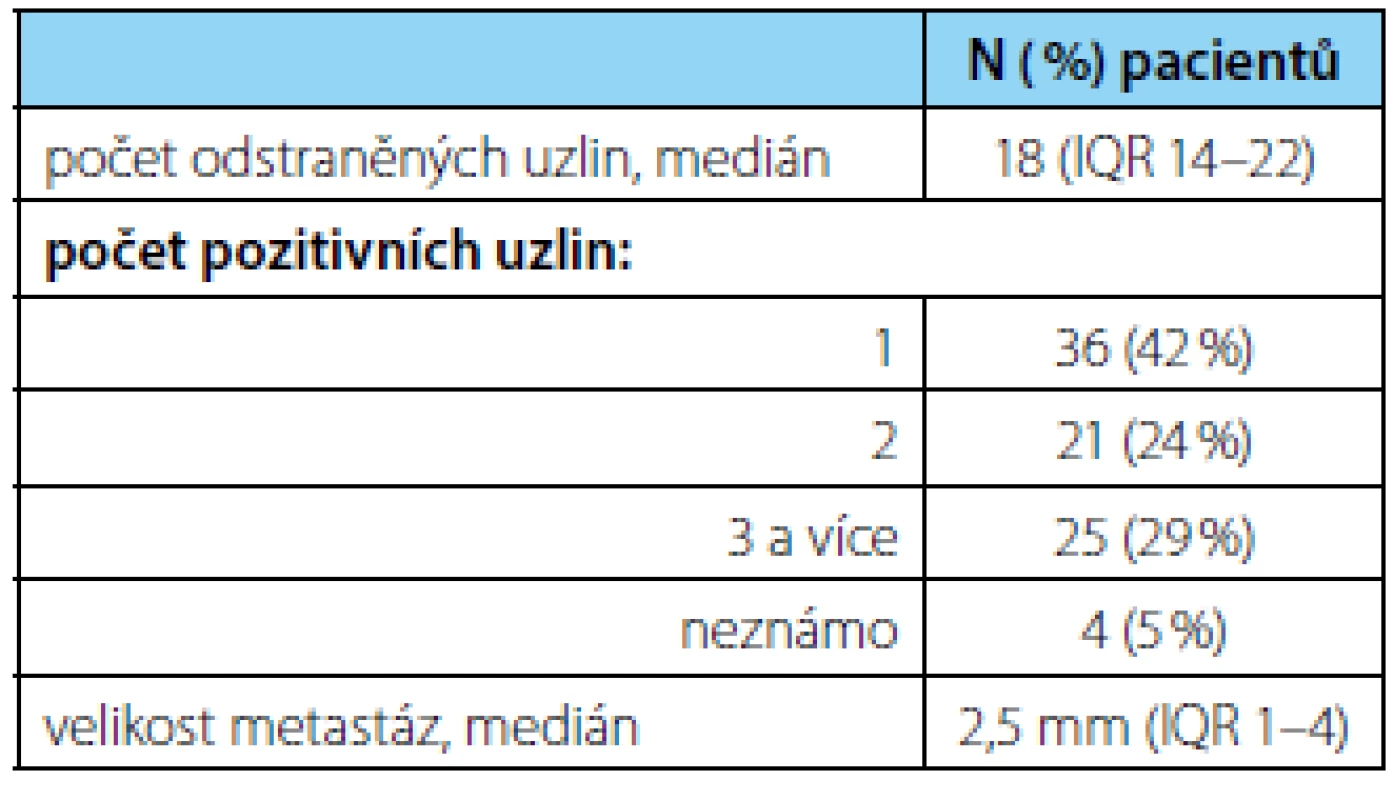
Šest týdnů po operaci byl medián PSA 0,029 ng/ ml (IQR 0,007–0,135), 27 pacientů (31 %) mělo PSA ≤ 0,01 ng/ml. Při mediánu sledování 30 měsíců jsme biochemickou recidivu zaznamenali u 26 pacientů (30 %). Podle Kaplan-Meierova modelu dosáhlo tříletého přežití bez biochemické progrese a bez nasazené ADT 66 % (95 % interval spolehlivosti [CI], 53–78), resp. 64 % (95 % CI, 52–76) (obr. 1). Dvanáct pacientů (14 %) je v remisi onemocnění bez jakékoliv adjuvantní léčby. Po operaci bylo 34 pacientů (40 %) adjuvantně ozářeno při hodnotě PSA ≤ 0,05 ng/ml. Pro elevaci PSA bylo později 35 nemocných (41 %) ozářeno v záchranném režimu. Okamžitá ADT byla zahájena u 11 pacientů (13 %). Celkově je zatím pomocí ADT léčeno 25 nemocných, medián do doby nasazení byl 7 měsíců.
Obr. 1. Kaplan-Meierovy křivky pro přežití bez biochemické progrese u pacientů s uzlinovými metastázami Fig. 1. Kaplan-Meier curves for probability of freedom from biochemical recurrence in patients with nodal mestastases 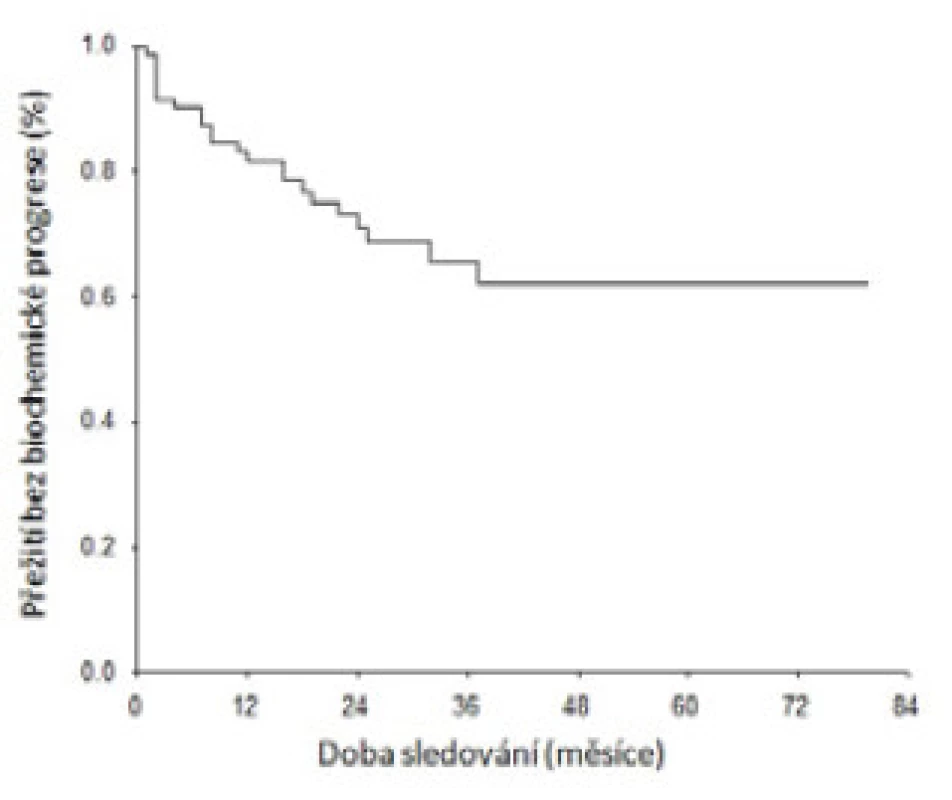
Celkem zemřelo 5 pacientů, z toho dva na progresi karcinomu prostaty 35, resp. 46 měsíců od operace. V obou případech byla ADT zahájena časně pro vysokou pooperační hodnotu PSA, GS 8–10 v definitivní histologii a nález dvou, resp. čtyř postižených uzlin. Tříleté celkové a nádorově-specifické přežití dosáhlo 93 % (95 % CI, 85–100), resp. 97 % (95 % CI, 91–100).
Riziko biochemické progrese bylo signifikantně nižší, pokud bylo pooperační PSA ≤ 0,01 ng/ml (p = 0,018) a tříleté přežití bez biochemické progrese dosáhlo v této skupině 81 % oproti 59 % ve skupině s PSA > 0,01 ng/ml (obr. 2). Riziko biochemické progrese bylo nižší také v případě počtu pozitivních uzlin ≤ 2 (p = 0,048). Při nálezu jedné postižené uzliny a více než dvou uzlin bylo tříleté přežití bez biochemické progrese 68 %, resp. 47 % (obr. 3). Neprokázali jsme žádný rozdíl v riziku biochemické progrese u skupin s mikro - a makrometastázami, tříleté přežití bez biochemické progrese dosáhlo 51 %, resp. 69 % (p = 0,496).
Obr. 2. Pravděpodobnost přežití bez biochemické progrese dle počtu pozitivních uzlin Fig. 2. Probability of biochemical progression-free survival by number of positive nodes 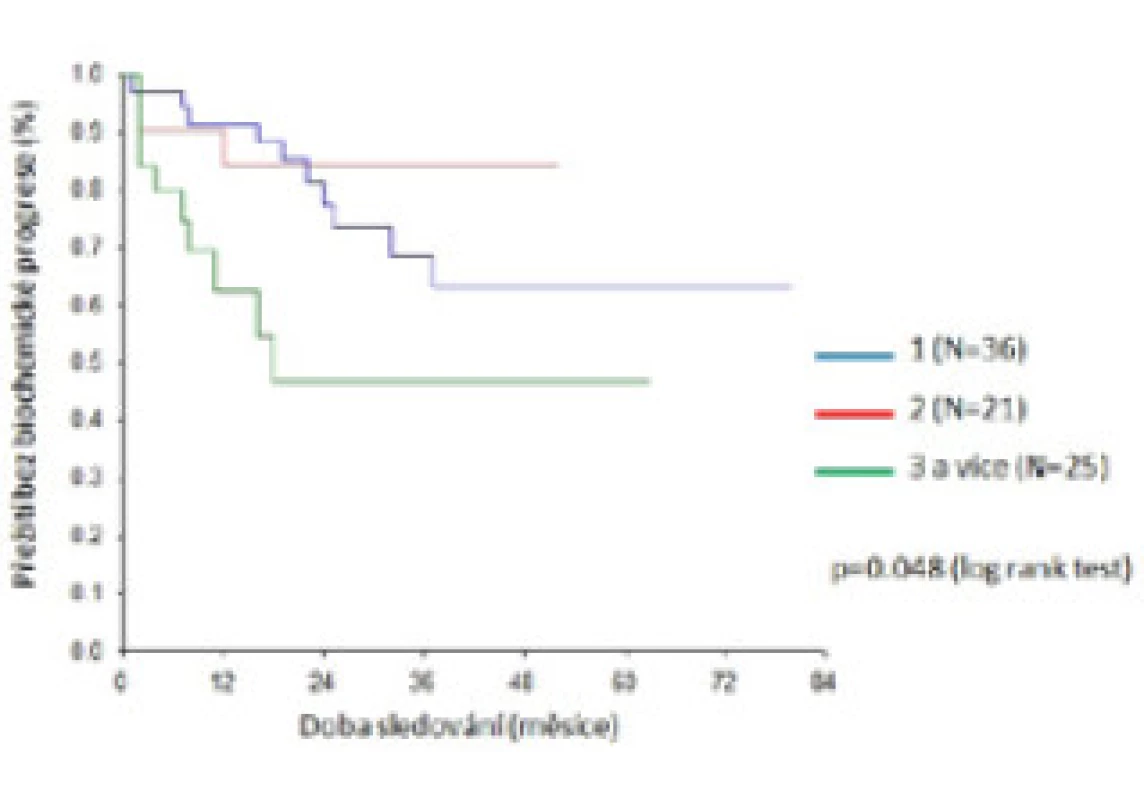
Obr. 3. Pravděpodobnost přežití bez biochemické progrese dle pooperační hodnoty PSA Fig. 3. Probability of biochemical progression-free survival by postoperative PSA value 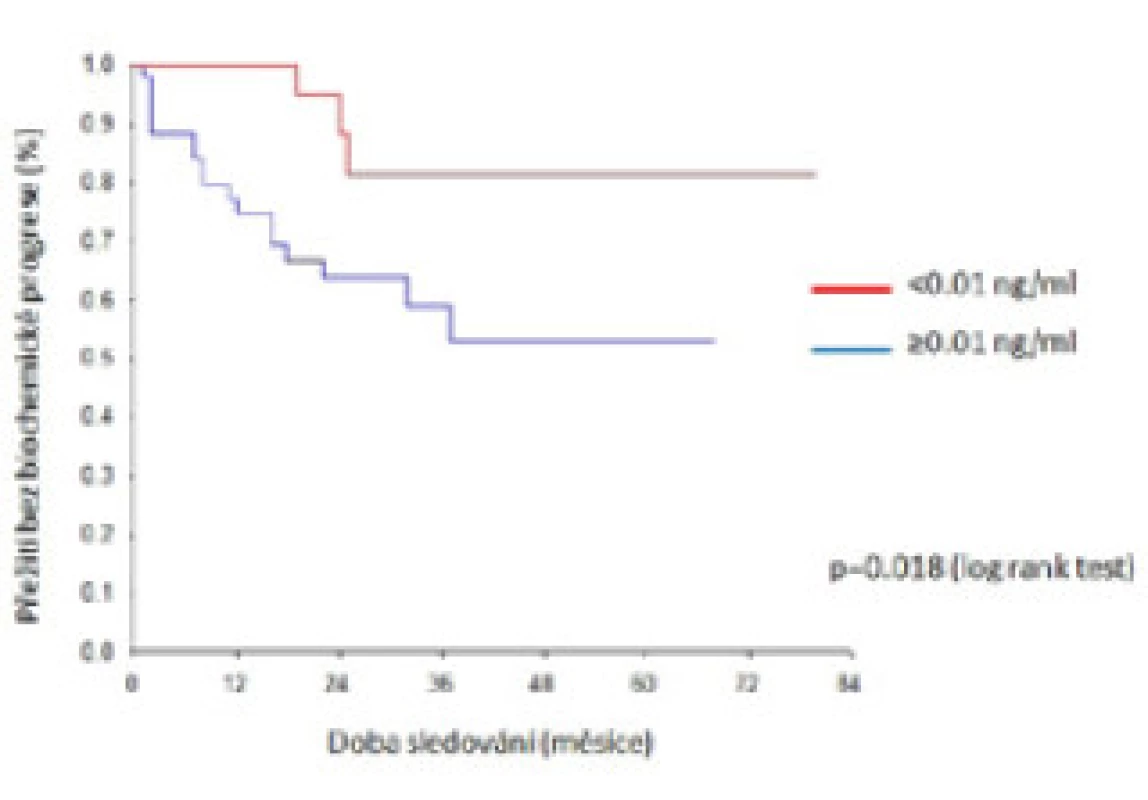
DISKUZE
Uzlinové metastázy u pacientů s karcinomem prostaty jsou nepříznivým prognostickým faktorem (1). Nemocní s uzlinovým postižením tvoří heterogenní skupinu, chybí jejich přesnější klasifikace a časně zahájena ADT je považována za standardní léčbu. Již 30 let jsou ale známy výsledky retrospektivních studií u karcinomu prostaty, které poukazují na skutečnost, že část pacientů s uzlinovými metastázami může dosáhnout remise po samotné operační léčbě (11). Základním předpokladem je pečlivě provedená regionální lymfadenektomie, která by optimálně měla zahrnout všechny oblasti primární lymfatické drenáže. Minimem je rPLAE, při které odstraníme všechny metastázy u přibližně 80 % nemocných (7).
V nedávné retrospektivní studii autoři z Bernu publikovali 15leté sledování u 88 pacientů s pozitivními uzlinami bez adjuvantní léčby. Všichni pacienti s dvěmi a více postiženými uzlinami zaznamenali biochemickou progresi a u 80 % byla zahájena odložená ADT. V případě jedné pozitivní uzliny zůstalo 18 % v remisi, pouze 43 % potřebovalo ADT a desetileté nádorově-specifické přežití bylo 75 % (4). Toujier et al. hodnotili 369 pacientů s uzlinovými metastázami bez adjuvantní léčby. Záchranná RT nebo odložená ADT byla zahájena při biochemické progresi. Desetileté nádorově-specifické přežití dosáhlo 72 %. Po 10 letech bylo 28 % pacientů bez biochemické progrese po samotné operaci (3). Výsledky uvedených studií ukazují, že značná část pacientů s minimálním uzlinovým postižením je v remisi po samotné operační léčbě. V našem souboru byla doposud ADT zahájena pro progresi onemocnění pouze u 34 % pacientů. Doba sledování je ale krátká (medián 30 měsíců), což je i největší limitací naší práce.
Při určování léčebné strategie u pacientů s uzlinovými metastázami je nutný širší pohled na proces metastazování. Samotný nález nádorových buněk v uzlinách nás informuje, že karcinom prostaty dosáhl změn fenotypu, které umožnily invazi a proces metastazování. I přes negativní výsledek zobrazovacích vyšetření musíme již u většiny těchto pacientů předpokládat výskyt cirkulujících nádorových buněk, případně i založení vzdálených mikrometastáz (12, 13). Tyto nádorové buňky mohou, ale nemusí nabýt dalších změn genomu, umožňujících také kolonizaci vzdálených orgánů, jejichž klinickým projevem je růst makrometastáz (12). Dobře to ilustruje skutečnost, že i přes nález uzlinových metastáz je část pacientů v remisi po samotné operaci a u části pacientů dojde k progresi metastáz s různě dlouhou latencí.
Z předchozí úvahy vyplývá, že optimální by u těchto pacientů bylo časné zahájení účinné systémové léčby. Bohužel, u žádné dostupné systémové léčby (ADT, chemoterapie, imunoterapie, cílená léčba nebo jejich kombinace) nemáme k dispozici randomizovanou studii, která by přínos jejího okamžitého zahájení ve srovnání s odloženou léčbou při biochemické progresi jednoznačně podporovala. Cílem optimální lokoregionální léčby u pacientů s minimálním uzlinovým postižením je zasáhnout v časné fázi metastazování, dosáhnout remise onemocnění a minimálně umožnit odklad ADT, která je obvyklou systémovou léčbou u těchto pacientů.
Současná indikace ADT u stadia pN1 je postavena na výsledku jedné randomizované studie čítající pouze 98 pacientů z let 1988–1993 (2). Messing et al. srovnali výsledky při okamžitém zahájení ADT a odložené léčbě při klinické progresi, tedy např. výskytu kostních metastáz, a prokázali zlepšení desetiletého nádorově-specifického přežití v ramenu s časnou ADT 85 % vs. 50 %. Je velice sporné, jestli lze tyto výsledky aplikovat na současné pacienty s minimálním uzlinovým postižením, při dostupnosti citlivého markeru PSA a možnosti zahájit ADT již při biochemické progresi. Boorjian et al. publikovali výsledky 507 pacientů po prostatektomii s uzlinovými metastázami, kdy adjuvantní ADT byla zahájena u 455 pacientů a u zbytku nemocných až při biochemické progresi. Desetileté nádorově-specifické přežití dosáhlo 86 % a autoři neprokázali rozdíl v riziku vzniku metastáz nebo úmrtí na karcinom prostaty (14).
Podle současných EAU doporučení lze načasovat zahájení ADT podle pooperační kinetiky PSA a odloženou ADT lze zvážit u pacientů s maximálně dvěma pozitivními uzlinami (15). Výsledky naší studie naznačují, že v případě minimálního uzlinového postižení a nízké pooperační hodnoty PSA ≤ 0,01 ng/ml nemusí být ADT zahájena okamžitě. Tříleté přežití bez biochemické progrese dosáhlo 81 % v této skupině pacientů.
Pacienti s uzlinovými metastázami nemají stejnou prognózu. Při rozhodování, u kterých pacientů zahájit časnou systémovou léčbu, nám chybí lepší klasifikace pacientů na základě prognostických a prediktivních molekulárních markerů. Zatím spoléháme na klinické prediktory, např. rozsah uzlinového postižení vyjádřený jako počet uzlin (3, 4), rozměr největší metastázy (16), nebo charakteristiky primárního nádoru (pT kategorie, GS). Postižení jedné uzliny nezhoršuje významně prognózu, Cheng et al. uvádějí desetileté nádorově-specifické přežití až 94 % (17). Dalším prognostickým faktorem je velikost metastázy. Fleischmann et al. udávají, že v případě metastáz > 10 mm je riziko úmrtí až čtyřnásobné ve srovnání s pacienty s mikrometastázami (12). V našem souboru jsme zatím při krátké době sledování neprokázali rozdíl v riziku biochemické progrese podle velikosti metastáz. Toujier et al. uvádí při multivariantní analýze jako prediktory biochemické progrese u nemocných s uzlinovými metastázami GS 8–10 (HR 2,23) a nález více než dvou pozitivních uzlin (HR 2,61) (4).
Nedávné tři randomizované studie srovnaly adjuvantní radioterapii s kontrolním ramenem u pacientů po radikální prostatektomie s pT3 nebo pozitivním chirurgickým okrajem, bez uzlinových metastáz (8–10). Ozařováno bylo pouze lůžko po prostatektomii dávkou 60–64 Gy. Všechny prokázaly prodloužení doby do biochemické progrese při adjuvantní radioterapii, ale pouze jedna také zlepšení celkového přežití (9). Role pooperační radioterapie v případě uzlinového postižení není jednoznačně stanovena a dostupná data jsou pouze retrospektivní. Briganti et al. uvádějí desetileté celkové přežití 74 % ve skupině s radioterapií a ADT ve srovnání s 55 % v případě samotné ADT (6). Na rozdíl od předchozích studií zahrnoval radioterapeutický plán celou pánev (medián 50 Gy) a poté boost na prostatické lůžko (medián 18 Gy). Autoři zdůrazňují význam optimální lokoregionální léčby pro přežití pacientů. V naší studii byly ozařovací dávky srovnatelné, 44 Gy na pánev a 22 Gy na lůžko.
Naše výsledky potvrzují, že ADT nemusí být zahájena u všech pacientů s minimálním uzlinovým postižením. Pacienti, kteří budou profitovat z multimodální léčby, jsou zejména s vícečetnými metastázami a nepříznivou kinetikou PSA. Do budoucna je potřebná přesnější klasifikace těchto pacientů a randomizované studie, které posoudí přínos časné systémové léčby. Z chirurgického hlediska je u karcinomu prostaty důležité se soustředit na dosažení optimální lokoregionální kontroly. rPLAE poskytuje přesný staging a u části pacientů můžeme dosáhnout remise onemocnění i přes nález uzlinových metastáz.
ZÁVĚR
Pacienti s uzlinovými metastázami tvoří heterogenní skupinu a u části z nich, zejména s minimálním postižením uzlin, může lokoregionální léčba vést k remisi onemocnění, nebo k prodloužení doby do biochemické progrese a do nasazení ADT. U této skupiny pacientů se rozhodnutí o zahájení systémové léčby může řídit pooperační kinetikou PSA. Pacienti s větším uzlinovým postižením potřebují multimodální léčbu s ADT, případně radioterapii. Randomizované studie jsou nutné k definování optimální strategie léčby pacientů s uzlinovými metastázami.
Došlo: 21. 3. 2015
Přijato: 8. 6. 2015
Střet zájmů: žádný
Prohlášení o podpoře: Podpořeno MZ ČR – RVO (MOÚ, 00209805).
Kontakt:
MUDr. Michal Staník, Ph.D.
Oddělení onkourologie,
Masarykův onkologický ústav,
Žlutý Kopec 7, Brno
e-mail: stanik@mou.cz
Zdroje
1. Eggener S, Scardino PT, Walsh PC, et al. Predicting 15-year prostate cancer specific mortality after radical prostatectomy. J Urol 2011; 185(3): 869–875.
2. Messing EM, Manola J, Yao J, et al. Immediate versus deferred androgen deprivation treatment in patients with node-positive prostate cancer after radical prostatectomy and pelvic lymphadenectomy. Lancet Oncol 2006; 7 : 472–479.
3. Toujier KA, Mazzola CR, Sjoberg D, Scardino PT, Eastham JA. Long-term outcomes of patients with lymph node metastasis treated with radical prostatectomy without adjuvant androgen deprivation therapy. Eur Urol 2014; 65 : 20–25.
4. Seiler R, Studer UE, Tschan K, Bader P, Burkhard FC. Removal of limited nodal disease in patients undergoing radical prostatectomy: long-term results confirm a chance for cure. J Urol 2014; 191(5): 1280–1285.
5. Allan CA, Collins VR, Frydenberg M, McLachlan R, Matthiesson KL. Androgen deprivation therapy complications. Endocr Relat Cancer 2014; 21(4): T119–129.
6. Briganti A, Karnes JR, Da Pozzo LF, et al. Combination of adjuvant hormonal and radiation therapy significantly prolongs survival of patients with pT2–4 pN+ prostate cancer: results of a matched analysis. Eur Urol 2011; 59(5): 832–840.
7. Staník M, Čapák I, Macík D, et al. Sentinel lymph node dissection combined with meticulous histology increases the detection rate of nodal metastases in prostate cancer. Int Urol Nephrol 2014; 46(8): 1543–1549.
8. Bolla M, van Poppel H, Collette L, et al. Postoperative radiotherapy after radical prostatectomy: a randomised controlled trial (EORTC trial 22911). Lancet 2005; 366 : 572–578.
9. Thompson IM, Tangen CM, Paradelo J, et al. Adjuvant radiotherapy for pathological T3N0M0 prostate cancer significantly reduces risk of metastases and improves survival: long-term followup of a randomized clinical trial. J Urol 2009; 181 : 956–962.
10. Wiegel T, Bottke D, Steiner U, et al. Phase III postoperative adjuvant radiotherapy after radical prostatectomy compared with radiál prostatectomy alone in pT3 prostate cancer with postoperative undetectable prostate-specific antigen: ARO 96–02/AUO AP 09/95. J Clin Oncol 2009; 27 : 2924–2930.
11. Golimbu M, Provet J, Al-Askari S, Morales P. Radical prostatectomy for stage D1 prostate cancer. Prognostic variables and results of treatment. Urology 1987; 30(5): 427–435.
12. Weinberg RA. The biology of cancer. 2. ed. New York: Garlan Science, Taylor & Francis Group, LLC 2014; 641–722.
13. Pal SK, He M, Wilson T, Liu X, Zhang K, et al. Detection and phenotyping of cirulating tumor cells in high-risk localized prostate cancer. Clin Genitourin Cancer 2014; doi: 10.1016/j.clgc.2014.08.014. V tisku.
14. Boorjian SA, Thompson RH, Siddiqui S, et al. Long-term outcome after radical prostatectomy for patients with lymph node positive prostate cancer in the prostate specific antigen era. J Urol 2007; 178 : 864–870.
15. Heidenreich A, Bastian PJ, Bellmunt J, et al. EAU guidelines on prostate cancer. part 1: screening, diagnosis, and local treatment with curative intent-update 2013. Eur Urol 2014; 65(1): 124–137.
16. Fleischmann A, Schobinger S, Schumacher M, Thalmann GN, Studer UE. Survival in surgically treated, nodal positive prostate cancer patients is predicted by histopathological characteristics of the primary tumor and its lymph node metastases. Prostate 2009; 69(4): 352–162.
17. Cheng L, Zincke H, Blute ML, et al. Risk of prostate carcinoma death in patients with lymph node metastasis. Cancer. 2001; 91(1): 66–73.
Štítky
Detská urológia Nefrológia Urológia
Článek Editorial
Článok vyšiel v časopiseČeská urologie
Najčítanejšie tento týždeň
2015 Číslo 2- Aktuálne európske odporúčania pre liečbu renálnej koliky v dôsledku urolitiázy
- MUDr. Šimon Kozák: V algeziológii nič nefunguje zázračne cez noc! Je dôležité nechať si poradiť od špecialistov
- Vyšetření T2:EGR a PCA3 v moči při záchytu agresivního karcinomu prostaty
- Lék v boji proti benigní hyperplazii prostaty nyní pod novým názvem Adafin
-
Všetky články tohto čísla
- Editorial
- LAPAROSKOPICKÁ RESEKCE TUMORŮ LEDVINY
- NOVÉ TRENDY V LÉČBĚ RENÁLNÍHO ANGIOMYOLIPOMU
- ISCHEMIE LEDVINY PŘI RESEKCÍCH LEDVIN A MOŽNOSTI JEJÍHO OVLIVNĚNÍ
- FYZIOTERAPIE V LÉČBĚ INKONTINENCE MOČI U ŽEN
- KRÁTKODOBÉ ONKOLOGICKÉ VÝSLEDKY PO RADIKÁLNÍ PROSTATEKTOMII S ROZŠÍŘENOU PÁNEVNÍ LYMFADENEKTOMIÍ A S NÁLEZEM UZLINOVÝCH METASTÁZ. LZE POMÝŠLET NA ÚSPĚCH BEZ SYSTÉMOVÉ LÉČBY?
- LÉČBA DE NOVO URGENTNÍHO SYNDROMU PO TOT IMPLANTACI
- LIPOSARKOM A GANGLIONEUROM JAKO PRIMÁRNÍ NÁDORY RETROPERITONEA
- ASYNCHRONNÍ BILATERÁLNÍ SEMINOM NA PODKLADĚ INTRATUBULÁRNÍ GERMINÁLNÍ NEOPLAZIE – NEKLASIFIKOVATELNÝ TYP
- TUMOR GLANS PENIS JAKO KLINICKÁ MANIFESTACE PLAZMABLASTICKÉHO LYMFOMU
- 30. VÝROČNÍ KONFERENCE EAU V MADRIDU
- Česká urologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- NOVÉ TRENDY V LÉČBĚ RENÁLNÍHO ANGIOMYOLIPOMU
- LIPOSARKOM A GANGLIONEUROM JAKO PRIMÁRNÍ NÁDORY RETROPERITONEA
- TUMOR GLANS PENIS JAKO KLINICKÁ MANIFESTACE PLAZMABLASTICKÉHO LYMFOMU
- FYZIOTERAPIE V LÉČBĚ INKONTINENCE MOČI U ŽEN
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



