-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Sulfony v dermatologii
Sulfones in Dermatology
Sulfones are regarded as drugs with ever increasing therapeutical potential in different entities in dermatology. Possible indications cover a range of skin disorders and they are frequently underestimated. This article deals with aspects of chemical structure, pharmacology, mechanism of action including anti-inflammatory and antiprotozoal activities, approved indications, side effects, and summarizes unapproved indications – both recommended and not recommended in dermatology. Data included could be helpful in our decision to use such drug in the treatment of various diseases.
Key words:
sulfones – dapsone – dermatology
Autoři: M. Salavec 1; N. Boštíková 2
Působiště autorů: Klinika nemocí kožních a pohlavních, FN a LF UK Hradec Králové 1; Lékařská fakulta UK Hradec Králové 2
Vyšlo v časopise: Čes-slov Derm, 92, 2017, No. 4, p. 155-175
Kategorie: Souborné referáty (doškolování lékařů)
Souhrn
Sulfony se řadí k několika málo lékům, jejichž potencionální užití v dermatologii nabývá skutečně značný rozsah a které jsou v řadě případů podceňovány. Tento článek se zabývá chemickou strukturou, farmakologií, mechanismy působení včetně protizánětlivého a antiprotozoálního účinku, užitím ve schválených indikacích, vedlejšími účinky, užitím v neschválených indikacích v dermatologii. Uvedené znalosti mohou napomoci v rozhodovacím procesu o nasazení těchto typů léků.
Klíčová slova:
sulfony – dapson – dermatologieTEORETICKÁ PROBLEMATIKA – CHARAKTERISTIKY DAPSONU A VÝSLEDKY KLINICKÝCH STUDIÍ O ÚČINCÍCH LÉKU
K první syntéze dapsonu došlo v roce 1908 [Fromm a Whitmann]. V této době nebylo úmyslem dapson užít jako terapeutické agens, byl to pouze výsledek rozvíjející se vědy o chemii. V roce 1933 byla užita první efektivní sulfonamidová sloučenina v klinických studiích a na trh přišla pod označením Prontosil® o 2 roky později. Za vším stálo obrovské úsilí Gerharda Domagka, který zjistil antibakteriální potenciál určitých sulfonamidů vyvinutých spolupracovníky, chemiky Klarerem a Mietzeschem. V roce 1939 obdržel Domagk Nobelovu cenu za medicínu a fyziologii. Nicméně díky politice nacionálního socialismu převzal ocenění až v prosinci 1949 [94].
Medicínský výzkum spojovaný se sulfony započal teprve v roce 1937, kdy se ve Francii (Fourneau et al.) a v Anglii (Buttle et al.) zjistil v rámci výzkumu sulfonamidů antimikrobiální účinek dapsonu. Pozdější nasazení dapsonu v terapii neinfekčních onemocnění nebylo výsledkem systémově prováděného výzkumu, ale spíše virtuálně řízeno náhodou [94].
Při hodnocení mechanismu účinku je dapson charakterizován dvojí funkcí. Kombinuje jak antimikrobiální/antiprotozoální vlastnosti, tak protizánětlivý efekt, který je podoben efektu při nasazení nesteroidních protizánětlivých léků. V posledních desetiletích to byly především hematologické vedlejší účinky, které vedly k intenzivním snahám o zlepšení poměru riziko/prospěch při nasazení sulfonů. Paralelně s tímto výzkumem probíhaly pokusy o syntézu parenterálních aplikačních forem. Nicméně do dnešního dne je perorální aplikace jedinou systémovou terapií sulfonů. K pochopení mechanismu účinku a při zvažování indikací v dermatologii, stejně jako při hodnocení terapeutických konsekvencí, je znalost farmakologie a metabolismu v zánětlivých buňkách a v humánní populaci nezbytná.
CHEMICKÁ STRUKTURA A FARMAKOLOGIE
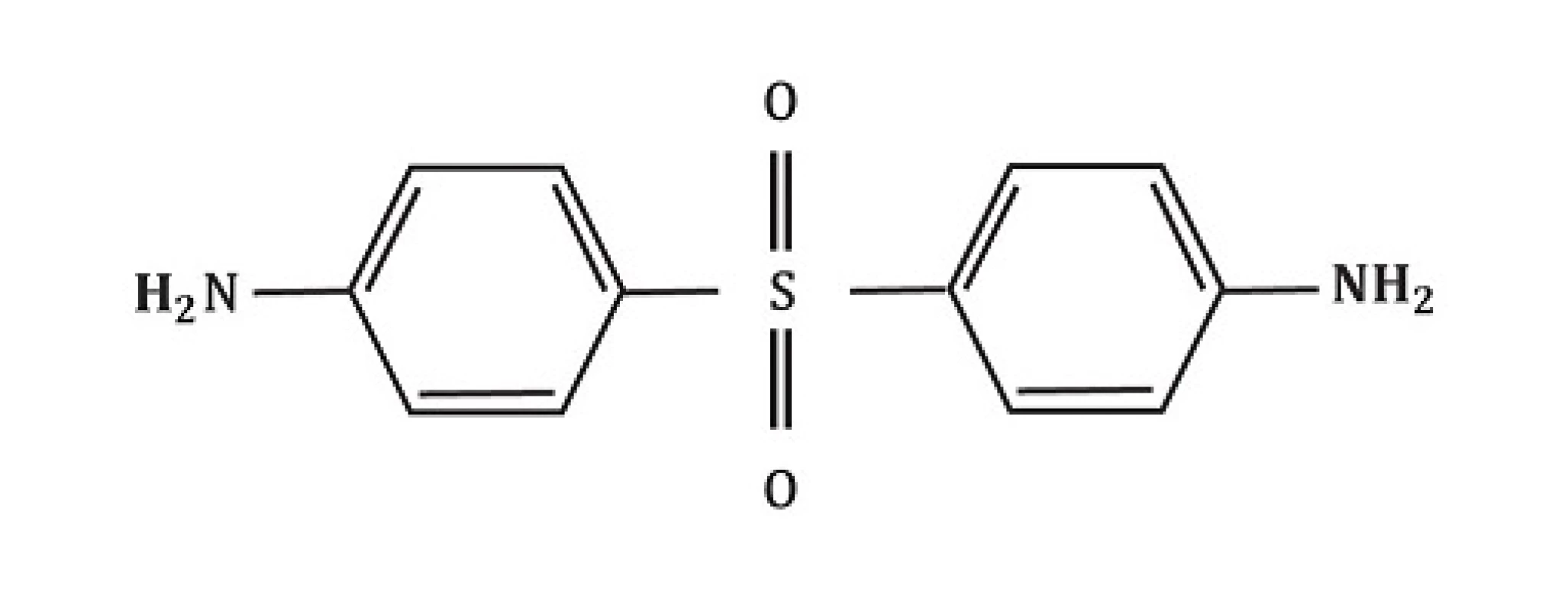
Chemicky je dapson definován jako derivát anilinu. Jako sulfon vykazuje strukturu atomu síry navázaného na 2 uhlíkaté atomy (obr. 1). Rozpustnost sulfonů závisí na užitém rozpouštědlu a vykazuje poměrně široké rozmezí (u vody 0,2 mg/ml; u metanolu 52 mg/ml). Po orálním podání je dapson téměř kompletně a rychle vstřebán ze střeva s biologickou dostupností přesahující 86 %. Vrcholy sérové koncentrace jsou dosaženy za 2–8 hodin. Průměrný poločas eliminace je 20–30 hodin. Při požití jednotlivé dávky v rozsahu 50–300 mg dapsonu, kolísají maximální sérové koncentrace od hodnot 0,63 až na 4,82 mg/l. Běžná dávka 100 mg/den dosahuje za stálých podmínek sérové koncentrace maximálně 3,26 mg/l. Po 24 hodinách jsou hodnoty okolo 1,95 mg/l. Při interpretaci výsledků vyšetřování in vitro musíme mít na paměti dosažené sérové koncentrace dapsonu in vivo. Po vstřebání prochází dapson enterohepatickou cirkulací. Je metabolizován játry, ale také aktivovanými polymorfonukleáry (PMN) a mononukleáry.
V játrech je dapson primárně metabolizován 2 různými způsoby: acetylací N-acetyltransferázou na monoacetyldapson (MADDS) a dále hydroxylací enzymy cytochromu P-450 (obr. 2). To vyústí ve vznik tzv. dapson hydroxylaminu (DDS-NOH) (obr. 3). Podání dapsonu bylo také užíváno k určení acetylačního fenotypu: rychlá versus pomalá acetylace. Při analýze efektu, ale i indukce nežádoucích účinků, je právě klíčový vznik DDS-NOH. K tomuto metabolickému pochodu dochází také v postižené kůži zánětlivých dermatóz a zdá se být zprostředkován aktivovanými PMN. Virtuálně je dapson distribuován do všech orgánů. Vychytáván je v kůži, svalech, ledvinách a v játrech. Stopové koncentrace mohou být přítomny v těchto tkáních až po dobu 3 týdnů po ukončení terapie. Látka je také distribuována do potu, slin, sputa, slz a do žluče. Z 50–90 % se dapson váže na plazmatické bílkoviny, zatímco MADDS je téměř kompletně navázán na plazmatické bílkoviny. Proniká hematoencefalickou bariérou a placentou a lze jej prokázat i v mateřském mléku. Byly popsány případy neonatální hemolýzy a cyanózy dětí matek, které užívaly dapson. Asi 20 % dapsonu je vyloučeno v nezměněné podobě močí, zatímco 70–85 % je eliminováno jako ve vodě rozpustné metabolity konjugované s glukuronovou kyselinou. Tento krok je zprostředkován uridin difosfát glukuronosyltransferázou (UDP). Menší množství léku může být vyloučeno stolicí včetně dosud neidentifikovaných metabolitů. Komplexní metabolické pochody dapsonu byly již v literatuře opakovaně shrnuty (obr. 4) – metabolismus dapsonu v lidských PMN a mononukleárech po aktivaci forbol myristate acetátem /PMA, tumor podporující aktivita, stimulace DNA, RNA/ a oxidační cesty NaOCl, podle [97]).
Obr. 2. Metabolické cesty dapsonu 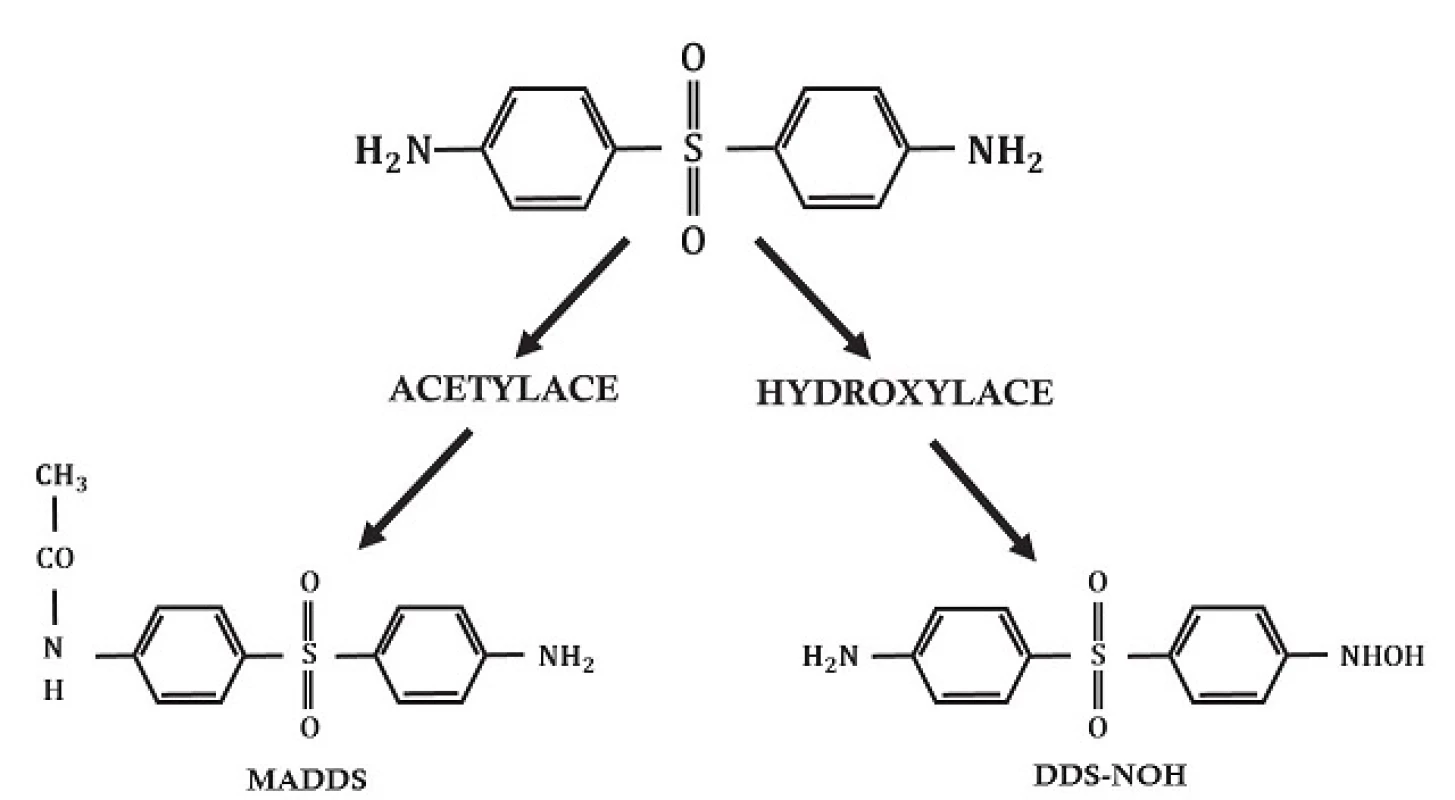
Obr. 3. Metabolismus dapsonu v lidských PMN 
Obr. 4. Struktura dapsone hydroxylaminu 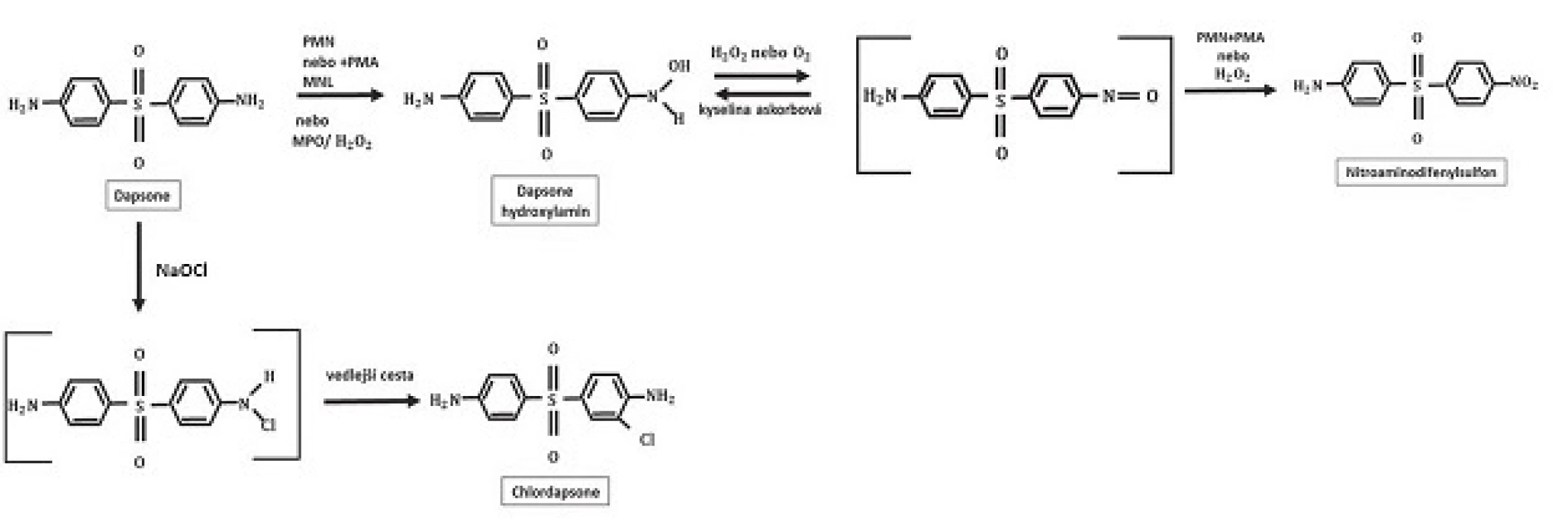
Metabolismus dapsonu v buněčných kulturách nebyl tak extenzivně studován. Z části to lze vysvětlit chemickými vlastnostmi dapsonu, který je pojímán jako sloučenina obtížně zpracovatelná. První nálezy týkající se metabolismu dapsonu v buněčných kulturách byly představeny Drayerem et al. [17] a Uetrechtem et al. [90]. Po inkubaci polymorfonukleárů a zymosanem aktivovaných lidských polymorfonukleárů dapsonu byla zjištěna produkce dapson-hydroxylaminu (-NO2) – viz obrázek 4 a derivátu dapsonu se substitucí chlóru (chlorodapson – obrázek 5) pomocí metod vysokotlaké kapalné chromatografie a plynové chromatografie/hmotnostní spektroskopie. Ani DDS-NOH, ani nitroderiváty nebyly detekovatelné bez předchozí stimulace. Aktivace leukocytů vyústí v indukci respirační metabolické cesty s následnou produkcí reaktivních kyslíkových species (ROS) jako H2O2 nebo OH - a 1O2 (O2 singlet, singletový kyslík, není volným radikálem). Během tohoto procesu využívá myeloperoxidáza (MPO) dapson jako substrát, což vyústí ve vznik DDS-NOH oxidační cestou. Konečně dalším neenzymatickým procesem vzniká nitroderivát dapsonu (obr. 6). Naopak, přidání katalázy nebo azidu sodného vedlo k inhibici oxidace dapsonu v závislosti na dávce. Autoři nebyli schopni prokázat předpokládanou alternativní enzymatickou cestu hydroxylace dapsonu pomocí prostaglandinového cyklu, protože klasické inhibitory, jako kyselina acetylosalicylová nebo indomethacin, neindukovaly snížení oxidace. Metabolismus dapsonu v lidských mononukleárních buňkách prokázal velmi obdobné charakteristiky.
Obr. 5. Struktura chlorodapsonu 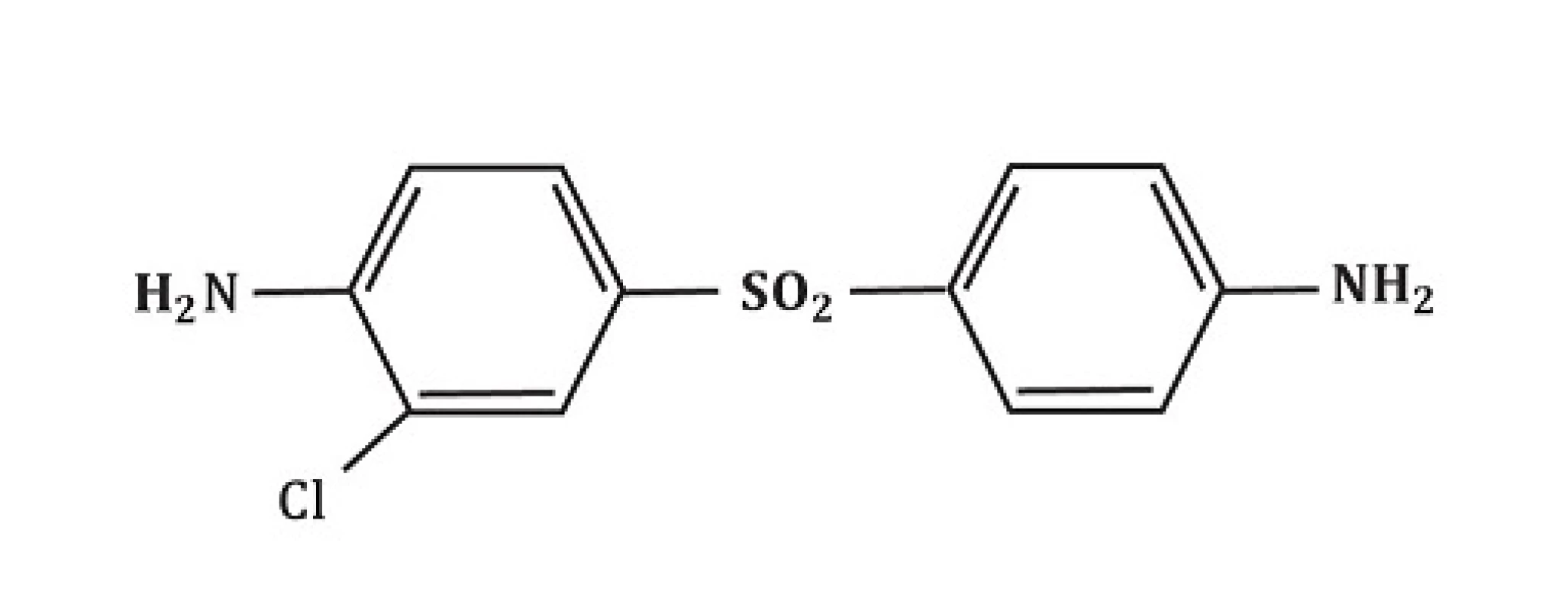
Obr. 6. Struktura nitroderivát dapsonu 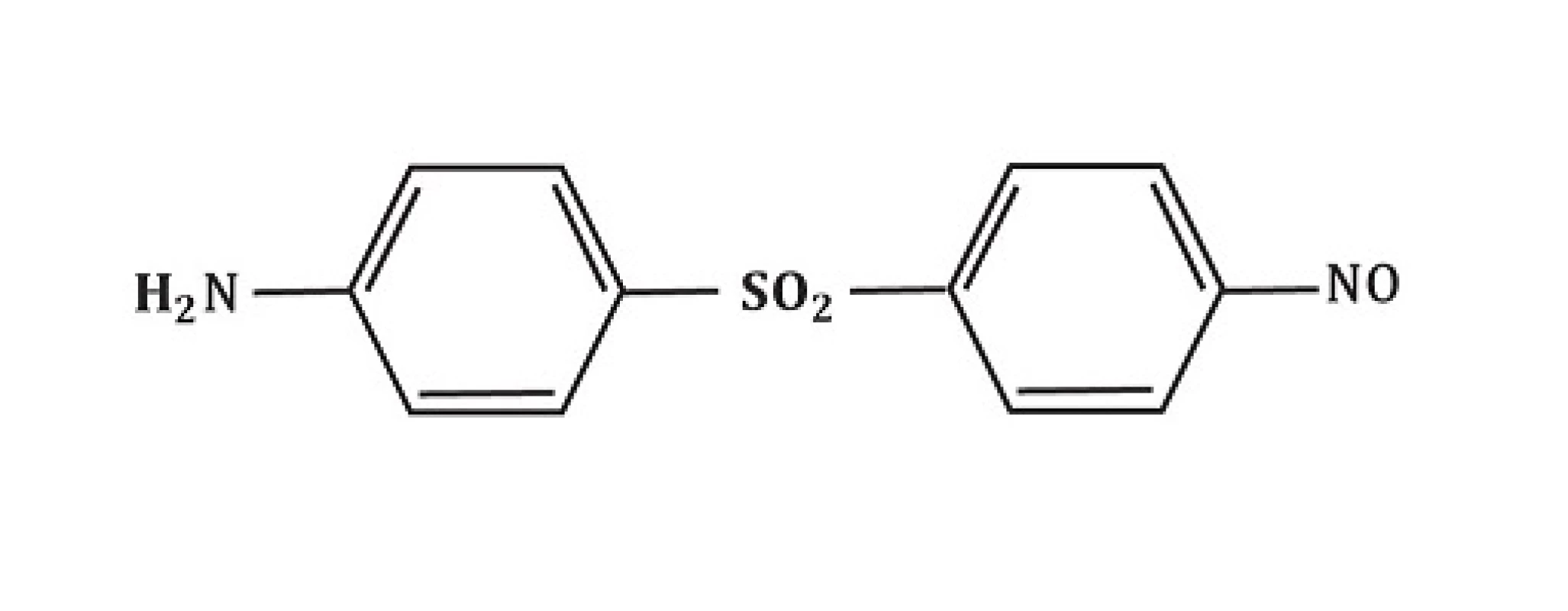
Po podání dapsonu dochází k rovnováze mezi acetylaci a deacetylací. Takto dochází k možnosti, že PMN v periferní krvi jsou exponovány jak dapsonu, tak jeho metabolitům. Tyto metabolity jako DDS-NOH jsou farmakologicky aktivní, nicméně jsou považovány jako zodpovědné faktory nejen protizánětlivých mechanismů (např. inhibice chemotaxe), ale také za řadu vedlejších účinků. To bylo do současnosti jasně dokumentováno u DDS-NOH. Khan et al. [46] vykázali v poslední době, že lidské keratinocyty stimulované různými vytokány, jako tumor nekrotizujícím faktorem alfa (TNF-α), interleukinem 1 beta (IL-1β) a interferonem gamma (INF-γ) mohou také produkovat DDS-NOH.
ANTIMIKROBIÁLNÍ AKTIVITA
Jako antimikrobiální látka vykazuje dapson bakteriostatický účinek. Inhibuje syntézu kyseliny dihydrolistové kompeticí s kyselinou paraaminobenzoovou v aktivním místě dihydropteroát syntetázy a podobá se takto účinku sulfonamidů. Sulfony potlačují růst různých patogenních bakterií jako streptokoků, stafylokoků, pneumokoků, mykobakterií a dalších kmenů. Mechanismus účinku lokálně aplikovaného dapsonu v léčbě acne vulgaris může vzniknout kombinací antimikrobiálních a protizánětlivých efektů. In vitro vykazuje dapson určitou antibakteriální aktivitu proti Propionibacterium acnes. Průkazem těchto antimikrobiálních aktivit hraje dapson zcela jasně i roli v léčbě určitých infekčních onemocnění.
PROTIZÁNĚTLIVÉ MECHANISMY ÚČINKU
Studie na zvířecích modelech
Dapson byl již před lety studován v různých zvířecích zánětlivých modelech. Experimenty byly prováděny zejména u malých savců, jako u myší, krys a morčat. Výsledky těchto studií vykázaly řadu variací v protizánětlivém působení. Většina autorů prokázala, že protizánětlivý účinek se liší od účinku nesteroidních protizánětlivých léčiv.
Reaktivní formy kyslíku ROS
(Reactive Oxygen Species)Formy zahrnují jak volné radikály, tak i látky, které volnými radikály nejsou. Jako volný radikál označujeme jakoukoliv chemickou entitu, atom, molekulu nebo ion, která má ve vnější sféře svého elektronového obalu alespoň jeden nespárovaný elektron a je přitom schopna samostatné existence. Reaktivní formy reagují s mastnými kyselinami, lipidy, aminokyselinami, proteiny a polynukleotidy, s koenzymy a s řadou nízkomolekulárních metabolitů. Jsou významnými prostředníky přenosu energie, faktory imunitní obrany, signální molekuly buněčné regulace. K látkám, které nejsou volnými radikály, patří: peroxid vodíku H2O2, kyselina chlorná HClO, ozon O3, singletový kyslík 1O2. K volným kyslíkovým radikálům patří superoxid kyslíku O2.-, hydroxylový radikál HO., peroxyl ROO., alkoxyl RO., hydroperoxyl HO2.. V roce 1983 byli Japonci první, kteří připsali dapsonu schopnost úklidu volných kyslíkových radikálů [66]. To ovšem vedlo k otázkám týkajícím se dřívějších studií, které připsaly dapsonu přímou odklízecí funkci. A mimo to, tyto experimenty poprvé ukázaly, že experimentálně stimulované buňky bez fagocytárních vlastností jsou schopné produkce ROS. Tyto experimenty proběhly i s mitochondriálním komplexem a zjistily pokles hladin bílkovin u dapsonem léčených zvířat. Dapson opět inhiboval uvolnění H2O2 indukované herbicidem. Autoři byli schopni reprodukovat stejné výsledky v savčích svalových buňkách a potvrdili tak, že dapson neinhibuje pouze stimulované zánětlivé buňky, jež mohou produkovat ROS.
SYSTÉM MYELOPEROXIDÁZA/HALOGENIDY
(dvouprvkové sloučeniny halogenů s elektropozitivnějšími prvky nebo se solí halogenovodíků)Myeloperoxidáza (MPO) zprostředkuje transformaci
H2O2 halogenidací:
H2O2 + Cl- myeloperoxidáza H2O + ClO
V další reakci mohou H2O2 a ClO - vést k uvolnění singletového O2, a znásobit tak cytotoxický potenciál. Všeobecně se dává za pravdu faktu, že část protizánětlivé aktivity dapsonu je dána (reverzibilní) inhibicí myeloperoxidázy (MPO). To vede k inhibici změny H2O2 na HOCl. Již časné práce zabývající se mechanismem účinku předpokládaly přímou inhibici MPO dapsonem. Následné studie potvrdily inhibiční efekt dapsonu na MPO. Inhibice MPO vede ke vzniku neaktivních intermediátů enzymu. Poněvadž kyselina hypochlorová je integrální součástí nejenom antibakteriální a antiprotozoální výzbroje polymorfonukleárů (PMN) a eozinofilů, ale stejně tak může vést k poškození tkáně u neinfekčních stavů, může se inhibice MPO dapsonem podílet na potenciálu protizánětlivé aktivity sulfonů.
Adhezivní molekuly/buněčná adheze
Heidenbluth et al. (citace v [97]) prokázaly schopnost dapsonu interferovat s funkcí integrinů. Vyšetřovali expresi leukocytárních integrinů v různých buněčných populacích za podání dapsonu (20, 100 a 200 µg/ml). Stimulace s PMA (Phorbol 12-Myristate 13-Acetate) indukovala zvýšenou expresi CD11a, b, c a CD18 jak v PMN. Dapson inhiboval expresi β-2 integrinů, CD11a, CD11c a CD18 v PMN pouze okrajově. Tento efekt nebyl závislý na dávce. Thuong-Nguyen et al. [89] ukázali, že dapson inhiboval adherenci neutrofilů k IgA a IgG v sérech pacientů s IgA lineární dermatózou a s bulózním pemfigoidem v závislosti na dávce. Jiní autoři prokázali inhibici adheze TNF-α – nebo destičky aktivujícím faktorem (Platelet Activating Factor, PAF) – aktivovaných PMN zdravých dárců při podání dapsonu.
α-11-proteáza inhibitor
Dapson má in vitro ochranný účinek α-1 inhibitor proteázy (AIP) na funkční schopnost inhibitoru elastázy; takto prokazuje obdobné vlastnosti jako fyziologický antioxidant ceruloplasmin. Ochranný účinek na AIP je spojován s potentní supresí produkce volných kyslíkových radikálů a s inhibicí systému myeloperoxidáza/halonidy. Vzhledem k faktu, že koncentrace dapsonu užité v těchto studiích dosáhly dávek užívaných in vivo, může být tento typ účinku efektivní u nemocí s dysfunkcemi AIP.
Chemotaxe
Dopady dapsonu na chemotaxi byly publikovány v několika studiích s částečně protichůdnými výsledky. V pilotní studii s užitím různých chemotaxinů byla zjištěna inhibice selektivně pouze při užití FMLP jako stimulans, ne ale při užití LDCT (Leukocyte Derived Chemotactic Factor, chemotaktický faktor odvozený od leukocytů), a ani při užití C5a. Navíc byly zjištěny závislosti druhové a buněčné – PMN křečků a monocyty neprokázali inhibici chemotaxe. Booth et al. též prokázali inhibiční efekt dapsonu na chemotaxi lidských neutrofilů za užití FMLP a IL-8 jako stimulů [7]. I náhodná migrace byla dapsonem inhibována. Studie in vivo nepřinesly konzistentní výsledky. Inhibice chemotaxe dapsonem per se je v současné době neudržitelná.
Membránou-asociovaný metabolismus fosfolipidů
Buněčná aktivace vytváří proces enzymaticky zprostředkovaných signálních transdukcí vedoucích k uvolnění kyseliny arachidonové, zdroje biologicky aktivních mediátorů metabolických cest cyklooxygenázy (COX) a lipooxygenázy (LOX). U zdravých dárců byl studován vliv dapsonu na cholin fosfotransferázu (ChPhTF) a na methyltransferázy I a II (MTF) za užití PMN, lymfocytů a erytrocytů [65]. Byl zjištěn bunečně-specifický typ inhibice dapsonem.
Prostaglandiny
Inhibici syntézy a uvolnění prostaglandinů dapsonem se věnoval Ruzicka et al. [80]. Zjistili inhibici vzniku prostaglandinu D2 (PGD2) závislou na dávce. Dapson vykázal dále inhibiční efekt na IgE zprostředkovanou antigen stimulovanou produkci PGD2. Uvolnění histaminu ale nebylo inhibováno.
Leukotrieny
Maloff et al. zkoumali efekt dapsonu na receptory LTB4 [97]. Při užití lidských PMN prokázali, že koncentrace dapsonu 10, 50 a 100 µmol inhibují specifickou vazbu LTB4 k receptoru. Další zvýšení koncentrace dapsonu nevyústilo ve zvýšení blokády. Přesný mechanismus přerušení signální kaskády ligandového receptoru není znám. Jiné práce prokázaly inhibici syntézy LTC4 v závislosti na dávce.
Interleukin 8
Interleukin 8 (IL-8) je produkován makrofágy, lymfocyty, epiteliálními buňkami, endoteliemi. Působí na neutrofily, bazofily, lymfocyty, monocyty, hematogenní progenitorové buňky a ovlivňuje chemotaxi neutrofilů do místa zánětu, antivirové účinky a vede ke zvýšení fagocytózy. Patří do rodiny CXC chemokinů (peptidy s klasifikací dle cysteinových zbytků; CC, CXC,CX3C a C). Signální transdukce je zprostředkována receptory CXCR1 a CXCR2 a je součástí virových infekcí a progresí tumorů. Po zjištění, že ROS významně ovlivňují regulaci IL-8 byly zahájeny studie zkoumající efekt dapsonu na IL-8. V in vitro modelu plné lidské krve, vykázal dapson v terapeutických koncentracích supresivní efekt na lipopolysacharidy indukovanou hladinu IL-8. Dapson též potlačil uvolnění IL-8 z keratinocytů indukované IgG protilátkami u bulózního pempfigoidu [84] a byl schopen inhibice exprese IL-8-mRNA [1] i bloku IL-8 indukované chemotaxe [36]. Diskutuje se o možném inhibičním efektu prostřednictvím cíleného účinku na neutrofily [43].
TNF-α
Abe et al. zkoumali vliv dapsonu na TNF-α a další prozánětlivé cytokiny jako IL-1β - a IL-8 v kontextu terapeutického využití u lupus erythematosus [1]. Dapson indukoval na dávce závislou supresi TNF-α v hladině mRNA. S výjimkou IL-8 nebylo zjištěno ovlivnění hladin dalších cytokinů. Efekt na IL-8 byl obdobný efektům popsaným výše. Je ale též nutné dodat, že koncentrace dapsonu užité ve studii přesahovaly běžné terapeutické koncentrace.
Eozinofilní peroxidáza
Bozeman et al. studovali vliv dapsonu na eosinofilní peroxidázu [8]. Inhibiční efekt sulfonu na MPO (myeloperoxidáza) byl dokonce silnější než u neutrofilů a byl asociován s redukovaným množstvím toxické kyseliny hypochlorové a dalších ROS.
SYSTÉM KOMPLEMENTU. KOAGULACE A FIBRINOLYTICKÝ SYSTÉM, KOŽNÍ PROTEÁZY
Inhibiční efekt dapsonu na alternativní cestu aktivace komplementu in vitro byl detekován Milikanem et al. [97]. Naopak Katz et al. nezjistili vliv dapsonu na klasickou nebo alternativní aktivaci komplementu ve zvířecích modelech i u pacientů s dermatitis herpetiformis [44]. Dapson nevykazuje vliv na aktivátor plazminogenu při inkubaci epidermálních buněk s pemfigovými protilátkami [32]. A konečně efekt dapsonu na kožní proteinázy byl zjištěn jako minimální [21].
Funkce lymfocytů
Při hodnocení funkce lymfocytů jsou opět výsledky zčásti protichůdné. Beiguelman a Pisam popsali inhibici PHA (Phytohemaglutinine; fytohemaglutinin)-indukované lymfocytární transformace (LZT) dapsonem [97]. U zdravých dárců s nasazeným dapsonem v terapeutických dávkách po dobu 7 dnů byla pozorována signifikantní inhibice PHA stimulované LZT [97]. Další autoři potvrdili toto pozorování při užití jiných mitogenů, jako concavalin A a lepromin [3, 49]. Zvířecí studie s jaterními a slezinnými imunitními buňkami (T a B lymfocyty stimulované s concavalinem A a LPS) zjistily na dávce závislý efekt dapsonu. V nižších koncentracích (1 µmol) dapson stimuloval proliferaci B a T buněk za vlivu mitogenů (concavalin A a LPS), ale inhiboval proliferaci B buněk ve vyšších koncentracích (150 µmol). Thomson a Souhami nezjistili změny v produkci protilátek [88]. Autoři podtrhují imunostimulační efekt dapsonu v nízkých koncentracích a imunosupresivní efekt ve vyšších koncentracích jako všeobecný princip.
Neuroprotekce
Poslední výzkumy odhadly schopnost dapsonu ovlivnit funkce centrálního nervového systému [42, 62, 75, 76, 92]. Dapson v experimentu potlačil neurotoxicitu [82]. V pilotní studii u pacientů s iktem byl zjištěn neuroprotektivní efekt. Neuroprotektivní efekt dapsonu byl přičten jeho antioxidativnímu působení [16]. Antikonvulzivní efekty dapsonu byly popsány v dřívějších studiích [27, 35]. V kontextu neurologických onemocnění publikovali japonští autoři výsledky úspěšné terapie kortikoidy dependentního Sweetova neurologického onemocnění s odpovědí při dávce 75 mg dapsonu/den [97]. Neurologická varianta Sweetova onemocnění je charakterizována neurologickými příznaky (meningitis, encephalitis) a dobře známými kožními projevy (např. bolestivé tuhé erytematózní plaky) v asociaci s HLA-Cw1 nebo B54.
Růst tumoru
Některé studie vedly k výsledkům poukazujícím na protitumorózní aktivitu určitých derivátů dapsonu [2, 5, 28, 34, 68].
Humánní farmakologické studie
Po předchozí terapii s lokálně aplikovanými metabolity dapsonu MADDS a DDS-NOH (1% koncentrace, vehikulum aceton) po dobu 2 týdnů bylo na kůži zdravých dobrovolníků aplikováno 10 ng LTB4. Po 24 hodinách byly provedeny biopsie a fluorometricky za užití elastázy metodou podle Lamerse et al. byly kvantifikovány PMN [51]. MADDS nevykázal inhibiční aktivitu na PMN ve srovnání s odpovídajícími kontrolami a neléčenými oblastmi. DDS-NOH vykázal statisticky signifikantní inhibici akumulace PMN převyšující efekt referenčního clobetasol-17-propionátu (CP). Naopak mateřská sloučenina dapson nevykázala leukotrienem B4 indukovanou chemotaxi PMN. Tyto výsledky in vivo testů jasně prokazují, že metabolity dapsonu, zvláště DDS-NOH, jsou farmakodynamicky aktivní. Další experimenty ukazují, že metabolity dapsonu vykazují farmakodynamické efekty při lokální aplikaci na kůži a mohou se přinejmenším vyrovnat dapsonu v protizánětlivých vlastnostech. Potlačená aktivita UVB erytému dapsonem byla následně potvrzena Salomonem, který pozoroval významné inhibiční efekty, jak lokálně aplikovaných (0,1–10%), tak systémově podaného dapsonu (100 mg/den) na UV indukovaný erytém zdravých dobrovolníků s kožním fototypem II a III [97]. Teoretické vysvětlení pro pozorovaný supresivní efekt dapsonu na vznik erytému může být dán inhibičním účinkem na prostaglandiny.
SOUHRN TYPICKÝCH CHARAKTERISTIK DAPSONU
Spojení antimikrobiálních/antiprotozoálních a antiflogistických účinků v široké škále indikací staví dapson do jedinečné pozice ve spektru nesteroidních antiflogistických léků. V současné době není v medicíně popsáno jiné léčivo, poskytující tak širokou škálu prospěšných vlastností, jako jsou:
- Kombinace antimikrobiálních/antiprotozoálních účinků (využito, např. v léčbě oportunních infekcí u nemocných s AIDS).
- Bezpečnost dlouhodobé léčby (např. doživotní terapie u lepry, dlouhodobá nebo chronicky intermitentní léčba zánětlivých dermatóz).
- Jedinečné a potentní antiflogistické aktivity specifické pro určitá onemocnění (např. promptní redukce pruritu a kontroly vývoje kožních lézí u dermatitis herpetiformis; rychlé zlepšení stavu po kousnutí koutníkem jedovatým).
- Kortikoidy spořící efekty (např. dlouhodobá léčba autoimunitních puchýřnatých chorob a jako adjuvantní léčba bronchiálního astmatu).
- Projektivní efekty CNS (antikonvulzivní efekty, redukce poškození tkáně záchvatovitými stavy, inhibice glioblastomu).
Konečně by měl být brán v úvahu farmakoekonomický benefit díky nízkým cenám dapsonu.
KLINICKÁ PROBLEMATIKA – SCHVÁLENÉ INDIKACE DAPSONU A JEHO VEDLEJŠÍ ÚČINKY
Supresivní medikamentózní terapie
Sulfony jsou v moderní medicíně indikovány jako součást kombinované léčby (s rifampicinem) různých forem lepry, pneumonií působených Pneumocystis jiroveci a k prevenci toxoplazmózy u jedinců s AIDS. V dermatologii je lék preferován v léčbě Duhringovy choroby, nicméně může být užit v terapii širokého spektra chronických zánětlivých změn, především pak u autoimunitních puchýřnatých chorob. Vhodné podávání, dávkování a pečlivé monitorování může být garancí efektu i bezpečnosti preparátu.
Tato forma terapie je tedy zavedenou terapií dermatitis herpetiformis (DH). K terapii užíváme sulfony, především dapson (v České republice Disulone tbl.® formou mimořádného dovozu), v zahraničí jsou udávány příležitostně sulfamethoxypyridazin a sulfapyridin (tab. 1). Užití sulfamethoxypiridazinu je doporučováno pro léčbu DH u osob starších 50 let [23]. Dávka kolísá od 0,5 g 2krát týdně až do dávky 4 g/den. Vedlejšími účinky je nausea, letargie a deprese. Byly popsány i suprese kostní dřeně a hemolytická anémie [61].
Tab. 1. Terapie dermatitis herpetiformis [22] ![Terapie dermatitis herpetiformis [22]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/791cd92f1f56cd4091d9a4a9e0f137a1.png)
Dapson již není v České republice běžně dostupný a registrační řízení na národní úrovni nebylo obnoveno. S tím souvisí nadměrná administrativní zátěž týkající se nejen vlastního dovozu, ale i spojená s žádostí o částečnou úhradu léku plátci zdravotní péče. Je též potřeba si uvědomit, že preskribující lékař odpovídá v plném rozsahu za zdravotní stav pacienta a musí velmi pečlivě monitorovat manifestaci nežádoucích vedlejších účinků. Na základě pokynu Ústředí VZP ČR územním pracovištím VZP byl v minulosti na pracoviště dermatovenerologů odeslán dopis stanovující podmínky schválení úhrady léku Disulone tbl. Tento dopis stanovuje postup podle ustanovení zákona č. 79/1997/Sb., o léčivech, a související vyhlášky MZ ČR č. 473/2000. V dopise VZP se vysloveně stanoví (citace): „Podmínkou pro schválení úhrady Disulonu tbl. je zejména dodržování bezlepkové diety, která je kauzální léčbou a pacient by měl být pravidelně sledován gastroenterologem a dermatologem.“ Je třeba připomenout, že při absenci registrace dapsonu na českém trhu nebyl ústředím VZP ani jiných pojišťoven kontaktován žádný dermatolog. Lék přitom nemá ve svých indikacích rovnocennou alternativu. Argumentace, že striktní bezlepková dieta je jedinou účinnou léčebnou metodou u dermatitis herpetiformis nemůže být plně akceptována. Striktní bezlepková dieta má být zcela nedílnou součástí terapie kožně nemocných (přinejmenším působí preventivně s ohledem na vývoj střevních lymfomů). U řady jedinců dovolí redukci nutné dávky dapsonu, podle osobních zkušeností však zcela výjimečně dovolí trvalé vysazení supresivní terapie onemocnění sulfony. Je ale potřeba vzít v úvahu klinický obraz dermatitis herpetiformis, subjektivní obtíže postižených s manifestací velmi úporného, kvalitu života ovlivňujícího pruritu a konečně dobu odezvy střevní sliznice na zavedenou dietu, čítající řadu měsíců. Pojišťovny vytýkají, že na žádankách o schválení úhrady chybí zpráva o dosavadní terapii pacientů, jejich celkový zdravotní stav, verifikace klinické diagnózy a stávajících režimových a dietních opatřeních. Navíc požaduje doložit legitimitu aplikace léčiva specifickým léčebným programem schváleným MZ ČR, neboť schválení úhrady je požadováno pro více než 1 pacienta. Specifický léčebný program byl vypracován autory tohoto článku, prošel připomínkami výboru odborné společnosti a byl zaslán příslušným orgánům, žel zcela bez reakce. Územní střediska VZP byla za dřívější relativně benevolentnější přístup kritizována vyššími nadřízenými složkami. Pojišťovny dále požadují zajištění předepsaných údajů: přesný obchodní název léčivého přípravku, jeho lékovou formu, velikost balení a složení (název účinné látky), přesný název výrobce a zemi výrobce, text souhrnu údajů o požadovaném léčivém přípravku a text jeho příbalové informace schválené regulačním orgánem země výrobce, seznam zemí, kde je požadovaný léčebný přípravek registrován. Dále u neregistrovaných léčebných přípravků používaných na základě povolení MZ ČR přiložit kopii „výjimky z registrace“, uvedení konečné ceny za balení léčebného přípravku a název dodavatele. Dostupnost přípravku pro pacienty s dermatitis herpetiformis se tak velmi limituje. Řada pacientů byla k zajištění přípravku odkazována na nákup v zahraničí. V poradně pro puchýřnaté autoimunitní choroby zajišťujeme dostupnost léčiva po iniciálním splnění výše uvedených požadavků ve spolupráci s ústavní lékárnou fakultní nemocnice v režimu žádostí o schválení úhrady léčiva v rámci mimořádného dovozu. Takto je lék alespoň částečně hrazen z prostředků zdravotního pojištění. Administrativní zátěž včetně hlášení proskripce SÚKLu přesto přetrvává a i po stránce ekonomické se finální cena za balení mnohanásobně zvýšila.
Perorální medikace velmi rychle potlačí kožní reaktivitu a je velmi efektní i v udržovací terapii. Předpokládá se, že dapson je efektivní látkou u dermatóz charakterizovaných abnormální akumulací neutrofilů nejrůznějšími možnými mechanismy – viz sekce A. K hojení kožních změn po nasazení dapsonu dochází již v průběhu 2 dnů, kompletní odhojení lze očekávat v průběhu 1 týdne. Nicméně při vysazení léku jsou relapsy poměrně rychlé. Dávka 100 mg denně (nejběžnější průměrná dávka podávaného dapsonu) obvykle velmi dobře kontroluje možnost kožního výsevu [81].
Standard České dermatovenerologické společnosti ČLS JEP [86] udává počáteční dávku 100–150 g/den s postupným snižováním až na 50 mg/den každý 2. až 3. den, sulfasalazin doporučuje při současném manifestním střevním onemocnění.
Podpůrně pak lze podat antihistaminika, vitamin C v dávkách 500–1000 mg/den a vitamin E a cimetidine ke snížení rizika methemoglobinémie, i když literární údaje nepodporují přílišný efekt (viz dále). Při sekundární infekci jsou doporučena antibiotika podle citlivosti vyvolávajícího agens. Současně s medikamentózní léčbou je vždy doporučena přísná bezlepková dieta, uváděno je i vhodné omezení jódu v potravě a v lécích, eventuálně eliminace kravského mléka. Jód a jeho deriváty se mohou u pacientů s DH účastnit aktivace neutrofilů v kůži. V iniciální fázi léčby má tedy omezení příjmu jodidů význam u pacientů se závažným kožním onemocněním, hůře odpovídajícím na supresivní terapii dapsonem. Při déle trvající přísné bezlepkové dietě není většinou nezbytná.
V lokální terapii se doporučuje antipruriginózní terapie [22].
NEŽÁDOUCÍ ÚČINKY
Hematologie
Hematologické nežádoucí účinky jsou dány hydroxylaminy dapsonu a jsou přítomny obligatorně. Liší se pouze mírou intenzity [52, 112]. Shrnutí nežádoucích účinků ukazuje tabulka 2.
Tab. 2. Nežádoucí účinky u dapsonu [97] ![Nežádoucí účinky u dapsonu [97]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/60bc40393bcb74bc093651acd5e75600.png)
Nejčastějším vedlejším účinkem je methemoglobinémie, ke které dochází při reakci metabolitů hydroxylaminu (DDS-NOH) s hemoglobinem v přítomnosti kyslíku. Dochází ke vzniku methemoglobinu, který je za normálních okolností snižován nikotinamid dinukleotid-dependentní reduktázou. Nedostatek tohoto enzymu znamená vyšší riziko vývoje methemoglobinémie. Klinicky se vysoké hladiny manifestují přítomností cyanózy. Akutní methemoglobinémie není tak častá, může ovšem vyústit v dyspnoe, anémii, vaskulární kolapsy a v nejzávažnějších případech i v úmrtí pacienta. Hladinu methemoglobinu je tedy nutné pravidelně monitorovat, zejména u pacientů s deficitem reduktázy nebo s přítomností kardiopulmonárních onemocnění. U nemocných bez deficitu glukózo-6-fosfát-dehydrogenázy (G6PD) se doporučuje podání methylénové modři intravenózně (1–2 mg/kg/den v pomalé i. v. injekci).
Podávání cimetidinu může snížit incidenci hlášených vedlejších účinků typu bolesti hlavy a letargie u pacientů s DH (redukuje konverzi dapsonu na hydroxylamin, nicméně vykazuje vlastní vedlejší účinky včetně gynekomastie).
Nejasný je přesný mechanismus hemolýzy, uvažuje se hypoteticky o účasti hydroxylaminu. Dvakrát více náchylní k vývoji hemolýzy jsou nemocní s deficitem glukózo-6-fosfát-dehydrogenázy (G6PD), zatímco jedinci s deficitem tohoto enzymu nevykazují tak často vysoké hladiny methemoglobinu. První 3 měsíce terapie je žádoucí vyšetřovat krevní obraz, diferenciální krevní obraz a počet retikulocytů každé 2 týdny, poté ve 3měsíčních intervalech.
Částečný protektivní efekt v rozvoji hemolýzy vykazuje podání vitaminu E (800 IU/den, po 4 týdny). V prvních 3 měsících terapie dapsonem má být pravidelně monitorován kompletní krevní obraz včetně diferenciálního krevního obrazu a počtu retikulocytů, dále nejméně každé 3 měsíce. Někdy je uváděn částečný ochranný efekt u dapson indukované hemolýzy při podávání vitaminu E v dávce 800 IU denně po dobu 4 týdnů [74].
Může dojít i k výskytu fatální agranulocytózy jako výrazu idiosynkratické reakce, obvykle se objevující 1–3 měsíce po zahájení terapie. Častěji se vyskytuje u starších jedinců (nad 60 roků života). Coleman doporučuje monitorování počtu neutrofilů během prvních 3 měsíců terapie [14]. Rychlý pokles počtu leukocytů pod 4 x 109/l by měl být indikací k přerušení léčby.
Syndrom hypersenzitivity dapsonu
Popsán je i syndrom přecitlivělosti na dapson. Od roku 1951 do roku 2009 bylo hlášeno 492 případů [95]. V metaanalytické studii bylo ze 492 uvedených hlášení, 114 případů naplňujících kritéria. U 336 nemocných byla provedena podrobná analýza určením prevalence ve výši 1,4 %. Latence od zahájení terapie do manifestace příznaků syndromu se pohybuje od méně než 20 dnů až do téměř 20 týdnů. Syndrom je provázen horečkou (více než 90 %), kožním výsevem (více než 90 %, lymfadenopatií (více než 70 %) a postižením četných orgánů, zejména jater (od elevace jaterních tesů přes hepatomegalie, žloutenky až po jaterní kóma). Kožní výsev je manifestován jako papulózní, pustulózní a ekzematózní léze. Syndrom je doprovázen pruritem, leukocytózou a eozinofilií, fotosenzitivitou. Tyto příznaky se objevují okolo 27. dne po zahájení léčby [50]. Tři či více měsíců po vzniku tohoto syndromu se může manifestovat i hypothyroidismus (proto je doporučené monitorování funkcí štítné žlázy).
U většiny postižených došlo k zotavení při vysazení dapsonu a při terapii kortikoidy. Okolo 10 % postižených vykázalo fatální průběh (hepatální kóma). Postižení sliznic, přítomnost hepatitidy, starší věk a komorbidity byly spojeny s vysokým rizikem fatálního průběhu. Při zvážení rozsahu užití dapsonu a počtech hlášených případů a ve shodě s provedenou metaanalýzou není tento nežádoucí efekt až tak výjimečný.
Nežádoucí účinky dapsonu na kůži
Nežádoucí účinky dapsonu na kůži byly literárně dokumentovány řadou klinických jednotek, např. erythema exsudativum multiforme, erythema nodosum, urticaria, toxická epidermální nekrolýza, exfoliativní dermatitida, morbili - a skarlatiformní exantémy [91]. Dapsonem indukovaná fotosenzitivita se objevuje velmi vzácně, nezávisí na dávce a vedle dapsonu se na ní podílí pravděpodobně i jeho metabolity [40]. U nemocných s AIDS léčených dapsonem současně s trimethoprimem se ve 30–40 % objevují výsevy, nicméně nejsou tak časté jako u pacientů na terapii samotným dapsonem. Navzdory těmto pozorováním toleruje významná část pacientů dapson i při nesnášenlivosti cotrimoxazolu [97].
Gastrointestinální systém/reakce jaterní tkáně
Nežádoucí účinky zahrnují anorexii, bolesti břicha, nauzeu a zvracení. Pozornost nicméně přitahují nežádoucí účinky na jaterní tkáň manifestující se 3 typy reakcí:
- Izolované abnormality jaterních funkcí (zvýšený bilirubin a/nebo jaterní enzymy) bez průkazu hepatitidy či hepatózy. Jsou-li tyto abnormality detekovány, musí být dávka dapsonu snížena či lék zcela vysazen do zjištění původu změn.
- Prehepatická žloutenka indukovaná hemolytickou anémií. Hyperbilirubinémie se častěji objeví u nemocných s deficitem G6PD. Stejně jako v předchozím případě musí být dávka dapsonu redukována či lék vysazen za pečlivého monitorování pacientů.
- Toxická nebo cholestatická hepatitida ve spojení se syndromem přecitlivělosti (Hypersensitivity syndrome, HS) na dapson. Jaterní kóma je nejčastější příčinou smrti u HS [54].
Nervový systém
Vzácně byly u nemocných s podáváním dapsonu popsány periferní neuropatie s primární ztrátou motorické funkce. Restituce je možná, trvá ale řadu měsíců až roků. Z popisu tragických případů, kdy byl dapson užit se suicidiálním úmyslem byla zjištěna jeho schopnost poškození periferní nervové tkáně včetně optického nervu s vývojem slepoty [31, 45]. Při manifestaci jakékoliv neuropatie musí být terapie dapsonem okamžitě ukončena.
Jiné vedlejší účinky
Nežádoucí účinky dosud neznámého mechanismu jsou většinou velmi vzácné (např. albuminurie, insomnie, psychózy, AV bloky, změny elektrolytů [96, 97, 100]. Některé mohou být částečně připsány na vrub anémie a/nebo methemoglobinémie.
KLINICKÁ PROBLEMATIKA – NESCHVÁLENÉ INDIKACE, PUBLIKOVANÁ DATA, DOPORUČENÍ
Pro protizánětlivý účinek je dapson nasazován především v terapii chronických dermatóz charakaterizovaných akumulací neutrofilů a/nebo eozinofilů. V minulosti byl nicméně užit povětšinou jako adjuvantní terapeutikum u některých dalších dermatóz (adjuvantní terapie k lokálním a systémovým steroidním schématům). V odborné literatuře bylo publikováno velké množství kazuistik, epidemiologických analýz i výsledků klinických studií prokazujících příznivý účinek dapsonu u těchto onemocnění (tzv. dapson-senzitivní onemocnění). I přes průkazné výsledky jsou následné reference pouze zlomkem relevantních odkazů [12, 13, 25, 26, 30, 41, 48, 70, 79, 99, 102]. Vedle toho existují i některá onemocnění, u kterých prokázal dapson v malých počtech případů efekt. Počáteční nadšení bylo ale následně mírněno následnými kontroverzními výsledky a/nebo úplnou absencí vhodných kontrolních studií vykazujících efekt. V těchto případech může být dapson doporučen pouze u zcela refrakterních případů na standardní terapii.
Klinické diagnózy s užitím dapsonu v terapii – dermatologické i non-dermatologické klinické jednotky
Dermatologické klinické jednotky
Acropustulosis infantilis
Dapson je u této jednotky považován za lék volby [96].
Akné
Efekt terapie dapsonem byl zjištěn v léčbě závažných nodulocystických zánětlivých forem akné. Nicméně důkazy k podpoře tohoto přístupu nejsou adekvátní a jsou založeny velmi často na kazuistických případech. K analýze efektu byly provedeny 4 studie. Ve dvojitě zaslepené studii srovnávající dapson a placebo byly výsledky terapie dapsonem nižší v efektu než u pacientů léčených normálně širokospektrými antibiotiky [78]. V nekontrolované studii 484 případů akné s rozdílným stupněm závažnosti léčených dapsonem v dávce 300 mg týdně, byla zjištěna příznivá odpověď u pacientů se stupněm závažnosti 4 (remise 80 % lézí na konci 3měsíční léčebné periody [39]). U mírných a středně závažných forem byla odpověď minimální. Srovnání denní dávky 100 mg dapsonu se 40 mg 13-cis retinové kyseliny u 40 mužských pacientů s nodulocystickým akné vykázalo pouze mírný klinický efekt. Zavedení isotretinoinu do léčby akné znamenalo pro svůj efekt označení tohoto léku jako léku volby u závažných forem akné. Nicméně výjimkou je terapie acne fulminans isotretinoinem, protože existují zprávy o indukci či precipitaci této jednotky isotretinoinem. Systémové steroidy a dapson proto zůstávají dvěma doporučovanými typy léků pro toto onemocnění.
Bechçetova choroba
Podle studie Ghateho et al. [24] je léčba dapsonem efektivní u perzistentních aftů a kožních manifestací mírně závažných případů Bechçetovy choroby. Je poněkud překvapivé, že vědecká báze tohoto terapeutického přístupu je podložena pouze velmi málo studiemi a kazuistikami. V řadě případů došlo po ukončení terapie dapsonem k exacerbaci projevů (36, 55). Mangelsdorf et al. zjistili u 4 nemocných léčených dapsonem až 50% redukci rozsahu frekvence a trvání kožně-slizničních lézí. Skutečný efekt dapsonu v léčbě tohoto onemocnění musí být potvrzen pečlivými kontrolními studiemi.
Epidermolysis bullosa acquisita (EBA)
Onemocněné, a zejména klasická tzv. mechanobulózní forma, je velmi charakteristické rezistencí na běžné terapeutické modality (kortikoidy, azathioprine, metotrexát, cyklofosfamidy). I u této jednotky je možné indikovat nasazení dapsonu v monoterapii či v kombinaci se steroidy. Kombinovaná terapie je pravděpodobně nejefektivnější v terapii dětské EBA. Remise přichází ve dnech až týdnech a užití kortikoidů je možné ukončit v průběhu 1 roku. Prognóza onemocnění u dětí je podstatně lepší než u postižených dospělých. U dospělých byla často pozorována selhání terapie dapsonem. Je třeba ale poznamenat, že řada literárních zdrojů prezentuje abnormálně a disproporčním způsobem vysokou incidenci terapeutického selhání z důvodů snahy o dokumentaci méně obvyklých a inovativních léčebných schémat ve srovnání s kombinovanou terapií dapson/kortikoidy, jež je ale běžnou a standardní léčbou EBA. Údaje o nových typech terapie, jako extrakorporální fotochemoterapie, plazmaferéza i vysoce dávkované imunoglobuliny i. v. vzešly od pacientů refrakterních na kombinovanou terapii dapson/kortikoidy.
Erythema elevatum diutinum
Jde o vzácnou chronickou formu kožní vaskulitidy. Yiannias et al. uvádějí pouze 13 popsaných případů za 60 let [94]. Ve snaze o publikaci zaměřenou na vzácnou dermatózu se tak objevilo více prací pojednávajících o efektu dapsonu než u jiných forem leukocytoklastické vaskulitidy. Mnoho těchto prací (kazuistiky i série pacientů) pak přineslo informaci o dramatickém efektu dapsonu u této klinické jednotky. Rychlé recidivy kožních změn a systémových příznaků po ukončení terapie dapsonem poukazují spíše na supresivní, nikoliv kurativní efekt. Onemocnění je chronické a změny kožní perzistují (diutinum = přetrvávající). Dramatické zlepšení při terapii dapsonem lze tedy přičíst na vrub léčebného efektu dapsonu. Pozdní léze onemocnění, které vykazují fibrohistiocytickou proliferaci neodpovídají na léčbu dapsonem [72].
Kaposiho sarkom
Již v roce 1984 byla popsána regrese Kaposiho sarkomu (KS) u nemocného MSM s diagnózou AIDS po terapii dapsonem v dávce 100 mg/den [71]. Plaky regredovaly v hnědavé atrofické jizvy po 6 týdnech terapie a následná histologie neprokázala změny typické pro Kaposiho sarkom. Následně se objevily práce sledující efekt dapsonu u biopticky ověřené diagnózy plakové a/nebo modulární formy Kaposiho sarkomu s průkazem efektu a úplné histologické regrese tumoru u plakové formy KS (histologický obraz „plak“ stadia je charakterizován difuznějším vaskulárním infiltrátem v dermis a doprovázený vyšší buněčnou denzitou v dermis s příležitostným šířením do podkožní tukové tkáně; buňky v lezích jsou více vřetenaté a uspořádány v krátkých, někdy chaoticky uspořádaných svazcích; jsou přítomny intra - a extracelulární eozinofilní hyalinní globule a obraz tzv. „autoiluminace“ – přítomnosti erytrocytu v paranukleolární vakuole v cytoplazmě vřetenitých endoteliálních buněk [94]). Hruza et al. však v pilotní studii 12 MSM (Men having sex with men, homosexuální muži) pacientů léčených dapsonem v dávce 100 mg/den nepotvrdili tento efekt (přetrvávání lézí a nové výsevy i při nejméně 56 týdnech medikace dapsonem [33]). V jiné studii popisující léčbu KS dapsonem při sledování klinických a histologických změn po dobu 2 let došlo u pacientů ke zlepšení symptomů, klinicky ale nebyla potvrzena významná modifikace lézí. Histologické vyšetření vykázalo redukci vřetenitých buněk a vzestup počtu vyzrálých cévních struktur. Úspěch terapie dapsonem byl zaznamenán i u non-HIV typu Kaposiho sarkomu [15]. Před eventuálním doporučením této formy léčby bude nutné provedení dodatečných randomizovaných studií s jednotným řazením podle stadií a jednotnými vyhodnocovacími kritérii.
Lineární IgA bulózní dermatóza
- a) forma dospělých
Lineární IgA bulózní dermatóza je řazena mezi získaná autoimunitní chronické puchýřnaté onemocnění charakterizované lineárními depozity IgA v zóně bazální membrány. Klinicky jsou obraz a histopatologie obdobné herpetiformní dermatitidě a bulóznímu pemfigoidu. Jednotka byla poprvé popsána v roce 1979 Chorzelskim et al. Na rozdíl od dermatitis herpetiformis není spojována s gluten-senzitivní enteropatií. Podobnost onemocnění s dermatitis herpetiformis podporuje indikaci dapsonu i u lineární IgA dermatózy, přičemž i zde onemocnění dobře odpovídá na tuto formu terapie a dapson je definován jako lék volby. Většina pacientů příznivě reaguje na dávky 100–150 mg dapsonu/den. Dávka by měla být postupně snižována do udržovací dávky 50 mg/ob den. Menší počet pacientů reaguje pouze na kombinovanou léčbu dapsonem a malými dávkami kortikoidů systémově podaných [94].
- b) forma dětská (chronické bulózní onemocnění dětí)
Jde o variantu stejného onemocnění, dosahující remise obvykle v průběhu 2–4 let a téměř vždy před dosažením puberty. Léčba sulfapyridinem či dapsonem vykazuje dobrou a poměrně rychlou odpověď (do 3 dnů). U nemocných s horší odpovědí lze v adjuvantním schématu přidat nízké dávky kortikoidů.
Lupus erythematosus
Vzhledem k všeobecně příznivé prognóze diskoidního (DLE) a subakutního lupus erythematosus (SCLE), kdy jsou vedle striktní fotoprotekce indikovány lokální terapie kortikoidy či systémová léčba antimalariky, není dapson považován za léčivo 1. linie. Může ale být zvážen při selhání výše uvedené terapie, při její kontraindikaci či v terapii zvláštních forem kožních lézí. Urtikariální léze s vaskulitidou často doprovází systémový lupus erythematosus (SLE). Matthews et al. popsali dramatické zlepšení těchto změn u SLE po podání dapsonu [57]. Obdobná efektivní odpověď byla potvrzena u bulózních forem SLE, kde je terapie dapsonem doporučována jako léčba 1. linie [9]. Příznivou odpověď můžeme očekávat i u slizničních ulcerací a anulárních lézí SCLE. Trombocytopenie je vážným problémem u nemocných se SLE. Bývá refrakterní k terapii steroidy i ke splenektomii. Nishina et al. prokázali efekt dapsonu v korekci trombocytopenie u SLE pacientů [64]. Dapson není doporučován v terapii DLE, i když prokázal efekt u malé části pacientů podle některých publikovaných prací.
Mycetom
Jde o lokalizovanou kožní infekci (klinická, nikoliv etiologická jednotka) různými mykotickými species nebo aktinomycetami. Infekce často ústí v rozsáhlé poškození kůže, podkožní tkáně a kostí nohou, rukou i dalších částí. Onemocnění se vyskytuje v tropech a subtropech, většinou u bosých zemědělců se sníženými hygienickými nároky. Průběh onemocnění je prolongovaný a výsledky léčby nejsou uspokojivé. Literatura udává více prací s popisem příznivého efektu kombinované terapie dapsonem, antibiotiky a antimykotiky [94].
Panniculitis
V roce 1972 byl popsán nový typ panniculitis, konkrétně lobulární typ spojený s deficitem alpha-1-antitrypsinu. Je děděn jako ZZ genotyp (2 kopie Z alely v 1 buňce) s výskytem asi 1 : 2 500 jedinců. Tato forma panniculitis může statisticky obnášet až 14 % všech onemocnění panniculitis, i když literární popis je vzácný (nedostatek povědomí, poddiagnostikováno), dapson je u této nemoci považován za lék 1. linie pro svůj velmi příznivý efekt [18, 83].
Pemphigoid bullosus
Toto onemocnění není všeobecně považováno jako jednotka odpovídající na terapii sulfonům. Lever popsal minimální nebo žádný efekt u pemfigu a bulózního pemfigoidu ve svých pracích [53]. V roce 1954 při užití sulfapyridinu v terapii 17 ze 38 pacientů s bulózním pemfigoidem došlo k úplné kontrole onemocnění u 4, ke zlepšení stavu u 7 nemocných a beze změny či se zhoršením se vykázalo 6 pacientů [94]. V roce 1972 popsal Honeyman et al. 5 pacientů vykazujících klinická, histopatologická a imunofluorescenční kritéria jak dermatitis herpetiformis, tak typická pro bulózní pemfigoid. Všichni nemocní dobře odpovídali na léčbu dapsonem [32]. O 4 roky později byla zjištěna dramatická odpověď na dapson u 3 nemocných s klasickým bulózním pemfigoidem v průběhu 2 týdnů. Později stejní autoři prokázali další 3 případy bulózního pemfigoidu v dětském věku odpovídající na dapson. Z 84 pacientů s bulózním pemfigoidem léčených na Mayo Clinic v letech 1968–1975 byl 41 podán sulfapyridin nebo dapson. Pouze 6 pacientů vykázalo signifikantní odpověď, 5 z nich vykázalo úplnou kontrolu onemocnění [69]. V otevřené studii Venninga et al. bylo léčeno 18 pacientů s prokázanou diagnózou BP, u 8 pacientů došlo ke kompletní kontrole onemocnění, 6 vykázalo částečné zlepšení [91]. Autoři v závěru doporučili terapii sulfonem buď jako iniciální léčbu, nebo léčbu relapsu, zejména v případech kontraindikace kortikosteroidní léčby. Další studie hodnotící efekt dapsonu jako adjuvantní terapie u nemocných s rekurentním závažným a rezistentním bulózním pemfigoidem z předchozí odpovědí na prednison a azathioprin prokázala po přidání dapsonu do adjuvantní léčby kompletní remisi u 12 pacientů [37]. Závěrem lze tedy říci již to, co naznačil Lever mnohem dříve, že sulfony mohou mít určitý efekt u některých nemocných s BP, nicméně lékem volby zůstávají kortikosteroidy. To ostatně bylo vysloveno v závěru retrospektivní studie 36 pacientů s BP léčených monoterapií dapsonem a lokálními steroidy či dapsonem a systémovou aplikací steroidů [94].
Pemfigoid – jizvící slizniční typ
Jde o chronické a progredující onemocnění, u kterého původní název „benigní“ slizniční pemfigoid není zcela na místě. Nedochází ke spontánní remisi a jizvící změny vážným způsobem zasahují oční systém. Terapie se odvíjí od rozsahu onemocnění, závažnosti a postižení orgánových systémů. Systémová terapie je nutná u rozsáhlého postižení sliznice dutiny ústní a u očního postižení. Dapson může být jednou ze zvažovaných terapeutických variant u pacientů, kteří špatně odpovídají na léčbu kortikoidy. I v tomto případě se objevily zprávy o užití léku v terapii této klinické jednotky. Více jak 83 % pacientů ze 24 sledovaných nemocných vykázalo částečnou nebo úplnou kontrolu onemocnění. U 4 nemocných byla terapie přerušena z důvodů manifestace nežádoucích účinků a další 2 pacienti nevykázali odpověď na terapii. Autoři Rogers et al. uzavírají možnost přiřazení této jednotky k dapson-senzitivním onemocněním [77]. V dalším sledování 105 nemocných s očním pemfigoidem léčených 3 různými chemoterapeutiky byla provedena srovnávací analýza dlouhodobého efektu a manifestace nežádoucích účinků. Iniciálně podaný dapson nepřinesl dobrou odpověď u 2 % nemocných, zatímco terapie cyklofosfamidem selhala u 8 % a léčba azathioprinem u 9 % nemocných. V dlouhodobé studii sledující výsledky a monitorující 104 nemocných (průměrně 4 roky) s oční formou jizvícího pemfigoidu byl dapson nasazen jako lék 1. linie s následným přidáním cyklofosfamidu či azathioprinu u pacientů s nedostatečným efektem dapsonu. Příznivě reagovala asi jedna třetina nemocných bez vývoje zánětlivých změn po ukončení terapie. Další jedna třetina nevykázala aktivitu onemocnění, ale bylo třeba v terapii pokračovat. Zbývající třetina nemocných reagovala na terapii pouze částečným zlepšením [20]. Studie Mobiniho et al. sledovala 29 nemocných s postižením pouze sliznice dutiny ústní. U 14 nemocných s rozsáhlým nálezem byla k lokální terapii přidána systémová forma léčby, z toho u 7 pouze za užití dapsonu. Klinický průběh u pacientů s přidanou léčbou dapsonem byl obdobný jako u nemocných s minimálními projevy onemocnění [60]. Řada expertů obhajuje dapson v terapii jizvícího pemfigoidu jako léku 1. linie v případech, kdy lokální léčba není provázena uspokojujícím výsledkem. Pro závažné případy s postižením očí, jícnu a laryngu by měl být indikován cyklofosfamid.
Pemfigus (včetně pemphigus herpetiformis
a IgA pemfigu)Lékem volby v terapii onemocnění skupiny pemfigu jsou systémově podávané kortikoidy. Po zavedení tohoto způsobu léčby došlo k dramatickému zlepšení odpovědí na léčbu a k poklesu mortality. Nicméně i přes zlepšení prognózy onemocnění se mortalita pohybuje okolo 25 % díky manifestaci nežádoucích účinků této terapie. Efekt dapsonu v léčbě onemocnění pemfigu byl opakovaně v literatuře popsán. Šlo zejména o nasazení dapsonu v kombinaci se steroidy, a to především u juvenilních forem pemfigu [6, 59]. Z českých autorů publikovala Cetkovská případ úspěšné terapie dětské formy pemfigu sulfony v roce 2003 [11]. Onemocnění skupiny pemfigu tak nejsou považována za onemocnění dobře odpovídající na terapii dapsonem a tento lék není doporučován. V in vitro experimentech neprokázal dapson inhibici akantolýzy lidských keratinocytů kultivovaných s pemfigovými protilátkami [38] a nevykázal redukci produkce aktivátoru plazminogenu na rozdíl od steroidů [29].
Samostatnou kapitolu vykazuje pemfigus herpetiformis. Jde o jednotku popsanou v roce 1975 Jablonskou et al. Nicméně již v roce 1955 byli Flodenem a Gentalem popsáni pacienti s obdobným klinickým fenotypem pod označením dermatitis herpetiformis s akantolýzou [94]. Pemphigus herpetiformis kombinuje klinické vlastnosti dermatitis herpetiformis s imunologickými a histologickými charakteristikami pemfigu. Dapson je lékem volby v léčbě tohoto onemocnění v dávkách od 100 do 300 mg denně [58]. Odpověď na léčbu dapsonem je u některých pacientů stejně tak dramatická jako u dermatitis herpetiformis. Nemocní s nízkou hladinou titrů protilátek, s negativitou v průkazu cirkulujících protilátek nebo jedinci s přítomnou eozinofilní spongiózou nejlépe odpovídají na tuto formu terapie. Terapie je indikována jako monoterapie nebo v kombinaci se systémovým podáním kortikoidů a imunosupresiv.
IgA pemfigus je relativně nově charakterizovaná skupina autoimunitních intraepidermálních puchýřnatých dermatóz s výsevem vezikulopustulózních lézí, neutrofilní infiltrací, akantolýzou a in vivo zjišťovanými navázanými a cirkulujícími IgA autoprotilátkami, jejichž cílem jsou povrchové buněčné komponenty epidermis [4]. Existují dva rozdílné typy IgA pemfigu: typ subkorneální pustulózní dermatózy (SPD) a intraepidermální neutrofilní typ (IEN, 63). Oba typy vykazují v klinickém obraze plihé puchýřky nebo pustuly sedící jak na erytematózní, tak na normální kůži. Významným symptomem, který ovlivňuje kvalitu života a denní aktivity pacientů, je pruritus. Dapson je lékem volby v léčbě IgA pemfigu [98]. Cetkovská et al. publikovali případ úspešné léčby pemfigu s IgA a IgG protilátkovou aktivitou asociovaného s karcinomem plic [10]. Alternativně u nemocných s horší tolerancí dapsonu nebo při nedostatečném efektu lze nasadit systémovou či lokální terapii kortikoidy, PUVA, retinoidy nebo kombinaci těchto terapií.
Prurigo pigmentosa
Dapson je u výše uvedeného onemocnění považován za lék volby [96].
Pyoderma gangrenosum
Již dlouho není toto onemocnění považováno za infekční jednotku, nicméně v minulosti se objevily četné pokusy o léčbu antimikrobiálními léky, které vykázaly úspěch [94]. Účinek je zcela jistě vztažen spíše k protizánětlivým imunomodulačním účinkům těchto léků. Tak byl např. užit sulfasalazine (sulfonamid) již v roce 1957 [94]. Následně byl testován sulfapyridine s určitým úspěchem u některých případů pyoderma gangrenosum [94]. První případ úspěšné léčby pyoderma gangrenosum dapsonem se objevil v roce 1962 [94], což bylo následně potvrzeno řadou autorů popisujících efekt monoterapie dapsonem či kombinované terapie s kortikoidy aplikovanými per os, i. v. nebo intralezionálně [94]. Nicméně existuje velmi málo záznamů o efektu dapsonu v léčbě pyoderma gangrenosum a většina popisuje jednotlivé případy nebo omezené série maximálně 4 nemocných. To může být dáno vzácností onemocnění (3 případy/1 mil. obyvatel/rok). Skutečná příčina bude ovšem spíše v nepříliš pozitivních odpovědích na tuto formu terapie. Dapson není tedy doporučován v terapii tohoto onemocnění. U maligní pyodermie popsané v roce 1968 a odpovídající na kortikoidní terapii může být dapson podán v kombinaci s nimi [19].
Subkorneální pustulózní dermatóza
(Sneddonova-Wilkinsonova choroba)Tato jednotka byla původně popsána výše uvedenými autory v roce 1956, kdy byla odlišena od jiných pustulózních a puchýřnatých erupcí [94]. Od té doby došlo k literárnímu popisu řady pacientů, které vyčlenily tuto jednotku jako vlastní morfologickou entitu rozdílnou od jiných pustulózních a puchýřnatých onemocnění. Lékem volby u tohoto onemocnění je dapson v dávkách 50 až 100 mg denně a ačkoliv je odpověď pomalejší než u dermatitis herpetiformis, dojde u většiny pacientů přinejmenším k částečnému, ne-li úplnému, odhojení. Na rozdíl od dermatitis herpetiformis může být léčba zastavena bez relapsů. V roce 1992 byl publikován přehled 29 nemocných s intraepidermálními IgA depozitity a klinickými a histologickými charakteristikami Sneddonovy-Wilkinsonovy choroby. Dapson byl užit jako prvoliniová terapie u 23 pacientů a vykázal efekt s dramatickým a dlouhotrvajícím zlepšením u 16 nemocných [93]. Onemocnění, které připomíná Sneddonovu-Wilkinsonovu chorobu, je pustulózní psoriáza. Většina autorů vyjadřuje přesvědčení, že selhání psoriasis pustulosa na terapii sulfony (na rozdíl od Sneddonovy-Wilkinsonovy choroby), je jedním z nejspolehlivějších kritérií odlišení obou jednotek [95].
Sweetův syndrom – akutní febrilní neutrofilní
dermatózaSweetův syndrom – akutní febrilní neutrofilní dermatóza je multisystémové zánětlivé onemocnění typické svými bolestivými erytematózními plakami a aseptickou neutrofilní infiltrací různých orgánů. Kožní biopsie vykazuje infiltraci dermis neutrofily v nepřítomnosti vaskulitidy. Odpovídá na systémovou terapii kortikoidy. Může dojít i k postižení CNS s nejrůznějšími symptomy podle lokalizace postižení CNS. Neurologická varianta je asociována s přítomností HLA Cw1 antigenu a postihuje obě pohlaví ve věkových skupinách 30–70 let. Některé případy idiopatické meningoencefalitidy mohou být ve skutečnosti neurologickou manifestací Sweetova syndromu. Úspěch v terapii kortikoid-dependentní neurologické formy Sweetova syndromu byl popsán v literatuře [97].
Syndrom urticaria vasculitis
Jde o zvláštní klinicko-patologickou jednotku charakterizovanou purpurickými urtikariálními pupeny a histologicky vykazující kritéria leukocytoklastické vaskulitidy. Reprezentuje systémové onemocnění s postižením mnoha orgánů, zvláště kloubů, plic a ledvin. Většina případů je spojována se základním onemocněním, jako jsou polékové reakce, choroby pojivové tkáně, infekce nebo maligní tumory. V těchto případech je primárním principem terapie odstranění stimulu. Léčba idiopatických případů, označovaných jako primární urticaria vasculitis syndrom, je obtížná. Dapson v monoterapii nebo v kombinaci s dalšími léčivy je jednou z četných léčebných variant zkoušených u tohoto onemocnění. U většiny publikovaných případů vykázal efekt [67]. Wolf et al. se domnívají, že nasazení dapsonu má význam u refrakterních rezistentních případů onemocnění.
Vasculitis leucocytoclastica
Efekt dapsonu je rozpoznán již dlouhodobě, ačkoliv existuje pouze malý počet studií o efektivitě léku u tohoto onemocnění. Nepředvídatelný a měnící se průběh onemocnění ve své obvyklé formě vede k obtížím při určení efektu jakéhokoliv terapeutického léčiva. Je zapotřebí rozšířených kontrolovaných randomizovaných studií k objektivnímu posouzení efektu dapsonu u této jednotky. Na druhé straně právě na základě současných znalostí nelze jednoznačně tuto terapii odmítnout, neboť může vykázat efekt u vybraných skupin pacientů [94].
Non-dermatologické klinické jednotky
AIDS s pneumonií P. jiroveci a s toxoplasmózou
Dapson je nasazován v primární profylaxi a prevenci [97].
Astma bronchiale kortizon - dependentní
Společné podání s dapsonem dovolilo v klinickém sledování snížení nutné dávky kortikoidů ke kontrole onemocnění [97].
Eozinofilní fasciitidy/Eozinofilní folliculitis Ofuji
Terapie dapsonem je doporučována ve formě adjuvantní terapie u eozinofilní folikulitidy., nicméně přesvědčivé výsledky prokázalo nasazení dapsonu i u eozinofilní fasciitidy [85].
Glioblastom, záchvatovité stavy (zvířecí modely)
Terapie dapsonem byla testována i u výše uvedených onemocnění s určitým efektem [97].
Chronická idiopathická urticaria/pozdní tlaková
urticariaU těchto onemocnění je dapson doporučen v adjuvantní terapii [97].
Kousnutí pavoukem koutníkem obecným
Kousnutí pavoukem se liší v závažnosti od minimálních reakcí až ke kožním nekrózám v celém rozsahu kůže a/nebo k závažným systémovým symptomům vedoucím ke smrti. Ačkoliv není většina kousnutí vážná a stav se odhojí bez zvláštních intervencí, vyžadují závažné reakce hospitalizace a léčbu. Léčba kousnutí pavoukem je značně rozdílná a velmi kontroverzní. První dokumentované případy kousnutí pavoukem koutníkem obecným v Severní americe pocházejí z roku 1929 [94]. Současné terapie, jako je užití kortikoidů (systémově nebo intralezionálně), antibiotik, antihistaminik, chirurgických přístupů, heparinu, NSAIDs a hyperbarické oxygenoterapie nevykazují mimořádně vyšší efektivitu v prevenci nekrózy a vzniku ulcerací. Fakt, že dapson inhibuje funkci polymorfonukleárů, což bývá efektivní u neutrofilních dermatóz, a dále fakt, že polymorfonukleáry hrají dominantní roli ve vzniku pavoukem indukované nekrózy, vedl některé výzkumníky k pokusům o léčbu dapsonem. V roce 1983 byl popsán prvý úspěšný případ nasazení dapsonu u kousnutí koutníkem obecným. Léčba spočívala v elevaci postižené končetiny, přikládání ledu, nasazení dapsonu 2krát 100 mg per os denně. Velmi brzo došlo k úlevě od bolesti i k redukci erytému a indurace. Ke kompletnímu odhojení došlo po 14 dnech terapie dapsonem. Efekt dapsonu byl potvrzen i ve zvířecích modelech a poté studován v klinických a experimentálních studiích [94]. Byla provedena i randomizovaná, zaslepená kontrolovaná studie efektu hyperbarického kyslíku, dapsonu a cyproheptadinu u zvířat s negativním závěrem o účinnosti. Tato studie ovšem využila jed jiného pavoučího druhu. Další zvířecí studie se zabývala efektem dapsonu a elektrošokové terapie ve srovnání s placebem na velikosti lézí indukovaných intradermální aplikací pavoučího jedu u morčat. Dapson vykázal signifikantně menší induraci a nekrózu než ostatní srovnávané typy léčby. Konečně, jiné studie doporučují kombinovanou léčbu dapsonem a protijedem v ovlivnění změn po kousnutí pavoukem (zejména zánětlivá odpověď byla výrazně lepší). Byly provedeny i studie srovnávající účinek dapsonu a antidota při kousnutí koutníkem obecným ve srovnání s kombinovanou terapií. U všech léčených pacientů byla navíc přidána terapie erythromycinem. S výjimkou dvou pacientů s velmi závažnými lézemi (celkově 95 nemocných) došlo u všech zbývajících pacientů k odhojení v průměru 20 dnů. V závěru ovšem nevyplývá jednoznačná superiorita rozdílných forem terapie ani srovnání výsledku s obdobnými studiemi. V souhrnu lze konstatovat, že některé experimentální studie i klinická sledování vykázaly prospěšný efekt dapsonu v redukci závažnosti lokálních a systémových reakcí na pavoučí kousnutí, snížení počtu komplikací a zlepšení pacientova výsledného stavu. Dojde-li k vývoji nekrózy nebo systémových reakcí, pak většina autorů doporučuje časnou terapii dapsonem [94].
Relapsující polychondritida
Tato jednotka byla poprvé popsána v roce 1923 a je definována jako vzácné onemocnění. Pravděpodobně autoimunitní etiologie, manifestující se recidivami progresivního zánětu a destrukce chrupavčité tkáně. Multisystémové onemocnění může vykázat závažné následky: může způsobit deformity v oblasti obličeje v návaznosti na destrukci chrupavčité tkáně nosu a uší; může vést ke slepotě a konečně vykazuje až u čtvrtiny postižených pacientů fatální průběh [94]. Do roku 1976 byla doporučována terapie steroidy systémově. Ve výše uvedeném roce byly publikovány 2 články popisující efekt dapsonu v jejich terapii [56]. Od té doby se objevily další práce potvrzující příznivý efekt dapsonu v terapii tohoto onemocnění [94]. Na straně druhé se ovšem objevily i práce popírající tento příznivý efekt. Nízká incidence a prevalence onemocnění, rozličnost klinického obrazu a nepředvídatelné recidivy jsou faktory, které by vyžadovaly randomizované kontrolní terapeutické studie, kritické zhodnocení efektu dapsonu a zavedení standardizovaného terapeutického protokolu. Ačkoliv nebyla dosud zavedena ideální léčba tohoto onemocnění, dostupné důkazy indikují, že dapson a/nebo systémově podané kortikoidy jsou nejvíce efektivní terapie. Dapson je doporučován spíše jako adjuvantní terapeutická modalita.
Revmatoidní artritida
Dapson v monoterapii byl srovnáván s antimalariky (hydroxychloroquine) a s kombinací obou typů léků. Efekt byl srovnatelný [97].
Imunitní trombocytopenie
Nasazení dapsonu bylo indikováno v refrakterních případech na standardní terapii [97] a vykázalo efekt jak u dospělých, tak v dětské populaci.
Schválené i neschválené indikace dapsonu v souhrnu představuje tabulka 3.
Tab. 3. Neschválené indikace pro užití dapsonu [94] ![Neschválené indikace pro užití dapsonu [94]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/27ba32044be8341e87fc263659aafb14.png)
KLÍČOVÉ POZNATKY PRO TERAPII PACIENTŮ DAPSONEM – SHRNUTÍ
Kontraindikace, monitorování základní a follow-up pacientů
Lék je kontraindikován u nemocných s alergií na účinnou látku, neměl by být indikován ani nemocným s těžkými formami anémie. U následujících stavů musí být podávání dapsonu velmi pečlivě monitorováno:
- Deficit glukózo-6-fosfát dehydrogenázy (G-6-PD)
- Deficit methemoglobin-reduktázy
- Závažné hepatopatie
- Kardiální insuficience/srdeční selhávání
- Plicní onemocnění
- Současné podávání léku zvyšující hladinu methemoglobinu
Před zahájením terapie musí předcházet pečlivé klinické vyhodnocení pacienta s úplnou anamnézou a fyzikálním vyšetřením. Rutinní laboratorní testy shrnuje tabulka 4 [97]. Kontrolní vyšetření by měla postihnout všechny možné nežádoucí účinky včetně cílených dotazů na známky neuropatie. Laboratorní testy pak vyžadují kompletní krevní obraz s diferenciálním krevním obrazem a počtem retikulocytů nejméně každé 2 týdny po dobu prvních 3–6 měsíců, následně pak každé 2–4 měsíce. V prvních 3–6 měsících se doporučují kontroly jaterních a renálních funkcí a vyšetření moči v měsíčních intervalech, dále pak každé 2–4 měsíce. Zvláštní pozornost zasluhují pacienti léčení léky schopnými indukovat vznik methemoglobinu nebo hemolýzy. U nemocných s preexistující anémií by mělo být provedeno pečlivé vyšetření a vyjasnění stavu hematologem. V léčbě pacientů dapsonem neexistuje hraniční omezení hemoglobinu. Započetí léčby je založeno na širokém počtu individuálních faktorů, např. věk, typ povolání, užívaná medikace, denní aktivity, preexistující a/nebo srdeční onemocnění. Po zahájení léčby dapsonem je nutné pravidelně kontrolovat hladinu methemoglobinu. V tomto ohledu hrají relevantní roli různá fakta:
- Vznik methemoglobinu po jednorázovém podání dávky dapsonu dosahuje svého maxima asi po 6 hodinách. V časné fázi léčby by měla být hladina methemoglobinu určena 4–6 hodin po podání léku, poněvadž maximální hladiny methemoglobinu v periferní krvi indikují skutečná kardiopulmonární rizika. Z těchto důvodů se doporučuje podání v nočních hodinách u nemocných aktivních během dne.
- Asi 14 dnů po zahájení léčby určí výsledek hladin methemoglobinu další podmínky podávání a dovolí též zhodnocení adherence pacienta na terapii.
- Další určení hladin methemoglobinu má být zváženo při jakékoliv změně stavu pacienta, např. zvýšení dávky dapsonu, klinických obtížích, současném podávání jiných léků, počátku kouření a užití vody ze zdrojů v zemědělských oblastech s potencionálním obsahem nitrátů/anilinů. Hladiny methemoglobinu nemusí být kontrolovány pravidelně, nedochází-li ke změnám klinického stavu pacienta.
Tab. 4. Laboratorní vyšetření před zahájením terapie dapsonem [97] ![Laboratorní vyšetření před zahájením terapie
dapsonem [97]](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/6f633ab4f0ca65be21d08f959755f9c4.png)
Strategie ke snížení rizika hematologických nežádoucích účinků
N-hydroxylace dapsonu cestou 3A rodiny izoenzymů nebo cestou CYP 2E1 jaterního systému jaterního cytochromu P-450 vede ke vzniku DDS-NOH, jenž je zodpovědný za hematologické nežádoucí účinky. Na tomto základě byla věnována značná pozornost úsilí o zvýšení tolerance k dapsonu. Inhibitory cytochromu P-450, jako jsou ketokonazol a cimetidine, redukují tvorbu methemoglobinu asociovanou s podáním dapsonu. Současné podávání cimetidinu v dávkách 3krát 400 mg/den redukuje hladiny methemoglobinu o 25–30 % in vivo, přičemž se tento efekt překvapivě snižuje po 3 měsících. Coleman doporučoval rutinně podání cimetidinu u vysokých dávek dapsonu (200 mg/den a více) [14]. Musíme však vzít nicméně v úvahu, že DDS-NOH vykazuje sám o sobě protizánětlivé efekty. Teoreticky tedy může potlačení jeho produkce snížit terapeutické efekty mateřské sloučeniny dapsonu. Tuto otázku nestudovali žádní autoři. Jiné strategie, např. užití různých antioxidantů jako kyseliny askorbové a vitaminu E, byly sledovány různými autory. Ani podání kyseliny askorbové v dávce 1 g/den, ani vitaminu E v dávce 800 mg/den nevykázalo významný efekt na hemolýzu indukovanou dapsonem [73]. Inhibiční efekt vykázala pouze současná aplikace obou uvedených sloučenin. Důvody těchto kontroverzních výsledků mohou být přičteny designu studií, které neodpovídaly v době svého provádění parametrům dobré klinické praxe (Good Clinical Practice – GCP, prováděny byly bez randomizace, zaslepení a kontrol placebem). V běžné praxi a v případech výrazných hematologických nežádoucích efektů může být podávání cimetidinu doporučeno v prvních týdnech terapie, nejsou-li dostupné jiné alternativní léčebné modality.
Možná hrozící rizika – současné užití anestetik lokálně
Fakt, že jiné současné medikace indukující vznik methemoglobinu (jako podání fenacetinu a sulfonamidů) představuje u pacientů s nasazeným dapsonem riziko, je dobře znám. Nicméně velmi často se nedbá na rizika spojovaná se současnou aplikací lokálních anestetik, jako je benzokain nebo lidokain. Byly publikovány případy, kde lokální aplikace anestetik amidového nebo esterového typu ve formě spreje nebo krému, vyústily ve vážnou methemoglobinémii manifestující se během chirurgických výkonů. Z těchto důvodů se doporučuje vlastnictví tzv. „Dapson pasu“, který nemocní v terapii dapsonem vždy předkládají svým lékařům. V případech plánovaných chirurgických výkonů se pak dapson vysazuje několik dnů před výkonem. Navíc se doporučuje určení hladiny methemoglobinu těsně před výkonem.
Fotoprotekce
Dapson je schopen suprese UV indukovaného erytému při orální i lokální aplikaci [97]. Nicméně nelze zcela vyloučit ani alergickou fotosenzitivitu na dapson (extrémně vzácná, popsáno cca 20 případů). Za alergickou reakci jsou zodpovědné sulfonové skupiny mateřské sloučeniny a metabolity dapsonu [87]. Při vědomí supresivního efektu dapsonu na UV indukovaný erytém je vhodné varovat přinejmenším pacienty kožního fototypu I před možností zvýšené fotosenzitivity po zastavení terapie dapsonem.
Zkřížená alergie dapson-sulfonamidy
Existují různé důkazy předpokládající, že obvykle nedochází ke zkřížené reaktivitě mezi sulfonamidy a dalšími léky obsahujícími sulfonamidy neantibiotického charakteru včetně dapsonu. Podle schvalovacího protokolu FDA neznamená alergie na sulfonamidy kontraindikaci k užití dapsonu. Absence zkřížené reaktivity mezi dapsonem a sulfonamidy byla potvrzena a připsána různým chemickým strukturám těchto dvou léků.
Gravidita
Zvířecí reprodukční studie s užitím dapsonu nebyly prováděny. Dapson byl testován u krys a králíků v koncentracích 500–800krát vyšších než terapeutické hladiny v referenci k AUC hodnotám (Area Under the Curve, plocha pod koncentrační křivkou léčiva, sekundární farmakokinetický parametr) pacientek v terapii 5% dapson gelem. V těchto studiích byl dapson spojován s embryocidními efekty. Nicméně neexistuje dokumentovaný škodlivý efekt dapsonu při užití v těhotenství [47]. Publikace týkající se užití dapsonu v léčbě lepry předpokládají bezpečné užití dapsonu v graviditě. Četné další zprávy o užití dapsonu u řady jiných onemocnění podporují tento předpoklad. V každém případě musí být riziko nepodání dapsonu indikovaným matkám zváženo s rizikem týkajícím se plodu. Podle FDA je dapson označen jako lék těhotenství v kategorii C. Pacienti by měli být informováni o nedostatku potvrzených dat.
ZÁVĚR
Dapson byl nejčastěji studován in vitro metodami za striktně definovaných experimentálních podmínek. Výsledky těchto experimentů dokreslují obraz možného mechanismu účinku léku. K dispozici je i celá řada dat získaných in vivo studiemi u lidí s tzv. dapson-senzitivními onemocněními. I přes veškeré pokroky jsme stále daleko od pochopení dapsonu se všemi, zčásti kontroverzními tvářemi při nasazení léku u většiny neinfekčních onemocnění. S ohledem na pochopení mechanismu účinku dapsonu tedy zbývá řada otázek:
- V letech minulých došlo k pokroku ve vývoji molekulárních metod, které významně vedly k novým náhledům na mechanismy účinků imunosupresivních a/nebo imunomodulujících léčiv včetně tzv. biologických léků. Obdobná vyšetření by měla být v koncentracích srovnatelných s terapeutickými podmínkami provedena u dapsonu ke zjištění dalších, detailnějších poznatků o mechanismu účinku (farmakogenetika).
- Většina experimentálních a klinických studií byla prováděna s „mateřskou“ sloučeninou dapsonu. Relevance metabolitů dapsonu není dosud dostatečně objasněna. Moderní, molekulárně cílené analýzy mohou napomoci v odstranění těchto nedostatků.
- Experimentální klíče k preventivnímu efektu dapsonu na neurotoxicitu vyžaduje detailní vyjasnění, poněvadž navrhované mechanismy poskytují prostor ke spekulacím.
- Pozorování pozitivního efektu dapsonu na model životního cyklu háďátka obecného přináší další otázky týkající se inhibičního účinku na stárnutí sulfonem v savčích buňkách a v organismu.
- Konečně lze říci, že dapson vykázal „renesanční“ efekt jako referenční molekula organické chemie, protože existuje úsilí k přípravě syntézy biologicky aktivních analogů dapsonu jako např. sulfoximinu [2, 5, 34, 68]. V tomto ohledu vykazuje v současnosti zvláštní zájem definice protinádorové aktivity dapsonu.
I přes četné nezodpovězené otázky zůstává dapson nepostradatelným lékem dermatologie a z výzkumného hlediska fascinujícím lékem. Vývoj molekuly obdobné dapsonu, prokazující pozitivní léčebný efekt za absence nežádoucích účinků, se tedy jeví jako nejvýše žádoucí.
Do redakce došlo dne 12. 7. 2017
Adresa pro korespondenci:
doc. MUDr. Miloslav Salavec, CSc.
Klinika nemocí kožních a pohlavních FN a LF UK
Sokolská 581
500 05 Hradec Králové
e-mail: salavecm@post.cz
Zdroje
1. ABE, M., SHIMIZU, A., YOKOYAMA, Y. et al. A possible inhibitory action of diaminodiphenyl sulfone on tumour necrosis factor-alpha production from activated mononuclear cells on cutaneous lupus erythematosus. Clin. Exp. Dermatol., 2008, 33, p. 759–763.
2. AL-SAID, M. S., GHORAB, M. M., NISSAN, Y. M. Dapson heterocytic chemistry, part VIII: synthesis, molecular docking and anticancer activity of some novel sulfonylbiscompounds carrying biologically active 1,3-dihydropyridine, chromene and chromenopyridine moieties. Chem. Cent. J., 2012, 6, 64.
3. ANDERSON, R., GATNER, E. M., VAN RENSBURG, C. E. et al. In vitro and in vivo effects of dapson on neutrophil and lymphocyte functions in normal individuals and patients with lepromatous leprosy. Anitmicrob. Agents Chemother., 1981, 19, p. 495–503.
4. BEUTNER, E., CHORZELSKI, T., WILSON, R. et al. IgA pemphigus foliaceus. J. Am. Acad. Dermatol., 1989, 20, p. 89–97.
5. BISSINGER, E. M., HEINKE, R., SPANNHOFF, A. et al. Acyl derivatives of p-aminosulfonamides and dapson as new inhibitors of the arginine methyltransferase hPRMT1. Bioorg. Med. Chem., 2011, 29, p. 3717–3731.
6. BJARNASON, B., SKOGLUND, C., FLOSADOTTIR, E. Childhood pemphigus vulgaris treated with dapson: a case report. Pediatr. Dermatol., 1998, 15, p. 381–383.
7. BOOTH, S. A., MOODY, C. E., DAHL, M. V. et al. Dapson suppresses integrin-mediated neutrophil adherence function. J. Invest. Dermatol., 1992, 98, p. 135–140.
8. BOZEMAN, P. M., LEARN, D. B., THOMAS, E. L. Inhibition of the human leukocyte enzymes myeloperoxidase and eosinophil peroxidase by dapson. Biochem. Pharmacol., 1992, 44, p. 553–563.
9. BURROWS, M., BHOGAL, B., BLACK, M. et al. Bullous eruption of systemic lupus erythematosus: a clinicopathological study of four cases. Br. J. Dermatol., 1993, 128, p. 332–338.
10. CETKOVSKÁ, P., KOMOROUSOVÁ, M., LOMICOVÁ, I. Management of a pemphigus with IgA and IgG antibodies and coexistent lung cancer. Dermatol. Ther., 2014, 27, 4, p. 236–239.
11. CETKOVSKA, P., PIZINGER, K. Childhood pemphigus associated with montelukast administration. Clin. Exp. Dermatol., 2003, 28, 3, p. 328–329.
12. COHEN, D. M., BEN-AMITAI, D., FEINMESSER, M. et al. Childhood lichen planus pemphigoides: a case report and review of the literature. Pediatr. Dermatol., 2009, 26, p. 569–574.
13. COHEN, P. R. Neutrophilic dermatoses: a review of current treatment options. Am. J. Clin. Dermatol., 2009, 10, p. 301–312.
14. COLEMAN, M. D. Dapson-mediated agranulocytosis: risks, possible mechanisms and prevention. Toxicology, 2001, 162, p. 53–60.
15. DE HAAS, E., DE WIT, R., VAN VOLTEN, W. Non-HIV-related Kaposi’s sarcoma suppressed by dapson. Br. J. Dermatol., 1996, 135, p. 813–814.
16. DIAZ-RUIZ, A., ZAVALA, C., MONTES, S. et al. Antioxidant, anti-inflammatory and antiapoptotic effects of dapson in a model of brain ischemia/reperfusion in rats. J. Neurosci. Res., 2008, 86, p. 3410–3419.
17. DRAYER, D. E., STRONG, J. M., JONES, B. et al. In vitro acetylation of drugs by human blood cells. Drug. Metab. Dispos., 1974, 2, p. 499–505.
18. EDMONDS, B., HODGE, J., RIETSCHEL, R. Alpha 1-antitrypsin deficiency-associated panniculitis: case report and review of the literature. Pediatr. Dermatol., 1991, 8, p. 296–299.
19. ERDI, H., ANADOLU, R., PISKIN, G. et al. Malignant pyoderma: a clinical variant of pyoderma gangrenosum. Int. J. Dermatol., 1996, 35, p. 811–813.
20. FOSTER, C., NEUMANN, R., TAUBER, J. Long term results of systemic chemotherapy for ocular cicatricial pemphigoid. Doc. Ophthalmol., 1992, 82, p. 223–229.
21. FRÄKI, J. E., HOPSU-HAVU, V. K. Inhibition of human skin proteinases by chloroquine, dapson and sulfapyridine. Arch. Dermatol. Res., 1977, 259, p. 113–115.
22. FRY, L. Dermatitis herpetiformis: problems, progress and prospects. Eur. J. Dermatol., 2002, 12, 6, p. 520–531.
23. FRY, L. Fine points in the management of dermatitis herpetiformis. Semin. Dermatol., 1988, 7, p. 206–211.
24. GHATE, J., JORIZZO, J. Behcet’s disease and complex aphthosis. J. Am. Acad. Dermatol., 1999, 40, p. 1–18.
25. GRABBE, J., HAAS, N., MÖLLER, A. et al. Erythema elevatum diutinum – evidence for disease-dependent leucocyte alterations and response to dapson. Br. J. Dermatol., 2000, 143, p. 415–420.
26. GÜRCAN, H. M., AHMED, A. R. Efficacy of dapson in the treatment of pemphigus and pemphigoid: analysis of current data. Am. J. Clin. Dermatol., 2009, 10, p. 383–396.
27. HAMADA, K., HIYOSHI, T., KOBAYASHI, S. et al. Anticonvulsive effect of dapson (4,4'-diaminodiphenyl sulfone) on amygdala-kindled seizures in rats and cats. Epilepsy Res., 1991, 10, p. 93–102.
28. HARGRAVE, D. Paediatric high and low grade glioma: the impact of tumour biology on current and future therapy. Br. J. Neurosurg., 2009, 23, p. 351–363.
29. HASHIMOTO, K., SINGER, K., LAZARUS, G. The effect of corticosteroids, dapson and gold on plasminogen activator synthesis and secretion by human epidermal cells cultured with pemphigus antibody. Br. J. Dermatol., 1984, 110, p. 297.
30. HEGARTY, A. M., ORMOND, M., SWEENEY, M. et al. Dapson efficacy and adverse events in the management of mucous membrane pemphigoid. Eur. J. Dermatol., 2010, 20, p. 223–224.
31. HOMEIDA, M., BABIKR, A., DANESHMEND, T. K. Dapson-induced optic atrophy and motor neuropathy. Br. Med. J., 1980, 281, p. 1180.
32. HONEYMAN, J., HONEYMAN, A., LOBITZ, W. et al. The enigma of bullous pemphigoid and dermatitis herpetiformis. Arch. Dermatol., 1972, 106, p. 22–25.
33. HRUZA, G., FRIEDMAN-KIEN, A., LAUBENSTEIN, L. et al. Dapson for AIDS-associated Kaposi’s sarcoma [letter]. Lancet, 1985, 1, p. 642.
34. CHEN, X. Y., BUSCHMANN, H., BOLM, C. Sulfoximine - and sulfilimine-based DAPSON analogs: syntheses and bioactivities. Synlett, 2012, 23, p. 2808–2810.
35. ISHIDA, S., HAMADA, K., YAGI, K. et al. Comparing the anticonvulsive effects of dapson on amygdala-kindled seizures and hippocampal-kindled seizures in rats. Acta Neurol. Scand., 1992, 85, p. 132–135.
36. JACYK, W. Behcet’s disease in South African blacks: report of five cases. J. Am. Acad. Dermatol., 1994, 30, p. 869–873.
37. JEFFES, E., AHMED, A. Adjuvant therapy of bullous pemphigoid with dapson. Clin. Exp. Dermatol., 1989, 14, p. 132–136.
38. JEFFES, E. W., KAPLAN, R., AHMED, A. Acantholysis produced in vitro with pemphigus serum: hydrocortisone inhibits acantholysis, while dapson and 6-mercaptopurine do not inhibit acantholysis. J. Clin. Immunol., 1984, 4, p. 359–363.
39. KAMINSKY, C., KAMINSKY, A., SCHICCI, C. et al. Acne: Treatment with diaminodiphenylsulfone. Cutis, 1974, 13, p. 869–871.
40. KAR, B. R. Dapson-induced photosensitivity: a rare clinical presentation. Photodermatol. Photoimmunol. Photomed., 2008, 24, p. 270–271.
41. KASPERKIEWICZ, M., ZILLIKENS, D. The pathophysiology of bullous pemphigoid. Clin. Rev. Allergy Immunol., 2007, 33, p. 67–77.
42. KAST, R. E., LEFRANCE, F., KARPEL-MASSLER, G. et al. Why dapson stops seizures and may stop neutrophils’ delivery of VEGF to glioblastoma. Br. J. Neurosurg., 2012, 26, p. 813–817.
43. KAST, R. E., SCHEUERLE, A., WIRTZ, CR. et al. The rationale of targeting neutrophils with dapson during glioblastoma treatment. Anticancer Agents Med. Chem., 2011, 11, p. 756–761.
44. KATZ, S. I., HERTZ, K. C., CRAWFORD, P. S. et al. Effect of sulfones on complement deposition in dermatitis herpetiformis and on complement-mediated guinea-pig reactions. J. Invest. Dermatol., 1976, 67, p. 688–690.
45. KENNER, D. J., HOLT, K., AGNELLO, R. et al. Permanent retinal damage following massive dapson overdose. Br. J. Ophthalmol., 1980, 64, p. 741–744.
46. KHAN, F. D., ROYCHOWDHURY, S., NEMES, R. et al. Effect of pro-inflammatory cytokines on the toxicity of the arylhydroxylamine metabolites of sulphamethoxazole and dapson in normal human keratinocytes. Toxicology, 2006, 218, p. 90–99.
47. KHAN, G. Dapson is safe during pregnancy. J. Am. Acad. Dermatol., 1985, 13, p. 838–839.
48. KNUDSON, R. M., KALAAJI, A. N., BRUCE, A. J. The management of mucous membrane pemphigoid and pemphigus. Dermatol. Ther., 2010, 23, p. 268–280.
49. KUMAR, B., GANGULY, N. K., KAUR, S. et al. Effect of dapson (DDS) on T-cells and their response to PHA and lepromin in tuberculoid leprosy patients. Lepr. India, 1983, 55, p. 465–471.
50. KUMAR, R. H., KUMAR, M. V., THAPPA, D. M. Dapson syndrome – a five year retrospective analysis. Indian J. Lepr., 1998, 70, p. 271–276.
51. LAMMERS, A. M., VAN DE KERKHOF, P. C., SCHALWIJK, J. et al. Elastase, a marker for neutrophils in skin infiltrates. Br. J. Dermatol., 1986, 115, p. 181–186.
52. LANG, P. G. Sulfones and sulfonamides in dermatology today. J. Am. Acad. Dermatol., 1979, 1, p. 479–492.
53. LEVER, W. Pemphigus and pemphigoid. Springfield: Charles C Thomas Publisher, 1965.
54. LORENZ, M., WOZEL, G., SCHMITT, J. Hypersensitivity reactions to dapson: a systematic review. Acta Derm. Venereol., 2012, 92, p. 194–199.
55. MANGELSDORF, H., WHITE, W., JORIZZO, J. Behcet’s disease. Report of twenty-five patients from the United States with prominent mucocutaneous involvement. J. Am. Acad. Dermatol., 1996, 34, p. 745–750.
56. MARTIN, J., ROENIGK, H. J., LYNCH, W. et al. Relapsing polychondritis treated with dapson. Arch. Dermatol., 1976, 112, p. 1272–1274.
57. MATTHEWS, C., SAIHAN, E., WARIN, R. Urticaria-like lesions associated with systemic lupus erythematosus: Response to dapson. Br. J. Dermatol., 1978, 99, p. 555.
58. MCIEJOWSKA, E., JABLONSKA, S., CHORZELSKI, T. Is pemphigus herpetiformis an entity? Int. J. Dermatol., 1987, 26, p. 571–577.
59. MEHRAVARAN, M., MORVAY, M., MOLNAR, K. et al. Juvenile pemphigus foliaceus. Br. J. Dermatol., 1998, 139, p. 496–499.
60. MOBINI, N., NAGARWALLA, N., AHMED, R. Oral pemphigoid. Subset of cicatricial pemphigoid. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endod., 1998, 85, p. 37–43.
61. NICOLAS, MEO., KRAUSE, PR., GIBSON, LE. et al. Dermatitis herpetiformis – Review. Int. J. Dermatol., 2003, 42, p. 588–600.
62. NICHOLAS, M. K., LUKAS, R. V., CHMURA, S. et al. Molecular heterogeneity in glioblastoma: therapeutic opportunities and challenges. Semin. Oncol., 2011, 38, p. 243–253.
63. NIIMI, Y., KAWANA, S., KUSUNOKI, T. IgA pemphigus: A case report and its characteristic clinical features compared with subcorneal pustular dermatosis. J. Am. Acad. Dermatol., 2000, 43, p. 546–549.
64. NISHINA, M., SAITO, E., KINOSHITA, M. Correction of severe leukopenia and thrombocytopenia in systemic lupus erythematosus by treatment with dapson. J. Rheumatol., 1997, 24, p. 811–812.
65. NIWA, Y., MIYACHI, Y. Inhibitor effects of dapson on enzymatic acitivities of membrane phospholipids in human blood cells. Arch. Dermatol. Res., 1985, 277, p. 473–477.
66. NIWA, Y., SAKANE, T., MIYACHI, Y. Dissociation of the inhibitory effect of dapson on the generation of oxygen intermediates – in comparison with that of colchicine and various scavengers. Biochem. Pharmacol., 1984, 33, p. 2355–2360.
67. NURNBERG, W., GRABBE, J., CZARNETZKI, B. Urticarial vasculitis syndrome effectively treated with dapson and pentoxifylline. Acta Derm. Venereol. (Stockh), 1995, 75, p. 54–56.
68. PARK, B. K., BOOBIS, A., CLARKE, S. et al. Managing the challenge of chemically reactive metabolites in drug development. Nat. Rev. Drug Discov., 2011, 10, p. 292–306.
69. PERSON, J., ROGERS, RIII. Bullous pemphigoid responding to sulfapyridine and the sulfones. Arch. Dermatol., 1977, 113, p. 610–615.
70. PIETTE, E. W., WERTH, V. P. Dapson in the management of autoimmune bullous diseases. Dermatol. Clin., 2011, 29, p. 561–564.
71. POULSEN, A., HULTBERG, B., THOMSEN, K. et al. Regression of Kaposi’s sarcoma in AIDS after treatment with dapson [letter]. Lancet, 1984, 1, p. 560.
72. PRONEUF, M., DUTERQUE, M., SOTTO, A. et al. Unusual erythema elevatum diutinum with fibrohistiocytic proliferation. Br. J. Dermatol., 1996, 134, p. 1131–1134.
73. PRUSSICK, R., ALI, M. A., ROSENTHAL, D. et al. The protective effect of vitamin E on the hemolysis associated with dapson treatment in patients with dermatitis herpetiformis. Arch. Dermatol., 1992, 128, p. 210–213.
74. REUNALA, T. Dermatitis herpetiformis. Clinics in Dermatology, 2001, 19, p. 728–736.
75. RIOS, C., NADER-KAWACHI, J., RODRIGUEZ-PAYÁN, A. J. et al. Neuroprotective effect of dapson in an occlusive model of focal ischemia in rats. Brain Res., 2004, 999, p. 212–215.
76. RODRÍGUEZ, E., MÉNDEZ-ARMENTA, M., VILLEDA-HERNÁNDEZ, J. et al. Dapson prevents morphological lesions and lipid peroxidation induced by quinolinic acid in rat corpus striatum. Toxicology, 1999, 139, 111–118.
77. ROGERS, R. S., SEEHAFER, J., PERRY, H. Treatment of cicatricial (benign mucous membrane) pemphigoid with dapson. J. Am. Acad. Dermatol., 1982, 6, p. 215–223.
78. ROSS, C. Treatment of acne vulgaris with dapson. Br. J. Dermatol., 1961, 73, p. 367–370.
79. RUZICKA, T., GOERZ, G. Dapson in the treatment of lupus erythematosus. Br. J. Dermatol., 1981, 104, p. 53–56.
80. RUZICKA, T., WASSERMAN, S. I., SOTER, N. A. et al. Inhibition of rat mast cell arachidonic acid cyclooxygenase by dapson. J. Allergy Clin. Immunol., 1983, 72, p. 365–370.
81. SALAVEC, M. Autoimunitní subepidermální bulózní onemocnění – část II. Ostatní subepidermální puchýřnaté autoimunitní dermatózy – dermatitis herpetiformis, lineární IgA bulózní dermatóza, epidermolysis bullosa acquisita. Referátový výběr z dermatovenerologie, Speciál 1/2013, s. 35–47.
82. SANTAMARIA, A., ORDAZ-MORENO, J., RUBIO-OSORNIO, M. et al. Neuroprotective effect of dapson against quinolinate - and kainate-induced striatal neurotoxicities in rats. Pharmacol. Toxicol., 1997, 81, p. 271–275.
83. SCHADENDORF, D., HAAS, N., NURNBERGER, F. et al. Recurrent nodular panniculitis in alpha 1-antitrypsin deficiency. Successful dapson therapy [letter]. Hautarzt, 1993, 44, p. 653–657.
84. SCHMIDT, E., REIMER, S., KRUSE, N. et al. The IL-8 release from cultured human keratinocytes, mediated by antibodies to bullous pemphigoid autoantigen 180, is inhibited by dapson. Clin. Exp. Immunol., 2001, 124, p. 157–162.
85. SMITH, L. C., COX, N. H. Dapson treatment for eosinophilic fasciitis. Arch. Dermatol., 2008, 144, p. 845–847.
86. ČESKÁ DERMATOVENEROLOGICKÁ SPOLEČNOST, obor Dermatovenerologie. Standard pro dermatitis herpetiformis. Dostupné na www: http://www.lfhk.cuni.cz/dermat/indexcz.htm.
87. STÖCKEL, S., MEURER, M., WOZEL, G. Dapson-induced photodermatitis in a patient with linear IgA dermatosis. Eur. J. Dermatol., 2001, 11, p. 50–53.
88. THOMPSON, D. M., SOUHAMI, R. Suppression of the arthus reaction in the guinea-pig by dapson. Proc. R. Soc. Med., 1975, 68, p. 273.
89. THUONG-NGUYEN, V., KADUNCE, D. P., HENDRIX, J. D. et al. Inhibition of neutrophil adherence to antibody by dapson: a possible therapeutic mechanism of dapson in the treatment of IgA dermatoses. J. Invest. Dermatol., 1993, 100, p. 349–355.
90. UETRECHT, J., ZAHID, N., SHEAR, N. H. et al. Metabolism of dapson to a hydroxylamine by human neutrophils and mononuclear cells. J. Pharmacol. Exp. Ther., 1988, 245, p. 274–279.
91. VENNING, V., MILLARD, P., WOJNAROWSKA, F. Dapson as first line therapy for bullous pemphigoid. Br. J. Dermatol., 1989, 120, p. 83–92.
92. WALKER, J. G., KADIA, T., BROWN, L. et al. Dapson induced methemoglobinemia in a patient with glioblastoma. J. Neurooncol., 2009, 94, p. 149–152.
93. WALLACH, D. Intraepidermal IgA pustulosis. J. Am. Acad. Dermatol., 1992, 27, p. 993–1000.
94. WOLF, R., TÜZÜN, B., TÜZÜN, Y. Dapson: unapproved uses or indications. Clinics in Dermatology, 2000, 18, 1, p. 37–53.
95. WOLFF, K. Subcorneal pustular dermatosis is not pustular psoriasis. Am. J. Dermatopathol., 1981, 3, p. 381–382.
96. WOZEL, G. Dapson – Pharmakologie. Thieme, Stuttgart: Wirkmechanismus und klinischer Einsatz; 1996.
97. WOZEL, G., BLASUM, CH. Dapson in dermatology and beyond. Arch. Dermatol. Res., 2014, 306, 2, p. 103–124.
98. YASUDA, H., KOBAYASHI, H., HASHIMOTO, T. et al. Subcorneal pustular dermatosis type of IgA pemphigus: demonstration of autoantibodies to desmocollin-1 and clinical review. Br. J. Dermatol., 2000, 143, p. 144–148.
99. YAZDANYAR, S., BOER, J., INGVARSSON, G. et al. Dapson therapy for hidradenitis suppurativa: a series of 24 patients. Dermatology, 2011, 222, p. 342–346.
100. ZHU, K. J., HE, F.T., JIN, N. et al. Complete atrioventricular block associated with dapson therapy: a rare complication of dapson-induced hypersensitivity syndrome. J. Clin. Pharm. Ther., 2009, 34, p. 489–492.
101. ZHU, Y. L., STILLER, M. J. Dapson and sulfones in dermatology: overview and update.J. Am. Acad. Dermatol., 2001 Sep, 45, 3, p. 420–434.
102. ZONE, J. J., MEYER, L. J. Dermatitis herpetiformis. Immunol. Ser., 1989, 46, p. 565–582.
Štítky
Dermatológia Detská dermatológia
Článek Odborné akce v roce 2017
Článok vyšiel v časopiseČesko-slovenská dermatologie
Najčítanejšie tento týždeň
2017 Číslo 4- První zkušenosti s léčbou psoriázy bimekizumabem v české reálné praxi – kazuistika z FNUSA
- Na český trh přichází biosimilar adalimumabu s prokázanou terapeutickou ekvivalencí
- Nehoňte nemocné s mMCC od čerta k ďáblu!
- První a jediná schválená imunoterapie vzácného agresivního karcinomu kůže
-
Všetky články tohto čísla
- Sulfony v dermatologii
-
DOŠKOLOVÁNÍ LÉKAŘŮ
KONTROLNÍ TEST - Mnohočetné familiární syringomy
- Rosai-Dorfmanova nemoc – kožní forma
- Klinický případ: Bolestivé noduly na zádech
-
Zápis ze schůze výboru ČDS
Praha 20. 4. 2017 - K životnému jubileu profesorky MUDr. Jagienky Jautovej, PhD., MBA
- Jubileum doc. MUDr. Dariny Jarčuškovej, CSc.
-
COLOR ATLAS OF ORAL DISEASES. DIAGNOSIS AND TREAMENT
(Barevný atlas onemocnění ústní sliznice a jejich léčby) - Odborné akce v roce 2017
- Česko-slovenská dermatologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Sulfony v dermatologii
- Mnohočetné familiární syringomy
- Rosai-Dorfmanova nemoc – kožní forma
- Klinický případ: Bolestivé noduly na zádech
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy