-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
International Society of Urological Pathology (ISUP) Vancouver Classification of Renal Neoplasia 2012
International Society of Urological Pathology (ISUP) Vancouver Classification of Renal Neoplasia 2012
Kidney tumours form a broad spectrum of distinguished histopathological and molecular genetic entities. The last WHO classification is dated to 2004. Current classification has been published in October 2013 by ISUP (International Society of Urological Pathology).
There were 5 new epithelials tumours: tubulocystic renal cell carcinoma (RCC), acquired cystic disease–associated RCC, clear cell (tubulo-)papillary RCC, the MiT family translocation RCCs (in particular t(6;11) RCC), and hereditary leiomyomatosis RCC syndrome–associated RCC.
Another 3 subtypes of RCC were added as “provisional” entities: thyroid-like follicular RCC; succinate dehydrogenase B deficiency–associated RCC; and ALK translocation RCC.
Modifications were performed in already existing entities: multicystic clear cell RCC (formerly multilocular cystic RCC) is newly included as a subcategory of clear cell RCC with low malignant potential. Oncocytic papillary RCC (PRCC) has not been recognized as a distinctive subcategory of PRCC yet. Hybrid oncocytic-chromophobe tumour was placed within the chromophobe RCC category.
Recent advances related to collecting duct carcinoma, renal medullary carcinoma, and mucinous spindle cell and tubular RCC were elucidated.
Outside of the epithelial category, current approach to our understanding of angiomyolipoma, including the epithelioid variant and angiomyolipoma with epithelial cysts was clarified. Cystic nephroma and mixed epithelial and stromal tumour were considered as a spectrum of one entity. Synovial sarcoma was placed within the sarcoma group. The new classification is to be referred to as the International Society of Urological Pathology Vancouver Classification of Renal Neoplasia.Keywords:
kidney - classification - ISUP - Vancouver classification - renal cell carcinoma
Autoři: Ondřej Hes
Působiště autorů: Šiklův ústav patologie, Univerzita Karlova v Praze, Lékařská fakulta Plzeň a FN Plzeň
Vyšlo v časopise: Čes.-slov. Patol., 50, 2014, No. 4, p. 137-141
Kategorie: Přehledové články - Uropatologie
Souhrn
Nádory ledvin představují široké spektrum histopatologických jednotek. Aktuální klasifikace WHO byla vydána v roce 2004. Nový návrh klasifikace vytvořený ISUP (International Society of Urological Pathology) byl publikován v říjnu 2013.
Bylo zavedeno 5 nových jednotek: tubulocystický renální karcinom (RK), acquired cystic disease–associated” RK, světlobuněčný (tubulo-)papilární RK, MiT translokační RK (zejména t(6;11) RK) a RK spojený se syndromem hereditární leiomyomatózy a renálního karcinomu.
Další renální karcinomy jsou přidány jako tzv. „provizorní“ jednotky: „thyroid-like follicular“ RK; „succinate dehydrogenase B deficiency–associated“ RK; a „ALK translocation“ RK.
Byl modifikován pohled na některé stávající jendotky: multicystický světlobuněčný RK (SRK) (dříve multilokulární cystický renální karcinom) byl zařazen pod SRK jako jeho podjednotka s nízkým maligním potenciálem s navrženým názvem: multilokulární cystická renální neoplasie nízkého maligního potenciálu. Onkocytický papilární RK (PRK) nebyl zatím uznán jako další podjednotka PRK. Hybridní onkocytický chromofóbní tumor je řazen jako podjednotka chromofóbního RK.
Byly doplněny nové poznatky o RK ze sběrných kanálků, medulárním RK a o mucinózním tubulárním a vřetenobuněčném RK.
Mimo epiteliální tumory byl představen současný stupeň poznání u angiomyolipomu. Byla doplněna kategorie AML s epiteliálními cystami a zpřesněn byl pohled na epiteloidní variantu AML. Cystický nefrom a smíšený epiteliální a stromální tumor jsou nově zařazeny do jedné společné jednotky jako okraje morfologického spektra. Synoviální sarkom byl přesunut mezi kategorii sarkomů.
ISUP doporučuje označovat tuto klasifikaci jako „ISUP vancouverská klasifikace“Klíčová slova:
ledviny - klasifikace - ISUP - vancouverská klasifikace - renální karcinom
Klasifikace nádorů ledvin je velmi komplikovaná a je jasné, že v budoucnu bude ještě mnohem složitější, než je tomu doposud. Poslední klasifikace Světové zdravotnické organizace (WHO) je z roku 2004 (1) a je evidentní, že zdaleka nesplňuje nároky na „zlatý standard“ pro běžnou diagnostickou praxi. V březnu 2012 byla uspořádána ISUP Consensus Conference ve Vancouveru a v říjnu 2013 byla vydána nová doporučená klasifikace renálních nádorů (2). Vlastní konferenci předcházela dotazníková korespondenční část. Následně ve Vancouveru (v rámci USCAP 2012) proběhla rozsáhlá diskuse jak přímo mezi autory klasifikace, tak mezi jednotlivými členy ISUP. Výsledkem byla série článků zabývajících se klasifikací, stagingem, diagnostickými a prognostickými markery nádorů ledvin otištěných v American Journal of Surgical Pathology v průběhu roku 2013, které vznikly opět na základě diskuze a konsensu autorů. ISUP vancouverská klasifikace 2012 bude základem nové WHO klasifikace. Tento přehledný článek by měl sloužit k rychlé orientaci mezi novými a navrhovanými jednotkami. Z tohoto důvodu jsou uvedeny pouze zcela bazální informace o každé jednotce. Rovněž vzhledem k přehlednému charakteru článku byly převzaty některé anglické názvy, aby překladem nedošlo k nižší srozumitelnosti textu. Také přehled literatury je velmi orientační a nemůže sloužit k detailnímu studiu problematiky.
PŘEHLED ZMĚN V KLASIFIKACI NÁDORŮ LEDVIN
Nově bylo zařazeno celkem 5 jednotek: tubulocystický renální karcinom, renální karcinom spojený se získanou cystickou nemocí ledvin (acquired cystic disease-associated renal cell carcinoma), translokační karcinomy řazené do MiT family (zejména t(6;11) renální karcinom) a renální karcinom spojený s hereditární leiomyomatózou.
Dále byly uvedeny 3 velmi vzácné nové jednotky, které prozatím nejsou řazeny do oficiálního klasifikačního schématu a očekává se další diskuze a zpřesnění diagnostických kritérií: renální karcinom napodobující štítnou žlázu (thyroid-like follicular RCC), renální karcinom spojený s defektem sukcinát dehydrogenázy B (SDHB associated RCC) a renální karcinomy spojené s translokací ALK.
Dále byl upraven statut světlobuněčného multicystického renálního karcinomu (podtyp světlobuněčného renálního karcinomu), onkocytický papilární renální karcinom nebude prozatím vydělován jako samostatná jednotka a hybridní onkocytické/chromofóbní karcinomy budou provizorně řazeny mezi chromofóbní renální karcinomy.
NÁDOROVÉ JEDNOTKY, KTERÉ BYLY PLNOHODNOTNĚ ZAŘAZENY DO NOVÉ KLASIFIKACE
Tubulocystický renální karcinom (TCRK)
Tento tumor byl původně nazýván jako nízce maligní (low-grade) RK ze sběrných kanálků. Diskutuje se jeho vztah k papilárnímu RK a v současné době znovu i vztah ke karcinomu ze sběrných kanálků tak, jako tomu bylo v minulosti. Vyskytuje se častěji u dospělých mužů (7 : 1) různých věkových skupin. Roste obvykle solidně, ale může obsahovat cystickou komponentu. TCRK má maligní potenciál, dokáže metastazovat i do vzdálených lokalizací (3,4). Klinicky byl sice popsán efekt inhibitorů tyrosinkinázy (4), ale v detailní analýze nebyl prokázán podklad pro tuto efektivitu (5). TCRK se typicky vyskytuje v kůře ledviny, obvykle je dobře ohraničený. Jde o tumor, který má tubulární, vzácně tubopapilární stavbu, obvykle je tvořen cylindrickými eozinifilními buňkami, grade dle Furmanové většinou 3 (obr. 1). Jsou vzácně popsány „high-grade“ léze. V rámci TCRK lze zastihnout dobře ohraničené fokusy papilárního RK či přechody směrem k PRCC. Přesné zařazení takových tumorů je vždy svízelné.
Obr. 1. Na snímku zachycen klasický tubulocystický RK (dolní polovina záběru), který vytváří v horní polovině snímku papilární formace. 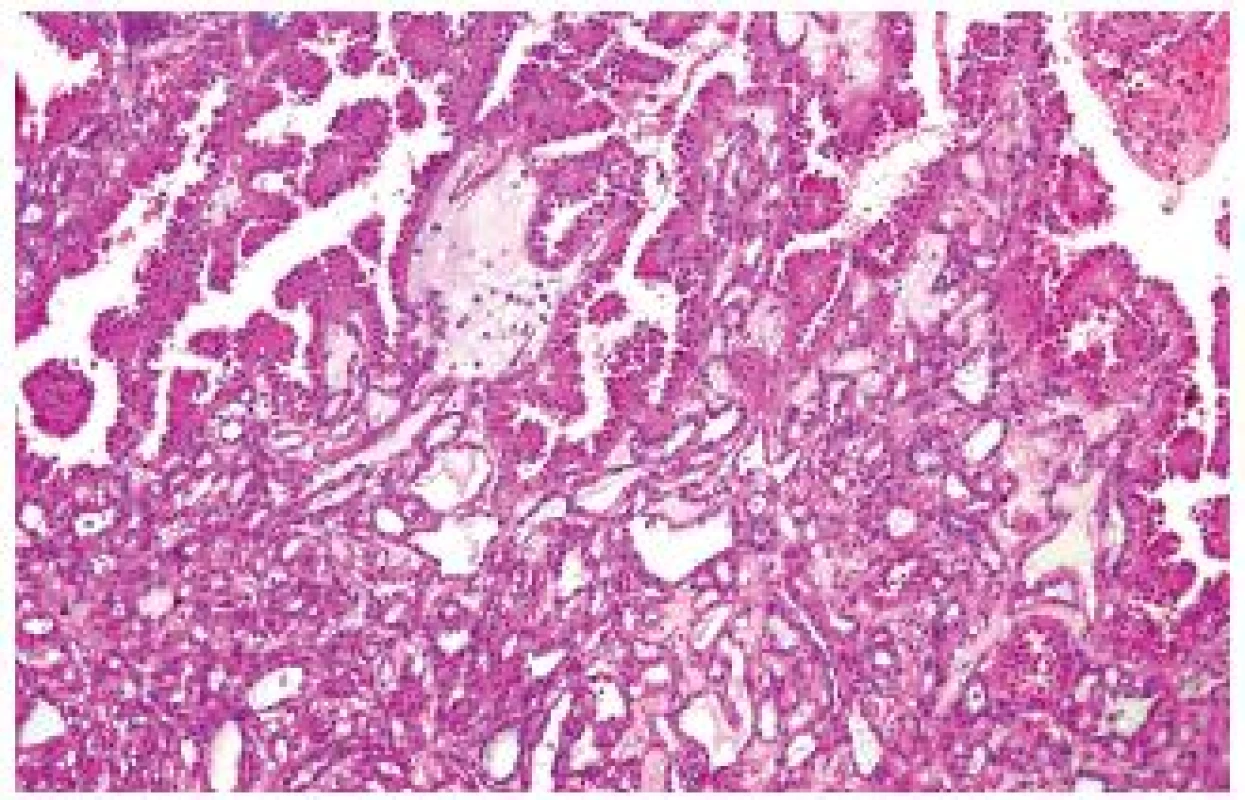
Léze typicky reaguje s CK 8, CK 18, CK 19, méně s CK 7. CD10 a racemáza jsou pozitivní v převážné většině případů. Byl prokázán gain chromozomů 7,17, ztráta Y, což opět nastoluje otázku širšího zařazení TCRK v rámci základních typů RK.
RK spojený se získanou cystózou ledvin (acquired cystic disease–associated RCC)
Jde o relativně dobře rozpoznatelný typ RK, který se nevyskytuje mimo „end-stage kidney disease“. Někteří autoři uvádějí, že se jedná o nejčastější nádor u pacientů s terminálním selháním ledvin (ESKD – end-stage kidney disease). Velké sestavy těchto lézí jsou známé z Japonska, nepochybně zde hraje úlohu velké množství dialyzovaných pacientů a možná předpoklady rasové (?). V našem registru, který čítá dnes přes 17 500 lézí, máme pouze 5 případů. Jedná se o tumor s dobrou prognózou. Je však nutné podotknout, že dialyzovaní pacienti jsou pečlivě sledováni a vždy dojde k časné detekci jakékoliv nádorové léze. Tumory mohou být solitární nebo multicentrické/bilaterální. Léze jsou obvykle kribriformní, acinární, popřípadě tubulární či papilární tvořené eozinofilními/onkocytickými elementy s přítomností obvykle četných, někdy však pouze fokálně se vyskytujících, oxalátových krystalů (obr. 2). Grade dle Fuhrmanové obvykle 2-3. Tumory obvykle reagují s racemázou. CD10, CK 7 bývají variabilně pozitivní. Numerické chromozomální aberace jsou u tohoto nádoru velmi běžné a četné (2,6,7).
Obr. 2. „Acquired cystic disease–associated“ RK. Nádory jsou obvykle kribriformní, avšak na tomto záběru je zachycen papilárně uspořádaný tumor s eozinofilními elementy s přítomností četných oxalátových krystalů. 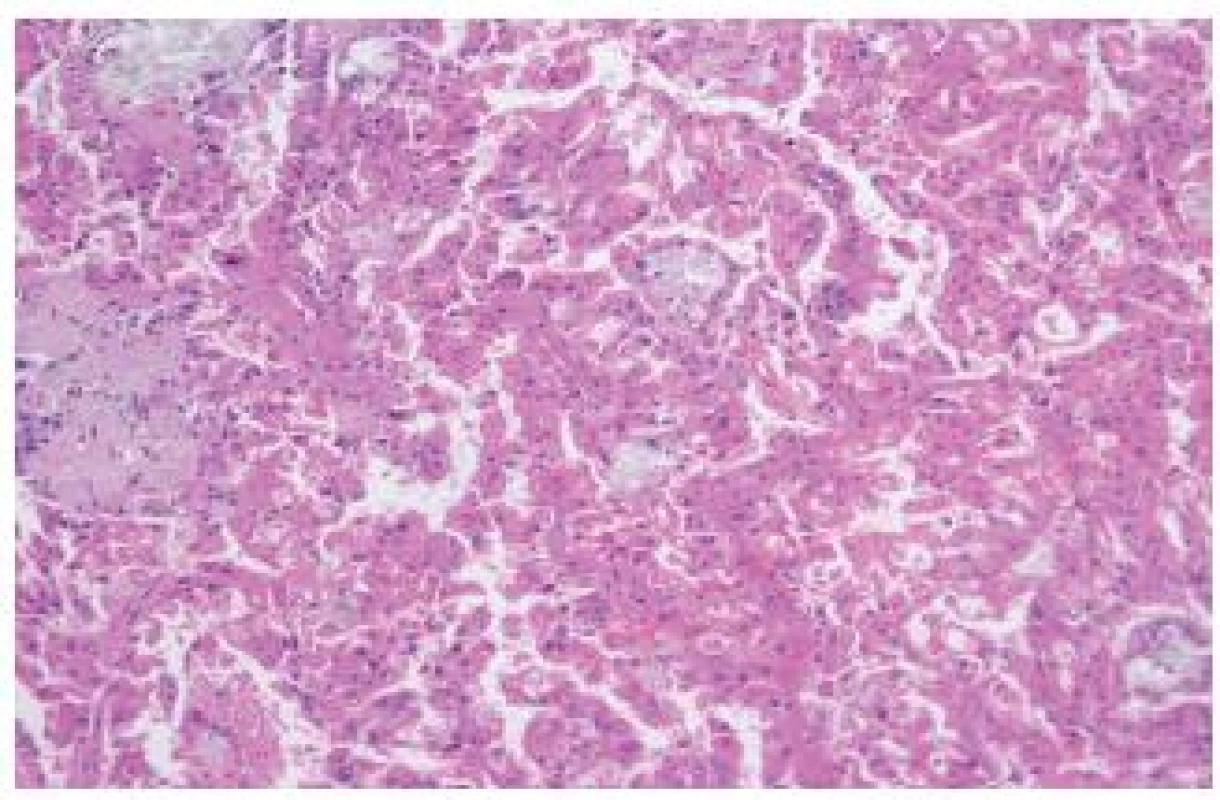
Světlobuněčný (tubulo-) papilární renální karcinom (clear cell (tubulo) papillary RCC - CPRCC)
Jedná se o vzácný tumor s minimálním maligním potenciálem (není znám doposud jediný agresivní případ). V úvodu je nutné zdůraznit, že v rámci publikovaných případů ve světovém písemnictví se jistě do této kategorie dostaly případy, které spíše spadají pod světlobuněčný RK, popř. papilární RK. Díky tomu jsou nepochybně občas udávané vlastnosti léze nejednoznačné. Tumor má papilární či tubopapilární stavbu, typicky je tvořen světlobuněčnými elementy s bazálně orientovanými jádry (grade dle Fuhrmanové převážně 1-2). Každý tubulus či papila je obkroužena jemnou sítí kapilár, podobně jako nativní tubuly v ledvině. Tumor reaguje pozitivně s CK 7, variabilně s vimentinem, CANH 9. Léze je negativní na abnormality VHL genu (8,9). V literatuře byl o 6 let dříve nejprve v kazuistice a později v sérii popsán velmi podobný tumor – tzv. RAT (renal angiomyoadenomatous tumor) (10), který se liší pouze přítomností objemné hladké svaloviny. V současné době je diskutována otázka, zda jsou RAT a CPRCC jedna či dvě jednotky (2) (obr. 3). Osobně pevně věřím, že jde o dva konce morfologického spektra jedné léze. V klasifikaci ISUP jsou však obě jednotky separovány jako samostatné typy RK, přičemž RAT zatím není zařazen do žádné kategorie.
Obr. 3. Světlobuněčný (tubulo-) papilární RK nebo RAT? Obě léze se liší pouze přítomností/absencí hladké svaloviny. 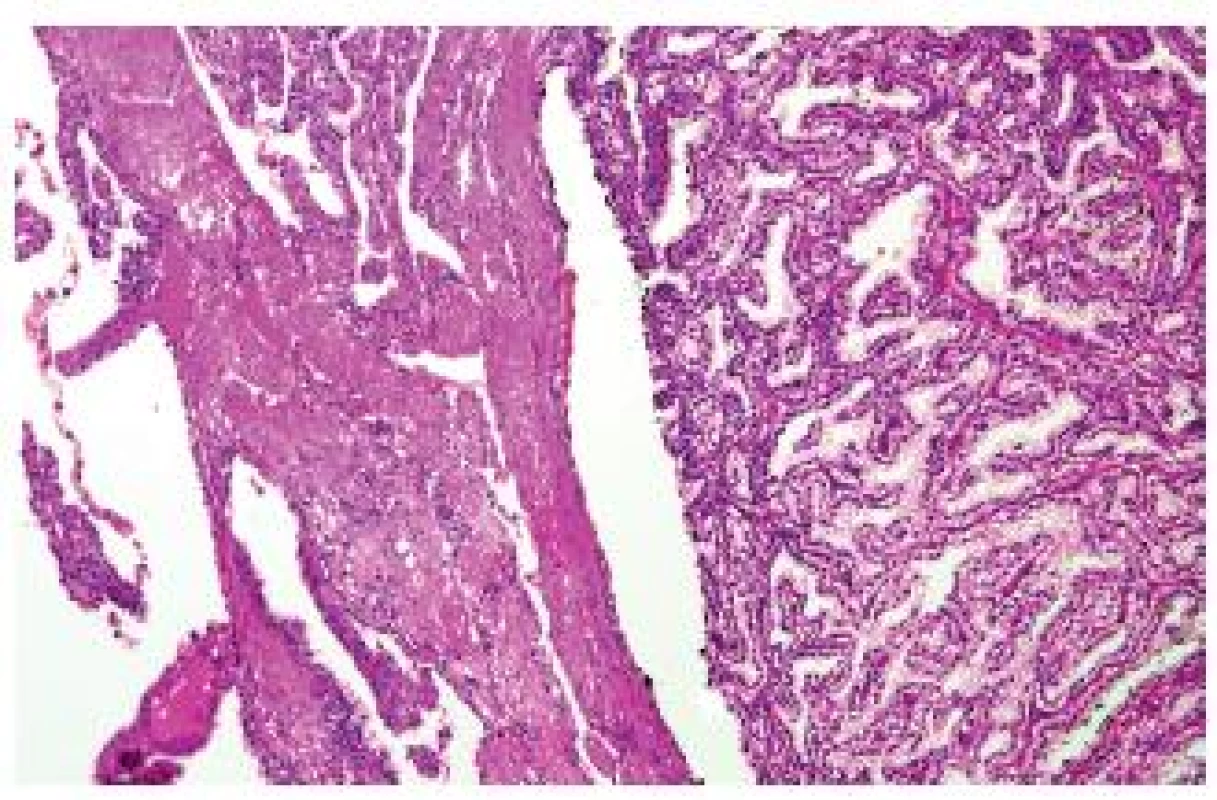
MiT Translokační renální karcinom (TRK)
Jedná se o tumory, které tvoří 15 % pacientů s tumorem ledviny do 40 let. Kromě jednotky Xp11.2 translocation renal cell carcinoma (9), která byla již ve WHO klasifikaci 2004 uvedena, byla přidána druhá skupina: „6p21 TRCC“, označované též jako „t(6;11) TRCC“ či dle typického obrazu v HE a imunohistochemickém barvení jako “rosette-like forming, HMB45-positive renal tumor” , či “TFEB RCC” (1,2). Zatímco TFEB RCC má relativně malý maligní potenciál, tak Xp11.2 TRCC se chová výrazně agresivněji.
V rámci skupiny Xp11.2 TRCC lze vcelku dobře definovat tzv. ASPL/TFE3 RK, který je morfologickou a imunohistochemickou (genetickou) kombinací alveolárního sarkomu měkkých tkání a RK. Tumor typicky exprimuje protein TFE3, který lze demonstrovat imunohistochemicky. V současné době je stále jasnější, že průkaz TFE3 proteinu pomocí imunohistochemie je velmi problematický. Diagnózu je tedy nutné podpořit molekulárně genetickým průkazem translokace, popř. proteinu. Ještě složitější je situace ve skupině PRCC/TFE3. Jde nepochybně o heterogenní skupinu nádorů. Zde ještě více, než u předcházející jednotky platí, že molekulárně genetický průkaz translokace/proteinu je nutný.
Naopak velkou většinu t(6;11) RCC lze diagnostikovat z hematoxylinu-eozinu, pouze s podporou imunohistochemického průkazu HMB45 (11,12). Vždy je nutné mít na paměti, že typické pseudorosetty mohou být přítomny fokálně a že nádor může morfologicky a imunohistochemicky velmi připomínat angiomyolipom (obr. 4) (13).
Obr. 4. Typické pseudorosetty nemusejí být přítomné ve všech řezech nebo jsou vyvinuty nedokonale a lézi lze snadno zaměnit za angiomyolipom. 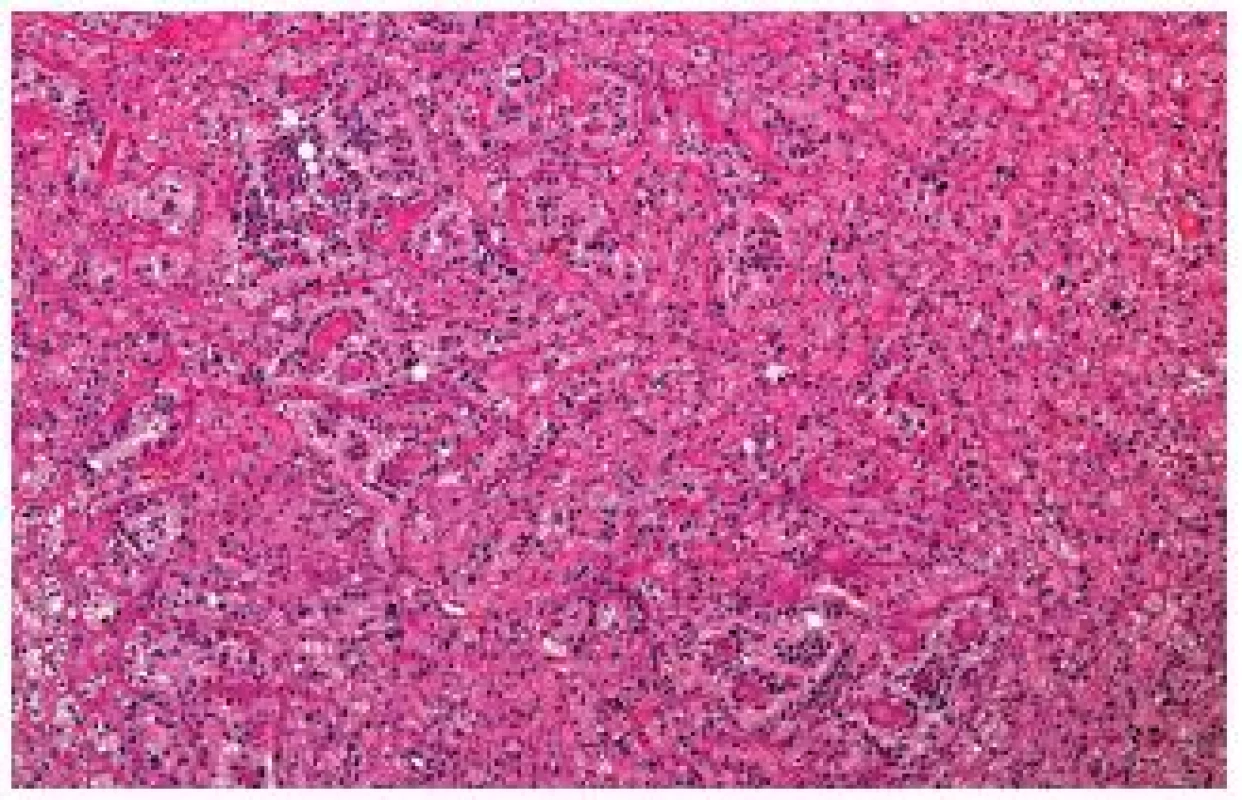
Syndrom hereditární leiomyomatózy a renálního karcinomu (hereditary leiomyomatosis RCC syndrome–associated RCC - HLRCC)
Syndrom hereditární leiomyomatózy a renálního karcinomu je autozomálně dominantní familiárně se vyskytující syndrom, pro nějž je typická tvorba leiomyomů na kůži a v děloze společně se vznikem renálních tumorů, konkrétně PRK (tradičně se udává typ 2 dle Delahunta) (1). U tohoto syndromu byla identifikována mutace genu pro fumarát hydratázu (FH). Na rozdíl od jiných hereditárních renálních karcinomů bývá solitární, diagnostikovaný v pokročilých stádiích, je vysoce agresivní a většina postižených na něj umírá (14,15). V současné době probíhá řada studií, které se snaží lépe charakterizovat renální tumory spojené s tímto syndromem. Je stále jasnější, že nádory v rámci HLRCC nejsou jen papilární, ale také tubulární či kribriformní a poměrně heterogenní i v rámci jedné léze. Základním znakem zůstávají nápadná jadérka (obr. 5). V současné době je k dispozici nekomerční protilátka 2SC a komerční FH. Jejich interpretace je však vysoce problematická, výsledky je nutné potvrdit pomocí genetické analýzy genu pro fumarát hydratázu.
Obr. 5. RK spojené se syndromem hereditární leiomyomatózy jsou poměrně polymorfní. Vždy jde o „high grade“ tumory tvořené eozinofilními buňkami s nápadnými jadérky. 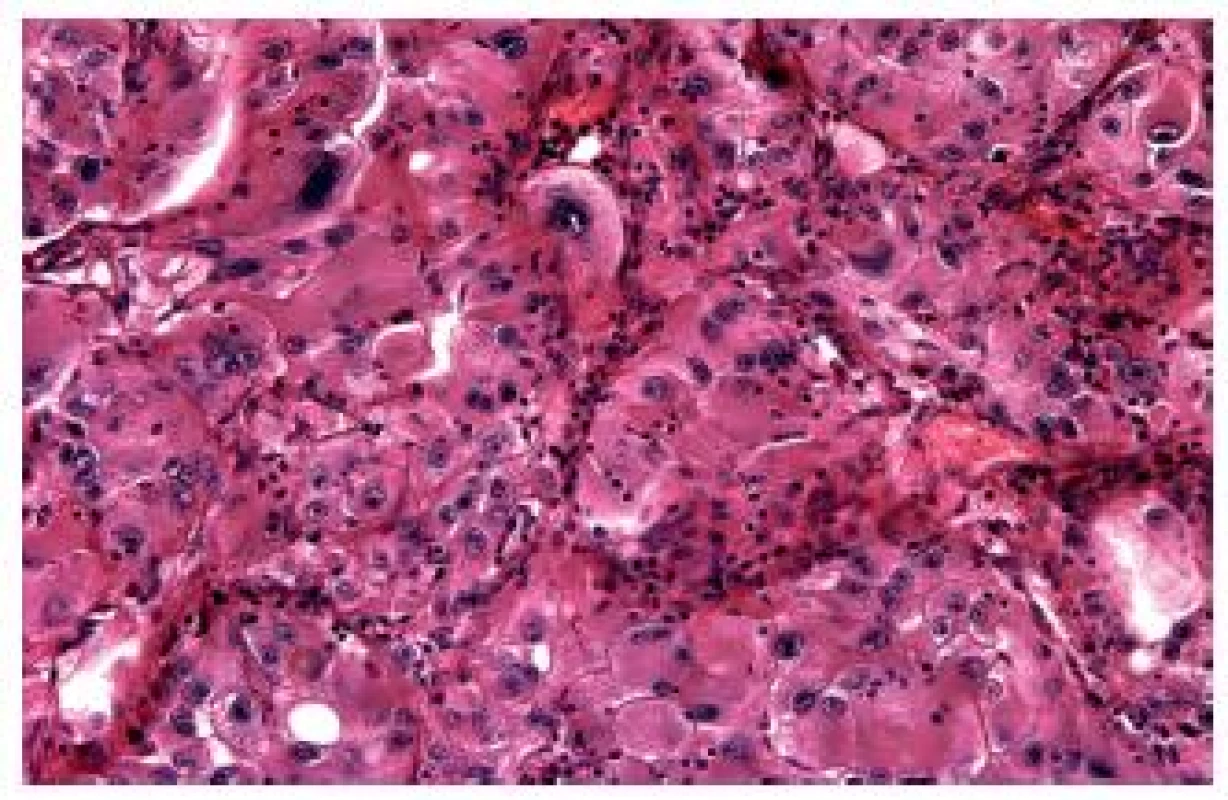
Je rovněž zřejmé, že u pacientů s tímto syndromem se nádory nevyskytují synchronně, dokonce se zdá, že podstatná část pacientů má pouze jeden typ nádoru. Nepochybně je nutné lépe morfologicky, eventuálně pomocí dalších markerů definovat tyto vysoce agresivní léze.
TZV. PROVIZORNÍ JEDNOTKY
„Thyroid-like follicular“ RK
Velmi vzácná léze, doposud bylo publikováno méně než 20 případů (2). Tumory připomínají svým růstem parenchym štítné žlázy nebo metastázu karcinomu štítné žlázy. Obvykle jsou opouzdřené s makro nebo mikrofolikulární stavbou (obr. 6). Typicky jsou imunohistochemicky negativní při barvení s thyreoglobulinem, TTF1. CK 7, PAX 2 a PAX 8 reaguje variabilně. Numerické chromozomální aberace jsou četné, prozatím bylo studováno minimum případů. Metastatické případy již byly v literatuře dokumentovány (16,17).
Obr. 6. „Thyroid-like follicular“ RK může být složen převážně z makrofolikulárních elementů. 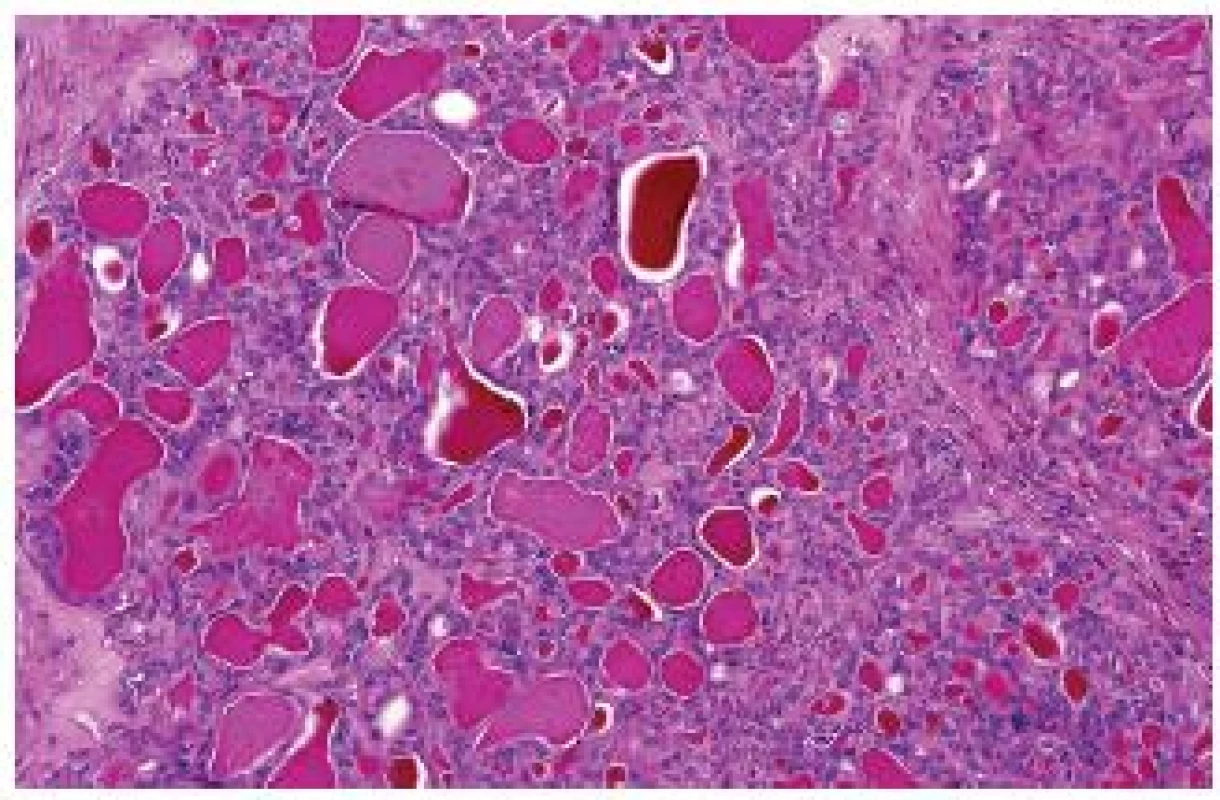
“Succinate dehydrogenase B deficiency–associated RCC“ (SDHB RK)
Tyto nádory se vyskytují u pacientů se zárodečnou mutací genu pro sukcinát dehydrogenázu B (pravděpodobně i A, C, možná i D) (SDHB) (2). Součástí syndromu je výskyt feochromocytomů/paragangliomů, gastrointestinálních stromálních tumorů a většinou velmi specifických renálních nádorů. Renální léze se vyskytují obvykle u mladších pacientů, vzácně se mohou chovat agresivně. Typické případy jsou solidní, tvořené populací eozinofilních buněk s vakuolizovanou (bublinkovitou) cytoplasmou (18,19) (obr. 7). Někdy jsou přítomné eozinofilní intracytoplasmatické inkluze. Tumor je typicky negativní s protilátkou proti SDHB, normální nenádorová tkáň slouží jako vnitřní kontrola. Interpretace barvení není jednoduchá, nález je nutno dále potvrdit analýzou genu pro SDH.
Obr. 7. „SDHB- associated“ RK - obvykle jsou nádory solidní, tvořené populací eozinofilních buněk s vakuolizovanou cytoplasmou. 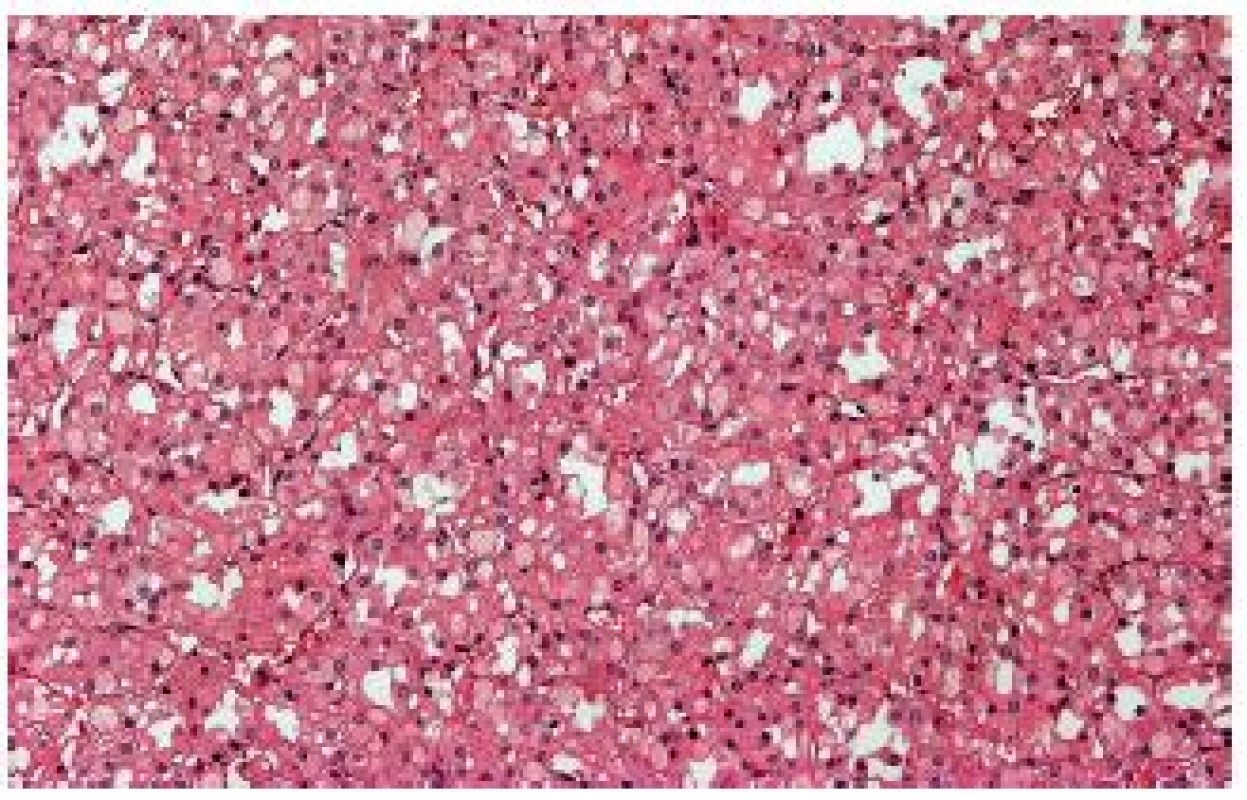
Renální karcinomy s ALK translokací
V nedávné době byly prokázány RK s fúzí genu pro vinculin (VCL) s genem pro anaplastic lymphoma kinázu (ALK). Další práce o těchto nádorech byly publikovány ve světovém tisku (2,20). Jedná se o morfologicky velmi variabilní tumory mladých či dospělých pacientů. Je otázkou, zda bude možné v budoucnu lépe tyto nádory definovat a rozpoznávat.
LÉZE S MÍRNĚ MODIFIKOVANÝM PŘÍSTUPEM
Multilokulární cystická renální neoplasie nízkého maligního potenciálu (multilokulární cystický RK)
Multicystický světlobuněčný RK (multilokulární cystický RK, multilokulární cystická renální neoplazie nízkého maligního potenciálu) (21) byl v minulé WHO 2004 klasifikaci uváděn jako samostatná jednotka (1). Je jasné, že tyto nádory mají vždy příznivé biologické chování a že v literatuře není znám agresivní případ. Důležité je správné zabločkování léze, je nutné vyloučit přítomnost komponenty vyššího gradu (grade 3; grade 2 se ještě připouští pro diagnózu). Je rovněž evidentní, že se jedná o podtyp světlobuněčného RK. Nový název „multilokulární cystická renální neoplasie nízkého maligního potenciálu“ byl zaveden proto, aby nedocházelo k nadbytečné léčbě či stresování pacientů.
Papilární RK
V rámci předkonferenční ankety a následně na konferenci byl diskutován zejména tzv. onkocytický PRK, který je řadou patologů považován za jasně definovanou variantu PRCC a dá se označit jako typ 3 PRK. Po hlasování na vancouverské patologické konferenci nebyl tento typ však jako samostatná jednotka uznán a zůstávají nadále jen typ I a II (2).
Hybridní onkocytické chromofóbní tumory
Jedná se o indolentní tumor a vyskytuje se ve třech formách: v rámci Birt-Hogg-Dubé syndromu, při renální onkocytóze a jako sporadický nádor (22). Jedná se nepochybně o heterogenní skupinu nádorů. V současné době však není ve světovém písemnictví znám jediný agresivní případ, což je hlavní důvod k uvedení této kategorie (2).
Karcinom ze sběrných kanálků a medulární RK
Zde jsou diskutovány zejména otázky histopatologické diferenciální diagnostiky karcinomu ze sběrných kanálků a vztah k uroteliálnímu karcinomu. Medulární RK je nadále považován za variantu karcinomu ze sběrných kanálků, ale může se dle posledních prací vyskytnout i bez srpkovité anémie (2).
Mucinózní tubulární a vřetenobuněčný RK (Mucinous tubular and spindle cell RCC)
Tumor byl již uveden ve WHO klasifikaci z roku 2004. V současném návrhu nejsou zařazeny žádné zásadní změny.
Epiteloidní angiomyolipom
Angiomyolipom (AML) patří do skupiny tzv. PEComů (perivascular epithelioid cell tumor - PEComa) (23). Ve vancouverské klasifikaci jsou doplněny další podjednotky, zejména je diskutována tzv. epiteloidní varianta a její agresivní potenciál. Byly uvedeny rizikové znaky, které lépe umožní předpovědět prognózu konkrétního tumoru. Jako další podjednotka byla zařazena tzv. onkocytická varianta AML a AML s epiteloidními cystami, které vykazují příznivé biologické chování.
Smíšené mezenchymální a epiteliální tumory
Cystický nefrom a smíšený epiteliální stromální tumor ledviny byly ve WHO klasifikaci 2004 uvedeny jako jednotky samostatné. Jejich charakteristika však nebyla jednoznačná. V současné době převažuje názor, že jde o dva konce spektra jedné nádorové jednotky (1,2).
Poslední změna byla spíše akademická, odstraněn byl primární renální synoviální sarkom ledviny a přesunut do skupiny sarkomů.
PODĚKOVÁNÍ
Práce byla podpořena grantem IGA NT 12010-4, projektem Ministerstva zdravotnictví koncepčního rozvoje výzkumné organizace 00669806 - FN Plzeň a Programem rozvoje vědních oborů Karlovy Univerzity (projekt P36).
✉ Adresa pro korespondenci:
prof. MUDr. Ondřej Hes, Ph.D.
Šiklův ústav patologie, Univerzita Karlova v Praze,
Lékařská fakulta Plzeň a FN Plzeň
Alej Svobody 80, 304 60 Plzeň
e-mail: hes@medima.cz
Zdroje
1. Eble JN, Sauter G, Epstein JI, Sesterhenn IA, (eds). Pathology and genetics of tumours of the urinary system and male genital organs. World Health Organization Classification of Tumours. Lyon: IARC Press; 2004.
2. Srigley JR, Delahunt B, Eble JN, et al. The International society of urological pathology (ISUP) Vancouver classification of renal neoplasia. Am J Surg Pathol 2013; 37(10): 1469-1489.
3. Zhou M, Yang XJ, Lopez JI, et al. Renal tubulocystic carcinoma is closely related to papillary renal cell carcinoma: implications for pathologic classification. Am J Surg Pathol 2009; 33(12): 1840-1849.
4. Hora M, Urge T, Eret V, et al. Tubulocystic renal carcinoma: a clinical perspective. World J Urol 2011; 29(3): 349-354.
5. Steiner P, Hora M, Stehlik J, et al. Tubulocystic renal cell carcinoma: is there a rational reason for targeted therapy using angiogenic inhibition? Analysis of seven cases. Virchows Arch 2013; 462(2): 183-192.
6. Sule N, Yakupoglu U, Shen SS, et al. Calcium oxalate deposition in renal cell carcinoma associated with acquired cystic kidney disease: a comprehensive study. Am J Surg Pathol 2005; 29(4): 443-451.
6. Tickoo SK, dePeralta-Venturina MN, Harik LR, et al. Spectrum of epithelial neoplasms in end-stage renal disease: an experience from 66 tumor-bearing kidneys with emphasis on histologic patterns distinct from those in sporadic adult renal neoplasia. Am J Surg Pathol 2006; 30(2): 141-153.
8. Gobbo S, Eble JN, Grignon DJ, et al. Clear cell papillary renal cell carcinoma: a distinct histopathologic and molecular genetic entity. Am J Surg Pathol 2008; 32(8): 1239-1245.
9. Aydin H, Chen L, Cheng L, et al. Clear cell tubulopapillary renal cell carcinoma: a study of 36 distinctive low-grade epithelial tumors of the kidney. Am J Surg Pathol 2010; 34(11): 1608-1621.
10. Michal M, Hes O, Němcová J, et al. Renal angiomyoadenomatous tumor: morphologic, immunohistochemical, and molecular genetic study of a distinct entity. Virchows Arch 2009; 454(1): 89-99.
11. Argani P, Hawkins A, Griffin CA, et al. A distinctive pediatric renal neoplasm characterized by epithelioid morphology, basement membrane production, focal HMB45 immunoreactivity, and t(6;11)(p21.1;q12) chromosome translocation. Am J Pathol 2001; 158(6): 2089-2096.
12. Smith NE, Illei PB, Allaf M, et al. t(6;11) renal cell carcinoma (RCC): expanded immunohistochemical profile emphasizing novel RCC markers and report of 10 new genetically confirmed cases. Am J Surg Pathol 2014; 38(5): 604-614.
13. Petersson F, Vaněček T, Michal M, et al. A distinctive translocation carcinoma of the kidney; “rosette forming,” t(6;11), HMB45-positive renal tumor: a histomorphologic, immunohistochemical, ultrastructural, and molecular genetic study of 4 cases. Hum Pathol 2012; 43(5): 726-736.
14. Przybycin CG, Magi-Galluzzi C, McKenney JK. Hereditary syndromes with associated renal neoplasia: a practical guide to histologic recognition in renal tumor resection specimens. Adv Anat Pathol 2013; 20(4): 245-263.
15. Merino MJ, Torres-Cabala C, Pinto P, Linehan WM. The morphologic spectrum of kidney tumors in hereditary leiomyomatosis and renal cell carcinoma (HLRCC) syndrome. Am J Surg Pathol 2007; 31(10): 1578-1585.
16. Amin MB, Gupta R, Hes O, et al. Primary thyroid-like follicular carcinoma of the kidney: report of 6 cases of a histologically distinctive adult renal epithelial neoplasm. Am J Surg Pathol 2009; 33(3): 393-400.
17. Jung SJ, Chung JI, Park SH, Ayala AG, Ro JY. Thyroid follicular carcinoma-like tumor of kidney: a case report with morphologic, immunohistochemical, and genetic analysis. Am J Surg Pathol 2006; 30(3): 411-415.
18. Gill AJ, Pachter NS, Chou A, et al. Renal tumors associated with germline SDHB mutation show distinctive morphology. Am J Surg Pathol 2011; 35(10): 1578-1585.
19. Ricketts CJ, Shuch B, Vocke CD, et al. Succinate dehydrogenase kidney cancer: an aggressive example of the Warburg effect in cancer. J Urol 2012; 188(6): 2063-2071.
20. Sukov WR, Hodge JC, Lohse CM, et al. ALK alterations in adult renal cell carcinoma: frequency, clinicopathologic features and outcome in a large series of consecutively treated patients. Mod Pathol 2012; 25(11): 1516-1525.
21. Williamson SR, Halat S, Eble JN, et al. Multilocular cystic renal cell carcinoma: similarities and differences in immunoprofile compared with clear cell renal cell carcinoma. Am J Surg Pathol 2012; 36(10): 1425-1433.
22. Petersson F, Gatalica Z, Grossmann P, et al. Sporadic hybrid oncocytic/chromophobe tumor of the kidney: a clinicopathologic, histomorphologic, immunohistochemical, ultrastructural, and molecular cytogenetic study of 14 cases. Virchows Arch 2010; 456(4): 355-365.
23. Nese N, Martignoni G, Fletcher CD, et al. Pure epithelioid PEComas (so-called epithelioid angiomyolipoma) of the kidney: A clinicopathologic study of 41 cases: detailed assessment of morphology and risk stratification. Am J Surg Pathol 2011; 35(2): 161-176.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článok vyšiel v časopiseČesko-slovenská patologie

2014 Číslo 4-
Všetky články tohto čísla
- Pokroky v uropatológii
- Za všetkým hľadaj ženu...
- MONITOR aneb nemělo by vám uniknout, že...
- Novinky v patologii prostaty
- Novinky v patologii močového měchýře
- International Society of Urological Pathology (ISUP) Vancouver Classification of Renal Neoplasia 2012
- Postavenie a význam cytológie moča v diagnostike uroteliálnych nádorov
- Izolovaná metastáza do srdce z maligního fyloidního nádoru s osteosarkomatózní diferenciací
- Morfologické a elektrofyziologické změny v srdečních síních zemřelých s fibrilací síní – pilotní studie
- Bartov syndróm asociovaný s epidermolysis bullosa junctionalis a s atréziou pyloru. Nekroptická kazuistika
- Novinky v testování RAS u kolorektálního karcinomu - konsensus z pracovního setkání zástupců referenčních laboratoří
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Postavenie a význam cytológie moča v diagnostike uroteliálnych nádorov
- Bartov syndróm asociovaný s epidermolysis bullosa junctionalis a s atréziou pyloru. Nekroptická kazuistika
- International Society of Urological Pathology (ISUP) Vancouver Classification of Renal Neoplasia 2012
- Novinky v patologii prostaty
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



