-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Postavenie a význam cytológie moča v diagnostike uroteliálnych nádorov
Current status of urinary cytology in the evaluation of bladder neoplasms
Urine cytology is a reliable method for identification and follow up of the patients who develop high-grade urothelial carcinoma. Reactive changes of superficial and intermediate urothelial cells cytologically often mimic low grade urothelial carcinoma. This is the cause of relatively high number of false positive and false negative results. Diagnostic accuracy can be improved introducing different procedures for material handling namely cytospin and liquid based cytology and new diagnostic protocols such as FISH for chromosomal aberrations or mRNA and miRNA analysis. Most recently Next Generation Sequencing for DNA analysis was applied. Availability of clinical information improves the diagnostic accuracy and shortens the time to diagnosis.
Keywords:
cytology - urine - urothelial carcinoma – LBC
Autoři: Ondrej Ondič 1,2
; Robert Slunéčko 1,2; Marián Švajdler - ml. 1 3
Působiště autorů: Šiklův ústav patologie, Univerzita Karlova Praha, lékařská fakulta Plzeň a FN Plzeň 1; Bioptická laboratoř s. r. o., Plzeň 2; Oddelenie patológie, Univerzitná nemocnica Louisa Pasteura, Košice 3
Vyšlo v časopise: Čes.-slov. Patol., 50, 2014, No. 4, p. 142-145
Kategorie: Přehledové články - Uropatologie
Souhrn
Urologická cytológia je spoľahlivá metóda pre prvozáchyt a monitoring pacientov s high-grade uroteliálnym karcinómom. Reaktívne zmeny povrchových i intermediálnych urotélií niekedy morfologicky napodobujú, ba i prekonávajú zmeny v low grade neoplastickom uroteli. To je príčinou relatívne vysokej falošnej pozitivity a falošnej negativity. Diagnostickú spoľahlivosť metódy rozličnou mierou zvyšuje použitie Cytospinu, liquid-based cytológie, metodiky FISH, analýza reťazcov mRNA a miRNA. Novinkou sú pokusy vyšetrovať DNA metódou Next Generation Sequencing. K zrýchleniu a zlepšeniu kvality urocytologickej diagnostiky významne prispieva i znalosť klinických údajov.
Kľúčové slová:
cytológia - moč - uroteliálny karcinóm - LBC
Mikroskopické hodnotenie močového sedimentu ako metódu pre diagnostiku karcinómu močového mechúra popísal Papanicolaou v roku 1945 (1). Uropatológii vrátane cytológie moča sa dlhodobo venovali a významne túto časť patológie ovplyvnili Mostofi, Bostwick a najmä William M. Murphy, ktorý svoje poznatky o cytológii moča zhrnul v monografii (2) a ešte pregnantnejšie v roku 1989 v prehľadovom článku (3).
Najsilnejšou stránkou urologickej cytológie je vysoko špecifická a vysoko senzitívna identifikácia high-grade uroteliálnych karcinómov. Je veľmi spoľahlivá pri prvozáchyte takýchto nádorov i pri monitoringu pacientov po liečbe (obr. 1). Je to dané zvláštnosťou urotelu, ktorý „sa chová tak, ako vyzerá“. Od popisu metódy do súčasnosti sa urocytológia vysporadúva s niekoľkými hendikepmi:
- A. Histologická klasifikácia uroteliálnych lézií sa často mení. Všeobecne uznaný ustálený klasifikačný systém, ktorý by reflektoval poznanie patológov a zároveň by bol jasný a praktický pre klinické použitie dodnes neexistuje. Rovnováha medzi patológmi uznávajúcimi bohaté delenie na podjednotky („splitters“) a tými, ktorí majú tendenciu klasifikácie zjednodušovať („lumpers“) v tejto časti patológie ešte nie je nastolená.
- B. Moč spôsobuje degeneráciu urotélií, v povrchových vrstvách sliznice „in situ“ a aj po ich odlúčení do dutiny močového mechúra.
- C. Pomalý životný cyklus normálneho urotelu s delením buniek raz za 200 až 500 dní (4) spôsobuje relatívnu hypocelularitu vzoriek.
- D. Reaktívne zmeny povrchových i intermediálnych urotélií morfologicky dosť verne napodobujú, ba niekedy dokonca prekonávajú zmeny v neoplastickom uroteli (obr. 2, 3).
Obr. 1. High grade papilárny uroteliálny karcinóm v kontrolnej cytológii u pacienta po rádioterapii. (Cytospinový preparát, farbenie PAP, zväčšenie 400x.) 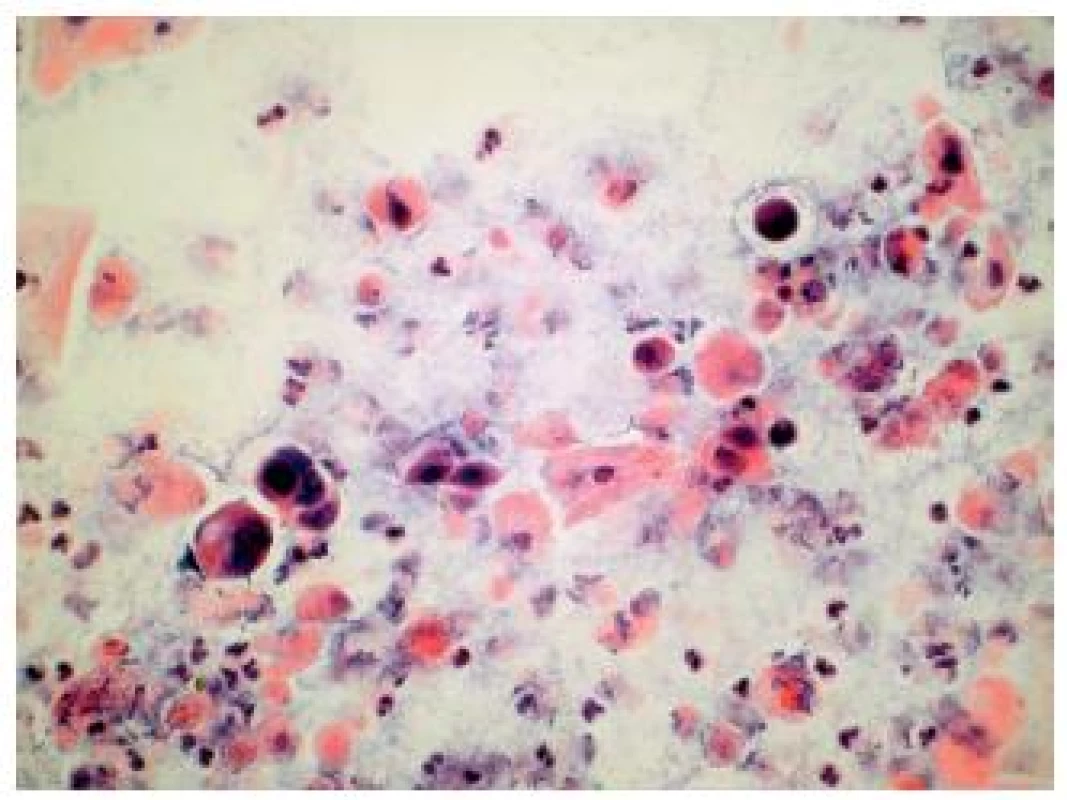
Obr. 2. Reaktívne zmenené urotélie u 22 ročného pacienta s mikrohematúriou a negatívnym cystoskopickým nálezom. (Cytospinový preparát, farbenie PAP, zväčšenie 400x.) 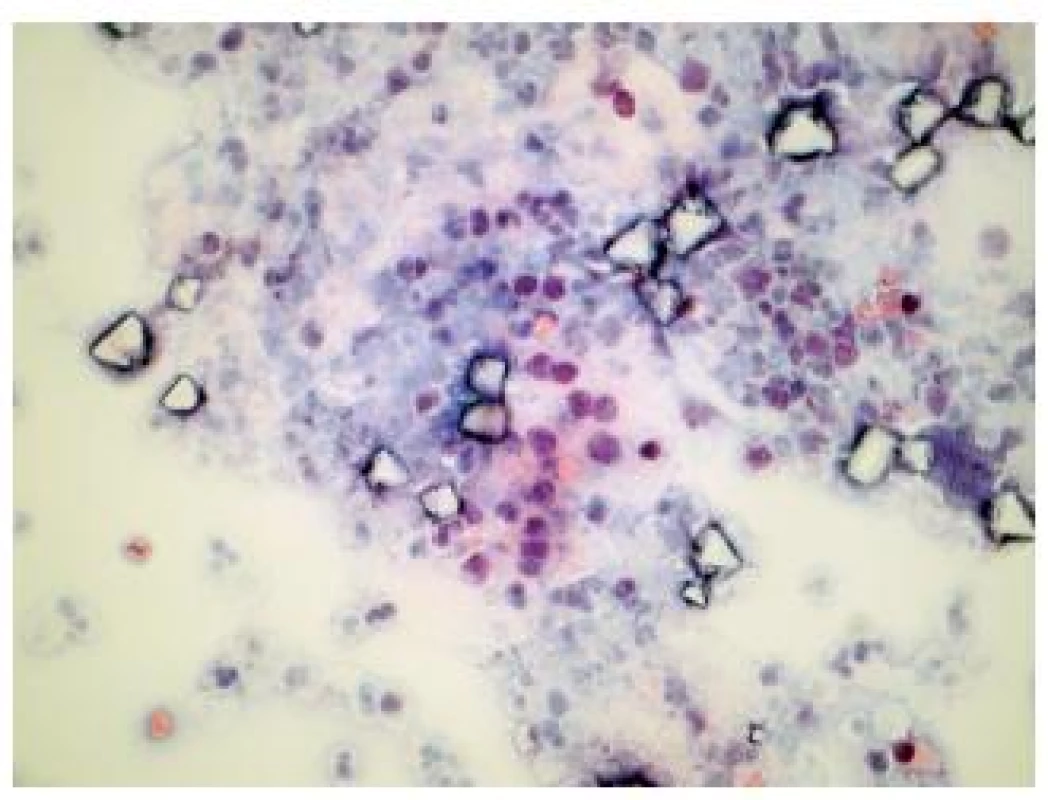
Obr. 3. Low grade papilárny uroteliálny karcinóm u 66 ročného pacienta s mikrohematúriou, pozitívnym cystoskopickým nálezom a biopticky na inom pracovisku potvrdeným papilárnym uroteliálnym karcinómom WHO grade 2. (Cytospinový preparát, farbenie PAP, zväčšenie 400x.) 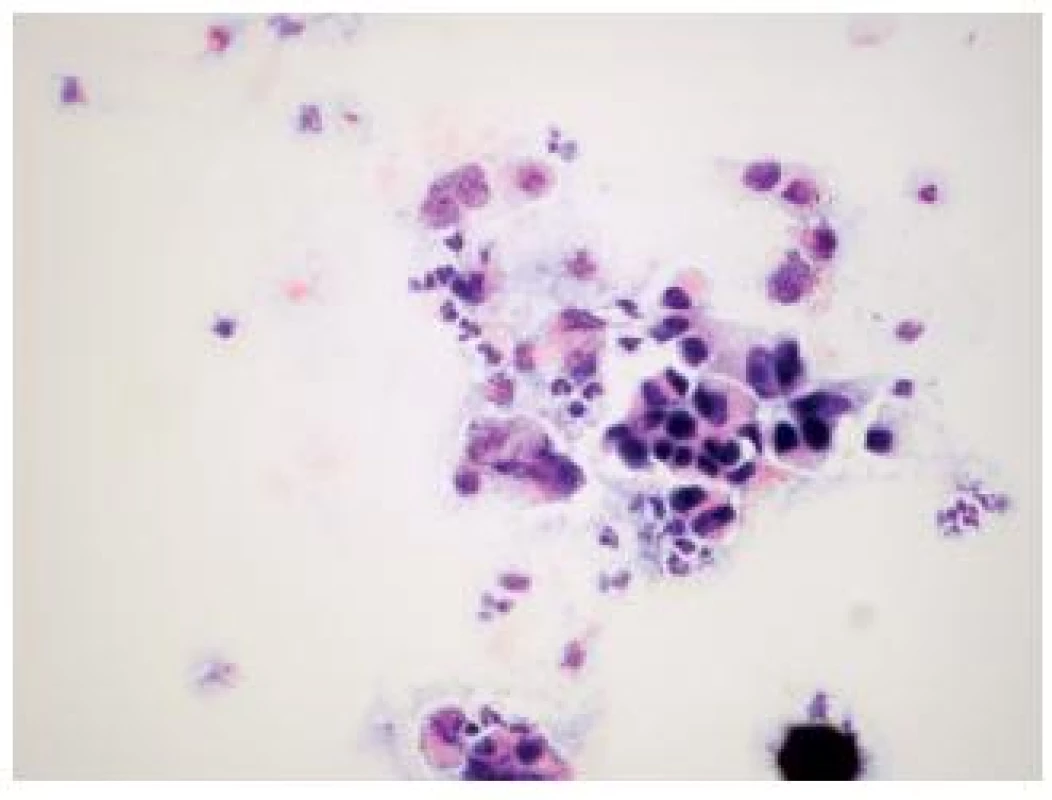
Vymenované ťažkosti sa do hodnotenia cytológie moča prenášajú takto:
- Existujú rozličné klasifikčné schémy cytologického nálezu (tab. 1). Ich používanie závisí od miestnych pomerov na pracovisku a na konkrétnych dohodách so spolupracujúcimi urológmi.
- Zistilo sa, že najvhodnejším materiálom z hľadiska reprezentatívnosti a zachovalosti buniek sa zdá byť náhodne vymočený denný moč, alebo vzorka získaná pri katetrizácii močového mechúra z inej indikácie, či výplach močového mechúra. Prípadné uloženie odobranej vzorky moča v chladničke na dobu do cca 4 hodín nespôsobí znehodnotenie vzorky pre účely cytologického vyšetrenia.
- Celularita preparátov a zachovalosť buniek sa zlepšuje centrifugáciou pomocou Cytospinu. Ďalším výrazným kvalitatívnym skokom je zavádzanie technológie liquid-based cytológie (LBC) (obr. 4, 5). Používajú sa (v USA so súhlasom FDA) existujúce systémy SurePath, alebo ThinPrep i ďalšie novovznikajúce systémy - napríklad juhokórejský systém CellprepPlus (5).
- Snaha o zlepšenie kvality preparátov v podobe metódy LBC (6) priniesla ďalší vedľajší efekt a to možnosť viacpočetných dodatočných doplnkových vyšetrení zo zbytkového materiálu. V celosvetovom meradle sú najbohatšie skúsenosti s hodnotením aneuploidie chromozómov 3, 7, 17 a straty lokusu 9p21 pre gén p16 metódou fluorescenčnej in situ hybridizácie (FISH) kitom UroVision. Tento systém je pomerne drahý. Využíva štyri sondy značené rozličnými farbami: červenou, zelenou, modrou a zlatou. Po aplikácii sond na genetický materiál buniek sa v preparáte hodnotí počet jednotlivých farebných signálov a následne sa interpretuje podľa kritérií výrobcu. Vyšetrenie umožňuje detekciu high grade ako aj low grade urotelových lézií v cytologicky sporných prípadoch. Pomerne spoľahlivo dokáže odhaliť rekurenciu tumoru aj v prípadoch, keď rekurentný tumor ešte nie je cystoskopicky viditeľný. Snaha zvýšiť spoľahlivosť hodnotenia a znížiť časovú náročnosť a cenu tohoto vyšetrenia viedla k testovaniu systémov počítačom asistovaného hodnotenia signálov FISH (BioView Duet imaging system, Ikoniscope - oncoFISH bladder Test System a ďalšie). Napríklad systému Ikoniscope - oncoFISH trvá vyhodnotenie jedného preparátu priemerne cca 31,7 min. Následné hodnotenie cytopatológom vyžaduje priemerne už len 8,3 min. (7). Zdá sa, že najefektívnejšie sa metóda FISH uplatní u pacientov s nejednoznačným cytologickým nálezom so súčasným negatívnym, alebo nejednoznačným cystoskopickým nálezom (8-10).
Tab. 1. Porovnanie klasifikačných systémov urologickej cytológie. 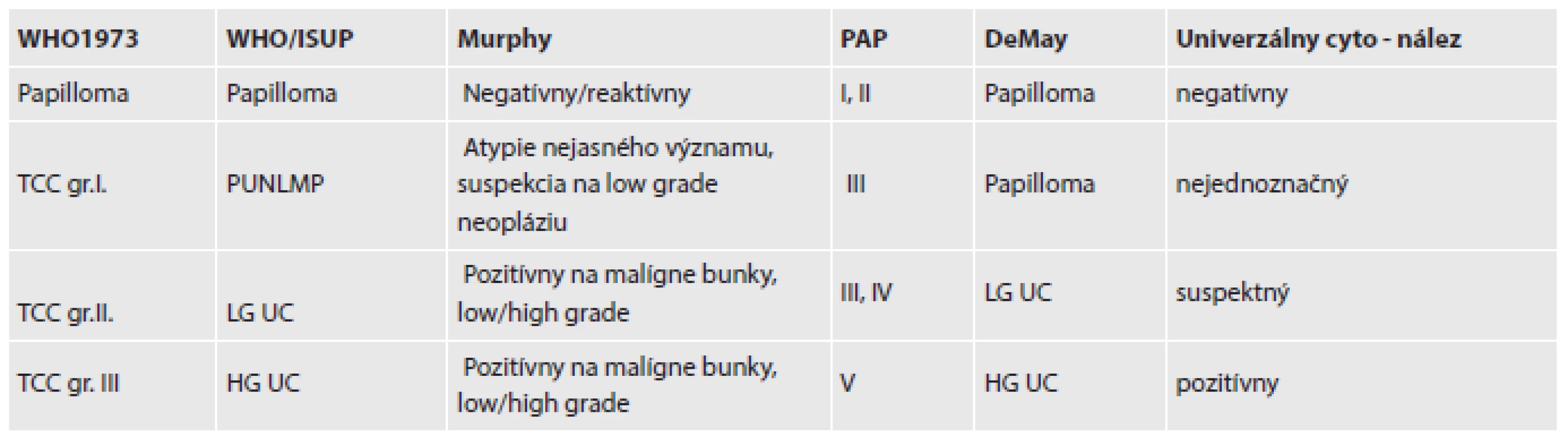
TCC – transitional cell carcinoma, PUNLMP – papillary urothelial neoplasm of low malignant potential, LG UC – low grade urothelial carcinoma, HG UC – high grade urothelial carcinoma Obr. 4. Reaktívne zmenené urotélie v kontrolnom odbere pri negatívnej cystoskopii u 62 ročného pacienta po výkonoch pre recidivujúci papilárny uroteliálny karcinóm WHO grade 2. (Preparát LBC, farbenie PAP, zväčšenie 400x.) 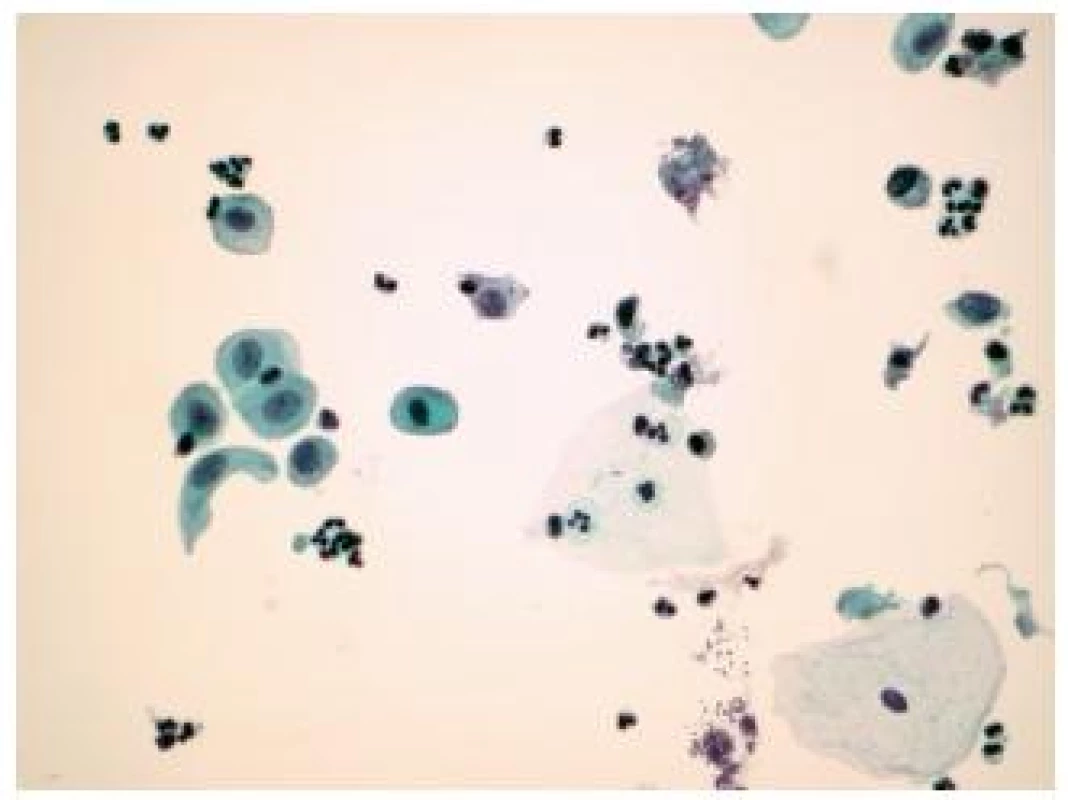
Obr. 5. Low grade papilárny uroteliálny karcinóm u 60 ročnej pacientky s hematúriou a pozitívnym cystoskopickým nálezom. Následná cystektómia ozrejmila invazívny papilárny uroteliálny karcinóm WHO grade 2. (Preparát LBC, farbenie PAP, zväčšenie 400x.) 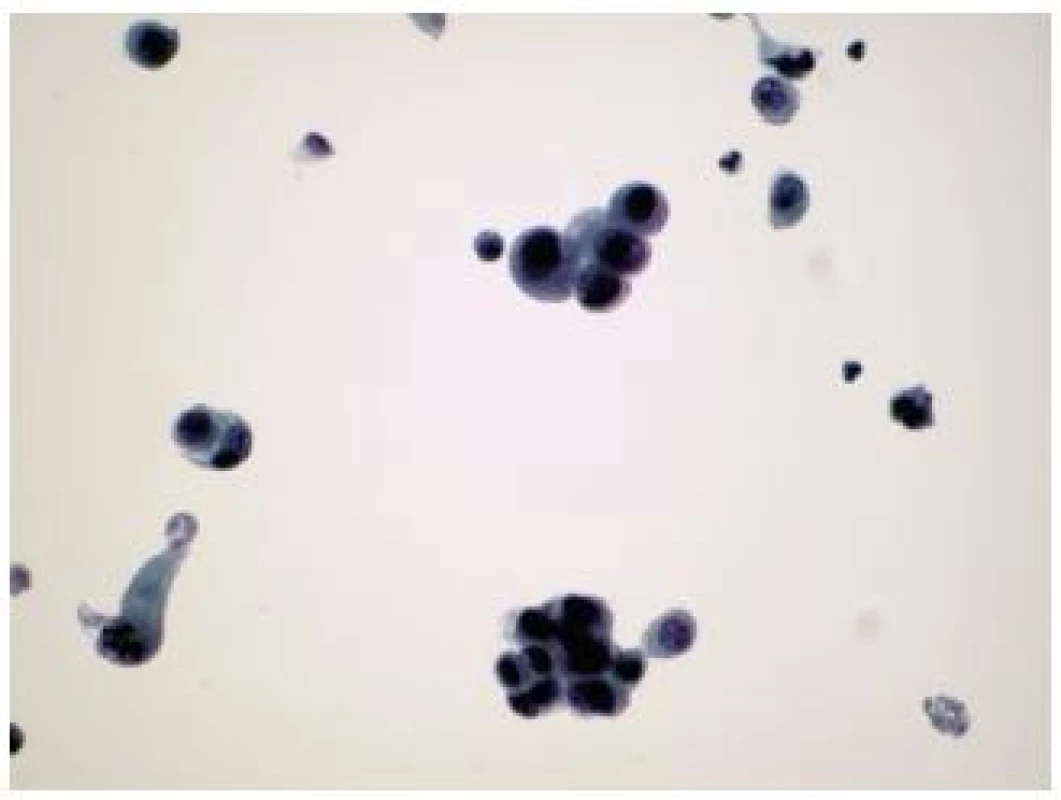
Ďalšou pomocnou metódou je detekcia prítomnosti niektorých reťazcov RNA v cytoplazme urotélií. Detekuje sa prítomnosť (kódujúcej) mRNA - tu patrí aj survivin mRNA (11) a test „uRNA“ detekujúci prítomnosť mRNA reťazcov CDC2, HOXA13, MDK, IGFBP5 (12). Druhou možnosťou je sledovanie microRNA (miRNA). Tá predstavuje zvláštnu triedu molekúl RNA malej dĺžky (približne 20 nukleotidov) s regulačnou funkciou v bunke. Pre prax je výhodný dlhý polčas rozpadu týchto molekúl in vivo a veľká stabilita in vitro (13). Na možnosť detekcie miRNA v uroteliálnych karcinómoch ako prvý upozornil Gottardo v roku 2007 (14). Simonato v roku 2012 ukázal, že aj archívny urocytologický preparát je vhodný pre detekciu miRNA pri splnení podmienky minimálnej celularity (aspoň 5000 buniek v 10 zorných poliach pri zväčšení 40x). Minimálne potrebné množstvo celkovej izolovanej RNA bolo 20 ng (15).
Zatiaľ najnovšou použitou aplikáciou je sekvenovanie celého genómu (Next generation sequencing - NGS) buniek uroteliálneho karcinómu. Nedávno bol takto vyšetrený kompletný histologický materiál 5 uroteliálnych karcinómov (16). Existuje hypotetický potenciál tohoto vyšetrenia aj pre cytologické materiály. Zatiaľ sa však ukázala výrazná intratumorálna heterogenita subpopulácií nádorových buniek. To výrazne sťažuje interpretáciu a zatiaľ nedovoľuje praktickú aplikáciu NGS. Potvrdilo sa, že sekvenovanie celého genómu umožňuje odlíšiť dve skupiny uroteliálnych karcinómov. Prvá skupina sú high-grade karcinómy s mutáciou génu p53, ktorá je asociovaná s ďalšími početnými štrukturálnymi zmenami chromozómov a veľkou mutačnou variabilitou génov. Druhá skupina sú low-grade karcinómy bez mutácie p53, s malou mutačnou variabilitou. Často sa u nich nachádza aktivačná mutácia génov RAS a FGFR3 a iné sporadické štrukturálne zmeny génov (tento poznatok je však starší než metóda Next Generation Sequencing).
Moč odobraný a spracovaný metódou LBC môže prispieť i k etiologickej diagnostike zápalov. Japonskí autori ukázali, že je vhodný na detekciu DNA HPV, Mycoplasma genitalium, Mycoplasma hominis, Ureaplasma parvum a Ureaplasma urealyticum (17).
Vyšetrovanie mRNA, miRNA a sekvenácia celého genómu uroteliálnych buniek generuje obrovské množstvo údajov. Ich selekcia a spracovanie pravdepodobne prinesie určenie skupiny ustálených znakov, ktoré sa oplatí detekovať v cytologickom materiáli. Pravdepodobne vzniknú diagnostické, prípadne prognostické „kity“, podobne ako napríklad pre karcinóm prsníka (Oncotype DX, MammaPrint, Mammostrat). Následne sa zrejme stanoví indikačný algritmus týchto doplnkových vyšetrení. Očakáva sa spresnenie nálezov urologickej cytológie najmä v odlišovaní reaktívnych zmien urotelu a low grade uroteliálnych karcinómov. Pri tejto diferenciálno-diagnostickej rozvahe sú totiž cytopatológovia dodnes často bezradní. Nálezy zostávajú nejednoznačné, alebo zisťujeme veľkú mieru falošnej pozitivity i falošnej negativity. Dobre mienené doporučenia učebníc a atlasov sú napriek všetkej svedomitej detailnosti a prepracovanosti často v konkrétnom prípade nedostačujúce. Novšie vydania dobrých učebníc cytológie moča túto diagnostickú insuficienciu aj úprimne deklarujú (18). Zároveň poukazujú na znaky, ktoré dovoľujú low-grade uroteliálny karcinóm v niektorých priaznivejších prípadoch relatívne spoľahlivo diagnostikovať aj na úrovni cytológie (tab. 2). Vieme, že viac ako 90 % pacientov zomierajúcich na uroteliálny karcinóm sa už iniciálne prezentuje high grade léziou (19). Iniciálne diagnostikovaná low grade uroteliálna lézia progreduje do high grade karicnómu a je napokon príčinou smrti len asi u 5 % pacientov. Význam cytologickej diagnózy low grade uroteliálneho karcinómu spočíva v započatí pravidelného dlhodobého sledovania pacienta. Falošná cytologická pozitivita tak nemá na pacienta negatívny dopad v zmysle neadekvátneho terapeutického výkonu. Falošná negativita však odďaľuje začiatok monitoringu. Naša skúsenosť je, že preparáty pripravené metódou LBC dovoľujú oproti Cytospinovým preparátom lepšie zhodnotiť jadro uroteliálnych buniek. Častejšie je možné spozorovať subtílne zmeny hlavne na úrovni jadra bunky, čo má zásadný diagnostický význam (obr. 3, 4). Ak do diferenciálnej diagnostiky vstúpia Decoy cells – urotélie so sklovitým chromatínom zväčšeného jadra, ktoré je infikované vírusom polyoma BK (obr. 6), potom je význam dobrej vizualizácie ešte zrejmejší. K papilárnym štruktúram je potrebné povedať toľko, že za jedinú významnú morfologickú charakteristiku možno považovať identifikáciu vaskularizovanej strómy (3). Iba ona na úrovni cytológie pomerne spoľahlivo ukazuje na low grade papilárny uroteliálny karcinóm. Papilárny agregát urotélií sám o sebe nemá výpovednú hodnotu. Nutné je hodnotiť celý kontext preparátu (anamnéza, počet a charakter agregátov, cytologické charakteristiky urotélií (tab. 2), „pozadie“, atď.). Je dôležité cielene sa zamerať aj na tzv. Coy cells - jednotlivé izolované atypické urotélie ukrývajúce sa v blízkosti iných diagnosticky nesignifikantných buniek (v gynekologickej cytológii tento popis veľmi dobre zodpovedá tzv. litigation cells – bunkám s potenciálom súdneho sporu. Označujú sa tak preto, lebo sú často prehliadané. Doporučenie cielene ich vyhľadávať možno označiť za ambiciózne, lepšia rada však na úrovni cytologického vyšetrenia neexistuje.) V rámci urologickej cytológie nemožno nespomenúť význam klinických informácií. Údaje o inštrumentálnom výkone, cystolitiáze, lokálnom podaní BCG vakcíny, chemoterapii (thio-TEPA, Mitomycín C, Cyklofosfamid) či o rádioterapii zásadným spôsobom menia uvažovanie cytológa. Podobne, aj ileálny pouch ovplyvňuje cytologický obraz moča. Poskytnuté klinické informácie môžu zásadne zvýšiť výťažnosť vyšetrenia a skrátiť jeho dĺžku.
Tab. 2. Charakteristické cytologické znaky nápomocné pri odlišovaní reaktívneho urotelu od low grade uroteliálneho karcinómu. 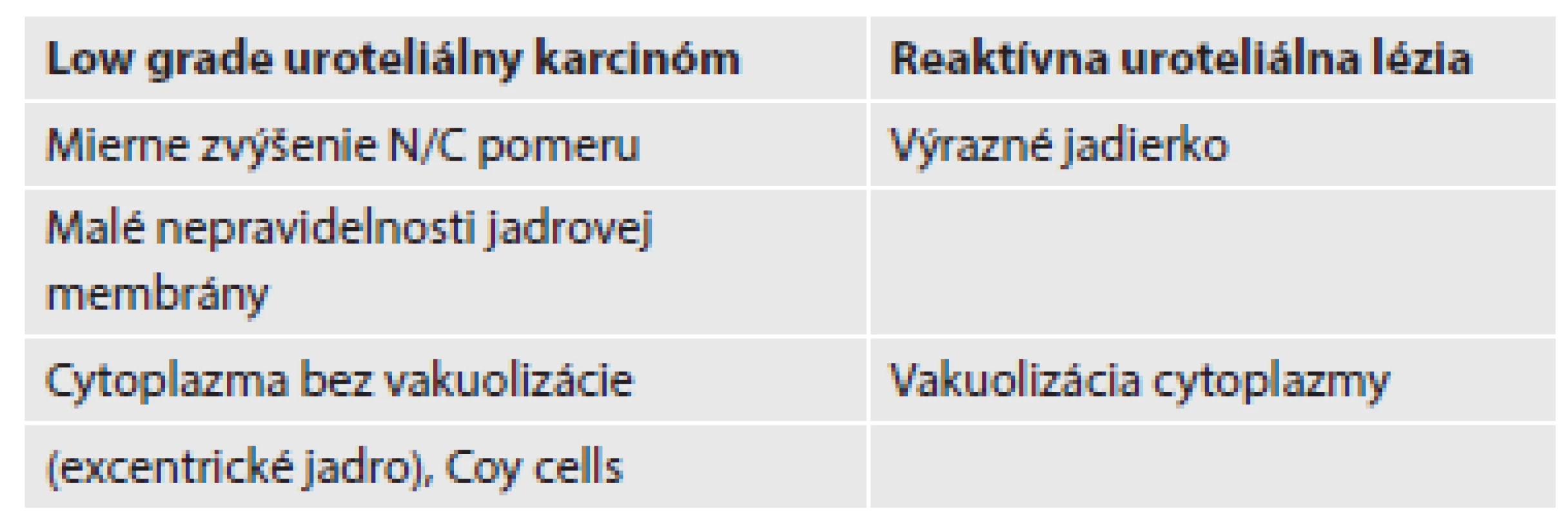
Obr. 6. Bunka spĺňajúca morfologické kritéria pre „Decoy cell“ v moči pacienta s transplantovanou obličkou s imunohistochemicky potvrdenou infekciou vírusom polyoma BK. (Cytospinový preparát, farbenie PAP, zväčšenie 400x.) 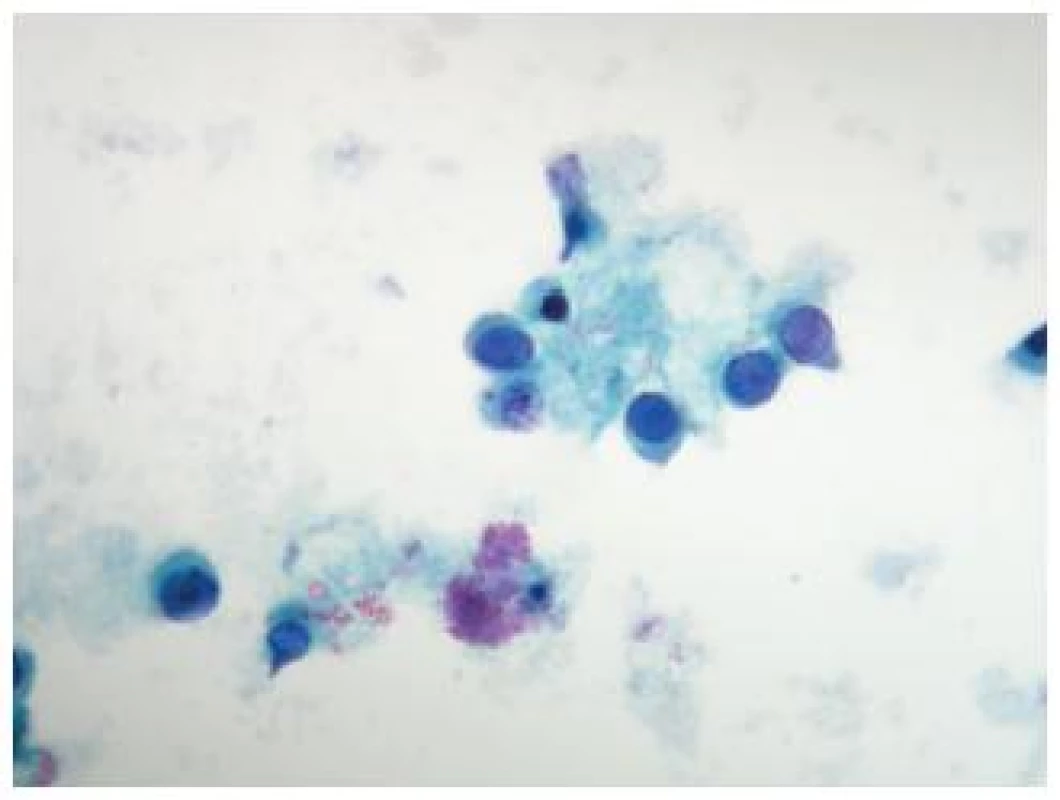
Napriek dobre známym obmedzeniam je urocytológia významným diagnostickým nástrojom, predovšetkým na záchyt high grade urotelových lézií. Pokroky v oblasti spracovania a prípravy cytologického preparátu (LBC) a metódy molekulárnej genetiky (FISH, NGS, analýza mRNA a miRNA) už teoreticky umožňujú (a snáď v blízkej budúcnosti v ešte výraznejšej miere dovolia) presnejšiu diagnostiku v nejednoznačných a cystoskopicky negatívnych prípadoch.
✉ Adresa pro korespondenci:
MUDr. Ondrej Ondič, FIAC
Bioptická laboratoř s.r.o.
Mikulášske nám. 4, 32600 Plzeň
tel: 00420 377 320 667
fax: 00420 377 440 539
email: ondic@medima.cz
Zdroje
1. Papanicolaou GN, Marshall VF. Urine sediment smears as a diagnostic procedure in cancers of the urinary tract. Science 1945; 101(2629): 519-520.
2. Murphy WM, Grignon DJ, Perlman EJ. Tumors of the kidney, bladder, and related urinary structures. AFIP atlas of tumor pathology, series 4. Washington, DC: American Registry of Pathology; 2004 : 241-343.
3. Murphy WM. Current status of urinary cytology in the evaluation of bladder neoplasm. Hum Pathol 1989; 21(9): 886-896.
4. Hainau B, Dombernowsky P. Histology and cell proliferation in human bladder tumors. Cancer 1974; 33 33(1):115-126.
5. Son SM, Koo JH, Choi SY, et al. Evaluation of Urine Cytology in Urothelial Carcinoma Patients: A Comparison of CellprepPlus® Liquid-Based Cytology and Conventional Smear. Korean J Pathol 2012; 46(1): 68-74.
6. Piaton E, Faÿnel J, Hutin K, Ranchin MC, Cottier M. Conventional liquid-based techniques versus Cytyc Thinprep processing of urinary samples: a qualitative approach. BMC Clin Pathol 2005; 5 : 9.
7. Marganski WA, El-Sirgany Costa V, Kilpatrick MW, Tafas T, Yim J, Matthews M. Digitized microscopy in the diagnosis of bladder cancer: analysis of >3000 cases during a 7-month period. Cancer Cytopathol 2011; 119(4): 279-289.
8. Denice Smith G, Sangle NA, Wilson A, et al. A retrospective review of UroVysion fish interpretations over 8.6 years: a major shift in the patient test population. Diagn Cytopathol 2013; 41(5): 437-447.
9. Dimashkieh H, Wolff DJ, Smith TM, Houser PM, Nietert PJ, Yang J. Evaluation of urovysion and cytology for bladder cancer detection: a study of 1835 paired urine samples with clinical and histologic correlation. Cancer Cytopathol 2013; 121(10): 591-597.
10. Gayed BA, Seideman C, Lotan Y. Cost-effectiveness of fluorescence in situ hybridization in patients with atypical cytology for the detection of urothelial carcinoma. J Urol 2013; 190(4): 1181-1186.
11. Eissa S, Badr S, Elhamid SA, Helmy AS, Nour M, Esmat M. The value of combined use of survivin mRNA and matrix metalloproteinase 2 and 9 for bladder cancer detection in voided urine. Disease Markers 2013; 34(1): 57–62.
12. O‘Sullivan P, Sharples K, Dalphin M, et al. A multigene urine test for the detection and stratification of bladder cancer in patients presenting with hematuria. J Urol 2012; 188(3): 741-747.
13. Bartel DP. MicroRNAs: target recognition and regulatory functions. Cell 2009; 136(2): 215–233.
14. Gottardo F, Liu CG, Ferracin M, et al. Micro-RNA profiling in kidney and bladder cancers. Urol Oncol 2007; 25(5): 387–392.
15. Simonato F, Ventura L, Sartori N, et al. Detection of MicroRNAs in archival cytology urine smears. PLoS ONE 2013; 8(2): e57490.
16. Morrison CD, Liu P, Woloszynska-Read A, et al. Whole-genome sequencing identifies genomic heterogeneity at a nucleotide and chromosomal level in bladder cancer. Proc Natl Acad Sci U S A 2014; 111(6): E672-681.
17. Kawaguchi S, Shigehara K, Sasagawa T, et al. Liquid-based urine cytology as a tool for detection of human papillomavirus, Mycoplasma spp. and Ureaplasma spp. in men. J Clin Microbiol 2012; 50(2): 401-406.
18. DeMay R. Art and science of cytopathology (2nd edn). American Society for Clinical Pathology; 2011 : 437.
19. Jordan AM, Weingarten J, Murphy WM. Can biologic potential be predicted from histologic grading? Cancer 1987; 60(11): 2766–2767.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článok vyšiel v časopiseČesko-slovenská patologie

2014 Číslo 4-
Všetky články tohto čísla
- Pokroky v uropatológii
- Za všetkým hľadaj ženu...
- MONITOR aneb nemělo by vám uniknout, že...
- Novinky v patologii prostaty
- Novinky v patologii močového měchýře
- International Society of Urological Pathology (ISUP) Vancouver Classification of Renal Neoplasia 2012
- Postavenie a význam cytológie moča v diagnostike uroteliálnych nádorov
- Izolovaná metastáza do srdce z maligního fyloidního nádoru s osteosarkomatózní diferenciací
- Morfologické a elektrofyziologické změny v srdečních síních zemřelých s fibrilací síní – pilotní studie
- Bartov syndróm asociovaný s epidermolysis bullosa junctionalis a s atréziou pyloru. Nekroptická kazuistika
- Novinky v testování RAS u kolorektálního karcinomu - konsensus z pracovního setkání zástupců referenčních laboratoří
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Postavenie a význam cytológie moča v diagnostike uroteliálnych nádorov
- Bartov syndróm asociovaný s epidermolysis bullosa junctionalis a s atréziou pyloru. Nekroptická kazuistika
- International Society of Urological Pathology (ISUP) Vancouver Classification of Renal Neoplasia 2012
- Novinky v patologii prostaty
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



