-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Morfologické a elektrofyziologické změny v srdečních síních zemřelých s fibrilací síní – pilotní studie
Morphological and electrophysiological changes of the heart atria in necropsy patients with atrial fibrillation – a pilot study
Atrial fibrillation (AF), the most common supraventricular tachycardia, has a morphological base, so called remodelation of atrial myocardium, with its abnormal conduction pattern as a consequence. The remodelation regards electrical, contractile, and structural properties. In this pilot study we attempted to find relations between the myocardial morphological (scarring, amyloidosis, left atrial enlargement) and electrophysiological (ECG characteristics of the P-wave) changes in patients with AF. We examined 40 hearts of necropsy patients – 20 with a history of AF and 20 with no history of AF. Grossly, the heart weight and the size of the left atrium (LA) were evaluated. Histologically, 7 standard sites from the atria were examined. In each specimen, the degree of myocardial scarring and of deposition of isolated atrial amyloid (IAA) were assessed. We failed to show any significant difference in the P-wave pattern between patients with and without AF. Morphologically, however, there were several differences – the patients with AF had significantly heavier hearts, larger left atria, more severely scarred myocardium of the LA and the atrial septum, and more severe deposition of IAA in both atria in comparison to the control group of patients with sinus rhythm. The left atrial distribution of both fibrosis and amyloidosis was irregular. In patients with AF the former was most pronounced in the LA ceiling while the latter in the LA anterior wall. The entire series showed more marked amyloidosis in the left than in the right atrium. An interesting finding was the universal absence of IAA in the sinoatrial node. The knowledge of distribution of atrial myocardial structural changes could be utilized by pathologists in taking specimens for histology and also by cardiologists in targeting the radiofrequency ablation therapy.
Keywords:
atrial fibrillation - isolated atrial amyloid - myocardial scarring - electrocardiographic features.
Autoři: Adéla Matějková; Ivo Šteiner
Působiště autorů: Fingerlandův ústav patologie LF UK a FN, Hradec Králové
Vyšlo v časopise: Čes.-slov. Patol., 50, 2014, No. 4, p. 150-154
Kategorie: Původní práce
Souhrn
Fibrilace síní (FS), nejčastější supraventrikulární tachykardie, je spojována s přestavbou síňového myokardu, která následně vede ke vzniku abnormalit ve vedení vzruchu síněmi. Jedná se o remodelaci na elektrické, kontraktilní a strukturální úrovni. V předkládané pilotní studii jsme se pokusili ozřejmit souvislost mezi morfologickými (jizvení, amyloidóza, zvětšení levé síně) a elektrofyziologickými (EKG charakteristiky P vlny) změnami u pacientů s FS. Makroskopicky a histologicky bylo vyšetřeno 40 srdcí zemřelých pacientů (20 s anamnézou FS, 20 bez anamnézy FS). U všech pacientů začleněných do studie byl k dispozici EKG záznam. Makroskopicky byla hodnocena především hmotnost srdce a velikost levé síně (LS). Histologicky bylo vyšetřeno 7 standardizovaných lokalit z obou srdečních síní. Ve všech vzorcích byla hodnocena tíže jizvení a rozsah depozice izolovaného síňového amyloidu (IAA). Na EKG záznamech byla hodnocena P vlna. Nepodařilo se prokázat významný rozdíl v charakteristikách P vlny mezi pacienty s a bez anamnézy FS. Morfologicky měli pacienti s FS ve srovnání s kontrolní skupinou signifikantně těžší srdce, s objemnější LS, s výrazněji zjizvenou svalovinou LS a mezisíňového septa a se závažnějším postižením obou síní amyloidózou. Distribuce fibrózy i depozit IAA byla v jednotlivých oddílech srdečních síní nerovnoměrná. V LS byla nejtěžší fibróza u pacientů s FS v oblasti stropu, nejvýraznější amyloidóza v oblasti přední stěny. V obou skupinách byla výraznější amyloidóza v levé síni nežli v pravé. Pozoruhodným nálezem byla nepřítomnost IAA v sinoatriálním uzlu převodního systému. Nesouvislé distribuce strukturálních změn myokardu síní by bylo možné využít k určení vhodného místa pro odběr vzorků k histologické diagnostice a přispět by mohla i kardiologům v terapii arytmií, k lepšímu zacílení radiofrekvenční ablace.
Klíčová slova:
fibrilace síní - izolovaný síňový amyloid - jizvení myokardu - elektrokardiografické změny
Fibrilace síní (FS) je nejčastější setrvalá porucha srdečního rytmu patřící mezi supraventrikulární tachykardie. Pacienti s FS mají zřetelně vyšší morbiditu a mortalitu (1). Incidence a prevalence FS stále roste, především v souvislosti s tím, jak stoupá průměrný věk populace a roste výskyt onemocnění, která k rozvoji FS přispívají. Mezi často zmiňované rizikové faktory FS patří – nemoci myokardu, akutní infarkt myokardu, chronická ischemická choroba srdeční, hypertenze, dilatace síní u srdečního selhávání, aortální a mitrální chlopňové vady či obezita. V současnosti je FS postiženo 1 – 2 % populace (2,3).
Spouštění paroxysmů FS je vyvoláváno samovolnými lokálními depolarizacemi, které vycházejí obvykle z oblasti tzv. myokardiálních rukávců plicních žil (MRPŽ) (4). Hlavní mechanismus udržování FS je spatřován v mnohočetných reentry okruzích vznikajících v obou srdečních síních (1,5). Za abnormalitami v síňové depolarizaci a možným rozvojem síňových tachyarytmií stojí přestavba síňového myokardu. Jedná se o remodelaci na elektrické, kontraktilní a strukturální úrovni (6-9). Jednou vzniklá FS následně přispívá k dalšímu rozvoji strukturálních změn v myokardu síní, což bývá dáváno do souvislosti s progresí paroxysmální FS v persistentní či permanentní FS (10). Popisován je také vztah dilatace levé síně k fixaci FS (11).
V rámci strukturální přestavby myokardu síní jsou zmiňovány jednak adaptační změny zahrnující především zvětšení síňových kardiomyocytů a perinukleární kumulaci glykogenu a dále pak častěji popisované degenerativní změny v podobě intersticiální fibrózy, která narušuje vedení vzruchu síněmi a tvoří tak podklad FS. U pacientů s FS je jizvení síní výraznější, zřejmě v souvislosti s vyšší aktivitou renin-angiotenzinového systému a roste se stoupajícím věkem (6,8).
Další strukturální změnou objevující se v srdečních síních se zvyšujícím se věkem je amyloidóza, která může také narušovat vedení vzruchů. Jde o izolovaný síňový amyloid (IAA). Jeho stavební jednotkou je atriální natriuretický peptid (ANP), produkovaný v síňových kardiomyocytech. Ke zvýšení produkce ANP dochází u osob se srdečními chorobami provázenými kardiální insuficiencí. Výskyt IAA, stejně jako četnost srdečních chorob, s věkem dramaticky roste, v deváté dekádě je detekovatelný u více než 90 % osob a pacienti s IAA mají sklony k FS (8,12,13).
Na rozvoji dilatace síní se podílí řada faktorů - poruchy ve struktuře stěny síní (intersticiální fibróza, amyloidóza), porucha kontraktility kardiomyocytů a zvýšené tlaky v síních při chlopňových vadách či srdečním selhávání.
V naší studii jsme se pokusili ozřejmit souvislost mezi morfologickými (jizvení, amyloidóza, dilatace levé síně) a elektrofyziologickými (EKG charakteristiky, zejména P vlna) změnami porovnáním pacientů s FS s kontrolní skupinou bez FS.
MATERIÁL A METODY
V letech 2007 – 2010 bylo v rámci širší studie makroskopicky a histologicky vyšetřeno 40 srdcí zemřelých pacientů pitvaných na Fingerlandově ústavu patologie (FÚP) v Hradci Králové. Podmínkou začlenění do studie byl dostupný EKG záznam provedený krátce před smrtí, maximálně však 3 měsíce starý.
Soubor tvoří dvě hlavní skupiny pacientů: 20 osob s anamnézou fibrilace síní (skupina FS) a 20 osob s prokázaným sinusovým rytmem, dle klinické dokumentace bez anamnézy poruchy srdečního rytmu (skupina SINUS – kontrolní skupina, která je přibližně korelovaná se skupinou FS dle pohlaví a věku). Skupina FS dále zahrnuje dvě podskupiny: 10 osob s FS přítomnou na EKG záznamu (podskupina FSF) a 10 osob s anamnézou FS, kteří však měli na posledním EKG záznamu sinusový rytmus (podskupina FSS).
U každého srdce bylo provedeno standardizované makroskopické vyšetření zahrnující mimo jiné změření levé síně (LS) ve třech rovinách a bližší popis jednotlivých srdečních oddílů včetně chlopní. V dalším hodnocení bylo využíváno hodnoty objemu LS vztaženého k povrchu těla zemřelého. Objem LS byl vypočítáván z rozměrů měřených posmrtně, u fixovaných srdcí, přičemž síň byla před vložením do fixativa vycpána buničinou, která bránila její deformaci.
K histologickému vyšetření bylo odebíráno 7 vzorků ze standardizovaných oblastí srdečních síní, a to po jednom vzorku z oblasti sinoatriálního (SA) uzlu, přední stěny pravé síně (PS), tři vzorky z levé síně – přední stěna, strop, zadní stěna, a dva vzorky z oblasti mezisíňového septa – horní (SSH) a zadní část (SSZ), vždy s rozlišením pravého a levého oddílu septa. Všechny vzorky byly zpracovány běžnou parafínovou technikou; preparáty byly barveny jednak hematoxylin-eozinem, a dále pro hodnocení přítomnosti amyloidu Saturnovou červení (Maldyk) a pro hodnocení rozsahu jizvení metodou elastika – van Gieson. Množství přítomného amyloidu, který měl charakteristické rysy IAA, bylo hodnoceno semikvantitativně stupni 0 - 3 : 0 = nepřítomnost či zcela nepatrné množství amyloidu; 1 = ojedinělá jemná vlákna okolo kardiomyocytů a/nebo drobná depozita v okolí a stěně intramyokardiálních cév; 2 = střední množství amyloidu, četnější depozita v celé tloušťce svaloviny; 3 = hustá síť vláken až solidní ložiska (obr. 1). V případě hodnocení tíže jizvení byly jednotlivé stupně semikvantitativně definovány: 0 = nepřítomnost či nevýznamné množství spíše řidšího vaziva v intersticiu; 1 = lehký stupeň jizvení difuzně či ojedinělá ložiska jizvení; 2 = střední stupeň jizvení difuzně či četnější ložiska jizvení disperzně v celé tloušťce svaloviny (obr. 2); 3 = těžký stupeň jizvení difuzně či objemná depozita fibrózy.
Obr. 1. Přední stěna levé síně s amyloidózou (IAA) 3. stupně; e = endokard (Saturnová červeň, zvětšení 100x). 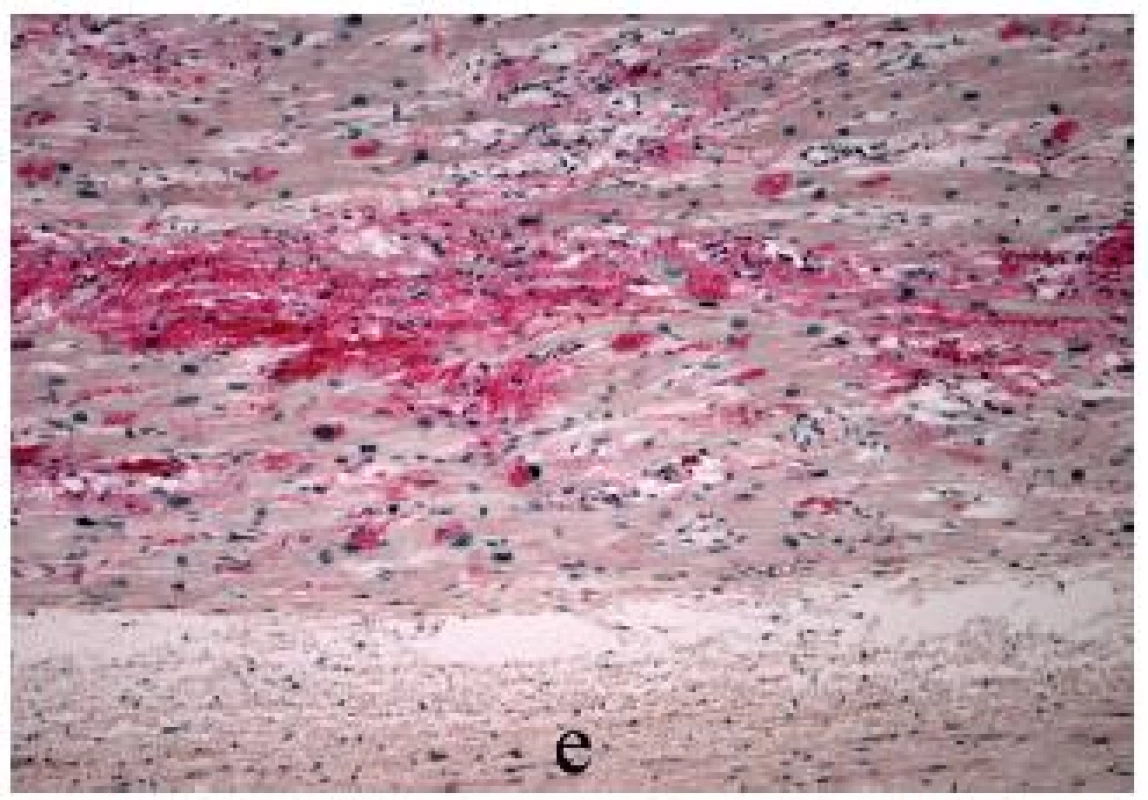
Obr. 2. Přední stěna pravé síně s intersticiální fibrózou 2. stupně (Elastika – van Gieson, zvětšení 200x). 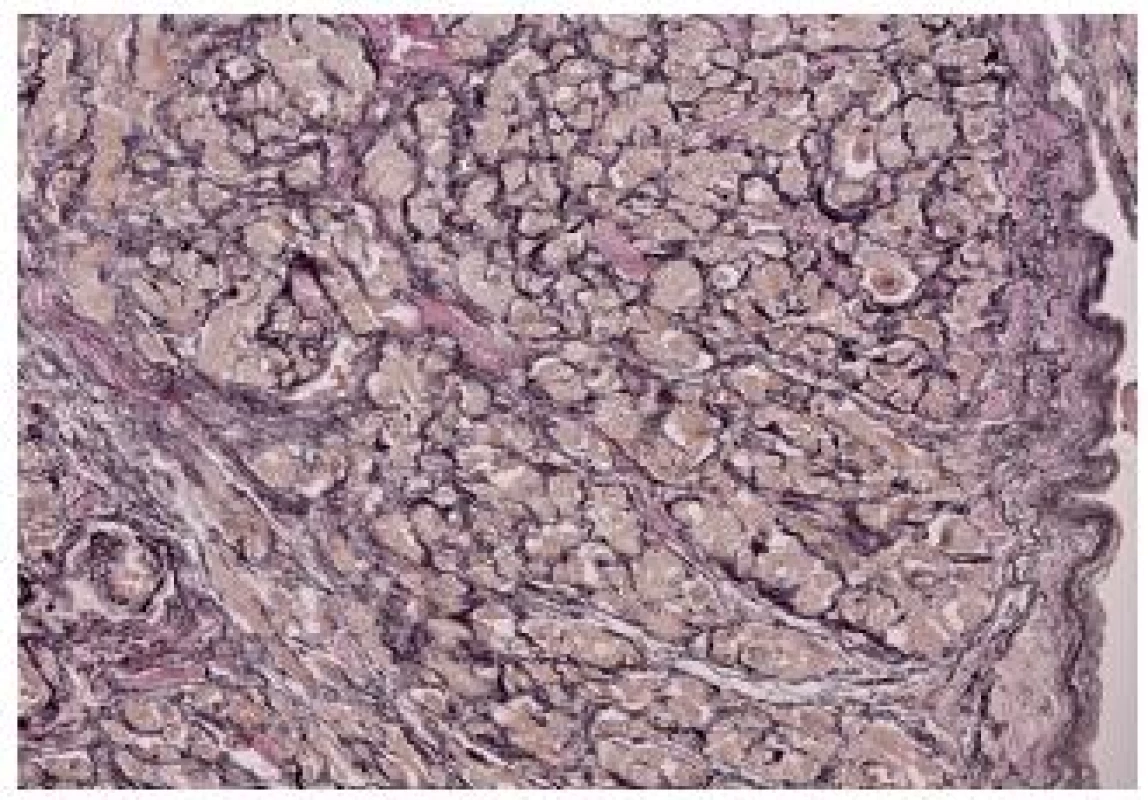
U všech případů byl vyhodnocen záznam standardního 12 svodového EKG. Hodnocení probíhalo pod vedením Vignendra Ariyarajaha, MD (Saint Boniface Hospital, Winnipeg, Man., Kanada). Pro posouzení případných odlišností v elektrokardiografickém záznamu mezi kontrolní skupinou a skupinou fibrilace byla zvlášť vyčleněna podskupina FSS, u které bylo možné posoudit parametry vedení elektrického vzruchu síněmi; na EKG byl u těchto případů přes anamnézu FS zastižen sinusový rytmus. Posuzovány byly následující hodnoty: délka trvání P vlny (Pmax, Pmin), rozptyl P vlny (Pdisp - rozdíl mezi nejširší a nejužší naměřenou hodnotou délky P vlny) a sklon osy P vlny (Paxis).
V rámci porovnání výsledků u jednotlivých skupin pacientů bylo provedeno jednak dvoustranné srovnání skupin FS a kontrolní skupiny SINUS a u parametrů týkajících se EKG záznamů byly porovnávány podskupina FSS a skupina SINUS. Parametry získané makroskopickým hodnocením srdce a histologickou klasifikací tíže jizvení a množství přítomného amyloidu bylo možno porovnat i trojstranně, tj. obě podskupiny FS – FSS a FSF s kontrolní skupinou SINUS, i FSF a FSS mezi sebou navzájem.
Pro statistické zpracování výsledků byl využit program NCSS 9 a Fisherův přesný test. Kvantitativní parametry jsou prezentovány pomocí mediánu s 95% intervalem spolehlivosti pro medián. Pro porovnávání kvantitativních parametrů mezi dvěma hlavními skupinami FS a SINUS byl použit dvouvýběrový t-test a neparametrické testy Mann-Whitney a Kolmogorov-Smirnov. Při porovnávání mezi třemi skupinami - SINUS a podskupinami FS – FSS a FSF byla použita jednovýběrová analýza rozptylu s následným mnohonásobným porovnáním Fisherovým LSD testem případně neparametrická Kruskal-Wallisova ANOVA s post-hoc Dunnovým testem s Bonferroni modifikací. Pro testování kvalitativních, respektive semikvantitativních parametrů (tíže jizvení, rozsah infiltrace amyloidem) byl využit χ2 test nezávislosti v kontingenční tabulce a Fisherův přesný test.
VÝSLEDKY
Skupina FS (20 případů); 11 mužů, 9 žen; medián věku 77 (69 - 84) let, z čehož podskupina FSF (10 případů) měla věkovou skladbu s mediánem 72,5 (67 - 83) let a podskupina FSS (10 případů) 82 (67 - 87) let. Skupina SINUS (20 případů); 7 mužů, 13 žen; 66 (59 - 80) let.
Z morfometrických hodnot byla porovnávána hmotnost srdce a objem LS vztažený k povrchu těla. Objem levé síně bylo možné vypočítat pouze u případů, kde byly změřeny všechny tři na sebe kolmé rozměry síně, což bylo ve skupině SINUS u 13 případů, a ve skupině FS u 14 případů, z toho 9 z podskupiny FSF a 5 z podskupiny FSS.
Při vzájemném porovnání skupin SINUS a FS byl zjištěn signifikantní rozdíl v hmotnosti srdce (p = 0,012), kdy ve skupině FS byla významně těžší srdce, medián 510 (430 - 560) g oproti skupině SINUS, kde byl medián 370 (340 - 450) g. Při porovnání všech tří skupin (SINUS, FSS a FSF) je statisticky významný rozdíl v hmotnosti srdce mezi kontrolní skupinou SINUS a podskupinou FSF, medián 550 (430 - 790) g (p < 0,001).
Statisticky významné rozdíly byly zjištěny také při porovnávání objemu LS vztaženého k povrchu těla, a to jak při vzájemném porovnání dvou hlavních skupin (SINUS, FS; p < 0,001), kdy levá síň je ve skupině FS významně větší (medián 93 (77 - 120) ml) oproti kontrolní skupině SINUS (medián 65 (46 - 80) ml). Při porovnání všech tří skupin (SINUS, FSS, FSF; p < 0,001) byl nejvýraznější rozdíl pozorován mezi kontrolní skupinou SINUS a podskupinou FSF, která měla síně největší (medián 101 (77 - 124) ml).
Při vzájemném porovnávání hodnot získaných z popisu EKG záznamů mezi skupinou SINUS a FSS nebyl nalezen statisticky významný rozdíl v žádném z hodnocených parametrů - Pmax, Pmin, Pdisp, Paxis (tab. 1).
Tab. 1. Hodnocení P vlny. 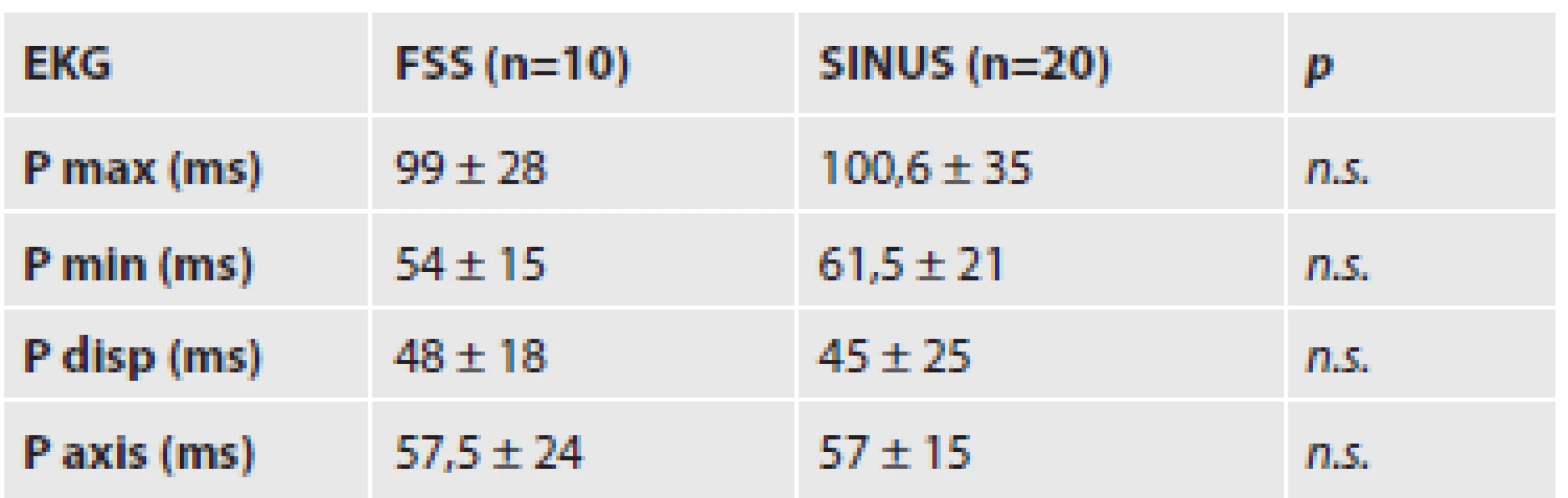
Uvedeny hodnoty průměru ± směrodatná odchylka. n = počet případů; n.s. = bez signifikantního rozdílu Hodnocením tíže jizvení síňového myokardu byl prokázán signifikantní rozdíl při porovnávání skupin SINUS a FS v oblasti stropu a zadní stěny levé síně a v oblasti pravé strany horní části mezisíňového septa, kdy ve skupině FS byla tíže jizvení větší než v kontrolní skupině. Obdobný výsledek byl pozorován i při porovnání tří skupin (SINUS, FSS, FSF), kde byla zřetelně těžší fibróza pozorována u podskupiny FSF. Navíc byl statisticky významný rozdíl v tíži jizvení i na levé straně zadní části mezisíňového septa. V ostatních částech mezisíňového septa byly výsledky na hranici statistické významnosti (tab. 2a).
V závažnosti infiltrace amyloidem byl prokázán signifikantní rozdíl při porovnávání skupin SINUS a FS v oblasti pravé síně a levé strany dorzální části mezisíňového septa. Závažnost postižení byla opět výraznější ve skupině FS. Stejný výsledek přineslo i porovnání tří skupin (SINUS, FSS, FSF), kde byla zřetelně výraznější infiltrace amyloidem pozorována opět u podskupiny FSF. Navíc byl statisticky významný rozdíl v závažnosti infiltrace pozorován i v oblasti zadní stěny levé síně (tab. 2b).
Tab. 2. Tabulka 2. Porovnání morfologických změn mezi dvěma (FS, SINUS) a třemi (FSS, FSF, SINUS) skupinami. a) Tíže jizvení v jednotlivých oddílech srdečních síní. 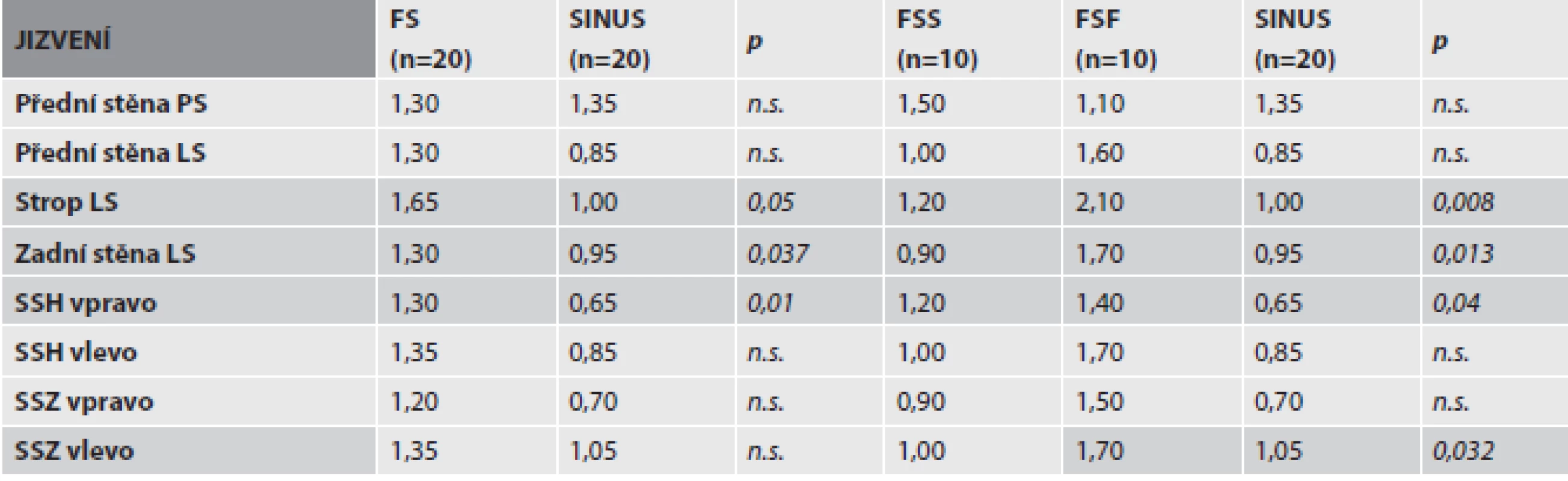
b) Závažnost infiltrace amyloidem v jednotlivých oddílech srdečních síní. 
V tabulkách uvedeny hodnoty průměrné tíže jizvení a závažnosti infiltrace amyloidem příslušných srdečních oddílů. Pro statistické zpracování využit χ2 test nezávislosti v kontingenční tabulce a Fisherův přesný test. Hodnota p ≤ 0,05 stanovena jako statisticky významný rozdíl. n = počet srdcí; n.s. = bez signifikantního rozdílu PS = pravá síň; LS = levá síň; SSH = septum síní horní část; SSZ = septum síní zadní část Ve všech skupinách byl amyloidózou výrazněji postižen myokard LS než PS. Statisticky významný rozdíl byl však pozorován pouze v kontrolní skupině SINUS. Porovnávána byla přední stěna obou síní.
Přímo ve tkáni SA uzlu nebyl amyloid prokázán ani v jediném z vyšetřovaných srdcí napříč jednotlivými skupinami.
V rámci skupin SINUS a FSF bylo provedeno srovnání jednotlivých oblastí LS mezi sebou. V tíži jizvení nebyl nalezen statisticky významný rozdíl ani v jedné z hodnocených skupin. V rozsahu infiltrace amyloidem byla ve skupině SINUS prokázána statisticky významná závislost mezi jednotlivými oddíly (p < 0,001), kdy postižení přední stěny je výraznější než postižení zadní stěny a postižení zadní stěny je výraznější než postižení stropu LS. Ve skupině FSF byl statisticky významný rozdíl pouze mezi přední a zadní stěnou LS, kdy míra postižení přední stěny byla větší než u stěny zadní (p = 0,029).
DISKUZE
Remodelační změny síňového myokardu ovlivňují vedení vzruchu síněmi, což bylo prokázáno v několika mapovacích studiích (5,6). Odchylky ve vedení lze zachytit a diagnostikovat pomocí vyšetření EKG. Röcken et al. (8) popsali, že přítomnost IAA významně prodlužuje délku P vlny a zvyšuje riziko FS. Výsledky práce Ariyarajaha et al. (12), která vznikla ve spolupráci s naším pracovištěm, podporují hypotézu, že síňové arytmie mají souvislost s IAA, a to zejména v případech tzv. high-grade IAA.
V našem souboru pacientů se nepodařilo prokázat významný rozdíl v charakteristikách P vlny na EKG záznamech zemřelých pacientů s a bez anamnézy FS. Zdá se však, že pacienti bez anamnézy FS mají P vlnu poněkud delší, s menším rozptylem hodnot než pacienti s anamnézou FS.
Více jsme se zaměřili na strukturální změny myokardu síní. Prokázali jsme, že zemřelí s FS měli ve srovnání s kontrolní skupinou výrazněji zjizvené síně, s větším množstvím deponovaného amyloidu. Podle očekávání byly tyto změny nejvýraznější u pacientů s chronickou fibrilací síní (podskupina FSF). Tento nález je ve shodě s výsledky recentních studií, které mimo jiné přikládají značný význam jizvení síní při vzniku FS (6). I když při statistickém porovnávání jednotlivých oblastí LS v tíži jizvení nebyl v rámci našich skupin pacientů prokázán signifikantní rozdíl, je možné při srovnání průměrného stupně jizvení příslušných oblastí najít vcelku značné rozdíly. Nejvýrazněji zjizvený byl strop LS, nejméně přední stěna LS, a to napříč všemi skupinami pacientů (tab. 2). Zcela opačné pořadí pak nacházíme při hodnocení rozsahu depozice IAA, kde nejtěžší amyloidóza byla pozorována v přední stěně LS a nejméně postižená byla oblast stropu LS. Rozdíly v distribuci amyloidu v rámci LS byly navíc na statisticky významné úrovni. Tento nález koreluje se zjištěními Röckena (8), který hodnotil přítomnost IAA v chirurgicky resekovaných ouškách PS a prokázal, že u pacientů s FS je četnost i rozsah depozice IAA vyšší ve srovnání s pacienty se sinusovým rytmem. Navíc i v jeho souboru množství amyloidu inverzně korelovalo se stupněm přítomné intersticiální fibrózy. Nerovnoměrnou distribuci IAA v LS a inverzní vztah mezi amyloidózou a jizvením popsali i Šteiner et al. (9,14) ve studii, která vyšetřovala sto nekroptických srdcí, na kterou tato pilotní studie částečně navazuje. Ve shodě s našimi nálezy byl i v jejich souboru rozsah amyloidózy nejvýraznější v přední stěně LS, která byla porovnávána se stěnou zadní a levým ouškem. Současně s tím popsali těžší amyloidózu u osob s anamnézou FS.
V našem souboru byl dále pozorován rozdíl v depozici amyloidu v síňovém myokardu mezi LS a PS. Rozsah postižení LS byl výraznější. Ke stejnému závěru dospěli i Šteiner (9) a Leone (15), který na souboru 72 pacientů s chronickou FS a kontrolní skupině 52 pacientů se sinusovým rytmem vyšetřoval ouška obou síní a prokázal, že amyloidóza je četnější a těžší v oušku LS.
Především v souvislosti s přechodem paroxysmální FS v persistentní či permanentní formu je v řadě studií pozornost soustředěna na sledování dilatace LS. Jedná se především o studie klinické, kde jsou jednotlivé rozměry či objem LS měřeny pomocí ultrazvuku, magnetické rezonance či CT vyšetření. Kerr et al. (16) sledovali soubor 757 pacientů s paroxysmální FS a prokázali, že zvětšení LS je nezávislým rizikovým faktorem vedoucím k progresi FS v chronickou formu. Ke stejnému závěru dospěli i Pillarisetti et al. (10), kteří na souboru 437 pacientů prokázali, že u pacientů se zvětšenou LS a přítomnou chlopňovou vadou lze předpokládat fixaci paroxysmální FS. Ke zvětšování LS dochází také se stoupajícím věkem, což samo o sobě není možno ovlivnit, ale je možné včas efektivně řešit onemocnění, která jsou řazena mezi stavy, které k dilataci LS přímo či nepřímo vedou. Jedná se zejména o efektivní léčbu hypertenze, diastolické dysfunkce či mitrálních a aortálních chlopňových vad. V našem souboru byla dilatace LS měřena posmrtně, po předchozí fixaci srdce. Hodnoty takto získaných objemů jsou jistě odlišné od skutečných objemů síní, pokud by tyto byly měřeny za života pacienta. Jelikož však zpracování srdcí a vlastní měření probíhalo standardizovaně, domníváme se, že je možno získanou hodnotu „posmrtného objemu“ použít k vzájemnému porovnávání jednotlivých případů. Pro zpřesnění výsledků byl navíc použit přepočet objemu LS k povrchu těla zemřelého vypočítaný dle DuBoise. Obdobný přepočet bývá využíván při určování velikosti LS v rámci ultrazvukového vyšetření srdce (17). V našem souboru měli pacienti s FS levé síně významně větší ve srovnání s kontrolní skupinou bez FS. Rozdíl byl patrný i mezi pacienty s chronickou fibrilací, kteří měli LS největší a pacienty s FS v anamnéze, bez FS na posledním EKG záznamu. Tyto nálezy korelují s výše uvedenými závěry klinických studií.
Limitem této pilotní studie je relativně malý počet hodnocených případů. Do širší studie však bude zařazen více než dvojnásobek srdcí. Další limitací je poněkud vyšší věk pacientů v podskupině FSS, který zvyšoval střední věk celé skupiny FS. Nejvýznamnější rozdíly však byly shledávány mezi podskupinou FSF a kontrolní skupinou SINUS, které se věkovým zastoupením příliš nelišily. Ve finální studii bude brán na přesnější korelaci skupin dle věku větší ohled.
ZÁVĚR
Lze tedy shrnout, že zemřelí pacienti s anamnézou FS měli ve srovnání s pacienty se sinusovým rytmem významně těžší srdce, s objemnější levou síní, s výrazněji zjizvenou svalovinou levé síně a mezisíňového septa a se závažnějším postižením obou síní amyloidózou. Nejvýraznější změny byly u pacientů s FS i na posledním EKG. Při porovnání jednotlivých oddílů LS bylo nejvíce amyloidu nalezeno v přední stěně, o něco méně v zadní stěně a nejméně ve stropu.
Pozoruhodným nálezem je nepřítomnost amyloidu v SA uzlu.
Vzhledem k tomu, že se výrazně zlepšila znalost o patofyziologii FS, která s sebou přinesla větší zájem o histopatologický podklad této choroby a mapování jeho souvislosti s elektrofyziologickými následky, už není na FS nahlíženo jako na čistě funkční onemocnění. Ve snaze zefektivnit prevenci a léčbu FS je více pozornosti soustředěno na strukturální změny histologické povahy, které se velmi významně účastní procesu vzniku, udržování a fixace FS. V prevenci zvětšení LS a potažmo fixace FS je zmiňována časná radiofrekvenční ablace a efektivní léčba srdečních onemocnění vedoucích k rozvoji dilatace LS či hypertenze. Rozvoj intersticiální fibrózy je možné ovlivnit podáváním ACE inhibitorů. Poněkud komplikovaná je problematika amyloidózy. Depozice IAA je totiž strukturální změnou, která je nevratná. Přítomnost amyloidu zvyšuje náchylnost k FS. FS následně podporuje další tvorbu a ukládání amyloidových depozit, čímž dochází k zacyklení celého stavu.
Z námi zjištěné distribuce strukturálních změn v LS lze patologům doporučit jako nejvhodnější oblast k vyšetřování případné přítomnosti IAA přední stěnu LS, kde byla intenzita postižení napříč skupinami nejvýraznější. Z klinického hlediska by naše výsledky mohly přispět i kardiologům v terapii arytmií k lepšímu zacílení radiofrekvenční ablace, a též k určení vhodného místa pro odběr vzorků k histologické diagnostice.
PODĚKOVÁNÍ
Autoři jsou vděční Vignendrovi Ariyarajahovi, MD za vyhodnocení EKG záznamů a RNDr. Evě Čermákové za statistické zpracování dat.
Studie byla podpořena grantem BBMRI LM2010004, programem PRVOUK P37/11 a projektem Specifického vysokoškolského výzkumu 266902.
✉ Adresa pro korespondenci:
MUDr. Adéla Matějková
Fingerlandův ústav patologie
Fakultní nemocnice
Sokolská 581, 50005 Hradec Králové
tel: 495 832 611
fax: 495 832 004
email: adela.matejkova@gmail.com
Zdroje
1. Lukl L. Fibrilace síní. Doporučené postupy pro praktické lékaře. Česká lékařská společnost JEP, www.cls.cz. 2001.
2. Piccini JP, Hammill BG, Sinner MF, et al. Incidence and prevalence of atrial fibrillation and associated mortality among medicare beneficiaries: 1993-2007. Circ Cardiovasc Qual Outcomes 2012; 5 : 85-93.
3. Čihák R. Co nového přinášejí guidelines 2010 pro léčbu pacientů s fibrilací síní? Kardiol Rev 2010; 12(4): 187-191.
4. Haissaguerre M, Jaiss P, Shah DC, et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med 1998; 339 : 659-666.
5. Eckstein J, Verheule S, de Groot N, Allessie M, Schotten U. Mechanisms of perpetuation of atrial fibrillation in chronically dilated atria. Prog Biophys Mol Biol 2008; 97 : 435-451.
6. Allesie M, Ausma J, Schotten U. Electrical, contractile and structural remodeling during atrial fibrillation. Cardiovasc Res 2002; 12 : 230-246.
7. Ausma J, Wijffels M, Thone F, Wouters L, Allessie M, Borgers M. Structural changes of atrial myocardium due to sustained atrial fibrillation in goat. Circulation 1997; 96 : 3157-3163.
8. Röcken C, Peters B, Juenemann G, et al. Atrial amyloidosis: an arrhytmogenic substrate for persistent atrial fibrillation. Circulation 2002; 106 : 2091-2097.
9. Šteiner I, Hájková P. Patterns of isolated atrial amyloid: A study of 100 hearts on autopsy. Cardiovasc Pathol 2006; 15 : 287-290.
10. Pillarisetti J, Patel A, Boc K, et al. Evolution of paroxysmal atrial fibrillation to persistent or permanent atrial fibrillation: predictors of progression. J Atr Fibrillation 2009; 1(7): 388-394.
11. Cui Q, Zhang W, Wang H, et al. Left and right atrial size and the occurrence predictors in patients with paroxysmal atrial fibrillation. Int J Cardiol 2008; 130 : 69-71.
12. Ariyarajah V, Steiner I, Hajkova P, et al. The association of atrial tachyarrhytmias with isolated atrial amyloid disease: preliminary observations in autopsied heart specimens. Cardiology 2009; 113 : 132-137.
13. Westermark P, Johansson B, Natvig JB. Senile cardiac amyloidosis: evidence of two different amyloid substances in the ageing heart. Scand J Immunol 1979; 10 : 303-308.
14. Šteiner I, Hájková P, Kvasnička J, Kholová I. Plicní žíly a fibrilace síní - studie 100 srdcí. Cesk Patol 2005; 41(4): 124-131.
15. Leone O, Boriani G, Chiappini B et al. Amyloid deposition as a cause of remodelling in persistent valvular atrial fibrillation. Eur Heart J 2004; 25 : 1237-1241.
16. Kerr ChR, Humphries KH, Talajic M et al. Progression to chronic atrial fibrillation after the initial diagnosis of paroxysmal atrial fibrillation: Results from Canadian Registry of Atrial Fibrillation. Am Heart J 2005; 149(3): 489-496.
17. Marchese P, Bursi F, Donne GD, et al. Indexed left atrial volume predicts the recurrence of non-valvular atrial fibrillation after successful cardioversion. Eur J Echocardiogr 2011; 12 : 214-221.
Štítky
Patológia Súdne lekárstvo Toxikológia
Článok vyšiel v časopiseČesko-slovenská patologie

2014 Číslo 4-
Všetky články tohto čísla
- Pokroky v uropatológii
- Za všetkým hľadaj ženu...
- MONITOR aneb nemělo by vám uniknout, že...
- Novinky v patologii prostaty
- Novinky v patologii močového měchýře
- International Society of Urological Pathology (ISUP) Vancouver Classification of Renal Neoplasia 2012
- Postavenie a význam cytológie moča v diagnostike uroteliálnych nádorov
- Izolovaná metastáza do srdce z maligního fyloidního nádoru s osteosarkomatózní diferenciací
- Morfologické a elektrofyziologické změny v srdečních síních zemřelých s fibrilací síní – pilotní studie
- Bartov syndróm asociovaný s epidermolysis bullosa junctionalis a s atréziou pyloru. Nekroptická kazuistika
- Novinky v testování RAS u kolorektálního karcinomu - konsensus z pracovního setkání zástupců referenčních laboratoří
- Česko-slovenská patologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Postavenie a význam cytológie moča v diagnostike uroteliálnych nádorov
- Bartov syndróm asociovaný s epidermolysis bullosa junctionalis a s atréziou pyloru. Nekroptická kazuistika
- International Society of Urological Pathology (ISUP) Vancouver Classification of Renal Neoplasia 2012
- Novinky v patologii prostaty
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



