-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Téma č. 11 – DĚTSKÁ HEMATOLOGIE A ONKOLOGIE
Vyšlo v časopise: Čes-slov Pediat 2008; 63 (7-8): 417-424.
HEMANGIOM – NEJČASTĚJŠÍ BENIGNÍ NÁDOR DĚTSKÉHO VĚKU
Ganevová M.
Klinika dětské hematologie a onkologie, FN Motol, Praha
Vzhledem k četnosti výskytu kožních hemangiomů u dětí raného věku je cílem našeho sdělení podat jejich stručnou charakteristiku.
Po zhodnocení souboru dětských pacientů s hemangiomatózou z let 2000–2007, kdy bylo ročně vyšetřeno v průměru 70 nových pacientů, z nichž více než dvě třetiny byly pouze celkově vyšetřeny a dále sledovány v rámci dispenzarizace na onkologické ambulanci Kliniky dětské hematologie a onkologie (KDHO), resp. na jiné ze specializovaných ambulanci FN Motol v Praze. V průběhu sledování byl pak podle dynamiky růstu hemangiomu doporučen další postup – konzervativní se sledováním v případě nerizikové lokalizace, kdy povrch hemangiomu je intaktní, nehrozí mechanické poškození ani traumatizace s krvácením a infekcí. Pokud je zvažováno chirurgické ošetření, zůstává dítě v péči stomatochirurgické, ORL, NCH, resp. chirurgické ambulance, zabývající se ošetřením laserem.
Za nejvíce rizikovou lokalizaci hemangiomu považujeme oblast orofaciální, která vyžaduje doplnění kompletních zobrazovacích vyšetření (MRI, resp. CT), vzhledem k věku dítěte v celkové anestezii při krátkodobé hospitalizaci na naší klinice, kdy jsou rodiče podrobně informováni o plánovaném léčebném postupu.
Pokud je indikována systémová léčba – p.o. Prednisonem nebo interferonem, její zahájení probíhá při hospitalizaci a další průběžné sledování klinického stavu dítěte a kontrolní náběry jsou prováděny u praktického lékaře (PLDD).
Pravidelné kontroly naší ambulancí 1krát za 4–6 týdnů u dětí po dobu celé léčby, kdy jsou prováděna kontrolní zobrazovací vyšetření UZ, MRI a konsiliární kardiologické a ECHO vyšetření včetně neurologického pro možnost progrese neurologických poruch chování, spánku, hyperaktivity apod.
V péči naší ambulance zůstávají děti po ukončené léčbě nejméně po dobu 6–12 měsíců, pokud není doplněno kompletní očkování, protože vakcinace je v průběhu léčby přerušena a její doplnění je zahájeno až po podrobném imunologickém vyšetření ve spolupráci s ÚSOL, očkovací ambulancí FNM.
Podle našich zkušeností předkládáme pediatrické veřejnosti návrhy a pokyny ke screeningu a vyšetřovacímu schématu k vyloučení orgánového postižení.
Informace a následující pokyny by měly být závazné zejména pro zdravotnickou, ale i laickou veřejnost. Hlavním cílem je sledování dynamiky růstu hemangiomu podrobnou fotodokumentací. Pokud není prokázáno orgánové postižení, je vhodné další sledování dítěte ve specializované kožní ambulanci a u praktického lékaře.
VYUŽITÍ POZITRONOVÉ EMISNÍ TOMOGRAFIE V DĚTSKÉ ONKOLOGII
Kabíčková E.1, Votrubová J.2, Sumerauer D.1, Drahokoupilová E.1, Cyprová S.1, Kynčl M.3, Bělohlávek O.2, Starý J.1
1Klinika dětské hematologie a onkologie UK 2. LF a FN Motol, Praha
2PET centrum Nemocnice Na Homolce, Praha
3Klinika zobrazovacích metod UK 2. LF a FN Motol, Praha
Úvod: Pozitronová emisní tomografie (PET) je moderní vyšetřovací metoda, která se v klinické praxi používá od poloviny 90. let. Využívá deoxyglukózu značenou radioaktivním fluorem (FDG), která se hromadí v metabolicky aktivní nádorové tkáni. FDG-PET umožňuje funkční vyšetření metabolismu nádorových buněk, má vyšší senzitivitu než běžně používaná CT a MRI vyšetření. Zkušeností s FDG-PET vyšetření u dětských onkologických pacientů je méně než u pacientů dospělých, význam FDG-PET v diagnostice a léčbě dětských nádorů zatím definován nebyl. Příčinou je především nízká incidence dětských nádorů.
Metody: V klinické praxi se PET nejčastěji zařazuje do vyšetřovacího schématu dětí s maligními lymfomy, sarkomy kostí a měkkých tkání. Nálezy PET vyšetření vždy porovnáváme s výsledky konvenčních zobrazovacích metod, dostupnými histologickými nálezy a klinickým průběhem onemocnění.
Výsledky: Spolupráci s PET centrem Nemocnice Na Homolce jsme zahájili v roce 2001. Za dobu spolupráce jsme provedli 650 PET nebo PET/CT vyšetření u dětí s nádorovým onemocněním. Většina zhoubných nádorů dětí a dospívajících velmi výrazně akumuluje FDG. Vysoký kontrast nádoru vůči pozadí umožňuje zobrazit nádory od cca 5 mm v průměru.
FDG-PET v dětské onkologii lze využít k určení lokalizace neznámého primárního nádoru, k upřesnění biologické povahy známého nádoru, k přesnému stanovení rozsahu onemocnění před zahájením léčby a k monitorování efektu podané protinádorové léčby. Dále lze pomocí FDG-PET zhodnotit charakter poléčebného rezidua a včasně odhalit recidivu nádorového onemocnění. Výhodou pro dětské pacienty je i možnost celotělového zobrazení při jednom vyšetření.
Závěr: Zařazení FDG-PET do algoritmu vyšetření dětských onkologických pacientů umožní přesnější stanovení rozsahu onemocnění před léčbou a neinvazivní hodnocení léčebné odpovědi, které má mimořádný význam při rozhodování o dalším léčebném postupu. Monitorování úspěšnosti léčby s využitím PET umožní snížit toxicitu léčby u dětí s příznivým průběhem a naopak intenzifikovat léčbu u pacientů vysoce rizikových a dále zlepšit léčebné výsledky.
Podpořeno výzkumnými záměry MZ 000064203.
EPIDEMIOLÓGIA A PROGNÓZA MALIGNÍT U DETÍ A MLADISTVÝCH V SLOVENSKEJ REPUBLIKE
Kaiserová E.1, Bubanská E.2, Stančoková T.2, Oravkinová I.3, Kolenová A.1, Hrašková A.1
1Detská onkologická klinika LFUK a DFNsP, Bratislava, Slovenská republika
2Klinika detskej onkológie a hematológie DFNsP, Banská Bystrica, Slovenská republika
3Oddelenie detskej onkológie a hematológie FNsP, Košice, Slovenská republika
Úvod: Incidencia nádorov u detí nemá taký výrazný vzostupný trend ako u dospelých. Výskyt jednotlivých nádorov je odlišný medzi rasami a medzi rôzne vyvinutými krajinami. V rozvinutých krajinách sa dosahuje 5-ročné prežívanie u viac ako 75 % detí.
Materiál a metódy: Vyhodnotili sme incidenciu malignít u detí a mladistvých v Slovenskej republike (SR) podľa údajov Národného onkologického registra a výsledky liečby k 31. 12. 2007 u detí a mladistvých do 18. roku života, liečených v detských onkocentrách v rokoch 2000–2006.
Výsledky: V rokoch 1970–1979 bola v SR priemerná ročná incidencia malignít 122,2, v rokoch 1980–1989 bola 125,6 na 1 milión detí do 15. roka života. V rokoch 1991–2002 kolísala v rozmedzí 115,2–143 na 1 milión 0–14-ročných a 156–196 na 1 milión 15–19-ročných; mierne stúpajúci trend ukázala len po 15. roku života. V rokoch 2000–2006 sa liečilo v detských onkocentrách 1165 chorých do 18. roku života. Najčastejšie boli leukémie, nádory CNS a lymfómy, ktoré spolu tvorili dve tretiny všetkých malignít. Pravdepodobnosť 8-ročného OS bola 0,74 a EFS 0,67. Prežívanie nad 70 % bolo pri akútnej lymfoblastovej leukémii, Hodgkinovom a nehodgkinovom lymfóme, Wilmsovom nádore, neuroblastóme a germinálnych nádoroch. Zlé výsledky s prežívaním ≤50 % boli pri akútnej myeloblastovej leukémii a nádoroch pečene.
Záver: Incidencia malignít u detí bola stabilná v rokoch 1991–2002, mierne sa zvýšila v porovnaní s desaťročím 1970–1979. Prognóza sa významne zlepšila pri všetkých diagnózach oproti údajom zo štúdie EUROCARE 3 z rokov 1990–1994, kedy sa u detí v SR dosahovalo celkové prežívanie len 63 %. Výsledky sú porovnateľné s Klinikou detskej onkológie v Prahe, so 7-ročným prežívaním 74 % detí liečených v rokoch 1996–2000.
MIKROCYTÁRNÍ ANÉMIE – JE VŽDY PŘÍČINOU POUZE NEDOSTATEČNÝ PŘÍJEM ŽELEZA?
Smíšek P.1, Suková M.1, Vávra V.1, Svobodová T.2, Vodičková E.3, Starý J.1
1Klinika dětské hematologie a onkologie FN Motol, Praha
2Pediatrická klinika FN Motol, Praha
3Oddělení klinické hematologie FN Motol, Praha
Anémie je jedna z nejrozšířenějších chorob vůbec. V dětském věku se nejčastěji setkáváme s anémií mikrocytární. Její příčinou je ve většině případů nedostatek železa. Sideropenie vzniká z nepoměru mezi příjmem železa potravou (často nedostatečným) a současně jeho zvýšenými potřebami pro rostoucí organismus. Incidence sideropenické anémie je nejvyšší v kojeneckém věku, zejména u nedonošených dětí, a dále v období puberty. Při zahajování léčby mikrocytární anémie preparáty železa je v diferenciální diagnostice třeba pamatovat i na závažnější, méně často se vyskytující onemocnění, která mohou být příčinou tohoto nálezu. Patří k nim v první řadě zvýšené déletrvající ztráty železa, nejčastěji při gynekologickém krvácení. Další velmi častou příčinou anémie jsou onemocnění zažívacího traktu – nespecifické střevní záněty, malabsorpce, chronické infekce (např. Helicobacter pylori). Krevní ztráty mohou provázet i onemocnění uropoetického a respiračního traktu. Mikrocytární anémii můžeme nalézt také u dlouhodobě probíhajících závažných onemocnění, např. u recidivujících infekcí, imunodeficiencí, autoimunních onemocnění, hepatopatií či endokrinopatií. Připomenout je třeba také talasemii, i když s touto nemocí se v naší republice setkáváme jen vzácně.
Problematika diferenciální diagnostiky mikrocytární anémie je ilustrována několika kazuistikami pacientů s tímto symptomem.
Podporováno VZ FNM 00064203.
VÝZNAM ČASNÉ DIAGNOSTIKY DĚTSKÝCH NÁDOROVÝCH ONEMOCNĚNÍ
Štěrba J.
Klinika dětské onkologie FN Brno a LF MU
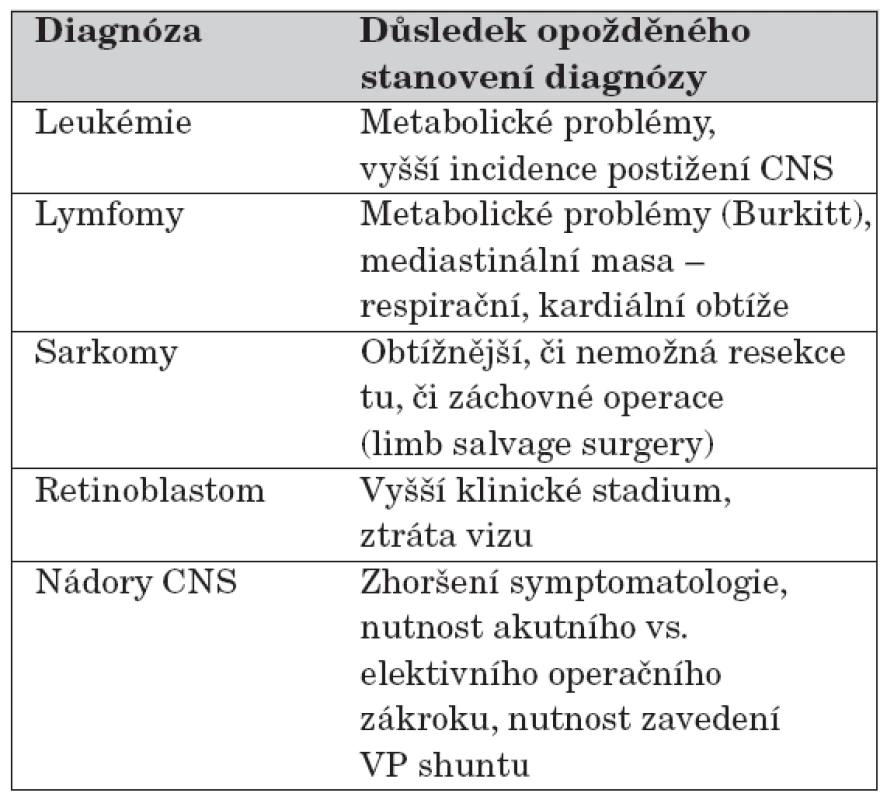
Nádorová onemocnění u dětí jsou ve srovnání s dospělými relativně vzácná, ve věkové skupině 0–14 let onemocní zhoubným nádorem každý rok 1 ze 7000 dětí. V ČR je tedy každý rok diagnostikováno cca 350 dětí a mladistvých s novým maligním onemocněním. Navzdory významným pokrokům v terapii a relativně nízké incidenci zůstávají nádorová onemocnění u dětí hlavní příčinou úmrtí mezi nemocemi. Pro asi 20 % dětí se zhoubným onemocněním jsou i dnešní léčebné postupy suboptimální, a každé páté dítě svému onemocnění dříve nebo později podlehne. Každý tisící mladý dospělý je dnes ve vyspělých zemích vyléčeným pediatricko-onkologickým pacientem, avšak téměř jedna třetina z nich má po onkologické léčbě klinicky významné pozdní následky. Časná diagnóza maligního onemocnění u dítěte zvyšuje jak jeho celkovou šanci na vyléčení, tak snižuje i intenzitu léčby potřebnou k vyléčení, a tím i toxicitu nezbytné léčby (tab.).
Diagnostika časných stadií maligních onemocnění je u dětí velmi obtížná, protože příznaky jsou relativně nespecifické a připomínají jiná, mnohem častější onemocnění dětského věku. Příznaky, které patří k běžným, nenádorovým onemocněním dětského věku, avšak mohou být projevem i maligního onemocnění, jsou především: celková slabost, únavnost, horečka, lymfadenopatie, anémie, bolesti kostí, kloubů, bolesti hlavy, zvracení, křeče, hematurie, hepatomegalie a splenomegalie. U těchto příznaků je oprávněný pravděpodobnostní přístup a nádorovou příčinu je zapotřebí zvažovat především tam, kde obvyklé příznaky neodpoví na obvyklou léčbu v obvyklý čas. Existují však i příznaky relativně vzácné, jako ataxie, známky postižení hlavových nervů, palpovatelné, či viditelné zduření (masa), či leukokorie. Tyto příznaky by již od počátku měly vzbuzovat obavy z eventuální neoplastické příčiny obtíží a mělo by být zváženo časné odeslání dítěte na specializované pediatricko-onkologické pracoviště.
DĚTSKÁ AKUTNÍ LYMFOBLASTICKÁ LEUKÉMIE – CO VÍME O VZNIKU A VÝVOJI LEUKEMICKÉHO KLONU
Trka J.
CLIP – Childhood Leukaemia Investigation Prague, Klinika dětské hematologie a onkologie UK 2. LF a FN Motol, Praha
Dětské akutní lymfoblastické leukémie (ALL) vznikají několikanásobným zásahem do genomu buňky, která dává vznik lymfocytární řadě. Série těchto zásahů vede k maligní transformaci buňky a vzniku klonu maligních leukemických buněk.
Je známo, že minimálně u určitých genetických subtypů (např. ALL s přestavbou genu MLL, s hybridním genem TEL/AML1, hyperdiploidních) dochází k prvnímu zásahu v době prenatálního vývoje plodu. Děti se tak rodí s detekovatelným preleukemickým klonem – nemoc však později postihne jen přibližně jedno procento z nich. Další zásah(y) v průběhu postnatálního života (typicky ve věku 2–6 let, kdy diagnostikujeme většinu dětských ALL) pak vedou ke spuštění kompletní maligní transformace a vzniku leukémie. Výzkumy na dvojčatech, z nichž alespoň jedno onemocnělo ALL, a případech sekundárních či následných ALL dokazují, že preleukemický klon nevzniká vždy přímo z lymfoidního prekurzoru. Primárně postiženou může být v hierarchii hemopoézy výše postavená buňka, tzv. leukemická kmenová buňka. Fakt, že tato buňka má specifické a od majoritního klonu odlišné genetické i imunologické vlastnosti, má velký význam pro poznání okolností vzniku leukemického klonu a potenciálně léčbu leukémie.
POSTERY
OSTEONEKRÓZA JAKO KOMPLIKACE LÉČBY AKUTNÍ LYMFOBLASTICKÉ LEUKÉMIE (ALL) U DĚTÍ
Khun T.1, Ptoszková H.1, Blažek B.1, Matuška V.2
1Klinika dětského lékařství, oddělení hematologie a hematoonkologie FN Ostrava
2Ortopedická klinika FN Ostrava
Netraumatická avaskulární nekróza kosti – osteonekróza (ON) je dobře známá komplikace glukokortikoidní terapie imunologických a maligních onemocnění. Patří k významným pozdním komplikacím léčby leukémie a lymfomů u dětí, projevuje se bolestí, ztrátou funkce až destrukcí a kolapsem kloubu. Může však také zůstat asymptomatická a nepůsobit žádné potíže.
Diagnóza je postavena na klinickém obraze a zobrazovacích metodách (prostý rentgenový snímek (rtg), vyšetření magnetickou rezonancí (MRI), počítačovou tomografií (CT), ev. scintigrafie skeletu).
Léčba ON je konzervativní nebo chirurgická. První přístup zahrnuje především odlehčení postižených kloubů, fyzikální terapii, nesteroidní antirevmatika a analgetika, pokud dochází k progresi potíží a postižení nastupuje léčba chirurgická – korová dekomprese, aplikace kostního štěpu do místa ON nebo náhrada postiženého kloubu.
V letech 1999–2005 bylo na KDL FNO léčeno 57 pacientů s akutní lymfoblastickou leukémií. Léčba byla vedena dle protokolu ALL BFM 95 (akutní lymfoblastická leukémie Berlin – Frankfurt – Münster) a ALL IC 2002 (ALL Intercontinental). Za toto období byla ON diagnostikována u 4 pacientů (7,7 %) – tří dívek a jednoho chlapce. Dva byli léčeni dle protokolu ALL BFM 95, dva dle ALL IC 2002, všichni dosáhli 1. kompletní remise, která trvá. Průměrný věk, v němž byla ON u pacientů diagnostikována, byl 16 let a 3 měsíce, průměrně 22 měsíců od zahájení léčby ALL (u dvou pacientů ještě během udržovací léčby, u dalších dvou až po jejím ukončení). U dvou pacientů bylo postižení monoartikulární, u dvou multiartikulární, celkem bylo postiženo 12 kloubů. Léčebně stačil jen u jedné pacientky konzervativní postup, u tří ostatních musela být použita léčba chirurgická – jednou aplikace čerstvého kostního štěpu do místa postižení s velmi dobrým trvajícím klinickým efektem, u dvou pacientů náhrady postižených kloubů, které bouhužel ještě nejsou konečné.
Při všech současných terapeutických možnostech zůstává osteonekróza závažnou komplikací, která snižuje kvalitu života pacientů překonavších maligní onemocnění. Jistě je na místě úvaha o preventivním vyšetřování (MRI) nejčastěji postižených kloubů (kyčle) alespoň u pacientů v rizikové věkové skupině.
Nové postupy v léčbě neuroblastomů nejvyššího rizika
Mališ J., Lešková L., Sumerauer D., Sedláček P., Vícha A., Malinová B., Kynčl M., Šmelhaus V., Starý J.
Klinika dětské hematologie a onkologie UK 2. LF a FN Motol, Praha
Úvod: V letech 2003 až 2007 (pět let) jsme ošetřovali 65 dětí s diagnózou neuroblastomu, z nichž 22 (33 %) splňovalo kritéria neuroblastomu vysokého rizika, tzn. klinické stadium IV, nebo stadium II a III s počtem kopií N-myc vyšších než 10 v primární tkáni nádoru.
Soubor nemocných: Věk při stanovení diagnózy: med. 2,7 let (0,5; 12,3), 17 chlapců, 5 dívek. Iniciální klinická stadia: IV – 17 (15krát meta ve skeletu, 2krát uzliny a játra), III (+ amplifikace N-myc) – 4, II (+ amplifikace N-myc).
Léčba: A. Intenzivní indukční chemoterapie COJEC (8 cyklů chemoterapie v desetidenních intervalech), B. Chirurgické odstranění primárního nádoru, C. Megaterapie s převodem hematopoetických buněk, D. Radioterapie na původní rozsah primárního nádoru, E. Biologická léčba retinoidy (indukce apoptózy).
Odpověď na léčbu: Po indukční terapii COJECem dosáhl jeden nemocný kompletní remise, 13 dětí velmi dobré částečné odpovědi (VGPR), tzn. významné zmenšení primárního nádoru a 90% ústup aktivity na scintigrafickém vyšetření MIBG, 7 dětí mělo částečnou odpověď (PR), jedno mělo progresi onemocnění bezprostředně po ukončení indukční chemoterapie. Operaci primárního nádoru podstoupilo 18/22 dětí (1krát progrese, 1krát inoperabilní nádor, 2krát iniciální operace primárního nádoru). Megaterapii podstoupilo 20/22 dětí (1krát progrese, 1krát změna léčebného postupu).
Léčebné výsledky: Z této skupiny je možné hodnotit 18 dětí, 4 ještě pokračují v léčbě. Z 18 hodnocených dětí mělo 10 (55,5 %) relaps základního onemocnění za med. 19,7 měsíců (5,6; 30,4), z nich již 8 zemřelo, 2 žijí s aktivním onemocněním. Osm dětí žije bez známek aktivity základního onemocnění med. 26,2 měsíců (16,5; 63,6).
Závěr: Léčba neuroblastomů nejvyššího rizika je trvající problém dětské onkologie. I přes intenzivní multimodální terapii jsou sice výsledky lepší v porovnání s předchozími léčebnými postupy, ale rozhodně se nejedná o dramatické zlepšení léčebných výsledků.
Podpořeno MZ0 00064203.
BEZPEČNÁ ALOGENNÍ TRANSPLANTACE KRVETVORNÝCH BUNĚK
Michálek J., Matějková E., Foltánková V., Vitetta E. S.
1. dětská interní klinika FN Brno a Univerzitní centrum buněčné imunoterapie MU
Reakce štěpu proti hostiteli (GVH) je obávanou komplikací alogenní transplantace kostní dřeně. Hlavní roli hrají T lymfocyty dárce, které v konečném důsledku vedou k postižení tkání hostitele, především kůže, jater a gastrointestinálního traktu. Deplece alogenních T lymfocytů vede ke snížení rizika GVH nemoci, avšak současně narůstá riziko oportunních infekcí, relapsu základního onemocnění a odvrhnutí štěpu. Ideálně se jeví selektivní deplece aloreaktivních lymfocytů s ponecháním těch lymfocytů, které vykazují protileukemický, resp. protinádorový potenciál. Již dříve jsme ukázali, že selektivní deplece nežádoucí aloreaktivity může být velice efektivně dosaženo pomocí anti-CD25 imunotoxinu, který vede k více než 99% eliminaci aloreaktivních klonů dárce. Podobného efektu lze dosáhnout pomocí fotodynamické deplece aloreaktivních lymfocytů. Potenciace protinádorového efektu dárcovských lymfocytů dále rozšiřuje současné možnosti alogenní transplantace; je možná bezprostředně po transplantaci a nebo v rámci dárcovských lymfocytárních infuzí při potransplantačním relapsu nádorového onemocnění. Dárcovské lymfocytární infuze mohou být rovněž zbaveny nežádoucí aloreaktivity, navíc může být posílen jejich protinádorový efekt výběrem protinádorových klonů dárcovských lymfocytů nebo vakcinací nádorově-specifickými antigeny.
Autoři sdělení budou prezentovat přehled současných možností využití protinádorového potenciálu alogenních lymfocytů a jejich klinického využití.
Podporováno grantem IGA Ministerstva zdravotnictví ČR 1A8709-5.
PODÁNÍ PRVÉ PROTINÁDOROVÉ VAKCÍNY NA BÁZI DENDRITICKÝCH BUNĚK V ČR DĚTEM SE SOLIDNÍMI NÁDORY
Michálek J., Očadlíková D., Štěrba J.
1. dětská interní klinika FN Brno a Univerzitní centrum buněčné imunoterapie MU
Úvod: Aktivace imunitního systému dětských pacientů s nádorovým onemocněním může významně přispět k eliminaci nádoru. Poprvé v České republice byla v rámci pilotní studie testována vakcína na bázi autologních dendritických buněk připravená v čistých prostorách Masarykovy univerzity v Brně.
Cíle: Testování toxicity protinádorové vakcíny na bázi dendritických buněk pro individuální podání u terminálně nemocných dětských pacientů léčených na Klinice dětské onkologie ve Fakultní nemocnici Brno.
Metody: K přípravě protinádorové vakcíny bylo využito zavedených laboratorních postupů. Od pacientů byly získány nádorové buňky z nádorové tkáně a mononukleární buňky periferní krve, které obsahují prekurzory dendritických buněk a lymfocyty. Prekurzory dendritických buněk byly kultivovány in vitro v přítomnosti cytokinů (IL-4, GM-CSF, TNF-alfa) umožňujících jejich vyzrávání ve zralé formy dendritických buněk. Dendritické buňky byly naloženy autologními ozářenými nádorovými buňkami. Během této inkubace dochází k tzv. „primingu“ dendritických buněk nádorovými antigeny. Takto připravené dendritické buňky jsou profesionálními antigen-prezentujícími buňkami a jsou proto velmi účinnými stimulátory vlastních T lymfocytů. Takto připravená protinádorová vakcína byla rozdělena do 3–6 alikvotů, uchovávána zmražená až do doby podání pacientovi současně s imunopotenciační látkou KLH (keyhole limpet hemocyanin). Samotné očkování probíhalo ve 14denních intervalech a byla sledována toxicita podané vakcíny. Vakcína byla podána 6 dětským pacientům s různými solidními nádory ve věku 7–18 let.
Výsledky: Dosavadní výsledky ukazují, že podání vakcíny není spojeno s toxicitou vyšší než stupně I dle WHO klasifikace, vakcína je dobře snášena. Lokální imunologická odpověď byla zaznamenána u všech 6 pacientů. Klinický benefit u terminálně nemocných pacientů vedl ke stabilizaci choroby u 2 pacientů, 4 pacienti zemřeli na progresi choroby.
Závěr: Dosavadní výsledky ukazují, že příprava a aplikace individuální vakcíny na bázi dendritických buněk je bezpečná bez výrazných vedlejších účinků.
NEIMUNNÍ HEMOLYTICKÁ ANÉMIE V PERINATÁLNÍM OBDOBÍ
Suková M.1, Pindurová E.1, Vepřeková L.2, Vodičková E.3, Starý J.1
1Klinika dětské hematologie a onkologie UK 2. LF a FN Motol, Praha
2Klinika dětí a dorostu VFN, Praha
3Oddělení klinické hematologie, FN Motol, Praha
Anémie v časném novorozeneckém období je závažný stav, vyžadující vzhledem k riziku následků perinatální hypoxie rychlou diagnostiku a léčbu. Etiologie anémie je proto často předmětem diagnostiky až po transfuzi. Významnou roli v diferenciálně diagnostické rozvaze hraje perinatální anamnéza, ukazující na nejpravděpodobnější anémie ze ztrát a v důsledku intrauterinního distresu. Anémie vznikající intrauterinně je provázena intrauterinní hypoxií a projevy extramedulární hematopoézy, anémie vznikající perinatálně může mít významný klinický obraz s oběhovou instabilitou a má vždy určitou složku hemolytickou. Kromě klasické HON způsobené inkompatibilitou v systémech krevních skupin a kongenitálních hypoplastických syndromů upozorňujeme zejména na problematiku neimunní hemolytické anémie, jejíž diagnostika je v novorozeneckém věku vzhledem k funkční nezralosti erytropoézy obtížná, a to zejména při absenci pozitivní rodinné anamnézy (hereditární sferocytóza).
Na kazuistikách demonstrujeme méně obvyklé příčiny závažné adnátní anémie (talasemie, kongenitální dyserytropoetická anémie) a navrhujeme diagnostický algoritmus při závažné adnátní anémii u novorozence.
KOSINOROVÁ ANALÝZA 24HODINOVÉHO KOLÍSÁNÍ KREVNÍHO TLAKU DĚTÍ, DOSPÍVAJÍCÍCH A MLADÝCH DOSPĚLÝCH PO PROTINÁDOROVÉ LÉČBĚ
Šťastná J.1, Hrstková H.1, Krontorádová K.1, Nováková Z.2, Honzíková N.2, Fišer B.2, Závodná E.2
11. dětská interní klinika FN Brno a LF MU
2Fyziologický ústav, LF MU Brno
Cíl studie: Byla provedena kosinorová analýza záznamů 24hodinového ambulantního monitorování systolického (sTK) a diastolického (dTK) krevního tlaku zdravých osob a pacientů po protinádorové léčbě antracykliny.
Materiál a metody: Vyšetřili jsme 109 osob: 45 dětí po antracyklinové léčbě pro akutní lymfoblastickou leukémii (skupina A; průměrná doba mezi koncem léčby a ambulantním monitorováním krevního tlaku byla 9,7 ± 3,1 let, celková kumulativní dávka antracyklinů 227 ± 42 mg/m2) a 64 zdravých dětí jako kontrolní skupinu D. Obě hlavní skupiny byly rozděleny do 3 věkových kategorií – děti 13–15 let, dospívající 16–18 let a mladí dospělí 19–22 let.
Sestavili jsme profilové křivky (průměrné hodnoty z každé hodiny) ze záznamu 24hodinového ambulantního monitorování krevního tlaku (Space Lab Int) a proložili je křivkou s funkcí cosinus. Určili jsme střední hodnotu funkce cosinus – mesor, její amplitudu a fázový posun vzhledem k 24hodinovému cyklu – akrofáze v každé skupině pacientů a kontrol.
Výsledky: V kontrolní skupině byla nalezena signifikantní korelace mezi věkem a hodnotou mesoru, jak pro systolický (r = 0,374, p <0,01), tak pro diastolický krevní tlak (r = 0,365, p <0,01). U pacientů léčených antracykliny tato korelace nalezena nebyla. Hodnoty amplitudy a akrofáze byly na věku nezávislé.
Hodnoty mesoru pro sTK a dTK ve věkové skupině 19–22 let byly sníženy u pacientů léčených antracykliny ve srovnání se zdravou populací (sTK – A vs. D:112 ± 6 mm Hg vs. 117 ± 7 mm Hg, p <0,05; dTK: 67 ± 3 mm Hg vs. 69 ± 6 mm Hg).
Akrofáze u pacientů po antracyklinové léčbě byla posunuta o 1 hodinu dříve (sTK – A vs. D: 14,4 hod. vs. 15,6 hod., p <0,05; dTK: 14,1 hod. vs. 15,3 hod., p <0,01).
Závěr: Můžeme uzavřít, že na věku závislé zvyšování krevního tlaku, které bylo pozorováno v kontrolní skupině zdravých dětí, dospívajících a mladých dospělých, zcela chybí u skupiny bývalých dětských pacientů po prodělané protinádorové léčbě antracykliny. Můžeme se domnívat, že jde o pozdní efekt této terapie ve smyslu narušení jemné souhry sympatického a parasympatického nervového systému.
Studie byla podpořena výzkumným záměrem MSMT 0021622402.
AKUTNÍ HYBRIDNÍ LEUKÉMIE U DĚTÍ: SPEKTRUM PŘESTAVEB GENŮ PRO IMUNOGLOBULINY A T-BUNĚČNÉ RECEPTORY
Volejníková J., Froňková E., Mejstříková E., Řezníčková L., Valová T., Zuna J., Hrušák O., Starý J., Trka J.
Klinika dětské hematologie a onkologie UK 2. LF a FN Motol, Praha a Centra PSDH
Úvod: Akutní hybridní leukémie (AHL) je vzácnou, dosud málo poznanou podskupinou leukémie. Zahrnuje tři situace: 1) současnou expresi znaků různých linií na jedné populaci blastů, 2) dvě morfologicky/imunologicky nezávislé leukemické linie, 3) přesmyk do jiné linie před dosažením remise. Zatímco exprese antigenů z jiné než primární linie jsou časté, mezinárodní imunologická klasifikace EGIL označí jako AHL pouze leukémie s vysokým skóre této aberantní exprese. Příčina aberantní exprese není známa. Lymfocyty během svého vývoje přeskupují geny pro imunoglobuliny a T-buněčné receptory (Ig/TCR), vyšetřením počtu a typu těchto přestaveb chceme přispět k poznání původu (resp. liniové orientace a zralosti) buněk podléhajících maligní transformaci.
Pacienti a metody: V období 09/1996–08/2006 jsme komplexně vyšetřili 730 dětí při diagnóze akutní leukémie, 122 při relapsu, 14 se sekundární leukémií. 33 pacientů splnilo kritéria AHL v diagnóze (29 ALL/My+, 4 AML/Ly+), 8 v relapsu (6 ALL/My+, 2 AML/Ly+).
Výsledky: Nejčastějším fúzním genem u AHL je TEL/AML1, prognosticky nepříznivé fúzní geny MLL/AF4 a BCR/ABL se vyskytují častěji než u non-AHL. Spektrum Ig/TCR přestaveb odpovídá primární linii podle imunofenotypu: pro-B/My+ AHL mají „nezralý“ profil – málo, většinou nekompletních přestaveb těžkých řetězců imunoglobulinů (IgH), žádné přestavby lehkých řetězců (IgL). Naopak, pre-B/My+ AHL mají 1–2 kompletní přestavby IgH a 1–2 přestavby IgL, odpovídající malignímu zásahu až během přestavování lehkých řetězců. Samostatnou skupinu tvoří TEL/AML1+ AHL, kde při zvýšené aktivitě enzymů rekombináz nacházíme velké množství přestaveb Ig/TCR obdobných jako u non-AHL TEL/AML1+ leukémií. Další výjimkou jsou pro - a pre-T-ALL s myeloidními znaky: 4 ze 6 mají Ig/TCR geny zcela nepřestavěné, stejně jako 4/4 AML s T-znaky.
Závěr: Incidence a zralost přestaveb Ig/TCR odpovídá u AHL primárně B-řady imunofenotypicky určenému stadiu, u TEL/AML1+ leukémií deregulaci způsobené fúzním proteinem. Specifickou skupinu tvoří AHL současně exprimující T-lymfoidní a myeloidní znaky, které nezávisle na primární linii nepřestavují geny pro TCR/Ig.
Podpořeno GAUK 7393/2007, VZ MŠMT MSM 0021620813, MZNR 8269-3/2005.
Cílená léčba valproovou kyselinou u podskupiny akutních myeloidních leukémií s hybridním genem AML1/ETO (experimentální model)
Zápotocký M.1, Starková J.1, Mejstříková E.1, Smetana K.2, Trka J.1
1CLIP – Childhood Leukaemia Investigation Prague, Klinika dětské hematologie a onkologie UK 2. LF a FN Motol, Praha
2Ústav hematologie a krevní transfuze UK 1. LF a VFN, Praha
V České republice je diagnostikováno cca 12 dětských pacientů s akutní myeloidní leukémií (AML) ročně. Přes terapeutický pokrok v posledních dekádách je celkové přežití těchto pacientů 60%. U části pacientů (8–15 %) jsou leukemické buňky charakterizovány přítomností fúzního onkogenu AML1/ETO, který podle současných poznatků blokuje transaktivaci genů, které jsou v normální krvetvorbě regulovány proteinem AML1. V tomto fenoménu se významná role přikládá deacetylázám histonů a tím změnám přístupnosti DNA pro transkripční komplexy. Valproová kyselina (VPA) má schopnost inhibovat deacetylázy histonů a může teoreticky zvrátit blokační efekt hybridního proteinu AML1/ETO. Předpokládali jsme, že v experimentu VPA zvrátí patologicky zablokovanou transaktivaci cílových genů proteinu AML1 a tím obnoví myeloidní diferenciaci.
Testovali jsme vliv VPA na AML1/ETO pozitivní buněčnou linii Kasumi-1 a srovnávali jsme účinek s linií, která tento fúzní protein nenese (linie MV4;11). Obě linie byly kultivovány po dobu 24 a 48 hodin s koncentrací VPA 0 mM, 0,5 mM a 1,0 mM. Diferenciaci jsme prokazovali průtokovou cytometrií (sledováním změn v imunofenotypu), morfologickým vyšetřením jader a jadérek a hodnotili jsme změnu exprese genů důležitých v myelo-diferenciaci pomocí kvantitativní RT-PCR.
U Kasumi-1 jsme průtokovou cytometrií pozorovali diferenciaci u buněk ovlivněných VPA, u kterých došlo k poklesu exprese povrchových markerů typických pro nezralé myeloidní progenitory (CD33, CD34, CD117) a vzestupu markerů charakteristických pro myeloidní vyzrávání (CD11a a CD11b). V buněčném cyklu se snížil počet proliferujících buněk a zvýšilo se množství buněk vstupujících do apoptózy. Tyto nálezy jsme potvrdili i morfologicky hodnocením jader a jadérek. Naproti tomu jsme nepotvrdili vyzrávání po podání VPA u linie bez proteinu AML1/ETO. Expresní analýza prokázala u Kasumi-1 obnovení exprese genů PU.1 a C/EBPalfa zodpovědných za myeloidní vyzrávání.
Naše práce ukazuje, že původně v neurologii využívaný preparát VPA dokáže indukovat apoptózu a nastartovat diferenciaci AML1/ETO pozitivních leukemických buněk. Valproová kyselina je tak potenciálně slibným doplňkovým lékem v chemoterapii této skupiny leukémií.
Podpořeno GAUK 71/2006.
KRANIOFARYNGEOM – DIAGNOSTICKO-TERAPEUTICKÝ POSTUP
Zitterbart K.1, Magnová O.2, Hřivňacká J.3, Ventruba J.4, Pavelka Z.1
1Klinika dětské onkologie LF MU a FN Brno
2I. dětská interní klinika LF MU a FN Brno
3Klinika radiační onkologie LF MU a Masarykův onkologický ústav, Brno
4Klinika dětské chirurgie, ortopedie a traumatologie LF MU a FN Brno
Péče o pacienta s kraniofaryngeomem je komplexní, ne vždy jsou názory na správný postup jednoznačné. Jde o nádor většinou benigní, v tomto případě je radikální resekce kurabilní, nádor však má sklon k invazi do okolních struktur a k recidivám. Jeho centrální lokalizace často způsobuje poškození zrakové dráhy, pituitární dysfunkci a obstrukční hydrocefalus. Nejzávažnějšími celoživotními následky je postižení v oblasti hypotalamické, které vede k těžkým a život ohrožujícím komplikacím, jako jsou chybění pocitu žízně, monstrózní obezita, poruchy spánku, chování a kognitivních funkcí. Hypotalamický syndrom je ve velké části způsoben operačním výkonem při snaze o radikální odstranění nádorové tkáně.
Radikální chirurgický postup by proto měl být indikován u pacientů s malým nádorem a bez postižení hypotalamické oblasti a zrakové dráhy. V opačném případě by měl být zvolen neurochirurgický postup vedoucí ke snížení tlakových změn vyvolaných nádorem, s ponecháním reziduální nádorové tkáně, s cílem zachovat neporušené okolní struktury (hypotalamus, zrakový nerv). Indikované zařazení konformní či stereotaktické radioterapie významně snižuje riziko progrese onemocnění a tím i nutnost provedení dalších neurochirurgických zákroků – ty jsou i přes klesající radikalitu spojeny se vzrůstající pooperační mortalitou a morbiditou. Je však rovněž nutno posoudit riziko vzniku pozdních následků radioterapie, především u dětí ve věku pod 5 let.
Cílem takto navrženého léčebného postupu je minimalizovat rizika recidivy/progrese choroby a zlepšit kvalitu života pacienta. Toho je možno dosáhnout jen těsnou a koordinovanou spoluprací zainteresovaných odborníků ve specializovaných pediatricko-onkologických centrech.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článek Rámcový program kongresuČlánek Přehled přednášek a posterůČlánek PLENÁRNÍ ZASEDÁNÍČlánek Téma č. 1 – DĚTSKÁ CHIRURGIEČlánek Téma č. 3 – NEONATOLOGIEČlánek Rýma a kyselina hyaluronováČlánek Téma č. 17 – VARIAČlánek REJSTŘÍK AUTORŮ
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2008 Číslo 7-8- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficitmi v reálnej praxi
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
-
Všetky články tohto čísla
- VIII. český pediatrický kongres s mezinárodní účastí
- Rámcový program kongresu
- Přehled přednášek a posterů
- PLENÁRNÍ ZASEDÁNÍ
- Téma č. 1 – DĚTSKÁ CHIRURGIE
- Téma č. 2 – DOROSTOVÉ LÉKAŘSTVÍ
- Téma č. 3 – NEONATOLOGIE
- Téma č. 4 – PRIMÁRNÍ PÉČE O DĚTI A DOROST
- Téma č. 5 – DĚTSKÁ STOMATOLOGIE
- Téma č. 6 – INTENZIVNÍ PÉČE O DĚTI A DOROST
- Téma č. 7 – DĚTSKÁ NEFROLOGIE
- Téma č. 8 – SOCIÁLNÍ PEDIATRIE
- Téma č. 9 – DĚTSKÁ REVMATOLOGIE
- Téma č. 10 – DĚTSKÁ PNEUMOLOGIE
- Rýma a kyselina hyaluronová
- Téma č. 11 – DĚTSKÁ HEMATOLOGIE A ONKOLOGIE
- Téma č. 12 – ETIKA V MEDICÍNĚ
- Téma č. 13 – DĚTSKÁ A DOROSTOVÁ PSYCHIATRIE
- Téma č. 14A – DĚTSKÁ ENDOKRINOLOGIE
- Téma č. 14B – DĚTSKÁ DIABETOLOGIE
- Téma č. 15 – DĚTSKÁ DERMATOVENEROLOGIE
- Téma č. 16 – DĚTSKÁ GASTROENTEROLOGIE, HEPATOLOGIE A VÝŽIVA
- Téma č. 17 – VARIA
- REJSTŘÍK AUTORŮ
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Rýma a kyselina hyaluronová
- Téma č. 1 – DĚTSKÁ CHIRURGIE
- Téma č. 7 – DĚTSKÁ NEFROLOGIE
- Téma č. 2 – DOROSTOVÉ LÉKAŘSTVÍ
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy