Súvis génových polymorfizmov glutatión S-transferázy T1 a M1 s mikroalbuminúriou a incipientnou nefropatiou u detí s diabetes mellitus 1. typu
The association between glutathione S-transferase T1 and M1 gene polymorphisms and microalbuminuria and incipient nephropathy in children with type 1 diabetes mellitus
Oxidative stress is discussed factor in the etiopathogenesis of diabetic nephropathy (DN). Glutathione S-transferase (GST) represents the family of multifunctional isoenzymes with antioxidant function. The most researched isoenzymes are glutathione S-transferase theta 1 (GST T1) and mu 1 (GST M1) while null polymorphisms are associated with lower activity of these enzymes. The aim of this work was to establish, whether GST T1 and M1 gene polymorphisms were linked to presence of microalbuminuria and diabetic nephropathy in children with type 1 diabetes.
In 116 patients with type 1 diabetes at the age 6–19 years, basic anthropometric parameters were noticed, glycosylated hemoglobin was examined by standard biochemical methods and microalbuminuria was examined from 12-hour night urine sample. Incipient nephropathy was diagnosed as repeated finding of microalbuminuria of 20–200 μg/min. GST T1 and M1 gene polymorphisms were established by polymerase chain reaction.
Children with GST T1 null genotype (n=42) had significantly higher microalbuminuria compared to the subjects with GST T1 wild genotype (n=74) (p<0.05). No significant difference was found in other measured parameters. Similarly, no significant difference was estimated in measured parameters between subjects regarding GST M1 genotype. Incipient nephropathy was diagnosed in 26 children (22.41%). Patients with diabetic nephropathy (DN+) had significantly higher age (p<0.01), longer diabetes duration (p<0.01), higher body mass index (p<0.01) and higher microalbuminuria (p<0.01) compared to patients without nephropathy (DN-). These parameters were confirmed as risk factors for DN origin by multivariate logistic regression. Differences in gene polymorphisms between DN+ and DN- subgroups were not significant.
GST T1 null genotype may be associated with higher microalbuminuria, however further studies are necessary to confirm this indication.
Key words:
diabetic nephropathy, gene polymorphisms, glutathione S-transferase T1 and M1
Autori:
J. Vojtková; M. Čiljaková; P. Ďurdík; Z. Michnová; T. Turčan
Pôsobisko autorov:
Klinika detí a dorastu, Univerzita Komenského v Bratislave, Jesseniova lekárska fakulta a Univerzitná nemocnica Martin
prednosta prof. MUDr. P. Bánovčin, CSc.
Vyšlo v časopise:
Čes-slov Pediat 2013; 68 (2): 92-100.
Kategória:
Původní práce
Súhrn
V etiopatogenéze diabetickej nefropatie (DN) sa diskutuje o vplyve oxidačného stresu. Glutatión S-transferáza (GST) predstavuje rodinu multifunkčných enzýmov s antioxidačnou funkciou. Null polymorfizmy GST theta 1 (GST T1) a mu 1 (GST M1) sú asociované s nižšou aktivitou týchto enzýmov. Cieľom práce bolo zistiť, či génové polymorfizmy GST T1 a M1 majú súvis s výskytom mikroalbuminúrie a diabetickej nefropatie u detí s diabetes mellitus typu 1.
U 116 pacientov s diabetes mellitus typu 1 vo veku 6–19 rokov boli zaznamenané základné antropometrické parametre, mali vyšetrenú koncentráciu glykozylovaného hemoglobínu a mikroalbuminúriu. Incipientná nefro-patia bola diagnostikovaná ako opakovaný nález mikroalbuminúrie zo vzorky 12-hodinového nočného moču 20–200 μg/min. Polymerázovou reťazovou reakciou boli stanovené génové polymorfizmy GST T1 a M1.
Diabetici s GST T1 null genotypom (n = 42) mali signifikantne vyššiu mikroalbuminúriu v porovnaní s diabetikmi s GST T1 wild genotypom (n = 74) (p <0,05), pričom v ostatných sledovaných parametroch nebol nájdený signifikantný rozdiel. Podobne nebol potvrdený signifikantný rozdiel v sledovaných parametroch v súvislosti s GST M1 genotypom. Incipientná diabetická nefropatia bola prítomná u 26 jedincov (22,41 %). Pacienti s diabetickou nefropatiou (DN+) mali signifikantne vyšší vek (p <0,01), dlhšie trvanie diabetu (p <0,01), vyšší body mass index (p <0,01) a vyššiu mikroalbuminúriu (p <0,01) v porovnaní s diabetikmi bez nefropatie (DN-). Multivariačnou logistickou regresiou boli uvedené parametre potvrdené ako rizikové faktory pre vznik DN. Rozdiely výskytu génových polymorfizmov medzi podskupinami DN+ a DN- neboli signifikantné.
GST T1 null genotyp môže súvisieť s vyššou mikroalbuminúriou, avšak pre potvrdenie tejto indikácie sú vhodné ďalšie štúdie.
Kľúčové slová:
diabetická nefropatia, génové polymorfizmy, glutatión S-transferáza T1 a M1
ÚVOD
Diabetes mellitus typu 1 (type 1 diabetes, T1D) je metabolické ochorenie charakterizované hyperglykémiou s absolútnym nedostatkom inzulínu následkom autoimunitného zápalu beta buniek pankreasu. Kvalita života jedincov s T1D je výrazne determinovaná prítomnosťou chronických diabetických komplikácií, ktoré nie sú doménou len dospelého veku, ale vzhľadom na skorý nástup ochorenia sa s nimi stretávame aj u detí a adolescentov. Diabetická nefropatia (DN) postihuje asi 30–35 % diabetikov 1. typu, pričom klinicky manifestná DN sa objaví asi u 30 % diabetikov po 15–20 rokoch trvania diabetu [1]. Klinické rozdelenie DN je uvedené v tab. č. 1.
![Klinické štádiá diabetickej nefropatie (podľa [2]).](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/170b782ab7f8bdb1a861c9391756fe48.png)
V etiopatogenéze diabetickej nefropatie má úlohu genetická predispozícia spolu s pretrvávajúcou hyperglykémiou, ktorá indukuje mnohé metabolické procesy pôsobiace vo vzájomnej interakcii, medzi ktoré patrí neenzýmová glykácia proteínov, polyolová cesta a oxidačný stres. Oxidačný stres, ako výsledok nerovnováhy medzi tvorbou reaktívnych foriem kyslíka (RFK) a činnosťou antioxidačných mechanizmov, indukuje expresiu tkanivového rastového faktora β1 (TGF- β1) a fibronektínu, ktoré podporujú produkciu extracelulárnej matrix, čím prispievajú k zhrubnutiu glomerulárnej bazálnej membrány a k renálnemu poškodeniu. Nadprodukcia RFK alteruje mezangiálne bunky, vyvoláva bunkové procesy vedúce k apoptóze a v mezangiálnych a glomerulárnych bunkách zvyšuje aktivitu proteínkinázy C (PKC) pôsobiacej v bunkovej signalizácii [3]. Izoformy PKC- β1 a 2 zhoršujú krvný prietok cez obličky, zvyšujú kapilárny únik, indukujú produkciu extracelulárnej matrix a aktivujú prozápalové cytokíny, čím prispievajú k mikrovaskulárnemu poškodeniu [4]. PKC tiež stimuluje produkciu RFK. Tieto zmeny spolu s neenzýmovou glykáciou proteínov vedú k renálnej hyperperfúzii, hyperfiltrácii, k hromadeniu extracelulárnej matrix, k vazokonstrikcii renálnych ciev, k rekonštrukcii renálnej štruktúry a dokonca k nefroskleróze.
V súvislosti s oxidačným stresom sú v popredí záujmu génové polymorfizmy niektorých antioxidačných enzýmov, ktoré by mohli mať vplyv na vznik chronických diabetických komplikácií. Glutatión S-transferáza (GST) predstavuje rodinu enzýmov zapojených v metabolizme cudzorodých látok, katalyzujúcich konjugáciu redukovaného glutatiónu s exogénnymi alebo endogénnymi substrátmi (aldehydy, N-nitrozamín, polycyklické aromatické uhľovodíky) s cieľom ich detoxifikácie a jednoduchšej exkrécie. Substrátom pre uvedenú reakciu sú aj sekundárne metabolity reaktívnych foriem kyslíka a organické hydroperoxidy, z čoho vyplýva antioxidačná funkcia GST. Navyše, GST enzýmy majú úlohu v syntéze zápalových mediátorov (leukotriény, prostaglandíny) a tiež v bunkovej signalizácii ako regulátory apoptózy. Podľa substrátovej špecificity, chemickej afinity, štruktúry a kinetiky bolo identifikovaných niekoľko tried cytozolových GST. Najviac študovaným je GST M1 enzým v mu triede kódovaný génom lokalizovaným na chromozóme 1 a GST T1 enzým v theta triede kódovaný génom lokalizovaným na chromozóme 22 [5]. Bolo dokázané, že jedinci s GST null genotypom disponujú signifikantne zníženou aktivitou tohto antioxidačného enzýmu [6] a majú vyššie koncentrácie intermediárnych produktov oxidačného metabolizmu v porovnaní s jedincami s wild genotypom. Táto skutočnosť môže viesť k exacerbácii patologických účinkov reaktívnych foriem kyslíka a môže mať dôležitý vplyv v etiopatogéneze viacerých ochorení.
Podľa posledných prác, GST T1 a M1 génové polymorfizmy majú súvis s vývojom chronických diabetických komplikácií [7, 8], avšak väčšina autorov sa venuje dospelej populácii s diabetom typu 2 (type 2 diabetes, T2D). Cieľom tejto práce je zistiť, či génové polymorfizmy glutatión S-transferázy T1 a M1 majú súvis s mikroalbuminúriou a incipientnou nefropatiou u detí s T1D.
METODIKA
Pacienti a sledované parametre
Projekt bol schválený Etickou komisiou Jesseniovej lekárskej fakulty v Martine. Zúčastnení jedinci a ich zákonní zastupcovia boli informovaní o zámere projektu a mali podpísaný informovaný súhlas. Do štúdie boli zahrnutí pacienti s T1D (kritériá Americkej diabetologickej asociácie) [9], pacienti s ketoacidózou alebo s akútnym infektom boli zo štúdie vylúčení.
Každý jedinec mal zaznamenané trvanie T1D, vek nástupu T1D a základné antropometrické parametre – hmotnosť, výšku, body mass index (BMI). Od každého pacienta boli odobrané dve vzorky venóznej krvi, jedna pre stanovenie glykozylovaného hemoglobínu štandardnými biochemickými postupmi (DCCT norma) a druhá pre vyšetrenie génových polymorfizmov. Zo vzorky 12-hodinového nočného moču bola vyšetrená mikroalbuminúria za štandardných podmienok. V prípade pozitívneho nálezu (>20 µg/min) bola mikroalbuminúria znovu vyšetrená o 2 mesiace za rovnakých podmienok. Ak zvýšená mikro-albuminúria (20–200 µg/min) bola prítomná v obidvoch vzorkách, stav u pacienta bol označený ako incipientná nefropatia. V prípade opakovanej hodnoty mikroalbuminúrie nad 200 µg/min bol stav považovaný za manifestnú nefropatiu. Všetci pacienti mali vyšetrený tlak krvi digitálnym tonometrom. Hodnoty krvného tlaku pod 90. percentilom pre daný vek, pohlavie a výšku boli považované za normálne, hodnoty medzi 90. a 95. percentilom boli považované za prehypertenziu a hodnoty nad 95. percentilom za hypertenziu.
Extrakcia DNA a vyšetrenie polymorfizmov
Na extrakciu genómovej DNA bola použitá štandardná fenol – choloroformová metóda. GST T1 a M1 génové polymorfizmy boli vyšetrené technikou polymerázovej reťazovej reakcie (polymerase chain reaction, PCR). Primery použité pre GST M1 polymorfizmus boli 5´- GAACTCCCTGAAAAGCTAAAGC-3´ a 5´- GTTGGGCTCAAATATACGGTGG-3´ a pre GST T1 5´- TTCGTTACTGGTCCTCACATCTC-3´ a 5´- TCACGGGATCATGGCCAGCA-3´. Za účelom vylúčenia falošne negatívnych výsledkov bola použitá kontrola beta-globínom. Použité primery pre beta-globín boli 5´- CAACTTCATCCACGTTCACC – 3´a 5´- GAAGAGCCAAGGACAGGTAC – 3´. PCR reakcia prebiehala v objeme 25 µl, z čoho 6 µl tvorili primery, 1 µl izolovaná DNA, 8 µl PCR zmes (Taq polymeráza, MgCl2) a 10 µl redestilovaná voda. Dĺžka získaných produktov bola 215 bázových párov (bp), 480 bp a 268 bp pre GST M1, GST T1 a beta-globín v uvedenom poradí.
Štatistická analýza
Výsledky boli spracované štatistickým programom SYSTAT (verzia 11). Parametre boli vyjadrené ako priemer ± štandardná odchýlka. Pre vyjadrenie štatistickej významnosti bol použitý Studentov t test, pričom p menej ako 0,05 bolo považované za štatisticky významné. Pre stanovenie rizika bol multivariačnou logistickou regresiou stanovený parameter OR (odds ratio) s 95. konfidenčným intervalom (95CI).
VÝSLEDKY
Štúdie sa zúčastnilo 116 pacientov s T1D vo veku 6–19 rokov (priemer 12,95 ± 4,13 rokov), 53 ženského a 63 mužského pohlavia. Charakteristika skupiny je uvedená v tabuľke 2.
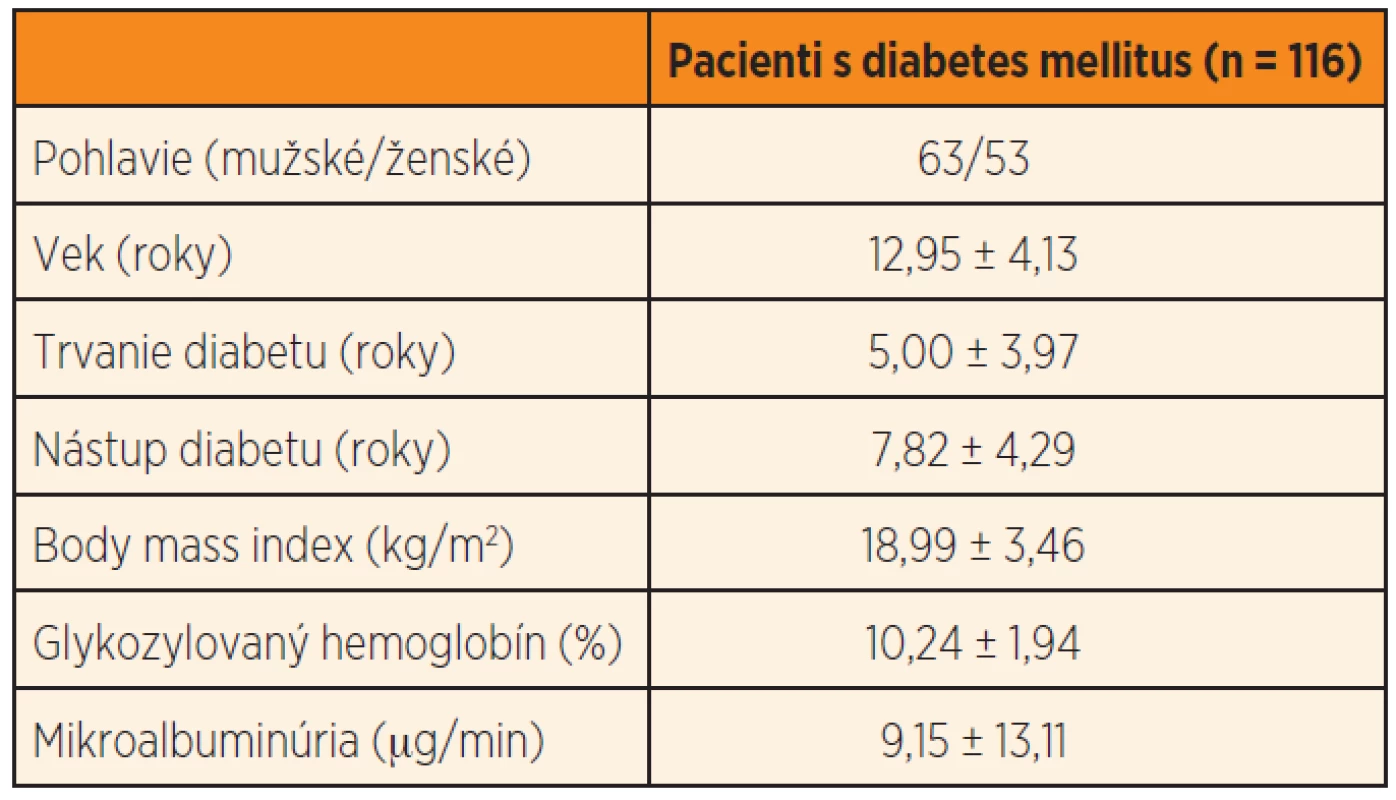
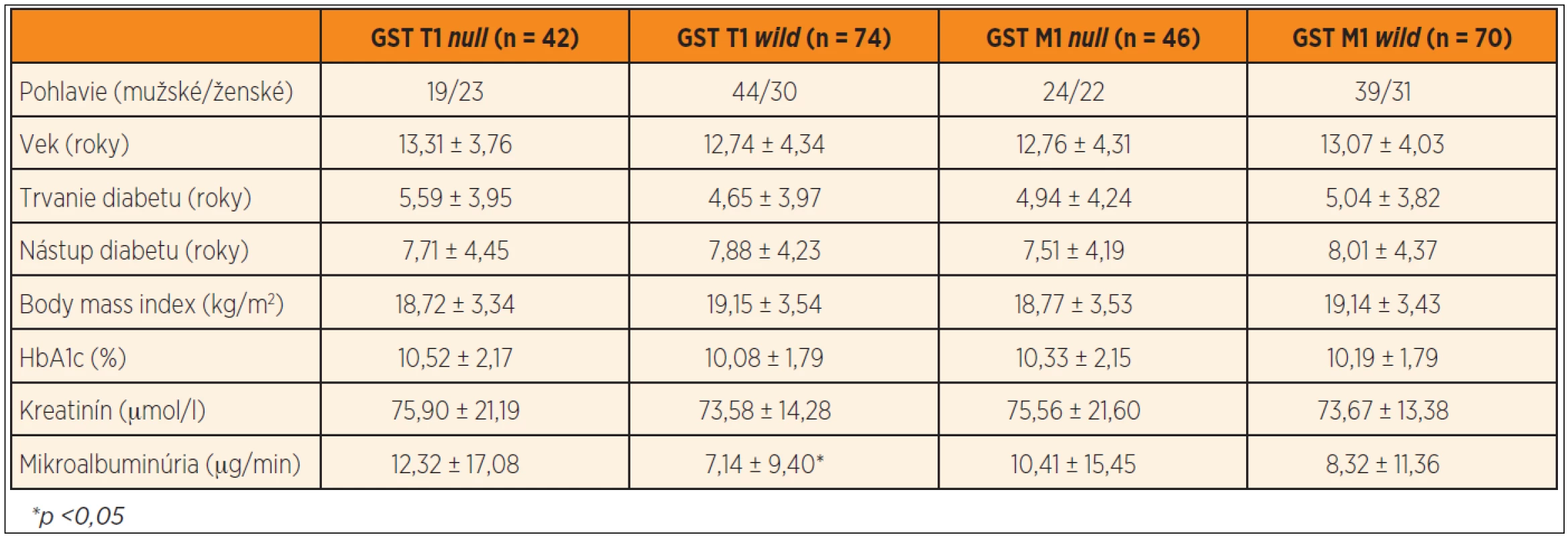
V našom súbore bolo 42 jedincov (36,21 %) nosičmi GST T1 null genotypu a 74 jedincov (63,79 %) GST T1 wild genotypu. GST M1 null genotyp bol prítomný u 46 diabetikov (39,66 %) a GST M1 wild genotyp u 70 pacientov (60,34 %). Diabetici s GST T1 null genotypom mali signifikantne vyššiu mikroalbuminúriu v porovnaní s diabetikmi s GST T1 wild genotypom (12,32 ± 17,08 vs. 7,14 ± 9,40 µg/min, p <0,05) (graf 1), pričom v ostatných sledovaných parametroch nebol nájdený signifikantný rozdiel. Podobne nebol potvrdený štatisticky významný rozdiel v sledovaných parametroch medzi jedincami s GST M1 null a wild genotypom (tab. 3).

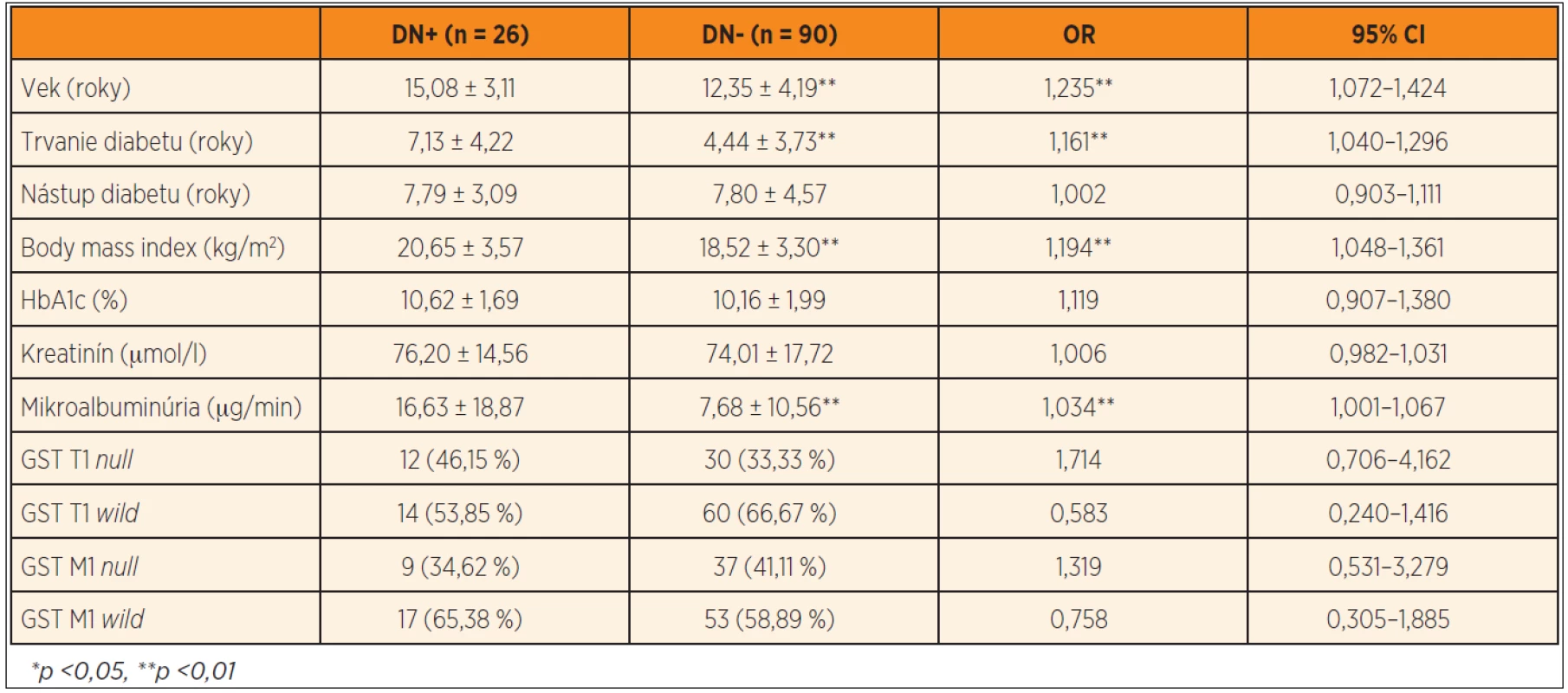
Podľa opakovaného vyšetrenia mikroalbuminúrie bola diabetická nefropatia prítomná u 26 jedincov (22,41 %), pričom u všetkých bola v rozmedzí hodnôt charakteristických pre incipientnú nefropatiu. Dvaja pacienti s diabetickou nefropatiou mali jednorazovým vyšetrením zistené hodnoty krvného tlaku medzi 90. a 95. percentilom pre daný vek, pohlavie a výšku, všetci ostatní diabetici mali hodnoty tlaku krvi pod 90. percentilom. Pacienti s diabetickou incipientnou nefropatiou (DN+) mali signifikantne vyšší vek (15,08 ± 3,11 rokov vs. 12,35 ± 4,19, p <0,01), dlhšie trvanie diabetu (7,13 ± 4,22 rokov vs. 4,44 ± 3,73, p <0,01), vyšší BMI (20,65 ± 3,57 kg/m2 vs. 18,52 ± 3,30, p <0,01) a vyššiu mikroalbuminúriu (16,63 ± 18,87 µg//min vs. 7,68 ± 10,56, p <0,01) v porovnaní s diabetikmi bez nefropatie (DN-). Multivariačnou logistickou regresiou bol ako rizikový faktor pre vznik diabetickej nefropatie potvrdený vek (OR = 1,235, 95CI 1,072–1,424, p <0,01), trvanie diabetu (OR = 1,161, 95CI 1,040–1,296, p <0,01), body mass index (OR = 1,194, 95CI 1,048–1,361, p <0,01) a mikroalbuminúria (OR=1,034, 95CI 1,001 – 1,067, p <0,01). Častejší výskyt GST T1 null genotypu v podskupine DN+ nebol signifikantný (46,15 % vs. 33,33 %, OR = 1,714, 95CI 0,706–4,162, p >0,05), takisto ako riziko predstavené ostatnými génovými polymorfizmami (tab. 4).
DISKUSIA
Génové polymorfizmy glutatión S-trans-ferázy T1 a M1 sú považované za faktory, ktoré majú prinajmenšom parciálnu úlohu v etio-patogenéze mnohých stavov, ako sú kardio-vaskulárne, gastroenterologické, neurologické, respiračné, alergické, toxické alebo metabolické ochorenia [10, 11, 12, 13, 14, 15, 16, 17]. Podľa posledných prác, GST T1 a M1 génové polymorfizmy ovplyvňujú tiež vývoj diabetes mellitus [18] a chronických diabetických komplikácií [19, 20]. Výsledky štúdií varírujú podľa jednotlivých autorov, regiónov a sledovanej populácie. Prevažná väčšina informácií bola opísaná u dospelých pacientov s T2D, doteraz sa iba jeden kolektív autorov zameriaval na adolescentov alebo mladých dospelých s T1D [21].
Podľa štatistickej analýzy výsledkov našej práce bola zistená signifikantne vyššia mikroalbuminúria u diabetikov s GST T1 null genotypom v porovnaní s pacientami s GST T1 wild genotypom, avšak v prípade GST M1 polymorfizmov nebol zistený signifikantný rozdiel. Častejší výskyt GST T1 null genotypu v podskupine DN+ však nebol signifikantný, čo mohlo byť spôsobené nízkym počtom subjektov v našom súbore. S podobnými informáciami o vplyve GST T1 a M1 genotypu na renálne komplikácie sa môžeme stretnúť aj v literatúre. Podľa posledných prác GST T1 null genotyp je asociovaný s chronickým zlyhaním obličiek u diabetických aj nediabetických jedincov bez ohľadu na GST M1 genotyp [22]. Podobne, GST M1 null genotyp nepredstavoval zvýšené riziko vzniku diabetickej nefropatie japonských pacientov s T2D [23] ani zvýšené riziko zlyhania obličiek [24], zatiaľ čo GST T1 null genotyp zvyšoval riziko zlyhania obličiek diabetických pacientov [24]. Podľa slovinských autorov GST T1 ani M1 genotyp nepredstavuje rizikový faktor pre vznik diabetickej nefropatie pacientov s T1D s priemerným vekom 27 rokov [25]. Tieto rozdielne výsledky môžu byť spôsobené regionálnymi rozdielmi alebo odlišnou dĺžkou trvania diabetu (priemerne 18 rokov v práci slovinských autorov v porovnaní s 5 rokmi v našej práci). Jedným z limitujúcich faktorov asociačných štúdií, ktoré vyhodnocujú vplyv genotypu na progresiu choroby je fakt, že s dlhším trvaním ochorenia sa vyvinie viac chronických komplikácií. Incipientná nefropatia bola v našom súbore prítomná u 22,4 % diabetikov. So zvyšovaním sa dĺžky trvania T1D sa dá predpokladať zvyšovanie prevalencie tejto chronickej komplikácie a teda aj odlišné výsledky asociácie nefropatie s GST génovými polymorfizmami. Vzhľadom na signifikantne nižšiu mikroalbuminúriu v podskupine detí s GST T1 null genotypom však predpokladáme aspoň čiastočný vplyv uvedených polymorfizmov v patogenéze diabetickej nefropatie.
V súvislosti s diabetickou nefropatiou boli študované aj génové polymorfizmy iných antioxidačných enzýmov. Súvis génových polymorfizmov katalázy s DN nebol dokázaný [26, 27], avšak bol potvrdený súvis génových polymorfizmov superoxiddizmutázy s diabetickou nefropatiou [28] a tiež so štádiami albuminúrie [29].
Podľa štatistickej analýzy výsledkov našej práce boli ako rizikové faktory pre vznik DN stanovené vek, trvanie diabetu, BMI a mikroalbuminúria, ktorých význam už bol v literatúre opísaný [30, 31]. Jedným z faktorov urýchľujúcich progresiu nefropatie je hypertenzia [32], ktorá sa vyskytuje často aj u detí s T1D [33]. Súvis GST génových polymorfizmov s vysokým tlakom krvi bola doteraz študovaná u iných než diabetických jedincov. Podľa publikovaných prác kombinácia genotypov GST T1 null/M1 null sa vyskytovala častejšie u pacientov s novodiagnostikovanou esenciálnou hypertenziou v porovnaní s normotenznými jedincami [34]. Podobne, jedinci s GST M1 null genotypom mali signifikantne vyššie riziko vývoja hypertenzie [35]. Okrem dvoch diabetikov mali všetci jedinci v našom súbore normálne hodnoty krvného tlaku, avšak pre presnejšie hodnotenie by bolo v budúcnosti vhodné 24-hodinové ambulantné monitorovanie tlaku krvi a jeho eventuálna korelácia s génovými polymorfizmami.
Prevažnú väčšinu pacientov v našom súbore tvorili pacienti s nedostatočnou kompenzáciou T1D, ktorí boli odosielaní regionálnymi endokrinológmi za účelom zlepšenia kompenzácie základného ochorenia. Táto skutočnosť pravdepodobne ovplyvnila priemernú koncentráciu glykozylovaného hemoglobínu v našom súbore a tiež frekvenciu výskytu incipientnej nefropatie – 22 % po piatich rokoch trvania T1D. Pre porovnanie, podľa prospektívnej štúdie EURODIAB Prospective Complications Study Group bola kumulatívna incidencia mikroalbuminúrie u pacientov s T1D 12,6 % po 7,3 rokoch trvania diabetu [36]. Prevalencia mikroalbuminúrie však môže dosiahnuť aj vyššie hodnoty – 18 % už pred 5 rokmi trvania T1D [37], najmä u pacientov s nedostatočnou kompenzáciou glykémie, s vysokou lipidémiou a hypertenziou. Navyše, nezávislým rizikovým faktorom pre mikroalbuminúriu je aj obdobie puberty [38], čo pravdepodobne prispelo k vyššej prevalencii mikroalbuminúrie aj v našom súbore, keďže priemerný vek sledovaných pacientov bol 13 rokov. U adolescentov s T1D často dochádza k zhoršeniu kompenzácie kvôli endokrinným zmenám v puberte (rastový faktor podobný inzulínu – IGF, sexuálne hormóny) [39], ale aj kvôli nedostatku fyzickej aktivity, nadmernému príjmu potravy, nedodržiavaniu inzulínového režimu, prípadne kvôli rizikovému správaniu (alkohol, fajčenie, drogy, antikoncepcia).
Podľa našich výsledkov u detí s T1D, null polymorfizmus glutatión S-transferázy T1 je asociovaný s vyššou koncentráciou mikroalbuminúrie, častejší výskyt tohto polymorfizmu u jedincov s incipientnou nefropatiou však nebol signifikantný. V budúcnosti sú vhodné ďalšie štúdie s väčším počtom sledovaných jedincov, ktoré by potvrdili alebo vyvrátili spojitosť GST polymorfizmov s chronickými diabetickými komplikáciami.
Poďakovanie
Za odbornú pomoc pri stanovení génových polymorfizmov ďakujeme doc. Mgr. Eve Babušíkovej, PhD., z Ústavu lekárskej biochémie Jesseniovej lekárskej fakulty Univerzity Komenského v Martine, pod vedením prof. MUDr. Dušana Dobrotu, CSc.
Práca bola podporená grantom „OPV – 26110230031/04/D/2010“a projektom “Dobudovanie Centra experimentálnej a klinickej respirológie – CEKR II”, ktorý je spolufinancovaný zo zdrojov EÚ.
Došlo: 19. 6. 2012
Přijato: 21. 10. 2012
MUDr. Jarmila Vojtková, PhD.
Klinika detí a dorastu JLF UK a UNM
Kollárova 2
036 01 Martin
Slovenská republika
e-mail: jarmilavojtkova@gmail.com
Zdroje
1. Rybka J. Diabetes mellitus – komplikace a přidružená onemocnění. 1. vyd. Praha: Grada, 2007: 1–320.
2. Bouček P, Kvapil M, Monhart V, Pelikanova T, Rychlik I, a spol. Česká diabetologická společnost ČLS JEP a Česká nefrologická společnost. Doporučené postupy při diabetickém onemocnění ledvin. Aktuality v nefrologii 2012; 18: 18–26.
3. Ha H, Hwang IA, Park JH, Lee HB. Role of rective oxygen species in the pathogenesis of diabetic nephropathy. Diabetes Res Clin Pract 2008; 82: S42–45.
4. Chudý P, Bánovčin P ml. Poruchy hemostázy pri nešpecifických črevných zápaloch. Lekársky obzor 2008; 56 (7–8): 324–329.
5. Oliviera AL, Rodrigues FF, Santos RE, Aoki T, Rocha MN, et al. GSTT1, GSTM1 and GSTP1 polymorphisms and chemotherapy response in locally advanced breast cancer. Genet Mol Res 2010; 9: 1045–1053.
6. Datta SK, Kumar V, Ahmed RS, Tripathi AK, Kalra OP, Banerjee BD. Effect of GSTM1 and GSTT1 double deletions in the development of oxidative stress in diabetic nephropathy patients. Indian J Biochem Biophys 2010; 47: 100–103.
7. Bid HK, Konwar R, Saxena M, Chaudhari P, Agrawal CG, Banerjee M. Association of glutathione S-transferase (GSTM1, T1 and P1) gene polymorphisms with type 2 dia-betes mellitus in north Indian population. J Postgrad Med 2010; 56: 176–181.
8. Ramprasath T, Senthil Murugan P, Prabakaran AD, Gomathi P, Rathinavel A, Selvam GS. Potential risk modifications of GSTT1, GSTM1 and GSTP1 (glutathione-S-transferases) variants and their association to CAD in patients with type-2 diabetes. Biochem Biophys Res Commun 2011; 407: 49–53.
9. American Diabetes Association. Diagnosis and classification of diabetes mellitus. Diabetes Care 2008; 31: S55–S60.
10. Havlicekova Z, Jurko A Jr. Heart rate variability changes in children after cardiac transplantation. Bratisl lek Listy 2005; 106: 168–170.
11. Brndiarová M, Mikler J, Bánovčin P., Michnová T, Fábry J. Extraezofágový reflux – otorinolaryngologické komplikácie gastroezofágového refluxu. Čes-slov Pediat 2011; 66: 85–91.
12. Babušíková E, Jeseňák M, Kirschnerová R, Bánovčin P, Dobrota D. Association of oxidative stress and GST-T1 gene with childhood bronchial asthma. J Phy-siol Pharmacol 2009; 60: S27–30.
13. Jeseňák M, Havlíčeková Z, Buchanec J, Villa MP, Ronchetti R, Bánovčin P. Diagnostický algoritmus potravinovej alergie v detskom veku. Čes-slov Pediat 2008; 63: 272–282.
14. Mikler J, Banovcin P, Jesenak M, Hamzikova J, Statelova D. Successful treatment of extreme acute lead intoxication. Toxicol Ind Health 2009; 25: 137–140.
15. Sivák S, Kurca E, Hladká M, Zelenák K, Turcanová-Koprusáková M, Michalik J. Early and delayed auditory oddball ERPs and brain MRI in patients with MTBI. Brain Inj 2008 Feb; 22 (2):193–197.
16. Straka L, Novomeský F, Krajcovic J, Stuller F, Brzo-bohatá A, Vojtísek T. Forensic interpretation of postmortal ethanol neogenesis in blood samples of cadaverously decomposed bodies. Soud Lek 2010; 55 (2): 18–21.
17. Manfredi S, Calvi D, Fiandra M, Botto N, Biagini A, Andreassi MG. Glutathione S-transferase T1- and M1- null genotypes and coronary artery disease risk in patients with Type 2 diabetes mellitus. Pharmacogenomics 2009; 10: 29–34.
18. Yalin S, Hatungil R, Tamer L, Ates NA, Dogruer N, et al. Glutathine S-transferase gene polymorphisms in Turkish patients with diabetes mellitus. Cell Biochem Funct 2007; 25: 509–513.
19. Hori M, Oniki K, Ueda K, Goto S, Mihara S, et al. Combined glutathione-S-transpherase T1 and M1 positive genotype afford protection against type 2 diabetes in Japanese. Pharmacogenomics 2007; 8: 1307–1314.
20. Hossaini AM, Zamrroni IM, Kashem RA, Khan ZF. Polymorphism of glutathione S-transferases as genetic risk factors for the development of complica-tions in type 2 diabetes mellitus. J Crit Care 2008; 23: 444–448.
21. Bekris LM, Stephard C, Peterson M, Hoehna J, Van Yserloo B, et al. Glutathione-s-transpherase M1 and T1 polymorphisms and association with type 1 diabetes age-at-onset. Autoimmunity 2005; 38: 567–575.
22. Datta SK, Kumar V, Pathak R, Tripathi AK, Ahmed RS, et al. Association of glutathione S-transferase M1 and T1 gene polymorphism with oxidative stress in diabetic and nondiabetic chronic kidney disease. Ren Fail 2010; 32: 1189–1195.
23. Fujita H, Narita T, Meguro H, Shimotomai T, Kitazato H, et al. No association of glutathione S-transferase M1 gene polymorphism with diabetic nephropathy in Japanese type 2 diabetic patients. Ren Fail 2000; 22: 479–486.
24. Yang Y, Kao MT, Chang CC, Chung SY, Chen CM, et al. Glutathione S-transferase T1 deletion is a risk factor for developing end-stage renal disease in diabetic patients. Int J Mol Med 2004; 14: 855–859.
25. Hovnik T, Dolzan V, Bratina NU, Podkrajsek KT, Battelino T. Genetic polymorphisms in genes encoding antioxidant enzymes are associated with diabetic retinopathy in type 1 diabetes. Diabetes Care 2009; 32: 2258–2262.
26. Panduru NM, Moţa E, Moţa M, Cimponeriu D, Serafinceanu C, Cheţa DM. Polymorphism of catalase gene promoter in Romanian patients with diabetic kidney disease and type 1 diabetes. Rom J Intern Med 2010; 48: 81–88.
27. Dos Santos KG, Canani LH, Gross JL, Tschiedel B, Souto KE, Roisenberg I. The catalase -262C/T promoter polymorphism and diabetic complications in Caucasians with type 2 diabetes. Dis Markers 2006; 22: 355–359.
28. Mohammedi K, Maimaitiming S, Emery N, Bellili-Muñoz N, Roussel R, et al. Allelic variations in superoxide dismutase-1 (SOD1) gene are associated with increased risk of diabetic nephropathy in type 1 diabetic subjects. Mol Genet Metab 2011; 104: 654–660.
29. Lee SJ, Choi MG, Kim DS, Kim TW. Manganese superoxide dismutase gene polymorphism (V16A) is associated with stages of albuminuria in Korean type 2 diabetic patients. Metabolism 2006; 55: 1–7.
30. Viswanathan V, Tilak P, Kumpatla S. Risk factors associated with the development of overt nephropathy in type 2 diabetes patients: A 12 years observational study. Indian J Med Res 2012; 136: 46–53.
31. Zhou Y, Guo LX, Yu DN, Zhou L, Wang Y, et al. Analyses on the relative factors regarding diabetic nephropathy among 1758 cases of type 2 diabetic patients. Zhonghua Liu Xing Bing Xue Za Zhi 2012; 33: 610–613.
32. Suláková T, Janda J. Ambulatory blood pressure in children with diabetes 1. Pediatr Nephrol 2008; 23: 2285–2286.
33. Suláková T, Janda J, Cerná J, Janstová V, Suláková A, Slaný J, Feber J. Arterial HTN in children with T1DM-frequent and not easy to diagnose. Pediatric Diabetes 2009; 10: 441–448.
34. Bessa SS, Ali EM, Hamdy SM. The role of glutathione S- transferase M1 and T1 gene polymorphisms and oxidative stress-related parameters in Egyptian patients with essential hypertension.Eur J Intern Med 2009; 20: 625–630.
35. Capoluongo E, Onder G, Concolino P, Russo A, Santonocito C, et al. GSTM1-null polymorphism as possible risk marker for hypertension: results from the aging and longevity study in the Sirente Geographic Area (ilSIRENTE study). Clin Chim Acta 2009; 399: 92–96.
36. Chaturvedi N, Bandinelli S, Mangili R, Penno G, Rottiers RE, Fuller JH. Microalbuminuria in type 1 diabetes: rates, risk factors and glycemic threshold. Kidney Int 2001; 60: 219–227.
37. Stephenson JM, Fuller JH. Microalbuminuria is not rare before 5 years of IDDM: EURODIAB IDDM Complications Study Group and the WHO Multinational Study of Vascular Disease in Diabetes Study Group. J Diabetes Complications 1994; 8:166–173.
38. Donaghue KC, Chiarelli F, Trotta D, Allgrove J, Dahl-Jorgensen K. Microvascular and macrovascular complications associated with diabetes in children and adolescents. ISPAD Clinical Practice Consensus Guidelines 2009 Compendium. Pediatric Diabetes 2009; 10: 195–203.
39. Court JM, Cameron FJ, Berg-Kelly K, Swift PGF. Diabetes in adolescence. Pediatric Diabetes 2008; 9: 255–262.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorastČlánok vyšiel v časopise
Česko-slovenská pediatrie

2013 Číslo 2
- Gastroezofageální reflux a gastroezofageální refluxní onemocnění u kojenců a batolat
- Sekundárne protilátkové imunodeficiencie z pohľadu reumatológa – literárny prehľad a skúsenosti s B-deplečnou liečbou
Najčítanejšie v tomto čísle
- Telarché praecox (předčasný vývoj prsů)
- Adrenarché praecox (předčasné pubické a/nebo axilární ochlupení)
- Vývoj střevní mikroflóry a rizika používání probiotik u imunosuprimovaných dětí
- Dievča s karyotypom 46, XY
