Vývoj střevní mikroflóry a rizika používání probiotik u imunosuprimovaných dětí
Development of gut microbiota and risks of probiotics use in immunocompromised children
The aim of this study was to highlight the important role of gut and microbiota for human health and disease. Investigations realized over last decades considerably altered the common perception about the role of large gut and microbiota in both human health and disease. Large gut is not only organ for the storage and excretion of waste matter and where absorption of water and other nutrients is taking place. This organ together with microbiota is metabolically active and serves as substantial defensive mechanism. Alteration of gut mucosa and/or deviation in microbiota composition may arise anytime during the whole life and may be relate to the manifestation of different disorders (allergy, autoimmune diseases, and obesity). Therefore large attention is nowadays given to the options positively modulate the microbiota in attempt to prevent the onset of pathological condition or to positively influence existing disorders by supplementation of probiotics. Understanding how the human gut microbiota and host are affected by probiotic bacterial strains still requires carefully controlled laboratory and clinical studies. Use of probiotics in immunocompromised patients could not only bring positive effect, but on the other hand also could generate serious health risks.
Key words:
gut microbiota, immunity, efficacy, safety, probiotics, immunocompromised child
Autori:
P. Sedláček 1; D. Janečková 1; J. Vávrová 2; K. Dědečková 2; P. Říha 1; P. Keslová 1
Pôsobisko autorov:
Klinika dětské hematologie a onkologie UK 2. LF a FN Motol, Prahapřednosta prof. MUDr. J. Starý, DrSc.
1; Ústav lékařské mikrobiologie UK 2. LF a FN Motol, Prahapřednosta MUDr. P. Dřevínek, Ph. D.
2
Vyšlo v časopise:
Čes-slov Pediat 2013; 68 (2): 119-130.
Kategória:
Přehledný článek
Súhrn
Cílem této práce je poukázat na důležitou roli tlustého střeva a střevní mikroflóry pro zdraví a nemoc člověka. Výzkumy vedené v posledních desetiletích významně ovlivnily obecné povědomí o roli, kterou hraje u lidí ve zdraví a nemoci tlusté střevo a střevní mikroflóra (mikrobiom). Tlusté střevo zdaleka není jen orgánem, ve kterém se hromadí a kterým se následně vylučují zbytky stravy a kde dochází k absorpci vody a živin. Tento orgán ve spolupráci se střevní mikroflórou je metabolicky aktivní a funguje jako důležitý obranný mechanismus. Porucha sliznice střeva a/nebo odchylky ve složení mikrobiomu mohou vznikat kdykoliv v průběhu celého života a mohou souviset s manifestací různých chorob (alergie, autoimunitní choroby, obezita). Z toho důvodu je nyní věnována velká pozornost možnostem pozitivně ovlivnit mikrobiom ve snaze předejít rozvoji patologických stavů či příznivě ovlivnit existující poruchy například podáváním probiotik. K porozumění mechanismům, jak může být lidská střevní mikroflóra ovlivněna probiotickými bakteriálními kmeny, je stále zapotřebí pečlivě kontrolovaných laboratorních i klinických studií. Podávání probiotik imunosuprimovaným pacientům může představovat nejen pozitivní efekt, ale na druhou stranu i závažná zdravotní rizika.
Klíčová slova:
střevní mikrobiom, imunita, účinnost, bezpečnost, probiotika, imunosuprimované dítě
ÚVOD
Tlusté střevo je sídlem komunity více než 500 různých převážně anaerobních bakteriálních druhů a dalších stovek protozoí, anaerobních hub a bakteriofágů. Počty mikroorganismů se v různých pracích velice liší. Příčinou může být skutečnost, že až 80 % bakteriálních druhů, které je možno detekovat metodou PCR z lidského střeva, nelze úspěšně kultivovat. Též různé metody detekce mikroorganismů přináší rozdílné výsledky [1]. Cílem přehledového článku je stručně zmínit zkušenosti s podáváním probiotik a prebiotik a shrnout současné poznání o vhodných indikacích, efektivitě a bezpečnosti podávání probiotik v prevenci či v léčbě střevních obtíží. Tato práce může napomoci zdravotníkům v rozhodování o vhodném použití, výhodách a potenciálních rizicích probiotik v různých skupinách dětských pacientů.
Studie lidského mikrobiomu ukazují, že jeho skladba se významným způsobem individuálně liší ve spektru a poměrech mikrobů, které postupně osídlují střevo. Příčina této rozmanitosti u zdravých i nemocných jedinců zůstává stále tajemstvím. Nepochybně však je ovlivňována vlivy, mezi které patří dieta (industrializace, urbanizace, ekonomický vývoj, globalizace), vnější prostředí (časnost mikrobiální expozice), genetické předpoklady nositele a různorodost metabolických vlivů. V neposlední řadě její složení ovlivňují celkové změny organismu při nemoci a užívání různých léků (chemoterapie, antibiotika, antacida…). Střevní mikroflóra se podílí na regulaci vzrůstajícího počtu imunologických procesů [2]. Střevní mikroflóra ovlivňuje motilitu a perfuzi střevní stěny, stimuluje imunitní systém na úrovni střeva a střevní mukózy, redukuje riziko bakteriální translokace, eliminuje toxiny, produkuje steroidy a vitaminy [3–4]. Střevní mikroflóra dále zajišťuje ochranu proti širokému spektru střevních patogenů (Salmonella, Shigella, Campylobacter, Yersinia…), potenciálních patogenů (Clostridium, Helicobacter…) a kvasinek (Candida). Neméně důležitá je i kontrola oportunní mikroflóry (Pseudomonas, Enterobacteria, Staphylococcus…) [5]. V důsledku vzniklé disharmonie mikrobiomu dochází k rozvoji různých patologických stavů. Ve snaze dosáhnout či udržet optimální mikrobiální poměry ve střevě dochází ke zvýšení zájmu odborníků i laické veřejnosti o využití probiotik, prebiotik a různých nutričních výrobků [6]. Podávání probiotik imunosuprimovaným pacientům může přinášet nejen pozitivní efekt, ale na druhou stranu i působit závažná zdravotní rizika. Výsledky, získané pečlivě navrženými laboratorními studiemi, mohou definovat předpoklady nutné k účinnému, efektivnímu a bezpečnému podávání probiotik i u imunosuprimovaných jedinců.
STŘEVNÍ MIKROFLÓRA – MIKROBIOM
Bezprostředně před porodem je střevo plodu absolutně sterilní [7]. Během a krátce po porodu se do novorozence dostávají mikroby z porodních cest a střevní mikroflóry matky, z vnějšího okolí (nemocnice, domov) a později zřejmě částečně i skrze mateřské mléko. Střevo začíná být během prvních hodin a dní života kolonizováno především laktobacily a bifidobakteriemi [8]. Počty a druhy bakterií se v průběhu prvních tří měsíců významně mění, ale pokud jsou pak podmínky stabilní, střevní mikroflóra se stabilizuje. Je stále více zřejmé, že komenzální mikroby získané v průběhu časného období po porodu hrají důležitou roli pro vývoj tolerance s hostitelem, samy mezi sebou a různými antigeny. Časná expozice vnějšímu prostředí a genetické faktory významně determinují charakteristiky individuální mikroflóry kojence. V této souvislosti se velmi diskutuje nepříznivý efekt podávání antibiotik v průběhu kojeneckého období. Zdá se, že v důsledku by toto mohlo mít negativní vliv na pozdější rozvoj astmatu či jiných alergií [9, 10]. Kojení zajišťuje ochranu proti infekcím. Mateřské mléko obsahuje řadu faktorů, které modulují a podporují imunitní reakci proti infekci. Tyto faktory zahrnují sekreční IgA, antimikrobní CD14-like protein, cytokiny, mastné kyseliny. Obsahuje též laktózu, která umožňuje bakteriím prospívat a množit se. Mateřské mléko je zdrojem především prebiotik a menšího množství různých probiotických kmenů (především laktobacilů a bifidobakterií). Pokud se laktóza nestačí v tenkém střevě rozložit, stane se v tlustém střevě potravou pro bifidobakterie [obr. 1].
Rozkladem laktózy vzniká kyselina mléčná, která zabraňuje usídlení patogenních bakterií. Během prvního roku je střevní ekosystém kojence kolonizován především oportunními mikroorganismy, kterým je dítě vystaveno. Stafylokoky, streptokoky a Escherichia coli jsou obvykle prvními, následovány jsou později striktními anaeroby jako Clostridia, Bifidobacteria, Ruminococci a Bacteroides [11]. U kojených dětí dominuje Bifidobacterium, ale s přechodem na tuhou stravu četnost bifidobakterií klesá [12]. Nedostatečná kolonizace střeva u kojenců může mít naopak negativní vliv na imunitní funkci střeva a zvyšovat rizika atopie či ekzémů [13–15]. Většinou je diskutována role mikrobiomu v nejčasnějších obdobích po porodu, je však třeba zdůraznit, že definitivní podoba mikrobiomu u zdravého člověka je utvářena po odstavení dítěte a zavedení další výživy a obvykle je v zásadě dotvořena kolem 1.–3. roku života [6, 16]. Svůj význam si ale udržuje po celé období života člověka.
U starších lidí se různorodost mikrobiomu snižuje, ubývá bifidobakterií a naopak přibývá stafylokoků, streptokoků a Enterobacteriaceae a u starých lidí pak především dominuje Clostridium species a Bacteroides [17, 18]. Je mnoho faktorů, které v průběhu celého života ovlivňují, jaké bakteriální druhy získávají či ztrácejí dominanci v gastrointestinálním traktu. Řada studií z posledních let prokazuje negativní vliv podávání antibiotik na poškození střevní mikroflóry [19]. Stres, jídlo, chemické léky, toxické prostředí, klima – to všechno jsou faktory, které stimulují nebo inhibují různé typy mikroorganismů. Již v ústech je vždy velké množství bakterií. Mnoho z nich se tam dostane ze snědeného jídla. V žaludku se jejich počet snižuje a v tenkém střevu zase počet narůstá a zvyšuje se dále směrem ke konečníku. Největší množství bakterií nalezneme v tlustém střevu, kde je jich řádově 1011. Celkem ve střevě dospělého člověka žijí stovky druhů mikroorganismů.
Přestože je však na planetě 100 různých bakteriálních divizí, pouze šest z nich kolonizuje lidské střevo (Bacteroidetes, Firmicutes, Actinobacteria, Proteobacteria, Fusobacteria, Verrucomicrobia) [20]. Dominantními mikroorganismy v tlustém střevě jsou bakterie, které tvoří až 60 % hmotnosti stolice, střevo je rezervoárem více než 1014 mikroorganismů. Naprostá většina (až 99 %) z 500 (-1000) různých bakteriálních druhů přítomných v tlustém střevu zdravého člověka je tvořena zástupci 40–50 běžnějších druhů. Mimo bakterie jsou ve střevech častými mikroorganismy i různé houby a prvoci, o nichž se však zatím ví jen málo. Z hub se ve střevech vyskytují rody Candida, Saccharomyces, Aspergillus a Penicillium, ale jejich význam narůstá při jejich pomnožení například v důsledku negativního selekčního tlaku antibiotik. Z těchto důvodů je zřejmé, že je téměř nemožné si utvořit jasný přehled o tom, jak vlastně funguje interakce mezi nositelem a velmi různorodou a změnám podléhající mikroflórou.
Z výsledků mnoha studií jednoznačně vyplývá, že bakteriální kolonizace hostitele úzce souvisí s vyzráváním jeho imunitního systému [21]. K dobré maturaci imunitního systému je zapotřebí signálů, které prostřednictvím imunomodulačních molekul vysílají symbiotické bakterie. Za určitých podmínek mohou bakterie působit symbioticky, ale při poruše imunitního systému naopak způsobují zánět (Helicobacter hepaticus, Clostridium difficile). Různé životní situace plné stresů nebo dysharmonie mají významný vliv na vytváření dysbiózy. Velký počet chemických léků potlačuje prospěšnou flóru a vyřazuje ji z normální činnosti. Také toxiny z prostředí mohou provokovat střevní dysbiózu. Potravní doplňky rovněž mohou neadekvátně porušit důležitou rovnováhu. Též klimatické vlivy podporují různé bakteriální kultury.
Dysbióza je často spojována s poruchami žaludku a střeva [22]. Příznaky, jako dyspepsie, zácpa nebo nedokončená stolice, se budou později manifestovat jako zánět žaludku nebo chronický zánět střev. Vředy na žaludku nebo na střevu mohou být následkem dysbiózy, pokud není řádně léčena a rozpoznána. Žlučníkové problémy a zácpa či průjem jsou často dávány do souvislosti s dysbiózou. Dysbióza je velmi často popisována u poruch imunitního systému, např. u potravinové nesnášenlivosti. Atopie nebo alergie, jako jsou ekzém a vyrážka, mají podobný původ [23]. Chronické zánětlivé nemoci, např. záněty kloubů, se také dostávají do kontextu s dysbiózou. Jisté typy migrény, kde jídlo a dieta jsou velmi podezřelé jako spouštěče potíží, by také mohly souviset se střevní dysbiózou.
PROBIOTIKA
Ke konci 19. století přišel ukrajinský vědec Ilja Mečnikov s tím, že konzumace fermentovaných mléčných výrobků vede k dlouhověkosti bulharských rolníků. Izoloval bakterii dnes známou jako Lactobacillus delbrueckii subsp. bulgaricus. Probiotické bakterie se uplatnily také během druhé světové války, kdy německý lékař A. Nissle objevil pozitivní účinky určitého kmene E. coli. Tento kmen, pojmenovaný po svém objeviteli E. coli Nissle 1917, se stal základem přípravku, který se používá při střevních obtížích. Samotný termín probiotikum byl poprvé použit až v roce 1965 vědci Lillym a Stillwellem. Podle jejich definice byla probiotika substancemi sekretovanými jedním mikroorganismem, stimulujícími růst jiných mikroorganismů [24]. V roce 1989 byla Fullerem definována probiotika jako živé organismy, které příznivě ovlivňují hostitele tím, že zlepšují rovnováhu střevní mikroflóry. Průmyslová výroba se datuje od 20. století.
Vztah mezi člověkem a mikroorganismy přítomnými v trávicím traktu je oboustranně výhodný. Mikroorganismy vykonávají řadu užitečných funkcí. Fermentují nevyužité organické látky z potravy, zamezují růstu patogenních druhů mikroorganismů, regulují vývoj střeva a v neposlední řadě produkují vitaminy (B12 a K). Působí jako bariéra, která ochraňuje integritu střevní sliznice, přeměňují karcinogeny na bezpečné metabolity, metabolizují bilirubin, cholesterol a v neposlední řadě stimulují imunitní odpověď. Také produkují hormony, které regulují ukládání tuků. Na druhou stranu mnohé mikroorganismy mohou způsobovat onemocnění. Zatímco jisté střevní bakterie jsou patogenní, řada probiotických bakterií přináší svému hostiteli řadu výhod. Na probiotika se v poslední době soustřeďuje značná pozornost. Pro jejich využití je ale důležité znát vlastnosti jednotlivých kmenů a druhů [25].
Probiotické mikroorganismy jsou typicky členy rodů Lactobacillus, Bifidobacterium a Streptococcus. Tyto bakterie jsou fermentující, obligatorně či fakultativně anaerobní organismy. Produkují kyselinu mléčnou. Jejich přirozenou biologickou schopností je v lidském trávicím traktu převážit nad jinými potenciálně patogenními mikroorganismy. Existuje mnoho hypotéz, jakým způsobem toho dosahují. Produkují metabolické látky, které příznivě působí na regulaci biologických funkcí ve střevě. Těmto látkám se někdy říká postbiotika a fungují jako biologické a imunní modulátory. Dodávají enzymy či ovlivňují enzymatickou aktivitu gastrointestinálního traktu. Ovlivňují pH ve střevě. Některé probiotické kmeny mají antioxidační vlastnosti, jsou schopny snižovat nadbytečná množství reaktivních radikálů a tím potenciálně snižovat rizika rozvoje onemocnění spojených s oxidativním stresem [26].
Velmi důležitou schopností některých probiotik je jejich schopnost kolonizovat střevo a přilnout k buňkám střeva formou biofilmu [27]. Adheze může trvat týdny až měsíce po požití poslední dávky probiotik. V takovém případě může dojít vlivem probiotik k imunostimulaci prostřednictvím aktivace a klonální expanze T a B lymfocytů, které pak migrují do slizničních systémů v celém těle. Biosurfaktanty, syntetizované některými probiotickými kmeny (např. Lactobacillus spp., Bacillus spp.) inhibují adhezi patogenních multirezistentních bakterií (např. Klebsiella pneumoniae, Enterococcus faecalis, Escherichia coli, Staphylococcus aureus) [28, 29]. Biosurfaktanty se mohou kromě antimikrobiální aktivity vyznačovat i antivirovou aktivitou. Například v případě biosurfaktantu surfaktinu produkovaného bakterií Bacillus subtilis se ukázalo, že je schopen působit proti herpesvirům a retrovirům.
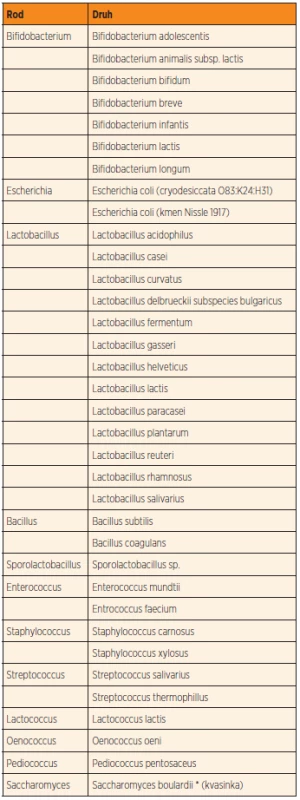
K nejvíce známým a prozkoumaným probiotickým bakteriím patří například velmi často používaný kmen Lactobacillus rhamnosus GG a dále Bifidobacterium lactis a Streptococcus thermophilus. Tyto a jiné probiotické bakterie (tab. 1) hrají důležitou roli při udržování rovnováhy a stability střevního mikrobiomu a tím zaručují plnou funkci střeva při vyměšování, vstřebávání vody a živin a v udržování imunitní funkce střeva [30]. Probiotika mohou minimalizovat poruchy střevní mikroflóry v průběhu či po podávání antibiotik. Této stability a rovnováhy může být dosaženo zvýšením podílu laktobacilů a bifidobakterií v mikrobiomu [25]. Tyto bakterie se biologicky odlišují od bakterií (gramnegativních), které neprodukují kyselinu mléčnou a rovněž mohou dominovat ve střevní mikroflóře (Klebsiella, Pseudomonas, Serratia a Proteus). Ty však patří mezi potenciálně škodlivé a nebezpečné bakterie, které mohou pronikat skrze střevní epitel a mohou být příčinou různých onemocnění. Probiotický efekt byl též studován u některých kvasinek a jejich produktů (Saccharomyces species).
Zdrojem probiotik mohou být různé potraviny (jogurt, kefír, sýry, kysané zelí, kvašené okurky, dětské probiotickými kmeny obohacené výživy apod.) či komerčně připravované preparáty obsahující jeden či více probiotických kmenů někdy v kombinaci s vitaminy, stopovými prvky a jinými potravinovými doplňky. Probiotické bakterie, obsažené v komerčních výrobcích, musí splňovat podmínku, že si udrží po dobu své trvanlivosti funkční a zdravotně prospěšné vlastnosti, které inzerují výrobci. Výrobek by měl splňovat podmínky, že po celou dobu trvanlivosti je uchována životnost a růstová schopnost probiotických kmenů a jejich schopnost po užití projít v účinné formě žaludkem až do střeva [31].
PREBIOTIKA
Prebiotika jsou obvykle oligosacharidy, které se vyskytují přirozeně v potravinách a/nebo jsou uměle přidávány do potravin, nápojů a kojenecké výživy. Přestože jsou nestravitelné, jejich přítomnost v trávicím ústrojí selektivně posiluje proliferaci a/nebo aktivitu některých probiotických kmenů v tlustém střevě (především Bifidobacterium species). Prebiotické oligosacharidy (frukto-oligosacharidy, galakto-sacharidy, sójové oligosacharidy, laktulóza, xylo-oligosacharidy, isomaltosacharidy, gentio-oligosacharidy a inulin) jsou tvořeny řetězci fruktózy s terminální glukózou a obsahují deset či méně molekul cukru. Řada z těchto oligosacharidů se kromě mateřského mléka vyskytuje v přírodní formě například v těchto potravinách: pšenice, cibule, banán, med, česnek, pórek, chřest, čekanka, sója aj.
Mezi probiotika též v širším pojetí zahrnujeme komplex polysacharidů, které jsou podkladem vlákniny. Přestože nukleotidy, které mohou být rovněž přítomny ve stravě, nesplňují definici prebiotika, považujeme je za takzvaně prebiotikům podobné látky, které mají imunomodulační efekt a ovlivňují biologické vlastnosti střeva. Jsou obsaženy jak v mateřském mléce, tak jsou přidávány i do některých produktů umělé výživy, nápojů a potravinových doplňků. V postmoderním světě se tzv. zdravá strava stává součástí každodenní diety a mimo své nutriční hodnoty nabízí i potenciální zdravotní užitek. Mezi nejčastěji využívané potraviny tohoto charakteru patří různé mléčné výrobky s obsahem probiotik a prebiotik [32].
SYNBIOTIKA
Synbiotika mohou být připravována zvlášť, nebo jsou přidávána do potravin jako potravinové doplňky. Podmínkou jejich kombinace není průkaz synergického efektu, ale podle některých studií se to jeví jako pravděpodobné. Konceptem vzniku synbiotik bylo kombinací probiotik s prebiotiky získat směs, která by příznivě působila na příjemce tím, že umožní prostřednictvím přítomných prebiotik podávaným probiotickým bakteriím uchovat životnost, osídlit trávicí ústrojí a stimulací jejich množení a metabolické aktivity prospěšně ovlivnit mikrobiom. Potravina/produkt mohou přímo ovlivnit životnost, fyziologii a účinnost probiotika jednak posílením, nebo naopak oslabením efektu [33]. Je však jen málo dostatečně podložených informací o tom, jaký mohou mít potraviny a komerčně připravované produkty vliv na účinnost probiotik.
VSTŘEBÁVÁNÍ
Podstatnou podmínkou efektu prebiotik a probiotik je samozřejmě jejich schopnost uchovat si funkční způsobilost pozitivně ovlivnit mikrobiální prostředí ve střevě tím, že jsou schopny bez inaktivace bezpečně a účinně proniknout trávicím ústrojím až do tlustého střeva [34–37]. Je proto důležité probiotickým kmenům zajistit odolnost vůči kyselému prostředí žaludku, žluče a prostředí tenkého střeva. Řada projektů s dobrovolníky prokázala, že ne všechny komerčně dostupné formy probiotik jsou vhodné a jejich průnik se u zdravých dobrovolníků někdy významně lišil, a to v závislosti na množství přijatých kolonií, druhu probiotického kmene a jistě i na individuálních okolnostech zkoumaných jedinců. Pro zajištění očekávaného příznivého efektu probiotika je též důležitá volba bakterií, které jsou schopny adherence ke střevní stěně [31]. Vedle vhodného výběru probiotického kmenu a jeho formy může důležitým faktorem ovlivňujícím úspěšnost průniku probiotika do střevního traktu být i množství podaných bakteriálních kolonií, ale pro toto tvrzení zatím nejsou jednoznačné důkazy.
INDIKACE K POUŽITÍ PROBIOTIK
Probiotika se používají u dětí preventivně i léčebně v řadě indikací. Řada studií potvrdila příznivý efekt probiotik v prevenci a léčbě akutního průjmového onemocnění, průjmu spojeného s předchozí léčbou antibiotiky (antibiotic-associated diarrhoea; AAD), v podpůrné léčbě ulcerózní kolitidy. Přestože na základě kazuistik byl pozorován příznivý vliv probiotik u celé řady dalších patologických stavů, nejednoznačné nebo nesignifikantní výsledky většinou velmi různorodých studií s nedostatečnými počty pacientů neumožňují kvalifikovaně posoudit skutečnou pozitivní roli probiotik v podpůrné léčbě Crohnovy nemoci, nekrotizující enterokolitidy, akutní pankreatitidy, syndromu dráždivého tračníku (IBS), obezity a v prevenci či léčbě kožních alergií [16, 38].
Probiotika jsou používána též v podpůrné léčbě pacientů s nádorovým onemocněním (např. Saccharomyces…). Předpokladem je jejich předpokládaný protinádorový efekt (kolorektální karcinom) [39, 40] či příznivý ochranný efekt ve střevě na snížení rizika bakteriální translokace vedoucí ke vzniku enterogenní infekce (enterokolitidy či sepse) při střevní dysmikrobii a/nebo poškozené střevní sliznici vlivem chemoterapie či aktinoterapie. Zkušenosti u této skupiny pacientů jsou ale velmi sporé. V jedné randomizované studii se autoři snažili příznivě ovlivnit střevní mikroklima podáváním preparátu Yakult, který obsahuje probiotický kmen Bifidobacterium breve kmen Yakult s cílem předejít rozvoji střevní infekce u 42 pacientů v průběhu intenzivní léčby nádorového onemocnění. Autoři hodnotili efekt ve snížení incidence infekcí, změn střevní mikroflóry, změny koncentrace organických kyselin ve stolici a pH stolice. Prokázali pokles infekcí ve skupině pacientů, kteří užívali probiotikum. V jejich střevní mikroflóře došlo k posílení přítomnosti anaerobních bakterií. K významnějšímu narušení mikrobiomu došlo ve skupině, které bylo podáváno placebo, a to především navýšením populace bakterií ze skupiny Enterobacteriaceae. Podle těchto pilotních dat se zdá, že kultura Bifidobacterium breve kmen Yakult by mohla být pro imunosuprimované pacienty bezpečnou a přínosnou intervencí při úpravě poškozené střevní mikroflóry [41].
U pacientů po transplantaci kmenových buněk krvetvorby dochází velmi rozmanitými mechanismy (léčba antibiotiky, podávání chemoterapeutik, imunosupresiv, poškození střevní mikroflóry již v průběhu předcházející léčby, kolonizace střevního obsahu multirezistentními bakteriálními kmeny, kolonizace kvasinkové, toxické poškození střev, omezený enterální příjem potravy, selektivní dekontaminace trávicího traktu apod.) k poškození střevní stěny a k podstatným vesměs negativním změnám střevní mikroflóry [42]. Nadále při absenci kvalitních a dostatečně hodnotitelných a reprodukovatelných laboratorních i klinických studií existuje velká nejistota o bezpečnosti a efektivitě podávání probiotik u těchto dlouhodobě velmi imunitně suprimovaných pacientů. Pro tuto skupinu pacientů je proto zatím bezpečnější pečovat o střevo vhodnou volbou léků včetně přípravného předtransplantačního režimu s cílem snížit toxický efekt na střevní sliznici (režimy s redukovanou intenzitou; RIC) a se snahou upřednostňovat enterální výživu s dobrou kontrolou glukózové tolerance [43]. Nicméně právě u této skupiny pacientů by bylo velkým přínosem vhodné studie iniciovat.
BEZPEČNOST PROBIOTIK U IMUNOSUPRIMOVANÝCH PACIENTŮ
Na základě klinických studií a pozorování je známo, že různá probiotika mají různé profily bezpečnosti. Primárně by měla být probiotika pro klinické použití izolována z lidských materiálů, protože probiotika ze zvířecích materiálů mohou v sobě skrývat nepoznané faktory rizikové pro lidský organismus. Ačkoliv běžně nepředstavují pro zdravého člověka žádné riziko, u oslabených pacientů byly ojediněle pozorovány různé nežádoucí účinky [44] a dokonce i život ohrožující sepse způsobené běžně používanými kmeny probiotik (Saccharomyces boulardii, Bifidobacterium, Lactobacillus casei, Lactobacillus rhamnosus aj.) [45–48]. Americká pediatrická společnost proto vyjádřila obavy z používání probiotik u dětí, které jsou imunosuprimovány, trpí chronickými onemocněními, jsou vážně nemocné a mají zavedenu nějakou invazivní medicínskou pomůcku. Dokud tedy nebudou dostatečně eliminována bezpečnostní rizika pro vážně chronicky nemocné děti, neměla by u nich být léčba probiotiky zaváděna [38].
Z důvodu rizika translokace a diseminace probiotického kmenu v organismu pacienta se sníženou obranyschopností je nutné též prohloubit znalosti o senzitivitě a jejích proměnách používaných probiotických kmenů vůči spektru antibiotik, která se podávají preventivně či léčebně, intermitentně či dlouhodobě u této skupiny pacientů. Některé laktobacily projevují přirozenou vysokou rezistenci vůči řadě antibiotik, především vůči vankomycinu, která nemusí být přenosná [49]. Kromě toho ve střevě přítomné komenzální bakterie mohou předávat determinanty rezistence dalším patogenům a je proto nutno brát v úvahu rizika přenosu rezistence vůči antibiotikům i u laktobacilů. Rezistence vůči makrolidům, penicilinům a tetracyklinům byla prokázána u 40 izolátů Lactobacillus acidophilus, Lactobacillus plantarum, Lactobacillus crispatus a Lactobacillus casei, které byly izolovány ze stolic zdravých dobrovolníků. Opakované expozice antibiotikům vedly k selekci rezistentních mutant. V studii autoři testovali chování běžně používaného probiotického druhu (Lactobacillus rhamnosus ATCC 53103) vystaveného expozici některých antibiotik (erythromycin, tetracyclin, amoxicillin/klavulanát a ciprofloxacin). Výsledkem pozorování bylo, že dlouhodobá expozice probiotika erythromycinu a ciprofloxacinu může vést k selekci mutanty, která získá nižší citlivost vůči těmto antibiotikům, ačkoliv není zřejmé, že by tento mechanismus byl způsoben genetickou mutací či přenosem genu s rezistencí na tato antibiotika [50]. V další studii byl prokázán in vivo a in vitro přenos genu rezistence na vankomycin z enterokoka na běžně komerčně používaný probiotický druh Lactobacillus acidophilus, a to bez selekčního vlivu vankomycinu. Z těchto důvodů je potřeba pečlivě vážit možná rizika používání probiotik u imunosuprimovaných pacientů či u pacientů současně léčených antibiotiky [51].
Získaná schopnost rezistence bývá pro většinu mutant reverzibilní, ale důležitá je četnost reverzibilních mutací. Různé druhy laktobacilů jsou často používány v probiotických produktech, je proto potřeba věnovat více pozornosti jejich schopnosti získat rezistenci [52]. Řada publikací dokumentuje život ohrožující stavy v důsledku translokace probiotických kmenů u imunosuprimovaných pacientů. Tyto bakterie, ve většině případů naprosto bezpečné, nemusí být v takovém případě vnímány jako kauzální patogeny a jsou pak přehlíženy jako kontaminace. Z důvodů jejich špatné citlivosti na běžně používaná antibiotika nemusí být snadné zvolit účinnou léčbu. Problematika translokace a následné infekce způsobené probiotickými kmeny zasluhuje tedy velkou pozornost. V takové situaci je nutno zhodnotit možná rizika a možný prospěch pro pacienta [53]. Všechna tato fakta je nutno brát v úvahu v situaci, kdy bychom v rámci klinických studií a projektů plánovali krátkodobě či dlouhodobě probiotika podávat dětem s primární či sekundární imunodeficiencí (vrozené poruchy imunity, stavy po chemoterapii, po ozařování, po biologické léčbě autoimunitních onemocnění, po orgánových transplantacích či po transplantacích krvetvorných buněk).
ZÁVĚR
Paušální používání probiotik v klinické praxi s cílem preventivně či léčebně pozitivně ovlivnit zdravotní stav jedinců zatím není jednoznačně podpořeno kvalitními studiemi. Problémem je široké spektrum různých probiotických kmenů, testovaných jednotlivě či v kombinacích bez/nebo s prebiotiky, a to v různých dávkovacích schématech a u různých patologických stavů. Velkou proměnnou je vysoká variabilita střevní mikroflóry i u zdravých lidí, a to v závislosti na věku, dietních zvyklostech, imunitním stavu, předchozím či trvajícím užívání různých léků (včetně antibiotik) apod.
Je zřejmé, že podávání komerčně dostupných probiotických preparátů v různých formách (jogurty, kefíry, sýry, potravinové doplňky…) je bezpečné pro zdravou populaci, i když jejich pozitivní vliv není vždy jednoznačně prokázán. Jednou z příčin selhání jejich očekávaného přínosu může být neúspěšný transport probiotika až do tlustého střeva a trvalejší osídlení probiotického kmene ve střevní mikroflóře. Pro imunosuprimované pacienty mohou zvláště některé probiotické kmeny potenciálně představovat závažná zdravotní rizika. Výsledky, získané pečlivě navrženými laboratorními studiemi, mohou definovat předpoklady nutné k účinnému, efektivnímu a bezpečnému podávání probiotik i u imunosuprimovaných jedinců.
Poděkování
Za cenné připomínky a za pomoc s přípravou manuskriptu děkuji především MUDr. Pavlovi Dřevínkovi, Ph.D., a MUDr. Petrovi Tláskalovi, CSc., z Fakultní nemocnice v Motole.
Podpořeno projektem MZ ČR koncepčního rozvoje výzkumné organizace 00064203 (FN Motol).
Došlo: 13. 8. 2012
Přijato: 10. 11. 2012
Prof. MUDr. Petr Sedláček, CSc.
Klinika dětské hematologie a onkologie UK 2. LF
FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: petr.sedlacek@lfmotol.cuni.cz
Zdroje
1. Lagier JC, Armougom F, Million M, et al. Microbial culturomics: paradigma shift in the human gut microbiome study. Clin Microbiol Infect 2012; epub.
2. Holmes E, Kinross J, Gibson GR, et al. Therapeutic modulation of microbiota-host metabolic interactions. Sci Transl Med 2012; 4 : 137rv6.
3. Lata J, Jurankova J, Kopacova M, et al. Probiotics in hepatology. World J Gastroenterol 2011; 17 : 2890–2896.
4. Fric P. Probiotics in gastroenterology. Z Gastroenterol 2002; 40 : 197–201.
5. Forejt M. Impact of probiotics on the immune system of organism. Potravinarska Revue 2008; 2 : 18–19.
6. Palmer C, Bik EM, DiGiulio DB, et al. Development of the human infant intestinal microbiota. PLoS Biol 2007; 5 : 1556–1573.
7. Lewis DB, Gern JE, Hill HR, et al. Newborn immunology: relevance to the clinician. Curr Probl Pediatr Adolesc Health Care 2006; 36 : 189–204.
8. Guarino A, Wudy A, Basile F, et al. Composition and roles of intestinal microbiota in children. J Matern Fetal Neonatal Med 2012; 25 (Suppl 1): 63–66.
9. Marra F, Lynd L, Coombes M, et al. Does antibiotic exposure during infancy lead to development of asthma?: a systematic review and metaanalysis. Chest 2006; 129 : 610–618.
10. Lodinova-Zadnikova R, Prokesova L, Kocourkova I, et al. Prevention of allergy in infants of allergic mothers by probiotic Escherichia coli. Int Arch Allergy Immunol 2010; 153 : 201–206.
11. Bezirtzoglou E, Stavropoulou E. Immunology and probiotic impact of the newborn and young children intestinal microflora. Anaerobe 2011; 17 : 369–374.
12. Amarri S, Benatti F, Callegari ML, et al. Changes of gut microbiota and immune markers during the complementary feeding period in healthy breast-fed infants. J Pediatr Gastroenterol Nutr 2006; 42 : 488–495.
13. Abrahamsson TR, Jakobsson HE, Andersson AF, et al. Low diversity of the gut microbiota in infants with atopic eczema. J Allergy Clin Immunol 2012; 129 : 434–440.
14. Ismail IH, Oppedisano F, Joseph SJ, et al. Reduced gut microbial diversity in early life is associated with later development of eczema but not atopy in high-risk infants. Pediatr Allergy Immunol 2012 Nov; 23 (7): 674–681.
15. Walker WA. Mechanisms of action of probiotics. Clin Infect Dis 2008; 46 (Suppl 2): 87–91.
16. Ringel-Kulka T. Targeting the intestinal microbiota in the pediatric population: a clinical perspective. Nutr Clin Pract 2012; 27 : 226–234.
17. Biagi E, Nylund L, Candela M, et al. Through ageing, and beyond: gut microbiota and inflammatory status in seniors and centenarians. PLoS One 2010; 5: e10667.
18. Prakash S, Rodes L, Coussa-Charley M, et al. Gut microbiota: next frontier in understanding human health and development of biotherapeutics. Biologics 2011; 5 : 71–86.
19. Ubeda C, Taur Y, Jenq RR, et al. Vancomycin-resistant Enterococcus domination of intestinal microbiota is enabled by antibiotic treatment in mice and precedes bloodstream invasion in humans. J Clin Invest 2010; 120 : 4332–4341.
20. Peterson DA, Frank DN, Pace NR, et al. Metagenomic approaches for defining the pathogenesis of inflammatory bowel diseases. Cell Host Microbe 2008; 3 : 417–427.
21. Candela M, Biagi E, Maccaferri S, et al. Intestinal microbiota is a plastic factor responding to envi-ronmental changes. Trends Microbiol 2012; 20 : 385–391.
22. Dahlqvist G, Piessevaux H. Irritable bowel syndrome: the role of the intestinal microbiota, pathogenesis and therapeutic targets. Acta Gastroenterol Belg 2011; 74 : 375–380.
23. Sherman PM, Cabana M, Gibson GR, et al. Potential roles and clinical utility of prebiotics in newborns, infants, and children: proceedings from a global prebiotic summit meeting, New York City, June 27–28, 2008. J Pediatr 2009; 155 : 61–70.
24. Lilly DM, Stillwell RH. Probiotics: Growth-promoting factors produced by microorganisms. Science 1965; 147 : 747–748.
25. Fooks LJ, Gibson GR. Probiotics as modulators of the gut flora. Br J Nutr 2002; 88 (Suppl 1): S39–49.
26. Amaretti A, di Nunzio M, Pompei A, et al. Antioxidant properties of potentially probiotic bacteria: in vitro and in vivo activities. Appl Microbiol Biotechnol 2013 Jan; 97 (2): 809–817.
27. Duary RK, Rajput YS, Batish VK, et al. Assessing the adhesion of putative indigenous probiotic lactobacilli to human colonic epithelial cells. Indian J Med Res 2011; 134 : 664–671.
28. Rivardo F, Turner RJ, Allegrone G, et al. Anti-adhesion activity of two biosurfactants produced by Bacillus spp. prevents biofilm formation of human bacterial pathogens. Appl Microbiol Biotechnol 2009; 83 : 541–553.
29. Fernandez MF, Boris S, Barbes C. Probiotic properties of human lactobacilli strains to be used in the gastrointestinal tract. J Appl Microbiol 2003; 94 : 449–455.
30. Delcenserie V, Martel D, Lamoureux M, et al. Immunomodulatory effects of probiotics in the intestinal tract. Curr Issues Mol Biol 2008; 10 : 37–54.
31. Tuomola E, Crittenden R, Playne M, et al. Quality assurance criteria for probiotic bacteria. Am J Clin Nutr 2001; 73 : 393S–398S.
32. Nagpal R, Kumar A, Kumar M, et al. Probiotics, their health benefits and applications for developing healthier foods: a review. FEMS Microbiol Lett 2012 Sep; 334 (1): 1–15.
33. Sanders ME, Marco ML. Food formats for effective delivery of probiotics. Annu Rev Food Sci Technol 2012; 1 : 65–85.
34. Mahenthiralingam E, Marchbank A, Drevinek P, et al. Use of colony-based bacterial strain typing for tracking the fate of Lactobacillus strains during human consumption. BMC Microbiol 2009; 9 : 251.
35. Savard P, Lamarche B, Paradis ME, et al. Impact of Bifidobacterium animalis subsp. lactis BB-12 and, Lactobacillus acidophilus LA-5-containing yoghurt, on fecal bacterial counts of healthy adults. Int J Food Microbiol 2011; 149 : 50–57.
36. Bisanz JE, Reid G. Unraveling how probiotic yogurt works. Sci Transl Med 2011; 3 : 106ps41.
37. Prilassnig M, Wenisch C, Daxboeck F, et al. Are probiotics detectable in human feces after oral uptake by healthy volunteers? Wien Klin Wochenschr 2007; 119 : 456–462.
38. Thomas DW, Greer FR. Probiotics and prebiotics in pediatrics. Pediatrics 2010; 126 : 1217–1231.
39. Boleij A, Tjalsma H. Gut bacteria in health and disease: a survey on the interface between intestinal microbiology and colorectal cancer. Biol Rev Camb Philos Soc 2012; 87 : 701–730.
40. Blumberg R, Powrie F. Microbiota, disease, and back to health: a metastable journey. Sci Transl Med 2012; 4 : 137rv7.
41. Wada M, Nagata S, Saito M, et al. Effects of the enteral administration of Bifidobacterium breve on patients undergoing chemotherapy for pediatric malignancies. Support Care Cancer 2010; 18 : 751–759.
42. Jenq RR, Ubeda C, Taur Y, et al. Regulation of intes-tinal inflammation by microbiota following alloge-neic bone marrow transplantation. J Exp Med 2012; 209 : 903–911.
43. Thompson JL, Duffy J. Nutrition support challenges in hematopoietic stem cell transplant patients. Nutr Clin Pract 2008; 23 : 533–546.
44. Ozdemir O. Various effects of different probiotic strains in allergic disorders: an update from laboratory and clinical data. Clin Exp Immunol 2010; 160 : 295–304.
45. Zein EF, Karaa S, Chemaly A, et al. Lactobacillus rhamnosus septicemia in a diabetic patient associated with probiotic use: a case report. Ann Biol Clin 2008; 66 : 195–198.
46. Jenke A, Ruf EM, Hoppe T, et al. Bifidobacterium septicaemia in an extremely low-birthweight infant under probiotic therapy. Arch Dis Child Fetal Neonatal Ed 2012; 97: F217–218.
47. Berger RE. Lactobacillus sepsis associated with probio-tic therapy. J Urol 2005; 174 : 1843.
48. Kochan P, Chmielarczyk A, Szymaniak L, et al. Lactobacillus rhamnosus administration causes sepsis in a cardiosurgical patient – is the time right to revise probiotic safety guidelines? Clin Microbiol Infect 2011; 17 : 1589–1592.
49. Bernardeau M, Vernoux JP, Henri-Dubernet S, et al. Safety assessment of dairy microorganisms: the Lactobacillus genus. Int J Food Microbiol 2008; 126 : 278–285.
50. Drago L, Rodighiero V, Mattina R, et al. In vitro selection of antibiotic resistance in the probiotic strain Lactobacillus rhamnosus GG ATCC 53103. J Chemother 2011; 23 : 211–215.
51. Mater DD, Langella P, Corthier G, et al. A probiotic Lactobacillus strain can acquire vancomycin resistance during digestive transit in mice. J Mol Microbiol Biotechnol 2008; 14 : 123–127.
52. Drago L, Mattina R, Nicola L, et al. Macrolide resistance and in vitro selection of resistance to antibiotics in Lactobacillus isolates. J Microbiol 2011; 49 : 651–656.
53. Liong MT. Safety of probiotics: translocation and infection. Nutr Rev 2008; 66 : 192–202.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorastČlánok vyšiel v časopise
Česko-slovenská pediatrie

2013 Číslo 2
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Gastroezofageální reflux a gastroezofageální refluxní onemocnění u kojenců a batolat
Najčítanejšie v tomto čísle
- Telarché praecox (předčasný vývoj prsů)
- Adrenarché praecox (předčasné pubické a/nebo axilární ochlupení)
- Vývoj střevní mikroflóry a rizika používání probiotik u imunosuprimovaných dětí
- Dievča s karyotypom 46, XY
