-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Kvalita spánku detí a adolescentov s diabetes mellitus 1. typu
Quality of sleep in children and adolescents with type 1 diabetes
Introduction:
In aspect of the influence of quantity and quality of sleep on metabolic control of type 1 diabetes (T1D) the works extended in last years, but data are limited in childhood. In 2016 meta-analysis revealed that children with type 1 diabetes slept shorter than their peers. Conclusions were not done in aspect of sleep quality and presence of sleep disordered breathing.Goal:
The aim of work was to examine sleep quality by polysomnographic examination in the group of children with type 1 diabetes and to determine the influence of short-term and long-term metabolic compensation (HbA1c) on sleep quality in children with type 1 diabetes.Methods:
44 children (28 girls and 16 boys) aged 10–18 years with type 1 diabetes were included to the study after exclusion of children with hypoglycemia before and during polysomnography. The group was divided into two subgroups, The first group (n=23) consisted from children with sub-optimal metabolic control of diabetes (HbA1c 7.5–9%), while children with non-optimal control of diabetes (HbA1c ≥9%) were included to the second group. The subgroups did not differ in aspect of anthropometric parameters and diabetes duration. Results of continuous glucose monitoring and polysomnographic examinations were analysed in subgroups.Results:
We did not find significant difference in parameters of sleep latency, sleep effectivity, percentage of time spended in NREM N1, NREM N3, AHI and OAHI. Children with worse metabolic control of type 1 diabetes (HbA1c ≥9%) spent significantly more time in sleep stage of NREM N2 (51.352% vs. 45.565%, p=0.008), significantly less time in sleep stage of REM (15.990% vs. 19.052%, p=0.011) and had significantly lower effectivity of deep sleep (45.114% vs. 49.913%, p=0.028) comparing to children with long-term better metabolic control of diabetes. Obstructive sleep apnoe (OSA) was diagnosed in only one patient, 9 children had mild degree of central sleep disordered breathing.Conclusion:
Children with non-optimal metabolic control of T1D spent more time in sleep stage of NREM N2 and had significantly decreased effectivity of deep sleep NREM N3. Approximatelly one fifth of children with T1D had mild central disordered breathing, the prevalence of OSA was comparable with general pediatric population. We did not find difference in the occurance of sleep disordered breathing in relation to compensation of T1D in children and adolescents.Key words:
T1D, metabolic compensation, quality of sleep, effectivity of deep sleep, OSA
Autori: M. Čiljaková 1,2; J. Vojtková 1; A. Šujanská 1; M. Michalovičová 1; K. Pozorčiaková 1; Z. Sňahničanová 1; M. Jančinová 1; P. Ďurdík 1; Peter Bánovčin 1
Pôsobisko autorov: Klinika detí a dorastu JLF UK a UNM, Martin 1; Detské oddelenie NEDÚ, Ľubochňa 2
Vyšlo v časopise: Čes-slov Pediat 2017; 72 (1): 25-32.
Kategória: Původní práce
Súhrn
Úvod:
V poslednom období pribúdajú práce o vplyve zníženej kvantity a kvality spánku na metabolickú kompenzáciu diabetes mellitus 1. typu (DM1), dáta v detskom veku sú však limitované. Meta-analýza z roku 2016 vyhodnotila, že deti s diabetom 1. typu spali kratšie ako ich zdraví rovesníci. Závery ohľadom kvality spánku a prítomnosti spánkových porúch dýchania neboli stanovené.Cieľ:
Cieľom práce bolo vyšetriť kvalitu spánku pomocou polysomnografického vyšetrenia v skupine detí s DM1 a zistiť vplyv aktuálnej a dlhodobej metabolickej kompenzácie (HbA1c) na kvalitu spánku detí s DM1.Metóda:
Po vylúčení detí s hypoglykémiou pred alebo počas polysomnografie bolo do štúdie zaradených 44 detí (28 dievčat a 16 chlapcov) s DM1 liečených inzulínovou pumpou vo veku od 10–18 rokov. Súbor sme rozdelili do 2 podskupín, 1. skupinu (n = 23) tvorili deti s menej uspokojivou metabolickou kontrolou diabetu (HbA1c 7,5–9 %), zatiaľ čo do 2. skupiny (n = 21) boli zaradené deti s horšou kompenzáciou diabetu (HbA1c ≥9 %). Podskupiny sa nelíšili ohľadom antropometrických parametrov a doby trvania diabetu. V jednotlivých podskupinách boli analyzované výsledky kontinuálneho glukózového monitoringu a polysomnografického vyšetrenia.Výsledky:
Nezistili sme signifikantný rozdiel v parametroch spánková latencia, spánková efektivita, percento času stráveného v NREM N1, NREM N3, AHI a OAHI. Deti s dlhodobo horšou metabolickou kompenzáciou DM1 (HbA1c ≥9 %) strávili signifikantne viac času v štádiu spánku NREM N2 (51,352 % vs. 45,565 %, p = 0,008), signifikantne menej času v štádiu spánku REM (15,990 % vs. 19,052 %, p = 0,011) a mali významne nižšiu efektivitu hlbokého spánku (45,114 % vs. 49,913 %, p = 0,028) v porovnaní s deťmi s dlhodobo lepšou metabolickou kontrolou diabetu. Obštrukčné spánkové apnoe (OSA) sme diagnostikovali len u jedného pacienta, 9 detí malo ľahký stupeň centrálnej poruchy dýchania v spánku.Záver:
Deti s dlhodobo neuspokojivou metabolickou kontrolou DM1 strávili viac času v štádiu spánku NREM N2 a mali signifikantne nižšiu efektivitu hlbokého spánku NREM N3. Približne pätina detí s DM1 mala ľahkú centrálnu poruchu dýchania v spánku, výskyt OSA bol porovnateľný s bežnou detskou populáciou. Nezistili sme rozdiel vo výskyte spánkových porúch dýchania v závislosti od kompenzácie DM1 u detí a adolescentov.KĽÚČOVÉ SLOVÁ:
DM1, metabolická kompenzácia, kvalita spánku, efektivita hlbokého spánku, OSAÚVOD
V posledných rokoch sa v manažmente DM1 zaznamenali významné zmeny, v liečbe sa s úspechom používajú inzulínové analógy, inzulínové pumpy, kontinuálne glukózové senzory. Nové inzulíny a moderné technológie dokázali signifikantne redukovať riziko hypoglykémií, napriek tomu sa vo väčšine veľkých medzinárodných štúdií nepreukázalo výraznejšie zlepšenie metabolickej kompenzácie diabetu (HbA1c) za posledných 20 rokov [1, 2]. Rovnako štúdia publikovaná v roku 2014, kde hodnotili výsledky metabolickej kompenzácie diabetu v 20 krajinách na 5 kontinentoch u takmer 6000 detí a mladých dospelých vo vekovej kategórii 8–25 rokov, zistila priemerný HbA1c 8,5 % (N do 6,5 %), pričom len 27 % detí spĺňalo kritériá optimálnej metabolickej kontroly (HbA1c <7,5 % do 18 rokov, alebo <7 % nad 18 rokov) [3]. Napriek pokroku v terapii DM1 v súčasnosti teda existujú ďalšie faktory, ktoré nepriaznivo ovplyvňujú kontrolu diabetu v detskom veku. Okrem všeobecne nepriaznivej zmeny životného štýlu, v poslednom období pribúda prác o vplyve zníženej kvantity a kvality spánku na vznik diabetu a jeho metabolickú kompenzáciu. Udáva sa, že približne tretinu života prespíme, pričom deti by mali spať dlhšie. Podľa American Academy of Sleep Medicine (AASM), odporúčaná doba spánku vo veku 5–11 rokov je 10 hodín, vo veku 12–19 rokov 9 hodín. U dospelých sa spánok považuje za kvantitatívne dostatočný, ak trval minimálne 7 hodín [4].
Vzťah medzi spánkom a diabetom je dlhodobejšie popisovaný najmä u dospelej populácie s diabetes mellitus 2. typu (DM2). Podľa meta-analýzy 7 štúdií z roku 2010 (n = 107 756), redukcia kvantity spánku ≤5–6 hodín denne zvyšovala riziko vzniku DM2 (relatívne riziko RR 1,28) v priebehu nasledujúcich 5–17 rokov [5]. Riziko DM2 bolo tiež zvýšené pri dlhšom spánku >8–9 hodín (RR 1,48) [3]. U dospelých s DM2 bola popísaná podobná závislosť v tvare písmena U v štúdii japonských autorov (n = 4870), kde vyšší HbA1c bol v skupine s udávaným trvaním spánku ≤5,5 hodiny denne a v skupine ≥8,5 hodiny denne [6]. Okrem doby trvania spánku má význam aj správne načasovanie spánku. Po 10-ročnom sledovaní pracujúcich v rôznych periódach dňa (n = 2426) a pracujúcich iba v dennej smene (n = 3203) sa zistilo, že intermitentná práca v nočnej smene zvyšovala riziko vývoja DM2 (RR 1,35) [7].
Ukazuje sa, že okrem kvantity spánku má vzťah k inzulinorezistencii a k vývoju DM2 aj kvalita spánku. Supresia hlbokého spánku u zdravých dospelých (SWS – slow wave sleep, štádium NREM N3) viedla k zníženiu inzulínovej senzitivity o 25 % bez kompenzačného vzostupu inzulínu po podaní intravenóznej glukózy [8]. Obštrukčné spánkové apnoe (OSA) je charakterizované opakujúcimi sa epizódami prolongovanej parciálnej alebo intermitentne kompletnej obštrukcie horných dýchacích ciest (HDC) s následnou poruchou ventilácie, intermitentnou hypoxiou, fragmentáciou spánku, plytkým spánkom s redukciou hlbokého (SWS) spánku. Štandardným vyšetrením k posúdeniu kvality spánku je polysomnografia, ktorá dovoľuje presnú kvantifikáciu apnoických/hypopnoických respiračných udalostí za hodinu spánku (AHI), centrálnych alebo v dôsledku obštrukcie (OAHI). Diagnóza OSA u dospelých je stanovená pri OAHI ≥5, pričom stredne závažné OSA je definované ako OAHI 15–30 v dospelom veku [4]. V detskom veku sú kritériá pre diagnózu OSA modifikované, už OAHI ≥1,0 sa považuje za dostatočné pre diagnózu OSA, stredne závažný stupeň je 5–10 apnoických/hypopnoických respiračných udalostí za hodinu spánku [9, 10]. Výskyt OSA v dospelej populácii DM2 stúpa s vekom a v dôsledku globálnej epidémie obezity. Aj keď obezita je hlavným rizikovým faktorom pre vývoj OSA a inzulínovej rezistencie, aj samotné OSA môže viesť k inzulínovej rezistencii. Prevalencia DM2 u dospelých s OSA sa udáva 15–30 %, teda približne 3x vyššia ako v bežnej populácii. Rovnako prevalencia OSA u dospelých s DM2 je alarmujúca, udáva sa až 58–86% výskyt [4]. OSA je asociované s aktiváciou sympatikového nervového systému, zápalových procesov ako aj aktiváciou oxidačného stresu [11]. Existujú práce, ktoré preukázali u DM2 v kombinácii s OSA vyššie percento chronických komplikácií, vrátane periférnej neuropatie, retinopatie a nefropatie. Meta-analýzy sledujúce vplyv OSA liečby pomocou CPAP (continuous positive airway pressure) na metabolickú kompenzáciu diabetu poskytli nekonzistentné výsledky, nehodnotili však vplyv adherencie k liečbe zo strany dospelých pacientov [4].
V detskej populácii je OSA najčastejšie sa vyskytujúca spánková porucha s prevalenciou 1–5 % [12]. Detskí pacienti s týmto syndrómom predstavujú rizikovú skupinu pre možný vznik a následne ďalší rozvoj sekundárnych dôsledkov vyplývajúcich zo základných patofyziologických mechanizmov tohto ochorenia [13, 14]. Neurokognitívne zmeny v zmysle prejavov hyperaktivity a porúch správania, ktoré imitujú príznaky ADHD, neprospievanie, rastová retardácia, kardiovaskulárne, či metabolické poruchy patria medzi závažné klinické následky tohto ochorenia [14, 15, 16]. Obezita je významným rizikovým faktorom pre vznik a rozvoj OSA aj v detskom veku [17]. Práve depozitá tuku v oblasti krku tlakom prispievajú k zúženiu HDC počas spánku [18].
Znížená kvantita a kvalita spánku vedie k určitým patofyziologickým zmenám v metabolizme glukózy. Spánková deprivácia viedla k zníženému vychytávaniu glukózy v mozgu, predovšetkým v subkortikálnych a kortikálnych oblastiach [19]. Deprivácia a fragmentácia spánku sa spája so zvýšenou aktivitou SNS, ktorý má inhibičný vplyv na sekréciu inzulínu. Zvýšená aktivita SNS vedie navyše k stimulácii lipolýzy a vzostupu koncentrácie voľných mastných kyselín, ktoré podporujú vznik inzulínovej rezistencie [20, 21]. Existujú štúdie, ktoré preukázali zvýšené sérové koncentrácie noradrenalínu a adrenalínu, hormónov podporujúcich glukoneogenézu v súvislosti s redukciou spánku [22, 23]. Pri zníženej kvantite a kvalite spánku boli taktiež popísané zmeny v koncentrácii kortizolu a rastového hormónu [24], vzostup proinflamačných cytokínov [25], prispievajúcich k inzulinorezistencii. Reštrikcia spánku viedla k poklesu sérovej koncentrácie leptínu a vzostupu grelínu, tieto zmeny boli asociované so zvýšeným apetítom [26]. Intermitentná hypoxia (IH) následkom OSA viedla k inzulinorezistencii niekoľkými mechanizmami, okrem aktivácie SNS a nadobličkovej osi aj stimuláciou hepatálnej syntézy lipidov. Navyše IH zvyšovala oxidačný stres s nepriaznivým efektom aj na B bunky pankreasu [20, 27].
Prác venujúcich sa problematike vzťahu spánku a DM1 je neporovnateľne menej. Určité objasnenie do problematiky priniesla meta-analýza publikovaná v roku 2016, do práce bolo zahrnutých 22 štúdií venujúcich sa problematike spánku a DM1 prevažne v dospelom veku [28]. Dospelí jedinci s DM1 referovali nižšiu kvalitu spánku, pričom doba trvania spánku sa nelíšila v porovnaní so zdravými kontrolami. Spánok viac ako 6 hodín bol asociovaný s nižším HbA1c (o 0,24 %) v porovnaní so skupinou s kratším trvaním spánku [29], lepšiu metabolickú kontrolu (o 0,19 %) mali aj dospelí s DM1 s referovanou lepšou kvalitou spánku [30]. Väčšina prác využívala na hodnotenie kvality spánku dotazníkovú metódu. Autori konštatujú, že kvalita spánku mohla byť ovplyvnená faktormi ako je hypoglykémia, neuropatická bolesť či dysestézie [31]. Preukázalo sa, že hypoglykémia môže ovplyvniť tak spánkovú architektoniku ako aj efektivitu spánku. Prevalencia OSA v skupine dospelých s DM1 bola vysoká (51,9 %), pričom odhadovaná prevalencia OSA v dospelej populácii je len 3–7 %, zvyšuje sa s vekom a stupňom obezity [28, 32, 33]. Zaujímavosťou bolo, že priemerný BMI u dospelých s DM1 bol 22,9–25,8 kg/m2, čiže obezita nevysvetľovala vysokú prevalenciu OSA v skupine dospelých s DM1. Autori predpokladajú vplyv diabetickej neuropatie, predovšetkým autonómnej neuropatie na tonus faryngeálnych svalov a vznik OSA. Dospelí s AHI ≥15 mali horšiu metabolickú kontrolu diabetu. Prítomnosť OSA u dospelých s DM1 bola navyše asociovaná s kardiovaskulárnymi ochoreniami a retinopatiou [34].
Do meta-analýzy bolo zahrnutých len 5 prác, týkajúcich sa problematiky spánku a DM1 v detskom veku a adolescencii. Autori za základe rozboru 3 prác so súhrnným počtom 70 detí s DM1 a 70 zdravých kontrol konštatujú, že deti s diabetom spia o 26,55 minút kratšie ako ich zdraví rovesníci [35, 36, 37]. Závery ohľadom kvality spánku a prítomnosti OSA neboli stanovené. Kvalitu spánku hodnotenú pomocou PSG a vzťah k metabolickej kontrole diabetu (HbA1c, priemerná senzorová glukóza) v detskom veku analyzovala len práca Perfect a spol., publikovaná v roku 2012 [35]. Štúdia na súbore 40 detí s DM1 vo veku 10–16 rokov preukázala, že deti s lepšou metabolickou kontrolou strávili dlhší čas v hlbokom štádiu spánku (NREM N3). Práve hlboký spánok je asociovaný s aktiváciou parasympatikového nervového systému (PNS), nižšou aktivitou SNS a obnovou energetických zásob. 14 detí zo súboru malo AHI ≥1,5, tieto deti mali vyššiu priemernú glykémiu a strávili viac času v hyperglykémii.
Cieľom našej práce bolo vyšetriť kvalitu spánku pomocou polysomnografického vyšetrenia v skupine detí s DM1 a zistiť vplyv aktuálnej (priemerná senzorová glukóza, variabilita glykémií) a dlhodobej metabolickej kompenzácie (HbA1c) na kvalitu spánku detí s DM1.
METODIKA A SÚBOR PACIENTOV
Štúdia prebiehala v rokoch 2014 až 2016, po schválení Etickou komisiou JLF UK a UNM v Martine. Do štúdie boli zaradené deti s diabetes mellitus 1. typu (DM1) vo veku 10–18 rokov liečené inzulínovou pumpou, po písomnom súhlase zákonného zástupcu dieťaťa. Všetky deti spĺňali kritériá menej uspokojivej (HbA1c 7,5–9 %) alebo neuspokojivej (HbA1c ≥9 %) kompenzácie diabetu podľa definície ISPAD z roku 2014. Väčšina detí bola odoslaná regionálnymi detskými endokrinológmi na hospitalizáciu za účelom zlepšenia metabolickej kompenzácie, menšiu časť súboru tvorili deti dispenzarizované v Detskej endokrinologickej ambulancii UNM v Martine s nedostatočnou kontrolou diabetu v domácom prostredí. Do štúdie neboli zaradené deti s diabetom s pridruženým neurologickým, psychiatrickým, genetickým alebo kardiologickým ochorením, rovnako deti s poruchou funkcie štítnej žľazy alebo celiakiou boli primárne vyradené zo štúdie. Ďalším exklúznym kritériom bol akútny respiračný infekt, diabetická ketoacidóza alebo ťažká hypoglykémia pri prijatí alebo do 4 týždňov pred prijatím na hospitalizáciu.
Po splnení vstupných kritérií bol prvý deň hospitalizácie dieťaťu s DM1 aplikovaný glukózový senzor (Enlite, Medtronic), ktorý poskytoval kontinuálne informácie o stave intersticiálnej glukózy (288 meraní denne) v čase pred a počas polysomnografie. Prístroj bol denne kalibrovaný 3 hodnotami kapilárnej glukózy z glukometra, taktiež každá senzorová glukóza nad 15 mmol/l alebo pod 3,9 mmol/l bola zároveň overená hodnotou kapilárnej glukózy. Prístroj mal nastavené zvukové a vibračné výstrahy pri vysokej a nízkej senzorovej glukóze, deťom s hyperglykémiou nad 15 mmol/l bol podaný korekčný bolus podľa bolusového poradcu. Deti s klinickou hypoglykémiou a/alebo senzorovou hodnotou <3,9 mmol/l s potvrdenou kapilárnou hypoglykémiou 12 hodín pred a/alebo počas polysomnografického vyšetrenia boli vyradené zo štúdie. Výsledky kontinuálneho glukózového monitorovania hodnotil jeden špecialista v detskej endokrinológii pomocou počítačového programu (Carelink Pro, Medtronic).
Na tretí deň hospitalizácie každý pacient s DM1 podstúpil štandardné celonočné polysomnografické vyšetrenie v detskom spánkovom laboratóriu KDaD JLF UK UNM. V našej práci sme použili štandardizovaný polysomnografický prístroj ALICE Sleepware 5. Pre celonočné PSG vyšetrenie za štandardných podmienok bolo zabezpečené odporúčané priestorové vybavenie vo forme samostatnej miestnosti pre vyšetrovaný subjekt a ďalšej miestnosti pre technického pracovníka. Miestnosť bola príjemná, svetelne a zvukovo izolovaná. Predspánkový rituál a čas ukladania k spánku bol prispôsobený zaužívanému stereotypu dieťaťa v domácom prostredí. Nasadenie elektród predchádzalo zahájeniu monitorovania aspoň 1 hodinu pred spánkom. Počas celého nočného nahrávania bol prítomný školený technický pracovník, ktorý pripravil pacienta na vyšetrenie, kontinuálne sledoval správne nahrávanie jednotlivých parametrov, viedol písomný záznam a zasahoval v prípade technickej poruchy či potreby pacienta. Registrácia bola rozšírená o celonočný videozáznam pri infračervenom osvetlení. Medzi základné sledované polysomnografické parametre počas celonočnej registrácie patrili: elektroencefalogram (EEG), elektrookulogram (EOG) oboch očí, elektromyogram (EMG) svalov brady, elektrokardiogram (EKG), záznam dýchania (meraný prietok vzduchu nosom a ústami pomocou flow-senzora, dýchacie pohyby hrudníka a brucha snímané pomocou hrudných a brušných pásov), mikrofón, pulzný oxymeter, polohový snímač a elektromyogram (EMG) mm. tibiales anteriores. Pri polysomnografickom vyšetrení sme sledovali základné kvantitatívne informácie o štruktúre spánku. Respiračné udalosti boli skórované podľa American Academy of Sleep Medicine [38, 39]. Obštrukčné spánkové apnoe bolo definované ako počet apnoických a hypopnoických udalostí obštrukčného typu za hodinu spánku (OAHI ≥1/hodinu spánku). Skórovanie spánkových štádií bolo realizované podľa štandardizovaných kritérií podľa Rechtschaffena a Kalesa [40]. Pri vyšetrení bola prítomná zdravotná sestra zaškolená do PSG a manažmentu akútnych komplikácií diabetu. Komplexný polysomnografický záznam hodnotil jeden špecialista z detskej spánkovej medicíny.
Výsledky jednotlivých meraní boli štatisticky spracované štatistickým programom SYSTAT (verzia 11). Číselné hodnoty boli parametricky distribuované a vyjadrené ako priemer ± štandardná odchýlka. Pre určenie signifikantného rozdielu medzi podskupinami bol použitý Studentov t-test, pričom p <0,05 bolo považované za štatisticky signifikantný rozdiel.
VÝSLEDKY
Po splnení vstupných kritérií bolo primárne do štúdie zaradených 57 detí s DM1, 31 dievčat a 26 chlapcov. 9 detí bolo vyradených z dôvodu hypoglykémie pred alebo počas polysomnografického vyšetrenia. Dve deti nesúhlasili s aplikáciou kontinuálneho glukózového monitoringu, u ďalších 2 detí bolo meranie neúspešné vzhľadom na výrazné rozdiely medzi senzorovou a kapilárnou glukózou. Celkovo bolo do štúdie zaradených 44 detí (28 dievčat a 16 chlapcov) s DM1 liečených inzulínovou pumpou vo veku od 10–18 rokov. Následne sme súbor rozdelili do 2 podskupín, 1. skupinu (n = 23) tvorili deti s menej uspokojivou metabolickou kontrolou diabetu (HbA1c 7,5–9 %), zatiaľ čo do 2. skupiny (n = 21) boli zaradené deti s horšou kompenzáciou diabetu (HbA1c ≥9 %). Podskupiny sa nelíšili ohľadom antropometrických parametrov (hmotnosť, výška, BMI) a doby trvania diabetu (tab. 1).
Tab. 1. Porovnanie antropometrických parametrov, doby trvania diabetu a parametrov kontinuálneho glukózového monitorovania v skupine detí s HbA1c 7,5–9 % (n = 23) so skupinou detí s HbA1c ≥9 % (n = 21). 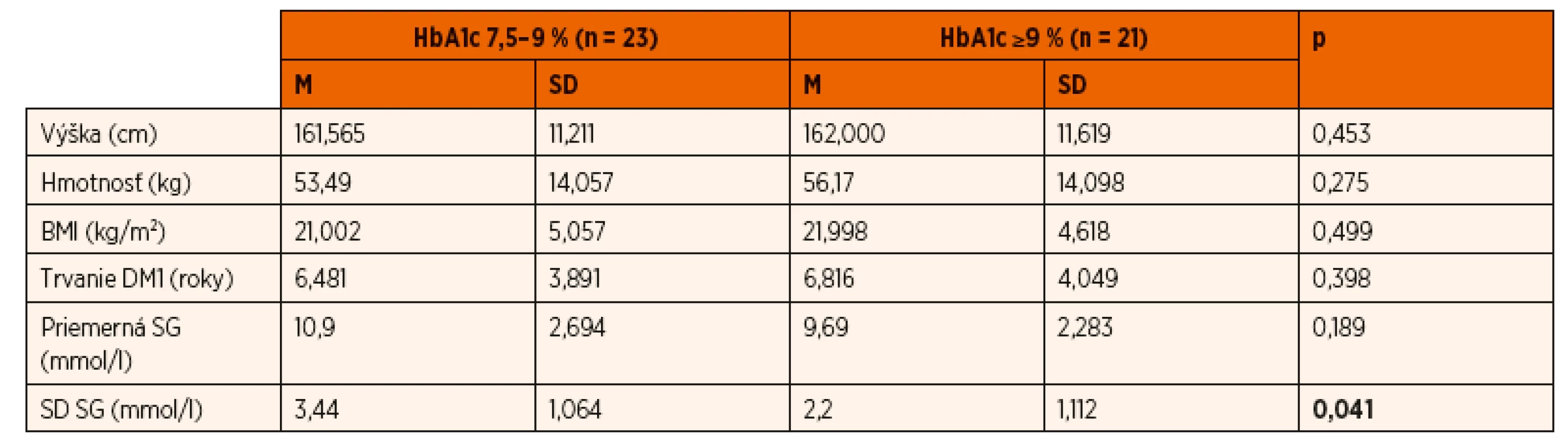
SG – senzorová glukóza SD SG – variabilita senzorovej glukózy V jednotlivých podskupinách boli analyzované výsledky kontinuálneho glukózového monitoringu v programe CareLink Pro, a to deň pred, počas a deň po polysomnografii. Vyhodnocovali sme priemernú senzorovú glukózu (SG) počas uvedených dvoch dní, prekvapivo v skupine s vyšším HbA1c bola priemerná SG lepšia (9,69 mmol/l, SD 2,283) ako v skupine s nižším HbA1c (10,9 mmol/l, SD 2,694), avšak rozdiel nebol štatisticky významný. Štatisticky významný rozdiel sme pozorovali v parametre variabilita senzorovej glukózy, označenej ako smerodajná odchýlka SG v počítačovom programe CareLink Pro. Variabilita glukózy (SD SG) bola signifikantne vyššia (p = 0,041) v skupine s nižším HbA1c (±3,44, SD 1,064) ako v skupine s vyšším HbA1c (±2,2, SD 1,112, tab. 1). Parametre aktuálnej metabolickej kompenzácie DM1 (priemerná SG, variabilita SG) tesne pred, počas a po PSG vyšetrení v našej práci nekorelovali s parametrom dlhodobej metabolickej kontroly diabetu (HbA1c).
Z komplexného záznamu PSG vyšetrenia sme analyzovali predovšetkým kvalitu (architektoniku) spánku. Vyhodnocovali sme spánkovú latenciu, index prebudení, spánkovú efektivitu, efektivitu hlbokého spánku, percento času stráveného v jednotlivých spánkových štádiách (REM, NREM N1, NREM N2, NREM N3), apnoe/hypopnoe index za hodinu spánku (AHI) a obštrukčný apnoe/hypopnoe index za hodinu spánku (OAHI). Nezistili sme signifikantný rozdiel v parametroch spánková latencia, spánková efektivita, percento času stráveného v NREM N1, NREM N3, AHI a OAHI (tab. 2). Deti s dlhodobo horšou metabolickou kompenzáciou DM1 (HbA1c ≥9 %) strávili signifikantne viac času v štádiu spánku NREM N2 (51,352 % vs. 45,565 %, p = 0,008), signifikantne menej času v štádiu spánku REM (15,990 % vs. 19,052 %, p = 0,011) a mali významne nižšiu efektivitu hlbokého spánku (45,114 % vs. 49,913 %, p = 0,028) v porovnaní s deťmi s dlhodobo lepšou metabolickou kontrolou diabetu (tab. 2, obr. 1). OSA sme diagnostikovali len u jedného pacienta, 9 detí malo ľahký stupeň centrálnej poruchy dýchania v spánku. Nezistili sme rozdiel vo výskyte spánkových porúch dýchania v závislosti od kompenzácie DM1.
Tab. 2. Porovnanie parametrov celonočnej polysomnografie v skupine detí s HbA1c 7,5–9 % (n = 23) so skupinou detí s HbA1c ≥9 % (n = 21). 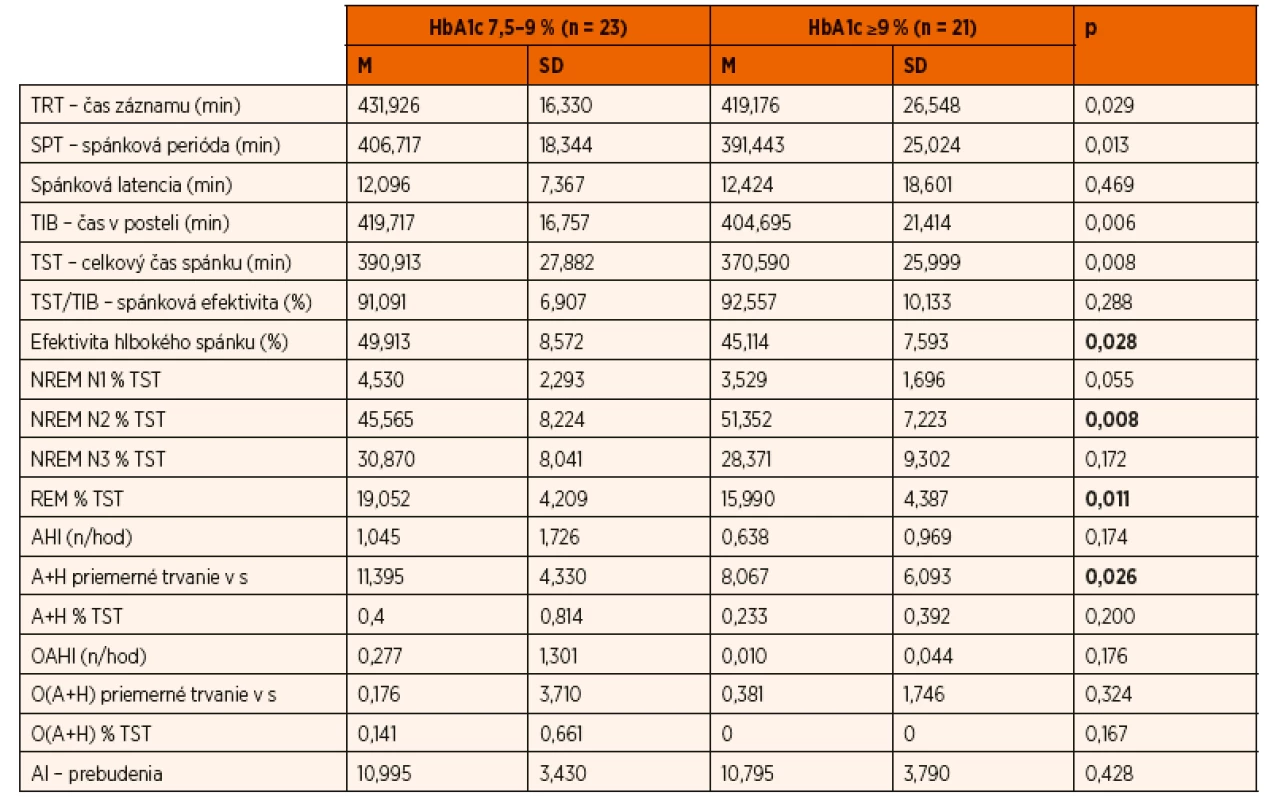
% TST = percento času z celkovej doby spánku Obr. 1. Grafické znázornenie trvania jednotlivých štádií spánku REM, NREM N1, NREM N2, NREM N3 u detí s DM1, vyjadrené ako percento celkovej doby spánku: porovnanie skupiny detí s HbA1c 7,5–9 % (n = 23) so skupinou detí s HbA1c ≥9 % (n = 21). 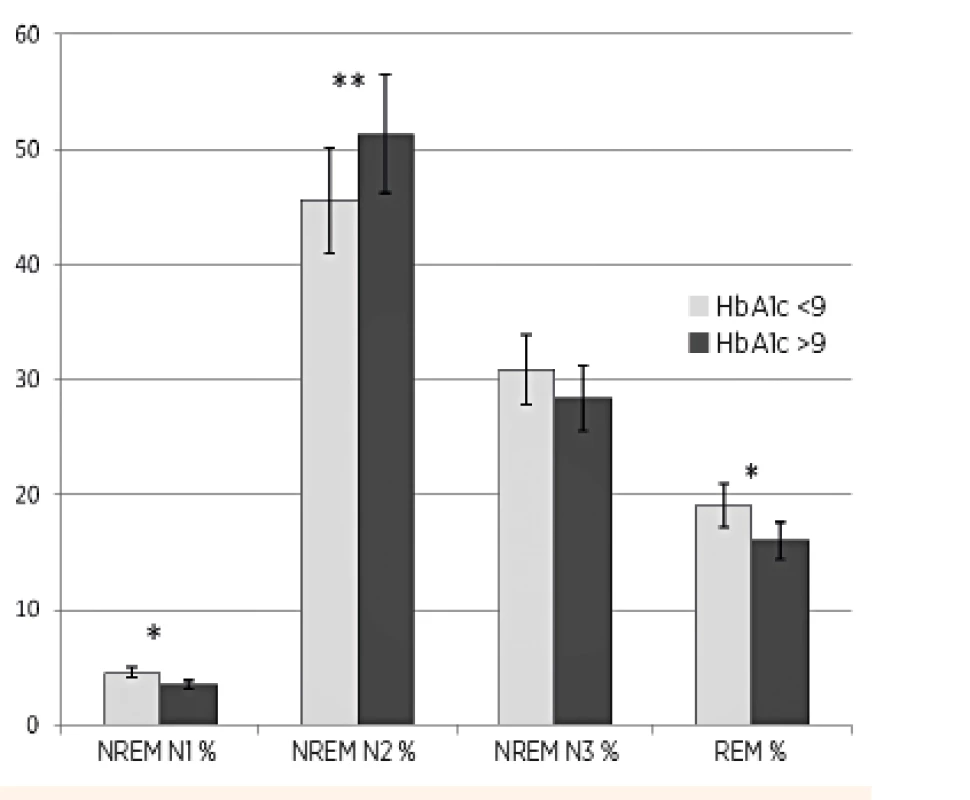
* signifikantný rozdiel (p = 0,05–0,01 ) * * výrazne signifikantný rozdiel (p <0,01) DISKUSIA
V našej práci deti a adolescenti s DM1 s HbA1c ≥9 % strávili signifikantne viac času v plytkom spánku NREM N2 v porovnaní s deťmi s nižším HbA1c. Výsledky sú porovnateľné s inou prácou [35], kde autori referovali taktiež podobnú zmenu architektoniky spánku u detí s DM1. V uvedenej práci dlhší plytký spánok detí s DM1 koreloval s vyššou priemernou glukózou a so zvýšenou hodnotou HbA1c. Navyše, ich rodičia referovali emočné problémy, poruchy správania, zníženú kvalitu života, horšie školské výsledky, zníženú výkonnosť, spavosť a depresívne nálady. Otázkou zostáva, čo je primárne, či emočné problémy, poruchy správania a depresívna nálada v období puberty nie sú príčinou neuspokojivej metabolickej kompenzácie a nedostatočne kvalitného spánku v zmysle plytkého spánku, alebo naopak [41, 42]. Existujú práce, kde deti so zvýšeným skóre depresie a úzkosti merali glykémie menej frekventne [43]. Rovnako v našom súbore detí bola častou identifikovanou príčinou neuspokojivej metabolickej kompenzácie nízka frekvencia selfmonitoringu glykémií a opomínanie podávania prandiálnych bolusov v domácich podmienkach podľa vyhodnotenia počítačového programu CareLink Pro.
Čas strávený v kvalitnom hlbokom spánku NREM N3 bol v našej skupine detí s DM1 a HbA1c ≥9 % kratší, avšak rozdiel nebol signifikantný v porovnaní s lepšie kompenzovanou skupinou. Aj práce z posledných rokov popísali skrátenie hlbokého spánku u detských a dospelých pacientov s DM1 v skupine s neuspokojivou kompenzáciou ochorenia [33, 44, 45, 46, 47], v meta-analýze štúdií u dospelých s DM1 tento rozdiel nebol signifikantný [28]. Hlboký spánok je asociovaný s prevahou PNS a nižšou aktivitou SNS. Znížená aktivita SNS vedie k inhibícii lipolýzy a poklesu koncentrácie voľných mastných kyselín, čo zlepšuje inzulínovú senzitivitu. PNS je zodpovedný za obnovu energetických zdrojov [20].
Z uvedených mechanizmov vyplýva, že dostatočný hlboký spánok môže priaznivo ovplyvňovať metabolickú kompenzáciu diabetu a naopak, výraznejšie skrátenie tejto fázy spánku môže prispievať k zhoršeniu glykemickej kontroly. V našej práci sme nepopísali signifikantné skrátenie hlbokého spánku u detí s horšou dlhodobou metabolickou kontrolou diabetu, výsledok však mohol byť skreslený aktuálnou glykemickou kontrolou, nakoľko priemerná senzorová glukóza v oboch skupinách bola porovnateľná. Zlepšenú aktuálnu glykemickú kontrolu detí s DM1 sme dosiahli vďaka úpravám nastavení inzulínovej pumpy ešte v prvý deň hospitalizácie. Naša práca naznačuje, že už krátkodobé zlepšenie glykemickej kontroly by mohlo mať priaznivý efekt na kvalitu spánku vo forme úpravy hlbokého spánku. Efektivita hlbokého spánku však bola signifikantne vyššia v skupine detí s HbA1c <9 %.
Deti s hypoglykémiou počas polysomnografie neboli zaradené do sledovania, nakoľko samotná hypoglykémia by mohla narušiť spánkovú architektoniku v dôsledku potreby sacharidovej substitúcie. Rovnako deti s hypoglykémiou 12 hodín pred PSG boli vyradené zo štúdie, nakoľko následná aktivácia SNS by mohla negatívne ovplyvniť aj kvalitu spánku [48]. Neprítomnosť hypoglykémie pred a počas PSG mohla byť aj príčinou, že v našej práci sme nepozorovali signifikantné skrátenie hlbokého spánku u detí s dlhodobo horšou metabolickou kompenzáciou diabetu. V dostupnej literatúre sme nenašli prácu, ktorá by pri štúdiu architektoniky spánku u DM1 vylúčila zo súboru pacientov s hypoglykémiou. Výsledky nízkej senzorovej glukózy sme vždy overovali prítomnosťou klinických symptómov hypoglykémie a kapilárnou glykémiou vyšetrenou pomocou glukometra.
Práca autorov Perfect et al. nepotvrdila koreláciu OSA s dlhodobou metabolickou kompenzáciou DM1 u detí vo vekovej kategórii 10–16 rokov. 14 detí zo súboru malo AHI ≥1,5, tieto deti mali porovnateľný HbA1c, avšak priemerná senzorová glukóza bola signifikantne vyššia, rovnako aj čas strávený v hyperglykémii. Práca preukázala vyšší výskyt nie obštrukčného, ale centrálneho spánkového apnoe [35]. V našej štúdii nevykazovali deti s DM1 signifikantný rozdiel v parametroch AHI a OAHI v závislosti od dlhodobej metabolickej kompenzácie. Navyše krátkodobá metabolická kompenzácia vyjadrená priemernou senzorovou glukózou bola v oboch skupinách porovnateľná. OSA sme diagnostikovali len u jedného pacienta, 9 detí malo ľahký stupeň centrálnej poruchy dýchania v spánku (AHI ≥1,0). Z nášho sledovania boli vylúčené deti s hypoglykémiou, čo by tiež mohlo priaznivo ovplyvniť výskyt centrálneho spánkového apnoe, ktoré bolo popísané v predchádzajúcej štúdii u detských pacientov s DM1. Práca naznačuje, že aj krátkodobá glykemická kontrola by mohla prispievať k spánkovým poruchám dýchania v detskom veku.
Referovaná prevalencia OSA v skupine dospelých s DM1 bola prekvapivo vysoká (51,9 %), pritom priemerný BMI u dospelých s DM1 bol 22,9–25,8 kg/m2, čiže obezita nevysvetľovala vysokú prevalenciu OSA v skupine dospelých s DM1 [28]. Autori predpokladajú vplyv diabetickej neuropatie, predovšetkým autonómnej neuropatie na tonus faryngeálnych svalov a vznik OSA [49]. V našej práci bola priemerná doba trvania diabetu 6,6 roka, avšak dlhodobá metabolická kontrola diabetu nebola optimálna, takže nemôžeme vylúčiť vplyv autonómnej neuropatie na parameter AHI alebo OAHI. Riziko vývoja chronických komplikácií, vrátane autonómnej neuropatie, stúpa s dobou trvania ochorenia a s nedostatočnou kompenzáciou diabetu, je popisované aj u detí s DM1 [50].
Deti s HbA1c 7,5–9 % mali signifikantne vyššiu variabilitu senzorovej glukózy v porovnaní so skupinou detí s vyšším HbA1c. Práce z posledných rokov poukazujú na to, že nielen chronická hyperglykémia, ale aj variabilita glykémií by mohla byť spúšťacím faktorom vývoja chronických komplikácií diabetu [2]. Vplyv variability glykémií na spánkovú architektoniku nie je známy. Limitáciou práce je, že práve variabilita senzorovej glukózy, signifikantne rozdielna v oboch súboroch, mohla do určitej miery ovplyvniť výsledky spánkovej architektoniky v našom súbore. Výsledky mohli byť navyše modifikované štádiom puberty a pohlavím, čo sme osobitne neanalyzovali vzhľadom na veľkosť súboru. Vyšetrenia boli realizované formou hospitalizácie, faktor stresu mohol ovplyvňovať výsledky krátkodobej glykemickej kontroly ako aj výsledky v spánkovom laboratóriu. Do štúdie nebola zahrnutá skupina detí s DM1 a optimálnou metabolickou kontrolou (HbA1c <7,5 %), nakoľko tieto deti nespĺňali indikačné kritériá pre hospitalizáciu. Sú potrebné ďalšie štúdie, ktoré by analyzovali vplyv krátkodobej a dlhodobej metabolickej kompenzácie diabetu na spánkovú architektoniku a naopak, vplyv kvality spánku na glykemickú kontrolu DM1 v detskom veku.
ZÁVER
Deti s dlhodobo neuspokojivou metabolickou kontrolou DM1 strávili viac času v štádiu spánku NREM N2 a mali signifikantne nižšiu efektivitu hlbokého spánku NREM N3. Približne pätina detí s DM1 mala ľahkú centrálnu poruchu dýchania v spánku, výskyt OSA bol porovnateľný s bežnou detskou populáciou. Nezistili sme rozdiel vo výskyte spánkových porúch dýchania v závislosti od kompenzácie DM1 v detskom veku.
Vzhľadom na pribúdajúce údaje o vplyve spánku na metabolickú kontrolu DM1 je potrebné venovať zvýšenú pozornosť spánkovej hygiene. Ukazuje sa, že dostatočný a kvalitný spánok môže priaznivo ovplyvňovať parametre glykemickej kompenzácie pacientov s DM1. V detskom veku a adolescencii bola znížená kvantita a kvalita spánku asociovaná so zhoršenou metabolickou kontrolou diabetu, ale aj s emočnými problémami, poruchami správania a depresívnou náladou. Cielené otázky ohľadom chrápania, dennej spavosti, únavy, pomočovania, zhoršenia školského prospechu v kombinácii so spomaleným rastom dieťaťa s DM1 pomáhajú identifikovať deti, rizikové pre poruchy dýchania v spánku. Včasná diagnóza spánkového apnoe a následná liečba ochorenia u dieťaťa s DM1 nielen zlepšuje kvalitu života, ale navyše môže pozitívne vplývať na metabolickú kontrolu diabetu a redukovať riziko chronických komplikácií.
Poďakovanie patrí špeciálne deťom zaradeným do štúdie a ich rodičom, PhDr. Ivane Dzurecovej za technické zabezpečenie kontinuálneho glukózového monitorovania a Jane Letrichovej za technické zabezpečenie celonočnej polysomnografie.
Práca bola podporená projektom VEGA č. 1/0262/14 a projektom «CEKR2» ITMS: 26220120034 a spolufinancovaná zo zdrojov EÚ.
Došlo: 19. 12. 2016
Přijato: 5. 1. 2017
Doc. MUDr. Miriam Čiljaková, PhD.
Klinika detí a dorastu JLF UK a UNM
Kollárova 2
036 01 Martin
Slovenská republika
e-mail: mimaciljak237@gmail.com
Zdroje
1. Wood J, Miller K, Maahs D, et al. Most youth with type 1 diabetes in the T1D exchange clinic registry do not meet American Diabetes Association or International Society for Pediatric and Adolescent Diabetes Clinical Guidelines. Diabetes Care 2013; 36 : 2035–2037.
2. Rewers MJ, Pillay K, de Beaufort C, et al. Clinical Practise Consensus Guidelines 2014 Compendium. Assesment and monitoring og glycemic control in children and adolescents with diabetes. Pediatric Diabetes 2014, 15 (Suppl 20): 102–114.
3. TEENs study. 2014. Most Youth with Type 1 Diabetes Miss Glycemic Goals. www.medscape.com/viewarticle/827246.
4. Reutrakul S, Cauter EV. Interactions between sleep, circadian functtion, and gluucose metabolism: implications for risk and severity of diabetes. Ann NY Acad Sci 2014; 1311 : 151–173.
5. Cappuccio FP, D’Elia L, Strazzullo P, Miller MA. Quantity and quality of sleep and incidence of type 2 diabetes: a systematic review and meta-analysis. Diabetes Care 2010; 33 : 414–420.
6. Ohkuma T, Fujii H, Iwase M, et al. Impact of sleep duration on obesity and the glycemic level in patients with type 2 diabetes: the Fukuoka diabetes registry. Diabetes Care 2013; 36 : 611–617.
7. Suwazono Y, Sakata K, Okubo Y, et al. Longterm longitudinal study on the relationship between alternating shift work and the onset of diabetes mellitus in male Japanese workers. J Occup Environ Med 2006; 48 : 455–461.
8. Tasali E, Leproult R, Ehrmann DA, Van Cauter E. Slow-wave sleep and the risk of type 2 diabetes in humans. Proc Natl Acad Sci U S A 2008; 105 : 1044–1049.
9. Marcus SL, Brooks LJ, Draper KA, et al. Diagnosis and management of childhood obstructive sleep apnea syndrome. Clinical Practise Guideline. Pediatrics 2012; 130 : 576–584.
10. Powell S, Kubba H, Brien Ch, Tremlett M. Paediatric obstructive sleep apnoea. BMJ 2010; 340 : 1018–1023.
11. Pallayova M, Donic V, Gesova S, et al. Do differences in sleep architecture exist between persons with Type 2 diabetes and nondiabetic controls? J Diabetes Sci Technol 2010; 4 : 344–52.
12. Lumeng JC, Chervin RD. Epidemiology of pediatric obstructive sleep apnea. Proc Am Thorac Soc 2008; 5 : 242–252.
13. Kaditis AG, Alonso Alvarez ML, Boudewyns A, et al. Obstructive sleep disordered breathing in 2 – to 18-year - old children: diagnosis and management. Eur Respir 2016; 47 (1): 69–94.
14. Vojtková J, Michnová Z, Turčan T, et al. Lung function tests in children with diabetes mellitus type 1. Acta Pneumonologica et Allergologica Pediatrica 2010; 13 (3,4): 5–8.
15. Giordani B, Hodges EK, Guire KE, et al. Changes in neuropsychological and behavioral functioning in children with and without obstructive sleep apnea following Tonsillectomy. J Int Neuropsychol Soc 2012; 18 : 212–222.
16. Gozal D Sans Capdevila O, Kheirandish-Gozal L. Metabolic alterations and systemic inflammation in obstructive sleep apnea among non-obese and obese pre-pubertal children. Am J Resp Crit Care Med 2008; 177 (10): 1142–1149.
17. Bhattacharjee R, Kim J, Kheirandish-Gozal L, Gozal D. Obesity and obstructive sleep apnea syndrome in children: a tale of inflammatory cascades. Pediatr Pulmonol 2011; 46 : 313–323.
18. Gozal D, Kheirandish-Gozal L. Obesity and excessive daytime sleepiness in prepubertal children with obstructive sleep apnea. Pediatrics 2009; 123 : 13–18.
19. Thomas M, Sing H, H. Belenky H, et al. Neural basis of alertness and cognitive performance impairments during sleepiness. I. Effects of 24 h of sleep deprivation on waking human regional brain activity. J Sleep Res 2000; 9 : 335–352.
20. Grassi G, Dell’Oro R, Quarti-Trevano F, et al. Neuroadrenergic and reflex abnormalities in patients with metabolic syndrome. Diabetologia 2005; 48 : 1359–1365.
21. Varechova S, Durdik P, Cervenkova V, et al. The influence of autonomic neuropathy on cough reflex sensitivity in children. J Physiol Pharmacol 2007; 58 (Suppl 5): 705–715.
22. Tentolouris N, Argyrakopoulou G, Katsilambros N. Perturbed autonomic nervous system function in metabolic syndrome. Neuromolecular Med 2008; 10 : 169–178.
23. Buxton OM, Pavlova M, Reid EW, et al. Sleep restriction for 1 week reduces insulin sensitivity in healthy men. Diabetes 2010; 59 : 2126–2133.
24. Stamatakis KA, Punjabi NM. Effects of sleep fragmentation on glucose metabolism in normal subjects. Chest 2010; 137 : 95–101.
25. Wieser V, Moschen AR, Tilg H. Inflammation, cytokines and insulin resistance: a clinical perspective. Arch Immunol Ther Exp (Warsz) 2013; 61 : 119–125.
26. Morselli LL, Guyon A, Spiegel K. Sleep and metabolic function. Pflugers Arch 2012; 463 : 139–160.
27. Ciljakova M, Vojtkova J, Durdik P, et al. Cough reflex sensitivity in adolescents with diabetic autonomic neuropathy. Eur J Med Res 2009; 14 (Suppl IV): 45–48.
28. Reutrakul S, Thakkistian A, Annothaisintawee T, et al. Sleep characteristics in type 1 diabetes and associations with glycemic control: systematic review and meta-analysis. Sleep Medicine 2016; 23 : 26–45.
29. Watson NF, Badr MS, Belenky G, et al. Recommended amount of sleep for a healthy adult: a joint consensus statement of the American Academy of Sleep Medicine and Sleep Research Society. Sleep 2015; 38 : 843–844.
30. Bot M, Pouwer F, de Jonge P, et al. Differential associations between depressive symptoms and glycaemic control in outpatients with diabetes. Diabet Med 2013; 30: e115–122.
31. Bouhassira D, Letanoux M, Hartemann A. Chronic pain with neuropathic characteristics in diabetic patients: a French cross-sectional study. PLoS ONE 2013; 8: e74195.
32. Punjabi NM. The epidemiology of adult obstructive sleep apnea. Proc Am Thorac Soc 2008; 5 : 136–143.
33. Janovsky CC, Rolim LC, de Sa JR, et al. Cardiovascular autonomic neuropathy contributes to sleep apnea in young and lean type 1 diabetes mellitus patients. Front Endocrinol (Lausanne) 2014; 5 (119): 1–4.
34. Manin G, Pons A, Baltzinger P, et al. Obstructive sleep apnoea in people with type 1 diabetes: prevalence and association with micro - and macrovascular complications. Diabet Med 2015; 32 : 90–96.
35. Perfect MM, Patel PG, Scott RE, et al. Sleep, glucose, and daytime functioning in youth with type 1 diabetes. Sleep 2012; 35 : 81–88.
36. Matyka KA, Crawford C, Wiggs L, et al. Alterations in sleep physiology in young children with insulin-dependent diabetes mellitus: relationship to nocturnal hypoglycemia. J Pediatr 2000; 137 : 233–238.
37. Pillar G, Schuscheim G, Weiss R, et al. Interactions between hypoglycemia and sleep architecture in children with type 1 diabetes mellitus. J Pediatr 2003; 142 : 163–168.
38. Berry RB, Budhiraja R, Gottlieb DJ, et al. Rules for scoring respiratory events in sleep: update of the 2007 AASM Manual for the Scoring of Sleep and Associated Events. Deliberations of the Sleep Apnea Definitions Task Force of the American Academy of Sleep Medicine. J Clin Sleep Med 2012; 8 : 597–619.
39. Villa MP, Multari G, Montesano M, et al. Sleep apnoea in children with diabetes mellitus: effect of glycaemic control. Diabetologia 2000; 43 : 696–702.
40. Rechtschaffen A, Kales A. A manual of standardized terminology, techniques and scoring systems for sleep stages of human subject. Washington DC: National Institutes of Health, 1968, Pub. 204.
41. Perez-Chada D, Perez-Lioret S, Videla AJ, et al. Sleep disordered breathing and daytime sleepiness are associated with poor academic performance in teenagers. A study using the Pediatric Daytime Sleepiness Scale (PDSS). Sleep 2007; 30 : 1698–1703.
42. Zhao Q, Sherrill DL, Goodwin JL, Quan SF. Association between sleep disordered breathing and behavior in school-aged children: the Tucson Children›s Assessment of Sleep Apnea Study. Open Epidemiol J 2008; 1 : 1–9.
43. Herzer M, Hood KK. Anxiety symptoms in adolescents with type 1 diabetes: association with blood glucose monitoring and glycemic control. J Ped Psychology 2010; 35 (4): 415–425.
44. Feupe SF, Frias PF, Mednick SC, et al. Nocturnal continuous glucose and sleep stage data in adults with type 1 diabetes in real-world conditions. J Diabetes Sci Technol 2013; 7 : 1337–1345.
45. Jauch-Chara K, Schmid SM, Hallschmid M, et al. Altered neuroendocrine sleep architecture in patients with type 1 diabetes. Diabetes Care 2008; 31 : 1183–1188.
46. Borel AL, Benhamou PY, Baguet JP, et al. High prevalence of obstructive sleep apnoea syndrome in a type 1 diabetic adult population: a pilot study. Diabet Med 2010; 27 : 1328–1329.
47. Donga E, van Dijk M, van Dijk JG, et al. Partial sleep restriction decreases insulin sensitivity in type 1 diabetes. Diabetes Care 2010; 33 : 1573–1577.
48. Matyka KA, Crawford C, Wiggs L, et al. Alterations in sleep physiology in young children with insulin-dependent diabetes mellitus: relationship to nocturnal hypoglycemia. J Pediatr 2000; 137 : 233–238.
49. Bottini P, Dottorini ML, Cordoni MC, et al. Sleep-disordered breathing in nonobese diabetic subjects with autonomic neuropathy. Eur Respir J 2003; 22 : 654–660.
50. Barkai L, Madácsy L. Cardiovascular autonomic dysfunction in diabetes mellitus. Arch Dis Child 1995; 73 (6): 515–518.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článek Editorial
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2017 Číslo 1- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficitmi v reálnej praxi
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
-
Všetky články tohto čísla
- Recidivující infekce močových cest – přínos diagnostiky a léčby dysfunkční mikce
- Včasná antibiotická terapia a riziko renálneho jazvenia u detí s prvou nekomplikovanou infekciou močových ciest
- Haemophilus diseases in ENT in children before and after the introduction of Haemophilus influenzae type b vaccine
- Kvalita spánku detí a adolescentov s diabetes mellitus 1. typu
- Editorial
- Funkcia štítnej žľazy u obéznych detí
- Nezvyčajná príčina hyperkalciémie u pacientky s primárne kortikorezistentným nefrotickým syndrómom – kazuistika
- Infekcia močových ciest – rúcanie starých dogiem
- Recidivující krvácení do trávicího ústrojí
- Jak vyšetřovat moč při podezření nebo již prokázané infekci močových cest
- General Movements – vyšetření nezralého nervového systému
- Získaná kardiovaskulární onemocnění u Turnerova syndromu
- Febrilní křeče: doporučený postup pro vyšetření dítěte s nekomplikovanými febrilními křečemi. Adaptovaný doporučený postup American Academy of Pediatrics
- Diagnostický a terapeutický postup u detských pacientov s prvou nekomplikovanou infekciou horných močových ciest
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Jak vyšetřovat moč při podezření nebo již prokázané infekci močových cest
- Haemophilus diseases in ENT in children before and after the introduction of Haemophilus influenzae type b vaccine
- Recidivující krvácení do trávicího ústrojí
- General Movements – vyšetření nezralého nervového systému
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



