-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Doporučení Pracovní skupiny dětské nefrologie České pediatrické společnosti pro diagnostiku a léčbu infekcí močových cest u dětí a dorostu
Guidelines for the diagnosis and treatment of urinary tract infections in children and adolescents. Recommendations of the Working Group Pediatric Nephrology of the Czech Pediatric Society
Urinary tract infections (UTI) are the second or third most common infections in pediatric age. Therefore, each pediatrician needs to be informed about the diagnosis and treatment of UTI. There are different approaches in different age groups, there are also differences in the management of the first and recurrent UTI. There exist several different national guidelines that sometimes differ considerably and no worldwide accepted guideline exists. The authors from the Working Group Pediatric Nephrology of the Czech Pediatric Society present here the Czech national Guidelines for the diagnosis UTI in children and adolescents. They present the definition, prevalence, diagnostics, treatment, prognosis and follow-up in pediatric population with urinary tract infections.
KEY WORDS:
urinary tract infections, children, adolescents, vesicoureteric reflux
Autoři: T. Seeman 1; K. Bláhová 1; E. Bébrová 2; M. Kynčl 3; J. Janda 1
Působiště autorů: Pediatrická klinika 2. LF UK a FN Motol, Praha 1; Ústav mikrobiologie 2. LF UK a FN Motol, Praha 2; Klinika zobrazovacích metod 2. LF UK a FN Motol, Praha 3
Vyšlo v časopise: Čes-slov Pediat 2017; 72 (2): 76-87.
Kategorie: Dětská nefrologie - 2.část
Souhrn
Infekce močových cest jsou druhou až třetí nejčastější infekcí dětského věku. Vzhledem k této častosti infekcí močových cest (IMC) musí být každý pediatr informován o diagnostických a léčebných postupech, které se liší především podle věkových období. Rozdílně se přistupuje k první atace IMC resp. recidivující/chronické infekci. Existuje řada národních doporučených postupů, které se často od sebe významně liší, nelze očekávat, že se někdy dojde k celosvětovému všeobecnému konsensu. Členové Pracovní skupiny dětské nefrologie České pediatrické společnosti vycházejí ze zahraničních zkušeností a respektují i současný stav diagnostiky a léčby IMC v České republice a ve spolupráci s mikrobiology a specialisty pro zobrazovací metody u děti vytvořili Doporučení pro diagnostiku a léčbu IMC u dětí a dorostu. V přehledném sdělení budou prezentována základní doporučení pro definici, diagnostiku, léčbu, prognózu a dispenzarizaci dětí a dorostu s infekcemi močových cest.
KLÍČOVÁ SLOVA:
infekce močových cest, děti, dorost, vezikoureterální refluxÚVOD
Infekce močových cest (IMC) jsou po infekcích dýchacích cest společně s infekcemi zažívacího traktu druhou až třetí nejčastější infekcí v dětském věku. Proto musí být každý pediatr informován o diagnostických a léčebných postupech u dětí s IMC. Doporučené postupy diagnostiky a léčby se v posledním desetiletí významně změnily, jednotná evropská doporučení neexistují, téměř každý evropský či severoamerický stát má svá vlastní doporučení. Ve světě nejčastěji citovaná jsou doporučení Americké pediatrické akademie z roku 2011, která byla publikována v časopise Pediatrics, ta jsou ale určena pouze pro děti ve věku 2 měsíců až 2 let a pouze pro děti s febrilními IMC, tedy s pyelonefritidami [1]. Proto se Pracovní skupina dětské nefrologie České pediatrické společnosti rozhodla zpracovat doporučení pro diagnostiku a léčbu všech forem IMC u dětí všech věkových kategorií, která by navíc brala v úvahu také specifika péče o děti s IMC v České republice.
Následující doporučení, které bylo vytvořeno během několika let po mnoha diskusích kolektivem autorů pediatrů, mikrobiologů a rentgenologů, se snaží být zejména praktickým, stručným a přehledným shrnutím doporučené péče o děti s IMC a je doporučením Pracovní skupiny dětské nefrologie České pediatrické společnosti.
DEFINICE A TERMINOLOGIE IMC
Infekce močových cest je definována jako nález významné bakteriurie, ta je definována různě jako počet mikrobů/1 ml moče podle způsobu odběru moče.
Infekce močových cest se rozdělují podle lokalizace infekce a klinického průběhu na infekci dolních močových cest (cystitida) a horních močových cest (pyelonefritida) a na akutní a chronické IMC.
Cystitida, tj. infekce dolních močových cest (termín uretritida se nedoporučuje), prakticky vždy se dostanou bakterie do měchýře, izolovaná uretritida je zřejmě raritní.
Pyelonefritida, tj. infekce horních močových cest, zánět postihuje ledvinný parenchym (termín pyelitida je zavádějící, izolovaná bakteriální infekce v pánvičce je vysoce nepravděpodobná). Cystitida i pyelonefritida se vyskytují jako akutní, resp. chronické onemocnění.
Asymptomatická bakteriurie je definována jako opakované nálezy významné bakteriurie u jedinců s normální anatomií uropoetického traktu a normálním funkčním vyšetřením ledvin i vývodných močových cest. Nomenklatura IMC je shrnuta v tabulce 1.
Tab. 1. Terminologie infekcí močových cest. 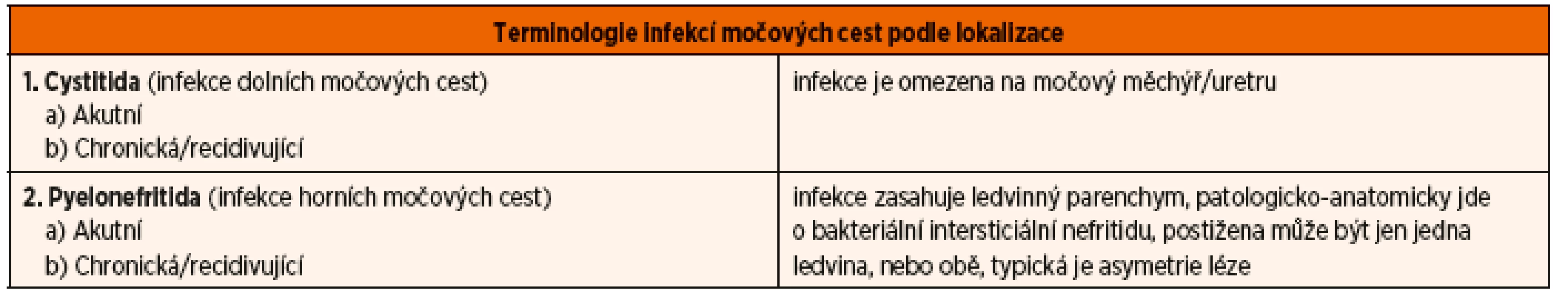
Podle klinického hodnocení se doporučuje z hlediska diagnostiky a léčby rozlišovat na nekomplikované a komplikované IMC (tab. 2).
Tab. 2. Rozdělení infekcí močových cest podle klinického hodnocení. 
Akutní fokální bakteriální nefritida (AFBN), dříve nazývaná lobární nefronie, je jednotka popisovaná v poslední době častěji při ultrasonografickém vyšetření, jistě je to dáno zlepšením zobrazovací techniky. Pro AFBN jsou charakteristická okrouhlá hypoechogenní ložiska v ledvinném parenchymu se sníženou krevní perfuzí, často chybně považovaná za nádor nebo absces. Klinický obraz bývá častěji než u APN provázen celkovými příznaky až známkami sepse. Léze představuje přechod mezi APN a abscesem ledviny, typické pro AFBN je, že ložisko nekolikvuje. Diagnostické rozpaky často vedou k vyšetření CT nebo MRI.
VÝSKYT INFEKCE MOČOVÝCH CEST
Infekce močových cest je nejčastějším onemocněním uropoetického traktu (UPT) vůbec a v epidemiologii dětských nemocí stojí na 2.–3. místě (nejčastější je postižení respiračního systému, na 2.–3. místě pak onemocnění zažívacího, resp. právě IMC). Prevalence IMC u dětí od 2 měsíců do 2 let s horečkou bez zjevné příčiny se pohybuje okolo 5 % a je u děvčátek více než 2x častější než u chlapců. V prvních měsících života se objevuje IMC relativně častěji u chlapců, ve druhé polovině roku je již častější u děvčat. Kumulativní incidence v prvních 2 letech života se pohybuje okolo 2 % této věkové skupiny.
Infekce močových cest je častým důvodem návštěvy v ordinaci praktického lékaře pro děti a dorost, ale i akutních přijetí na lůžkové dětské oddělení. U většiny případů jde o akutní cystitidu, kdy se jedná o banální onemocnění, pokud nerecidivuje. Naopak pyelonefritida, hlavně její opakované ataky, představují riziko poškození parenchymu včetně významné poruchy funkce ledvin a vzniku hypertenze.
Recidivy akutních IMC jsou v dětském věku poměrně časté, vyskytují se až u 50 % dětí.
Etiologie a patogeneze IMC
Nejčastějšími vyvolavateli IMC jsou u dětí, stejně jako u dospělých, gramnegativní mikroorganismy. Nejčastějším patogenem jsou kmeny Escherichia coli (E. coli) v 70–80 % případů IMC. Méně častými vyvolavateli IMC jsou Proteus, Klebsiella, Pseudomonas spp. IMC mohou vyvolat i grampozitivní bakterie – Enterococcus, Staphylococcus spp., tento nález ale často signalizuje kontaminaci při odběru moči.
Podíl jednotlivých mikrobů se liší podle klinického obrazu, je rozdílný u akutních resp. recidivujících a chronických IMC, roli hraje i věk pacienta. Rezistentní kmeny se vyskytují u dětí s významnými poruchami odtoku moči na funkčním či anatomickém podkladě (neurogenní resp. dysfunkční močový měchýř, děti se spina bifida, vezikoureterální reflux, hydronefróza atd.). U takových komplikovaných IMC, obstrukčních uropatií a u pacientů s dlouhodobými močovými katetry klesá podíl E. coli a stoupá počet ostatních uvedených kmenů [2].
Bakterie se do močových cest dostávají nejčastěji ascendentní cestou – močovou trubicí do močového měchýře, přes močovody pak do pánvičky a ledvinného parenchymu. Okolí ústí močové roury je u dětí běžně osídleno gramnegativními i grampozitivními mikroby, které mohou být přítomny i v distálních partiích uretry, za normálních okolností však nikoliv v její proximální části a měchýři močovém. U pacientek s recidivující IMC se prokázalo, že denzita bakterií v okolí zevního ústí uretry je významně vyšší než u osob, které netrpí IMC. Již brzy po narození jsou přítomny v periuretrální oblasti aerobní i anaerobní mikroorganismy. U děvčátek převládají v kojeneckém věku Enterobacteriacae a Enterokoky, u chlapců je vyšší podíl kmene Proteus. Denzita periuretrálního osídlení je vyšší v nízkých věkových skupinách, to je jeden z důvodů, proč je IMC tak častá u kojenců a batolat. Není pochyb o tom, že se na tomto faktu podílí i inkontinence moči a stolice, se stoupajícím věkem se počet mikrobů v okolí uretry snižuje. Pokud se mikroby dostanou až do měchýře, představuje pro ně moč kultivační médium a začnou se při teplotě 37 oC rychle pomnožovat. Důvody průniku bakterií z oblasti zevního ústí uretry do měchýře jsou různé. Nejčastěji je to porucha normální funkce močového měchýře ve smyslu dokonalého vyprazdňování. Přerušované močení typické pro tzv. dysfunkční močový měchýř je jedním z důvodů ascense mikrobů. Tato funkční porucha má za následek turbulentní proudění v distální uretře, které vede k „nasávání“ moči z této oblasti (kde jsou přirozeně přítomny mikroby) do močového měchýře. Nedokonalé vyprázdnění močového měchýře na podkladě funkční poruchy (postmikční reziduum) tak představuje rizikový faktor – mikroby se v měchýři mohou pak pomnožovat a chybí ten nejjednodušší způsob, jak se jich může organismus zbavit – s odcházející močí. Hypotonie svalstva močového měchýře může u dětí vést k významnému poklesu mikcí během 24 hodin a opět zvyšuje riziko pomnožení mikrobů přímo v měchýři. V anamnéze dětí s chronickou IMC se častěji vyskytují i poruchy vyprazdňování stolice (častá obstipace), které mohou ovšem být v souvislosti s poruchou svalstva měchýře. Začátek sexuální aktivity adolescentů zvyšuje rizika ascendentní cesty močové infekce, jsou známy termíny „honeymoon cystitis“ – líbánková cystitida. Úsměvy budí i opakovaně publikované studie prokazující významně nižší frekvenci IMC u řádových sester ve srovnání s běžnou ženskou populací.
Pro běžnou pediatrickou praxi má v diferenciální diagnostice význam tzv. vezikovaginální influx, který není v dětském věku dívek nijak vzácným fenoménem, jeho problematika bude rozvedena níže. Toto vše platí samozřejmě především v případě krátké ženské uretry a má jen malý význam u chlapců, resp. mužů, kde uretra je podstatně delší. Ale i u mužského pohlaví mohou mikroby putovat až do měchýře. Řada prací byla věnována vztahu IMC a cirkumcise u chlapců. Považuje se za prokázané, že u chlapců provedená cirkumcise významně sníží frekvenci IMC. E. coli P+ adherují lépe k uroepitelu preputia a tím je větší příležitost k ascendentní invazi do močového měchýře. Ovšem vzhledem k nízké frekvenci IMC u mužského pohlaví rozhodně není tento fakt argumentem pro obecné doporučení provádět u chlapců rutinně obřízku. Je tedy třeba připustit, že i u kojenců mužského pohlaví se mohou bakterie dostat do močového měchýře ascenzí. V patofyziologii příčin IMC mají u dětí nejdůležitější vliv poruchy odtoku moči, ať již na podkladě anatomické odchylky nebo na podkladě funkční poruchy s abnormálním transportem moči a jejím vyprazdňováním.
V dětském věku hraje důležitou úlohu především vezikoureterální reflux (VUR). Některé recentní studie se vracejí znovu k etiopatogenezi VUR a jeho vztahu k pyelonefritidě. Hodnocení DMSA-scanu totiž stále častěji ukazuje, že postpyelonefritické změny vznikají i bez přítomnosti VUR. Asi u 68 % dětí s akutní pyelonefritidou se objevují výpady akumulace radiofarmaka při DMSA scanu v akutní fázi.
Riziko vzniku pozánětlivých jizev je v přímém vztahu s počtem prodělaných pyelonefritid. Zatímco po 1. atace akutní pyelonefritidy má jizvy jen 5–10 % dětí, děti s >4 atakami mají jizvy již v 60 % (viz graf 1). Existují však naopak i případy parenchymových jizev u pacientů s VUR, kteří nikdy neprodělali IMC. Tento fakt ukazuje na vrozenou příčinu parenchymového jizvení u některých dětí s VUR (prenatální poškození ledvin vezikoureterálním refluxem). Zde se spíše jedná o vrozenou dysplazii ledviny postižené refluxem než o klasické pozánětlivé jizvy (detekována častěji u chlapců než u děvčat).
Graf 1. Riziko vzniku pozánětlivých jizev podle počtu prodělaných IMC (adaptováno podle Jodala). 
Po skoro dvou dekádách zpochybňování úlohy vezikoureterálního refluxu (VUR) se tedy v posledních letech ukazuje, že VUR je přece jen významným rizikovým faktorem pro vznik chronické IMC a poškození parenchymu se vznikem jizev v intersticiu, a to v některých případech i bez přítomnosti IMC.
Řada experimentálních i klinických studií upozornila na důležitou roli vztahu vyvolavatele infekce močových cest (IMC) a hostitele: byla např. popsána nová skupina tzv. toll-like receptors (TLR), které ovlivňují schopnost pacienta bránit se účinně proti bakteriálnímu osídlení vyvolavatele. Individuální rozsah reakce např. s cytokiny může ovlivňovat klinický průběh IMC. Poměrně významná variabilita klinického i laboratorního průběhu IMC je zřejmě dána geneticky určitou dispozicí obranné reakce makroorganismu při osídlení dutého systému bakteriemi. Je otázkou, do jaké míry bude v budoucnu možné testováním genetických markerů lépe definovat rizikové pacienty a přizpůsobit individuálně diagnostiku a léčbu IMC (tailored therapy – léčba šitá na míru).
KLINICKÝ OBRAZ
Klinické projevy IMC se liší u pacientů s cystitidou a pyelonefritidou.
Starší děti a dorostenci jsou schopni verbálně vyjádřit své pocity, udávají při cystitidě většinou dysurické obtíže (až strangurie – řezavka), mají polakisurii, mohou mít bolesti v podbřišku, někdy sekundární enurézu. Teplota nebývá zvýšena, nebo je dítě jen subfebrilní.
Děti s akutní pyelonefritidou jsou naopak vždy febrilní (teploty běžně dosahují hodnot 39–40 oC), u novorozenců nebo i kojenců se může objevit subikterus, mají nauzeu, jsou dráždiví, neklidní, klinické příznaky akutní pyelonefritidy mohou připomínat onemocnění gastrointestinálního traktu (nauzea, zvracení, průjem). Menší děti udávají bolesti břicha, starší již lokalizují bolesti do bederní krajiny. Při pyelonefritidě nebývají výraznější dysurie, pokud však cystitida předchází pyelonefritidě, může mít dítě zpočátku dysurie bez zvýšené teploty a až později s infekcí postupující z dolních močových cest na horní se přidávají horečky, bolesti zad, břicha a dysurie ustupují.
U všech dětí s těmito klinickými symptomy je nutné pomýšlet na IMC a odebrat cílenou anamnézu a provést vyšetření moče a krve (viz Diagnostika).
V anamnéze je vhodný aktivní dotaz směřovaný na rodiče/školní děti/dorostence na nápadné skvrny na pleně dítěte, barvu moči, ev. zákal, jiné příměsi, neobvyklý (nápadnější) zápach moči. U všech kojenců a batolat, ale i u starších dětí, nesmí v anamnéze chybět dotaz na charakter mikce (patrný diskomfort při mikci, silný, nepřerušovaný proud moči, resp. jiný způsob močení?). Pokud lze posoudit, i počet mikcí/den a diuréza, zvláště u starších dětí je to dobře zjistitelné. U dorostenek informace o sexuálních aktivitách a užití kontraceptiv.
Každé dítě, jehož anamnéza a symptomy budí podezření na IMC, musí mít vyšetřenu moč testačními papírky indikujícími esterázovou a nitritovou reakci (průkaz pyurie a významné bakteriurie) a/nebo vyšetřenu nativní moč mikroskopicky, ev. sediment na přítomnost patologické leukocyturie (pyurie). V případě patologického nálezu musí následovat kultivační vyšetření moče. Infekce močových cest mají velkou tendenci se opakovat, recidivy se vyskytují u 20–50 % dětí.
DIAGNOSTIKA
1. Anamnéza a fyzikální vyšetření
Diagnóza nebo podezření na IMC vychází samozřejmě nejprve z anamnézy a fyzikálního vyšetření. V anamnéze se cíleně ptáme na klinické příznaky IMC (viz výše).
Fyzikální vyšetření nemusí při IMC ukazovat jednoznačně na postižení UPT. Často bývá jediným příznakem zvýšená teplota nebo horečka, zejména u menších dětí, batolat a kojenců.
U starších dětí (zejm. školního věku) pátráme po bolestivosti v bederní krajině (pozitivní tapotement, Israeliho hmat), palpujeme břicho do hloubky směrem k uložení ledvin (bolestivost?), posuzujeme citlivost při palpaci nad symfýzou (cystitida?). U děvčat i chlapců je třeba vyšetřit i zevní genitál, posoudit event. přítomnost fluoru, balanitidy, fimózy.
2. Vyšetření moči chemické a mikroskopické
Každé dítě se zvýšenou teplotou, zvláště přes 38,5 oC, která není vysvětlitelná z anamnézy a při fyzikálním vyšetření, musí mít vyšetřenu moč chemicky, nejprve testačními papírky (vždy a jedině s proužkem „leukocyty“ s esterázovou reakcí), nejlépe i mikroskopicky. Typickým nálezem při IMC je
- pozitivní esterázová reakce (pyurie),
- pozitivní nitritová reakce (významná bakteriurie),
- pyurie při mikroskopickém vyšetření.
Negativní esterázová a nitritová reakce s normálním nálezem počtu leukocytů v nativní necentrifugované moči (do 20 leukocytů v l µl), a nebo v močovém sedimentu (do 10 leukocytů v zorném poli při zvětšení cca 400x) s vysokou pravděpodobností IMC vylučuje. Pokud nejsou přítomny jiné rizikové faktory (např. anamnéza již prodělané IMC, zvláště pyelonefritidy), pak není třeba moč posílat k mikrobiologickému vyšetření. To ovšem neplatí pokud jde o celkovou alteraci pacienta, např. i se septickými teplotami. Pak raději nabrat na mikrobiologické vyšetření moč, ale i hemokulturu. Nejvyšší validitu z uvedených 3 parametrů má mikroskopický nález pyurie (patologické leukocyturie), následuje esterázová reakce a nejnižší validitu má nakonec nitritový test. Existuje řada studií hodnotících senzitivitu a specificitu testačních papírků, přesto jejich použití patří k rutině.
3. Mikrobiologické vyšetření moči
Nezbytným předpokladem – atributem diagnózy IMC je významná (signifikantní) bakteriurie. Významná bakteriurie je definována podle způsobu odběru moči. Při odběru ze středního proudu je to 105 bakterií/1 ml moči. Při tomto odběru je ale velmi suspektní již počet 5x104/1 ml. V katetrizované moči je významný již nález 104/1 ml, resp. suspektní 5x103/1 ml. V moči získané suprapubickou punkcí je jakýkoliv nález bakterií významný. Americká pediatrická společnost (AAP) ještě doporučuje významnost bakteriurie diferencovat dle věku: u dětí 2–24 měs. při pečlivě odebraném vzorku moči považovat za významnou již hodnoty 5x104/1 ml (50 000/ml moči). U novorozenců jsou již podezřelé hodnoty nad 104/1 ml [1].
Diskutuje se význam nálezu v moči získané ze sterilního nalepeného sáčku – původně bylo možno hodnotit jen v případě nevýznamné bakteriurie, některé studie ale upozorňují, že monokultura vyšší než 107/1 ml je vysoce suspektní, že nejde o kontaminaci. Nález více než jednoho kmene ve vzorku moči je vždy podezřelý z kontaminace bez ohledu na způsob získání vzorku, význam nálezu stoupá, je-li přítomen jiný kmen než E. coli.
Definice významné bakteriurie podle způsobu odběru moče jsou uvedeny v tabulce 3.
Tab. 3. Kassovo schéma významné bakteriurie. 
Pozn.: Klasické Kassovo schéma bylo převzato ze zkušeností s dospělými pacienty, u dětí v poslední době doporučuje Americká pediatrická akademie (AAP) považovat za významnou bakteriurii hodnoty >5x104/1 ml moči (50 000/1 ml moči). Z hlediska mikrobiologické rutiny to není jednoduché, je třeba se domlouvat s mikrobiologickou laboratoří, ale je to možné. Metody odběru moče na mikrobiologické vyšetření
Doba odběru moče
Odběr moči na kultivaci musí být proveden ještě před zahájením antibakteriální léčby. Ve většině případů nekomplikované IMC vede často již první dávka antibiotika//chemoterapeutika ke sterilizaci moči, a tím k falešně negativnímu nálezu.
Metody vlastního odběru moči na mikrobiologické vyšetření
- a) Střední proud moči je metodou volby. Po očistění zevního ústí uretry – voda, mýdlo, žádné dezinfekční prostředky – se u chlapců pokusíme o nenásilné přetažení prepucia, pokud to není možné, uvedeme to na mikrobiologickou žádanku! U kojenců je možno také se pokusit o odběr ze středního proudu, např. Perézův reflex kombinovaný s taktilní stimulací nad měchýřem [13]. Při vysoké horečce a alteraci celkového stavu a snaze o časné nasazení antibiotické léčby se doporučuje raději pacienty co nejdříve vycévkovat.
- b) Cévkovaná moč – používat měkké cévky, u děvčat většinou není problém, cévkování chlapců vyžaduje zkušenost a asistenci nejméně 2 osob.
- c) Suprapubická aspirace: u nás, ale ani v Evropě se příliš neprosadila, jde o invazivní výkon, i v USA je v poslední době spíše ústup od této metody. Novější studie poukazují na vyšší procento neúspěšného odběru ve srovnání s katetrizací, tedy pokud nelze odebrat moč ze středního proudu, doporučuje se raději katetrizovat.
- d) Adhezivní plastické sterilní sáčky: pokud je při tomto způsobu sběru moči bakteriurie 107/ml a více a jedná se o monokulturu (zvláště při nálezu méně běžného kmene), doporučuje se považovat bakteriurii za významnou. Vyšší validitu mají nálezy u chlapců, riziko kontaminace stoupá při dlouhé době fixace sáčku (déle než 30 min. po mikci) a u dětí s průjmem. Významnost bakteriurie při tomto způsobu odběru posuzovat v kontextu s ostatními nálezy (chemické a mikroskopické vyšetření moči). Jde ale pouze o nouzové řešení, v žádném případě se nedoporučuje jako rutina.
4. Laboratorní vyšetření krve
Součástí laboratorní diagnostiky dítěte s podezřením na pyelonefritidu je odběr krve na biochemické vyšetření, event. krevní obraz.
Doporučená vyšetření u podezření na pyelonefritidu:
- zánětlivé parametry (CRP a/nebo FW, a/nebo krevní obraz s leukocyty, event. prokalcitonin v případě hospitalizace dítěte,
- event. parametry renálních funkcí, iontogram (podle celkového stavu dítěte).
U kojenců a batolat s alterací celkového stavu vždy pokus o odběr hemokultury, zvláště pokud sonografie svědčí o dilataci UPT. V případě klinického podezření na cystitidu není vyšetření krve nutné.
Diferenciální diagnostika mezi cystitidou a pyelonefritidou v pediatrické praxi
Z diagnostického, léčebného i prognostického hlediska je důležité u podezření na IMC (z klinického a močového nálezu) odlišit infekci dolních močových cest (cystitida) od infekce horních močových cest (pyelonefritida). Diagnostika, léčba i prognóza pacientů s akutní pyelonefritidou je odlišná od pacientů s cystitidou.
Celosvětově se většinou používají v různých modifikacích kritéria, která zavedl již v minulém století švédský pediatr Ulf Jodal. Jodalova kritéria jsou vhodná především pro primární péči, ale užívají se i při přijetí k hospitalizaci (viz tab. 4).
Tab. 4. Rozlišení akutní pyelonefritidy od akutní cystitidy – modifikovaná Jodalova kritéria. 
Pozn.: Klinické příznaky (kromě horečky) jako bolesti břicha, v bederní krajině aj. nepatří mezi kritéria pyelonefritidy, nemusí znamenat postižení ledviny, naopak při pyelonefritidě mohou být subjektivní příznaky podobné cystitidě. V rutinní primární pediatrické praxi mají modifikovaná Jodalova kritéria při své jednoduchosti a dostupnosti vyšetřovacích metod velký význam (v primární pediatrické péči by každá ordinace měla mít možnost vyšetřit obratem hladinu CRP). Jejich specificita ale samozřejmě není dokonalá, dítě může mít horečku a zvýšené zánětlivé parametry z jiné příčiny než močové infekce. Přesto je jejich senzitivita pro odlišení pyelonefritidy od cystitidy u dítěte s jednoznačnou klinikou a nálezy v moči svědčícími pro IMC velmi vysoká (přes 90 %).
Jako zlatý standard průkazu postižení parenchymu ledvin platí stále DMSA 99mTc-statická scintigrafie, v rámci běžné diagnostiky akutní pyelonefritidy se ale nepoužívá, jde také o invazivní metodu s radiační zátěží (použití radionuklidu).
Základním kritériem pro stanovení diagnózy akutní pyelonefritidy je tedy patologický nález v moči, horečka vyšší než 38,5 oC, sedimentace erytrocytů vyšší >25 mm/1 hodinu a/nebo zvýšení CRP >25 mg/l, ev. zvýšení prokalcitoninu, a významná leukocytóza v krevním obraze s posunem doleva. Přítomnost dalších nálezů pravděpodobnost postižení parenchymu (pyelonefritidu) zvyšuje: v močovém sedimentu jsou přítomny leukocytární válce, při sonografickém vyšetření je významně zvětšená délka nebo objem ledvin (nad +2 SDS Dinkelova grafu), je přítomna porucha koncentrační schopnosti ledvin (vyšetření s DDAVP samozřejmě nelze provádět v prvních dnech APN). Podezření na akutní pyelonefritidu dále podporuje průkaz vezikoureterálního refluxu alespoň II. stupně v anamnéze. Riziko postižení parenchymu při IMC je zvýšené, pokud víme z předchozí anamnézy, že dítě už pyelonefritickou ataku prodělalo dříve, event. že dokonce byly zjištěny jizvy v ledvině.
Důležité je, že uvedená základní vyšetření lze provést na úrovni primární péče a tak rozhodnout, zda pacienta léčit ambulantně nebo doporučit přijetí na lůžko (testační proužky indikující leukocyturii – pyurii, vyšetření CRP, resp. jednoduchý mikroskop a kalibrovaná komůrka k vyšetření nativní necentrifugované moči by měly patřit ke standardnímu vybavení ordinace PLDD).
5. Zobrazovací metody
Ultrazvuk ledvin
Ultrazvukové vyšetření ledvin patří k rutinnímu vyšetření u dítěte s podezřením na akutní pyelonefritidu. U febrilního pacienta s pozitivním nálezem v moči svědčícím pro IMC (testovací papírky, mikroskopie) je indikováno ultrazvukové vyšetření ledvin (nejlépe do 24 hodin). Vyšetření nemá za cíl potvrdit diagnózu IMC, má především vyloučit komplikovanou pyelonefritidu – zejména městnání v dutém systému (hydronefróza, dilatace ureterů, anomálie ledvin – v případě takových nálezů je třeba konzultovat dětského urologa), ložiskové změny (akutní fokální bakteriální nefritida, absces, cysty). Ultrazvukem je třeba posoudit močový měchýř, jeho kontury, event. divertikly, sílu stěny a posoudit i reziduum moči po ukončení mikce. Rutinně by se měla hodnotit velikost a symetrie ledvin a event. fokální změny (Dinkelův graf – vždy zaznamenat do dokumentace nejen délku ledvin, ale i výšku pacienta). Zatím ani ultrazvukové přístroje poslední generace nejsou schopny spolehlivě diagnostikovat postižení parenchymu. U recidivujících IMC, event. již s prokázanou lézí parenchymu by mělo být opakované vyšetření s měřením alespoň dlouhé osy ledvin rutinou. Lag-down růst ledviny v Dinkelově grafu je podezřelý z jizvení parenchymu. U pacientů s chronickou IMC se doporučuje dát graf domů rodičům a nosit jej ke kontrolám. Obrovský technický pokrok ultrazvukové techniky a dostupnost kontrastních médií dnes zlepšuje diagnostiku VUR (viz níže). Snahou výrobce je umožnit detekci parenchymových jizev (renal scarring), to ale zatím nelze ani u nejmodernějších přístrojů, doménou zůstává statická scintigrafie s DMSA.
Mikční cystouretrografie (MCUG)
Mikční cystouretrografie s radiokontrastní látkou je stále klasickou metodou k průkazu vezikoureterálního refluxu (VUR), změn na vnitřní straně močového měchýře a posuzuje i průběh uretry během mikce.
Vezikoureterální reflux je přítomen u cca 35 % dětí po 1. atace akutní pyelonefritidy (většinou nižšího I.–III. stupně). Pravděpodobnost VUR stoupá s dalšími atakami akutní pyelonefritidy, při 2 a více atakách až u cca 75 % dětí (viz tab. 5).
Tab. 5. Výskyt VUR u kojenců podle počtu prodělaných akutních pyelonefritid (adaptováno z Clinical Practice Guideline Urinary Tract Infection 2011). 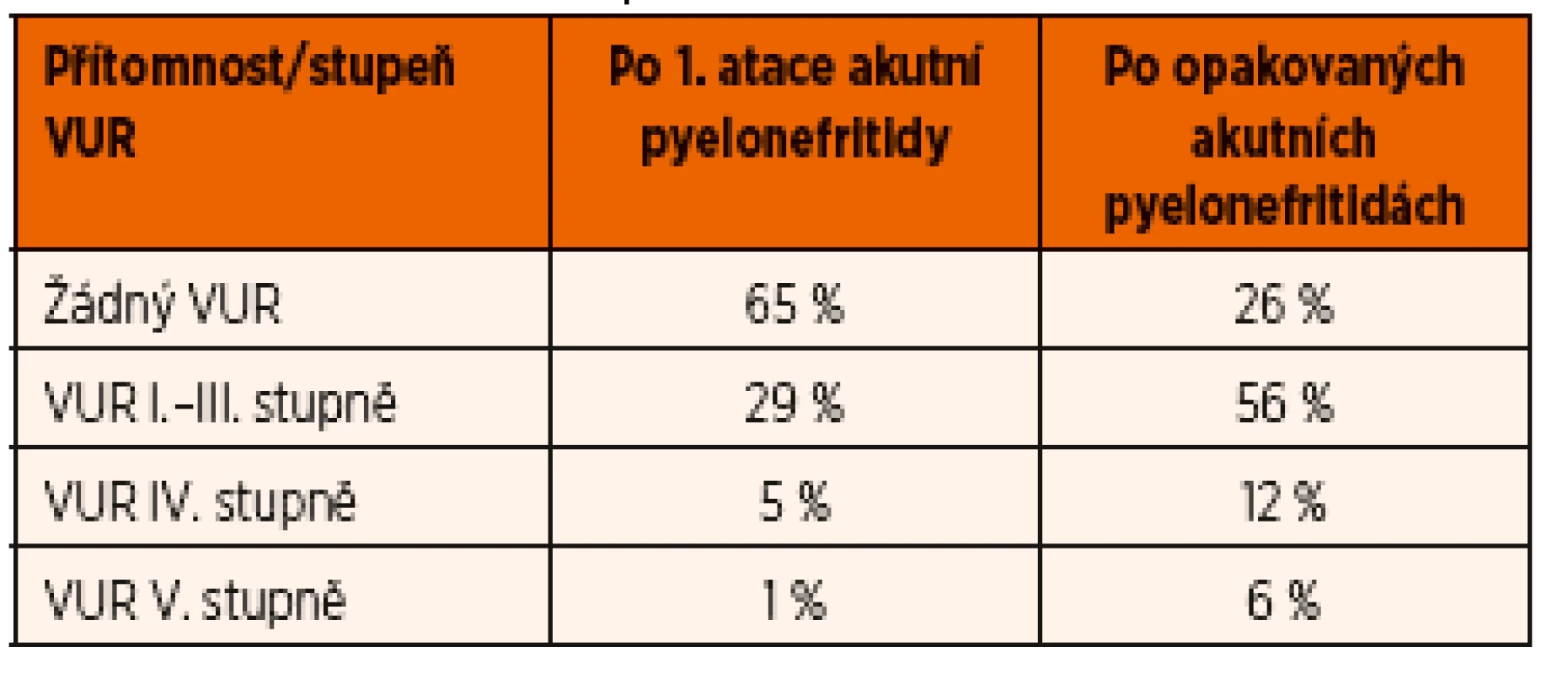
Indikace MCUG
Podle různých národních doporučení se tato často významně liší, většina doporučení (ne všechna) v poslední době doporučují indikovat MCUG u kojenců a batolat po 1. atace akutní pyelonefritidy selektivně – tj. jen u vybraných pacientů splňujících indikační kritéria (viz dále).
Dnes tedy převládá názor, že u kojenců a batolat po 1. atace akutní pyelonefritidy s negativní anamnézou a normálním sonografickým nálezem na uropoetickém traktu není nutné MCUG provádět. Naopak provést MCUG je doporučováno u kojenců a batolat již při 1. atace IMC v situacích uvedených v tabulce 6.
Tab. 6. Indikace MCUG u kojenců a batolat s IMC. 
Doba provedení MCUG u dětí po IMC
Dříve se doporučovalo provést MCUG 4–6 týdnů po akutní atace IMC, aby se vyloučil vliv zánětu v oblasti ureterálních ostií na ventilový mechanismus. Do té doby byly děti na chemoprofylaxi recidivy IMC. V posledních letech se objevily studie ukazující, že vyšetření je možné provést již koncem 1. týdne po atace pyelonefritidy, pokud je stav pacienta kompenzován, je afebrilní, moč je již sterilní a pacient je zatím na ATB/chemoterapii, přičemž rozdíl mezi výskytem VUR mezi dětmi s časně a odloženě provedenou MCUG nebyl statisticky významný [3].
Vyšetření MCUG tedy lze provést
- a) časně – tj. ještě v průběhu hospitalizace, za výše uvedených podmínek; pokud není VUR prokázán, ušetří se několikatýdenní podávání profylaxe, navíc se řada rodičů po propuštění pacienta bohužel k odloženému vyšetření MCUG vůbec nedostaví;
- b) odloženě – tj. po 4–6 týdnech od proběhlé pyelonefritidy, přičemž do provedení MCUG je dítě po odléčení akutní pyelonefritidy na chemoprofylaxi (viz dále).
Pokud je MCUG indikována, má se provádět na pracovišti vybaveným moderní technikou a personálem, který má dostatek zkušeností s technikou hodnocení nálezů, při vyšším počtu vyšetření se zvyšuje technická kvalita a evaluace nálezů.
Technika provedení MCUG: zavedení cévky do močového měchýře, aplikace kontrastní látky cévkou ve formě kapací infuze, výška hladiny asi 70 cm nad symfýzou dítěte ležícího na zádech. Roztok má být zahřátý na tělesnou teplotu a kape do vyrovnání tlaku. Provádějí se nejméně 2 rtg snímky – v klidu a pak při samotné mikci. Orientační odhad funkční kapacity měchýře = (věk x 30) + 30 ml. Z praktických důvodů se doporučuje katetrizace močového měchýře mimo oddělení zobrazovacích metod, aby dítě přicházelo k vyšetření již zklidněné a schopné spolupráce. U neklidných dětí lze doporučit sedaci midazolamem ve formě nosních kapek v dávce 0,2 mg/kg (jediný preparát, který byl testován ve smyslu efektu na urodynamiku, neovlivňuje ji).
Vezikovaginální influx
Vezikovaginální influx je definován jako stav, kdy při mikci proniká moč z močového měchýře do vaginy. Stav nemusí být spojen s IMC. Fenomén je důležitý v rámci etiologie a diferenciální diagnostiky IMC, může predisponovat k IMC v případě gynekologického zánětu. Vaginální influx lze prokázat při klasické MCUG, kontrastní materiál proniká přes vestibulum do vaginy. Moč může ve vagině stagnovat, dráždí sliznici a na ní se objevují leukocyty, které nemusí být známkou zánětu. Ty se pak dostávají do definitivní moči a nález se pak označuje jako falešná pyurie. Většinou tato „pyurie“ není spojena s významnou bakteriurií. Ve vzácných případech, zejména pokud dívka trpí na vulvovaginitidy, může být vezikovaginální influx spojen se sekundární infekcí močových cest.
Doporučujeme děvčatům s influxem močit na WC míse s koleny daleko od sebe, to snižuje riziko influxu. V případě vulvovaginitidy se sekundární IMC se vždy doporučuje přeléčit nejen IMC, ale i primární příčinu – vulvovaginitidu antibiotickými či chemoterapeutickými vaginálními globulemi.
Vylučovací urografie (VUG)
Indikace VUG je v současnosti velice omezená, většinou pouze na přání dětského urologa při podezření na anomálii horních cest močových, jejich zdvojení a při obstrukci UPT. Nahrazuje ji vyšetření MR-urografie nebo CT s daleko vyšší výpovědní hodnotou (ovšem CT je spojena s velkou radiační zátěží), případně dynamická scintigrafie ledvin. Při kvalitním přístrojovém vybavení lze posoudit morfologii dutého systému, klasické známky chronické pyelonefritidy jsou: deformace kalicho-pánvičkového systému, otupení kalíšků (clubbing), asymetrie velikosti ledvin, známky svrášťování. V souvislosti s významným zlepšením ultrazvukové techniky indikace i význam klasické VUG ustupují do pozadí a prováděna je poměrně zřídka a v poslední době se již prakticky neprovádí.
Statická scintigrafie
Statická scintigrafie ledvin – 99mTc-DMSA zatím stále platí za zlatý standard průkazu zánětlivého postižení ledviny, resp. pyelonefritických jizev. Akutní zánět se projevuje sníženou akumulací radiofarmaka v místě zánětu. Vyšetření je možné provádět v akutní fázi IMC nebo s časovým odstupem. V akutní fázi statická scintigrafie může ukázat lokální výpad akumulace radiofarmaka, tedy pyelonefritidu, ale nemusí to ještě znamenat jizvu! Rozsah léze se může lišit (jednostranná, oboustranná léze, lokalizace výpadu akumulace). V akutní fázi se v dnešní době většinou vyšetření 99mTc-DMSA scan nedoporučuje.
Naopak statická scintigrafie s časovým odstupem (doporučený interval odstupu od akutní ataky pyelonefritidy je 4–6 měsíců) nám poskytne informaci, zda po akutním zánětu vznikla trvalá jizva/jizvy parenchymu ledviny/ledvin a je většinou odborníků doporučovanou vyšetřovací metodou u dětí. Avšak v posledních letech je, stejně jako v případě MCUG, ústup od rutinního provádění i statické scintigrafie ledvin s časovým odstupem. Většina odborných společností, včetně naší Pracovní skupiny dětské nefrologie při ČPS, doporučuje provést statickou scintigrafii ledvin s časovým odstupem také jen selektivně v těchto případech:
- a) po 1. atace akutní pyelonefritidy v případě:
- komplikované akutní pyelonefritidy (viz tab. 2),
- atypické akutní pyelonefritidy (viz tab. 6),
- b) s recidivujícími akutními pyelonefritidami: u všech kojenců a batolat.
Dynamická scintigrafie ledvin
Dynamická scintigrafie ledvin s MAG3 (mercapto-acetyltriglycin značený 99mTc) je indikována především při podezření na obstrukci uropoetického traktu. MAG je vychytáván a vylučován buňkami ledvinných tubulů do moči. Asi 90 % 99mTc-MAG3 je v plazmě navázáno na transportní bílkoviny, jeho vylučování glomerulární filtrací je nevýznamné. Dynamická scintigrafie ledvin je jedinou metodou, která posuzuje odděleně funkci obou ledvin, resp. jejich částí. Do určité míry může posoudit i průtok plazmy ledvinami. Je důležitým vyšetřením, především při podezření na obstrukci močových cest.
Magnetická rezonance (MRI)
Magnetická rezonance představuje dokonalé znázornění uropoetického traktu s potřebnými detaily. Nejlépe posoudí anatomii UPT a detailní patologické změny, které významně usnadní urologům rozhodnutí o event. indikaci a postupech, pokud se plánuje chirurgická intervence. V poslední době klinické studie upozorňují, že MRI vykazuje vyšší senzitivitu při průkazu akutního zánětlivého postižení ledviny ve srovnání se statickou 99mTc-DMSA scintigrafií [4]. Ukazuje se, že by „gadolinium-enhanced MRI“ mohla odlišit zánětlivou reakci od jizvy již v časném stadiu, toto rozlišení pomocí DMSA není možné. Problémem při MRI zůstává dostupnost kvalitního přístroje, zkušeného vyšetřujícího a nutnost sedace, resp. celkové anestezie, což je problém u kojenců a batolat i menších dětí. Roli hrají i nemalé finanční náklady vyšetření, MRI rozhodně není a ani v blízké budoucnosti nebude obvyklým vyšetřením u dětí s akutní IMC. I zde platí shora uvedené doporučení o personálním a přístrojovém zajištění výkonu.
Diagnostický postup u kojenců a batolat s akutní pyelonefritidou je shrnut ve schématu 1.
Schéma 1. Diagnostický algoritmus u akutní pyelonefritidy u kojenců a batolat. 
LÉČBA IMC
Při léčbě infekcí močových cest máme 2 hlavní cíle:
- eliminaci akutní infekce,
- prevenci komplikací a recidiv – snížení rizika vzniku chronického poškození ledvin (pozánětlivých jizev) a jeho komplikací (hypertenze, proteinurie, chronická renální insuficience).
1. Eliminace akutní infekce
Z definice IMC vyplývá užití antibiotik, resp. chemoterapeutik.
Akutní pyelonefritida
Zahájení a aplikační forma antibiotické léčby
Antibiotickou léčbu zahajujeme ihned po stanovení klinické diagnózy (klinický obraz + laboratorní vyšetření moče chemicky a mikroskopicky + laboratorní vyšetření krve) a odběru moče na mikrobiologické vyšetření (nečekáme tedy na výsledek mikrobiologického vyšetření 24–48 hodin). Opožděné zahájení antibiotické léčby je spojeno se zvýšeným výskytem chronických pozánětlivých jizev na ledvinách [5–7].
U kojenců a batolat se preferuje zavedení i.v. kanyly a parenterální aplikace. Pokud z některých důvodů není možná antimikrobní parenterální léčba, je možno připustit i podávání léků per os, pokud ovšem tento způsob dítě bezpečně toleruje, nezvrací, není přítomen průjem a klinický stav není hodnocen jako septický.
Některé nejnovější kontrolované studie skutečně prokazují, že i v nízkých věkových skupinách lze podávat léky perorálně se stejným efektem na eradikaci infekce [8]. Nicméně některá zahraniční doporučení posílat kojence s pyurií a pozitivní esterázovou/nitritovou reakcí do domácí péče 20 km od nemocnice budí oprávněné pochybnosti. Proto se domníváme, že v České republice, na rozdíl od USA nebo Velké Británie, by měli být kojenci a mladší batolata s akutní pyelonefritidou raději hospitalizováni alespoň po nezbytně krátkou dobu.
Důvodem omezené hospitalizace (především v USA) jsou významně vyšší náklady hospitalizace ve srovnání s ambulantní léčbou [1]. Argumentem hospitalizace u nás je riziko posílat do domácího ošetření kojence//batole s vysokou teplotou, event. zvracením či průjmem, velká vzdálenost bydliště od nemocnice a sociálně problematická rodina.
Doporučujeme u kojenců a batolat parenterální léčbu při hospitalizaci, především jsou-li známky celkové alterace (prodloužený capillary refill time), průjmu, zvracení, rodina bydlí daleko od zdravotnického zařízení, nebo je špatné spojení a podezření na non-compliance (rodiče//adolescenti).
U starších pacientů bez celkové alterace (zejm. školní děti) nemusí být vždy hospitalizace indikována, pokud je perorální aplikace léků zajištěna. Parenterální léčbu ale raději doporučujeme při symptomech uvedených shora u kojenců a i v případech, kdy léčba započatá ambulantně nemá odpovídající efekt [9].
Hlavní indikace k parenterální léčbě akutní pyelonefritidy jsou shrnuty v tabulce 7.
Tab. 7. Doporučené indikace k parenterální léčbě akutní pyelonefritidy. 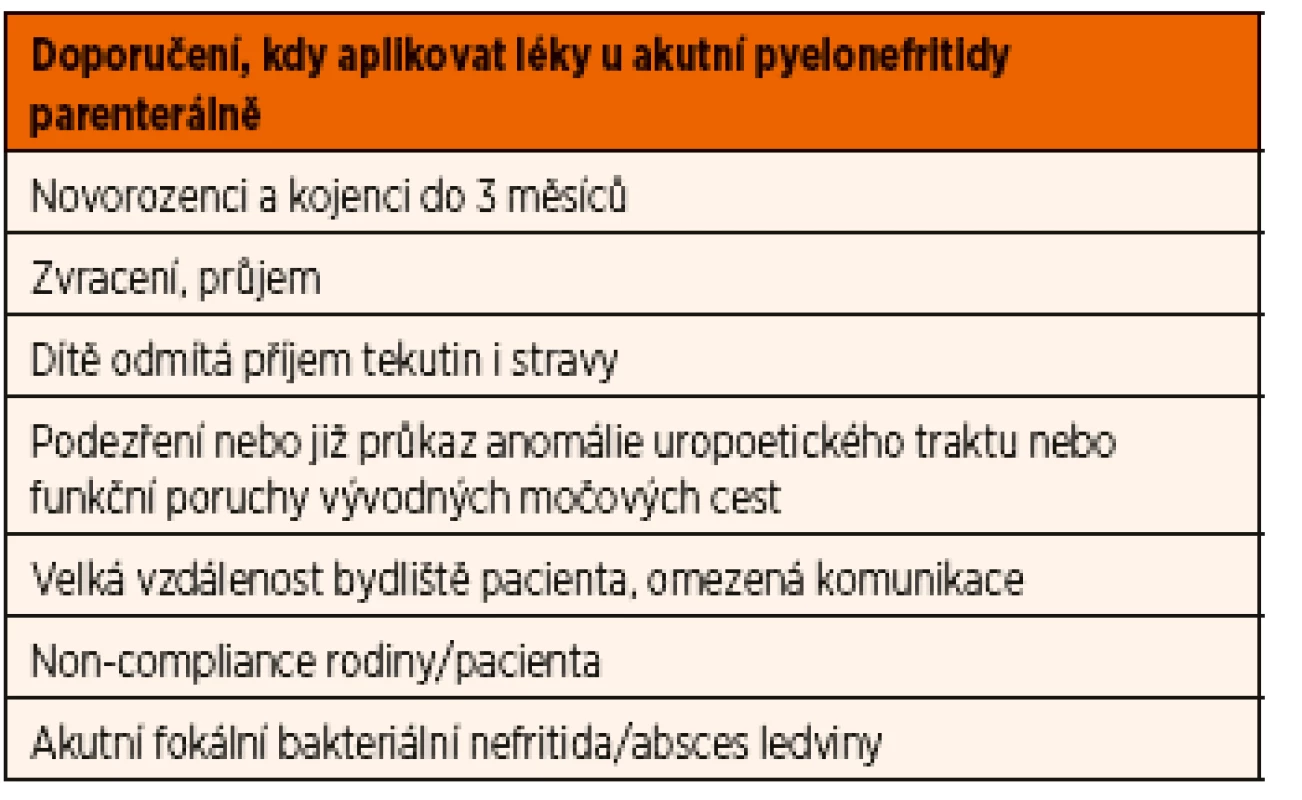
Empirická volba antibiotika
V naprosté většině případů není k dispozici kultivační nález v moči s citlivostí na daná antibiotika, a proto je volba antibiotika většinou empirická a vychází z předpokládaných nejčastějších vyvolavatelů IMC. Může vycházet i z místních přehledů citlivosti nejčastějších vyvolavatelů IMC, pokud jsou t. č. k dispozici a reflektují regionální situaci.
Neexistuje žádné jednoznačné doporučení, jaké antibiotikum empiricky (bez znalosti vyvolávajícího agens) použít.
Empirická léčba vychází z toho, že většina IMC je způsobena E. coli. Rezistence tohoto kmene vůči dlouhá léta užívaným ATB (ampicilin/amoxicilin) v poslední době stále stoupá (včetně chráněných ampicilinů s klavulanátem/sulbactamem). Bohužel to platí i pro cefalosporiny 1. generace a cotrimoxazol, dobrý efekt si stále udržuje furantoin. Riziko rezistence stoupá při anamnéze předchozí chemoprofylaxe. U akutní pyelonefritidy se dnes většinou doporučují cefalosporiny 3. generace (např. ceftriaxon, cefixime), event. aminoglykosidy (gentamicin, amikacin), zvláště v případě podezření na jiný kmen než E. coli (např. Pseudomonas). Tato ATB ale nejsou účinná při IMC způsobené Enterococcus sp., pak se doporučují ampicilinové preparáty. U pacientů se známou nepříznivou reakcí na ampicilin a cefalosporiny je možno použít cotrimoxazol nebo fluorochinoliny (např. ciprofloxacin). Fluorochinoliny určitě nejsou lékem první volby, doporučuje se rezervovat je pro IMC způsobené Pseudomonas sp. a multirezistentními gramnegativními bakteriemi. U kojenců do 2 měsíců věku se doporučuje kombinace amoxicilinu s aminoglykosidy.
Názvy a dávky doporučovaných ATB jsou uvedeny v tabulce 8.
Tab. 8. Antibakteriální léčba akutní pyelonefritidy. 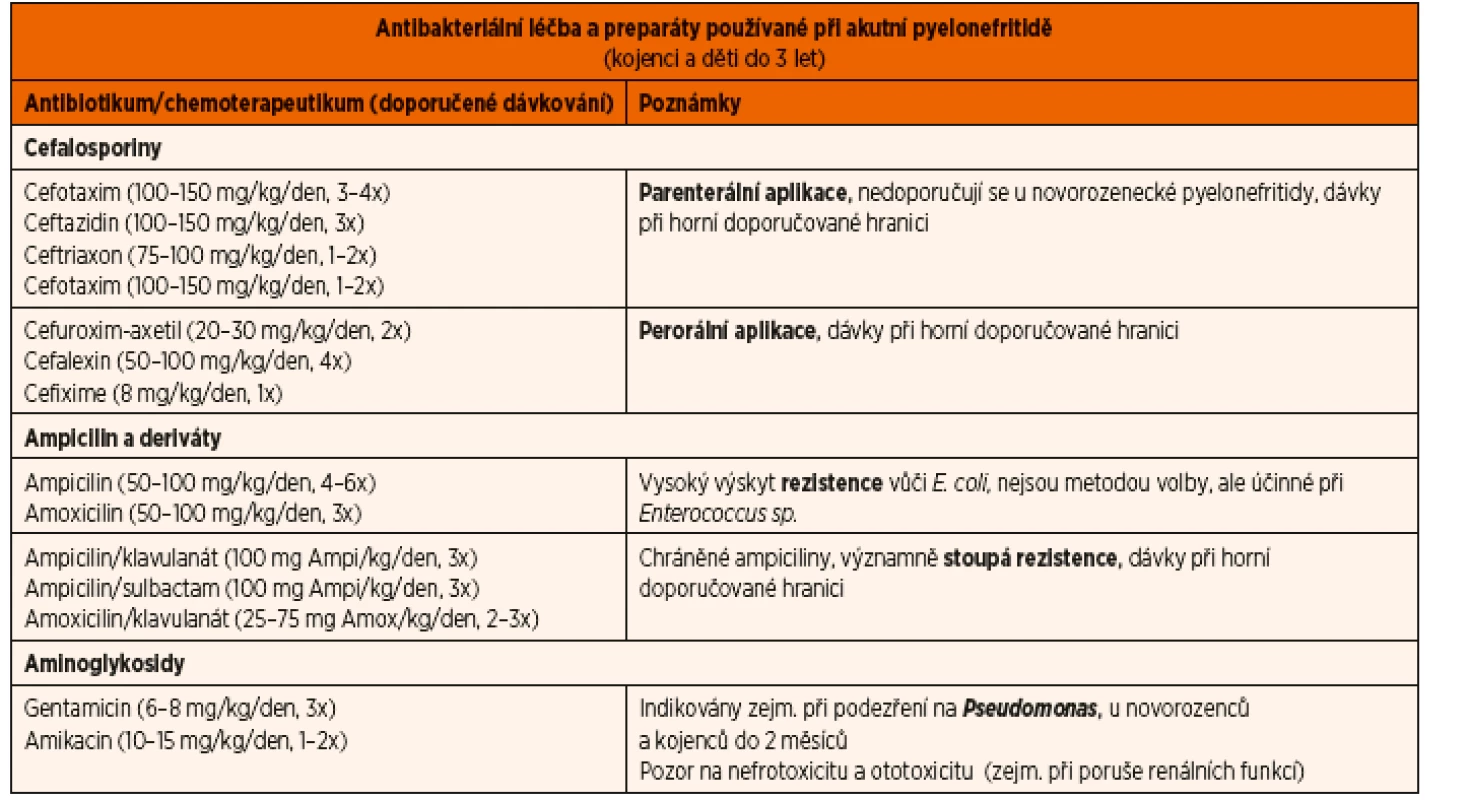
Pozn.: Pokud jsou k dispozici lokální přehledy citlivosti, možno je využít. Při podezření nebo již prokázané anatomické/funkční poruše UPT konzultace urologa, který by měl akutně řešit především obstrukci močových cest. Doba aplikace antibiotik
Parenterální aplikace ATB má trvat alespoň do poklesu teplot a úpravy celkového stavu, tedy do doby, kdy dítě je schopno přijímat aplikační formu per os, nezvrací a nemá průjem. Pokud při shora uvedené léčbě trvá horečka déle než 48 hodin, je nutné uvažovat o komplikované IMC nebo rezistenci mikroba.
Celková doba podávání ATB u pyelonefritidy by měla být 10–14 dní. U novorozenců a kojenců do 3. měsíce i déle než horní hranice doby aplikace. Doba podávání závisí na klinickém stavu dítěte, laboratorních výsledcích a rovněž na morfologickém nálezu uropoetického traktu (zejména u akutní fokální bakteriální nefritidy).
U prokázané anatomické či funkční poruchy může sterilizace UPT vyžadovat i delší dobu.
U novorozenců a kojenců do 3. měsíce života se i při normální anatomii a funkci UPT většinou doporučuje delší doba než 10 dní (alespoň 14–21 dní, i když nálezy v moči jsou již po několika dnech negativní).
Při anomáliích UPT je třeba vždy konzultovat dětského urologa a být v úzkém kontaktu s mikrobiology.
Při parenterální aplikaci je možno přejít na perorální podání většinou během 3 dnů, když tento způsob pacient již toleruje, zlepšil se klinický stav, klesají horečky a zánětlivé parametry a pacient toleruje p.o. příjem.
Při citlivosti vyvolávajícího mikroba by teplota měla klesnout do 48 hodin, v této době by se měly již významně normalizovat laboratorní nálezy a zmírnit/vymizet celkové objektivní příznaky a subjektivní obtíže u pacientů, kteří jsou schopni je udávat. V té době je již k dispozici výsledek kultivace a citlivosti. Pokud uvedený efekt není patrný, pak je indikována změna/doplnění léčby. Na druhé straně při dobrém klinickém a laboratorním efektu je možno pokračovat v léčbě, i když hlášená citlivost není optimální.
Podpůrná léčba
Dostatečnou hydrataci je u kojenců a batolat často možné zajistit jen parenterálním podáváním infuzních roztoků do zlepšení klinického stavu (ústup zvracení, nauzey, horeček).
Z antipyretik jsou vhodnější paracetamol nebo parenterální metamizol, protože antipyretika – antiflogistika (NSAID) mohou nepříznivě ovlivnit perfuzi ledvin, zejména u dehydratovaných dětí se sklonem k prerenálnímu akutnímu poškození ledvin. V případě zjištění urologické anomálie na UPT nebo akutní fokální bakteriální nefritidy nebo abscesu je nutné kontaktovat urologa pro případnou urologickou intervenci.
Akutní cystitida
Většinou se jedná o starší děti, resp. adolescenty (nejčastěji adolescentky), doporučuje se použití chemoterapeutik, v perorální formě, citlivost podle místních přehledů (viz tabulka „ATB pro cystitidu“).
Doba podávání je kratší než u pyelonefritidy, většinou stačí 3–5denní léčba. Doporučuje se nepoužívat cotrimoxazol, ale přednostně trimethoprim nebo nitrofurantoin v běžné dávce nebo cefalosporiny (tab. 9).
Tab. 9. Antibakteriální léčba akutní cystitidy. 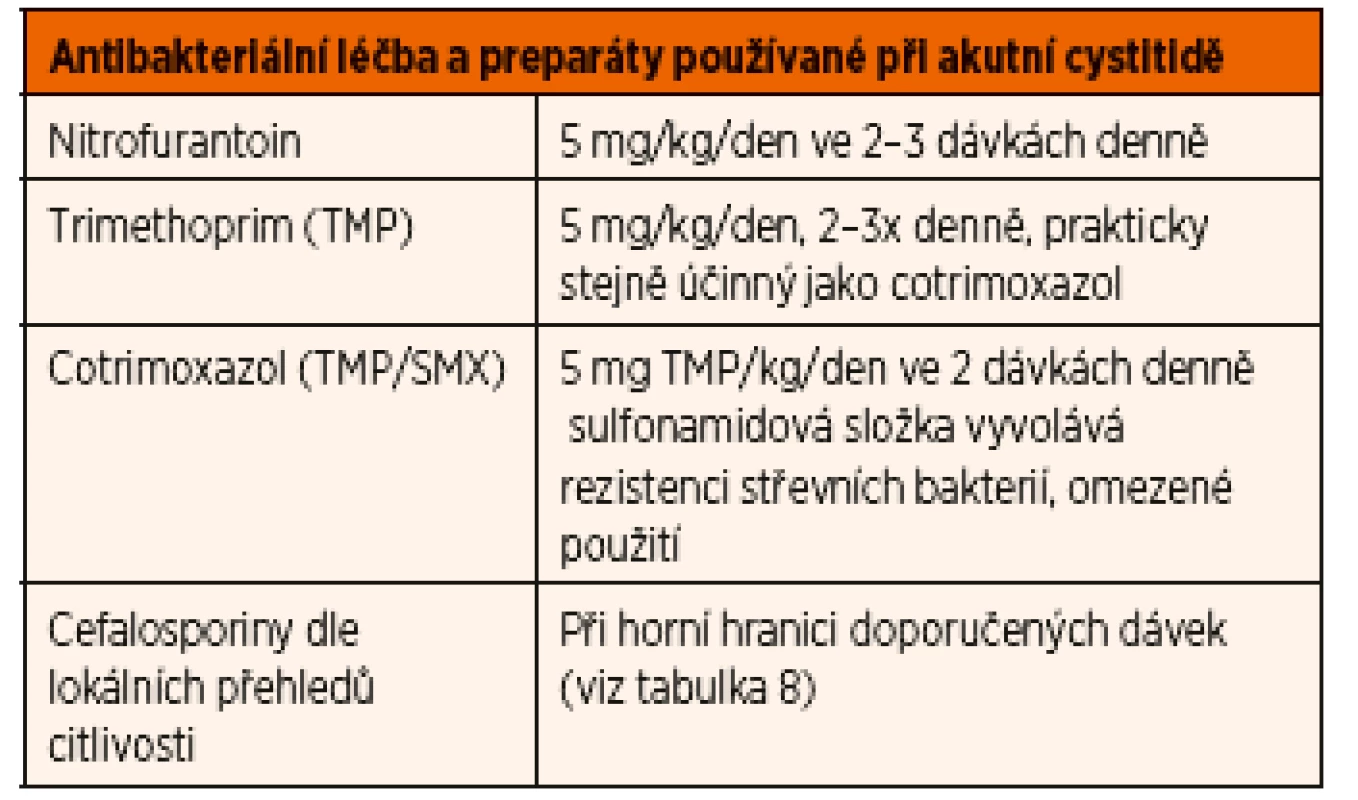
Asymptomatická bakteriurie
Asymptomatická bakteriurie, tedy opakované nálezy významné izolované bakteriurie u jedinců s normální anatomií uropoetického traktu a normálním funkčním vyšetřením ledvin i vývodných močových cest, není indikována k léčbě.
2. Prevence komplikací a recidiv
Chemoprofylaxe při recidivujících IMC a VUR
Chemoprofylaxe je definována jako podávání chemoterapeutik (ale i antibiotik) v případě, že se již podařilo sterilizovat UPT. Cílem chemoprofylaxe je zabránit/snížit riziko recidivy IMC. Používají se především chemoterapeutika v dávkách významně nižších než při léčbě akutní IMC. Mezinárodní refluxová studie v 80. letech (IRSC) ukázala, že podávání nízkých dávek furantoinu, resp. cotrimoxazolu po sterilizaci močového traktu snižuje riziko další ataky IMC. Při konzervativní léčbě VUR se chemoprofylaxe ukázala stejně efektivní jako operační řešení. Některé klinické studie v posledních 10 letech ale prokázaly, že rutinně prováděná chemoprofylaxe, včetně konzervativní léčby VUR, nemá takový význam, jaký se jí původně přikládal. Nebyl nalezen žádný rozdíl v recidivách IMC u dětí s profylaxí, resp. bez ní, a incidencí nových pyelonefritických jizev, resp. progrese starých jizev. To se ukázalo především u pacientů bez obstrukční uropatie, hypoplazie/dysplazie ledvin, kdy jizvy vznikají jen vzácně. Tyto nálezy vedly (podobně jako u VUR) ke zpochybnění chemoprofylaxe. Studie zpochybňující efekt dlouhodobé profylaxe ale testovaly především pacienty ve věku do 2 let, proto byla iniciována v USA první randomizovaná placebem kontrolovaná studie RIVUR [10], jejíž výsledky byly zveřejněny v roce 2014 a která prokázala, že chemoprofylaxe u dětí s VUR I.–IV. stupně signifikantně snižuje výskyt IMC (o 50 %!), i když nesnížila výskyt nových jizev a zvýšila výskyt rezistentních bakteriálních kmenů. Je tedy zřejmé, že chemoprofylaxe snižuje výskyt IMC, i když má své nevýhody.
Důležitou roli při chemoprofylaxi hraje i compliance rodiny, resp. pacientů samotných.
Kdy používat chemoprofylaxi
Pokud jde o první ataku nekomplikované akutní pyelonefritidy a morfologický nález na uropoetickém traktu je v mezích normy a nejsou ani známky poruchy vyprazdňování dolního segmentu, není další léčba nutná a chemoprofylaxe se nedoporučuje.
V případě recidivujících IMC nebo u pacientů, kde byl diagnostikován VUR vyššího stupně (III.–V.), je podávání chemoprofylaxe vhodné, protože podle nejnovějších údajů z randomizované placebem kontrolované RIVUR studie [10] chemoprofylaxe prokazatelně snižuje výskyt recidiv IMC (evidence-based medicine).
Doporučujeme následující přístup: pokud se u pacientů s anatomickou nebo funkční poruchou UPT objeví akutní pyelonefritida, je vhodné chemoprofylaxi praktikovat. Platí to především pro děti s dilatací horních i dolních močových cest (nejčastější příčinou je vezikoureterální reflux, ale i jiné anatomické či funkční poruchy – např. neurogenní močový měchýř u dětí po operaci meningomyelokély, denní katetrizace/autokatetrizace močového měchýře atd.).
Výběr léku a dávkování při chemoprofylaxi
Běžně používané preparáty jsou stejné jako při léčbě akutní cystitidy (viz tabulka shora), ale dávky jsou u nitrofurantoinu a trimethoprimu cca 1/3, s aplikací 1x denně před spaním (viz tab. 10). Podle efektu lze individuální dávky vytitrovat a ev. střídat ATB podle lokálních přehledů rezistence, pokus vyvarovat se osídlení pacienta rezistentními kmeny.
Tab. 10. Léky a jejich dávkování při profylaxi infekcí močových cest. 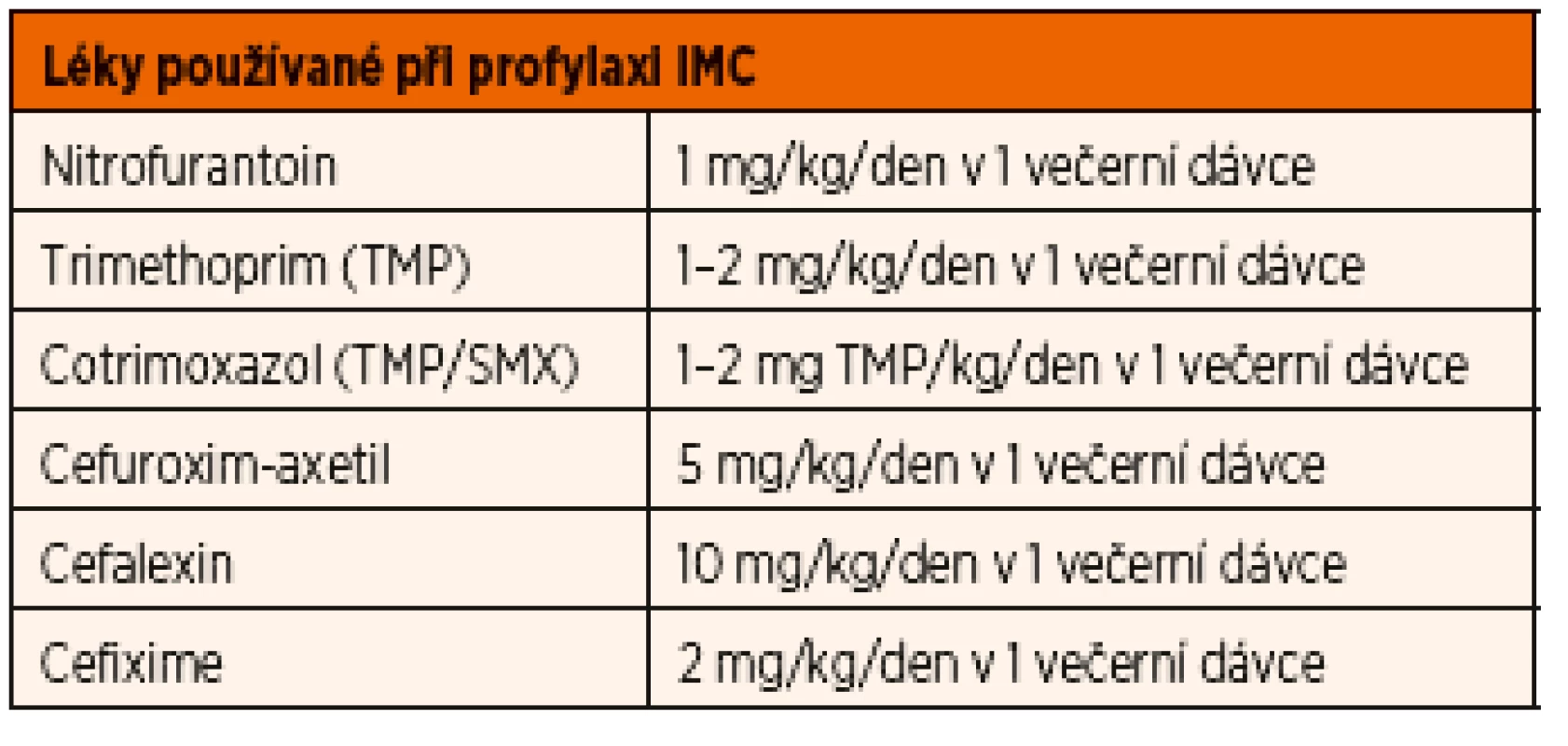
Současné indikace chemoprofylaxe IMC jsou shrnuty v tabulce 11.
Tab. 11. Doporučené indikace chemoprofylaxe IMC u dětí. 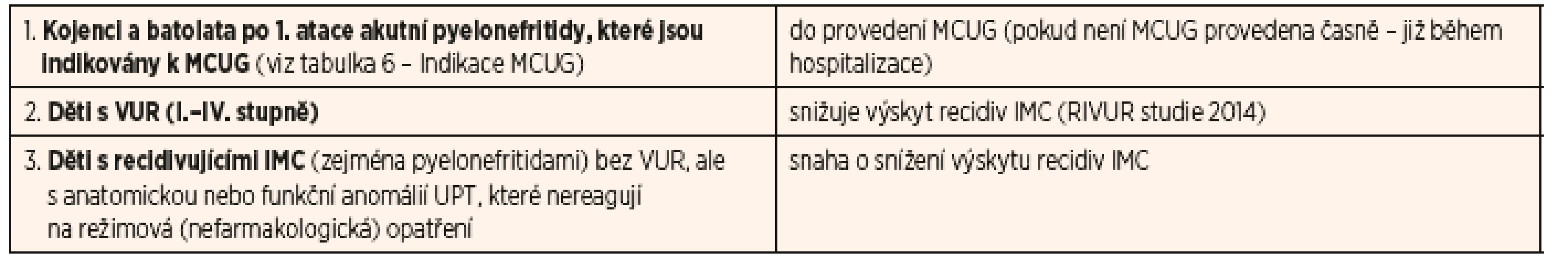
Další podpůrná opatření v rámci prevence IMC
Nejjednodušší způsob, jak zabránit adherenci mikrobů ke sliznici UPT, jsou dostatečný příjem tekutin (diuréza) a časté mikce. Režim dostatečného příjmu tekutin je tedy velmi důležitý a menší děti je třeba v tomto smyslu pečlivě kontrolovat.
Neřešená dlouhodobá obstipace představuje rizikový faktor pro IMC, často je spojena s dysfunkcí dolních močových cest (tzv. bowel and bladder dysfunction, BBD – dysfunkce střeva a měchýře).
Při průkazu funkční poruchy pomocí urodynamického vyšetření je možno zkusit podávat anticholinergika, např. oxybutinin v dávce max. 0,2 mg/kg alespoň ve 2 denních dávkách. Obstipace u dorostenek představuje při podávání kontraceptiv rizikový faktor, běžně se doporučuje po styku časné vymočení.
Extrakty z brusinky (klikva = Vaccinium macrocarpon, Cranberry juice)
V posledních letech se rozšířilo jejich používání. Význam má hlavně D-mannosa, která se dostává do moči. Fimbrie E. coli produkují 2 adheziny, z nichž jeden je mannosa senzitivní a druhý mannosa rezistentní. Součástí extraktu je proanthocyanin, který blokuje přichycení fimbrií E. coli k uroepitelu močových cest.
Usnadňuje tak jejich eliminaci (principem je tedy kompetitivní inhibice a pak „flush“ efekt, kdy mikroby jsou vyloučeny diurézou). Efektivita byla a je i nadále testována v řadě studií, jejichž design se bohužel značně liší a tak dochází k různým závěrům o efektivitě této profylaxe/léčby. Nedávná cochranská metaanalýza publikovaná 2012 signifikantní efekt na snížení výskytu IMC neprokázala [11], ovšem recentní publikace z roku 2016 kritizuje design dosavadních studií a žádá přesnější definici jednotlivých skupin probandů [14]. Extrakty z klikvy, ev. probiotika se mohou uplatnit při profylaxi IMC, nikoliv jako samostatný přípravek při léčbě významné bakteriurie. Pokud pacientky, v našem případě dorostenky, mají samy dobrou zkušenost ve smyslu snížení počtu recidiv IMC, nebudeme je od této praxe odrazovat.
Probiotika
Již dříve byla publikována řada studií, které upozorňují na příznivý vliv užívání probiotik na frekvenci recidiv IMC, především u žen. Ojedinělé jsou i zprávy o použití u dětí včetně nejnižších věkových skupin, např. u dětí s vezikoureterálním refluxem. Příznivý efekt probiotik je zatím podporován pouze empirickou zkušeností, chybějí studie. Recentní cochranská metaanalýza 9 randomizovaných kontrolovaných studií zahrnující přes 700 pacientů neprokázala statisticky významné snížení IMC u dospělých ani u dětí [12]. V poslední době se probiotika přidávají k extraktům z klikvy a na našem trhu existuje řada takových přípravků.
Imunostimulace
Při recidivujících IMC je možno, hlavně u starších děvčat, zkusit nespecifickou imunostimulaci podáváním bakteriálních extraktů (např. Uro-Vaxom). Preparát obsahuje lysát z bakterií E. coli. Lysát stimuluje T-lymfocyty, indukuje tvorbu endogenního interferonu a zvyšuje IgA hodnoty v moči. Názory se dlouho různily, nebyly kontrolované studie. Dnes jsou k dispozici recentní metaanalýzy svědčící o významném snížení frekvencí recidivující IMC. Analogický preparát je Solco Urovac, který se aplikuje parenterálně. Opakovaně se objevují pokusy připravit účinnou vakcínu proti IMC vyvolávaných E. coli (s použitím antigenů kmenů E. coli izolovaných od pacientů s recidivující/chronickou IMC, většího rozšíření v praxi ale nedoznaly).
Informace rodičům dítěte po 1. atace akutní pyelonefritidy, při recidivách
Obecně platí, že u pacienta po 1. atace akutní pyelonefritidy by rodina měla být informována o riziku opakovaní a v detailech poučena, kdy mít podezření na recidivu a jak by se mělo v dané situaci výskytu možných příznaků postupovat (horečka, která není doprovázena příznaky kataru horních dýchacích cest, neobvyklé skvrny na pleně, nápadně páchnoucí moč, diskomfort při mikci, zvracení, průjem). Dítě by mělo být za této situace vyšetřeno co nejdříve, rodiče by se měli ihned pokusit o odběr moči (tedy u recidivujících IMC mít připraven doma event. i adhezivní plastikový sáček na sběr moči). Při opakovaných recidivách řada pracovišť dává rodičům k dispozici testační papírky, event. dip-slide metodu.
DISPENZARIZACE DĚTÍ S IMC
Pacienti po 1. atace nekomplikované IMC bez VUR a bez pozánětlivých jizev nemusí být nefrologicky dispenzarizováni, je vhodné ale při každé nevysvětlené horečce, bolestech břicha nebo podobných symptomech IMC vždy co nejdříve vyšetřit moč, aby se včas diagnostikovala a léčila případná recidiva IMC.
Komplikované případy IMC s opakovanými recidivami nebo spojené s VUR či jinou anomálií uropoetického traktu by měl praktický lékař pro děti a dorost konzultovat s dětským nefrologem a/nebo urologem.
Pacienti s recidivujícími IMC (zvláště s již zjištěnými chronickými jizvami, s VUR – refluxovou nefropatií, ale i s jizvami bez VUR) mají zvýšené riziko vzniku arteriální hypertenze a proteinurie, a proto musí mít kontrolován krevní tlak v ambulanci (vhodné je i provedení ABPM u dětí s jizvami – vyšší riziko hypertenze, zejm. noční). Děti s oboustrannými jizvami mají riziko vzniku chronické renální insuficience až chronického selhání ledvin, a proto musí mít pravidelně monitorovány i renální funkce (orientačně alespoň sérový kreatinin).
PROGNÓZA IMC
Přestože se u IMC jedná o velmi časté onemocnění, je pozdní prognóza většiny pacientů s normální morfologií a funkcí uropoetického traktu velmi dobrá a jejich další život není významně ovlivněn.
Avšak u pacientů s různými vrozenými anomáliemi UPT (zejm. VUR), které vedou k recidivujícím akutním IMC, především pyelonefritidám, k chronickému jizvení ledvinného parenchymu (refluxová nefropatie), k hypertenzi, proteinurii a v případě oboustranného poškození ledvin i k chronické renální insuficienci, je prognóza mnohem závažnější a děti mohou dospět až do stadia chronického selhání ledvin již v dětském věku. Chronická pyelonefritida s oboustranným rozsáhlým jizvením parenchymu na podkladě anatomických anomálií uropoetickéhjo traktu patří k nejčastějším příčinám chronického selhání ledvin u dětí a dorostu s nutností náhradní léčby dialýzou a transplantací.
Prof. MUDr. Tomáš Seeman, CSc.
Pediatrická klinika 2. LF UK a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: tomas.seeman@lfmotol.cuni.cz
Zdroje
1. Subcommittee on Urinary Tract Infection, Steering Committee on Quality Improvement and Management. Urinary tract infection: clinical practice guideline for the diagnosis and management of the initial UTI in febrile infants and children 2 to 24 months. Pediatrics 2011 Sep; 128 (3): 595–610.
2. Storm DW, Koff SA, et al. In vitro analysis of the bactericidal activity of Escherichia coli Nissle 1917 against pediatric uropathogens. J Urol 2011 Oct; 186 (Suppl 4): 1678–1683.
3. Doganis D, Mavrikou M, et al. Timing of voiding cystourethrography with first time urinary infection. Pediatric Nephrology 2009; 24 : 319–322.
4. Cerwinka WH, et al. Magnetic resonance urography in pediatric urology. Curr Opin Urol 2010 Jul; 20 (4): 323–329.
5. Oh MM, Kim JW, Park MG, et al. The impact of therapeutic delay time on acute scintigraphic lesion and ultimate scar formation in children with first febrile UTI. Eur J Pediatr 2012; 171 : 565.
6. Shaikh N, Ewing AL, et al. Risk of renal scarring in children with a first urinary tract infection: a systematic review. Pediatrics 2010 Dec; 126 (6): 1084–1091.
7. Shaikh N, Mattoo TK, Keren R, et al. Early antibiotic treatment for pediatric febrile urinary tract infection and renal scarring. JAMA Pediatr 2016 Sep 1; 170 (9): 848–854.
8. Bocquet N, Sergent Alaoui A, Jais JP, et al. Randomized trial of oral versus sequential IV/oral antibiotic for acute pyelonephritis in children. Pediatrics 2012 Feb; 129 (2): e269–275.
9. Kolský A, et al. Terapie infekce infekcí močových cest u dětí. Pediatrie pro praxi 2003; 5 : 267–272.
10. RIVUR Trial Investigators, Hoberman A, Greenfield SP, Mattoo TK, et al. Antimicrobial prophylaxis for children with vesicoureteral reflux. N Engl J Med 2014 Jun 19; 370 (25): 2367–2376.
11. Jepson RG, Williams G, Craig JC. Cranberries for preventing urinary tract infections. Cochrane Database Syst Rev 2012 Oct 17; 10:CD001321.
12. Schwenger EM, Tejani AM, Loewen PS. Probiotics for preventing urinary tract infection in adults nad children Cochrane Database Syst Rev 2015 Dec 3; (12): CD008772.
13. Herreros ML, et al. A new technique for fast and safe collection of urine in newborns. Arch Dis Child 2013; 98 (1): 27–29.
14. Liska DJ, Kern HJ, Maki KC. Cranberries and urinary tract infections: How can the same evidence lead to conflicting advice? Adv Nutr 2016 May 16; 7 (3): 498–506.
Rakouské doporučení na internetu: Arbeitsgruppe Leitlinien Harnwegsinfektion: Diagnose und Therapie des fieberhaften Harnwegsinfektes bei Säuglingen ab dem 3. Lebensmonat und Kleinkindern (2015): http://www.paediatrie.at/home/Spezialbereiche/Nephrologie/Leitlinie-Diagnose-und-Therapie-des-fieberhaften-Harn.php.
Švýcarské doporučení na internetu: Diagnose und Behandlung von Harnwegsinfektionen beim Kind. Empfehlungen der Schweizerischen Arbeitsgruppe für pädiatrische Nephrologie, 2013. http://www.swiss-paediatrics.org/sites/default/files/10-13_0.pdf.
Německé doporučení na internetu – co je nového: Beetz R, Kuwertz-Bröking E: Neues zu Harnwegsinfektionen bei Kindern. Mschr. Kindderheil. April 2015, Volume 163, HYPERLINK "http://link.springer.com/journal/112/163/4/page/1" o "Issue 4" Issue 4, pp 323–330.http://link.springer.com/article/10.1007%2Fs00112-014-3225-3.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2017 Číslo 2- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficitmi v reálnej praxi
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
-
Všetky články tohto čísla
- Praktický prístup k manažmentu monosymptomatickej nočnej enurézy
- Jak přesné je echokardiografické měření otevřené tepenné dučeje?
- Neurofibromatóza u 5letého dítěte – diagnóza na základě huhňavosti
-
18. DNY DĚTSKÉ ENDOKRINOLOGIE
PARDUBICE, 27. – 28. 1. 2017
Růst -
18. DNY DĚTSKÉ ENDOKRINOLOGIE
PARDUBICE, 27. – 28. 1. 2017
NADLEDVINY -
18. DNY DĚTSKÉ ENDOKRINOLOGIE
PARDUBICE, 27. – 28. 1. 2017
GLYKÉMIE -
18. DNY DĚTSKÉ ENDOKRINOLOGIE
PARDUBICE, 27. – 28. 1. 2017
KOST, KALCIO-FOSFÁTOVÝ METABOLISMUS, VODA A ELEKTROLYTY -
18. DNY DĚTSKÉ ENDOKRINOLOGIE
PARDUBICE, 27. – 28. 1. 2017
PORUCHY SEXUÁLNÍ DIFERENCIACE A PUBERTY -
18. DNY DĚTSKÉ ENDOKRINOLOGIE
PARDUBICE, 27. – 28. 1. 2017
ŠTÍTNÁ ŽLÁZA - MUDr. Zdeňka Misařová, CSc. – 90 let
-
Vzpomínka na profesorku MUDr. Helenu Lomíčkovou, DrSc.,
někdejší přednostku Dětské oční kliniky Fakulty dětského lékařství v Praze-Motole
5. 11. 1919 – 2. 7. 2016 - Editorial: Infekce močových cest, Nefrotický syndrom, Hemolyticko - uremické syndromy/trombotická trombocytopenická purpura a Enuréza
- Doporučení Pracovní skupiny dětské nefrologie České pediatrické společnosti pro diagnostiku a léčbu infekcí močových cest u dětí a dorostu
- Nefrotický syndrom v dětském věku
- Trombotické mikroangiopatie – hemolyticko-uremické syndromy a trombotická trombocytopenická purpura
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Trombotické mikroangiopatie – hemolyticko-uremické syndromy a trombotická trombocytopenická purpura
- Nefrotický syndrom v dětském věku
- Doporučení Pracovní skupiny dětské nefrologie České pediatrické společnosti pro diagnostiku a léčbu infekcí močových cest u dětí a dorostu
- Neurofibromatóza u 5letého dítěte – diagnóza na základě huhňavosti
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



