-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Etiologie a léčba novorozeneckého diabetu
The aetiology and treatment of neonatal diabetes
Neonatal diabetes (ND) is a rare disease occurring at a frequency of 1 : 90–160,000 in children up to 6 months of age. Transient hyperglycaemia may occur in premature babies. A combination of long lasting high hyperglycaemia in a child born with intrauterine growth retardation leads to the higher probability of developing diabetes.
Neonatal diabetes is at least in 80% caused by the mutation in one of the genes described so far. Transient form that disappears after several weeks of insulin therapy may recur in adolescence. Permanent neonatal diabetes requires treatment permanently. The major causes of ND are the mutations in the genes coding the potassium channel of the beta-cell (ABCC8 and KCNJ11). This form of ND can be mild with a good sensitivity to the treatment of sulfonylurea derivatives or severe where the diabetes is associated with epilepsy and developmental delay (DEND syndrome). Aetiology also includes gene for insulin, glucokinase, or PLAGL1 gene imprinting on chromosome 6q. Rarely, neonatal diabetes can be a part of dysregulation of the immune system (IPEX syndrome, etc.). Early genetic diagnosis allows targeted treatment of these children.
Keywords:
neonatal diabetes – ABCC8 – KCNJ11 – IPEX syndrome – monogenic diabetes
Autori: Š. Průhová; L. Petruželková; P. Dušátková; V. Straková; B. Obermannová; Z. Šumník
Pôsobisko autorov: Pediatrická klinika 2. LF UK a FN Motol, Praha
Vyšlo v časopise: Čes-slov Pediat 2019; 74 (1): 11-15.
Kategória: Sympozium: Dětská diabetologie
Súhrn
Novorozenecký diabetes je vzácné onemocnění vyskytující se s četností 1 : 90–160 000 dětí mladších 6 měsíců. Tranzientní hyperglykémie se mohou vyskytovat u nedonošených dětí. Pokud však trvají déle, vedou k vysokým vzestupům glykémie a dítě se narodí s intrauterinní růstovou retardací, je třeba pomýšlet na rozvoj diabetu.
Novorozenecký diabetes je minimálně z 80 % způsoben mutací v některém z dosud popsaných genů. Může mít formu tranzientní, která vymizí po několika týdnech nutnosti léčby inzulinem a může recidivovat v dospívání. permanentní novorozenecký diabetes vyžaduje léčbu trvale. Nejčastěji je příčinou mutace v genech pro kaliový kanál beta buňky (ABCC8 a KCNJ11), která může mít formu mírnější s dobrou citlivostí k léčbě deriváty sulfonylurey II. generace, nebo formu těžkou spojující diabetes s epilepsií a opožděným psychomotorickým vývojem (DEND syndrom). V etiologii se dále uplatňují geny pro inzulin, glukokinázu či abnormality imprintingu genu PLAGL1 na chromosomu 6q. Vzácně může být novorozenecký diabetes součástí dysregulace imunitního systému při syndromu IPEX apod. Včasná genetická diagnóza umožňuje cílenou léčbu těchto dětí.
Klíčová slova:
novorozenecký diabetes – ABCC8 – KCNJ11 – IPEX syndrom – monogenní diabetes
ÚVOD
Diabetes mellitus je závažné chronické onemocnění, které se může objevit v jakémkoli věku. V dětství se setkáváme především s diabetem 1. typu, jehož manifestace přichází častěji v batolecím a předškolním věku nebo v pubertě. Výskyt diabetu v prvním roce života je naštěstí mnohem vzácnější. Navíc se v tomto časném věku můžeme setkat s větší pravděpodobností s různou etiologií diabetu.
I když se novorozenecký věk časuje pouze do prvních 7 dní až 4 týdnů života, jako novorozenecký diabetes mellitus (NDM) označujeme diabetes diagnostikovaný do konce 6. měsíce života. Toto časově nesprávně nazvané období novorozeneckého diabetu vzniklo tradicí, kdy se ukázalo, že etiologie diabetu v prvních 6 měsících je úplně jiná než u dětí, které manifestují diabetes po půl roce života. Je zajímavé, že v období mezi 6. a 8. měsícem se diabetes prakticky neobjevuje. Přijde-li dítě s diabetem po 8. měsíci života, již se jedná o „klasický“ diabetes 1. typu vznikající na podkladě polygenní dědičnosti zásadně modifikované kombinací HLA 2. třídy.
Geneticky podmíněný novorozenecký diabetes se vyskytuje s četností 1 : 90–160 000 živě narozených dětí [1].
KLINICKÉ PROJEVY NOVOROZENECKÉHO DIABETU
Děti s NDM se častěji rodí předčasně nebo s nižší porodní hmotností a délkou. Hypotrofie je přičítána nedostatečnému množství inzulinu v těle již prenatálně. Hlavním projevem diabetu je neprospívání, ubývání na váze s případnou polyurií a rychlý rozvoj dehydratace i ketoacidozy, která je diagnostikována až u 30 % případů. Zvláště nedonošené děti mají vysoké riziko metabolického rozvratu s rychlým nástupem i progresí.
Stabilita glykémie v novorozeneckém věku, tj. v prvních 4 týdnech života, může být ovlivněna mnoha faktory. V tomto období se za hyperglykémii považuje hodnota glykémie nalačno nad 6,9 mmol/l z venózní krve a nad 8,3 mmol/l z krevní plazmy. Hodnoty nad 10–11,1 mmol/l svědčí pro diabetes [2]. Po ukončení 4. týdne života bychom již očekávali udržení hladin glykémie v rozmezí běžném pro ostatní věk.
S vyšší glykémií se můžeme setkat zvláště u nedonošených a velmi nedonošených dětí, kde se podle některých odhadů až 75 % dětí potýká s hyperglykémií [3]. Mezi hlavní příčiny se řadí vysoký přísun glukózy infuzí, nezralost β-buněk, stres spojený s inzulinovou rezistencí a zvýšená glukoneogeneze játry. Ke zhoršení průběhu glykémií mohou přispívat i některé léky. Hyperglykémie u těchto dětí většinou vyžaduje léčbu, ale v průběhu další péče se stav spontánně upravuje. Nicméně i u nedonošených dětí se může jednat již o manifestaci NDM [4]. Doporučuje se na něj pomýšlet, pokud [1]:
- hyperglykémie trvá déle než 6 dní,
- je glykémie vyšší než 15 mmol/l,
- je hyperglykémie nejasného původu,
- se dítě narodilo s intrauterinní růstovou retardací,
- má dítě kombinaci vrozených vývojových vad spojovaných s NDM (tab. 1).
Po stanovení diagnózy diabetu je nutné doplnit vyšetření o hladiny autoprotilátek (antiGAD, antiIA2 a antiinzulinových) a C-peptidu. Většina dětí s NDM nemá prokazatelný C-peptid. Ke správnému rozhodování o etiologii diabetu patří také odběr krve na genetické vyšetření (viz níže), zobrazení pankreatu ultrazvukem, případně screening dalších vrozených vad a možných sdružených stavů (tab. 1) a pečlivý rozbor rodinné anamnézy diabetu.
Tab. 1. Monogenně podmíněné formy novorozeneckého diabetu (upraveno dle Mackay; Rubio-Cabezas; Vaxillaire, 2012 a doplněno [5, 7, 22]). ![Monogenně podmíněné formy novorozeneckého diabetu (upraveno dle Mackay; Rubio-Cabezas; Vaxillaire, 2012 a doplněno [5, 7, 22]).](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/16eac9633ee547c290599c032d7c33da.jpeg)
NDM – novorozenecký diabetes mellitus; TNDM – tranzientní novorozenecký diabetes, po několika měsících léčby spontánně mizí, ale většinou se opět objevuje v dospívání nebo časné dospělosti; PNDM – permanentní novorozenecký diabetes, od manifestace trvale; DM – diabetes mellitus; AR – autosomálně recesivní; AD – autosomálně dominantní; PMR – psychomotorická retardace; DEND – kombinace diabetu a neurologického postižení různého stupně (developmental delay, epilepsy and neonatal diabetes); T1D – diabetes 1. typu; HSM – hepatosplenomegalie; AITD – autoimunní thyroiditida Novorozenecký diabetes se klinicky rozděluje na dvě skupiny:
- Tranzientní novorozenecký diabetes mellitus (TNDM), který sice vymizí během zhruba 12 týdnů a dále nevyžaduje léčbu, ale až v 50 % případů později v životě relabuje [5].
- Permanentní novorozenecký diabetes mellitus (PNDM), který vyžaduje trvale kontinuální léčbu od diagnózy [6].
ETIOLOGIE NOVOROZENECKÉHO DIABETU
Pomineme-li tranzientní hyperglykémie nedonošených dětí, pak skutečný diabetes je poměrně vzácný a předpokládá se, že prakticky všechny případy jsou nějak geneticky podmíněné. V literatuře najdeme, že až 80 % případů má prokazatelný geneticky poklad [1]. Nicméně pokud připočteme další případy autoimunního diabetu, který vzniká na podkladě monogenně podmíněné dysregulace imunitního systému, jakou vidíme např. u syndromu IPEX, bude počet geneticky prokázaných případů ještě dále stoupat.
Vzhledem k předpokládané monogenní etiologii onemocnění se tedy doporučuje co nejdříve po stanovení diagnózy provést molekulárně genetické vyšetření k určení typu diabetu. Pro pacienty se všemi typy NDM je nyní dostupná genetická diagnostika – přehled dosud publikovaných genů je v tabulce 1.
Většina pacientů s TNDM má abnormality imprintingu genu PLAGL1 na chromosomu 6q charakteru uniparentální disomie, paternální duplikatury nebo maternální hypometylace [5].
Nejčastějším důvodem vzniku PNDM jsou mutace v genu KCNJ11, který kóduje Kir6.2 podjednotku KATP kanálu β-buněk [7]. Oba případy (TNDM i PNDM) mohou vznikat také na podkladě mutací v genu ABCC8 kódujícím SUR1 podjednotku KATP kanálu β-buněk [8] a genu pro inzulin (INS) [9, 10]. Celkem zodpovídají mutace v těchto třech genech za 90 % všech případů PNDM. Velmi vzácně je PNDM způsoben mutacemi obou alel glukokinázového genu nebo obou alel genu IPF-1 [11, 12]. Ačkoli je tabulka 1 s výčtem všech dosud publikovaných genů spojovaných s NDM rozsáhlá, je nutné konstatovat, že mimo zmíněné případy je naprostá většina extrémně vzácná. Zvláště případy spojované s autosomálně recesivní dědičností typickou pro země s vyšším počtem konsangvinních sňatků se u nás prakticky nevyskytují a nebyly zatím zachyceny.
Většina nositelů mutace v KCNJ11 má tuto patogenní změnu v heterozygotním stavu. Typická je negativní rodinná anamnéza, protože u 90 % z nich se jedná o nové, spontánně vzniklé mutace. Klinicky se tyto děti prezentují izolovaným PNDM, u 20 % z nich se ale mohou objevit sdružené neurologické projevy. Nejzávažnějším, avšak naštěstí vzácným klinickým projevem mutací v KCNJ11 je DEND syndrom (Developmental delay, Epilepsy and Neonatal Diabetes): nápadná porucha psychomotorického vývoje s poruchou motorických a sociálních funkcí a generalizovanou epilepsií, často provázená hypsarytmií na EEG záznamu. Opoždění psychomotorického vývoje se může projevit již postnatálně hypotonií, případně se rozvíjí v prvních měsících života. DEND syndrom může být spojen s mírnou stigmatizací v obličeji (obr. 1a, b) [13].
Obr. 1. a, b. Pacienti se syndromem DEND.
Fig. 1. a, b. Patients with DEND (Developmental delay, Epilepsy and Neonatal Diabetes) syndrome.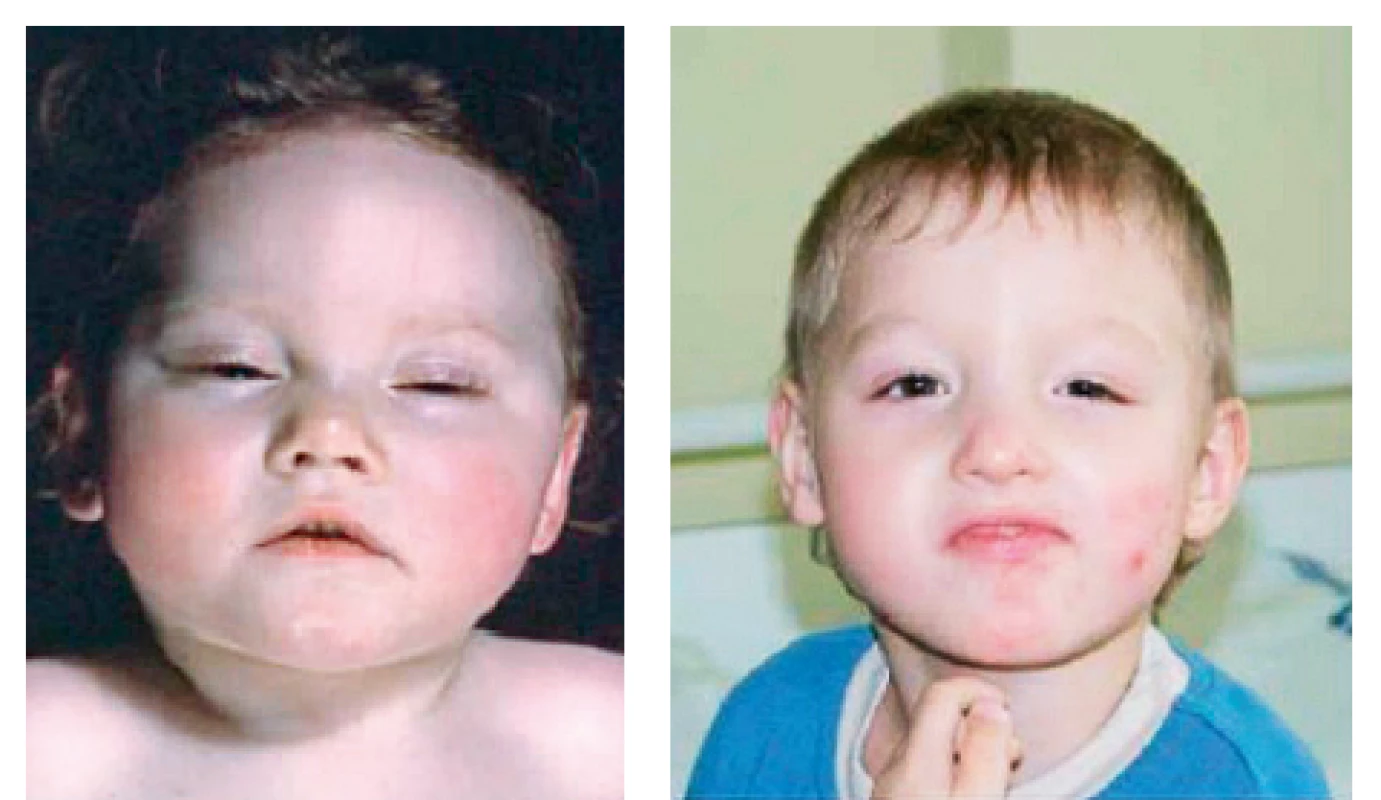
V některých případech může být příčinou PNDM hypoplazie až aplazie pankreatu způsobená mutacemi v genech GATA6, IPF1, RFX6 a dalších. Mutace v genu GATA6 se častěji vyskytují u nedonošených dětí a mohou být spojeny s vrozenou srdeční vadou [4].
Zvláštní pozornost zasluhují autoimunní formy monogenního diabetu, které se mohou projevit v prvních 6 měsících života. Byl jim věnován článek v tomto časopise v roce 2018 [24]. Nejvýznamnější je syndrom IPEX (Imunitní PolyEndokrinopatie vázaná na X chromosom), vzácné autoimunní onemocnění postihující pouze chlapce. Do klinického obrazu patří PNDM, thyroiditida, průjmy, ekzémy, rekurentní těžké infekce, hemoragická diatéza a hemolytická anémie [14]. V krvi je přítomna trvalá aktivace autoagresivních T-lymfocytů CD4+. Syndrom vzniká na podkladě mutace v genu FOXP3 kódující protein scurfin, který působí jako transkripční faktor. Vzácněji se mohou objevit mutace v genu IL2RA, které tvoří tzv. IPEX-like syndrom [15], nebo aktivační mutace v genu STAT3 [16].
LÉČBA DĚTÍ S NOVOROZENECKÝM DIABETEM
Iniciálně po zjištění diagnózy jsou všechny děti s novorozeneckým diabetem léčeny kontinuální infuzí inzulinu. U nedonošených dětí se krátkodobě může začít redukcí nálože glukózy na 3–6 mg/kg/hod. Pokud by ale takové omezení vedlo k nedostatečnému kalorickému příjmu, je na místě zahájit také podávání inzulinu, které zahajujeme zvláště v případě, že glykémie stoupají opakovaně nad 10 mmol/l.
U dětí donošených, zvláště s manifestací diabetu mimo první dny života, postupujeme podobně jako u jiného dítěte s nově manifestovaným diabetem. Zahájíme kapací infuzi s glukózou, ionty a inzulinem v dávce 0,01–0,05 j//kg/hod ke stabilizaci glykémie, redukci acidózy a zajištění dostatečné hydratace. Po stabilizaci stavu je možné přejít na léčbu subkutánní – aktuálně se doporučuje přednostně léčba inzulinovou pumpou, případně intenzifikovaný inzulinový režim, který je postavený na podávání pomalu působícího inzulinu každých 6–8 hodin v kombinaci s rychle působícím humánním inzulinem či inzulinovým analogem aplikovaným ke korekci hyperglykémie či před krmením.
U dětí s prokázanou mutací v genech ABCC8 a KCNJ11 je po stanovení diagnózy vhodné vyzkoušet citlivost k derivátům sulfonylurey (SU) [1, 13, 17]. Test se provádí přednostně s glibenclamidem v dávce 0,5 mg/kg/dávku spolu s podáním standardního množství mléka ke snídani pro daný věk. Měříme glykémii, C-peptid a inzulin nalačno před podáním léku a mléka a za 120 minut po podání. Hodnotíme celkový vzestup C-peptidu a inzulinu a vývoj glykémie. Za pozitivní se považuje vzestup C-peptidu do měřitelných hodnot nebo alespoň na trojnásobek a současně zabránění vzestupu glykémie. Případně lze den před tím provést stejný test bez podání glibenclamidu a oba výsledky pak porovnat.
Pro léčbu se u pacientů se syndromem DEND používá glibenclamid, který se jako jediný z derivátů SU II. generace váže na receptory SUR1 (v β-buňce) i SUR2 (v myokardu, CNS a cévách). Cílem léčby je nejen korekce glykémie, ale také snaha ovlivnit postižené mozkové buňky a podpořit vývoj dítěte, což se v některých mírnějších případech (nazývaných také intermediate DEND) skutečně daří. Nicméně je nutné zmínit, že některé děti na léčbu deriváty SU nereagují vůbec, a to jak v oblasti změn psychomotorického vývoje, tak v ovlivnění glykémie. Přesto se doporučuje u všech dětí s NDM s prokázanou mutací v KCNJ11 nebo ABCC8 genu tuto léčbu vyzkoušet.
Pro děti, jejichž mutace v ABCC8 či KCNJ11 nejsou spojeny se syndromem DEND, nebo které nevykazují známky tohoto syndromu, se pro léčbu diabetu využívají spíše deriváty SU selektivní pro SUR1 receptor, např. gliklazid, glimepirid, glipizid či gliquidon. Deriváty SU snižují jak glykémii nalačno stimulací bazální sekrece inzulinu a snížením glukoneogeneze v játrech (zvláště preparáty s prodlouženým účinkem jako glibenclamid nebo gliklazid s řízeným uvolňováním), tak postprandiální glykémii (preparáty s kratší dobou účinku). Léčebně začínáme v případě glibenclamidu na 0,1 až 0,5 mg/kg/den podle citlivosti v testu, rozdělených do 2–3 denních dávek. U některých pacientů je nutné k zajištění dostatečného efektu nastoupat až k dávce 1,5 mg/kg/den i víc (zvláště u pacientů se syndromem DEND) [18].
U dětí s ostatními typy novorozeneckého diabetu je jedinou možností léčby inzulin. Pacienti se syndromem IPEX jsou indikováni k včasné transplantaci kostní dřeně [19–21]. Imunologická léčba u ostatních specifických typu monogenního autoimunního diabetu se řídí podle genetického nálezu.
ZÁVĚR
Novorozenecký diabetes je vzácné závažné geneticky podmíněné onemocnění. Možnosti současné genetiky přinášejí pochopení etiologie a současně cílenou léčbu pro většinu pacientů. V České republice je možnost diagnostikovat monogenní formy diabetu díky unikátnímu projektu, jehož cílem je hledat příčiny vzniku diabetu u dětí.
Molekulárně genetická diagnostika monogenní formy diabetu je v České republice dostupná v Laboratoři molekulární genetiky (www.lmg.cz) Pediatrické kliniky 2. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Motol a je podpořena grantem Agentury zdravotnického výzkumu č NV18-01-00078 a Projektem konceptuálního rozvoje výzkumné organizace č. 00064203/6001 (Ministerstva zdravotnictví České republiky).
Doc. MUDr. Štěpánka Průhová, Ph.D.
Pediatrická klinika
2. LF UK a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: stepanka.pruhova@fnmotol.cz
Zdroje
- Rubio-Cabezas O, Ellard S. Diabetes mellitus in neonates and infants: Genetic heterogeneity, clinical approach to diagnosis, and therapeutic options. Horm Res Paediatr 2013; 80 (3): 137–146.
- Beardsall K, Vanhaesebrouck S, Ogilvy-Stuart AL, et al. Prevalence and determinants of hyperglycemia in very low birth weight infants: Cohort Analyses of the NIRTURE Study. J Pediatr 2010 Nov; 157 (5): 715–719.
- Sabzehei MK, Afjeh SA, Shakiba M, et al. Hyperglycemia in VLBW infants; incidence, risk factors and outcome. Arch Iran Med 2014 Jun; 17 (6): 429–434.
- Besser REJ, Flanagan SE, Mackay DGJ, et al. Prematurity and genetic testing for neonatal diabetes. Pediatrics 2016 Sep; 138 (3): e20153926–e20153926.
- Mackay DJG, Temple IK. Transient neonatal diabetes mellitus type 1. Am J Med Genet Part C Semin Med Genet 2010 Aug; 154C (3): 335–342.
- Iafusco D, Stazi M, Cotichini R, et al. Permanent diabetes mellitus in the first year of life. Diabetologia 2002 Jun; 45 (6): 798–804.
- Rubio-Cabezas O, Klupa T, Malecki MT, and CEED3 Consortium. Permanent neonatal diabetes mellitus – the importance of diabetes differential diagnosis in neonates and infants. Eur J Clin Invest 2011 Mar; 41 (3): 323–333.
- Babenko AP, Polak M, Cavé H, et al. Activating mutations in the ABCC8 gene in neonatal diabetes mellitus. N Engl J Med 2006 Aug; 355 (5): 456–466.
- Edghill EL, Flanagan SE, Patch A-M, et al. Insulin mutation screening in 1,044 patients with diabetes: Mutations in the INS gene are a common cause of neonatal diabetes but a rare cause of diabetes diagnosed in childhood or adulthood. Diabetes 2008 Apr; 57 (4): 1034–1042.
- Støy J, Edghill EL, Flanagan SE, et al. Insulin gene mutations as a cause of permanent neonatal diabetes. Proc Natl Acad Sci U S A 2007 Sep; 104 (38): 15040–15044.
- Njølstad PR, Søvik O, Cuesta-Muñoz A, et al. Neonatal diabetes mellitus due to complete glucokinase deficiency. N Engl J Med 2001 May; 344 (21): 1588–1592.
- Stoffers DA, Zinkin NT, Stanojevic V, et al. Pancreatic agenesis attributable to a single nucleotide deletion in the human IPF1 gene coding sequence. Nat Genet 1997 Jan; 15 (1): 106–110.
- Gloyn AL, Pearson ER, Antcliff JF, et al. Activating mutations in the gene encoding the ATP-sensitive potassium-channel subunit Kir6.2 and permanent neonatal diabetes. N Engl J Med 2004 Apr; 350 (18): 1838–1849.
- Bacchetta R, Barzaghi F, Roncarolo M-G. From IPEX syndrome to FOXP3 mutation: a lesson on immune dysregulation. Ann N Y Acad Sci 2018 Apr; 1417 (1): 5–22.
- Caudy AA, Reddy ST, Chatila T, et al. CD25 deficiency causes an immune dysregulation, polyendocrinopathy, enteropathy, X-linked-like syndrome, and defective IL-10 expression from CD4 lymphocytes. J Allergy Clin Immunol 2007 Feb; 119 (2): 482–487.
- Flanagan SE, Haapaniemi E, Russell MA, et al. Activating germline mutations in STAT3 cause early-onset multi-organ autoimmune disease. Nat Genet 2014 Aug; 46 (8): 812–814.
- Carmody D, Bell CD, Hwang JL, et al. Sulfonylurea treatment before genetic testing in neonatal diabetes: Pros and Cons. J Clin Endocrinol Metab 2014 Dec; 99 (12): E2709–E2714.
- Cooper EC, Pan Z, Grinton BE, et al. Putting an end to DEND: a severe neonatal-onset epilepsy is treatable if recognized early. Neurology 2007 Sep; 69 (13): 1310–1311.
- Burroughs LM, Torgerson TR, Storb R, et al. Stable hematopoietic cell engraftment after low-intensity nonmyeloablative conditioning in patients with immune dysregulation, polyendocrinopathy, enteropathy, X-linked syndrome. J Allergy Clin Immunol 2010 Nov; 126 (5): 1000–1005.
- Horino S, Sasahara Y, Sato M, et al. Selective expansion of donor-derived regulatory T cells after allogeneic bone marrow transplantation in a patient with IPEX syndrome. Pediatr Transplant 2014 Feb; 18 (1): E25–E30.
- Murguia-Favela L, Hong-Diep Kim V, Upton J, et al. IPEX syndrome caused by a novel mutation in FOXP3 gene can be cured by bone marrow transplantation from an unrelated donor after myeloablative conditioning. LymphoSign J 2015 Mar; 2 (1): 31–38.
- Vaxillaire M, Bonnefond A, Froguel P. The lessons of early-onset monogenic diabetes for the understanding of diabetes pathogenesis. Best Pract Res Clin Endocrinol Metab 2012 Apr; 26 (2): 171–187.
- Vaxillaire M, Populaire C, Busiah K, et al. Kir6.2 mutations are a common cause of permanent neonatal diabetes in a large cohort of French patients. Diabetes 2004 Oct; 53 (10): 2719–2722.
- Straková V, Dušátková P, Elblová L, Průhová Š. Monogenní formy autoimunního diabetu jako součást dysregulace imunitního systému. Čes-slov Pediat 2018; 73 (2): 104–109.
Štítky
Neonatológia Pediatria Praktické lekárstvo pre deti a dorast
Článok vyšiel v časopiseČesko-slovenská pediatrie
Najčítanejšie tento týždeň
2019 Číslo 1- Facilitovaná subkutánna imunoglobulínová terapia u seniorov s imunodeficienciami v reálnej praxi
- fSCIG v reálnej klinickej praxi u pacientov s hematologickými malignitami
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Gastroezofageální reflux a gastroezofageální refluxní onemocnění u kojenců a batolat
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Etiologie a léčba novorozeneckého diabetu
- Monogenně podmíněný diabetes MODY v dětském věku: retrospektivní studie pacientů diagnostikovaných na Dětské klinice FN Plzeň v letech 2000–2017
- Depresívne a úzkostné symptómy vo vzťahu k spánku u detí a adolescentov s diabetes mellitus 1. typu
- Editorial: Česko-slovenská pediatrie v roce 2019
- Rizikové faktory ovlivňující výsledek léčby novorozenců s hypoxicko-ischemickou encefalopatií léčených řízenou hypotermií
- Editorial: Dětský diabetes na prahu nové éry
- Možnosti antibiotické léčby akutní sinusitidy
- Poděkování spolupracovníkům za rok 2018
- 20. dny dětské endokrinologie Ostrov u Tisé, Ústecký kraj 25.–26. 1. 2019
- Moderní technologie v terapii diabetu 1. typu v dětském věku
- Česko-slovenská pediatrie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Možnosti antibiotické léčby akutní sinusitidy
- Etiologie a léčba novorozeneckého diabetu
- Moderní technologie v terapii diabetu 1. typu v dětském věku
- Rizikové faktory ovlivňující výsledek léčby novorozenců s hypoxicko-ischemickou encefalopatií léčených řízenou hypotermií
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



