-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Nocardia farcinica jako původce abscesu mozku u pacienta s intersticiálním onemocněním plic
Nocardia farcinica as the Causative Agent of a Brain Abscess in a Patient with Interstitial Lung Disease
This case report describes a two-step protocol for the identification of the causative agent of nocardiosis in a patient with brain abscess, antibiotic susceptibility testing and etiological treatment after neurosurgery. The patient treated with corticosteroids for pulmonary fibrosis and presenting with multiple neurological manifestations was admitted to a neurosurgery clinic. CT and contrast MRI revealed an expansive multilocular lesion 45 x 35 mm in size in the left parietal lobe, differentially diagnosed as malignant glioma. The lesion was biopsied and the histology showed a brain abscess containing white blood cells and dead tissue. The aspirated pus culture yielded bacteria of the genus Nocardia that were further identified, in the first step, by phenotypic methods (Gram positivity, partial acidoresistance, airborne mycelium detection, growth at 45 °C, lysozyme resistance and antibiotic resistance phenotype) as belonging to resistance phenotype V., v.s. N. farcinica (resistance to aminoglycosides except amikacin and to third-generation cephalosporins). In the second step of the polyphasic identification, rDNA was isolated and a 1000 bp part of the 16S rRNA gene was sequenced. Sequence comparison with the GenBank database using BLAST software identified the agent as N. farcinica (100%). The isolate was tested for susceptibility by the NCCLS /CLSI dilution method and showed good susceptibility to co-trimoxazole, amikacin and imipenem. The patient was treated with long-term intravenous cotrimoxazole acid in combination with amikacin and his clinical condition and laboratory parameters of inflammation improved. N. farcinica is among the three most frequently isolated Nocardia species in Europe as well as in the Czech Republic where it was repeatedly recovered from the lungs and respiratory tract of immunocompromised patients with systemic nocardiosis.
Key words:
Nocardia farcinica – brain abscess – polyphasic identification – 16S rRNA – resistance phenotype.
Autoři: J. Scharfen jr. 1,2; M. Morávková 2; M. Bunček 3; V. Hobza 4; S. Plíšek 5; P. Urbášková 6; I. Sedláček 7; H. Žemličková 6,8; H. Stárková 1; P. Paterová 2
Působiště autorů: Národní referenční laboratoř pro patogenní aktinomycety, Oddělení lékařské mikrobiologie a imunologie, Oblastní nemocnice Trutnov, a. s. 1; Ústav klinické mikrobiologie LF UK v Hradci Králové a FN, Hradec Králové 2; Generi Biotech, a. s., Hradec Králové 3; Neurochirugická klinika LF UK v Hradci Králové a FN, Hradec Králové 4; Infekční klinika LF UK v Hradci Králové a FN, Hradec Králové 5; Národní referenční laboratoř pro antibiotika, Státní zdravotní ústav v Praze 6; Česká sbírka mikroorganismů Přírodovědecké fakulty Masarykovy University v Brně 7; Národní sbírka typových kultur, Státní zdravotní ústav Praha 8
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 59, 2010, č. 1, s. 13-20
Souhrn
Cílem sdělení jsou možnosti dvoustupňové polyfázové identifikace původce nokardiózy u pacienta s abscesem mozku, vyšetření citlivosti na antibiotika a etiologická léčba pacienta po neurochirurgickém zákroku. Pacient léčený kortikoidy pro fibrózu plic byl přijat na neurochirurgickou kliniku s pestrými neurologickými projevy. Při CT vyšetření a při kontrastním zobrazení pomocí magnetické rezonance (MRI) byl zjištěn multilokulární expanzní proces velikosti 4,5 x 3,5 cm v parietálním laloku vlevo, diferenciálně diagnosticky označen jako maligní gliom. Byla provedena punkce ložiska. Histologicky byl diagnostikován absces mozku obsahující leukocyty a nekrotické hmoty. Z hnisu získaného punkcí byly vykultivovány bakterie rodu Nocardia, které byly fenotypovými metodami (grampozitivita, částečná acidorezistence, průkaz vzdušného mycelia, růst při 45 °C, rezistence na lysozym a fenotyp rezistence na antibiotika) v prvním stupni fenotypové diagnostiky zařazeny do fenotypu rezistence V., v.s. N. farcinica (rezistence na aminoglykosidy kromě amikacinu a rezistence na cefalosporiny III. generace). Ve druhém stupni polyfázové diagnostiky byla izolována rDNA a byla provedena sekvenace genu pro 16S rRNA ve velikosti 1000 bp. Získaná sekvence byla určena v databázi GenBank pomocí softwaru BLAST jako N. farcinica (100%). Citlivost kmene byla vyšetřena diluční metodou podle standardu NCCLS /CLSI. Kmen byl dobře citlivý na kotrimoxazol, amikacin a imipenem. Pacient byl dlouhodobě intravenózně léčen kombinací kotrimoxazolu s amikacinem s pokračující úpravou klinického stavu a hodnot zánětlivých parametrů. N.farcinica patří mezi tři nejčastěji izolované nokardie v Evropě i v ČR. Byla opakovaně izolována v České republice zejména z plic a dýchacích cest u případů systémové nokardiózy obvykle u pacientů s imunodeficiencí.
Klíčová slova:
Nocardia farcinica – absces mozku – polyfázová identifikace – 16S rRNA – fenotyp rezistence.Nokardie jsou ubikvitérní organismy, které se vyskytují v životním prostředí, zejména v půdě, sladké i slané vodě [4, 5, 6]. Jsou vyvolavateli onemocnění široké škály organismů, od rostlin, měkkýšů a ryb po savce včetně člověka [16]. Nokardióza je onemocnění postihující většinou imunokompromitované, ale i imunokompetentní osoby. V posledních deseti letech bylo v rodu Nocardia popsáno několik desítek nových species, často na základě molekulárně genetických vyšetření většinou bez potřebných fenotypových údajů [6]. Fenotypové komplexy druhů jsou často velmi heterogenní a ukrývají mnohé doposud nepopsané species. Proto se při druhové identifikaci nokardií nelze obejít bez dvoustupňové diagnostiky, kde hraje rozhodující úlohu polyfázová identifikace založená na komplexní interpretaci výsledků fenotypové i genotypové analýzy. Přesná identifikace je nutná pro cílenou léčbu založenou na druhově specifických fenotypech rezistence. V Evropě a podobně i ve světě jsou nejčastějšími izolovanými druhy nokardií Nocardia farcinica, N. cyriacigeorgici a N.nova [16, 26]. V České republice je podle statistik referenční laboratoře nejčastějším izolátem N. nova [20, 21]. N. farcinica je však považována za nejčastějšího a patrně nejvirulentnějšího vyvolavatele systémových infekcí [5,23, 25]. Systémová nokardióza obvykle začíná v plicích jako abscedující pneumonie, která se metastaticky šíří zejména do CNS, někdy diseminuje do celého organismu [2, 7, 8, 9, 12, 13, 14, 15, 19, 22, 24, 27 ]. V některých případech nelze původní ložisko v plicích nalézt. Jsou známy případy kolonizace dolních dýchacích cest nokardiemi bez klinických příznaků onemocnění, obvykle však existuje funkční nebo imunitní predispozice takových pacientů k infekci mykobakteriemi nebo nokardiemi. V předkládaném sdělení byla N. farcinica identifikována jako původce abscesu mozku, kde diferenciálně diagnosticky připadal v úvahu i nádorový proces [10].
Materiál a metoda
Bakteriologie. Hnis z abscesu mozku byl vyšetřen standardním postupem mikroskopicky po obarvení podle Grama a podle Ziehla - Neelsena a kultivačně včetně vyšetření citlivosti na antibiotika diskovou difusní metodou na ÚKM FN v Hradci Králové. Materiál byl kultivován na standardní sestavě tuhých a tekutých půd při 37 oC aerobně a v CO2 , a to na krevním agaru Columbia, MacConkeyho půdě, čokoládovém agaru a pomnožení v játrovém bujonu a anaerobně na Brain Heart Infusion agaru při 36 +/ - 1 C. Kmen vyrostl aerobně i anaerobně až po prodloužené inkubaci 4 dnů. Drobné vrůstající kolonie obsahovaly grampozitivní až gramlabilní pleomorfní mikroorganismy typu nokardií. Izolát v čisté kultuře byl zaslán na identifikaci do NRL pro patogenní aktinomycety v Trutnově. Zde byly potvrzeny předchozí výsledky (aerobní růst, grampozitivní fragmentující větvící se vlákna, částečná acidorezistence obarvením za studena podle Kinyouna), epimikroskopicky byla vyšetřena tvorba mycelia (včetně vzdušného), rezistence na lysozym diskovou metodou podle Boirona [1] a fenotyp rezistence na antibiotika diskovou metodou pomocí antibiotických disků fy Biorad na Mueller - Hintonové agaru (MH) fy Biomerieux [6, 20, 21, 25]. Zákal v koncentraci 1 j McFarlanda byl připraven resuspendováním materiálu setřeného z kolonií vatovým tamponem ve sterilním fyziologickém roztoku [20, 24]. Zóny inhibice byly změřeny elektronickým posuvným měřítkem a vyhodnoceny podle breakpointů dostupných v literatuře [25]. Měření se provádělo po 24, 48 a 72 hodinách. Podle orientační fenotypové identifikace byl izolát zařazen mezi nokardie, fenotyp rezistence V, v.s. N. farcinica [25].
Vyšetření citlivosti izolátu standardní diluční metodou podle NCCLS/CLSI. Izolát byl zaslán do NRL pro antibiotika ve Státním zdravotním ústavu v Praze a byl vyšetřen diluční metodou podle standardní metody CLSI [3, 11, 18, 21, 24]. Ve stručnosti: Zákal k inokulaci mikrotitračních destiček s antibiotiky byl připraven resuspendováním stěru získaného pomocí sterilního tamponu z několika kolonií na pevné půdě do fyziologického roztoku, síla zákalu byla upravena na 1 j podle stupnice McFarlanda. Inhibice růstu v jamkách byla hodnocena podle breakpointů uvedených ve standardní metodě CLSI. Poměrně rychlý růst již adaptovaného kmene umožnil vyhodnocení po 24 hodinách růstu.
Druhý stupeň identifikace nokardií pomocí molekulárně genetických metod. Ve druhém stupni identifikace byla z jedné kolonie na agarové půdě izolována DNA modifikovanou metodou CTAB [Harmsen, D., osobní sdělení]. Jedna bakteriální kolonie byla resuspendována v TE pufru a 30 min.inkubována při 80 °C. Bylo přidáno 50 μg lysozymu a směs byla inkubována při 37 °C přes noc. Potom byla směs opakovaně zmražena a rozmražena a byla přidána proteináza K/ SDS a inkubována 2 h při 65 °C. Po centrifugaci při 11000 rpm byla izolována DNA ze supernatantu chloroformovou extrakcí a etanolovou precipitací.
PCR amplifikace genu pro 16S rDNA a sekvencování. 16S rDNA gen byl amplifikován s použitím univerzálního eubakteriálního primeru 5’-CAG-GAA-ACA-GCT-ATG-ACG-TAC-ACC-AGC-CAC-AAG-GGA-ACC-3’. Byla použita „hot start“ technika pomocí TrueStart Taq polymerázy, Fermentas, Litva. Konečná koncentrace MgCl2 byla 2,5 mM ve všech reakcích, izolovaná DNA byla přidána v konečné koncentraci 10 ng/μl, celkový objem PCR byl 50 μl. Byly použity následující cyklovací podmínky: 3 min / 95 °C; 35 x 45 sec/ 95 °C, 60 sec/ 55 °C, 60 sec/ 72 °C s provedením na Bio-Rad MyCycleru. Produkty PCR byly zkontrolovány gelovou elektroforézou a produkt PCR byl přečištěn pomocí směsi ExoSAP. Stručně, 10 μl produktu PCR bylo smícháno se 4 μl směsi ExoSAP-IT, USB, USA a byly inkubovány při 37 °C po 30 min a denaturovány při 80 °C po dobu 15 min. Přečištěné PCR produkty byly přímo použity v sekvenační reakci s použitím stejných primerů jako pro PCR a se sekvenačním kitem firmy ABI, USA DyeTerminator v 3.1, podle doporučení výrobce. Sekvenační reakce byly purifikovány pomocí DyeEx 2.0 Spin Kit, Qiagen, Germany a analyzovány na sekvenátoru ABI PRISM® 3100 - Avant-genetic Analyzer, Applied Biosystems, USA. Contigy byly sestaveny na VectorNTI, Invitrogen, USA a vyčištěné sekvence byly vyhodnoceny v databázi GenBank pomocí programu BLAST. Identifikace species byla považována za správnou při shodě sekvencí s databází na hladině 99-100 % a nabídka species v softwaru BLAST byla homogenní a v souladu s výsledky fenotypové identifikace [17].
Výsledky
Mikroskopické vyšetření hnisu neprokázalo kromě masivní polymorfonukleární infiltrace žádné bakterie. Po čtyřech dnech aerobní kultivace vyrostly na krevním agaru velmi drobné vrůstající kolonie bělavě oranžové barvy pokryté jemnou vrstvou vzdušného mycelia. Mikroskopicky po obarvení podle Grama byly prokázány grampozitivní kokovité, kokobacilární, tyčinkovité a větvící se silně fragmentující vláknité organismy. Po několika pasážích kmen rostl rychleji, takže po 24 hodinách vytvářel kolonie velikosti až 3 mm silně vrůstající svou bazí do agarové půdy. Kolonie připomínaly sázená vejce s koronou submerzního mycelia na obvodu kolonie, byly hladké v M fázi, případně kožovité až drobivé v R fázi, někdy vytvářející vzdušné mycelium. Barva kolonií byla krémově žlutá až oranžová. Předběžné vyšetření citlivosti diskovou metodou odhalilo rezistenci na cefalosporiny třetí generace, hraniční citlivost na kotrimoxazol a citlivost na amikacin a amoxicilin – klavulanát. Nález byl konzultován s NRL pro patogenní aktinomycety, podle morfologie a typické rezistenci bylo vysloveno podezření na N. farcinica.
Obr. 1 [a] kokovitá morfologie v barvení podle Grama; [b] fragmentovaná vlákna,tyčky, koky N.farcinica v barvení podle Grama; [c] částečná acidorezistence N.farcinica v barvení podle Kinyouna/; [d] úplná inhibice růstu N.farcinica v okolí disků s ceftriaxonem a cefotaximem; [e] hladké kolonie N.farcinica s koronou slabě viditelného bílého aeriálního mycelia na periferii, po 3 dnech kultivace na krevním agaru, skutečná velikost do 2 mm; [f]starší hladké lesklé nažloutlé kolonie N.farcinica s vyvýšeným středem, pětidenní pasáž na krevním agaru, skutečná velikost do 3 mm.; [g]vzdušné a substrátové mycelium N.farcinica při epimikroskopickém vyšetření na bločku vodovodního agaru (tap water agar). Vláknité mikrokolonie jsou zachyceny v různých rovinách ostrosti.; [h] mohutná korona submerzního substrátového mycelia N.farcinica kolem 14 dnů staré kolonie na MH agaru Figure 1. [a] coccoid morphology of nocardiae in the Gram stained smear of N.farcinica; [b] fragmented filaments, rods and cocci in Gram stained smear of N.farcinica; [c] partial acidoresistance of N.farcinica in modified Kinyoun stain; [d] complete growth inhibition of N.farcinica around ceftriaxon and cefotaxim discs.; [e] Smooth colonies of N.farcinica surrounded by faintly visible white aerial mycelium, after 3 day cultivation on blood agar plate (BAP), real size till 2 mm.; [f] older smooth glossy yellow-tan colonies of N.farcinica with raised central part, 5 day subculture on BAP, real size till 3 mm.; [g] aerial and substrate mycelium of N.farcinica on the tap water agar block in epimicroscopy. Filamentous microcolonies are captured in various planes of definition. ![Obr. 1 [a] kokovitá morfologie v barvení podle Grama; [b] fragmentovaná vlákna,tyčky, koky N.farcinica v barvení podle Grama; [c] částečná acidorezistence N.farcinica v barvení podle Kinyouna/; [d] úplná inhibice růstu N.farcinica v okolí disků s ceftriaxonem a cefotaximem; [e] hladké kolonie N.farcinica s koronou slabě viditelného bílého aeriálního mycelia na periferii, po 3 dnech kultivace na krevním agaru, skutečná velikost do 2 mm; [f]starší hladké lesklé nažloutlé kolonie N.farcinica s vyvýšeným středem, pětidenní pasáž na krevním agaru, skutečná velikost do 3 mm.; [g]vzdušné a substrátové mycelium N.farcinica při epimikroskopickém vyšetření na bločku vodovodního agaru (tap water agar). Vláknité mikrokolonie jsou zachyceny v různých rovinách ostrosti.; [h] mohutná korona submerzního substrátového mycelia N.farcinica kolem 14 dnů staré kolonie na MH agaru
Figure 1. [a] coccoid morphology of nocardiae in the Gram stained smear of N.farcinica; [b] fragmented filaments, rods and cocci in Gram stained smear of N.farcinica; [c] partial acidoresistance of N.farcinica in modified Kinyoun stain; [d] complete growth inhibition of N.farcinica around ceftriaxon and cefotaxim discs.; [e] Smooth colonies of N.farcinica surrounded by faintly visible white aerial mycelium, after 3 day cultivation on blood agar plate (BAP), real size till 2 mm.; [f] older smooth glossy yellow-tan colonies of N.farcinica with raised central part, 5 day subculture on BAP, real size till 3 mm.; [g] aerial and substrate mycelium of N.farcinica on the tap water agar block in epimicroscopy. Filamentous microcolonies are captured in various planes of definition.](https://pl-master.mdcdn.cz/media/image/9121c94af429949affcb6ec076d280aa.jpeg?version=1537790254)
V NRL pro patogenní aktinomycety byla dokončena orientační diagnostika do komplexu species. Bakterie byly grampozitivní, parciálně acidorezistentní při barvení za studena podle Kinyouna, kataláza pozitivní, rezistentní na lysozym v testu podle Boirona et al. [1]. Rostly dobře při 45 oC. Při epimikroskopickém vyšetření v procházejícím světle na bločku TAP agaru byla prokázána přítomnost bohatě rozvětveného substrátového a aeriálního mycelia. Při vyšetření fenotypu rezistence na antibiotika byl zjištěn fenotyp rezistence V typický pro N. farcinica (tabulka 1).
Tab. 1. Vyšetření fenotypu rezistence diskovou difuzní metodou Table 1. Assesment of antibiotic resistance pattern by disc diffusion method 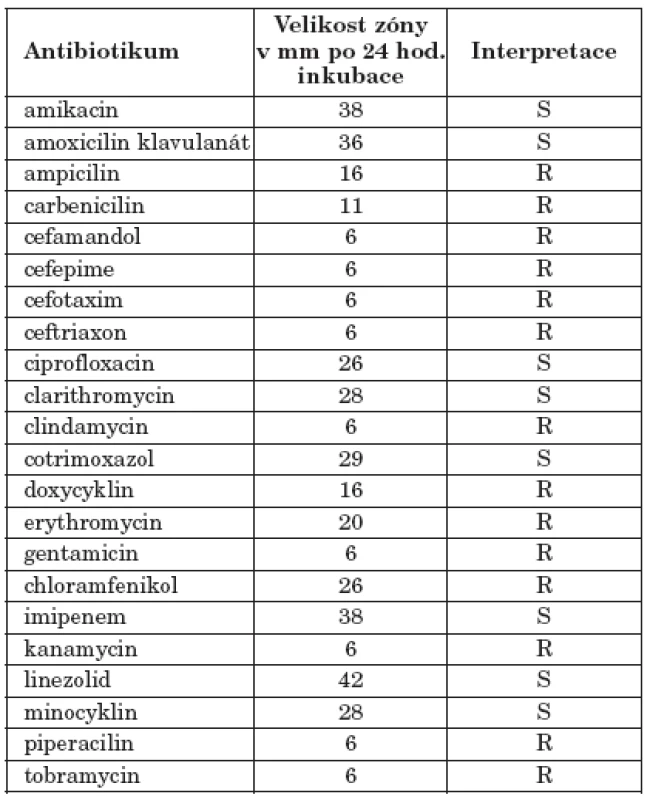
Vyhodnocením výsledku sekvenace 16S r RNA podle databáze GenBank byla na hladině pravděpodobnosti 100% identifikována N. farcinica, což bylo v souladu s výsledkem fenotypové orientační diagnostiky. Kmen byl zaslán k vyšetření citlivosti diluční metodou podle standardní metody NCCL/CLSI z roku 2006 (tabulka 2). Výsledky získané standardní diluční metodou byly v souladu s výsledky difuzního diskového testu použitého pro stanovení fenotypu rezistence (tabulka 1).
Tab. 2. Hodnoty vyšetření minimálních inhibičních koncentrací (MIC) Nocardia farcinica diluční mikrometodou Table 2. Values of minimal inhibitory concentration (MIC) of Nocardia farcinica by the dilution micromethod 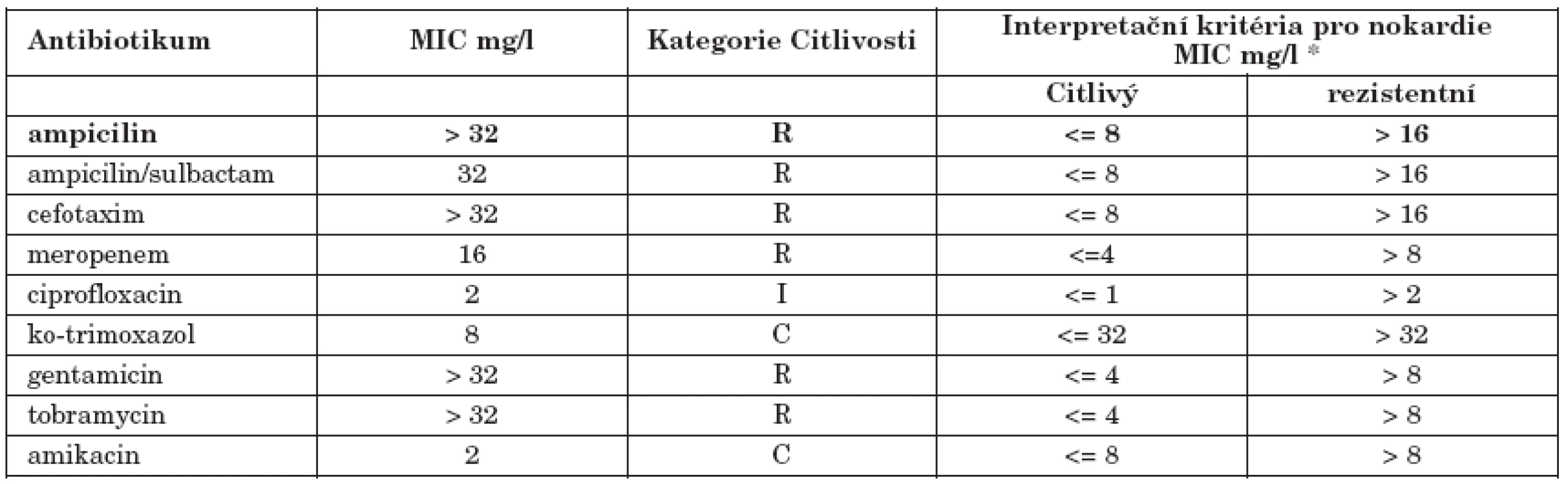
LEGEND: Cathegory C(S)-sensitive, R-resistant, I-intermediary Výsledky vyšetření citlivosti diluční metodou byly odečítány po 24, 48 a 72 hodinách. Kmen byl typicky rezistentní na cefalosporiny III. generace a na aminoglykosidy kromě amikacinu.
Tab. 3. Izoláty N. farcinica v ČR, podle původu klinického materiálu Table 3. Isolates of Nocardia farcinica in the Czech Republic, according to the source of clinical material 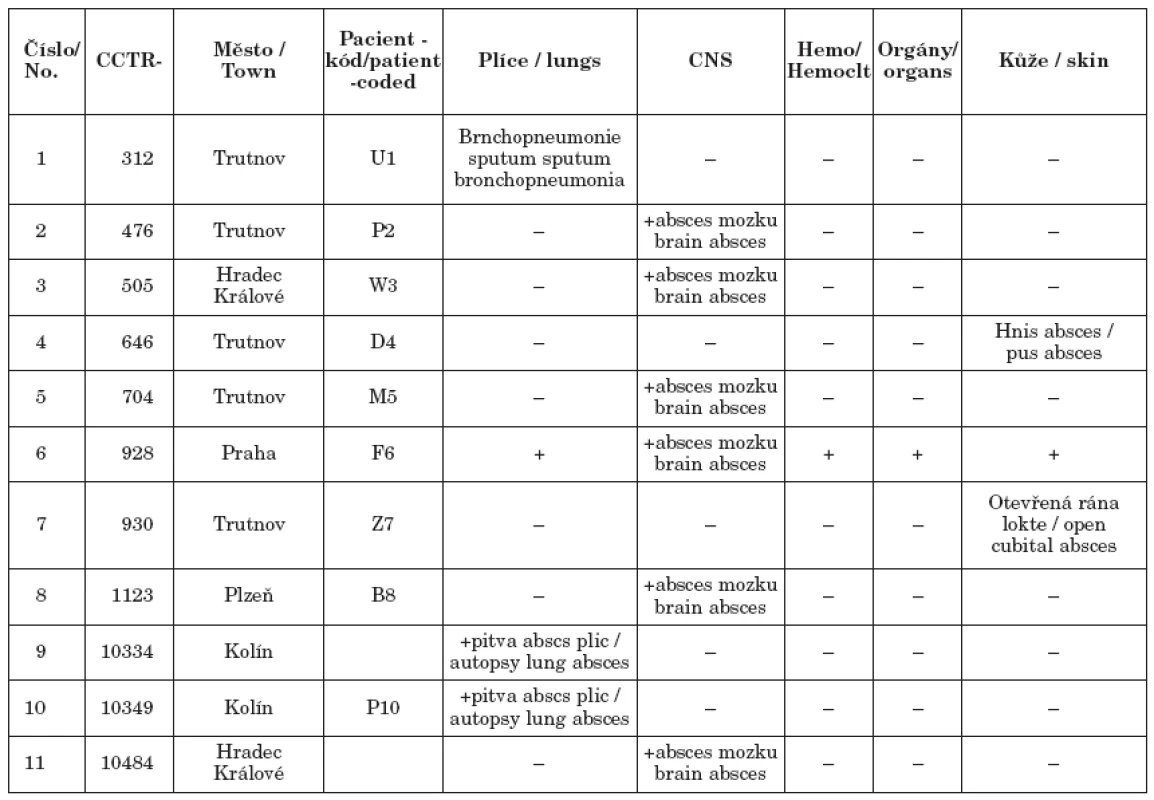
Klinický průběh onemocnění a léčba
Sedmdesátiletý muž v důchodu, předchozím povoláním učitel se dlouhodobě léčil na Plicní klinice Fakultní nemocnice v Hradci Králové pro astma a fibrózu plic provázenou kašlem, námahovou dušností, restriktivní ventilační poruchou bez omezení difuze a bez obstrukce. Používal domácí oxygenoterapii. Trpěl arteriální hypertenzií, hypercholesterolémií, varixy na dolních končetinách a mnohočetnou artrózou. Pacient nekouří, abusus návykových látek neuváděl. Užíval léky Furosemid, Prednison, Cardiolipin, Vagantol, Warfarin, Cotrimoxazol, Neurol, Kodein, Controloc.
Pro progresi plicního onemocnění byla zahájena v červnu 2008 terapie kortikoidy, která byla v srpnu 2008 komplikována pneumocystovou pneumonií a v říjnu 2008 pneumonií vyvolanou Klebsiella pneumoniae. V únoru 2009 byl pacient vyšetřen na neurologické klinice pro 1 měsíc trvající zhoršování paměti a občasné bolesti hlavy, měl apraxii tj. nedokázal ovládat běžné domácí přístroje. Dále se u něj rozvinula agrafie, alexie a paréza pravé horní končetiny. Po nasazení kortikoterapie na neurologické klinice došlo k úplné úpravě klinického stavu. Na CT vyšetření byla zjištěna multilokulární expanze velikosti 4,5 x 3,5 cm vysoko parietálně vlevo. Bylo vysloveno podezření na zhoubný nádor v.s.maligní glioblastom, diferenciálně diagnosticky byla předpokládána metastáza temenního laloku vlevo v lobus parietalis. Při nízkém CRP (CRP 0 j) a zvýšených leukocytech (leukocyty 10,03), byly zvýšené hodnoty antigenu CA-19-9 105,9.
Na neurochirurgické klinice Fakultní nemocnice v Hradci Králové (27.2-1.4.09) byla indikována navigovaná stereobiopsie racemózního multicystického klínovitého procesu parietální oblasti vlevo. Operace probíhala v lokální anestezii s anesteziologickým dohledem, protože z internistického hlediska existovala kontraindikace celkové anestézie kvůli základnímu plicnímu onemocnění, prognóza dožití byla odhadnuta na 1 rok.
6.3.09 byla provedena navigovaná punkční stereobiopsie ložiska s aspirací obsahu a biopsií stěny ložiska. V odebraném materiálu byly histologicky prokázány pouze nekrotické hmoty a hnisavý exsudát, bylo vysloveno podezření na absces. Hnis byl zaslán na mikrobiologické vyšetření na ÚKM FN v Hradci Králové. Zde byly mikroskopicky v odebraném materiálu prokázány masivně leukocyty, mikroorganismy nebyly prokázány. Po čtyřech dnech při prodloužené inkubační době vyrostly na krevním agaru drobné vrůstající kolonie. V nich byly prokázány gramlabilní pleomorfní tyčinky typu Nocardia. Ihned po zjištění růstu gramlabilních silně fragmentujících tyčinek byla původní terapie změněna na kombinaci amoxicilin – klavulanát plus amikacin. Izolát byl zaslán k identifikaci do Národní referenční laboratoře pro patogenní aktinomycety v Trutnově. Empiricky byl nasazen ceftriaxon 3 x 1g po dobu 7 dnů. Dne 18.3. byla na Neurochirurgické klinice opakována navigovaná otevřená biopsie stěny povrchního abscesu. Absces byl vyprázdněn punkcí a byla provedena laváž hlubšího ložiska. Pokračovala léčba amoxicilin – klavulanát 1,2 g i.v. v kombinaci s amikacinem 500 mg 3 krát denně. Na kontrolním CT s kontrastní látkou byla prokázána reziduální cystická ložiska s výrazným perifokálním edémem bez progrese. Výsledky laboratorního vyšetření byly FW 93/125, LEU 10,6, CRP 81(23.3.09), CRP 18 (26.3.09), CRP 5 (30.3.09), FW 92/125, LEU 19,2, , FW 105/124, LEU 14.6. Po vyšetření citlivosti izolátu na antibiotika pomocí standardní diluční metody byla potvrzena citlivost izolátu na kotrimoxazol a léčba byla změněna na kombinaci antibiotik kotrimoxazol a amikacin (kotrimoxazol i.v. 2 x 30 ml, tj. 6 ampulí po 480 mg ráno a večer, celková denní dávka 5760 mg) a amikacin (500 mg 2 krát denně i.m.) [23]. V současnosti pokračuje tato léčba s průběžnou kontrolou CNS pomocí zobrazovacích metod, plánuje se další neurochirurgický výkon. Celkový klinický stav pacienta je dobrý. Prognóza se v souladu s literárními údaji považuje za vážnou.
Diskuse
Nocardia farcinica patří mezi nejčastěji se vyskytující druhy nokardií vyvolávající systémovou nokardiózu (tabulka 3) [26]. V Evropě se v některých studiích řadí na první místo. V NRL pro patogenní aktinomycety bylo od roku 1975 identifikováno 11 kmenů Nocardia farcinica z klinického a pitevního materiálu od pacientů z České republiky. Nejzávažnější byl případ po transplantaci ledvin, kde došlo k diseminaci procesu do všech orgánů včetně kůže a pacient zemřel. Bylo zaznamenáno několik plicních infekcí. Jeden nález N.farcinica byl diagnostikován z pitevního nálezu z plicní tkáně v koinfekci s N.cyriacigeorgici a aspergilózou [25]. N.farcinica patří mezi multirezistentní druhy nokardií – fenotyp rezistence V s vyloučením všech beta – laktamových antibiotik včetně cefalosporinů III. generace. Je rovněž rezistentní na aminoglykosidy kromě amikacinu. Lékem volby je kotrimoxazol, může však na něj existovat druhově podmíněná nebo získaná rezistence. Proto kmen musí být řádně identifikován do druhu a musí být vyšetřena citlivost na antibiotika standardní diluční metodou podle NCCLS.
Důležitost přesné identifikace a vyšetření citlivosti je vidět i u zde popsaného případu. Empirická léčba mozkového abscesu ceftriaxonem je cílena na častější původce mozkových abscesů, jako jsou zejména anaerobní streptokoky odontogenního původu. Dala by se s úspěchem použít i u nokardiózy vyvolané druhem s odlišným fenotypem rezistence na antibiotika než je právě Nocardia farcinica. Ta je primárně rezistentní na cefalosporiny III. generace. Proto byla ihned po zjištění citlivosti diskovou difusní metodou léčba změněna na kombinaci amikacinu s amoxicilin – klavulanátem. Po chirurgické evakuaci ložiska a při zmíněné terapii došlo k významnému klinickému zlepšení. Lokální nález se však při celkově dobrém stavu pacienta nezlepšoval. Proto později, když byla potvrzena diluční metodou citlivost na kotrimoxazol, byla terapie změněna na kombinace kotrimoxazolu s amikacinem. Iatrogenní imunosuprese s použitím kortikoidů u funkčního onemocnění plic bývá predispozicí pro rozvoj nokardiózy. I když se většinou nokardióza rozvíjí u pacientů s imunodeficiencí nebo základním onemocněním, které snižuje celkovou obranyschopnost organismu, vzniká nokardióza i u imunokompetentních osob [7, 8, 9, 10, 12, 15, 22].Vzniku takového onemocnění pravděpodobně předchází bezpříznaková kolonizace dýchacích cest, kterou se nám opakovaně podařilo prokázat ve spolupráci s Oddělením klinické mikrobiologie Nemocnice v Příbrami.
Kmen Nocardia farcinica CCTR - 1406 byl uložen v České národní sbírce typových kultur ve Státním zdravotním ústavu v Praze pod označením CNCTC 7411 – Nocardia farcinica.
Zjištěná sekvence N. farcinica byla uložena v databázi GenBank pod přístupovým číslem GQ121036.
Poděkování
Autor děkuje Iloně Hofmanové za výbornou technickou spolupráci v laboratoři.
Část práce byla hrazena z grantu FP6 projektu “DIAGNOSIS - Development of new and cost effective methods and tools for diagnosis of human pathogens” Contract nr. LSHB-CT-2006-037212.
Použité zkratky
CCM: Česká sbírka mikroorganismů Přírodovědecké fakulty Masarykovy univerzity v Brně,
CCTR: sbírka mikroorganismů v Trutnově
CNCTC: Národní sbírka typových kultur ve Státním Zdravotním Ústavu v Praze
CNS: centrální nervový systém
CRP: C - reaktivní protein
CT: počítačová tomografie
FW: sedimentace erytrocytů
LEU: leukocyty
MH: agar podle Muellera a Hintonové
MRI: zobrazovací metoda pomocí magnetické rezonance
NCCLS/CLSI: Národní ústav pro klinické laboratorní standardy, USA
NRL: národní referenční laboratoř
rpm: otáčky za minutu
TAP agar: tap water – agar s vodovodní vodou
UIP: běžná intersticiální pneumonie
Do redakce došlo 13. 5. 2009
MUDr. J. Scharfen, jr.
Národní referenční laboratoř
odd. lékařské mikrobiolologie a imunologie
Oblastní nemocnice Trutnov a. s.
641 21 Trutnov
e-mail: scharfen@nemtru.cz
Zdroje
1. Boiron, P., Provost, F., Dupont, B. Laboratory methods for the diagnosis of nocardiosis. 1st Ed., Institut Pasteur, Paris, 1993.
2. Borchers, M., von der Mülbe, B., Teikemeier, F., Theegarten, D. Pulmonary nocardiasis with abscesses spreading to cerebrum, cerebellum and orbits. Article in German. Dtsch. Med. Wochenschr. 2006, 131,19,1085-8
3. Brown, B. A., Wallace, Jr., R. J. Broth microdilution MIC test for Nocardia spp., 5.12.1–5.12.9. In H. D. Isenberg (ed.), Clinical microbiology procedures handbook. American Society for Microbiology, Washington,D.C.1992.
4. Brown, J.M., McNeil,M.M. Nocardia, Rhodococcus, Gordonia, Actinomadura, Streptomyces, and other aerobic actinomycetes, pp. 370–398. In P. R. Murray, E. J. Baron, J. H. Jorgensen, M. A. Pfaller, R. H. Yolken (ed.), Manual of clinical microbiology, 8th ed. ASM Press, Washington,D.C, 2003.
5. Brown-Elliott, B.A., Brown, J.M., Conville, P.S., Wallace, R.J. jr. Clinical and laboratory features of the Nocardia spp., based on current molecular taxonomy. Clin. Microbiol. Rev. 2006; 19, 2, 259-282.
6. Conville, P.S, Witebsky, F.G. Nocardia, Rhodococcus, Gordonia, Actinomadura, Streptomyces, and Other Aerobic Actinomycetes, pp. 515–541. In P. R. Murray, E. J. Baron, J. H. Jorgensen, M.L.Landry, M. A. Pfaller (ed.), Manual of clinical microbiology, 9th ed. ASM Press, Washington, 2007
7. Djennane, S., Zecknini, K., Billy, C., Kamga, I., Perronne, V., Granier, F. Nocardia farcinica brain abscess associated with a pulmonary embolism in an immunocompetent patient. Presse Med. 2005, 34, 7, 522-4.
8. Fellows, G.A., Kalsi, P.S., Martin, A.J. Nocardia farcinica brain abscess in a patient without immunocompromised. Br. J. Neurosurg. 2007, 3, 301-3
9. Hope, W., Looke, D. Sequential infection with Nocardia farcinica and Cryptococcus neoformans var. gattii in an immunocompetent host. J. Infect. 2003, 47, 256-9.
10. Iannotti, C.A., Hall, G.S., Procop, G.W., Tuohy, M.J., Staugaitis, S.M., Weil, R.J. Solitary Nocardia farcinica brain abscess in an immunocompetent adult mimicking metastatic brain tumor: rapid diagnosis by pyrosequencing and successful treatment. Surg. Neurol. 2008, May 29. [Epub ahead of print]
11. Jorgensen, J.H., Turnidge, J.D. Susceptibility test methods: Dilution and disc diffusion methods pp.1113-1115.. In Murray PR, et.al (eds). Manual of Clinical Microbiology, 8th ed. ASM, Washington 2003;
12. Kandasamy, J., Kabal, H.J., Cooke, R.P., Eldridge, P.R. Primary Nocardia farcinica brain abscess with secondary meningitis and ventriculitis in an immunocompetent patient, successfully treated with moxifloxacin. Acta Neurochir. (Wien). 2008; 150, 5, 505-6.
13. Kilincer, C., Hamamcioglu, M.K., Simek, O., Hicdonmez, T., Aydoslu, B., Tansel, O., Tiryaki, M., Soy, M., Tatman-Otkun, M., Cobanoglu, S. Nocardial brain abscess: review of clinical management. J. Clin. Neurosci. 2006, 13,4, 481-5.
14. Kostur, M., Storey, D. Nocardia farcinica osteomyelitis of the frontal bone five years after Nocardia brain abscess in an immunocompetent patient. J. Miss. State Med. Assoc. 2002 43,4,111.
15. Malincarne, L., Martini, M., Farina, C., Camanni, G., Valente, M., Belfiori, B., Fiorucci, S., Floridi, P., Cardaccia, A., Stagni, G. Primary brain abscess with Nocardia farcinica in an immunocompetent patient Clin. Neurol. Neurosurg. 2002,104,2,132-5.
16. McNeil, M. M., Brown, J. The medically important aerobic actinomycetes: epidemiology and microbiology. Clin. Microbiol. Rev. 1994, 7 357–417.
17. Mellmann, A., Cloud, J.L., Andrees, S. et al. Evaluation of RIDOM, MicroSeq an GenBank services in the molecular identification of Nocardia species. Int. J. Med. Microbiol. 2003; 293, 359-370.
18. NCCLS. Susceptibility testing of mycobacteria, nocardiae, and other aerobic actinomycetes. Approved standard. NCCLS document M24-A. NCCLS, Wayne, Pa, 2003.
19. Sabuncuo’lu, H., Cibali Aćikgo, Z.Z., Caydere, M., Ustün, H., Semih Keskil, I. Nocardia farcinica brain abscess: a case report and review of the literature. Neurocirugia (Astur). 2004, 6, 600-3
20. Scharfen, J. jr. Doporučená metoda k předběžné identifikaci nokardií podle fenotypu rezistence (Recommended method for preliminary identification of Nocardia spp. according to antimicrobial susceptibility pattern), Zprávy CEM ,SZÚ Praha, 2007; 3,16
21. Scharfen, J. jr. Nokardióza. Doporučená metoda mikrobiologické diagnostiky nokardiózy s přehledem léčby nokardiózy a návrhem standardního operačního postupu. NUCLEUS Hradec Králové, 2008. ISBN 978-80-87009-43-7
22. Singh, N.P., Goral, R., Manchanda, V., Gusta, P. Disseminated nocardiosis in an immunocompetent child. Ann. Trop. Paediatr. 2003,23,1,75-8
23. Sorrell, T.C. et al: Nocardia species, pp.2916-2924 In Mandell, Douglas and Bennettęs Principles and Practice of Infectious Diseases, 6th ed, Elsevier, 2005
24. Urbášková P. Rezistence bakterií k antibiotikům. Vybrané metody. Trios 1998.
25. van Dam, A.P., Pruijm, M.T., Harinck, B.I., Gelinck, L.B., Kuijper, E.J. Pneumonia involving Aspergillus and Rhizopus spp. after a near-drowning incident with subsequent Nocardia cyriacigeorgici and N. farcinica coinfection as a late complication. Eur. J. Clin. Microbiol. Infect. Dis. 2005, 24, 1,61-4
26. Wallace, R.J. jr., Tsukamura, M., Brown, A.B., et al. Cefotaxime-resistant Nocardia asteroides strains are isolates of the controversial species Nocardia farcinica. J. Clin. Microbiol. 1990, 28,12,2726-2732.
27. Wauters, G., Avesani, V., Charlier, J. et al.: Distribution of Nocardia species in clinical samples and their routine rapid identification in the laboratory. J. Clin. Microbiol. 2005, 43, 6, 2624 -2628.
Štítky
Hygiena a epidemiológia Infekčné lekárstvo Mikrobiológia
Článok vyšiel v časopiseEpidemiologie, mikrobiologie, imunologie
Najčítanejšie tento týždeň
2010 Číslo 1- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Očkování proti virové hemoragické horečce Ebola experimentální vakcínou rVSVDG-ZEBOV-GP
- Koronavirus hýbe světem: Víte jak se chránit a jak postupovat v případě podezření?
-
Všetky články tohto čísla
- Nocardia farcinica jako původce abscesu mozku u pacienta s intersticiálním onemocněním plic
- Molekulární epidemiologie viru Varicella zoster
- Stálý nárůst incidence pertuse v České republice od 90. let
- Změna bakteriálního spektra na ranných plochách u těžce popálených pacientů
- Výskyt tularémie na Slovensku v rokoch 1997 – 2008
- Geografie pandemie HIV/AIDS: rozbor vybraných dostupných článků a studií
- MLST streptokoků skupiny B u novorozenců v České republice v letech 2004 – 2008
- Prevalence hantavirových protilátek v sérech hemodialyzovaných chronických pacientů v České republice
- Životní jubileum prof. MUDr. Vladimíra Janouta, CSc.
- Exotickí domáci miláčikovia ako potenciálny zdroj salmonel
- Epidemiologie, mikrobiologie, imunologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Životní jubileum prof. MUDr. Vladimíra Janouta, CSc.
- Nocardia farcinica jako původce abscesu mozku u pacienta s intersticiálním onemocněním plic
- Výskyt tularémie na Slovensku v rokoch 1997 – 2008
- Exotickí domáci miláčikovia ako potenciálny zdroj salmonel
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy










