-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Rizikové faktory trombózy
Risk factors for venous thrombosis
Pathogenesis of thrombosis is based on multiple factors. In past years many interacting factors were described, both inherited and environmental. Surveying these should be indicated only in cases where knowledge of the defect can influence patient’s treatment or prophylaxis. We should examine only factors in which there is a proven relation to clinical picture. We should always take family and personal history into account while interpreting the results.
Keywords:
thrombophilia – venous thromboembolism – laboratory examination
Autori: M. Matýšková; M. Šlechtová
Pôsobisko autorov: Oddělení klinické hematologie FN Brno
Vyšlo v časopise: Geriatrie a Gerontologie 2013, 2, č. 4: 201-205
Kategória: Přehledové články
Súhrn
Patogeneze trombózy je mul-tifaktoriální. V posledních letech byla vedle obecných rizikových faktorů popsána řada vrozených a dalších získaných faktorů, které riziko trombózy zvyšují. Vyšetřování faktorů, které zvyšují riziko trombózy, by mělo být cílené pouze na případy, kdy znalost defektu může ovlivnit postup léčby či profylaxe u daného jedince. Stanovovány by navíc měly být pouze faktory, u kterých je jednoznačně prokázána souvislost s klinikou. Při interpretaci nálezů je nutné zohlednit rodinnou a osobní anamnézu vyšetřeného.
Klíčová slova:
trombofilie – žilní tromboembolismus – laboratorní vyšetřeníÚvod
Žilní tromboembolismus (VTE) je třetí nejčastější onemocnění cévního systému a nejčastější příčina smrti(0,5 milionů/rok v EU). Pojem VTE pokrývá široké spektrum od asymptomatických trombóz lýtkových po klinicky významné hluboké žilní trombózy (DVT) včetně plicní embolie.
Incidence VTE je udávána asi 0,7–1,2/1000 obyvatel/rok, z toho asi třetina je plicní embolie (EP) s nebo bez diagnostikované žilní trombózy (VT). Incidence VTE stoupá exponenciálně s věkem až asi na 5–6 případů/1000 obyvatel/rok u 80letých. Bez ohledu na antikoagulační léčbu VTE často v prvních měsících po příhodě recidivuje (asi 7 % v prvních 6 měsících). Asi v 6 % DVT a 10–12 % EP dochází v průběhu prvního měsíce po diagnóze k úmrtí. Úmrtnost na EP se zvyšuje až na 30 % ve studiích, které zahrnují autopsii(1,2). Incidence trombózy také závisí na rase, kde je také rozdílný výskyt především vrozených rizikových faktorů(2).
Riziko recidivy trombózy je asi o 60 % vyšší u mužů než u žen; riziko je vyšší 6–12 měsíců po ukončení OA bez ohledu na trvání léčby(3).
Trombóza jako symptom může komplikovat celou řadu chorob. Na rozdíl od vrozených krvácivých stavů není nikdy vyvolána pouze jedním faktorem, tj. ani vrozeným defektem. Je vždy komplexní multifaktoriální geneze. Stále platí 150 let stará Virchowova triáda, že příčinou trombózy mohou být změny cévní stěny, krevního toku a látek v krvi přítomných. Dosud veškeré nalezené odchylky či stavy, které mohou vést k trombóze, můžeme do těchto tří skupin zařadit(4).
Rizikové faktory VTE
Trombofilie je definována jako vrozený nebo získaný defekt hemostázy, který je s největší pravděpodobností příčinou zvýšeného sklonu k trombóze(5, 6, 7). Klinická definice trombofilie je uvedena v tabulce 1.
Tab. 1. Klinická definice trombofilie 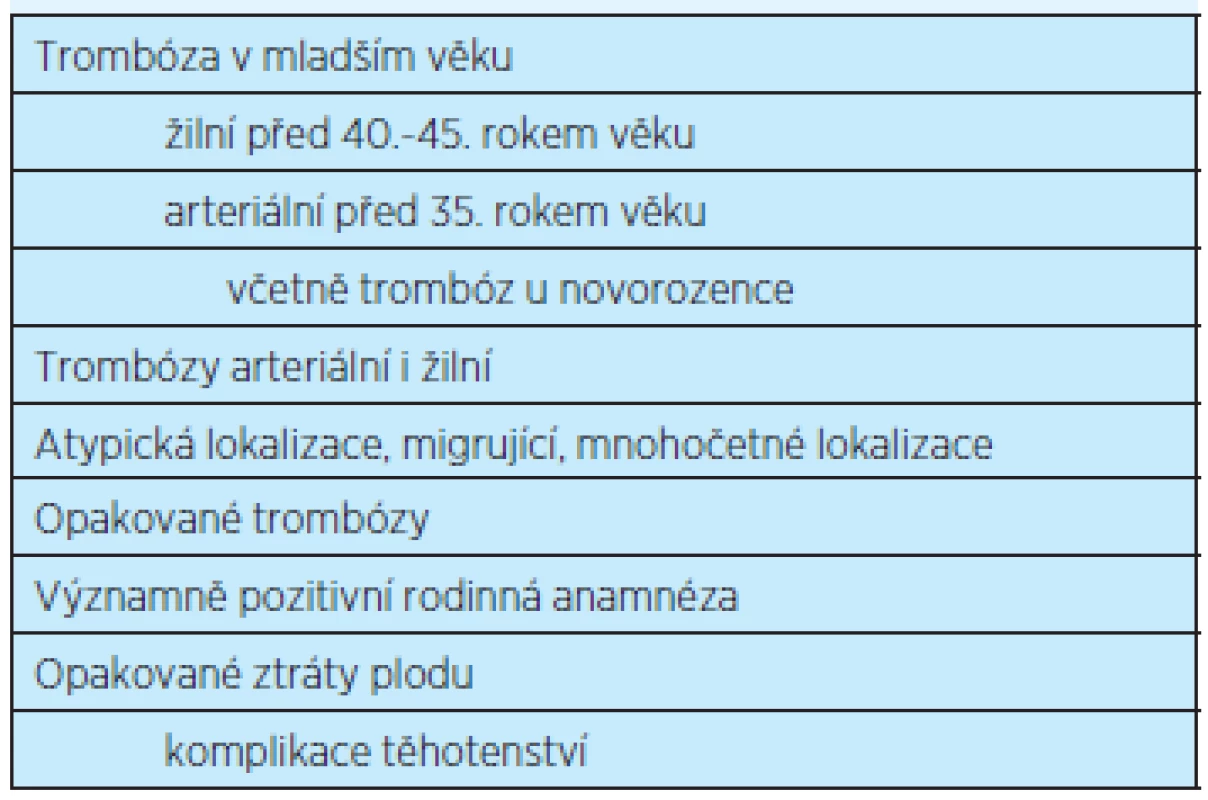
Jako genetické rizikové faktory především žilní trombózy (VT) jsou uznávány, vedle velmi vzácné dysfibrinogenemie, defekt antitrombinu (AT), proteinu C či S (PC, PS), mutace faktoru V Leiden (FVL) a protrombinu (PT) G20210A(8). Většina z nich je autozomálně dominantně dědičná. Přestože asociace těchto defektů s VT je jasně prokázána, setkáváme se u jednotlivých defektů s velkou heterogenitou projevů. Nejčastěji u naší zdravé populace nalézáme FVL, prevalence je cca 7 %(9), která se fenotypicky projevuje jako rezistence na aktivovaný protein C (APCR). Klinicky se defekt projevuje většinou distální žilní trombózou (hlavně hlubokou, ale je popsána i povrchová). Riziko trombózy se u heterozygotní formy zvyšuje cca 7x, u homozygotní cca 50x. FVL není rizikový faktor pro EP(10), ani pro recidivu trombózy(11). U nositelek tohoto polymorfismu riziko TEN stoupá v graviditě a šestinedělí(12,13). U PT 20210A se zvyšuje i výskyt EP. I defekty přirozených inhibitorů (AT, PC, PS) jsou primárně sdruženy s žilními trombózami (včetně atypické lokalizace) a zvyšují i riziko EP. Klinická manifestace a její tíže vždy závisí na typu defektu. U žen se často projeví v těhotenství, šestinedělí či při užívání hormonální kontracepce (HAK) či substituce (HRT)(14). U některých typů jsou popsány ojediněle i arteriální trombózy.
Vzácné jsou vrozené dysfibrinogenemie, které mohou být doprovázeny jak krvácením, tak i trombózami. Prevalence vrozené dysfibrinogenemie u osob s TEN v anamnéze se odhaduje na 0,8 %, prevalence trombózy mezi pacienty s dysfibrinogenemie je neznáma, odhaduje se na 10–20 %(15).
Přes významný nárůst prací, které popisují nálezy dalších, zejména vrozených polymorfismů, jež by mohly být zařazeny mezi rizikové, není dosud prokázán jejich jednoznačný význam a nedoporučuje se je běžně vyšetřovat.
Mezi rizikové faktory smíšené etiologie (tj. kombinace vrozené dispozice a získaných faktorů) jsou řazeny zvýšené hladiny koagulačních faktorů, především FVIII, fibrinogenu a hyperhomocysteinemie.
Zvýšená hladina FVIII je nezávislý rizikový faktor trombózy i retrombózy, relativní riziko (RR) VT 3x vyšší (FVIII >150 % x <150 %) a 6x vyšší (FVIII >150 % x <100 %), navíc riziko stoupá o 10 % s vzestupem FVIII o 10 %. Hladina není závislá na reakci akutní fáze, je prokázáno minimální kolísání hladiny FVIII a rodinná závislost. Genetický defekt však dosud nebyl nenalezen. FVIII zvyšuje i riziko recidivy TEN po první trombotické příhodě(16, 17,18).
Zvýšená hladina fibrinogenu je také diskutována jako rizikový faktor jak arteriálních, tak žilních trombóz(19).
Homocystein (Hc) je metabolit methioninu, k jeho přeměně jsou jako kofaktory nezbytné vitaminy skupiny B. Normální koncentrace Hc v plazmě je mezi 5–15 µmol/l. Příčin vrozené či získané hyperhomocysteinemie (HHc) je celá řada. Nejčastější vrozenou příčinou jsou defekty enzymů, hlavně cystathion-beta-syntázy (CBS) a metylen-tetrahydrofolát reduktázy (MTHFR). Homozygotní defekty hlavně CBS jsou spojeny s těžkou HHc a jsou doprovázeny řadou abnormalit (neurologické a psychické, časnou chorobou cév včetně TEN) a mohou být spojeny s koncentrací Hc až 400 µmol/l. Lehká a středně těžká forma HHc se objevuje u heterozygotů. HHc je spojována s kardiovaskulárním postižením a s hlubokými žilními trombózami, vztah mírné HHc (16–30 µmol/L) k žilní tromboembolické nemoci je však stále kontroverzní(20, 21).
Ze získaných rizikových faktorů je nejvýznamnější přítomnost antifosfolipidových protilátek (APA). Vyšetření APA je indikováno v případě nálezu nejasného prodlouženého aktivovaného tromboplastinového času (APTT), náhodné zjištění trombocytopenie obvykle lehkého až středního stupně. Z klinických nálezů je vyšetření vhodné při trombóze, která vznikla u pacientů s již dříve zjištěným onemocněním a/nebo při léčbě, o nichž je známo, že vedou k indukci APA, u žen při opakované ztrátě plodu(22).
Práce z poslední doby ukazují na vhodnost identifikace somatické mutace Janusovy tyrozinkinázy 2 (JAK2 V617F). Mutace se vyskytuje v různě velké frakci granulocytů periferní krve u drtivé většiny (65 až 97 %) pacientů s polycytemia vera (PV), je jí přisuzován zásadní význam v patogenezi tohoto onemocnění. Současné studie dále uvádí podíl výskytu mutace u 30 – 57 % pacientů s esenciální trombocytemií a u 35 – 95 % pacientů s chronickou idiopatickou myelofibrózou. Pozitivní nález může signalizovat časné stadium myeloproliferativní nemoci. U nositelů této mutace se obecně předpokládá vyšší riziko komplikací (trombózy, potraty, apod.). Tato mutace by vždy měla být vyšetřena v případě výskytu trombóz v oblasti splanchniku či mozku(23).
Rizikové faktory VTE můžeme dělit nejrůznějším způsobem, např. vrozené, smíšené (viz výše), přechodné a získané (tab. 2). Někdy se mluví o obecných (běžných) rizikových faktorech – věk, imobilizace, operace, úraz, VTE v osobní či rodinné anamnéze; o faktorech ovlivnitelných – obezita, hyperhomocysteinemie, a neovlivnitelných faktorech = vrozených defektech.
Tab. 2. Rizikové faktory žilní trombózy 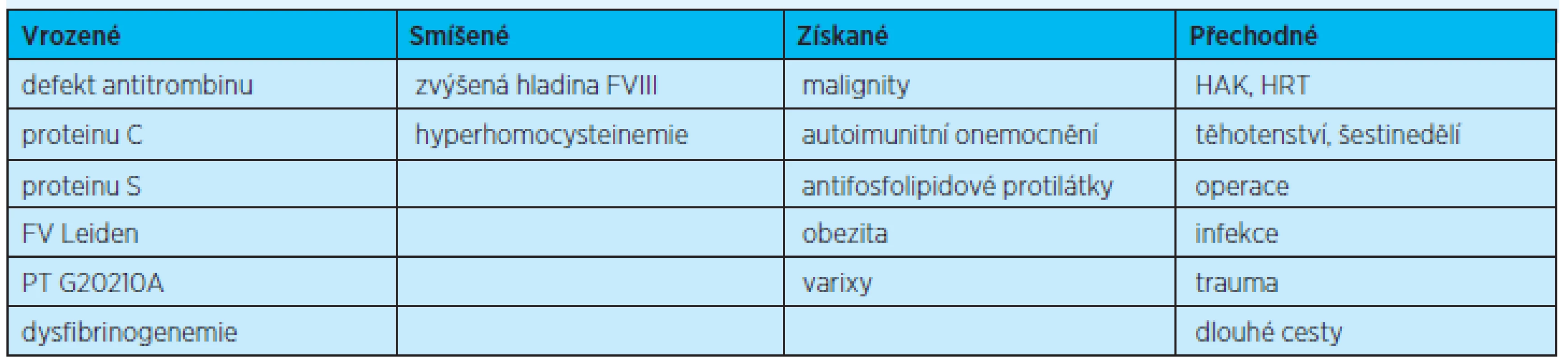
Dále je řada nejrůznějších klinických stavů (tj. chorob), při kterých se trombózy častěji vyskytují (tab. 3) a při kterých je nutné zvažovat antitrombotickou profylaxi(7, 24).
Tab. 3. Klinické stavy častěji doprovázené trombózou 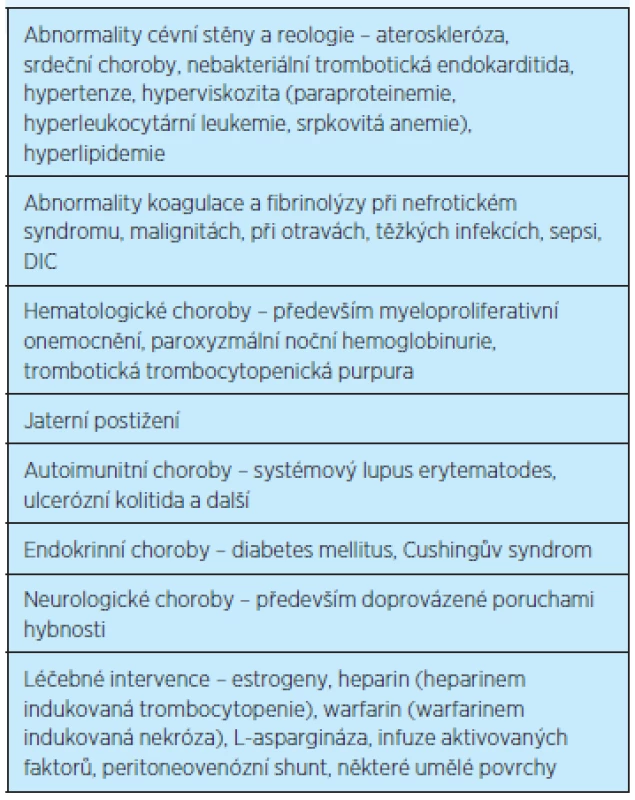
Nádorové onemocnění, zejména maligní, je doprovázeno řadou primárních i sekundárních projevů z postižených tkání či systémů. Velmi častou komplikací nádorů jsou trombózy, které nejen onemocnění doprovází, ale často mu i předchází(25, 26). Příčiny poruch hemostázy nádorů jsou rozmanité a vyplývají jednak z vlastního nádorového onemocnění, jednak může být vliv léčby (zavedené centrální žilní katetry, porty, operační výkony, chemoterapie) a také postižení jater a dalších orgánů a tkání (metastázy, toxické působení aj.), infekce, opakované substituce transfúzními přípravky. Aktivace hemostázy u nádorového onemocnění se podílí i na progresi a metastazování nádoru.
Rizikové faktory lze zařadit do skupin podle zvyšování možnosti trombózy na faktory s vysokým rizikem, středním a nízkým. Za vysoce rizikové jsou považovány zlomeniny kyčle a dolních končetin, náhrada kloubů (TEP), velké operační zákroky či traumata, poranění míchy. Do skupiny středních je řazena např. artroskopie kolenních kloubů, centrální žilní katétry, chemoterapie, městnavé srdeční selhání, HAK, HRT, malignity, šestinedělí, trombózy v osobní anamnéze, vrozená trombofilie. Do nízkého rizika (odds ratio, OR <2) spadá např. dlouhé sezení (dlouhá jízda autem či let letadlem), vyšší věk, laparoskopie (např. cholecystektomie), obezita, těhotenství, varixy(27).
Při vzniku VTE se efekt endogenních faktorů, genetických faktorů a faktorů prostředí, které v dané chvíli působí současně, při nejmenším sečítá, často i násobí(28).
Jako nejzávažnější z hlediska výskytu trombózy se ukazují také některé defekty AT, dále defekty v homozygotní formě (např. FVL) a kombinace poruch. Ale např. i u závažné kombinace jako je nedostatek antitrombinu a FVL, závisí riziko trombózy na typu defektu a projevy jsou v rodinách různé. Podobně přítomnost vrozené či smíšené trombofilie a získaného faktoru (např. těhotenství, hormonální kontracepce) může riziko trombózy neúměrně navýšit(29, 30).
Opomíjeným rizikovým faktorem zůstává krevní skupina v AB0 systému. Osoby se skupinou A, B či AB (ne-0) mají cca 2x vyšší riziko trombózy oproti osobám s krevní skupinou(31, 32). Tento vliv je pozorován i u arteriálních trombóz.
Mezi tzv. ovlivnitelné rizikové faktory je řazena např. obezita, která zvyšuje riziko trombózy 2–3x. Mechanismus není zcela jasný, zřejmě se podílí fyzikální aspekty, zpožděný žilní návrat, biochemické parametry (zvýšené koagulační i zánětlivé faktory). Riziko se významně zvyšuje zejména při podávání HAK či HRT(33).
Mezi ovlivnitelné faktory, které zvyšují riziko trombózy, se řadí i nedostatek vitaminů skupiny B (foláty, B6, B12)(34, 35).
K přechodným rizikovým faktorům je řazena hospitalizace, kde se na zvýšeném riziku většinou podílí další faktory (imobilizace, nádory, infekce, operace atd.) – až 20 % pacientů na interně a 40 % na chirurgii bude mít trombózu(36). U operace/traumatu závisí výše rizika na typu operace a charakteristice pacienta (včetně věku)(37).
Ukazuje se, že i cestování obecně zvyšuje riziko trombózy asi 2x. MEGA studie ukázala, že není rozdíl mezi cestováním letadlem či jiným dopravním prostředkem (autobus, vlak, auto). Nejvyšší riziko trombózy je první týden po cestě. Riziko je zvýšené u nositelů FV Leiden (OR 8,1; 95% CI 2,7–24,7), u osob s BMI vyšším než 30 kg/m2 (OR 9,9; 95% CI 3,6–27,6), u osob vyšších než 190 cm (OR 4,7; 95% CI 1,4–15,4) a u žen užívajících HAK (odhadem OR >20). Toto zvýšení platí pro cestování obecně, výraznější je při dlouhých letech a platí to i pro osoby, které měří méně než 160 cm (OR 4,9; 95% CI 0,9–25,6)(38).
Incidenci trombózy ovlivňují i naše stravovací návyky. Dieta, obsahující více rostlinné stravy a ryb, také snižuje incidenci trombóz(39).
Indikace vyšetření trombofilie
Obecně je přijímáno, že vyšetření na vrozené trombofilie není indikováno u osob přibližně nad 45 let(40, 41). Ve vyšším věku může ovlivnit léčbu (dlouhodobá antikoagulační léčba) přítomnost antifosfolipidových protilátek. Vyšetřit také můžeme hladinu faktoru VIII – zvýšená hladina upozorňuje i na zvýšené riziko recidivy trombózy. Klinický význam tohoto vyšetření je však také diskutován.
V podstatě je vždy nutné zvážit, zda nález defektu bude pro nemocného přínosem:
- Detekce defektu v žádném případě neovlivní postup při léčbě akutní VTE příhody.
- Ani v případě zvažování délky antikoagulační léčby se přístup u nositelů běžných rizikových faktorů nebude lišit od ostatních. Trvání léčby vždy primárně závisí na riziku recidivy, které se musí zvažovat proti riziku krvácení(42). Délka léčby se bude řídit tíží příhody, tj. klinickým nálezem, souběžnými chorobami, komplikacemi léčby, anamnézou či přídatnými rizikovými faktory (budeme jinak postupovat při trombóze po operaci a jinak u tzv. „idiopatické“). Delší profylaxe se doporučuje jen tehdy, byla-li první příhoda život ohrožující či idiopatická. Při zvažování ukončení léčby je třeba zohlednit nejen aktuální klinický stav, ale i aktuální laboratorní výsledky. Význam má zejména stanovení D-dimerů, které může upozornit na vyšší riziko trombózy v případě vysazení antikoagulační léčby(43, 44). V neposlední řadě je důležitá spolupráce nemocného. Po jedné trombotické příhodě, byť u nemocného s nalezeným vrozeným rizikovým faktorem, většinou není indikována doživotní antikoagulační léčba.
- Profylaxe trombózy se bude vždy na prvním místě řídit anamnézou a stavem, pro který je indikována. Při stratifikaci rizika je nutné zohlednit všechny rizikové faktory. Nález trombofilního faktoru neovlivní profylaxi trombózy v zátěžové situaci, pokud bude nositelem osoba starší 45 let.
Laboratorní testy
Diagnostika trombofilie se opírá především o dobře odebranou rodinnou a osobní anamnézu. U osob s trombózou, především tzv. idiopatickou, je nutné vždy vyšetřit krevní obraz – nejen z důvodů vyloučení hematoonkologického onemocnění (při podezření na myeloproliferaci je vždy indikováno vyšetření JAK2 polymorfismu). Např. nález megaloblastové anemie vždy indikuje nedostatek folátů a vitaminu B12. Riziko trombózy zvyšuje i nález zvýšeného počtu krevních destiček(36). Dále vyšetřujeme základní koagulaci (zkrácené APTT, zvýšený fibrinogen, prodloužení trombinového testu může upozornit na dysfibrinogenemii), hladinu D-dimerů. Další vyšetření je potom nezbytné provést na specializovaných pracovištích – např. podezření na přítomnost antifosfolipidových protilátek. Při hodnocení výsledků si musíme být vědomi limitací vyšetření a znát řádnou interpretaci výsledků. S výjimkou molekulárně biologických vyšetření jsou testy ovlivněny akutním stavem (např. pokles AT, zvýšení FVIII), warfarinizací (K-dependentní faktory), nálezy je proto nezbytné opakovat mimo tyto situace.
Závěr
Patogeneze trombózy je multifaktoriální a všechny rizikové faktory, bez ohledu na to, zda se jedná o vrozené či získané, se navzájem významně ovlivňují. Vyšetření vrozených rizikových faktorů trombózy by mělo být prováděno u mladších jedinců s významně pozitivní rodinou anamnézou(45). Vyšetření není indikováno u starších osob(46). Ve většině případů však nález trombofilního defektu neovlivní léčebné postupy(47). Neměli bychom zapomínat, že už sama anamnéza trombotických příhod je varováním a indikací k důslednější prevenci v zátěžových situacích.
MUDr. Miloslava Matýšková, CSc.,
MUDr. Marie Šlechtová
Oddělení klinické hematologie FN Brno
MUDr. Miloslava Matýšková, CSc.
e-mail: mmatys@fnbrno.cz
Od r. 1989 pracuje ve FN Brno Bohunice, od roku 1991 na Oddělení klinické hematologie. Je členkou výboru České hematologické společnosti a místopředsedkyní Laboratorní sekce ČHS. V hematologii se věnuje poruchám hemostázy, v posledních letech především se zaměřením na rizikové faktory trombózy.
Zdroje
1. White RH: The epidemiology of venous thromboembolism. Circulation 2003; 107: I-4–I-8.)
2. Cushman M: Epidemiology and risk factors for venous thrombosis. Semin Hematol 2007; 44(2): 62–69.
3. Agnelli G, Prandoni P, Santamaria MG et al.: Three months versus one year of oral anticoagulant therapy for idiopathic deep venous thrombosis. N Engl J Med 2001; 345 : 165–169.
4. http://www.bpac.org.nz/resources/bt/2011/03_thrombophilia.asp
5. Middeldorp S: Is thrombophilia testing useful? ASH Education Book 2011; 1 : 150–155.
6. Walker ID, Greaves M: Preston FE on behalf of the Haemostasis and Thrombosis Task Force British Committee for Standards in Hematology. Investigation and management of heritable thrombophilia. Br J Haematol 2001; 114 : 512–528.
7. NICE guidance CG92 Venous thromboembolism – reducing the risk Issude: January 2010. http://guidance.nice.org.uk/CG92
8. Rosendaal FR: Risk Factors for venous thrombotic Disease. Thromb Haemost 1999; 82 : 610–619.
9. Matýšková M, Paseka J, Vorlová Z et al.: Prevalence of factor V Leiden mutation in healthy women. In: Scharrer I, Schramm W: 29. Hämophilie - Symposion Hamburg 1998, Springer 1999, 309–311.
10. Rossi E. Za T, Ciminello A et al.: The risk of symptomatic pulmonary embolism due to proximal deep venous thrombosis differs in patients with different types of inherited thrombophilia. Thromb Haemost 2008; 15 (6): 1030–1034.
11. Ho WK, Hankey GJ, Quinlan DJ, Eikelboom JW: Risk of recurrent venous thromboembolism in patients with common thrombophilia. Arch Intern Med 2006; 166 : 729–736.
12. Pomp ER, Lenselink, AM, Rosendaal, FR, Doggen CJM: Pregnancy, the postpartum period and prothrombotic defects: risk of venous thrombosis in the MEGA study. J Thromb Haemost 2008; 6 : 632–637.
13. Dulíček P, Malý J, Kalousek I et al.: Výskyt venózního tromboembolizmu u žen s Leidenskou mutací v souvislosti s graviditou a šestinedělím. Čes Gynekol 2005; 70 (2): 133–138.
14. Robertson L, Wu O, Langhorne P et al.: For the TREATS study: Thrombophilia in pregnancy: a systematic review. Br J Haematol 2005; 132 : 171–196.
15. Haverkate F: Familial dysfibrinogenemia and thrombophilia. Thromb Haemost 1995; 73(1): 151–61.
16. Kamphuisen PW, Eikenboom JCJ, Bertina RM: Elevated Factor VIII levels and the risk of thrombosis. Arterioscler Thromb Vasc Biol 2001; 21 : 731–738.
17. Kyrle PA, Minar E, Hirschlm M et al.: High plasma levels of factor VIII and the risk of recurrent venous thromboembolism. N Engl J Med 2000; 343 : 457–462.
18. Legnani C, Cosmi B, Cini M et al.: High plasma levels of factor VIII and risk of recurrence of venous thromboembolism. Br J Haemeatol 2004; 124 : 504–510.
19. Ariëns RA: Elevated fibrinogen causes thrombosis. Blood 2011; 117(18): 4687–4688.
20. Hyánek J et al.: Hyperhomocysteinemia – unrecognized and neglected. Clin Biochem Metab 2009; 2 : 83–92.
21. Kottke-Marchant K, Green R, Jacobsen DW et al.: High plasma homocystein: a risk factor for arterial and venous thrombosis in patients with normal coagulation profiles. Clin. Appl. Thrombosis/Hemostasis 1997; 3(4): 239–244.
22. Buliková A, Penka M: Antifosfolipidový syndrome – diagnostika a léčba. Vnitř Lék 2005; 51(7&8): 809–817.
23. Tondeur S, Boutruche S, Biron-Andréani C, Schved JF: Prevalence of the Jak2 V617F mutation associated with splanchnic vein thrombosis. A 10-year retrospective study. Thromb Haemost 2009; 101 : 787–789.
24. Ageno W, Squizzato A, Ambrosini F et al.: Thrombosis prophylaxis in medical patients: a retrospective review of clinical practice patterns. Haematologica 2002; 87 : 746–750.
25. Lee AYY: Thrombosis in cancer: An update on prevention, treatment, and survival benefits of anticoagulants. ASH Education Book 2010; 1 : 144–149.
26. Horsted F, West J, Grainge J: Risk of venous thromboembolism in patients with cancer: A systematic review and meta-analysis. PLoS Med 2012; 9(7): http://www.plosmedicine.org/article/info%3Adoi%2F10.1371%2Fjournal.pmed.1001275
27. Anderson FA Jr, Spencer FA: Risk Factors for venous thromboembolism. Circulation 2003; 107: I-9–I-16.
28. Rosendaal FR: Venous Thrombosis: The Role of Genes, Environment, and Behavior. ASH Education Book 2005; 1 : 1–12.
29. Blanco-Molina Á, Trujillo-Santos J, Tirado R et al.: Venous thromboembolism in women using hormonal contraceptives. Findings from the RIETE Registry. Thromb Haemost 2009; 15 (3): 478–482.
30. van Vlijmen EF, Brouwer JL, Veeger NJ et al.: Oral contraceptives and the absolute risk of venous thromboembolism in women with single or multiple thrombophilic defects: results from a retrospective family cohort study. Arch Intern Med 2007; 167 : 282–289.
31. Jick H, Slone D, Westerholm B et al.: Venous thromboembolic disease and AB0 blood group type. A cooperative study. Lancet 1969; 1 : 539–542.
32. Matýšková M, Zavřelová J, Pejchalová A et al.: Krevní skupiny AB0 a faktor V Leiden. Čas lék čes 2002; 141 (5): 146–151.
33. Abdollahi M, Cushman M, Rosendaal FR: Obesity: risk of venous thrombosis and the interaction with coagulation factor levels and oral contraceptive use. Thromb Haemost 2003; 89 : 493–498.
34. Oger E, Lacut K, Le Gal G: Hyperhomocysteinemia and low B vitamin levels are independently associated with venous thromboembolism: results from the EDITH study: a hospital-based case–control study. J Thromb Haemost 2006; 4 : 793–799.
35. Hron G, Lombardi R, Eichinger S et al.: Low vitamin B6 levels and the risk of recurrent venous thromboembolism. Haematologica 2007; 92(9): 1250–1253.
36. Zakai AA, Wright J, Cushman M: Risk factors for venous thrombosis in medical inpatients: validation of a thrombosis risk score. J Thromb Haemost 2004; 2 : 2156–2161.
37. White RH, Zhou H, Gage BF: Effect of age on the incidence of venous thromboembolism after major surgery. J Thromb Haemost 2004; 2 : 1327–1333.
38. Cannegieter SC, Doggen CJM, van Houwelingen HC, Rosen-daal FR: Travel-related venous thrombosis: results from a large population-based case control study (MEGA Study). PLoS Med 2006; 3. http://www.plosmedicine.org/article/info%3Adoi%2F10.1371%2Fjournal.pmed.0030307
39. Steffen LM: Greater fish, fruit, and vegetable Intakes are related to lower Incidence of venous thromboembolism. The longitudinal investigation of thromboembolism etiology. Circulation 2007; 115 : 188–195.
40. Baglin T, Gray E, Greaves M et al.: Clinical guidelines for testing for heritable thrombophilia. Br J Haematol 2010; 149 : 209–220.
41. Dalen JE: Should patients with venous thromboembolism be screened for thrombophilia? Am J Med 2008; 121 : 458-463.
42. Coppens M, Reijnders JH, Middeldorp S et al.: Testing for inherited thrombophilia does not reduce the recurrence of venous thrombosis.J Thromb Haemost 2008; 6 : 1474–1477.
43. Cosmi B: Value of D-dimer testing to decide duration of anticoagulation after deep vein thrombosis: yes. J Thromb Haemost 2006; 4 : 2527–2529.
44. Bruinstroop E, Klok FA, van de Ree MA et al.: Elevated D-dimer levels predict recurrence in patients with idiopathic venous thromboembolism: a meta-analysis. J Thromb Haemost 2009; 7 : 611–618.
45. Lijfering WM, Brouwer JLP, Veeger NJGM et al.: Selective testing for thrombophilia in patients with first venous thrombosis: results from a retrospective family cohort study on absolute thrombotic risk for currently known thrombophilic defects in 2479 relatives. Blood 2009; 113 : 5314–5322.
46. Anard-Michelot H, Siguret V, Gouin-Thibault I et al.: Screening for thrombophilic abnormalities in very elderly patients. Ann Biol Clin (Paris) 2010; 68 (6): 643–648.
47. Middeldorp S: Evidence-based approach to thrombophilia testing.J Thromb Thrombolysis 2011; 31 : 275–281.
Štítky
Geriatria a gerontológia Praktické lekárstvo pre dospelých Protetika
Článek Má dáti – dalČlánek Genetika v terénní praxi
Článok vyšiel v časopiseGeriatrie a Gerontologie
Najčítanejšie tento týždeň
2013 Číslo 4- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
- Vareniklin jako pomocník v léčbě nikotinismu i u psychiatrických pacientů
-
Všetky články tohto čísla
- Má dáti – dal
- Alzheimerova demence – epidemie 21. století: můžeme a umíme jí předcházet?
- Genetika v terénní praxi
- Rizikové faktory trombózy
- Profylaxe tromboembolické nemoci
- Profylaxe posttraumatické epilepsie
- Prevence osteoporózya sarkopenie
- Sluneční záření a lidský organismus aneb „kam nechodí slunce, tam chodí lékař“
- Prevence infekcí očkováním jako celoživotní proces
- Diabetes mellitus – existují možnosti prevence?
- Zápis z mimořádného jednání výboru ČGGS ze dne 17. 7. 2013
- Zápis z jednání výboru ČGGS dne 18. 9. 2013
- Geriatrie a Gerontologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Profylaxe tromboembolické nemoci
- Profylaxe posttraumatické epilepsie
- Rizikové faktory trombózy
- Alzheimerova demence – epidemie 21. století: můžeme a umíme jí předcházet?
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



