-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Konzervativní léčení seniorů s chronickým onemocněním ledvin ve stadiu CKD 3b a vyšším
Konzervativní léčení seniorů s chronickým onemocněním ledvin ve stadiu CKD 3b a vyšším
In last decades remarkable increase in numbers of old patients with chronic kidney disease was confirmed. Despite new developments in dialysis technology and kidney transplantation there is a growing number of patients with chronic comorbidities and disabilities for whom these methods are not preferable. Recently published data show long – term effect of protein restricted diet supplemented with keto amino acids. Conservative management therefore can remarkably increase prognosis and quality of life for these high risk renal patients in stage C3b and higher.
Keywords:
chronic kidney disease – conservative management – low protein diet – keto amino acids
Autoři: V. Teplan; E. Topinková
Vyšlo v časopise: Geriatrie a Gerontologie 2017, 6, č. 1: 16-22
Kategorie: Přehledové články
Souhrn
V posledních desetiletích se významně zvýšil počet nemocných vyšších věkových kategorií se závažným onemocněním ledvin. Přes rozvoj dialyzačních technik a transplantace ledvin přibývá nemocných, u kterých biologický věk a četné orgánové komplikace neumožňují zařazení do dialyzačně-transplantačního programu. V posledním období se objevily studie o úspěšné dlouhodobé konzervativní léčbě s podáváním modifikovaných nízkobílkovinných diet doplněných ketoanalogy esenciálních aminokyselin. Konzervativní léčba tak umožňuje významně zlepšit prognózu rizikových seniorů ve stadiu CKD 3b a vyšším.
Klíčová slova:
chronické onemocnění ledvin – konzervativní léčba – nízkobílkovinná dieta – ketoanaloga esenciálních aminokyselinÚvod
Konzervativním léčením rozumíme postupy spočívající v úpravě či příznivém ovlivňování metabolických a funkčních odchylek při chronickém onemocnění ledvin cestou dietní a medikamentózní.
Je důležité zahájit konzervativní léčebné postupy již v časném stadiu snížení renálních funkcí v době, kdy hladina sérového kreatininu je jen mírně zvýšena (dosáhne hodnoty kolem 150 µmol/l, u seniorů i hodnot nižších, stadium G3a-b dle KDIGO), tak aby všemi dostupnými léčebnými postupy byla zpomalena progrese chronického renálního onemocnění a upraveny již přítomné metabolické odchylky spojené se sníženou funkcí ledvin. Měla být také objasněna etiologie základního onemocnění, které by mohlo být přímo léčebně ovlivnitelné.
Dříve, než se nemocní dostanou do pokročilého stadia, je třeba se rozhodnout o dalším léčebném postupu, a tedy i o možnosti zařazení do dialyzačně-transplantačního programu. Konzervativní léčba umožňuje včasnou přípravu k založení AV zkratu či peritoneálního katetru a současně přípravu k zařazení na čekací listinu k transplantaci ledviny u indikovaných pacientů včetně preemptivní transplantace ze živého či kadaverózního dárce. V poslední době se problematika konzervativního léčení významně věnuje skupině seniorů vyšších věkových skupin s multiorgánovým postižením, u kterých není možná transplantace ledviny a současně ani chronická dialyzační léčba nepřináší dobré výsledky, a tedy konzervativní léčba zůstává léčebným postupem do terminálního stadia onemocnění.
1. Konzervativní léčení chronického onemocnění ledvin ve stáří
Více než polovina nemocných v dlouhodobém dialyzačním programu přesahuje svým věkem 65 roků a přibývá i pacientů ve věkové kategorii nad 75 let. Přes rozvoj dialyzačních technologií a transplantačního programu proto celkově roste počet nemocných, u kterých biologický věk a další orgánové poškození neumožňují úspěšnou transplantaci ledviny, ale často ani dlouhodobou dialyzační léčbu. Při četných závažných orgánových komorbiditách je jejich životní prognóza špatná. Vázne i návaznost sektoru sociálních služeb a celková kvalita života klesá.
V posledních letech se objevily studie o úspěšné dlouhodobé konzervativní léčbě s podáváním modifikovaných nízkobílkovinných diet doplněných ketoanalogy esenciálních aminokyselin u nemocných nad 80 let(1,2). Jejich více než dvouletá prosperita při nízké hodnotě renální funkce s glomerulární filtrací kolem 10 ml/min (0,17 ml/s) ukazuje na možnost konzervativního léčení chronického onemocnění ledvin ve stadiu CKD 4–5 u indikovaných seniorů jako alternativu dialyzační léčby. Navíc je třeba vzít v úvahu skutečnost, že ve stáří fyziologicky glomerulární filtrace klesá a dosahuje u seniorů vysokých věkových kategorií fyziologicky pouze kolem 50 % úrovně glomerulární filtrace ve věku 20–30 let(3). Snížená hodnota glomerulární filtrace proto musí být vztažena k věku pacientů. K podpoře léčebné alternativy konzervativní nefrologie přispívají i další studie deklarující, že pozdější zahájení dialyzačního léčení u seniorů může prodloužit údobí kompenzace při konzervativní léčbě v predialýze a celkově prodloužit dobu aktivního života těchto nemocných(4). Současně často užívané výpočtové hodnocení glomerulární filtrace pomocí CKD MDRD či CKD EPI je u seniorů zatížené značnou chybou, především danou sníženou hodnotou sérového kreatininu při úbytku svalové hmoty(5). Jsou také přítomny další změny elektrolytového a vodního metabolismu charakteristické pro vyšší seniorský věk.
Hlavním účelem léčebné výživy je dosáhnout u seniorů ideální tělesné hmotnosti pro danou věkovou skupinu a zajistit optimální složení diety s doporučeným poměrem živin. Přívod energie by měl odpovídat poměrům hmotnosti pacienta s přihlédnutím k příslušným faktorům, které se ve vysokém věku mohou uplatňovat. Při špatné compliance lze užít u seniorů i modifikovaného příjmu proteinů v dietě(6). Někteří autoři doporučují vložit do sedmidenního cyklu nízkobílkovinné diety 2 dny s vyšším obsahem bílkovin (až 1 g/kg/den). Podle našich zkušeností, s ohledem na dlouhodobý metabolický stav nemocných a jídelní stereotyp, vkládáme většinou 1–2x týdně jídelní sestavu obsahující 0,8 g bílkoviny/kg/den. V ostatních případech dáváme raději přednost nutričnímu suplementu či při špatné compliance a adherenci k dietě přechodu na volnější kontrolovanou dietu s obsahem 0,8 g bílkoviny/kg/den s omezeným obsahem fosfátů. V současné době populární vegetariánská dieta se do určité míry blíží původní italské, eventuálně i bramborovo-vaječné dietě německé. Na základě vegetariánské diety lze výhodně sestavit jídelní lístek pro všechny formy nízkobílkovinných diet. Pro nižší obsah esenciálních aminokyselin v některých vegetariánských pokrmech však musí být tyto diety suplementovány, nejlépe ketoanalogy esenciálních aminokyselin. U diety přísně vegetariánské však nestačí samotný přísun rostlinné bílkoviny pokrýt základní potřebu esenciálních aminokyselin a tyto musí být bezpodmínečně suplementovány(7).
Vedle adherence k dietě, kterou můžeme zhodnotit anamnesticky či lépe formou dotazníku, hodnotíme při nízkobílkovinné dietě compliance podle odpadu urey a fosfátů do moči za 24 hodin. V našich předchozích studiích bylo prokázáno, že starší nemocní mohou velmi dobře tolerovat nízkobílkovinnou dietu (NBD) doplněnou ketoanalogy esenciálních aminokyselin (KA), která pomáhá dlouhodobě stabilizovat metabolický stav(8,9).
2. Hlavní zásady dietoterapie
Dietologická úprava příjmu bílkovin a energie, určovaná individuálně podle stupně snížení renálních funkcí a metabolického stavu nemocného, je uvedena v tabulce 1. Množství přijímaného proteinu se zvyšuje o hodnotu přítomné proteinurie.
Tab. 1. Složení diet u nemocných s chronickým selháním ledvin 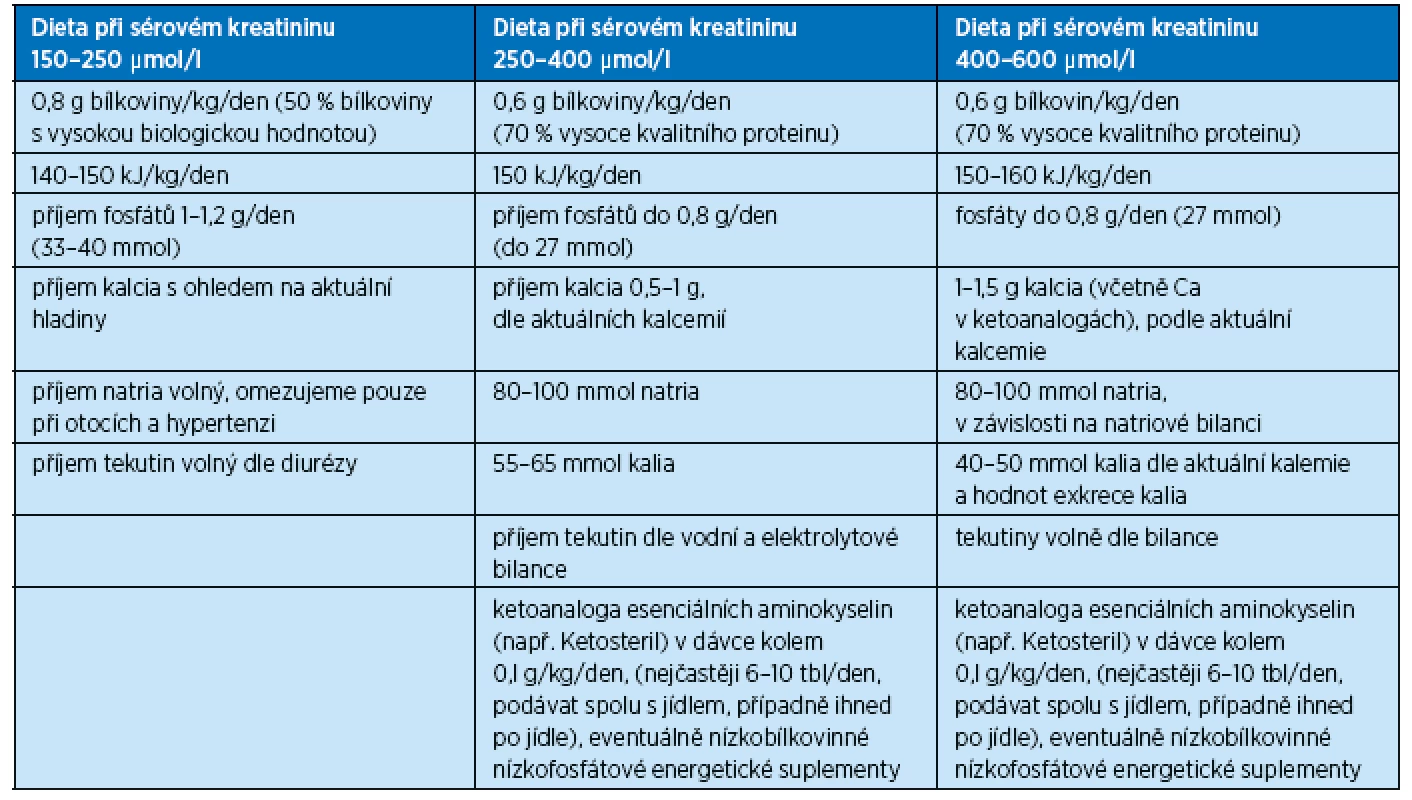
3. Metabolické poruchy u seniorů a potřeba živin
V průběhu stárnutí dochází ke změnám v renálních funkcích, které mohou ovlivnit vylučování vody a elektrolytů. Je snížená schopnost konzervovat vodu následkem poklesu maximální koncentrační schopnosti ledvin(10). Stejně významné je i snížení schopnosti vyloučit nadbytek vody s následným nebezpečím její retence a vzniku intoxikace vodou vzhledem k snížení glomerulární filtrace a zřeďovací schopnosti ledvin. Nálezy četných autorů jednoznačně nasvědčují tomu, že v průběhu stárnutí dochází k postupnému poklesu glomerulární filtrace (GFR), což se zjišťuje při měření této funkce na podkladě clearance inulinu (Cin), stejně jako clearance endogenního kreatininu (Ckr). Od 40 let věku nastává pozvolný pokles GFR, který je důsledkem poklesu průtoku plasmy a krve ledvinou, neboť klesá rovněž clearance paraaminohippurové kyseliny (PAH). Pokles Cin a CPAH je v průběhu stárnutí proporcionální, neboť poměr mezi těmito clearancovými hodnotami, označovaný jako filtrační frakce (FF), se v průběhu stárnutí nemění(11).
U seniorů je nutno počítat s měnící se energetickou potřebou a změnami v intermediárním metabolismu: nevyvážená výživa může být příčinou řady druhotných nemocnění, která negativně ovlivňují možnosti rehabilitace.
Svalové tkáně ubývá, ze 44 % celkové tělesné hmotnosti v mládí na 27 % ve věku nad 85 let. Antropometrie většinou zjišťuje ztluštění kožní řasy nad tricepsem a současně zmenšení obvodu paže (úbytek svaloviny). U starých lidí bývá omezena kapacita trávicích pochodů a resorpce(12). Zvýšená tělesná hmotnost spojená s přírůstkem tukové tkáně může být zaviněna nesprávnou výživou, značný význam má pokles tělesné aktivity. Se stoupající nadměrnou hmotností se zvyšuje výskyt některých dalších onemocnění, jako je diabetes mellitus, dna, hypertenze, ischemická choroba srdeční, poruchy periferní cirkulace a hyperlipidemie.
3.1. Bílkoviny v dietě
Ve věku nad 50 let výrazně stoupají nároky na kvalitu bílkovin a zejména esenciálních aminokyselin(13,14). Karence bílkovin je u starých lidí častá a jejími důvody jsou poruchy trávení, zhoršená schopnost žvýkaní při nedokonalé funkci chrupu, socioekonomické faktory (cena masa, příprava a nepravidelnost jídla). Nedostatek bílkovin vyvolává enzymové defekty, pokles plazmatických bílkovin, urychlení fyziologické senilní involuce, snižuje se duševní čilost, zhoršuje hojení ran a odolnost k infekčním chorobám klesá. Potřeba esenciálních aminokyselin je u starých lidí zvýšena, u metioninu a lyzinu je to až trojnásobek normální dávky. Zatím se ještě neprosadily upravené směsi aminokyselin, které by tyto požadavky splňovaly, zejména proto, že kinetika aminokyselin může být měnlivá. I při enterální aplikaci výživných směsí je nutno dbát na dostatečný přívod bílkovin a počítat s tím, že různé biologicky méně hodnotné bílkoviny rostlinného původu obsahují málo metioninu a lyzinu.
3.2. Sacharidy v dietě
U nemocných starších 65 let je nutno počítat ve více než 10 % s výskytem manifestního diabetu a až trojnásobným počtem diabetiků latentních, což znamená, že téměř 1/3 populace starší 65 let trpí poruchou sacharidové tolerance. Poruchy sacharidové přeměny nutí ke značnému omezení oligosacharidů v potravě; větší dávky sacharidů vyžadují uvolnění vyššího množství inzulínu, což má mj. za následek zvýšení lipogeneze a zbytečné zatížení již méně výkonného endokrinního pankreatu. Denní dávka sacharidů by neměla být vyšší než 400 g (nebo 6 g/kg/den). Podávání jiných oligosacharidů náhradou za glukózu může mít za následek zvýšenou produkci laktátu a urátů, proto i zde by měla být zachována určitá omezení, známá u jiných stavů. Při enterální aplikaci je vhodné snižovat dávku oligosacharidů, podáváme větší množství polysacharidů (degradační produkty škrobu). Snášenlivost laktózy bývá snížena pro poměrně častou insuficienci laktázy, proto ji podáváme omezeně.
3.3. Tuky v dietě
Tuková složka zvyšuje energetickou hodnotu potravy starých osob, v krvi se mohou zvýšit cholesterol a triacylglyceroly. I malé zvýšení cholesterolemie zvyšuje riziko vzniku degenerativních cévních změn. Vzhledem k nutnosti podávat energeticky bohaté směsi, a také dodat esenciální mastné kyseliny, nelze tuky při výživě vyloučit. Je nutno omezit především živočišné tuky s nasycenými mastnými kyselinami o dlouhém řetězci, nezbytný je denní přívod kyseliny linolové v množství 7–8 g(15). Denní dávka tuku nemá překročit 1 g/kg/den, resp. 30 % dodávané energie. Limitujícími faktory jsou snížená vyčeřovací schopnost plazmy a sklon k hyperlipoproteinemiím. Při intravenózním podávání tuků je nutno průběžně sledovat hladiny triacylglycerolů a glykemie jako ukazatele využití tuků a jejich tolerance. Je také nutno kontrolovat cholesterolemii. Pro enterální výživu jsou zvláště vhodné přípravky s vysokým obsahem esenciálních mastných kyselin. Ovlivnění cholesterolemie docílené podáváním bezcholesterolové enterální výživy nepřineslo jednoznačné úspěchy.
4. Současné postavení dietoterapie u seniorů
Je zřejmé, že příznivý účinek adekvátní redukce příjmu proteinů se odehrává i ve stáří ve více rovinách. První je vliv na progresi ledvinného onemocnění(16, 17). Další velmi významný je metabolický účinek nízkobílkovinné diety – především individuálně sestavené – na metabolické poruchy provázející chronické onemocnění ledvin vyššího stupně (3b–5)(18, 19). S tím souvisí i příznivý vliv takto sestavené diety na další metabolické poruchy již přímo nesouvisející s ledvinným onemocněním. V neposlední řadě představuje dietní režim i významnou složku edukační a aktivní spolupráce nemocného s lékařem a nutriční terapeutkou, která je nezbytně nutná pro dlouhodobou adherenci k dietě.
Důležité je poznání, že účinnou a adekvátní modifikaci nízkobílkovinné diety je třeba zahájit i u seniorů dříve, než nemocný dospěje do dekompenzovaného stadia renálního selhání. O charakteru nízkobílkovinné diety rozhoduje vedle množství obsažené bílkoviny také její složení. Z tohoto hlediska má velký význam zastoupení bílkovin s vysokou biologickou hodnotou (živočišné bílkoviny). Tyto bílkoviny obsahují vysoké procento esenciálních aminokyselin a měly by tvořit v závislosti na celkovém příjmu proteinů 50–70 % z celkového zastoupení bílkovin. Rostlinné bílkoviny obsahují značné množství méně kvalitního proteinu (s nízkým zastoupením esenciálních aminokyselin a relativně vysokým neesenciálních aminokyselin). Metabolické studie opakovaně prokazují, že pro dlouhodobou dietní léčbu nemocných v chronické renální insuficienci je nutné zajistit denní příjem bílkovin minimálně kolem 0,6 g/kg/den s vysokým zastoupením bílkovin s vysokou biologickou hodnotou. Pojem biologická hodnota bílkovin vyjadřuje podíl, v jakém je použitá bílkovina využita pro syntézu tkáňových proteinů. Biologická hodnota je tedy úměrná poměru esenciálních a neesenciálních aminokyselin. Zároveň musí být přítomny všechny nezbytné neesenciální bílkoviny a koncentrace každé esenciální aminokyseliny musí odpovídat její minimální denní potřebě. Nejvyšší biologickou hodnotu mají bílkoviny vajec, mléka, masa a brambor. Minimální denní potřeba esenciálních aminokyselin byla stanovena pro zdravé osoby a z tohoto schématu vycházejí některé suplementační přípravky esenciálních aminokyselin a jejich ketoanalog (např. Ketosteril). Pro efektivní podávání nízkobílkovinných diet je nezbytné zajistit adekvátní energetický příjem, který činí u seniorů kolem 130 kJ/kg/den (30 kcal/kg/den). Tyto nálezy byly potvrzeny nepřímou kalorimetrií při dlouhodobé studii nemocných v chronické renální insuficienci. Při výpočtu je třeba respektovat ideální tělesnou hmotnost nemocných.
Příliš nízký energetický příjem je častější příčinou proteino-energetické malnutrice než samotná redukce příjmu bílkovin. Při katabolizujícím onemocnění stoupá potřeba energie a dosahuje 140–150 kJ/kg/den. Též hladina plazmatických aminokyselin, především esenciálních, je úzce závislá na adekvátním příjmu energie. Pozorovaný pokles plazmatické hladiny aminokyselin při zvýšeném příjmu energie je přechodného charakteru a souvisí se zvýšeným anabolismem. Energetická potřeba nemocných v chronické renální insuficienci odpovídá zhruba zdravým jedincům(20).
Velmi důležitou roli v působení nízkobílkovinné diety představuje compliance. Pojmem compliance rozumíme též dobrou prosperitu nemocných při daném typu diety. Compliance je podmíněna objektivní složkou danou typem nízkobílkovinné diety s ohledem na stupeň renální insuficience, její klinické a laboratorní projevy a habitus nemocného. Stejně je ovlivněna složkou subjektivní, to jest aktivní spoluprací nemocného při dlouhodobém dodržování dietologického režimu. Dobrá compliance s omezením příjmu bílkovin je spojena s významným snížením hladiny urey v krvi a jejím vylučováním v moči; dobrá compliance s doporučenou energetickou hodnotou diety pak se stabilizací tělesné hmotnosti i podkožního tuku a konečně dobrá compliance s příjmem a dávkou esenciálních aminokyselin a jejich ketoanalog se stabilizovanou hladinou rozvětvených aminokyselin. Stejně tak při dobré compliance zůstávají stabilizované hladiny tyroideálních hormonů. Compliance výrazně zhoršují projevy gastrointestinálního uremického syndromu (nechutenství, zvracení, gastritida), široké zastoupení oligosacharidů v dietě, chuťově nevhodné formy esenciálních aminokyselin a dlouhotrvající (roky) poměrně monotónní dieta. Výraznou roli v adherenci na daný typ diety představují též regionální stravovací zvyklosti. Horší compliance s přísně nízkobílkovinnou dietou bude tam, kde ve stravovacích zvyklostech převládá vysoké zastoupení živočišných bílkovin. Naopak lepší compliance podporuje širší použití polysacharidů jako energetického zdroje a habituální návyk na stravu s nízkým obsahem bílkovin a fosforu (vegetariánská strava). Zásadní význam hrají psychologické faktory, především zájem nemocného na dietě (oddálení dialýzy, podpora rodiny, odborné vedení nutričním terapeutem a lékařem a v neposlední řadě též dostupnost nízkobílkovinných složek diety)(21).
4.1. Zahájení dietní léčby
Při stanovení vhodné diety je základním hlediskem stupeň snížení ledvinných funkcí. Dalším hlediskem je pak základní příčina ledvinného selhání a komplikující onemocnění. Ordinovaná dieta nemůže být stanovena obecně, ale musí být individuální a diferencovaná s ohledem na cíl, kterého chceme dietetickým opatřením dosáhnout(22):
- řízeným příjmem tekutin podporujeme optimální hydrataci,
- řízený příjem sodíku slouží buď k prevenci a léčbě otoků a hypertenze, nebo naopak ke kompenzaci případných ztrát natria močí,
- příjem kalia se řídí s ohledem na prevenci či léčbu hyperkalemie, respektive deplece draslíku,
- adekvátní energetická hodnota diety brzdí katabolismus bílkovin a adekvátní příjem bílkovin omezuje tvorbu konečných produktů dusíkového metabolismu a kompenzuje ztráty bílkovin močí,
- příjem proteinů v rozmezí 0,6–0,8 g/kg/den v závislosti na tíži renálního postižení.
Kontraindikace pro dlouhodobé podávání nízkobílkovinné diety jsou stejné jako u mladších nemocných:
- nemocní dekompenzovaní (kardiální selhávání, hepatorenální postižení, malnutrice apod.),
- nemocní s již přítomnými uremickými komplikacemi (polyneuropatie, perikarditida, medikamentózně nekorigovatelná hypertenze, těžká metabolická acidóza),
- nemocní s těžkými známkami retence vody a elektrolytů nereagující na diuretickou léčbu,
- nemocní se špatnou compliance k nízkobílkovinné dietě.
4.2. Speciální diety při kombinovaných metabolických poruchách
S dlouhodobou konzervativní léčbou je spojena otázka, zda nízkobílkovinná dieta ovlivňuje rychlost progrese renálního onemocnění s ohledem na základní nefrologickou diagnózu.
Ve velkých souborech bylo ukázáno, že s ohledem na dynamiku základního onemocnění ovlivňuje nízkobílkovinná dieta významně chronické proteinurické glomerulopatie, včetně diabetické(23, 24).
Nízkobílkovinná dieta ovlivňuje glomerulární hemodynamiku v reziduálních nefronech, a tím může přispívat k zpomalení rozvoje glomerulární sklerózy. Analogickým mechanismem se mohou uplatňovat i infuze aminokyselin, a tedy závisí na složení přijímaných roztoků aminokyselin. Největší „hyperfiltrační aktivita“ byla prokázána u fenylalaninu a tyrozinu, významně se uplatňovaly i tryptofan, treonin, metionin, lysin a histidin, zatímco rozvětvené aminokyseliny leucin, izoleucin, valin se uplatňovaly minimálně. Tento nález má značný význam při sestavování suplementačních směsí aminokyselin k nízkobílkovinným dietám. Předpokládá se, že na mechanismu hyperfiltrace se významně uplatňuje glukagon(25).
Cílem diety je uvést nemocného do optimálního stavu výživy a v tomto stavu ho udržet. Vedle již zmíněných chuťových zvyklostí nemocného musí dietní sestava respektovat i metabolické odchylky jednotlivých nemocných a svým složením významně přispívat k jejich úpravě.
Nízkobílkovinná dieta obsahuje v průměru kolem 45 g bílkovin (0,6 g/kg/den při 75 kg tělesné hmotnosti). Na energetické hodnotě diety se podílejí z 50–60 % sacharidy a z 30–40 % tuky. Energetický podíl proteinů je pouze do 10 %.
Hlavní energetické substráty představují tedy sacharidy a tuky. Je ovšem známo, že až dvě třetiny nemocných s chronickým onemocněním ledvin (CKD) mohou mít závažnější poruchu lipidového metabolismu a jedna polovina poruchu glykoregulace. Také incidence aterosklerotických komplikací je u nemocných s CKD zvýšena. S ohledem na tyto skutečnosti byla vypracována modifikace nízkobílkovinné diety pro nemocné s hyperlipoproteinemií.
Podobně byly vypracovány modifikace nízkobílkovinných diet pro nemocné s diabetem (limitován příjem sacharidů). Při současné hyperlipoproteinemii – většinu kombinované - a při dodržení proteinového a energetického dietního optima je někdy nutná i úprava dávky inzulinu(26, 27).
Další častou dietní modifikací je snížený příjem fosfátů (na 600–800 mg/den) při současně zvýšeném příjmu kalcia. Dále limitovaný příjem draslíku, respektive sodíku.
Při kombinovaných poruchách je třeba stanovit metabolické priority a provádět několikastupňovou dietní úpravu (např. po úpravě hladiny fosfátu dlouhodobě upravit dietu s ohledem na přítomnou hyperlipoproteinemii). Kombinované individualizované diety lze s výhodou připravit pomocí počítačového programu.
4.3. Suplementované a modifikované nízkobílkovinné diety
Pokud se nám nedaří dosáhnout deklarovaného složení diety – především z hlediska energetického – a dále v zátěžových katabolických situacích (interkurentní onemocnění, operace, zvýšená fyzická zátěž, váhová neprosperita nemocných) užíváme tzv. suplementů. Nejjednodušší je užití výživných nápojů. Jejich energetický základ tvoří maltodextrin a jsou ochuceny sirupem a džusem. Kombinované suplementy používáme při závažnějších metabolických poruchách výživy a preventivně při zvýšené zátěži organismu. Speciální výživné nápoje obsahují malé množství mléčné nebo vaječné bílkoviny doplněné vysokým obsahem energie. Obsah minerálů, stopových prvků a vitaminů je upraven s ohledem na renální insuficienci.
U některých nemocných se nedaří snížit hyperlipoproteinemii pouze upravenou dietou. V těchto případech přidáváme některé formy rostlinné vlákniny, respektive pektinu. Zásah vlákniny do metabolismu má komplexní charakter a vedle snížení resorpce tuku zlepšuje i sacharidovou toleranci. Nevýhodou je potřeba užít poměrně velké dávky (20–40 g), čímž se může nebezpečně zvýšit přísun kalia do organismu(8).
V řadě případů doplňujeme k ordinované dietě energetické doplňky ve formě prášku, který je přidán přímo do vybraných jídel (speciální polysacharid), či doplňujeme (fortifikujeme) touto formou potraviny po stránce optimálního složení proteinů (mléčný protein).
4.4. Použití esenciálních aminokyselin a jejich ketoanalog
Při pokročilých formách chronického onemocnění ledvin byly opakovaně dokumentovány nálezy abnormálních hladin některých aminokyselin v plazmě a kosterním svalu. Bývají zjišťovány nízké koncentrace především esenciálních aminokyselin, zatímco hladina některých neesenciálních bývá zvýšena. Typickým nálezem u dietologicky neléčených nemocných v chronické renální insuficienci jsou sníženy plazmatické koncentrace threoninu, valinu, leucinu, izoleucinu, lysinu, tryptofanu a tyrosinu. Hladina fenylalaninu se zpočátku nemění, později stoupá stejně jako poměr fenylalanin: tyrozin. Hladina histidinu je většinou snížena a vázne jeho využitelnost. Tento nález potvrzuje i snížená hladina karnosinu ve svalu (dipeptid složený z histidinu a beta-alaninu). Histidin představuje esenciální aminokyselinu pro nemocné v chronické renální insuficienci a vzhledem k váznoucí metabolizaci je semiesenciální i tyrosin, z neesenciálních aminokyselin je snížena plazmatická hladina serinu (snížená syntéza v ledvinné tkáni). Ostatní neesenciální aminokyseliny mají plazmatickou hladinu normální (glutamin, glycin, alanin) nebo zvýšenou (kyselina aspargová, kyselina glutamová, citrulin, ornitin, arginin). Ve svalu je zvýšena hladina především aminokyselin ureového cyklu. Jak vyplývá z uvedených údajů, je u nemocných v chronické renální insuficienci porušena distribuce především esenciálních aminokyselin extra - a intracelulárního prostoru. Pouze z nálezu plazmatických hladin jednotlivých aminokyselin nelze přesně odvozovat jejich koncentraci v organismu. Složení spektra aminokyselin neodpovídá nálezu u zdravých jedinců, a tedy nemocní s chronickým onemocněním ledvin vyžadují doplnění aminokyselinami odpovídající jejich metabolickým poruchám.
Velmi významnou úlohu v metabolismu aminokyselin a bílkovin hrají rozvětvené aminokyseliny (valin, leucin a izoleucin). Jejich nutriční důležitost byla objevena v 50. letech Rosem, který ukázal, že pro příznivou dusíkovou bilanci je nezbytné adekvátní množství rozvětvených aminokyselin. V 70. letech byl prokázán důležitý vliv těchto aminokyselin v regulaci proteinového, sacharidového a lipidového metabolismu. Za fyziologických podmínek se metabolizuje největší množství rozvětvených aminokyselin extrahepatálně ve svalech (asi 55 %) a tento podíl se při metabolických dekompenzacích v organismu zvyšuje(25).
Při metabolizaci aminokyselin je prvním krokem transaminace na odpovídající ketokyseliny. Tento pochod je reverzibilní, což má zásadní význam při užití ketoanalog esenciálních aminokyselin. Umožňuje tak příslušným ketokyselinám nahradit základní aminokyseliny v bílkovinách diety. Konečným produktem oxidace leucinu a izoleucinu je acetyl CoA, který může sloužit jako základní zdroj pro syntézu mastných kyselin. Při neúplné oxidaci leucinu vzniká hydroxymetyl-glutaryl-CoA, základní prekursor cholesterolu. Valin se metabolizuje na sukcinyl CoA – intermediální metabolit Krebsova cyklu, který má glykogenní účinek. Důležitý je zejména vztah alaninového a glutaminového metabolismu k metabolismu rozvětvených aminokyselin. Rozvětvené aminokyseliny jsou zdrojem alfa-amino-dusíku pro syntézu glutaminu a alaninu. Alanin je přenašečem aminoskupin mezi kosterními svaly a játry, takže je možno říci, že rozvětvené aminokyseliny regulují sekundárně přenos alfa-amino-dusíku mezi periferními a viscerálními tkáněmi. Glutamin je přenašečem aminoskupin mezi kosterními svaly a ledvinami. Alanin a glutamin jsou také klíčovými substráty pro glukoneogenézu. Všechny tři rozvětvené aminokyseliny mají regulační vliv na proteinový metabolismus ve smyslu poklesu katabolismu a tendenci k proteosyntéze. Největší protein šetřící účinek byl popsán u ketoanalogu leucinu. Vysoké koncentrace rozvětvených aminokyselin inhibují glukogenézu(28).
V chronické renální insuficienci zjišťujeme snížené plazmatické hladiny rozvětvených aminokyselin (hladina valinu pod 150 µmol/l je důkazem těžké malnutrice). Naproti tomu intracelulární koncentrace leucinu i izoleucinu jsou normální, zatímco koncentrace valinu je významně snížená. Tento poměr se nedá upravit ani při běžné suplementaci aminokyselin a je označován jako tzv. antagonismus rozvětvených aminokyselin.
Použití esenciálních aminokyselin a jejich ketoanalog v klinické praxi je těsně spojeno se stanovením minimálního denního potřebného množství esenciálních aminokyselin u zdravých osob. Významným pokrokem bylo nahrazení plnohodnotných esenciálních aminokyselin jejich keto - a hydroxyanalogy (KA). Uskutečněné studie využily mechanismu reverzibilní transaminace vybraných esenciálních aminokyselin. Podáváním bezdusíkatých „uhlíkových skeletů“ esenciálních aminokyselin ve formě jejich keto - a hydroxyanalogů vedlo jak k výraznému snížení příjmu exogenního dusíku do organismu, tak k využití části dusíku retinované močoviny k aminaci těchto aminokyselin. Formou ketoanalog byly podávány aminokyseliny leucin, izoleucin, valin, fenylalanin a metionin. Ostatní esenciální aminokyseliny byly podávány ve své L-formě (lysin, threonin a tryptofan), neboť jejich aminace v organismu byla metabolicky náročná a méně efektivní. V sestavě aminokyselin byly doplněny histidin a tyrosin. V našich podmínkách nebyly většinou prokázány snížené hladiny histidinu, ale jeho využitelnost vázne. Histidin významně zlepšuje dusíkovou bilanci a podílí se i na stabilizaci krevního obrazu. Zatímco minimální denní potřeba esenciálních aminokyselin pro zdravé osoby byla stanovena již před 40 lety, není otázka adekvátní úhrady esenciálních aminokyselin u nemocných v chronické renální insuficienci dodnes zcela vyřešena.
U nás dostupné přípravky mají ketoanaloga vázána ve formě kalciových solí, což znamená při obsahu např. 50 mg kalcia v 1 tbl. přípravku Ketosteril nezanedbatelný přísun kalcia.
Vedle ketoanalog lze podávat u nemocných v chronické renální insuficienci při nízkobílkovinné dietě též přípravky esenciálních aminokyselin. Podání samotných aminokyselin se však dlouhodobě příliš neosvědčilo, neboť stejného účinku lze dosáhnout při menších nákladech přidáním malého množství biologicky vysoce hodnotné bílkoviny či lépe oligopeptidů (navíc je příjem většího množství aminokyselin spojen s nebezpečím prohloubení metabolické acidózy). Podáváme je krátkodoběji (dnes výhradně parenterálně) především tam, kde metabolická aktivace ketoanalog (aminace) je porušena – u nemocných s jaterní lézí, v těžkém metabolickém stavu, u diabetiků apod.
Velikost dávky ketoanalog a esenciálních aminokyselin je závislá na bílkovinném složení diety, hmotnosti nemocného a jeho nutričním stavu. Při neselektivní nízkobílkovinné dietě obsahující 0,6 g bílkovin/kg/den se udává dávka 0,1–0,2 g aminokyselin/kg/den. Minimální dávka nezbytná k udržení dusíkové rovnováhy při naší dietě činila 4,8 g/den (přípravek Ketosteril).
Celkový příjem bílkovin včetně aminokyselin nesmí dlouhodobě klesnout pod 0,7 g/kg/den!
Kontraindikace v podávání ketoanalog jsou hyperkalcemie, uremická gastrointestinální symptomatologie a těžká jaterní léze. Pro nedostatek klinických zkušeností se nedoporučuje podávání v těhotenství.
Vzhledem k zvýšenému příjmu aminokyselin při nízkobílkovinných dietách byla také sledována otázka, zda zvýšená nálož aminokyselin touto cestou neovlivňuje nepříznivě hyperfiltraci v reziduálních nefronech. Experimentální studie ukázaly, že výhodné aminokyselinové složení těchto přípravků naopak hyperfiltraci snižuje.
Ketoanaloga významně ovlivňují také kalciofosfátový metabolismus u nemocných v chronické renální insuficienci. Snižují hyperfosfatemii a hladinu parathormonu, zvyšují kalcemii, čímž příznivě ovlivňují projevy sekundární hyperparathyreózy. Tomuto mechanismu se také přisuzuje významná role ve zpomalené progresi chronické renální insuficience.
4.5. Modifikované nízkobílkovinné diety
Při špatné compliance lze u seniorů užít modifikovaného příjmu proteinů v dietě. Někteří autoři doporučují vložit do sedmidenního cyklu nízkobílkovinné diety 2 dny s vyšším obsahem bílkovin (až 1 g/kg/den). Dle našich zkušeností, s ohledem na dlouhodobý metabolický stav nemocných a jídelní stereotyp, vkládáme většinou 1x týdně jídelní sestavu obsahující 0,8 g bílkovin/kg/den. V ostatních případech dáváme raději přednost nutričnímu suplementu či při špatné compliance a adherenci k dietě přechodu na volnější kontrolovanou dietu s obsahem 0,8 g bílkovin/kg/den s omezeným obsahem fosfátů(29).
Složení diety z hlediska kvalitativního může významně snížit i přítomnou hyperlipidemii (zvýšené zastoupení nasycených mastných kyselin a esenciálních mastných kyselin), a tím ovlivnit nepříznivý účinek aktivních lipoproteinových partikulí při progresi CKD (nepřímo je ovlivněna i tvorba prostaglandinů). Zvýšené zastoupení polysacharidů a vlákniny stabilizuje sacharidový metabolismus a ovlivní i hladinu triacylglycerolů. Dieta se podílí svojí energetickou hodnotou i na vyrovnané dusíkové bilanci a prevenci katabolismu.
Dieta s upraveným příjmem proteinů významně snižuje příjem fosfátů, a tím příznivě ovlivňuje hyperfosfatemii. Snižuje se kalcio-fosfátový produkt, je snížena produkce parathormonu. Nelze pochybovat o příznivém účinku adekvátního příjmu bílkovin na metabolický stav organismu. Dle řady nálezů je zřejmé, že je nutno omezit příjem bílkovin dříve, než dojde k těžkému poškození ledvin. V současné době populární vegetariánská dieta se do určité míry blíží původní italské či bramborovo-vaječné dietě německé. Na základě vegetariánské diety lze výhodně sestavit jídelní lístek pro všechny formy nízkobílkovinných diet. Pro nižší obsah esenciálních aminokyselin v některých vegetariánských pokrmech však musí být tyto diety suplementovány, nejlépe KA. U diety přísně vegetariánské však nestačí samotný přísun rostlinné bílkoviny pokrýt základní potřebu esenciálních aminokyselin a tyto musí být bezpodmínečně suplementovány.
4.6. Kontrola nemocných při dlouhodobém podávání nízkobílkovinných diet
Na úspěšnosti nízkobílkovinných diet se nepochybně podílí dlouhodobě vyrovnaná metabolická bilance nemocných, účinná léčba hypertenze a pravidelné kontroly konané v této fázi onemocnění lékařem nejméně 1x měsíčně(30).
Vedle základních laboratorních parametrů (kreatinin, urea, glomerulární filtrace, KO, sideremie /event. při léčbě rh-EPO feritin či saturace transferinu/, Na, K, Ca, P, k. močová, Astrup, glykemie, cholesterol, triacylglyceroly, močový sediment, bakteriurie, proteinurie/24hodin) musíme pravidelně kontrolovat základní parametry nutrice, tj. albumin, transferin, event. aminogram (resp. Whiteheadův kvocient, tj. poměr neesenciálních aminokyselin gly+glu+ser+tau a esenciálních aminokyselin leu+ileu+val+met). K základním údajům patří subjektivní pocit nemocného a jeho celková prosperita měřená antropometricky. Vedle tzv. adherence k dietě, kterou můžeme ověřit anamnesticky či lépe formou dotazníku, hodnotíme při nízkobílkovinné dietě tzv. compliance podle odpadu urey a fosfátů do moči za 24 hodin(8).
Nízkobílkovinná dieta, event. doplněná ketoanalogy esenciálních aminokyselin, představuje opakovaně deklarovanou součást konzervativní léčby u nemocných s chronickým onemocněním ledvin. Její realizace však vyžaduje nejenom zkušený nutriční tým s nabídkou přijatelného dlouhodobého jídelníčku, ale i aktivní spolupráci pacientů motivovaných výsledkem zlepšení metabolického stavu a oddálení terminálního selhání ledvin. Motivace nemocných může být snížena neúplnou informací od některých lékařů, především dialyzačních středisek, a také nedostatkem kvalifikovaných nutričních terapeutek. Také dlouhodobé dodržování omezující diety, i když individuálně upravené dle chuťových zvyklostí nemocných, může představovat u některých nemocných překážku v jejich životní prioritě plného žaludku. Pozitivní výsledky dietních studií byly získány v zemích, kde je stravovací kultura a kulinářství na vysoké úrovni (Francie, Itálie, Čína, Indie, Thajsko, Malajsko, Mexiko, Brazílie, Maďarsko, ale i ČR). Naopak v zemích fast foodů (USA, UK) či velkých steaků (Austrálie, Nový Zéland, Argentina) se nízkobílkovinná, částečně i vegetariánská dieta příliš neujala.
Autoři prohlašují, že nejsou ve střetu zájmů a publikace článku nebyla podpořena farmaceutickou firmou.
prof. MUDr. Vladimír Teplan, DrSc.1,
prof. MUDr. Eva Topinková, CSc.2
1Subkatedra nefrologie IPVZ Prahaa Interní klinika LF OU Ostrava
2Geriatrická klinika 1. LF UK a VFN Praha
prof. MUDr Vladimír Teplan, DrSc.
e-mail: Vladimir.Teplan@seznam.cz
Absolvoval LF UK v Praze. Klinickou praxi získal na Interním oddělení Thomayerovy nemocnice, dále na III. interní výzkumné základně IKEM a následně na Klinice nefrologie IKEM, kde byl 10 let přednostou kliniky a 8 let zástupcem přednosty. Dvacet let vedl postgraduální výchovu lékařů v nefrologii. Více než 30 let se zabývá metabolismem a výživou. V posledním desetiletí především otázkou metabolismu tukové tkáně, vodního a elektrolytového metabolismu a možnostmi, jak aktivně léčit pacienty adekvátní dietou a příjmem tekutin a minerálů. Velkou pozornost věnuje seniorům. Přednáší v České republice i v zahraničí. Je autorem řady monografií a článků v problematice nefrologie, metabolismu a výživy v domácím i zahraničním písemnictví.
Zdroje
1. Brunori G. Efficacy and safety of very-low-protein diet when postponing dialysis in the elderly: a prospective randomized multicenter controlled study. Am J Kidney Dis 2007; 49 : 569–580.
2. Brunori G. How manage elderly patients with chronic renal failure. conservative management versus dialysis. Blood Purif 2008, 26 : 36–40.
3. Schück O. Examination of kidney function, Martinus Nijhoff Publishers l984; 218–227.
4. Bellizzi V, Di Iorio BR, De Nicola L, et al. Very low protein diet supplemented with ketoanalogues improves blood pressure control in chronic kidney disease. Kidney Int 2007; 71 : 245–251.
5. Nesins M, Bright M. Cockcroft. Gault formula for diagnosis of moderate kidney failure. J Am Geriatr Soc 2008; 56(4): 774–776.
6. Chauveau P, Vendrely B, Haggan WE, et al. Body composition of patients on a very low-protein diet. Two-year survey with DEXA. J Ren Nutr 2003; 13 : 282–287.
7. Cianciaruso M, Lucidi P, Ciarambino T, et al. Metabolic effects of two low-protein diet in chronic kidney disease stage 4–5: a randomized controlled trial. Nephol Dial Transpl 2007; 23 : 636–644.
8. Teplan V. Metabolismus a ledviny. Grada Publishing 2000; s. 412.
9. Teplan V. Keto/amino acids in the treatment of chronic kidney disease patients: 30 years experience in 3,000 patients. Am J Nephrol 2005; 25(suppl 1): 8–10.
10. Nádvorníková H. Koncentrační schopnost ledvin. Praha: Avicenum 1983.
11. Oreopoulos DG, Dimkovic N. Geriatric nephrology is coming of age, J Am Soc Nephrol 2003; 14 (4): 1099–1101.
12. Musso CG. Geriatric nephrology and the “nephrogeriatric giants”. Int Urol Nephrol 2002; 34 (2): 255–256.
13. Apparicio M, Chauveau P, de Precigout V, et al. Nutrition and outcome on renal replacement therapy of patients with chronic renal failure treated by supplemented very low-protein diet. J Am Soc Nephol 2000; 12 : 708–711.
14. Misra M, Nolph K. Efficacy and safety of very-low-protein diet in the elderly: what are the options? Am J Kidney Dis 2008; 51(3): 530–531.
15. Cupisti A, Ghiadoni L, D´Alessandro C, et al. Soy protein diet improves endothelial dysfunction in renal transplant patients. Nephrol Dial Transpl 2007; 22 : 229–234.
16. Brenner BM, Meyer TW, Hostetter TH. Dietary protein intake and progressive nature of kidney disease. New Engl J Med 1982; 307 : 652–660.
17. Klahr S, Harris K. Adaptation of remnant nephrons. In Nutritional treatment of chronic renal failure, eds. Giovannetti, Kluwer Academic Publishers l989; 21–8.
18. Mitch WE. Beneficial response to modified diets in treating patients with chronic kidney disease. Kidney Int 2005; Suppl 94 : 133–135.
19. Aparicio M, Bellizzi V, Chauveau P, et al. Keto acid therapy in predialysis chronic kidney disease patiens:final consensus. J Ren Nutr 2012; 22(Suppl 2): S22–24.
20. Teplan V, Schück O, Racek J, et al. Reduction of plasma asymmetric dimethylarginine in obese patiens with chronic kidney disease after three years of low-protein diet supplemented with keto-amino acids: a randomized controlled trial. Wien Klin Wochenschr 2008; 120(15–16): 478–485.
21. Lin S. Low-protein diets and keto analogues: current research projects in China. Am J Nephrol (Suppl1) 2006 : 15.
22. Fouque D, Laville M, Boissel JP. Low protein diets for chronic kidney disease in nondiabetic adults. Cochrane Database Syst Rev 2006, 19: CD 001892.
23. Toigo G, Aparicio M, Attman PO, et al. Consensus report: Expert Working Group report on nutrition in adults patients with renal insufficiency (part 1 of 2). Clin Nutr 2000, 19(3): 145–212.
24. Toigo G, Aparicio M, Attman PO, et al. Consensus report: Expert Working Group report on nutrition in adults patients with renal insufficiency (part 2 of 2), Clin Nutr 2000; 19(4): 281–291.
25. Teplan V. Pharmacological features of keto amino acids. Am J Nephrol 2005; 25(suppl 1): 13–14.
26. Teplan V. Standards of care for diabetic nephropathy. Am J Nephrol 2005; 25(suppl 1): 18–21.
27. Pan Y, Guo LL, Jin HM. Low-protein diet for diabetic nephropathy: a meta-anylasis of randomized controlled trials. Am J Clin Nutr 2008; 88 : 660–666.
28. Zakar G. Metabolic effects of branched-chain amino acids and keto acids: mechanisms independent of protein intake? J Ren Nutr 2009; Suppl 1 : 25–26.
29. Teplan V. Suplementované restriktivní diety u nemocných vyššího věku s chronickým onemocněním ledvin. Vnitřn Lék 2016; 12(Suppl 6): 88–96.
30. Fouque D, Chen J, Chen W, et al. Adherence to ketoacids/essential amino acids-supplemented low protein diet and new indications for patients with chronic kidney disease. BMC Nephrology 2016; 17 : 63–64.
Štítky
Geriatria a gerontológia Praktické lekárstvo pre dospelých Protetika
Článek EditorialČlánek Divertikulární nemocČlánek XXI. Zlínský geriatrický denČlánek Nehojace sa rany
Článok vyšiel v časopiseGeriatrie a Gerontologie
Najčítanejšie tento týždeň
2017 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Vareniklin jako pomocník v léčbě nikotinismu i u psychiatrických pacientů
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Konzervativní léčení seniorů s chronickým onemocněním ledvin ve stadiu CKD 3b a vyšším
- Divertikulární nemoc
- Hodnocení kvality života u pacientů vyššího věku se sarkopenií: vývoj a validace české verze dotazníku SarQoL®
- Editorial
- Nečekané „vyléčení“ u geriatrického pacienta s makroadenomem hypofýzy
- Nutriční potřeba při léčbě chronických defektů u geriatrického pacienta
-
Z historie péče o chudé a chronicky nemocné v Praze.
Chudobinec sv. Bartoloměje a Chorobinec Na Karlově. - Nová evropská doporučení pro management pacientů vyššího věku s chronickým onemocněním ledvin ve stadiu 3b a vyšším (eGFR < 45 ml/min/1,73 m2)
- Ohlédnutí za hradeckým gerontologickým kongresem
- XXI. Zlínský geriatrický den
- Stáří je nepřetržitá série ztrát
- Nehojace sa rany
- Geriatrie a Gerontologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Divertikulární nemoc
- Konzervativní léčení seniorů s chronickým onemocněním ledvin ve stadiu CKD 3b a vyšším
- Hodnocení kvality života u pacientů vyššího věku se sarkopenií: vývoj a validace české verze dotazníku SarQoL®
-
Z historie péče o chudé a chronicky nemocné v Praze.
Chudobinec sv. Bartoloměje a Chorobinec Na Karlově.
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy




