-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Nutriční potřeba při léčbě chronických defektů u geriatrického pacienta
Nutriční potřeba při léčbě chronických defektů u geriatrického pacienta
Due to the prolonging life expectancy and decreasing mortality number of older patients with chronic skin ulcers is growing steadily. New materials for chronic wound care resulted in significant improvement of treatment results. Despite their use we face treatment failure in some cases. In this article we present 2 case studies for which assessment of nutritional status and nutritional support were beneficial and positively influenced wound healing process in older patients.
KEYWORDS:
chronic wound – nutrition need – proteins – energy – phases of wound healing – nutrients – oral nutrition suplements
Autoři: M. Mašková; T. Richter
Vyšlo v časopise: Geriatrie a Gerontologie 2017, 6, č. 1: 42-47
Kategorie: Kazuistiky
Souhrn
Vzhledem ke zvyšující se střední délce života a snižování mortality stoupá počet seniorských pacientů s chronickými defekty. Nové materiály pro vlhké hojení ran přinesly podstatné zlepšení výsledků léčby. Přesto se v některých případech setkáváme se selháním terapie. V tomto článku jsou uvedeny 2 kazuistiky, na kterých demonstrujeme přínos nutričního vyšetření v léčbě hojení ran u seniorů.
KLÍČOVÁ SLOVA:
chronický kožní defekt – nutriční potřeba – bílkoviny – energie – fáze hojení ran – živiny – sippingÚvod
Malnutrice u seniorů má stále se zvyšující incidenci, někteří autoři mluví až o epidemii. Možnosti jejího ovlivnění jsou problematické vzhledem k tomu, že nutriční screening a hodnocení se při ošetřování starších nemocných v odborných ambulancích ani v primární péči rutinně neprovádí. Malnutrice sama o sobě může přispívat k rozvoji a následně prodloužit hojení chronických ran(1). Proto by orientační zhodnocení nutričního stavu a screening rizika malnutrice (alespoň Body Mass Index a krátká forma Mini Nutrition Assessment, případně další testy) měly být součástí každého komplexního vyšetření seniora. V případě nutričních problémů je nezbytná spolupráce s nutričním terapeutem či nutricionistou a dostupnost konzultace by se měla stát standardním postupem.
Pacient s chronickou nebo obtížně se hojící ránou musí mít ve stravě dostatek energie, proteinů a dalších látek pro udržení své tělesné hmotnosti a vhodných podmínek pro každou fázi hojení ran(2). Proto je hrubým pochybením, pokud u pacienta s chronickým kožním defektem není provedeno zhodnocení nutričního stavu a stanovena nutriční potřeba jak kvantitativní, tak kvalitativní. Proces hojení ran u geriatrického pacienta vyžaduje multioborovou spolupráci, na které by se měl spolupodílet geriatr, dermatolog, nutricionista, algeziolog, chirurg, angiolog. Je potřebná nejen lékařská, ale i pravidelná ošetřovatelská péče, používání správných materiálů pro hojení ran, rehabilitačních pomůcek a rehabilitační péče.
Kazuistika 1
V naší první kazuistice uvádíme případ 73leté pacientky. Od 71 let docházela do ambulance hojení ran Geriatrické kliniky VFN pro chronické bilaterální defekty dolních končetin na podkladě chronické žilní insuficience. Stav léze na LDK při převzetí do ambulantní péče zachycuje obrázek 1. Z osobní anamnézy dále zmiňujeme: arteriální hypertenzi, poruchu glukózové tolerance a osteoporózu.
Obr. 1. Stav defektu na LDK při přijetí do ambulantní péče, únor 2015 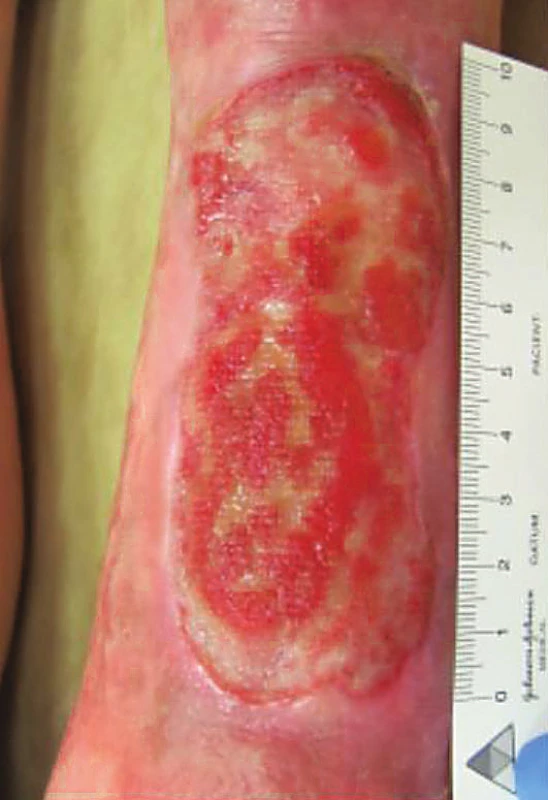
Při převzetí do ambulantní péče užívala Betaloc Zok, Furon, Prestarium neo forte, Controloc, Detralex a analgetika (DHC continus a Korylan). Pacientka bydlí v domově seniorů, chodí o francouzských holích. V anamnéze je uváděna alergie na krycí materiály se stříbrem, v dokumentaci v roce 2010 udáván exantém – pacientka však tuto informaci popírá.
První vyšetření kožních defektů na naší ambulanci v únoru 2015: defekty čisté, bez povlaku, anamnesticky kolísavá sekrece od minimální až po střední, velikosti LDK 3,5 x 4 cm a PDK 10 x 5 cm, kompresivní bandáž. Defekty se nacházely v proliferační fázi. Zpočátku postupně aplikováno několik krycích materiálů dle stavu rány – Hydrotac, Silvercel, Exufiber a Suprasorb A, Mepilex, po kterých docházelo ke zlepšování lokálního nálezu, rána se zmenšovala. Po půl roce se však hojení rány zastavilo a postupně oba defekty progredovaly do velikosti LDK 11 x 10 cm a PDK 13 x 10 cm (obr. 2). V listopadu 2015 došlo na levé dolní končetině v centru defektu k rozvoji nekrózy, zvětšila se sekrece z rány, objevilo se i lehké zarudnutí v okolí rány LDK. Došlo také k progresi otoků dolních končetin ke kolenům oproti původně přítomnému pouhému prosáknutí na dorsech nohou bilatelárně. Nově se objevily jak větší bolesti v ráně, i bolesti obou DK při chůzi v lýtkách, ke zhoršování bolestí v obou DKK vedlo i svěšení končetin, intenzita VAS 5. Pro silné bolesti při chůzi byla pacientka prakticky upoutaná na lůžko, pohyb jen zcela minimální.
Obr. 2. Zhoršení lokálního nálezu vlivem nepoznané a neléčené ischemické choroby dolních končetin, říjen 2015 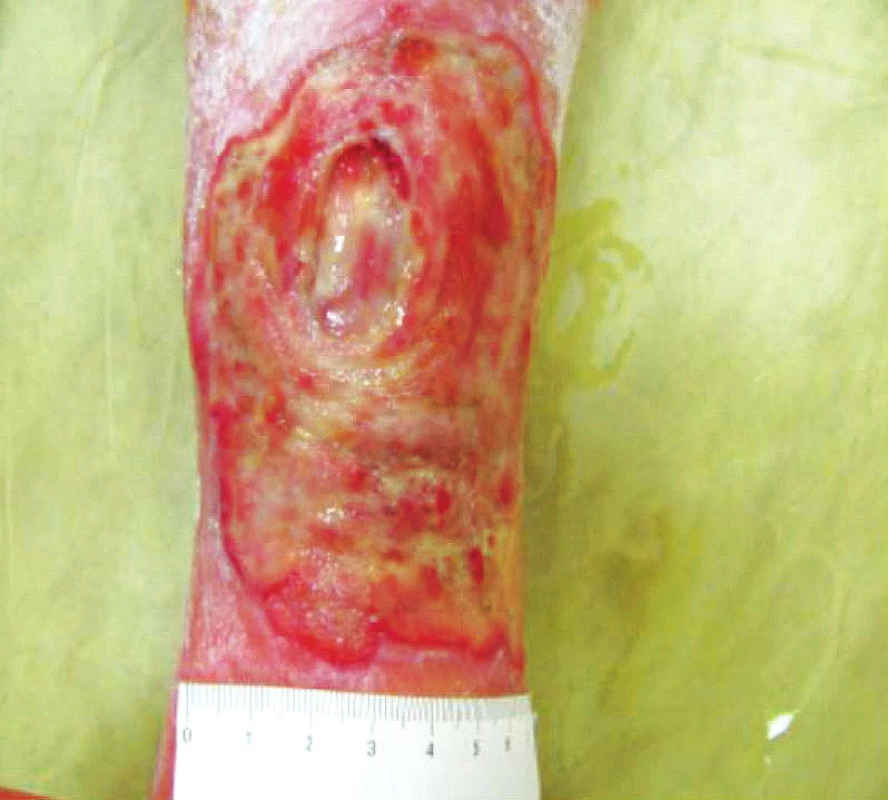
V listopadu 2015 byla přijata k hospitalizaci na Geriatrickou kliniku VFN. Z dostupných laboratorních vyšetření uvádíme: albumin 34,8 g/l, celková bílkovina 76,5 g/l, CRP 64 mg/l, Hb 111 g/l , leukocyty 8,9 x109/l, neutrofilní granulocyty 60,5 %.
Při přijetí pacientka měřila 158 cm a vážila 67 kg, BMI 26,8 kg/m2. Udávala bolesti po svěšení především LDK, po natažení na lůžko bolesti spontánně ustávaly. Pacientka je ex-kuřačka, nekouří již 2 roky. Během hospitalizace na LDK enzymaticky odlučována nekrotická tkáň (obr. 3), defekt se však nehojí, centrálně perzistuje hlubší ostře ohraničený defekt. Proto vysloveno podezření na ischemickou chorobu dolních končetin a indikována angiografie. Angiografické vyšetření 12/2015 prokázalo ICHDK s nálezem hraničně významné stenózy na zevní ilické tepně vlevo, významné stenózy v proximálním úseku a. tibialis anterior vpravo. Uzávěr a. poplitea vpravo, zbytky bércových tepen se plní přes kolaterály. Segmentární uzávěr levé AF v distálním úseku. Nález konzultován s angiology a intervenčními angiology, 1/2016 byl pacientce zaveden stent do levé arteria tibialis anterior, do terapie přidán statin. Vzhledem k lehké hypalbuminemii a předpokládaným ztrátám živin při výrazné sekreci a velikosti defektů zahájena perorální nutriční podpora formou sippingu, Cubitan 200 ml 1x denně k podpoře hojení. Použity byly tyto materiály: zpočátku Višněvského balzám na čistící fázi, Adaptic na hypergranulace, poté Mepitel a Suprasorb A. Tato komplexní léčba vedla v průběhu ledna k poměrně rychlému zlepšování lokálního nálezu, nekróza se odloučila. Při propuštění rána čistá, nepovleklá, bez přítomnosti nekrózy, velikost obou defektů 14 x 12 cm (obr. 4). Bolesti vymizely, pacientka se vrátila k chůzi o 2 francouzských holích, propuštěna zpět do domova seniorů. Pacientce bylo doporučeno pokračování v nutriční suplementaci i po propuštění.
Obr. 3. Nekrotický okrsek na defektu LDK, listopad 2015 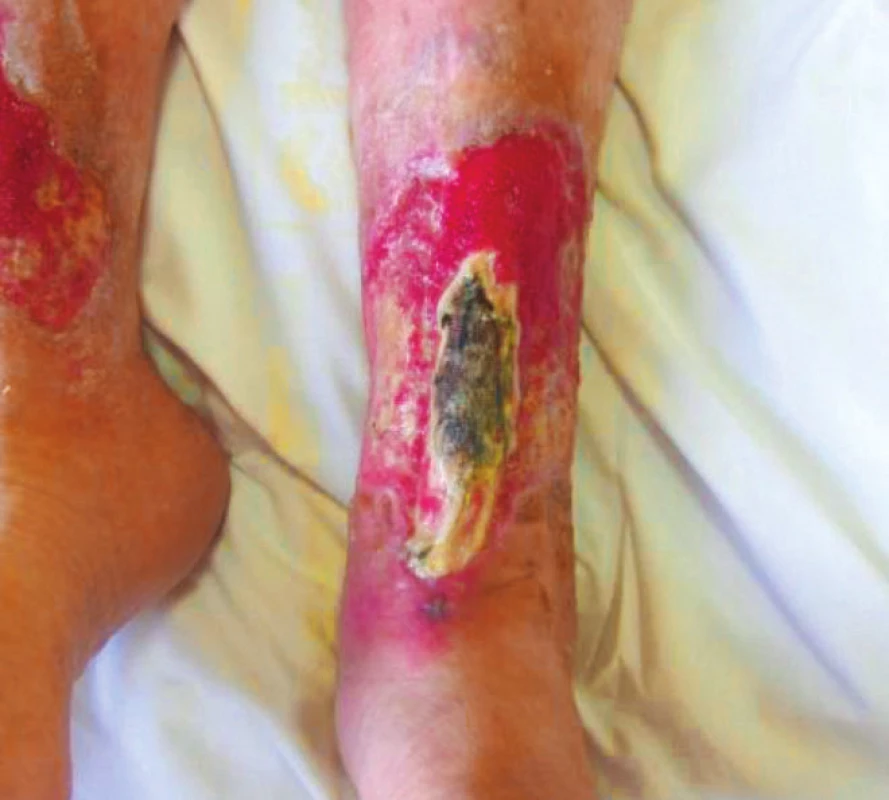
Obr. 4. Stav defektů po revaskularizačním výkonu, leden 2016 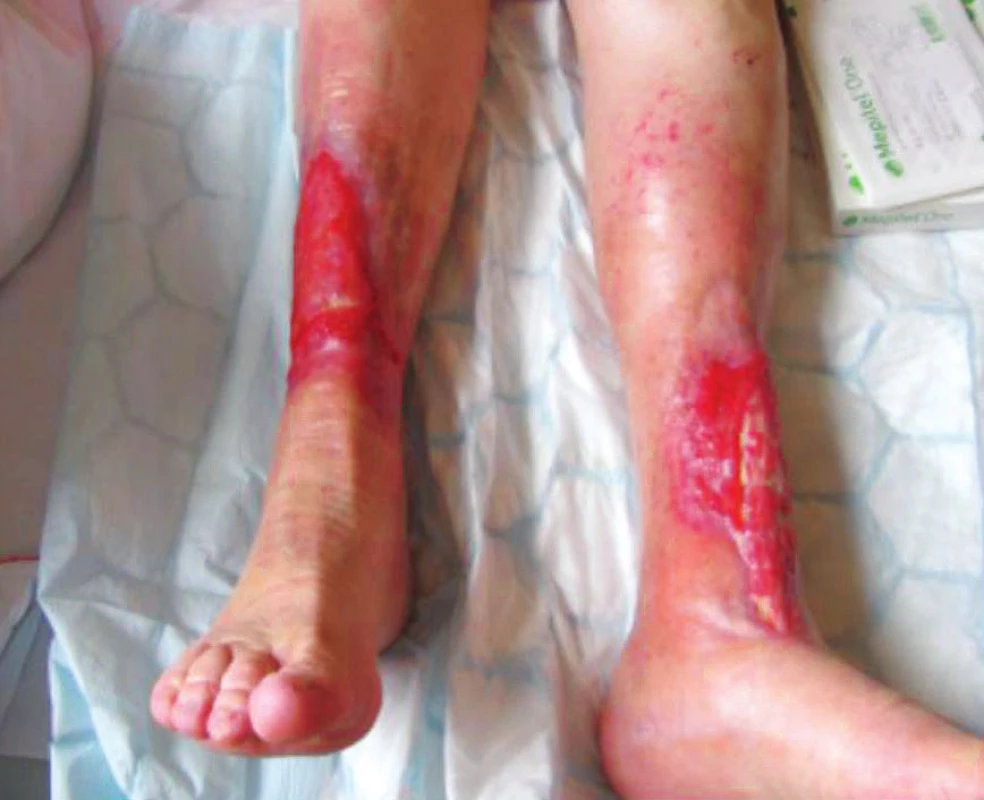
Při následující ambulantní kontrole v březnu 2016 k podpoře granulace a epitelizace aplikováno Actilite krytí (přípravek s manukamedem). Defekty se postupně zmenšovaly, i když pomaleji, než bychom očekávali. Přes doporučenou nutriční suplementaci od propuštění nebyla realizována – nutriční suplementace nebyla dále předepsána, pacientka si nutriční doplňky nechtěla platit. Od ledna 2016 došlo k váhovému úbytku 3 kg. Nutriční suplementy znovu zahájila až od července 2016 (zpočátku Fresubin protein energy 200 ml 1x denně) a pravidelně užívala následující 4 měsíce (obr. 5).
Obr. 5. Stav po 1 měsíci užívání nutričních doplňků, srpen 2016 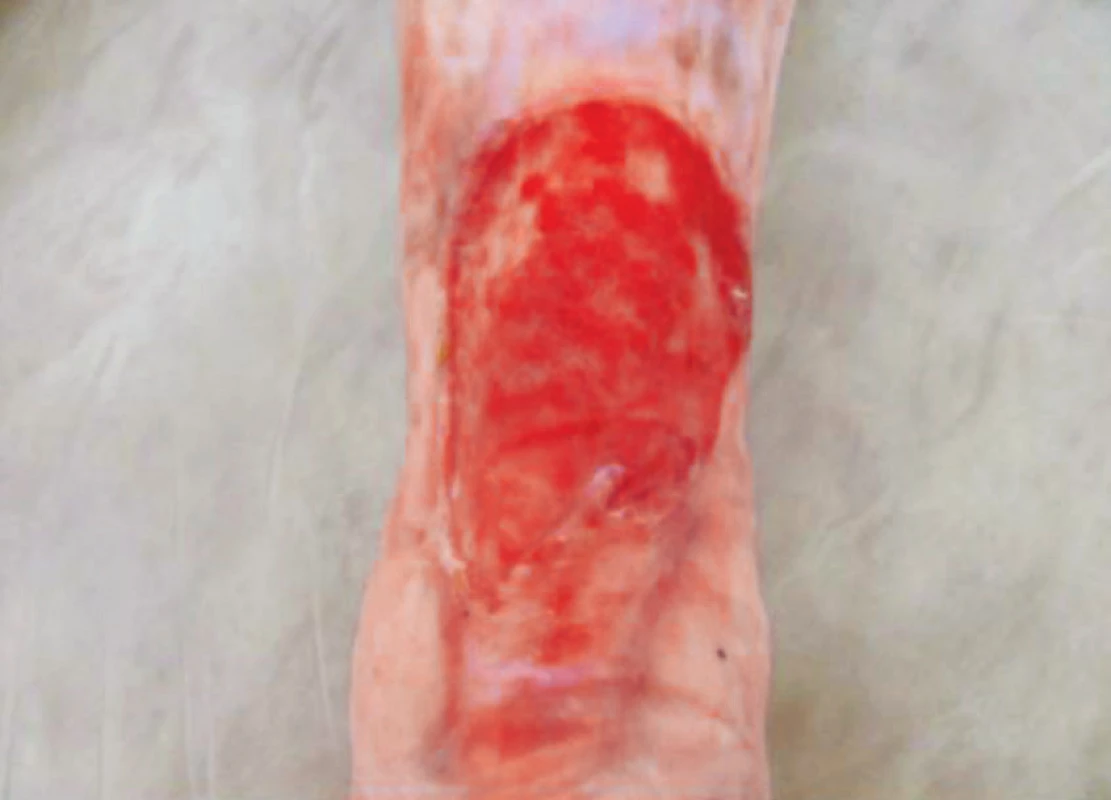
Pro riziko malnutrice při zvýšené sekreci z bércových defektů v září 2016 byla indikována a vyšetřena v nově otevřené nutriční ambulanci Geriatrické kliniky. Při vyšetření měla 66,8 kg, BMI 26,7 kg/m2, MNA 13/14 bodů. Od července nárůst hmotnosti na původní hmotnost, získala + 1,5 kg svalové hmoty. Nutriční suplementaci tolerovala velmi dobře bez vedlejších účinků. Byla doporučena denní nutriční potřeba 8500 kJ a potřeba bílkovin na 100 g. Cestou nutriční ambulance vydány recepty na Fresubin energy protein, který za měsíc změněn na Ensure plus advance, který užívala 2x denně. Za 3 měsíce užívání sippingu se defekty zmenšily na – LDK 7,5 x 6,5 cm, PDK 9 x 6,5 cm (obr. 6). Pacientka pravidelně každý měsíc docházela do nutriční ambulance, váha byla stabilní. Defekty byly ošetřovány v domově seniorů a každý měsíc pravidelně docházela na kontroly do ambulance hojení ran. Nutriční suplementace tak výrazně urychlila hojení v terénu chronické žilní insuficience i ICHDK.
Obr. 6. Zlepšení defektů po 3měsíční suplementaci, říjen 2016 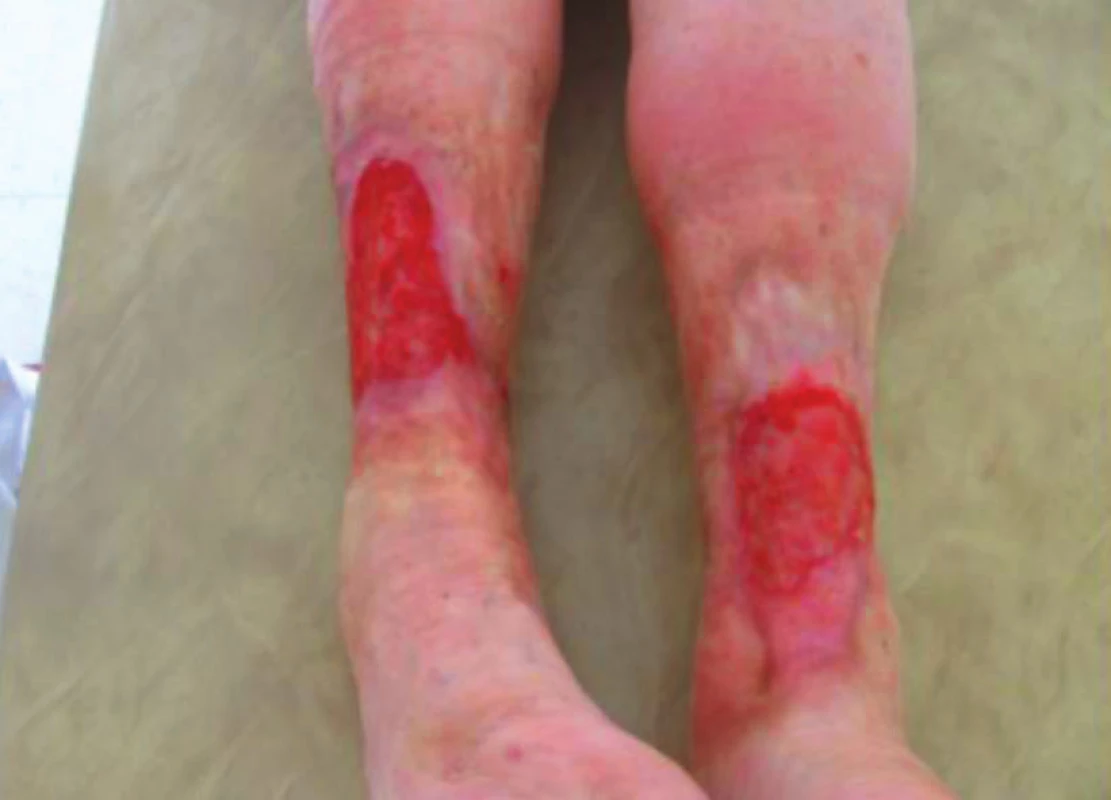
Bohužel v listopadu 2016 pacientka při kontrole s progresí defektů na obou dolních končetinách velikost LDK 12 x 13 cm, PDK 12,5 x 13 cm (obr. 7), způsobenou infekcí Pseudomonas aeruginosa. Nyní je pacientka po antibiotické terapii a jsme vlastně znovu na začátku procesu hojení ran.
Obr. 7. Defekty při infekci <i>Pseudomonas aeruginosa</i> 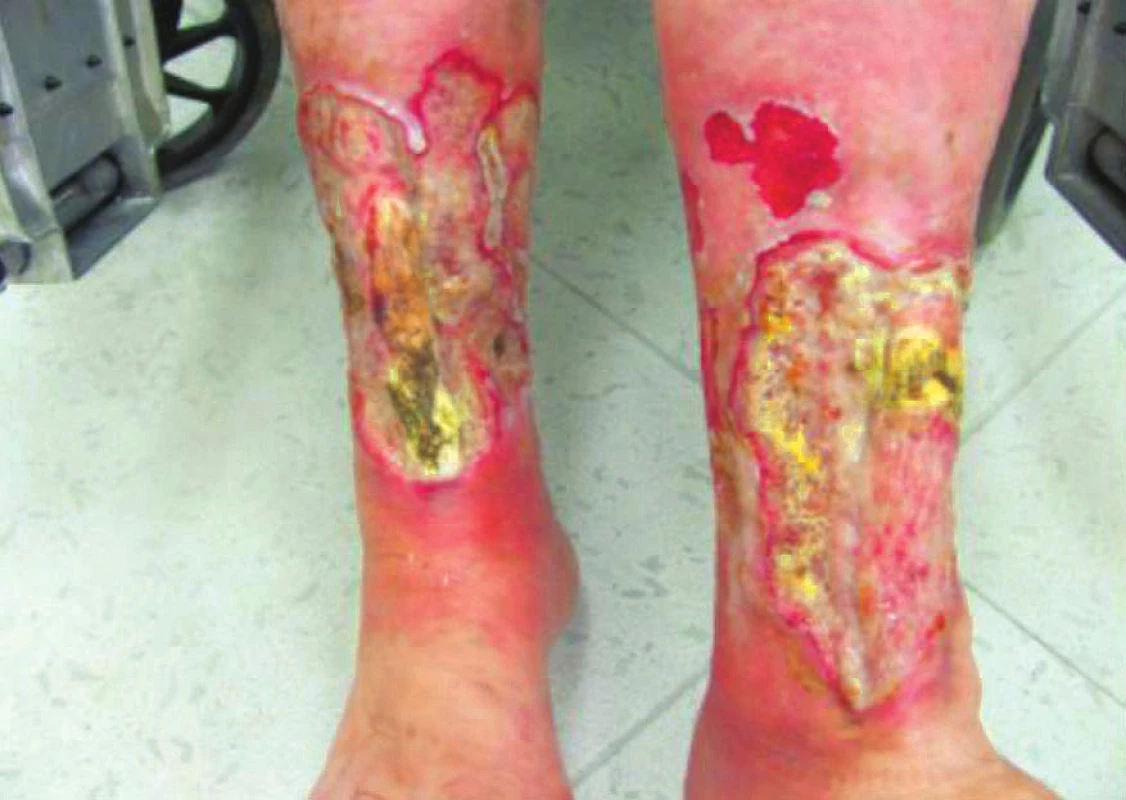
Uvedená kazuistika tak dokumentuje komplikovaný průběh chronických smíšených kožních defektů, kde komplexní léčba včetně nutriční podpory může vést k urychlení hojení rány. Bohužel v praxi je pro mnoho nemocných nutriční suplementace obtížná – praktičtí lékaři běžně neodesílají pacienty do nutriční ambulance a v řadě lokalit jsou tyto ambulance jen obtížně dostupné. Pro omezenou mobilitu je pro pacienty obtížné se dostavit na vyšetření do specializované ambulance. Proto nutriční vyšetření ještě není běžnou součástí léčby pacientů s chronickými defekty.
Kazuistika 2
Pacientka, 87 let. V osobní anamnéze uvedena: chronická renální insuficience, fibrilace síní, hypothyreóza, močová inkontinence, hypercholesterolemie. Z medikamentů užívá Letrox, Egilok, Warfarin, Spasmed a statin – název si nepamatuje. V srpnu 2016 při nastupování do metra se ji zaklínila noha mezi metrem a nástupištěm. Byla ošetřena na chirurgické ambulanci genciánovou violetí. K nám doporučena na konci října stejného roku s defektem velikosti 3 x 3,5 cm (obr. 8). Sekrece byla minimální. Na defekt byl použit Granuflex extra thin. Současně byl proveden nutriční screening. Vstupně měřila 154 cm, vážila 66 kg, BMI bylo 27,8. Byl také zhodnocen 3denní jídelníček s ohledem na skladbu potravin. Ta nebyla dostatečná, pacientka jedla malé porce 3x denně, převážně zeleninu. Nebyl dostatečný příjem. Doporoučená potřeba bílkovin byla 81g/den, denní energetický příjem 8500 kJ, proto byla navržena odpovídající dieta k prevenci malnutrice.
Obr. 8. Defekt po 3 měsících neúspěšné lokální terapie, říjen 2016 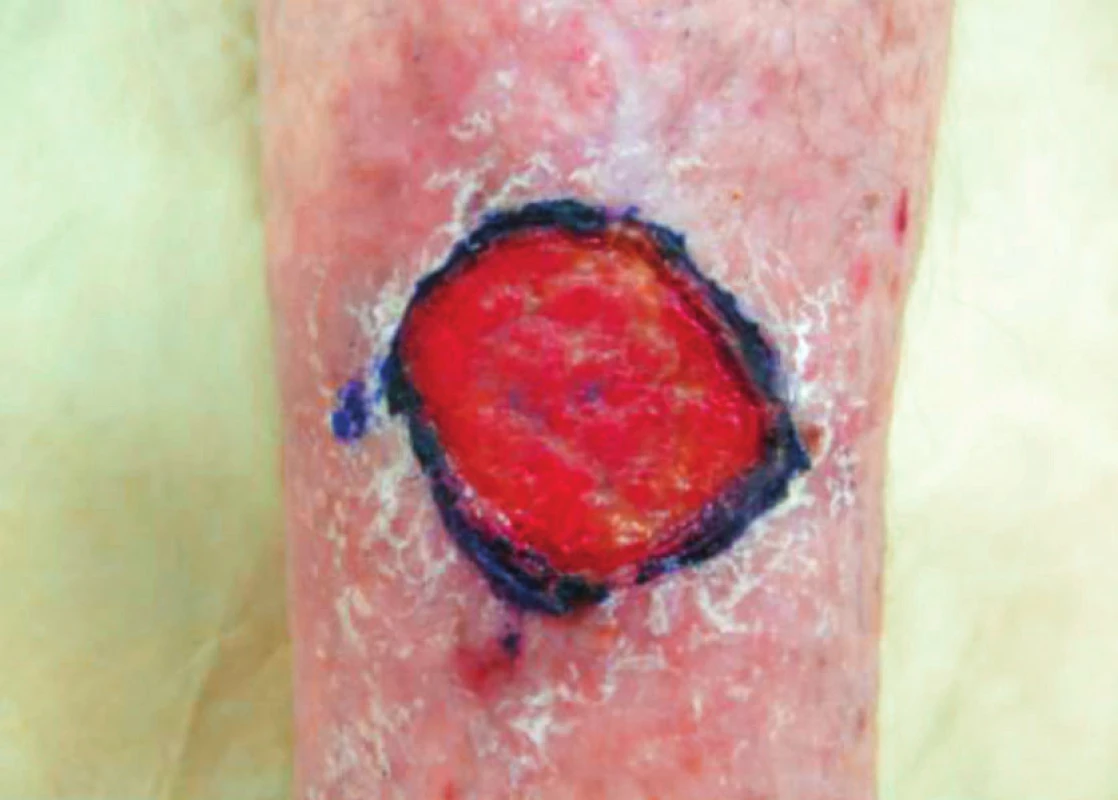
Při další kontrole pacientka přinesla 3denní jídelníček, který složením odpovídal doporučenému příjmu. Také rána se pomalu stahovala (obr. 9), nutriční suplementaci jsme proto neindikovali. Defekt se za 2,5 měsíce zcela zhojil, pacientka dál pokračuje v navržené dietě (obr. 10).
Obr. 9. Defekt za 2 měsíce po změně jídelníčku a lokální terapie, prosinec 2016 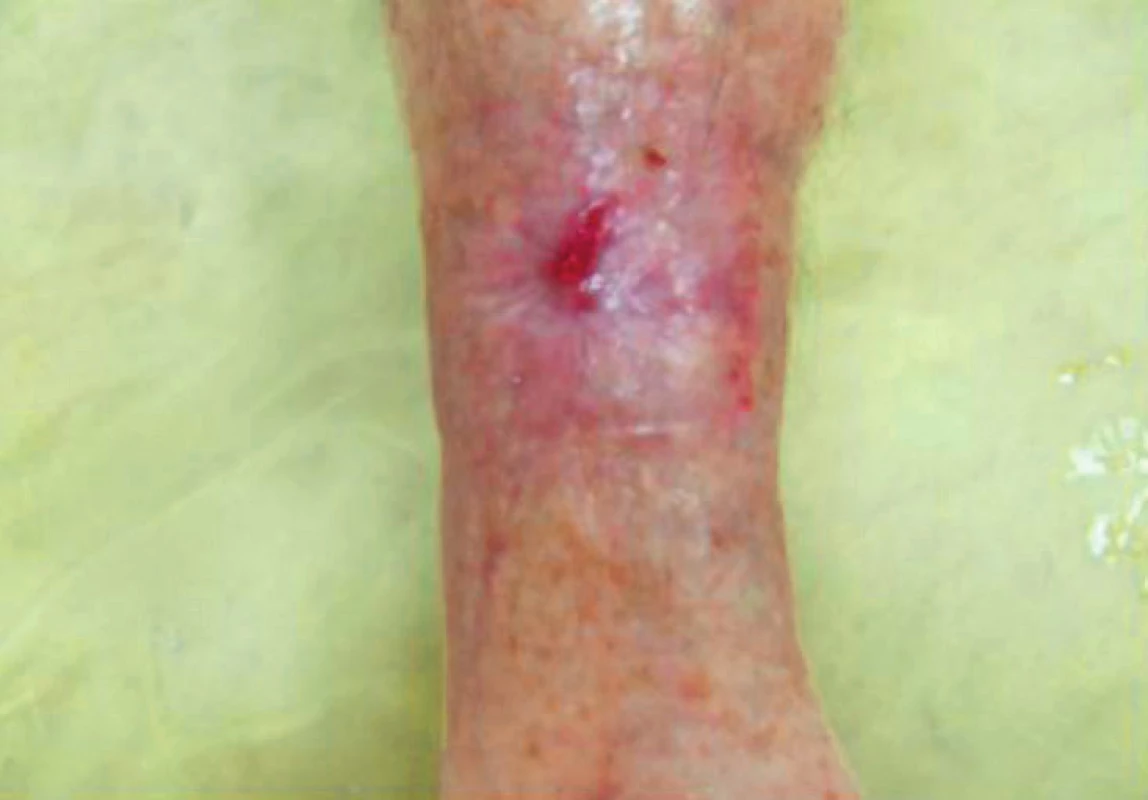
Obr. 10. Zhojený defekt po 2,5měsíční komplexní terapii, leden 2017 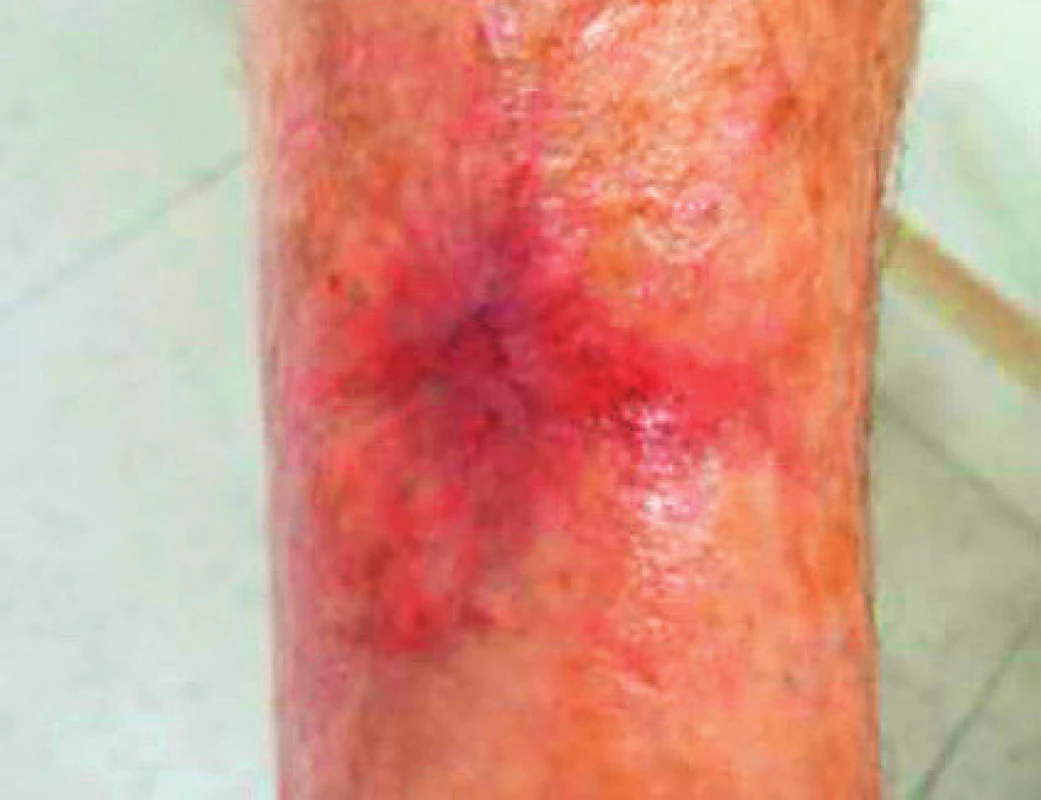
Diskuse
S přibývajícím věkem se snižuje celkový energetický výdej organismu, klesá potřeba energie. Senioři mají fyziologicky snížený pocit žízně a hladu (anorexie stáří), často u nich dochází k dehydrataci a malnutrici. To se podílí na snížení úspěšnosti léčby hojení ran. Dalšími rizikovými faktory nízkého příjmu potravy jsou např. špatný stav chrupu, poruchy žvýkání a polykání. Na malnutrici se ale podílí i faktory celkové, především polypragmazie, hypoxie, infekce, nádorové onemocnění a metabolické poruchy jako diabetes mellitus, psychiatrická nemocnost (demence, deprese)(3,4). Významné jsou i sociální a ekonomické faktory, např. omezená spotřeba „zdravých potravin“ z důvodu vyšší ceny. A samozřejmě záleží i na vlastním kožním defektu – v jaké fázi procesu hojení se rána nachází, jak veliká je sekrece, velikost defektu atd.(5)Faktory, které ovlivňují proces hojení ran, jsou uvedené v tabulce 1. Uvádí se, že malnutrice způsobuje podobné problémy při hojení ran jako stoupající věk (zpožděná neovaskularizace, prodloužená zánětlivá fáze apod.)(3).
Tab. 1. Faktory, které negativně ovlivňují proces hojení ran 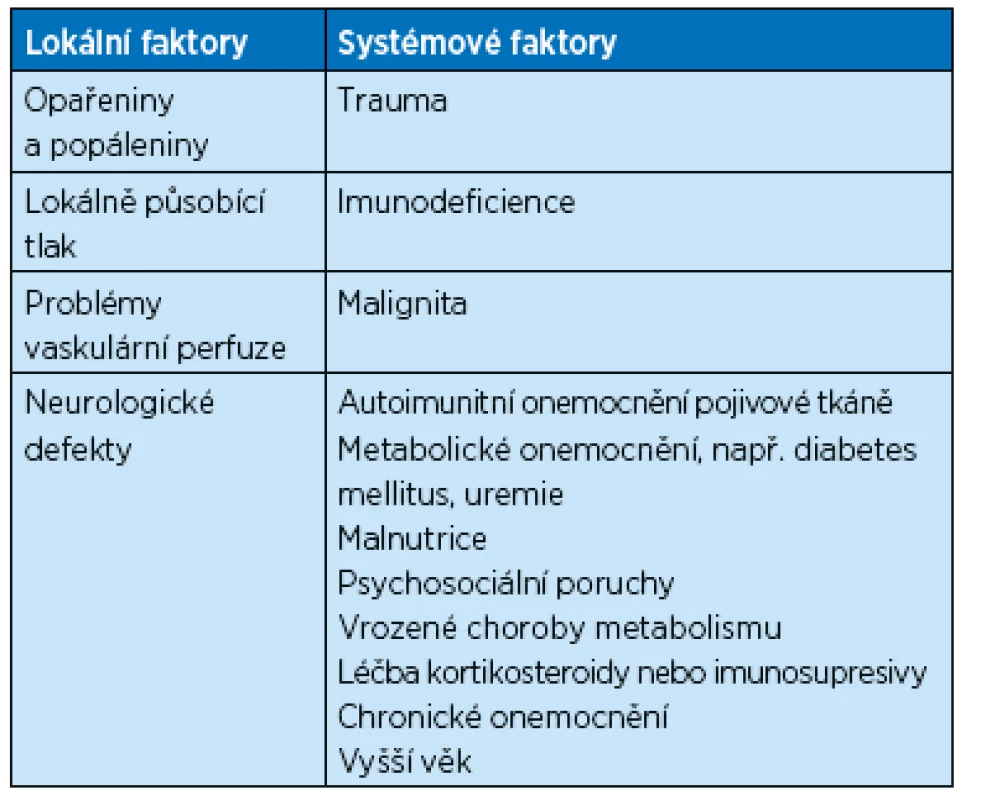
S přibývajícím věkem dochází k řadě změn v kůži a podkoží, kůže se ztenčuje, pacient se stává náchylným k poruše integrity kůže, a to i díky malým inzultům(6). Příčiny se hledají a je několik teorií: např. ztráta telomer či akumulace progerinu v kůži, které mohou zapříčinit proces stárnutí(7). Ve stáří je alterovaná zánětlivá odpověď při hojení ran díky opoždění migrace buněk a živin do rány(3).
Základním nutričním vyšetřením je měření BMI, přičemž je prokázána menší úmrtnost při nadváze (BMI 25–30) a obezitě I. stupně (BMI 30–35) než při normální hmotnosti(BMI 18,5–25). Tento paradox obezity je znám již poměrně dlouho. Z nedávných prací ale vyplývá, že snížení mortality je doloženo jen u seniorů, kteří mají zvýšenou hodnotu BMI a zároveň mají dostatečné procento svalové hmoty(5). U špatně se hojících defektů a ran s vysokou sekreční aktivitou doplňujeme dalšími nutričními testy (např. MNA, SGA) a podrobnějším laboratorním vyšetřením. Není-li pacient schopen adekvátního perorálního příjmu nebo pokud ani náležitou stravou nepokryje nároky na nutriční potřebu při hojení ran, je nutno přistoupit k dalším možnostem, které máme k dispozici. Jedná se především o perorální výživové doplňky, v indikovaných případech připadají v úvahu i sondová enterální a parenterální výživa.
Chronická rána, nutriční aspekty hojení ran
Rána je definována jako porucha integrity kůže a podkožních struktur nebo samotné kůže. Termín chronická rána je sice často používaný, ale bohužel není zcela jasně definován. Podle Wilda se jedná o ránu, která se hojí déle než 6 týdnů. Fáze hojení ran nejsou v předem daném čase ukončeny a mohou stagnovat nebo se posunout zpátky do předešlé fáze(2). Proces hojení ran se prezentuje jako série událostí, které začínají ihned po poruše kontinuity kůže a probíhají měsíce, někdy i roky. Jedná se o dynamický proces, který je rozdělen do 3 fází – zánětlivé, proliferační a remodelační fáze (někteří autoři – např. Stechmiller, udávají 4 fáze, protože zánětlivou fázi ještě rozdělují na koagulační a samotnou zánětlivou fázi)(4, 8).
Nejvíce chronických ran se nachází v zánětlivé fázi, pro kterou je charakteristická nejprve reflexivní vasokonstrikce, kdy dochází ke vzniku sraženiny (samotná koagulační fáze podle některých autorů). Zde se uplatňuje vliv vitaminu K. Poté nastupuje vazodilatace, kdy se do rány stěhují mononukleární buňky, zvláštně neutrofily, které bojují s bakteriálním přemnožením a brání vzniku infekce. Začíná se tvořit kolagen. Z nutriční stránky je důležitý zejména dostatečný přísun energie a bílkovin, vitamínů skupiny A, C, E a selenu. Tato fáze by v případě ideální rány měla trvat asi 4 dny.
V proliferativní fázi probíhá epitelizace, angiogeneze, granulace, formuje se novotvořená tkáň, a to i díky zvyšující se produkci kolagenu. Nutričně bychom měli zajistit dostatek energie, bílkovin, vitaminů skupiny A, B6, C, mědi, železa a zinku. Důležité jsou také antioxidanty. Tato fáze trvá kolem 1 týdne. V remodelační fázi se kolagen stává pevnější v tahu, formuje se definitivní jizevnatá tkáň. V této fázi se nejvíce zapojuje zinek, železo a vitamin C. Samozřejmostí je zvýšená potřeba energie a bílkovin(4, 8, 9).
Nutriční aspekty
Proces hojení ran klade velké nároky na denní potřebu energie a živin, a to díky zvýšenému metabolickému obratu, vzestupu buněčné proliferace, syntéze proteinů a enzymové aktivitě. U mladších jedinců tělo využívá substráty z tělesných zásob. S přibývajícím věkem však funkční rezervy organismu klesají vzhledem k nižšímu pocitu hladu a žízně. A nejedná se jen o zvýšený přísun energie a bílkovin. Pacienti s chronickým defektem mají i zvýšenou potřebu určitých minerálů, stopových prvků a vitaminů (tab. 2)(1, 4). Záleží také na velikosti sekrece a velikosti defektu. Čím je sekrece a celková plocha rány větší, tím větší je i potřeba nutriční intervence z důvodu větších ztrát živin. Z tohoto argumentu vyplývá i různá potřeba živin v každé fázi hojení ran. Jelikož největší sekreci nacházíme v zánětlivé fázi, tak i největší nutriční nároky se nacházejí právě v zánětlivé fázi procesu hojení ran(9). Důležitý je i dostatečný přísun tekutin. Pokud je pacient dehydratovaný, snižuje se srdeční výdej a klesá i perfuze rány. To zapříčiňuje nedostatečný přísun živin a dalších látek nutných pro proces hojení ran.
Tab. 2. Doporučený příjem vybraných živin u seniorů s přihlédnutím na přítomnost chronického defektu(10, 11) 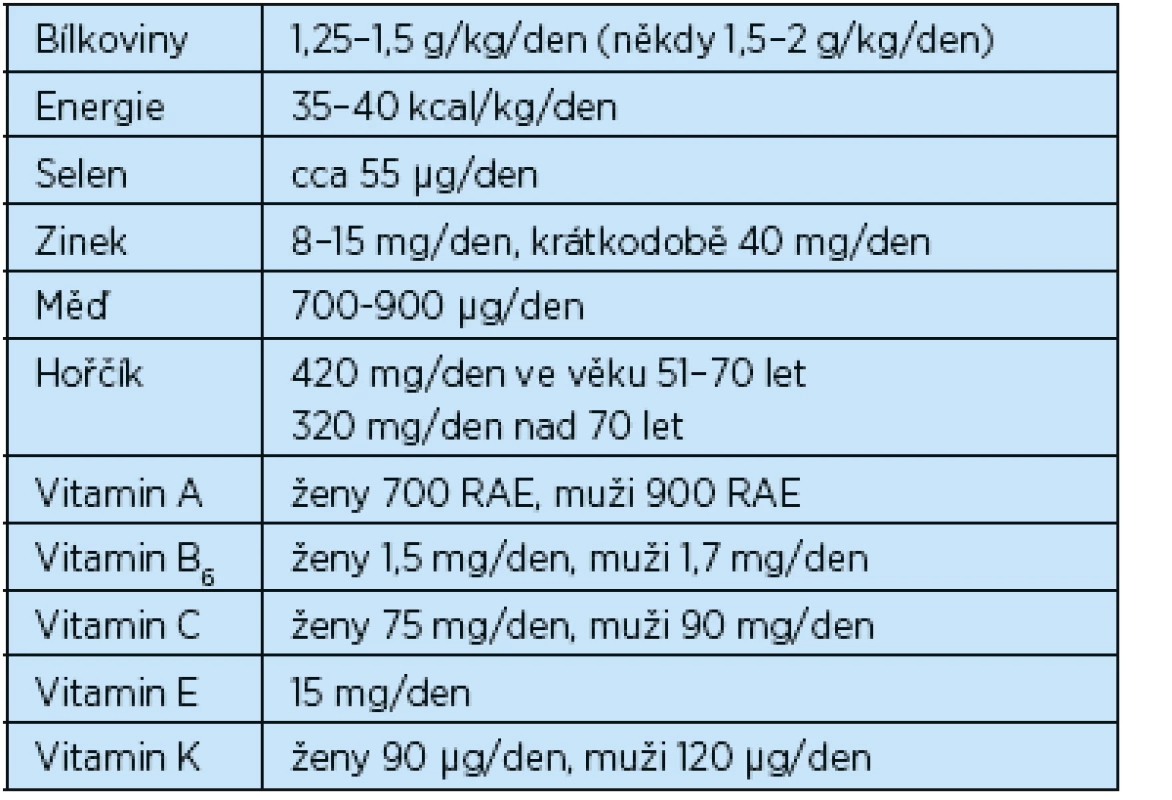
RAE = retinol activity equivalent (1 RAE = 1 mg retinolu) Denní potřeba energie pro zdravého člověka je 35 kcal/kg tělesné hmotnosti/den. Proces hojení ran u geriatrických pacientů je ale více náročný na energii, někteří autoři zmiňují 35–40 kcal/kg/den. Proteiny jsou důležité pro vývoj lymfocytů, leukocytů, monocytů, makrofágů a produkci kolagenu(4).
S přibývajícím věkem a za přítomnosti chronického defektu potřeba bílkovin stoupá. Doporučuje se příjem 1,25–1,5 g/kg/den, ve speciálních případech (výrazný katabolický stav) až 1,5–2 g proteinu/kg/den. Více se ale již nedoporučuje pro větší riziko dehydratace a renální insuficience(9). Předmětem výzkumů se v posledních letech stává úloha tzv. speciálních aminokyselin v léčbě chronických ran. Jedná se především o glutamin a arginin. Při jejich výzkumu byl mimo jiné zjištěn vliv na proliferaci kolagenu, zlepšují dodávku živin, imunitní reakce, stimulují zánětlivou odpověď(2, 9). I když teoreticky (v experimentu) byl pozitivní účinek na hojení ran prokázán, klinické studie tento přínos zatím nepotvrdily(4).
Lipidy jsou hlavní komponentou buněčných membrán, pomáhají zahajovat zánětlivou fázi hojení ran. Lokální aplikace omega-3 mastných kyselin zvyšuje proces hojení ran(4). Ale bohužel role lipidů v procesu hojení ran není ještě zcela prozkoumána(9).
Je studován vliv antioxidantů na proces hojení ran. Nejvíce studované antioxidanty jsou vitaminy A, C, E, zinek, měď, selen a ginkgo biloba(8). Pro syntézu kolagenu jsou důležité železo, hořčík, vitamin C a další látky. Měď je zodpovědná za pevnost kolagenu. Enzymy regulující proces hojení ran obsahují zinek, hořčík i měď. Zinek slouží jako kofaktor mnoha enzymatických reakcí(9). Doporučený denní příjem je 8–15 mg, krátkodobě až 40 mg/den po dobu 10 dní, přičemž dieta bohatá na proteiny zároveň obsahuje dostatečné množství zinku. Absorpce zinku je však snížena u vegetariánské diety, protože obsahuje velké množství vlákniny, která absorpci snižuje(10). Excesivní přísun zinku snižuje absorpci železa a mědi, a vede tedy k jejich deficienci.(9) Plošná substituce zinku a železa není ale doporučena, jen v případě již preexistující deficience(4, 12). Diagnózu deficitu zinku nám pomůže diagnostikovat i klinický obraz. Pozorujeme průjem, poruchy integrity kůže. Je snížen u malabsorpčních stavů(9).
Vitamin A hraje důležitou roli během zánětlivé fáze hojení ran. Stimuluje imunitní systém, epitelizaci, zvyšuje produkci kolagenu. Suplementace vitaminu A je indikována u polymorbidních pacientů s akutními či chronickými defekty(9). Vitamin C je důležitý pro hydroxylaci prolinu, který je komponentou kolagenu. Dále se zapojuje do imunitních funkcí, podporuje mitózu buněk, formaci kapilár. Pomáhá absorpci železa z trávicího traktu.
V tabulce 2 jsou uvedené doporučené denní příjmy (recommended daily dosis, RDD) vybraných živin pro seniorskou populaci a tabulka 3 informuje o složení živin u orálních suplementačních prostředků, které se používají při hojení ran pro zvýšený obsah bílkovin.
Tab. 3. Přehled nutričních doplňků vhodných pro hojení ran a obsah vybraných živin (ve 100 ml) – převzato z příbalových informací, SUKL 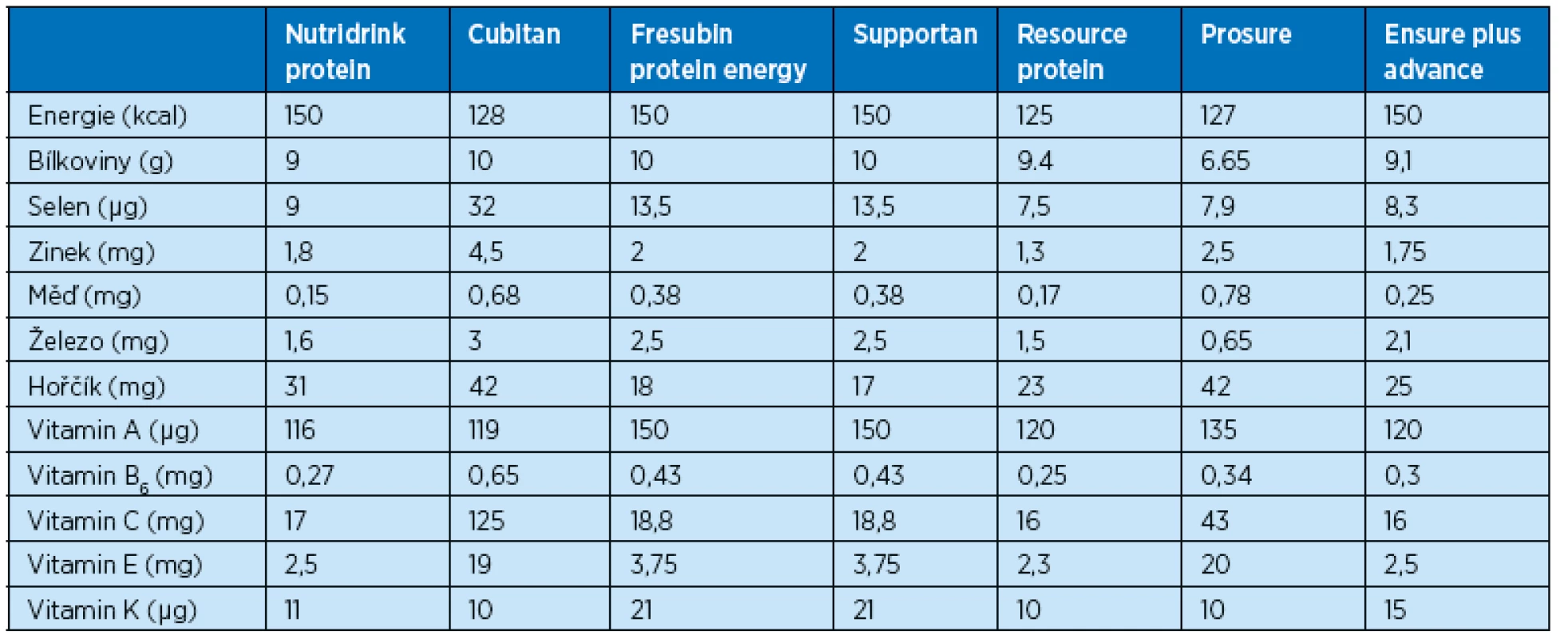
Závěr
V našem článku jsme na 2 kazuistikách chtěli poukázat na nutriční problematiku a zvýšenou potřebu živin v léčbě hojení ran u seniorů. Ve většině případů je příjem per os nedostatečný, proto je nutno na zvýšenou potřebu živin u seniora s chronickými defekty myslet a včas zasáhnout, ať jen úpravou jídelníčku nebo nutričními suplementy.
Autoři prohlašují, že nejsou ve střetu zájmů a publikace článku nebyla podpořena farmaceutickou firmou.
MUDr. Monika Mašková,
MUDr. Tomáš Richter, Ph.D.
Geriatrická klinika 1. LF UK a VFN
MUDr. Monika Mašková
e-mail: monama@centrum.cz
Promovala v roce 2012 na 1. LF UK. Od roku 2015 pracuje na Geriatrické klinice 1. LF UK a VFN v Praze na lůžkovém oddělení a v Ambulanci pro hojení ran a Ambulanci nutrice Geriatrické kliniky. Je zařazena do předatestační přípravy v oboru geriatrie.
Zdroje
1. McDaniel J, Kemmer K, Rusnak S. Nutritional profile of older adults with chronic venous leg ulcers: a pilot study. Geriatric Nursing 2015; 36(5): 381–386.
2. Grofová Z. Výživa, malnutrice, dekubity a hojení ran. Lékařské listy 2009; 58(18): 30–32.
3. Guo S, Dipietro Luisa A. Factors affecting wound healing. Journal of dental research 2010; 89(3): 219–229.
4. Wild T, et al. Basics in nutrition and wound healing. Nutrition 2010; 26(9): 862–866.
5. National Academies of Sciences, Engineering, and Medicine; Health and Medicine Division. Nutrition across the lifespan for healthy aging: proceedings of a workshop in brief. Washington (DC): National Academies Press 2016; Dostupné z: www.ncbi.nlm.nih.gov/books/NBK409023
6. Bowker L, Price J, Smith S. Oxford Handbook of Geriatric Medicine. OUP Oxford 2012.
7. Robert L, Labat-Robert J, Robert A. Physiology of skin aging. Pathologie Biologie 2009; 57(4): 336–341.
8. Campos A, Groth A, Branco A. Assessment and nutritional aspects of wound healing. Current opinion in clinical nutrition & metabolic care 2008; 11(3): 281–288.
9. Stechmiller J. Understanding the role of nutrition and wound healing. Nutrition in clinical practice 2010; 25(1): 61–68.
10. Lansdown A, et al. Zinc in wound healing: theoretical, experimental, and clinical aspects. Wound repair and regeneration 2007; 15(1): 2–16.
11. CHernoff R, et al. Geriatric Nutrition. Jones & Bartlett publishers 2013.
12. Sriram K, Vassyl A. Micronutrient supplementation in adult nutrition therapy: practical considerations. Journal of parenteral and enteral nutrition 2009.
Štítky
Geriatria a gerontológia Praktické lekárstvo pre dospelých Protetika
Článek Divertikulární nemocČlánek EditorialČlánek XXI. Zlínský geriatrický denČlánek Nehojace sa rany
Článok vyšiel v časopiseGeriatrie a Gerontologie
Najčítanejšie tento týždeň
2017 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Konzervativní léčení seniorů s chronickým onemocněním ledvin ve stadiu CKD 3b a vyšším
- Divertikulární nemoc
- Hodnocení kvality života u pacientů vyššího věku se sarkopenií: vývoj a validace české verze dotazníku SarQoL®
- Editorial
- Nečekané „vyléčení“ u geriatrického pacienta s makroadenomem hypofýzy
- Nutriční potřeba při léčbě chronických defektů u geriatrického pacienta
-
Z historie péče o chudé a chronicky nemocné v Praze.
Chudobinec sv. Bartoloměje a Chorobinec Na Karlově. - Nová evropská doporučení pro management pacientů vyššího věku s chronickým onemocněním ledvin ve stadiu 3b a vyšším (eGFR < 45 ml/min/1,73 m2)
- Ohlédnutí za hradeckým gerontologickým kongresem
- XXI. Zlínský geriatrický den
- Stáří je nepřetržitá série ztrát
- Nehojace sa rany
- Geriatrie a Gerontologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Divertikulární nemoc
- Konzervativní léčení seniorů s chronickým onemocněním ledvin ve stadiu CKD 3b a vyšším
- Hodnocení kvality života u pacientů vyššího věku se sarkopenií: vývoj a validace české verze dotazníku SarQoL®
-
Z historie péče o chudé a chronicky nemocné v Praze.
Chudobinec sv. Bartoloměje a Chorobinec Na Karlově.
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



