-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Nová evropská doporučení pro management pacientů vyššího věku s chronickým onemocněním ledvin ve stadiu 3b a vyšším (eGFR < 45 ml/min/1,73 m2)
Nová evropská doporučení pro management pacientů vyššího věku s chronickým onemocněním ledvin ve stadiu 3b a vyšším (eGFR < 45 ml/min/1,73 m2)
Physicians across discipline see older patients with advanced chronic kidney disease (CKD) and are facing difficult decisions regarding future treatment of these patients including decision if/if not to start dialysis. Therefore we present to Czech readers in a shorter form the recently published European guidelines on management of older patients with advanced CKD stage 3b and higher. New Guidelines focus on 6 problem areas of diagnosis and treatment: (1) estimation of GFR for classification and dose adaptation; (2) prognosticating rate of progression to end-stage renal disease; (3) prognosticating risk of death in medium term periods; (4) assessment of functional status and strategies to improve it; (5) assessment of nutritional status and strategies to improve it; (6) appraisal of benefits and drawbacks of renal replacement therapy versus conservative treatment. Based on thorough evaluation of scientific evidence the recommendations for clinical practice were formed. We do believe that knowledge of CKD differences in seniors will translate into improved medical care for these patients.
Keywords:
Ageing – chronic kidney disease (CKD) 3b and higher – CKD management – frailty – guidelines
Autoři: E. Topinková; V. Teplan
Vyšlo v časopise: Geriatrie a Gerontologie 2017, 6, č. 1: 5-15
Kategorie: Doporučené postupy
Souhrn
Lékaři napříč řadou oborů se stále častěji setkávají se staršími pacienty s pokročilým renálním postižením (Chronic Kidney Disease, CKD) a jsou postaveni před obtížné rozhodování o další léčbě těchto pacientů včetně rozhodování o ne/zahájení dialyzační léčby. Proto ve zkrácené formě představujeme českému čtenáři nově publikovaná evropská doporučení pro management starších pacientů s chronickou renální insuficiencí ve stadiu 3b a vyšším. Guidelines se zaměřují na 6 problémových okruhů diagnostiky a léčby pokročilého renálního postižení u starších osob: (1) výpočet odhadované eGFR pro klasifikaci CKD a dávkování léčiv; (2) prognózování progrese do konečné fáze renálních onemocnění; (3) prognózování úmrtí ve střednědobém časovém horizontu; (4) zhodnocení funkčních schopností a strategie k jejich zlepšení; (5) zhodnocení nutričního stavu a strategie k jeho zlepšení; a nakonec (6) posouzení přínosu a rizika náhrady funkce ledvin (renal replacement therapy, RRT) ve srovnání s konzervativní léčbou. Na základě vyhodnocení kvality vědeckých důkazů byla formulována doporučení pro klinickou praxi. Věříme, že znalost odlišností CKD u seniorů přispěje ke zlepšení péče o tyto pacienty.
Klíčová slova:
stárnutí – chronické onemocnění ledvin stadium 3b a vyšší – frailty – guidelinesÚvod
Stárnutí ledvin je provázeno řadou morfologických změn, které postihují glomeruly (globální glomeruloskleróza), tubuly, intersticium i cévy. Ke klinicky významným morfologickým změnám dochází již od páté dekády, které jsou u starších osob doprovázeny změnami ve funkci ledvin, tj. poklesem glomerulární filtrace, poklesem koncentrační schopnosti ledvin, změnami tubulárního transportu sodíku a draslíku a poklesem acidifikační schopnosti ledvin(1,2). Glomerulární filtrace klesá již od 40. roku věku asi o 1 ml/min ročně. Ve věku nad 80 let tak průměrná hodnota glomerulární filtrace dosahuje pouze 50 % hodnot ve srovnání s populací 20–30letých(3). Uvedené strukturální změny ledvin jsou dále potencovány a urychlovány řadou onemocnění s vysokým výskytem ve stáří – hypertenzí, diabetem, hyperlipidemií, kardiální insuficiencí, ale i lékovými vlivy. Funkční změny podmíněné stárnutím a přidruženou nemocností jsou příčinou, proč u seniorů dochází při relativně malém provokujícím inzultu k významným patologickým změnám vnitřního prostředí. Jde především o zvýšení sérové koncentrace kreatininu (SKr), podle níž se kalkuluje glomerulární filtrace (GFR, glomerular filtration rate).
V běžné klinické praxi je sérová koncentrace kreatininu (SKr) využívána pro posouzení úrovně renální funkce. Je známo, že SKr stoupá v hyperbolické závislosti na poklesu glomerulární filtrace. Posouzení stupně snížení glomerulární filtrace (GFR) pouze na podkladě SKr je proto nepřesné, protože SKr může překračovat horní hranici normy až při významném poklesu GFR o 50 %. Hodnoty SKr tak i přes klesající GFR mohou dlouho zůstávat v normálním rozmezí zejména u seniorů s nízkým příjmem bílkovin a potravy obecně a s významně sníženým objemem svalové hmoty (sarkopenií) v důsledku nižší produkce kreatininu. Senzitivita SKr pro odhalení snížené GFR je malá a na podkladě SKr nelze vůbec poruchu GFR kvantifikovat. Naproti tomu, když je u vyšetřovaného jedince hodnota SKr vysoká, je velmi pravděpodobné, že hodnota GFR je snížena. Specificita SKr je tedy relativně vysoká, ale opět nedovoluje přesněji kvantifikovat stupeň snížení GFR.
V posledních letech byly vypracovány matematické metody, které pouze na podkladě SKr, bez nutnosti kvantitativního sběru moči s přihlédnutím k věku, pohlaví ad. antropometrickým údajům umožňují přesnější odhad stupně snížení GFR. V poslední době je často používán vzorec MDRD, který byl navržen studií Modification of Diet in Renal Disease(4). Tento vzorec kalkuluje pouze s věkem, pohlavím a rasou. Jeho nevýhodou je skutečnost, že odhadovaná (vypočtená) GFR koreluje s přesně změřenou GFR teprve při poklesu pod 60 ml/min/1,73 m2. U jedinců s mírným poklesem GFR v intervalu 60–90 ml/min/1,73 m2 je odhad GFR nepřesný. V posledních letech byly proto navrženy další vzorce, například CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration) s cílem zpřesnit odhadovanou eGFR již při mírném poklesu skutečné GFR(5). V současnosti se pro výpočet eGFR používají také vzorce vycházející ze stanovení sérové koncentrace cystatinu C (SCyst). Výsledky řady prací totiž ukazují, že SCyst při poklesu GFR reaguje zvýšením rychleji ve srovnání s SKr. Posledním návrhem je vzorec, který se snaží vyjádřit pokles GFR na podkladě současného stanovení SKr a SCyst(6). Všechny uvedené vzorce se v literatuře označují jako eGFR (estimated Glomerular Filtration Rate). Podmínkou pro jejich použití je také stabilizovaná hodnota SKr. Uvedené vzorce pro výpočet eGFR jsou nepochybně přínosné, nejsou však vhodné v situacích, kdy potřebujeme znát přesnou hodnotu GFR anebo u akutního selhání ledvin. Při interpretaci výsledků musíme přihlížet i ke skutečnosti, že k významnému zvýšení SKr u starých osob dochází i při zhoršené perfuzi ledvin při dehydrataci a/nebo vazomotoricky podmíněným poklesem intraglomerulárního tlaku způsobeným léky (ACE inhibitory, sartany, nesteroidní antirevmatika). Výchozí hodnoty SKr jsou přitom často mírně zvýšené v důsledku stářím podmíněné glomerulosklerózy. Malá funkční rezerva je pak zodpovědná za významný vzestup SKr.
Se stárnutím populace však narůstá i počet osob s chronickým postižením ledvin (CKD, chronic kidney disease) včetně nemocných, u nichž jde již o závažné postižení renálních funkcí s eGFR pod 45 ml/min/1,73 m2 (dle klasifikace CKD stadium 3b). Tito nemocní jsou ohroženi další progresí renální insuficience a je jim třeba poskytnout zdravotní péči založenou na vědeckých důkazech. Ukazuje se však, že není dostatek vědeckých studií podporujících klinické rozhodování u těchto pacientů, často s další chronickou nemocností, s geriatrickými syndromy a křehkostí, například o tom, jak agresivní má být antihypertenzní léčba, o efektivitě dialyzační léčby a rozhodnutí, kdy ji zahájit apod. Proto v roce 2013 doporučila European Renal Best Practice (ERBP) přípravu guidelines s cílem zlepšit management starších pacientů se závažným postižením ledvin, které byly publikovány v listopadu 2016. Guidelines(7) „Clinical Practice Guideline on management of older patients with chronic kidney disease stage 3b or higher (eGFR < 45 ml/min/1,73 m2)“ jsou určeny pro lékaře všech odborností, především PL, internisty, chirurgy a další, kteří pečují o pacienty starší 65 let s chronickým onemocněním ledvin ve stadiu 3b a vyšším podle klasifikace Kidney Disease: Improving Global Outcomes (KDIGO)(3,8). Tato klasifikace vycházející z hodnot GFR je uvedena v tabulce 1.
Tab. 1. Stadia CKD podle výše glomerulární filtrace, klasifikace KDIGO Kidney Disease: Improving Global Outcomes (podle3, 8) 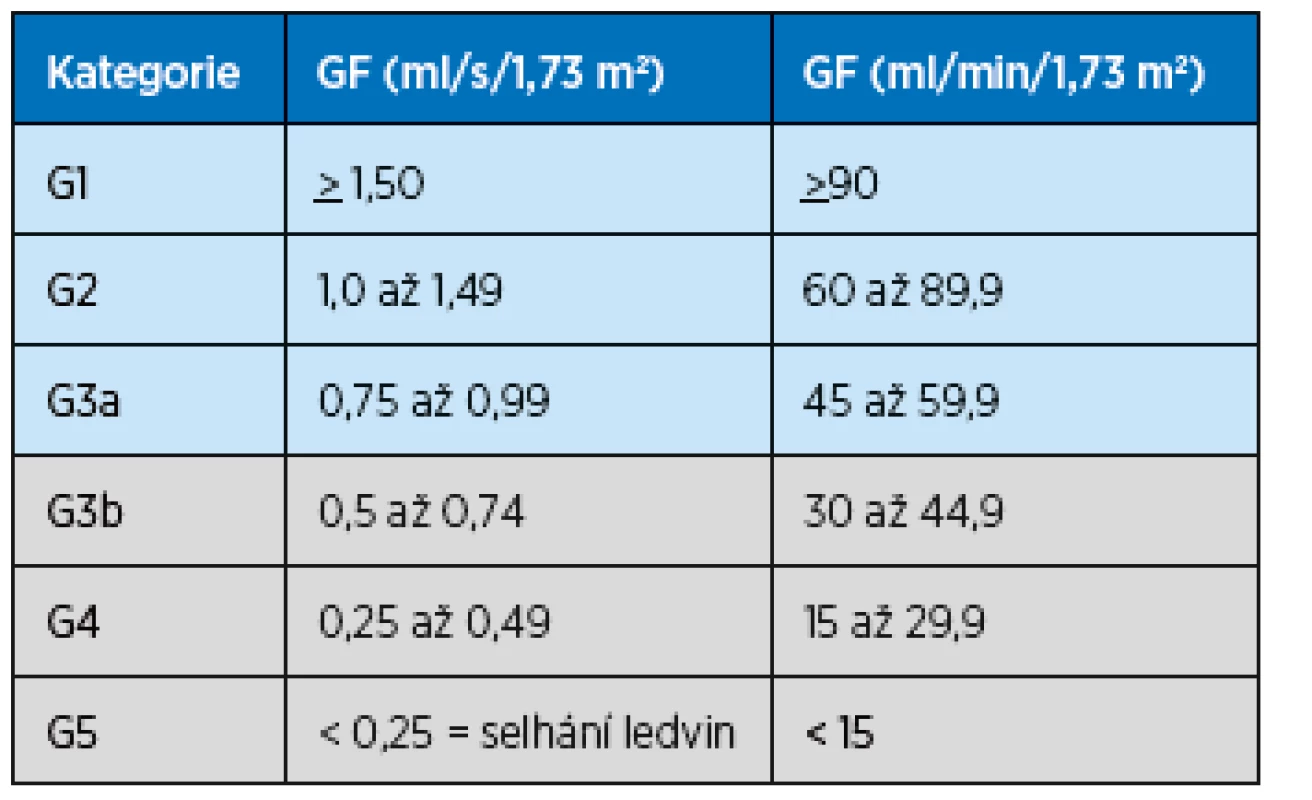
Šedá pole označují stadia CKD, která jsou zahrnuta v předkládaných guidelines Struktura guidelines
Guidelines jsou zaměřeny na nemocné s chronickým onemocněním ledvin starší 65 let s GFR nižší než 45 ml/min/1,73m2. Zdůrazňují odlišnosti v managementu onemocnění u starších osob ve srovnání s mladými nemocnými se stejně závažným postižením ledvin a ve srovnání s nemocnými nad 65 let, ale bez renálního onemocnění.
Guidelines vycházejí ze systematických přehledů literatury a zpracovávají následujících šest okruhů:
1. výpočet odhadované eGFR pro klasifikaci CKD a dávkování léčiv
Tato část poskytuje doporučení, kterou z metod hodnocení GFR je nejvhodnější používat pro klasifikaci renálního postižení a pro účely změny dávkování léčiv s renální eliminací.
2. prognózování progrese do konečné fáze renálních onemocnění
3. prognózování úmrtí ve střednědobém časovém horizontu
Obě oblasti jsou zaměřené na nalezení nejvhodnějšího prognostického modelu pro predikci rizika progrese CKD a úmrtí. Nabízí lékařům a pacientům volbu vhodné strategie s ohledem na jejich preference (sdílené rozhodování – shared decision-making) a plánování řešení pro konečné fáze renálního onemocnění. Cílem je poskytnout informaci i pro vhodnou strukturu služeb.
4. zhodnocení funkčních schopností a strategie k jejich zlepšení
5. zhodnocení nutričního stavu a strategie k jeho zlepšení
Oblasti 4 a 5 poskytují doporučení pro nejvhodnější screeningové metody pro posuzování funkčního a nutričního stavu a informace o nejvhodnějších strategiích pro prevenci a léčbu pacientů v riziku nebo již s přítomnými poruchami funkčních schopností a nutričních deficitů.
6. posouzení přínosu a rizika náhrady funkce ledvin (renal replacement therapy, RRT) ve srovnání s konzervativní léčbou
1) Výpočet odhadované eGFR pro klasifikaci CKD a dávkování léčiv
Tato oblast odpovídá na otázku, jaký je nejspolehlivější vzorec pro výpočet eGFR/odhad renálních funkcí a pro úpravu dávky léčiv u této specifické populace.
Proč je tato informace důležitá?
Metody používané pro přesné určení skutečné GFR (Cr-EDTA, clearance inulinu či polyfruktosanu nebo Tc-DPTA) nejsou vhodné pro použití v klinické praxi pro svou náročnost i náklady. Jak je již uvedeno v úvodním textu, existuje řada vzorců pro výpočet eGFR. Není však odborné shody, který ze vzorců pro výpočet eGFR užít u starých osob s pokročilým CKD, který by měl největší shodu se skutečnou GFR a mohl by být používán pro definitivní klasifikaci stadia CKD. Je zřejmé, že metody výpočtu eGFR doporučené pro obecnou populaci nemohou být uplatněny u této specifické populace. Obvyklá polyfarmakoterapie v této skupině nemocných vyžaduje přesné určení GFR, aby mohlo být odpovídajícím způsobem upraveno/redukováno dávkování léčiv s renální eliminací.
Doporučení
1.1 Doporučujeme pro výpočet odhadované eGFR u starých pacientů použít rovnice, které zohledňují rozdíly v produkci kreatininu spíše než rovnice využívající pouze samotnou hodnotu sérového kreatininu (síla důkazu 1A).
Starší nemocní mohou mít nižší produkci kreatininu způsobenou nižší svalovou hmotou, nižší fyzickou aktivitou a nižším příjmem potravy. To vše může ovlivňovat vztah mezi SKr a GFR. Odlišnou závislost mezi oběma parametry je obtížné předvídat, protože závisí více na antropometrických a výživových parametrech a také na přítomnosti křehkosti (frailty) spíše než na kalendářním věku. Hodnota SKr samotná tak nepostačuje ke správnému odhadu eGFR u starších osob.
1.2 Není dostatek vědeckých důkazů pro doporučení jedné z rovnic pro výpočet eGFR u osob nad 65 let s GFR nižší než 45 ml/min/1,73m2, protože všechny poskytují srovnatelné výsledky. Při použití kterékoli metody výpočtu může však dojít k významným nepřesnostem, a tak k nesprávné klasifikaci renálních funkcí, pokud jsou použity u starých pacientů s odlišným tělesným složením (síla důkazu 1B).
Nejsou vědecké důkazy pro to, že některá z metod výpočtu eGFR by byla konzistentně lepší než jiná. Relativní přesnost výpočtu je ovlivněna metodou měření SKr, ale i case-mixem kohorty starších nemocných (frail versus non-frail, stadium CKD, věk). Prakticky u všech metod výpočtu byla při použití přesného měření GFR nutná reklasifikace stadia CKD a žádná z metod se neukázala jako (nej)vhodnější.
1.3 Pokud je třeba znát přesně GFR, doporučujeme formální zhodnocení renálních funkcí (síla důkazu 1B). V případě, že toto hodnocení není provedeno pro náročnost a/nebo nákladnost, navrhujeme použít metodu výpočtu CKD-EPICr-Cyst jako přijatelnou alternativu (síla důkazu 2C).
1.4 U léčiv nebo aktivních metabolitů léčiv vylučovaných ledvinami doporučujeme při dávkování zohlednit renální funkce (síla důkazu 1A).
1.5 Pro léčiva s úzkým toxickým/terapeutickým oknem poskytne užitečné informace pravidelné měření jejich sérových koncentrací. Odlišná vazba na sérové proteiny v případě uremie může vyžadovat změnu cílových hladin celkové koncentrace léčiva (síla důkazu 2C).
Dávkování léčiv vylučovaných ledvinou a jejich renálně vylučovaných aktivních metabolitů by mělo být upraveno podle renálních funkcí. Uremie může ovlivnit vazbu na sérové bílkoviny, navíc starší nemocní mohou trpět malnutricí a hypalbuminemií. Proto sérová koncentrace volného léčiva (aktivní forma nenavázaná na vazebný protein) může být vyšší, než by odpovídalo stanovené celkové koncentraci léčiva. V těchto případech je žádoucí dosahovat nižších celkových sérových koncentrací. Pro redukci léčiva na základě výpočtu eGFR bychom měli používat Cockcroft-Gaultovu rovnici clearance kreatininu doporučovanou výrobci léčiv. Použití jiných výpočtů vedlo podle literatury k nesprávné kalkulaci dávky u 10 léčiv často předepisovaných u seniorů, konkrétně u rovnice MDRD až ve 28,6 % a u rovnice CKD-EPI ve 22,9 %.
2) Prognózování progrese do konečné fáze renálních onemocnění
Obsahem této části guidelines je odpověď na otázku, jaký je nejspolehlivější model pro vyhodnocení rizika progrese CKD do konečné fáze renálního onemocnění pro skupinu starých nemocných s již přítomným pokročilým renálním onemocněním (eGFR < 45 ml/min/1,73 m2).
Proč je tato informace důležitá?
Doporučení vhodného skórovacího modelu poskytne vhodný nástroj pro využití v klinické praxi a umožní spolehlivě odhadnout riziko progrese CKD do konečné fáze renálního onemocnění (end-stage kidney disease, ESKD) u starších nemocných. Výskyt CKD roste s věkem, avšak jen malá část progreduje do konečného orgánového selhání. Spolehlivá metoda, která by identifikovala nemocné s vysokým rizikem progrese, by umožnila zavést u této skupiny cílenou renoprotektivní léčbu, eventuálně připravit pacienta na některou z forem náhrady renálních funkcí. Nemocní s nízkým rizikem progrese do ESKD by mohli být ušetřeni zbytečné agresivní léčby.
Predikce rizika ESKD je obtížná, protože pokles GFR není lineární, zejména u starších osob se zvýšeným rizikem akutního postižení ledvin (acute kidney injury, AKI). U seniorské křehkosti a dalších chronických onemocnění může docházet k rychlému a nepředvídatelnému poklesu GFR. Riziko progrese do ESKD je třeba posuzovat i s ohledem na celkové mortalitní riziko z jakékoli příčiny. U pacientů nad 65 let převáží riziko vývoje do konečné fáze renálního selhání nad celkovým mortalitním rizikem pouze v případě, kdy je GFR nižší než 15 ml/min/1,73 m2. Protože starší osoby byly často vyloučeny z klinických studií, které posuzovaly výši rizika ESKD, není jasné, zda v současnosti užívané výpočty rizika lze aplikovat i u starých nemocných.
2.1 Pro predikci rizika progrese pokročilého renálního onemocnění s eGFR < 45 ml/min/1,73 m2 doporučujeme použít skórovací systém KFRE (Kidney Failure Risk Equation, tj. rovnice pro výpočet rizika progrese do konečného stadia selhání ledvin) využívající 4 klinické parametry: věk, pohlaví, GFR a poměr albumin/kreatinin v moči (síla důkazu 1B).
Prediktivní skórovací systém KFRE (Kidney Failure Risk Equation, KFRE) byl vyvinut kanadským výzkumným týmem pod vedením Tangriho a spol.(8) pro pacienty s pokročilým chronickým selháním ledvin ve stadiu G3–G5 a v současnosti byl validován u více než 700 000 osob ve více než třiceti zemích(9,10,11). Pro zhodnocení rizika progrese do konečné fáze renálního selhání postačuje jen minimum demografických a klinických údajů, tj. 4 parametry: věk, pohlaví, GFR a poměr albumin:kreatinin v moči. Výpočet rizika je možný automaticky laboratoří nebo zadáním údajů elektronicky, například do volně přístupné aplikace kidneyfailurerisk.com nebo www.renal.org. U populace mimo severoamerický kontinent je třeba při výpočtu rizika použít korekční faktor. Složitější matematické modely (KFRE s využitím 8 parametrů, kromě výše uvedených dále sérové hladiny kalcia, bikarbonátu, fosfátu a albuminu) nevedly k dalšímu zpřesnění predikce rizika, proto pro klinickou praxi doporučujeme používat jednodušší čtyřpoložkovou rovnici KFRE, která umožní předpovědět riziko ESKD během dalších 2 a 5 let(12). Riziko je hodnoceno jako malé 0–5 %, střední 5–15 %, vysoké 15 % a více pro progresi do ESKD v daném časovém intervalu.
Obr. 1. Měnící se riziko úmrtí a riziko rozvoje ESRD (end stage renal disease) ve vztahu k hodnotě eGFR a k věku 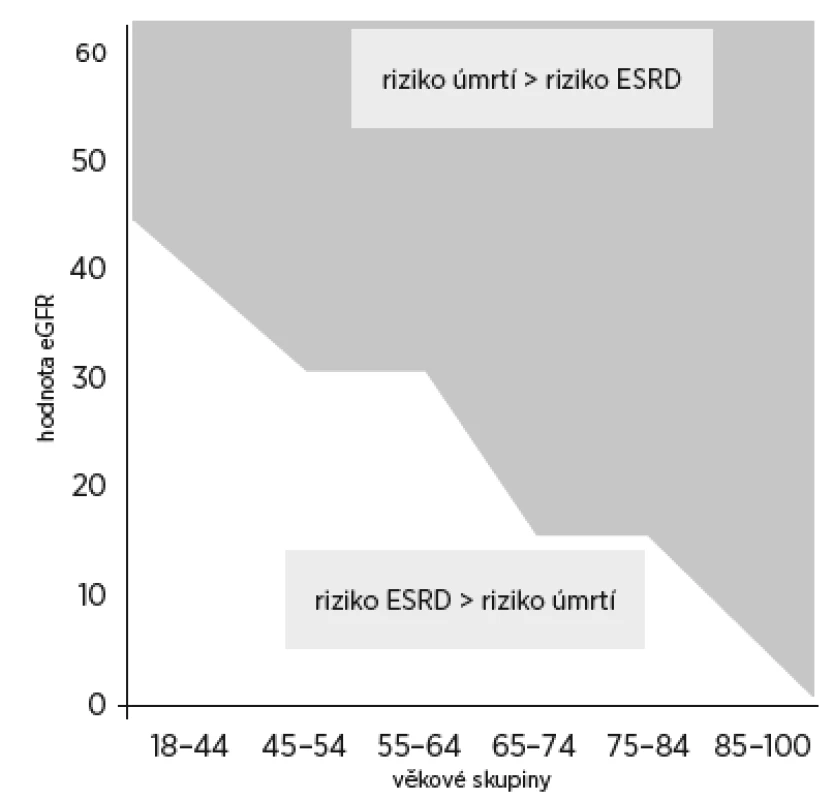
3) Prognózování úmrtí ve střednědobém časovém horizontu
Tato část guidelines se zaměřuje na doporučení nejspolehlivějšího nástroje pro prognózování úmrtí u starých a/nebo křehkých seniorů s pokročilým renálním onemocněním (eGFR < 45 ml/min/1,73 m2)
Proč je tato informace důležitá?
Poradenství pro seniory s pokročilým renálním onemocněním o dalších možnostech léčby vyžaduje spolehlivý odhad absolutního rizika úmrtí pro daného pacienta v konkrétním časovém horizontu, a to jak u nemocných, kteří zahájili dialýzu, tak i u pacientů léčených konzervativně(13). Možnost identifikovat osoby s vysokou pravděpodobností úmrtí během následujících několika měsíců bez ohledu na léčbu renálního selhání tak může zlepšit kvalitu života v posledních měsících bez další zbytečné zátěže zahajování dialyzační léčby. U nemocných s delším očekávaným přežitím pak umožňuje zvažovat poměr kvality života vs. absolutní délky přežití. Přestože existují prognostické modely, pouze několik z nich bylo vyvinuto pro starší populaci s pokročilým CKD a ještě méně ověřováno na populaci jiné než na souboru nemocných, na němž byl model vyvinut. Není proto jasné, zda existující modely dobře predikují riziko úmrtí u populace seniorů s pokročilým CKD.
3.1 Pro starší nemocné bez syndromu křehkosti s CKD ve stadiu 3-5 navrhujeme použít pro odhad rizika úmrtí v následujících 5 letech skóre podle Bansalové (tzv. Bansal score) (síla důkazu 2B).
Jak uvedeno výše, není potvrzena spolehlivost modelů predikujících mortalitu u starších osob s pokročilým CKD. Pro využití modelu použitelného rutinně v klinické praxi je nezbytné, aby s minimem snadno dostupných parametrů umožnil jednoduchou kalkulaci individuálního rizika úmrtí s použitím běžné kalkulačky nebo např. chytrého telefonu.
Model podle Bansalové predikuje absolutní pravděpodobnost úmrtí během následujících 5 let u pacientů nad 65 let s pokročilým CKD ve stadiu 3–5, kteří ještě nezahájili dialyzační léčbu(14). Model byl vyvinut na kohortě 5 888 nemocných pojištěnců americké Medicare ze studie Cardiovascular Health Study. Konečný model zahrnuje 9 snadno dostupných demografických, klinických a laboratorních údajů: věk, pohlaví, etnikum, eGFR, poměr močového albuminu ke kreatininu, přítomnost diabetu, kouření, anamnézu srdečního selhání a cévní mozkové příhody. Bansalové skóre bylo uspokojivě validováno na kohortě 789 seniorů Health, Aging and Body Composition Study(15) a těmito guidelines je doporučováno jako nejvhodnější nástroj pro predikci rizika úmrtí u starších pacientů s pokročilou CKD stadia 3b a vyšším. V tabulce 2 jsou uvedeny údaje pro výpočet skóre podle Bansalové, tabulka 3 pak zachycuje 5leté riziko úmrtí v procentech.
Tab. 2. Výpočet skóre podle Bansalové pro predikci rizika úmrtí v následujících 5 letech u seniorů s CKD stadia 3b a vyšším 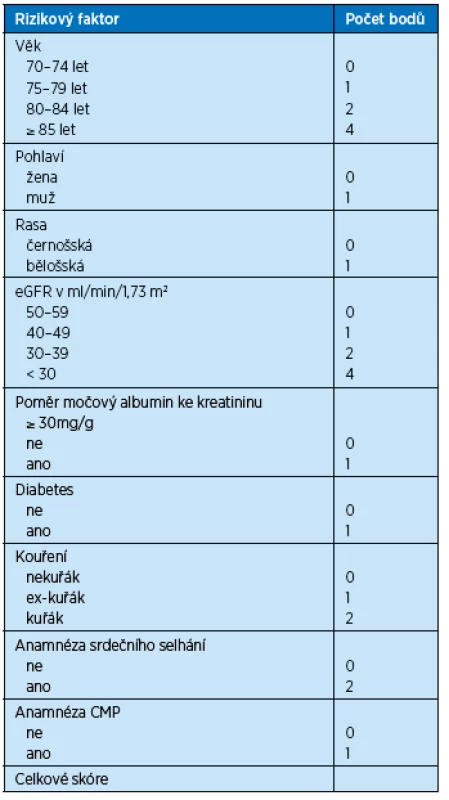
Tab. 3. Procentuální riziko úmrtí v následujících 5 letech u seniorů s CKD stadia 3b a vyšším 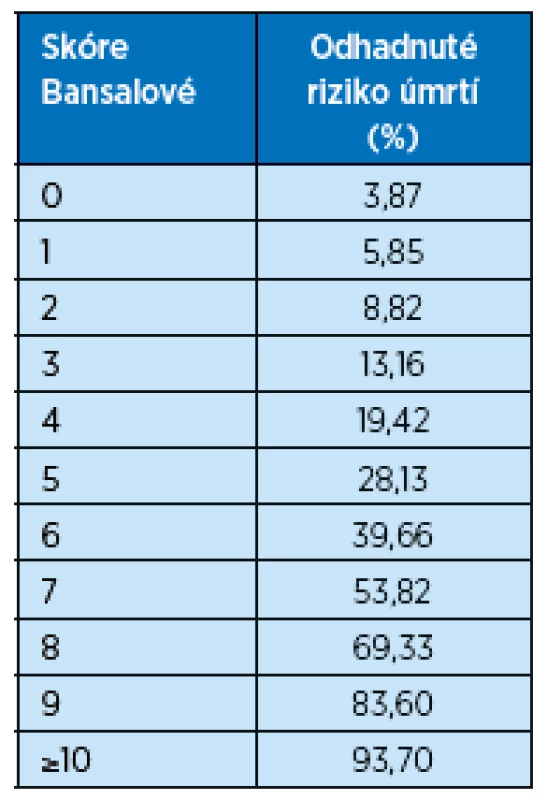
(podle výše skóre podle Bansalové) 3.2. Pro predikci individuálního rizika úmrtí u křehkých seniorů s nebo bez CKD nedoporučujeme používat současně existující modely (síla důkazu 1B). Navrhujeme, aby u pacientů s nízkým rizikem skóre podle Bansalové byl používán model zahrnující posouzení křehkosti (síla důkazu 2B).
Protože skóre Bansalové bylo validováno v kohortě seniorů žijících v komunitě bez závislosti v ADL činnostech, výsledky odhadovaného rizika nelze plně uplatnit u pacientů se syndromem křehkosti. Je známo, že křehkost je u nemocných s pokročilou CKD častou komorbiditou(16). Vzhledem k tomu, že chybí validace skóre Bansalové u křehkých seniorů, nelze doporučit použití tohoto skóre pro predikci úmrtí u nemocných s křehkostí(14). Frailty však představuje další rizikový faktor mortality, a to nezávisle na ostatních tradičně užívaných rizikových faktorech(17). V případě vysokého rizika úmrtí vyjádřeného vysokým skórem podle Bansalové bude predikce mortality spolehlivá i u pacientů se syndromem křehkosti. Naopak u nízkého mortalitního rizika je třeba pro predikci mortality zahrnout kromě tradičních rizikových faktorů i riziko z důvodů přítomné křehkosti.
3.3 Pro predikci rizika úmrtí u starších dialyzovaných nebo dialýzu zahajujících nemocných s CKD, stadiem 5, navrhujeme použít REIN skóre (síla důkazu 2B).
V literatuře byl nalezen jeden model tzv. REIN skóre (REIN = Renal Epidemiology and Information Network, REIN ESRD registry) odhadující riziko úmrtí v horizontu 3 měsíců, jenž zahrnoval seniory v konečné fázi renálního selhání, kteří zahájili dialýzu. Pro vývoj modelu byla použita data 12 500 osob z REIN registru osob s CKD starších 75 let s vysokým počtem komorbidit. Model zahrnul celkem 9 demografických, klinických a biochemických parametrů: věk, pohlaví, anamnézu městnavého srdečního selhání, ICHDK, poruchy srdečního rytmu, nádorové postižení, závažné behaviorální poruchy, mobilitu a sérový albumin a byl úspěšně validován v několika zemích(12). Také druhý dostupný model pro predikci rizika v horizontu 6 měsíců u pacientů s ESKD zahajujících dialýzu pochází z REIN registru(19). Vědecká kvalita obou REIN modelů je vysoká a pro dobrou dostupnost údajů pro výpočet REIN skóre ji lze doporučit pro klinickou praxi.
4a) jaké jsou nejvhodnější metody pro posouzení poklesu funkčních schopností u starých a/nebo křehkých osob s pokročilým onemocněním ledvin (CKD)?
Proč je tato informace důležitá?
CKD je nezávislý rizikový faktor pro funkční postižení a křehkost(20-22). Funkční pokles je spojen s negativními zdravotními výstupy včetně mortality a hospitalizace(23). Výsledky observačních studií ukázaly, že vhodnou intervencí lze u nemocných s CKD zabránit funkčnímu poklesu(24).
Pro posuzování funkčních schopností nemocných s CKD bylo vyvinuto několik posuzovacích nástrojů, které hodnotí různé oblasti fyzických funkcí(25). Lze je kategorizovat na oblast a) měření fyziologických funkcí v laboratorních podmínkách; b) hodnocení mobility a kapacity pro provádění výkonnostních testů/činností, a to formou sebehodnocení nebo prováděných v klinických podmínkách; a c) hodnocení fyzické aktivity. Tabulka 4 uvádí příklady hodnoticích testů/škál. Přes široké spektrum těchto hodnocení nepanuje shoda v tom, který z nástrojů je nejvhodnější pro posuzování fyzických funkcí u seniorů s pokročilým CKD a který současně splňuje požadované psychometrické charakteristiky, jako např. dobré diskriminační schopnosti, je jednoduchý a snadno použitelný v rutinní klinické praxi a dobře zachycuje změny funkční kapacity v čase.
Tab. 4. Příklady hodnoticích nástrojů pro posouzení funkčního stavu 
(podle Paintera a Marcuse(25) 4a.1 Doporučujeme, aby u starších pacientů s CKD ve stadiu 3b–5d bylo používáno jednoduché hodnocení funkčního stavu a jeho vývoj monitorován v pravidelných intervalech. Cílem hodnocení je identifikovat pacienty, pro které bude přínosné podrobné geriatrické vyšetření a rehabilitace (síla důkazu 1C).
Pro hodnocení fyzických funkcí existuje mnoho nástrojů. Síla evidence současných studií je poměrně nízká, protože jde pouze o studie observační a jen několik studií testovalo validitu a spolehlivost těchto nástrojů u starších nemocných s pokročilým CKD. Přesto jsou dostupná data u těchto pacientů shodná s výsledky studií v populaci mladších osob s CKD a také starších nemocných bez CKD.
Všechny studie konzistentně prokazují, že u starších pacientů s CKD ve stadiu 3b a vyšším je vysoký výskyt křehkosti a nízké fyzické zdatnosti a že obě tyto poruchy jsou spojeny se zvýšenou mortalitou. Individualizovaný přístup pro management frailty může zlepšit funkční stav a potenciálně snížit i mortalitu, kvalitu života a další oblasti života pacienta. Proto je smysluplné provádět screening na přítomnost křehkosti a monitorovat její vývoj a nastupující funkční deterioraci. Tak lze identifikovat pacienty, kteří by měli být dále vyšetřeni geriatrem nebo lékařem s geriatrickou kompetencí, popřípadě multidisciplinárním týmem.
4a.2 Pro hodnocení funkční zdatnosti doporučujeme co možná nejjednodušší testy včetně sebehodnoticích škál a jednoduchých klinických vyšetření (rychlost chůze, postavování ze sedu), které mají dostatečnou a srovnatelnou diskriminační schopnost identifikovat pacienty s poklesem funkční zdatnosti (síla důkazu 1C).
Výsledky studií prokazují, že všechny jednoduché testy poskytují srovnatelné informace a nejsou vědecké důkazy, že by některý z nich byl pro starší pacienty s CKD vhodnější. Sebehodnoticí škály mají výhodu pro svou jednoduchost a snadné použití. Jsou spolehlivé, vnitřně konzistentní a predikují riziko nežádoucího vývoje zdravotního stavu včetně mortality a hospitalizace. Není však známo, zda jsou i dostatečně citlivé ke změnám funkční zdatnosti v čase. Performanční testy, jako např. sit-to-stand, rychlost chůze, 6minutová chůze, byly validovány i v kohortách nemocných s CKD, mají dobrou spolehlivost při opakování i při hodnocení dvěma vyšetřujícími a taktéž predikují negativní vývoj. Dobře monitorují změny funkčního stavu po intervencích zaměřených na zlepšení funkční zdatnosti. Nízká aerobní fyzická aktivita hodnocená testem „Rapid Assessment of Physical Activity“ (RAPA) je u dialyzovaných pacientů spojena s vyšší mortalitou, není však známa spolehlivost testu. Hodnocení fyziologických funkcí, jako síla stisku ruky a VO2 max, jsou náročnější pro provádění v běžné klinické praxi, a proto budou mít jen omezený potenciál využití zvláště u křehkých seniorů. Z těchto důvodů doporučujeme pro hodnocení změn funkční kapacity u starších nemocných s CKD využívat sebehodnoticích a klinických testů uvedených v tabulce 2.
4b) Jsou přínosné intervence zaměřené na zlepšení funkčního stavu u starších pacientů s pokročilým CKD (eGFR < 45 ml/min/1,73 m2 nebo dialyzovaných)?
Proč je tato informace důležitá?
U starší populace s pokročilým CKD je známý vysoký výskyt křehkosti. Křehcí senioři s CKD a s úbytkem hmotnosti mají trojnásobně vyšší mortalitu a u fyzicky inaktivních je mortalita dvojnásobná. U nemocných s CKD je dostatek vědeckých důkazů o tom, že vyšší úroveň fyzické aktivity snižuje mortalitu a udržuje nebo zlepšuje fyzické funkce(24). Vzhledem ke stárnutí populace s CKD a s tím souvisejícím nárůstem křehkosti je důležité formulovat doporučení, jak udržet nebo zlepšit funkční stav u této populace. Tato část guidelines mapuje efektivitu intervencí u této specifické populace včetně nemocných dialyzovaných. Navazuje na obecnější doporučení skupiny KDIGO, která bez zohlednění věku doporučuje u nemocných s CKD cvičení 30 minut denně 5x týdně, nekuřáctví a udržení optimální hmotnosti(12).
4b.1 Cvičení má pozitivní dopad na funkční stav seniorů s CKD, stadiem 3b a vyšším (síla důkazu 1C).
U pacientů s CKD, kteří provádějí pravidelná fyzická cvičení, jsou důkazy pro příznivý efekt na fyzickou zdatnost, funkční stav/soběstačnost i celkovou pohodu. Studie jsou však malé a mají vysoké riziko selekčních bias. Není také jasné, jak velkého zlepšení funkce bylo dosaženo a zda došlo ke zlepšení sebeobsluhy a nezávislého života v domácím prostředí/komunitě. Nebyla nalezena žádná studie potvrzující nežádoucí účinky cvičení. Také u celé populace s CKD bylo prokázáno, že cvičení zlepšuje zdravotní výsledky. U starších nemocných s pokročilým CKD ve stadiu 3b-5, kteří jsou motivovaní, má cvičení přizpůsobené jejich fyzické aktivitě příznivý efekt a je bezpečné.
4b.2 Navrhujeme, aby byl cvičební trénink nabízen a strukturován individuálně, aby nedocházelo k nežádoucím událostem (síla důkazu 2C).
Je důležité si uvědomit, že ve všech studiích byl cvičební program sledován studijním týmem včetně fyzioterapeuta. Většina studií také přizpůsobila intenzitu cvičení individuálním schopnostem pacienta. Nemůžeme proto vyloučit, že jak pozitivní vliv cvičení, i to, že nedošlo k nežádoucím událostem, může být zásluhou multidisciplinárního přístupu. Proto tvůrci těchto guidelines navrhují, aby byl cvičební program prováděn pod dohledem fyzioterapeuta jako součást strukturovaného multidisciplinárního programu.
5a) Která metoda je nejvhodnější k hodnocení nutričního stavu starších pacientů s pokročilým CKD stadia 3b a vyššího (eGFR < 45 ml/min/1,73 m2) nebo u dialyzovaných?
Proč je tato informace důležitá?
U této skupiny nemocných jsou přítomny klinicky významné nutriční deficity související s metabolickými poruchami, chronickým zánětem, ztrátou chuti k jídlu, opakovanými chirurgickými výkony nebo infekcemi(26). Tyto skutečnosti mohou vést ke stavu proteino-energetické malnutrice (angl. protein-energy wasting), která je přítomna u 20–60 % pacientů ještě před zahájením náhrady funkce ledvin (RRT)(27).Další nutriční poruchy se objevují během dialyzačního stadia (CKD, stadium 5d). Stav výživy je také významným prediktivním faktorem pro přežití u pacientů zahajujících nebo podstupujících chronickou dialyzační léčbu(28). Zvláště starší pacienti mají zvýšené riziko malnutrice/kachexie z důvodů anorexie, sníženého příjmu proteinu, častých mnohočetných komorbidit (diabetes, vaskulární poruchy, CMP, malignita) a jsou náchylní k sociální izolaci a depresi. Protože průměrný věk v době zahájení dialýzy se stále zvyšuje a v zemích západní Evropy se pohybuje již kolem 70 let(29), je důležité doporučit spolehlivý, ale současně jednoduchý a pro klinickou praxi vhodný nástroj pro hodnocení nutričního stavu a odhalení proteino-energetické malnutrice a identifikovat nemocné vyžadující další vyšetření a nutriční intervenci. Mezinárodní společnost pro renální výživu a metabolismus v roce 2008 doporučila novou terminologii kachexie (protein-energy wasting). Sledované parametry zahrnují biochemické vyšetření, měření tělesného složení (např. bioimpedanci), stanovení svalové hmoty a příjem vybraných nutrientů(30). Cílové hodnoty však nebyly derivovány z kohorty starých nemocných a jejich využití u seniorů s CKD musí být ověřeno.
5a.1 Doporučujeme „Subjective Global Assessment“ (SGA) jako zlatý standard pro hodnocení nutričního stavu seniorů s CKD ve stadiu 3b a vyšším (eGFR < 45 ml/min/1,73m2) (síla důkazu 1C).
Většina studií prokazuje, že SGA poskytuje přijatelný odhad nutričního stavu, je ve vztahu s relevantními zdravotními výstupy (mortalitou a morbiditou) a je dostatečně citlivý k zachycení změny nutričního stavu. SGA je také poměrně jednoduchý s přijatelnou časovou náročností, a může být proto používán opakovaně pro rutinní hodnocení stavu výživy.
5a.2 Pro zhodnocení nutričního stavu starších dialyzovaných pacientů navrhujeme používat skóre zahrnující sérový albumin, BMI, sérový kreatinin/povrch těla (Body Surface Area, BSA) a denní příjem proteinu hodnocený nPNA (normalized protein nitrogen appearance, nPNA) (síla důkazu 2D).
Je třeba zdůraznit, že zvláště pro seniory na dialyzační léčbě je použití tohoto skóre výhodné, protože všechny parametry jsou dostupné z laboratorních a jednoduchých antropometrických měření a je možná snadná kalkulace. nPNA (normalized protein nitrogen appearance), dříve označovaný také jako rychlost proteinového katabolismu (nPCR – protein catabolic rate), odráží denní příjem proteinu (v g/kg hmotnosti/den) u hemodialyzovaných pacientů(31,32). Celkové skóre splňuje podmínku prediktivní kapacity pro úmrtí a jeho zlepšení indikuje i zlepšení zdravotních výstupů. Validace mimo vývojovou kohortu však nebyla provedena.
Tab. 5. Subjective Global Assessment (SGA) pro posouzení stavu výživy 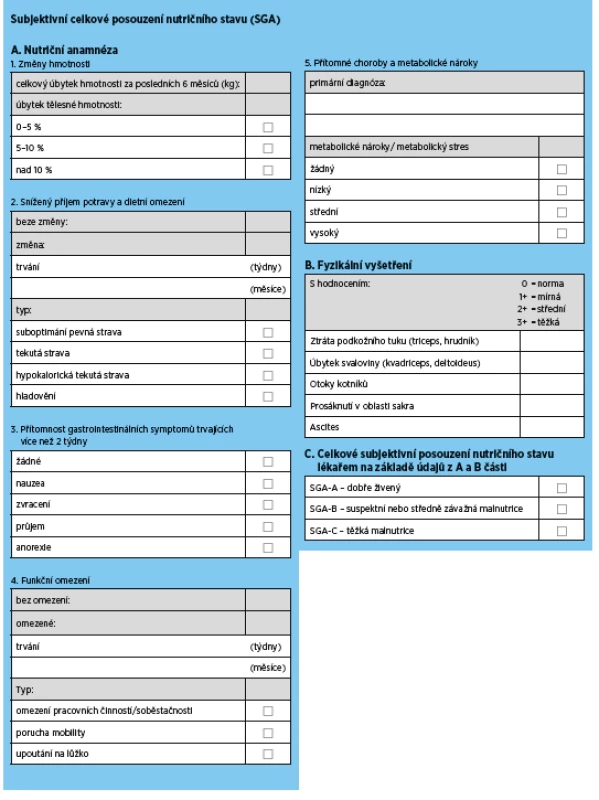
5b) Které intervence jsou přínosné pro zlepšení stavu výživy u starších/křehkých nemocných s pokročilým CKD (eGFR < 45 ml/min/1,73 m2) nebo dialyzovaných?
Proč je tato informace důležitá?
U seniorů s CKD jsou nutriční poruchy ve smyslu malnutrice a kachexie (protein-energy wasting) časté a přispívají ke zvýšené morbiditě a mortalitě(33). Klinické vyhodnocení a nutriční management představují u této populace nenaplněnou potřebu. Prevalence malnutrice u CKD se může lišit s ohledem na její definici založenou na hladině sérového albuminu (v rozmezí 20–45 %), klinickém (SGA a BMI) nebo instrumentálním [bioimpedance (BIA) a DEXA] vyšetření (výskyt malnutrice v rozmezí 18–20 %)(34). Zlepšení nutričního stavu zlepšuje i klinické výsledky. Přestože je doporučována řada intervencí nutričních, farmakologických i dialyzačních, chybějí důkazy založené na RCT studiích s dostatečnou statistickou silou.
Pacientům s pokročilým CKD jsou často doporučovány restriktivní diety (omezení bílkovin, kalia, fosfátů, tuku apod.). Dietní omezení jsou tak faktorem dále limitujícím přiměřený nutriční příjem spolu s akutními nebo chronickými chorobami, problémy s denticí, kognitivními poruchami, neschopností připravit jídlo nebo se najíst, depresí, sociální deprivací a polyfarmakoterapií. V důsledku uvedené polykauzality nutričních poruch u CKD není v současnosti širší konsenzus pro optimalizaci nutriční péče u této skupiny nemocných. Korekce malnutrice musí probíhat v postupných krocích v souladu s dostupnými důkazy.
5b.1 Pro zlepšení nutričního stavu seniorů s pokročilým CKD navrhujeme využít strukturované dietní poradenství a nutriční podporu (síla důkazu 2C).
Malnutrice a kachexie (protein energy wasting) jsou u této specifické populace časté a zvyšují mortalitu(33-35). Proto se doporučuje pečlivé zhodnocení výživy a ovlivnění potenciálních příčin. V současnosti však není jisté, které intervence jsou nejefektivnější.
Kvantita i kvalita vědeckých důkazů je dost nízká s omezeným počtem RCT, většinou se jedná o observační studie z jednoho centra s malým počtem pacientů a krátkou dobou sledování. Mezi studiemi jsou velké metodické rozdíly (vstupní kritéria, výstupy) neumožňující jednoznačně posoudit vhodnost a efektivitu nutričních intervencí.
6) Jaký je přínos dialyzační léčby u starých a křehkých pacientů?
Proč je tato informace důležitá?
Během několika posledních desetiletí dramaticky narostl počet osob v konečné fázi renálního onemocnění (ESKD). V souvislosti s tím se zvýšil i počet seniorů podstupujících dialyzační léčbu(36). Úmrtnost u dialyzovaných nemocných je vysoká a se stoupajícím věkem dialyzovaných mortalita dále strmě roste. Podstatný podíl na mortalitě má ukončení dialyzační léčby(37). Stoupající počty ukončení jdou paralelně s rostoucím počtem zahajovaných dialýz u starších osob. Dialyzační léčba ovlivňuje kvalitu života a úleva od některých symptomů je za cenu značné zátěže pro pacienty, jejich rodiny a pečovatele.
Rozhodování, zda zahájit dialyzační léčbu, nebo ne, by se mělo odehrávat ještě předtím, než je potřeba začít dialyzovat (obr. 2). Jak již bylo diskutováno v předchozích sekcích, je obtížné odhadnout, ve kterém okamžiku riziko úmrtí při dialyzační léčbě převáží riziko úmrtí z jiných příčin. Ještě obtížněji lze kvantifikovat, zda potenciální prodloužení přežití ospravedlňuje použití i zatěžující intenzivní léčby. Proto byla hledána odpověď na otázku, zda je vhodné navrhovat dialyzační léčbu pacientům pokročilého věku s křehkostí a s komorbiditami. Výzkum potvrdil značnou diskrepanci v rozhodování kliniků, pacientů a pečovatelů. Proto i v rámci přípravy těchto guidelines byla hledána odpověď na tuto otázku s cílem pomoci klinikům v řešení těchto častých, ale komplexních a obtížných problémů.
Obr. 2. Rozhodovací algoritmus pro starší pacienty s CKD stadia 3b a vyššího 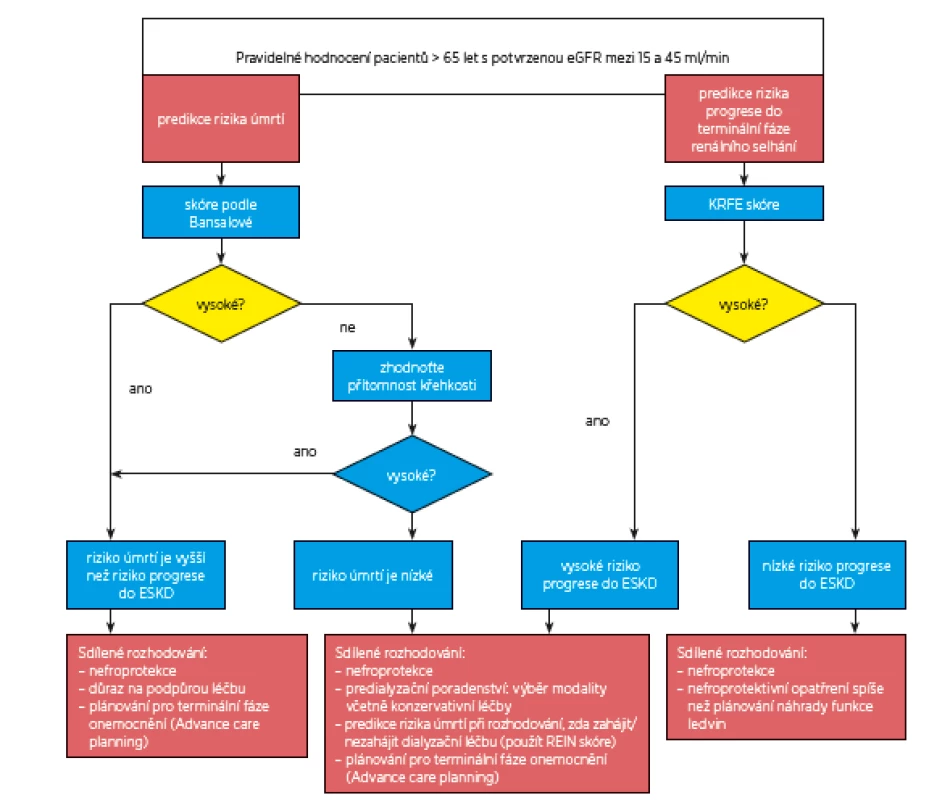
(eGFR < 45 ml/min/1,73 m2) 6.1 Doporučujeme, aby pro diskusi o vhodných možnostech náhrady funkce ledvin byly používány validní nástroje popsané v části (2) a (3), které umožní předpovědět pravděpodobný vývoj CKD (obr. 2).
U mnoha nemocných s pokročilým renálním selháním je progrese do konečné fáze onemocnění (ESKD) pomalá. Pravděpodobnost, že dosáhnou ESKD, je nízká a lze očekávat, že pacienti zemřou z jiné příčiny ještě před dosažením konečné fáze onemocnění. Také u nemocných s multimorbiditou je prognóza špatná s vysokým rizikem úmrtí. U obou popsaných skupin nemocných může být diskuse o náhradě renálních funkcí (RRT) nevhodná, může bránit optimálnímu vedení léčby a pro pacienty i jejich rodiny představuje zbytečný stres. V části 2 a 3 těchto guidelines jsou popsány validované nástroje k posouzení rizika progrese do ESKD a obecného rizika úmrtí.
6.2 Doporučujeme, aby v diskusi o optimálních léčebných postupech u ESKD byla zahrnuta i alternativa konzervativní léčby a aby konečné řešení představovalo konsenzuální rozhodnutí lékaře a pacienta (shared decision-making, sdílené/společné rozhodování) (síla důkazu 1D).
Existuje dostatek důkazů o tom, že konzervativní léčba může být vhodnou léčebnou alternativou pro staré pacienty, pacienty s komorbiditami a pacienty s nepříznivým funkčním stavem, která nemusí negativně ovlivňovat přežití ani kvalitu života. Volba konzervativní léčby místo dialyzační léčby může zabránit nežádoucím výsledkům, tj. omezit hospitalizace a zlepšit péči o nemocné, např. zahájením paliativní léčby nebo poskytováním péče tam, kde to pacientovi nejlépe vyhovuje.
6.3 U nemocných zvažujících zahájení náhrady renálních funkcí (síla důkazu 1C) doporučujeme využít pro stratifikaci rizika úmrtí „REIN skóre“.
REIN skóre bylo validováno na externí kohortě s dobrou kalibrací a diskriminační schopností pro predikci mortality u pacientů zahajujících dialýzu. V literatuře nebyly nalezeny žádné randomizované studie. Pokud předpokládáme, že mortalita u této skupiny pacientů je shodná u dialyzovaných jako nedialyzovaných, je vhodné použít REIN skóre, které poskytuje informaci pro lékaře i pacienta o krátkodobém mortalitním riziku. Součástí validační studie bylo použití vizuální analogové škály usnadňující pacientům porozumět riziku úmrtí(38).
Závěr
Lékaři napříč řadou oborů se stále častěji setkávají se staršími pacienty s pokročilou poruchou funkce ledvin (Chronic Kidney Disease, CKD) a jsou postaveni před obtížné rozhodování o další léčbě těchto pacientů včetně rozhodování o zahájení či nezahájení dialyzační léčby. Proto ve zkrácené formě představujeme českému čtenáři nově publikovaná evropská doporučení(7), která se zaměřují na šest nejvýznamnějších problémových okruhů diagnostiky a léčby osob nad 65 let s chronickou renální insuficiencí ve stadiu 3b a vyšším. Věříme, že znalost odlišností CKD a nových vědeckých poznatků z klinických studií u této věkové skupiny přispěje ke zlepšení péče o tyto nemocné.
Autoři prohlašují, že nejsou ve střetu zájmů a publikace článku nebyla podpořena farmaceutickou firmou.
prof. MUDr. Topinková Eva, CSc.1,
prof. MUDr. Teplan Vladimír, DrSc.2
1Geriatrická klinika 1. LF UK a VFN Praha
2Subkatedra nefrologie IPVZ Praha, Interní klinika LF OU Ostrava
prof. MUDr. Eva Topinková, CSc.
e-mail: Eva.Topinkova@vfn.cz
Od roku 2001 je přednostkou Geriatrické kliniky 1. LF UK a VFN v Praze a od r. 1997 vedoucí Subkatedry geriatrie IPVZ. Od 80. let rozvíjí obory vnitřní lékařství, geriatrii a gerontologii na 1. LF UK jako klinička, pedagožka a vědecká pracovnice. Zavedla výuku geriatrie do magisterského studia lékařství a řady bakalářských studijních programů, iniciovala OR postgraduální doktorandské studium Gerontologie a je jeho předsedkyní. Byla 3 volební období vědeckou sekretářkou, nyní místopředsedkyní ČGGS. Je past-prezidentkou klinické sekce IAGG-ER a dalších mezinárodních organizací (EUGMS, interRAI, UEMS, SIOG), expertem EK pro oblast „Aging and Disability“. Dále je řešitelkou a koordinátorkou mezinárodních výzkumných projektů v oblasti epidemiologie, dysability, klinických, sociálních a etických aspektů geriatrické péče.
Zdroje
1. Rule AD, Cornell LD, Pogio ED. The association between age and nephrosclerosis on renal biopsy among healthy adults. Ann Intern Med 2010; 153 : 561–567.
2. Oreopoulos DG, Dimkovic N. Geriatric nephrology is coming of age. J Am Soc Nephrol 2003; 14(4):1099–1101.
3. Teplan V a kol. Nefrologie vyššího věku. MF Praha 2015; 337 s.
4. Levey AS, Coresh J, Green T, et al. Expressing the Modification of Diet in Renal Disease Study equation for estimating glomerular filtration rate with standardized serum creatinine values. Clin Chem 2007; 53 : 766–772.
5. Levey AS, Stevens LA, Schmid CH, et al. CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration). A new equation to estimate glomerular filtration rate. Ann Intern Med 2009; 150 : 604–612.
6. Inker LA, Schmid CH, Tighiouart H, et al. Estimating glomerular filtration rate from serum creatinine and cystatin C. N Engl J Med 2012; 367 : 20–29.
7. Farrington K, Covic A, Aucella F, et al. Clinical Practice Guideline on management of older patients with chronic kidney disease stage 3b or higher (eGFR < 45 ml/min/1.73 m2). Nephrol Dial Transplant 2016 31: ii1–ii66. doi: 10.1093/ndt/gfw356.
8. Levey AS, Eckardt KU, Tsukamoto Y, et al. Definition and classification of chronic kidney disease: a position statement from Kidney Disease: Improving Global Outcomes (KDIGO). Kidney Int 2005; 67 : 2089–2100.
9. Tangri N, Stevens LA, Griffith J, et al. A predictive model for progression of chronic kidney disease to kidney failure. J Am Med Assoc 2011; 305 : 1553–1559.
10. Peeters MJ, van Zuilen AD, van den Brand JA, et al. Validation of the kidney failure risk equation in European CKD patients. Nephrol Dial Transplant 2013; 28 : 1773–1779.
11. Tangri N, Grams ME, Levey AS, et al. Multinational assessment of accuracy of equations for predicting risk of kidney failure: a meta-analysis. J Am Med Assoc 2016; 315 : 164–174.
12. KDIGO. 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int 2013; Suppl 3 : 1–150.
13. Pro prognózu dialyzovaných pacientů není rozhodující věk, ale přidružené nemoci. Komentář Dusilová-Sulková S. Postgrad nefrol 2010; 8 : 40–41.
14. Bansal N, Katz R, De Boer IH, et al. Development and validation of a model to predict 5-year risk of death without ESRD among older adults with CKD. Clin J Am Soc Nephrol 2015; 10 : 363–371.
15. Thamer M, Kaufman JS, Zhang Y, et al. Predicting early death among elderly dialysis patients: development and validation of a risk score to assist shared decision making for dialysis initiation. Am J Kidney Dis 2015; 66 : 1024–1032.
16. McAdams-DeMarco MA, Law A, Salter ML, et al. Frailty as a novel predictor of mortality and hospitalization in individuals of all ages undergoing hemodialysis. J Am Geriatr Soc 2013; 61 : 896–901.
17. Rockwood K, Song X, MacKnight C, et al. A global clinical measure of fitness and frailty in elderly people. Can Med Assoc J 2005; 173 : 489–495.
18. Cheung KL, Montez-Rath ME, ChertowGM, et al. Prognostic stratification in older adults commencing dialysis. J Gerontol A Biol Sci Med Sci 2014; 69 : 1033–1039.
19. Couchoud CG, Beuscart JB, Aldigier JC, et al. Development of a risk stratification algorithm to improve patient-centered care and decision making for incident elderly patients with end-stage renal disease. Kidney Int 2015; 88 : 1178–1186.
20. Dalrymple LS, Katz R, Rifkin DE, et al. Kidney function and prevalent and incident frailty. Clin J Am Soc Nephrol 2013; 8 : 2091–2099.
21. Roshanravan B, Khatri M, Robinson-Cohen C, et al. A prospective study of frailty in nephrology-referred patients with CKD. Am J Kidney Dis 2012; 60 : 912–921.
22. Roshanravan B, Robinson-Cohen C, Patel KV, et al. Association between physical performance and all-cause mortality in CKD. J Am Soc Nephrol 2013; 24 : 822–830.
23. Painter P, Roshanravan B. The association of physical activity and physical function with clinical outcomes in adults with chronic kidney disease. Curr Opin Nephrol Hypertens 2013; 22 : 615–623.
24. Heiwe S, Jacobson SH. Exercise training in adults with CKD: a systematic review and meta-analysis. Am J Kidney Dis 2014; 64 : 383–393.
25. Painter P, Marcus RL. Assessing physical function and physical activity in patients with CKD. Clin J Am Soc Nephrol 2013; 8 : 861–872.
26. Johansson L, Fouque D, Bellizzi V, et al. As we grow old: nutritional considerations for older patients on dialysis. Nephrol Dial Transplant 2016; doi: 10.1093/ndt/gfw201.
27. Ikizler TA, Cano NJ, Franch H, et al. Prevention and treatment of protein energy wasting in chronic kidney disease patients: a consensus statement by the International Society of Renal Nutrition and Metabolism. Kidney Int 2013; 84 : 1096–1107.
28. Moreau-Gaudry X, Jean G, Genet L, et al. A simple protein-energy wasting score predicts survival in maintenance hemodialysis patients. J Ren Nutr 2014; 24 : 395–400,
29. Noordzij M, Kramer A, Abad Diez JM, et al. Renal replacement therapy in Europe: a summary of the 2011 ERA-EDTA registry annual report. Clin Kidney J 2014; 7 : 227–238.
30. Fouque D, Kalantar-Zadeh K, Kopple J, et al. A proposed nomenclature and diagnostic criteria for protein-energy wasting in acute and chronic kidney disease. Kidney Int 2008; 73 : 391–398.
31. KDOQI Clinical Practice Guidelines for Nutrition in Chronic Renal Failure. Appendix V. Rationale and Methods for the Determination of the Protein Equivalent of Nitrogen Appearance (PNA), 2000. Dostupné z:http://www2.kidney.org.
32. Qunibi WY, Henrich WL. Protein intake in maintenance hemodialysis patients. UpToDate 2016. Dostupné z: http://www.uptodate.com.
33. Johansson L, Fouque D, Bellizzi V, et al. As we grow old: nutritional considerations for older patients on dialysis. Nephrol Dial Transplant 2016; doi: 10.1093/ndt/gfw201.
34. Ikizler TA, Cano NJ, Franch H, et al. Prevention and treatment of protein energy wasting in chronic kidney disease patients: a consensus statement by the International Society of Renal Nutrition and Metabolism. Kidney Int 2013; 84 : 1096–1107.
35. Moreau-Gaudry X, Jean G, Genet L, et al. A simple protein-energy wasting score predicts survival in maintenance hemodialysis patients. J Ren Nutr 2014; 24 : 395–400.
36. Noordzij M, Kramer A, Abad Diez JM, et al. Renal replacement therapy in Europe: a summary of the 2011 ERA-EDTA registry annual report. Clin Kidney J 2014; 7 : 227–238.
37. van Biesen W, van de Luijtgaarden MW, Brown EA, et al. Nephrologists’ perceptions regarding dialysis withdrawal and palliative care in Europe: lessons from a European Renal Best Practice survey. Nephrol Dial Transplant 2015; 30 : 1951–1958.
38. Peeters P, Van BiesenW, Veys N, et al. External Validation of a risk stratification model to assist shared decision making for patients starting renal replacement therapy. BMC Nephrol 2016; 17 : 41.
Štítky
Geriatria a gerontológia Praktické lekárstvo pre dospelých Protetika
Článek EditorialČlánek Divertikulární nemocČlánek XXI. Zlínský geriatrický denČlánek Nehojace sa rany
Článok vyšiel v časopiseGeriatrie a Gerontologie
Najčítanejšie tento týždeň
2017 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Konzervativní léčení seniorů s chronickým onemocněním ledvin ve stadiu CKD 3b a vyšším
- Divertikulární nemoc
- Hodnocení kvality života u pacientů vyššího věku se sarkopenií: vývoj a validace české verze dotazníku SarQoL®
- Editorial
- Nečekané „vyléčení“ u geriatrického pacienta s makroadenomem hypofýzy
- Nutriční potřeba při léčbě chronických defektů u geriatrického pacienta
-
Z historie péče o chudé a chronicky nemocné v Praze.
Chudobinec sv. Bartoloměje a Chorobinec Na Karlově. - Nová evropská doporučení pro management pacientů vyššího věku s chronickým onemocněním ledvin ve stadiu 3b a vyšším (eGFR < 45 ml/min/1,73 m2)
- Ohlédnutí za hradeckým gerontologickým kongresem
- XXI. Zlínský geriatrický den
- Stáří je nepřetržitá série ztrát
- Nehojace sa rany
- Geriatrie a Gerontologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Divertikulární nemoc
- Konzervativní léčení seniorů s chronickým onemocněním ledvin ve stadiu CKD 3b a vyšším
- Hodnocení kvality života u pacientů vyššího věku se sarkopenií: vývoj a validace české verze dotazníku SarQoL®
-
Z historie péče o chudé a chronicky nemocné v Praze.
Chudobinec sv. Bartoloměje a Chorobinec Na Karlově.
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy










