-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Monitorování perorální antikoagulační léčby v ambulantní praxi
Monitoring peroral anticoagulation therapy in outpatient practice
Cumarins are typically used in outpatient practice and the spectrum of patients taking cumarin anticoagulants is expanding. At the same time, the conditions for and the range of possible indications, as well as the monitoring of the effect and the adjustment of treatment
are changing - both on the part of the general practitioner treating the patient or the specialists involved in the treatment of such patients, and on the part of the patients themselves. Growing knowledge also changes the philosophy of treatment as such, the approach to the treatment and to its concomitant or relevant circumstances.Keywords:
thrombosis – cumarins – warfarin – point of care testing – outpatient care – home treatment
Autoři: M. Penka; J. Gumulec; A. Buliková; M. Matýšková; P. Smejkal; J. Kissová; M. Šlechtová; J. Novotný; G. Chlupová
Vyšlo v časopise: Kardiol Rev Int Med 2007, 9(3): 159-164
Souhrn
Kumariny jsou typickým lékem ambulantní praxe a spektrum nemocných, kteří je užívají se stále rozšiřuje. Zároveň se také mění podmínky a možnosti jejich indikace, sledování jejich účinku a úprava léčby – jak ze strany praktického lékaře nemocného, případně specialistů podílejících se na péči o nemocného, tak nakonec i nemocného samého. S nárůstem poznatků se také mění celá filozofie léčby, přístup k ní i k okolnostem, které ji provázejí nebo ji ovlivňují.
Klíčová slova:
trombóza – kumariny – warfarin – point of care testing – ambulantní péče – domácí léčbaÚvod
Dikumarolové látky či zkráceně kumariny nebo méně správně antivitaminy K jsou léky, které se v klinické medicíně používají od poloviny minulého století.
Jejich účinek se dá shrnout stručně a schematicky do následujících 2 bodů [1]:
- zasahují do metabolizmu K–vitamin dependentních působků ovlivněním redukčních pochodů blokádou epoxid reduktázy a reduktázy
- brání karboxylaci γ–glutamátových zbytků faktorů II, VII, IX a X a inhibitorů koagulace – proteinu C a S (schéma).
Schéma 1. Účinek K vitaminu v epoxidovém cyklu [2]. ![Schéma 1. Účinek K vitaminu v epoxidovém cyklu [2].](https://pl-master.mdcdn.cz/media/image/1068af349f4efe54cd18bd95f3ccc9a3.png?version=1537792394)
Kumariny jejich účinek a indikace
K nejvýznamnějším dikumarolovým preparátům patří etylbiskumacetát (Pelentan a Pelentanettae) a acenokumarol (Sintrom) s krátkým poločasem a warfarin (Coumadine, Lawarin, Warfarin), případně fenprokumon (Marcoumar) s poločasem delším [3]. V současné době se v ČR používá takřka výhradně warfarin, zatímco etylbiskumacetát se již ani nepoužívá ani nevyrábí.
Biologický účinek kumarinů sledujeme pomocí protrombinového času (prothrombin time – PT) metodou podle Quicka, vyjádřeného v INR (international normalized ratio), které určuje poměr vyšetřené plazmy k plazmě normálního vzorku přepočteného mezinárodním indexem senzitivity (ISI). Takto získaná laboratorní hodnota se nejlépe hodí ke sledování účinku perorálních antikoagulancií a k jejich srovnání v případech, pocházejí-li z různých laboratoří (obr. 1) [3–5].
K indikacím podání kumarinů patří prevence a léčba především žilního tromboembolizmu (VTE), ale lze je podávat i u nemocných s arteriální trombózou, kde je výhodné je kombinovat i s antiagregancii. Doporučenou cílovou hodnotou INR je 2,0–3,0 [6 – 9], přičemž se nedoporučuje provádět nízkodávkovanou (nedosahující INR 2,0) nebo vysokodávkovanou (přesahující INR 3,1) léčbu, i když některé studie (PREVENT a ELATE) částečný prospěch nízkodávkované léčby warfarinem s INR 1,5–1,9, resp. 1,5–2,0 prokazují [10].
Výhodou warfarinu je možnost jeho podání kojícím matkám, protože nepřechází do mateřského mléka.
Ovlivnění účinku kumarinů
Existuje celá řada okolností, které ovlivňují účinnost kumarinů a ty lze posuzovat podle aspektů klinických a podle aspektů laboratorního sledování. K těm klinickým patří souběžné choroby a interakce kumarinů s léky a potravinami [11]. Z hlediska laboratorního věnujeme pozornost jak preanalytické, tak analytické a postanalytické fázi vyšetření. Významný je zde tedy způsob a provedení odběru krve, dále pak zajištění správných laboratorních podmínek a správná technika samého vyšetření a nakonec i vydání a interpretace výsledků. Zatímco ošetřující lékař ovlivní dopad klinických změn, laboratorní pracovníci mají vliv na odpovídající úroveň provedeného vyšetření, i když právě posledně jmenovaný krok doznává v rámci ambulantní péče významných proměn. Nyní ale zpět ke klinice.
Ke zvýšení účinku kumarinů může dojít za těchto okolností:
- při nedostatku vitaminu K při malabsorpci, obstrukční žloutence, jaterních chorobách, iatrogenně při terapii antibiotiky potlačujícími saprofytickou (K vitamin produkující) střevní flóru
- při zvýšeném metabolizmu, u tyreotoxikózy nebo při déle trvajícím horečnatém stavu
- v průběhu infekce
- při interakci s léky: chlorpromazinem, dipyridamolem, chinidinem, laxancii, nesteroidními antiflogistiky, kortikosteroidy, tolbutamidem, erytromycinem, metronidazolem, s cefalosporiny 3. generace, cimetidinem, amiodaronem, hepariny
Ke snížení účinku kumarinů může dojít za těchto okolností:
- u osob s vrozenou nebo získanou rezistencí na warfarin včetně dědičně podmíněné snížené afinity warfarinových receptorů k warfarinu
- u uremie a hypometabolických stavů
- v rámci interakce s následujícími léky: barbituráty, haloperidolem, aldaktonem, cholestyraminem, rifampicinem, antihistaminiky, perorálními kontraceptivy, griseofulvinem a pochopitelně s vitaminem K či potravinami s jeho vysokým obsahem, přičemž k interferenci s léčbou dochází při přívodu K vitaminu v dávce přesahující 250 μg/den [12]
Graf 1. Grafické znázornění vyjádření INR se zaměřením na terapeutické rozpětí a rozpětí normálních hodnot. 
Graf 2. Použití LMWH k přemosťující léčbě v rámci přípravy výkonu, upraveno dle [26]. ![Použití LMWH k přemosťující léčbě v rámci přípravy výkonu, upraveno dle [26].](https://pl-master.mdcdn.cz/media/image/7db25fd04b5d880b7d231a8ffa8422a0.png?version=1537794826)
Komplikace léčby kumariny
Další významnou klinickou okolností jsou komplikace léčby kumariny. K nim patří krvácení, warfarinem indukovaná kožní nekróza a teratogenní účinek [13–15].
Krvácení, jehož výskyt činí přibližně 7 % (fatální 0,5 %), je dáno především předávkováním warfarinem a nesprávně sledovanou léčbou (tab. 2).
Tab. 1. Riziko tromboembolických komplikací z hlediska výkonu [19]. ![Riziko tromboembolických komplikací z hlediska výkonu [19].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/0486cc47c08fbe0033623c56e7824a68.png)
Může být však zapříčiněno i mutací propeptidu FIX, zvýšenou senzitivitou vůči warfarinu (danou například mutací VKORC1) a sníženým odbourávání warfarinu (resp. jeho 2 izomerů) např. v důsledku mutace cytochromu P450.
Warfarinem indukovaná kožní nekróza může být důsledkem současného defektu proteinu C, může provázet úvod léčby warfariny, zvláště pokud není veden pod clonou antitrombotické léčby hepariny a je-li zpočátku a déle podávána vyšší dávka warfarinu. Jedná se o syndrom analogický purpuře fuĺminans novorozenců a může mít závažné důsledky.
S teratogenními účinky se lze setkat, je-li warfarinem léčena těhotná v době mezi 6.12. týdnem gravidity.
Někdy se setkáváme naopak se selháním léčby i při dosažení účinné laboratorní kontroly Takové selhání může provázet např. nádorové choroby. Méně často se setkáváme i s osteoporózou či padáním vlasů.
K tomu, abychom nevystavovali nemocného nebezpečí vzniku komplikací, je nutno dodržovat kontraindikace podání kumarinů, ke kterým patří:
- těhotenství (hlavně 1. a 3. trimestr)
- choroby jater a slinivky
- vrozené či získané krvácivé stavy
- čerstvé operační zákroky nebo stavy těsně po operaci
- přítomnost nebo hrozba čerstvého krvácení
- chybí-li spolupráce pacienta pří léčbě a kontrole
- léčba bez možnosti laboratorních kontrol
- abúzus alkoholu
Pakliže se již komplikace vyskytnou, existuje řada systematických doporučení týkajících se opatření při předávkování kumariny. Na tomto místě uvádíme jako příklad doporučení britského výboru pro standardizaci v hematologii [3] z roku 1996, které je běžně užíváno a které respektuje laboratorní hodnoty i klinické příznaky:
- při INR 3,0–6,0, není-li provázeno krvácením, redukujeme či vynecháme dávku léku
- při INR 6,0–8,0 vynecháme dávky do nástupu hodnoty INR < 5,0
- při INR > 8,0 vynecháme dávku warfarinu a podáme p.o. vitamin K v dávce 0,5–2,5 mg (je zajímavé, že je účinnější perorální než subkutánní aplikace)
- při velkém krvácení podáváme koncentrát faktorů protrombinového komplexu a/nebo vitamin K 5 mg p.o. či i.v., což již vyžaduje hospitalizaci a za dramatických okolností takového krvácení je možno pomýšlet i na použití rekombinantního aktivovaného faktoru VII (rFVIIa)
Pro péči o nemocné na dlouhodobé antikoagulační léčbě jsou důležité obecné principy léčby kumariny, které lze shrnout následovně:
- začít podávat kumariny spolu s heparinem a převádět nejméně 5 dní a přitom volit spíše menší dávku kumarinů
- zajistit podmínky a spolupráci s nemocným a jeho dalšími ošetřujícími lékaři; zajistit jejich poučení
- kontrolovat léčbu nejméně 1krát za 4 týdny, maximálně 6 týdnů [17]
- uvážlivě měnit snižovat, zvyšovat a přerušovat léčbu (viz níže)
- ponechávat léčbu potřebně dlouhou dobu [18]
- pokud možno neměnit preparáty warfarinu z důvodu odlišnosti jejich struktury (zatímco Warfarin je amorfní, Lawarin je krystalická sůl)
Příprava nemocného k intervenčnímuzákroku
V některých případech se od ošetřujícího lékaře požaduje, aby zajistil přípravu k chirurgickému či jinému intervenčnímu zákroku. V těchto případech vycházíme z posouzení míry rizika daného samým chirurgickým výkonem (tab. 1) a dále z míry trombeombolického rizika daného přerušením antikoagulační léčby.
Tab. 2. Krvácení po warfarinu ve výsledcích provedených studií, z nichž nevýraznější představují výsledky Altmanna et al z roku 1991 ukazuje, že při kolísání hodnot INR v rozpětí mezi 3,0-4,5 je provázena 24% rizikem vzniku trombózy, zatímco léčba vedená v rozmezí 2,0-2,9 pouhým 6% výskytem. Faktem je, že ne všechny studie přinášejí tak přesvědčivé výsledky, nicméně závislost na kolísání rozpětí INR je zřejmá [16]. ![Krvácení po warfarinu ve výsledcích provedených studií, z nichž nevýraznější představují výsledky Altmanna et al z roku 1991 ukazuje, že při kolísání hodnot INR v rozpětí mezi 3,0-4,5 je provázena 24% rizikem vzniku trombózy, zatímco léčba vedená v rozmezí 2,0-2,9 pouhým 6% výskytem. Faktem je, že ne všechny studie přinášejí tak přesvědčivé výsledky, nicméně závislost na kolísání rozpětí INR je zřejmá [16].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/6265bff4a1cdf08f6e4d9b5fd9636c8c.png)
V závislosti na míře rizika lze provádět dle J. Ansella et al [11] (7. konsenzuální konference ACPP) přípravu v závislosti na míře rizika tromboembolie (případně krvácení) následovně:
Nízké riziko tromboembolie:
- vysazení warfarinu cca 4 dny před chirurgickou intervencí (za účelem dosažení INR blízko normálním hodnotám před výkonem)
- v případě vyššího VTE rizika samého výkonu pooperační profylaxe nefrakcionovaným heparinem (unfractionated heparin – UFH 5000 j.s.c.) či nízkomolekulárním heparinem (low–molecular–weight heparin – LMWH) + současné pokračování terapie warfarinem
Poznámka: profylaxe UFH či LMWH může být zahájena předoperačně.
Střední riziko tromboembolie:
- vysazení warfarinu cca 4 dny před chirurgickou intervencí (za účelem poklesu INR před výkonem)
- 2 dny před operací zahájení profylaxe UFH (5 000 j. s. c.) či LMWH + pooperační pokračování terapie warfarinem
Poznámka: někdy je doporučována profylaxe vyššími dávkami UFH či plnými dávkami LMWH.
Vysoké riziko tromboembolie
- vysazení warfarinu cca 4 dny před chirurgickou intervencí (za účelem dosažení normálních hodnot INR před výkonem)
- před operací – cca 2 dny za normalizace INR profylaxe plnou dávkou UFH či LMWH + současné pooperační pokračování terapie warfarinem
Poznámka: je-li profylaxe plnými dávkami UFH či plnými dávkami LMWH podávána s.c., pak ji ukončíme 12–24 hod před výkonem; je-li UFH aplikován kontinuálně i.v., ukončíme jeho podávání cca 5 hod před výkonem.
Nízké riziko krvácení
- warfarin snížíme od 4. či 5. dne před výkonem k dosažení nastavení INR cca 1.3 – 1.5
- pokračování plné (původní) terapie warfarinem zahajujeme ihned po výkonu
Poznámka: profylaxe UFH či LMWH může být zajištěna, je-li to nezbytné.
Vždy je nutno posuzovat míru nebezpečí z hlediska obou klinických extrémů – krvácení či retrombózy. Pak vycházíme z doporučení, jaké hodnoty INR lze podle klinické situace připustit. S. Schulman [20] postuluje zmíněnou závislost v následující 3 rovinách (tab. 3).
Tab. 3. Stanovení cílového INR z hlediska míry možných komplikací. 
Hodnoty INR přitom z hlediska hodnocení nastavení úrovně antikoagulačního účinku odpovídají určité plazmatické koncentraci jednotlivých faktorů krevního srážení (tab.4) [20].
Tab. 4. Plazmatická koncentrace faktorů krevního srážení reflektovaná hodnotou INR. 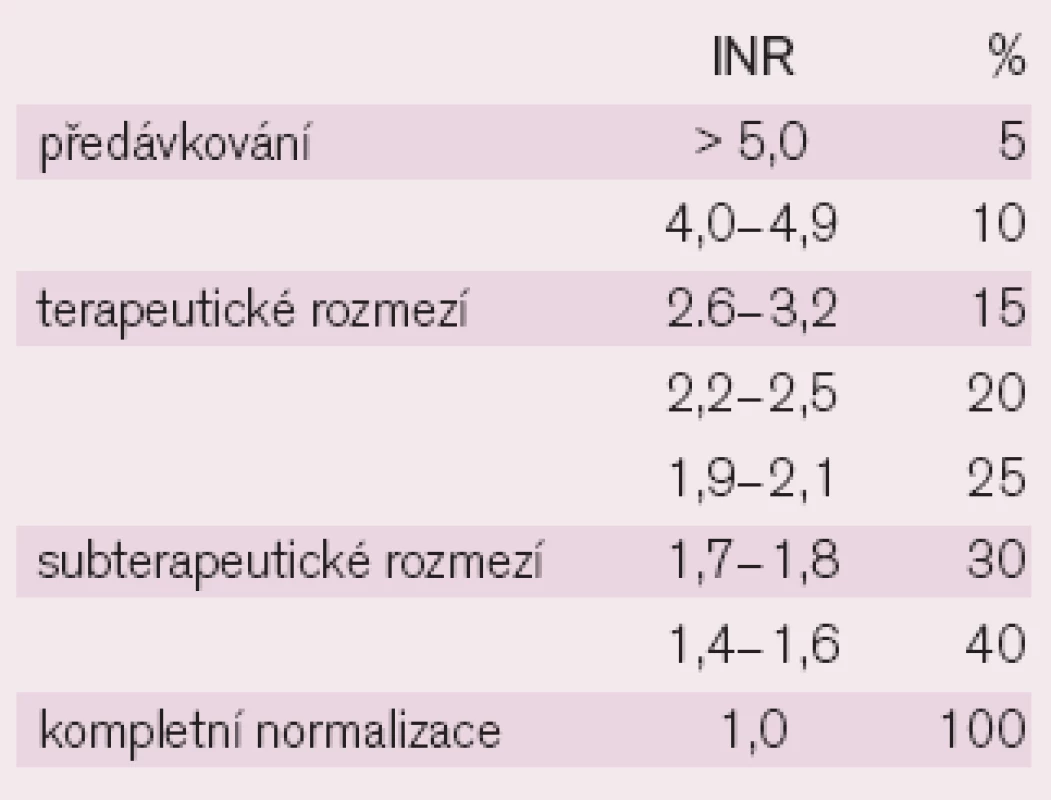
K rychlé korekci INR lze použít plazmu či plazmatické deriváty. Nejčastěji bývá používána čerstvě zmražená plazma (ČZP/fresh frozen plasma – FFP) nebo protrombinový koncentrát (prothrombin complex concentrat – PCC) [21].
Výpočet dávky FFP nebo PCC k požadované korekci INR uvádí tento vzorec:
Počet ml FFP či IU koncentrátu = požadovaná – aktuální koncentrace faktoru (%) × tělesná hmotnost (kg).
Příklad: nemocný po prodělané PE je stižen závažným krvácením ze zažívacího traktu
základní parametry: aktuální INR 7,5 (~ cca 5% biologická aktivita faktorů plazmatického systému), požadované INR ,5 (~ cca 40% ff), tělesná hmotnost je 80 kg.
Výpočet: (40–5) × 80 = 2 800 ml FFP či jednotek PCC
K doplňkovým opatřením přípravy nemocného k intervenčnímu výkonu patří:
- zavedení kaválního filtru – má zabránit komplikujícím embolizacím u nemocných s vysokým rizikem VTE, u kterých je nezbytný urgentní výkon (případně v době do 1 měsíce po prodělané příhodě VTE) [22]
- podávání K vitaminu ke korekci INR (souběžně se substituční léčbou) vždy v dávce nižší (do 5 mg) ! – k vyloučení nebezpečí následného vzniku rezistence k warfarinu; přitom je možná jak i.v., tak i p.o. aplikace; je třeba počítat s nástupem účinku K vitaminu do cca 4 hod od jeho podání [23]
Za určitých okolností perorální léčbu nepřerušujeme ani neupravujeme, pokud nepřesahuje významně dolní limit rozpětí terapeutického účinnosti (INR = 2,0) [11]. Patří k nim extrakce zubů (i mnohočetné) [24,25], dále operace katarakty, artrocentézy a endoskopie zažívacího traktu.
Doporučený postup v rámci přípravy nemocného na dlouhodobé antikoagulační léčbě k intervenci (chirurgické, gynekologické, invazivního vyšetření apod.) by tedy bylo možno shrnout do následujících bodů:
- vysazení (snížení) dávky warfarinu
- nasazení antitrombotické alternativní léčby
- korekce INR k okamžiku výkonu s aplikací profylaktické dávky LMWH
- navrácení původní léčby po (nebo v den) výkonu pod clonou plné (léčebné) heparinizace nefrakcionovaným (unfractionated heparin – UFH) nebo nízkomolekulárním (low molecular weight heparin – LMWH) heparinem
U zákroků s pooperačním krvácením nebo jeho rizikem pokračujeme v pooperačním průběhu v antitrombotické alternativní léčbě heparinem a na původní léčbu warfarinem přecházíme obvyklým způsobem, ale později.
Trvalé následky či smrt v souvislosti s trombózou či krvácením nacházíme v důsledku tepenného tromboembolizmu v 70–75 %, žilního tromboembolizmu ve 4–10 % a u pooperačního krvácení v 1–6 % [27]. Z toho je patrno, které klinické situace ohrožují nemocné více a přistupujeme k zajištění nemocných tak, abychom co nejúčinněji zajistili antitrombotickou prevenci a přitom i hemostázu pro daný výkon. Primární je přitom antitrombotická prevence. V každém případě ale zvažujeme, do jaké míry je zajištění antikoagulační, resp. antitrombotické prevence nutné.
V souvislosti s úvahou o zásahu do antikoagulační terapie (AKT) tedy zvažujeme, zda je:
- nutné pokračovat v AKT, přičemž vycházíme ze současných doporučení [11, 28] (nekomplikovaná první trombóza – 3 měsíce, komplikovaná trombóza (PE) – 6–12 měsíců, zjištěný defekt – dlouhodobě (celoživotně), zajištění kritické situace – přechodná cílená)
- nutno AKT přerušit či významně změnit
- výkon naléhavý nebo zda jej lze odložit [29]
Schéma přípravy nemocného k výkonu
- Nutná vysoká úroveň AKT a výkon spěchá: přerušení AKT, substituce PCC či FFP a okamžité převedení nemocného na UFH či LMWH v plné či přechodně krátkodobě v profylaktické dávce
- Možná nižší úroveň AKT a výkon spěchá: snížení dávky AKT, substituce FFP a UFH či LMWH v profylaktické dávce
- Nutná vysoká úroveň AKT a výkon nespěchá: snížení AKT, podání malé dávky K vitaminu (1–2,5 mg), převedení na léčebnou dávku UFH či LMWH; přitom v době, kdy ještě přetrvává hodnota INR v terapeutickém rozmezí, je možné je podat v profylaktické dávce
- Možná nižší úroveň AKT a výkon nespěchá: snížení AKT, minim. dávka K vitaminu (INR 2,0) a UFH či LMWH v profylaktické dávce
- AT není nutná z důvodu předchozí indikace: zvážení, zda výkon sám vyžaduje AKT, (pokud ne, pak ukončení AKT a pokud ano, pak profylaxe UFH nebo LMWH)
Závěr
Z hlediska současné péče o nemocné v ambulantním sledování a domácí léčbě je velmi významné zavedení možnosti využití míst rychlé diagnostiky (POCT – point of care testing), kdy se díky přístrojům (např. CoaguChek) dá rychle a z kapilární krve změřit hodnota INR. Protože se jedná o modifikace metody užívané v koagulační laboratoři, je nutno si uvědomit, že se výsledky mohou lišit. Pak je třeba zohlednit stupně odlišnosti a provádí-li se souběžně kontrola oběma způsoby, musí se dávkování přizpůsobovat v závislosti na stupni rozdílu. Tato diagnostika je dobrá pro možnost aktuální a rychlé kontroly, která může být svěřena do rukou praktického lékaře nebo poučeného a spolupracujícího pacienta samého. V souvislosti s tímto systémem sledování je však nutné proškolení lékařů i pacientů, protože se jedná o systém, kde se chyby mohou vyskytnout ve vyšší míře než v rámci klasického sledování. Studie zabývající se touto problematikou však přinášejí povzbudivé údaje o stabilním nastavení nemocných a ve srovnání s běžnou nespecializovanou péčí mohou vést i ke snížení komplikací [30]. Nutný je ovšem také spolehlivý systém archivace výsledků.
V souvislosti s organizací péče o nemocné na dlouhodobé antikoagulační léčbě by bylo vhodné vytvoření sítě kontrolních pracovišť, která by byla napojena přímo na Centra pro trombózu a hemostázu, která působí v největších a fakultních nemocnicích.
Adresa pro korespondenci:
prof. MUDr. Miroslav Penka, CSc.1
prim. MUDr. Jaroslav Gumulec2
MUDr. Alena Buliková, Ph.D.1
MUDr. Miloslava Matýšková, CSc.1
MUDr. Petr Smejkal1
MUDr. Jarmila Kissová1
MUDr. Marie Šlechtová1
MUDr. Jan Novotný1
MUDr. Gabriela Chlupová1
1 Oddělení klinické hematologie LF MU a FN Brno, pracoviště Bohunice
2 Onkologické centrum J. G. Mendela, Nový Jičín
Zdroje
1.Marder VJ, Rosove MH, Minning DM. Foundation and sites of action pf antithrombotic agents. Best Practice Mueller RL. First–generation agents: aspirin, heparin and coumarins. Best Pract Res Clin Haematol 2004; 17(1): 3–22.
2.Bick RL, Murano G. Physiology of Hemostasis. Clin Lab Med 1994; 14(4): 677–707.
3.Baglin TP, Rose PE and membres of the Haemostasis and Thrombosis Task Force. Guidelines on Oral Anticoagulation: 3rd ed. Br J Haematol 1998; 101 : 374–387.
4.Kessler P. Léčba orálními antikoagulancii. Orion – yhtymä Oyj, Orion Pharma 2002.
5.Kottke–Marchant K. Laboratory diagnosis of hemorrhagic and thrombotic disorders. Diagnostic Hematology. Hematol Oncol Clin North Am 1994; 8(4): 809–853.
6.Bergmann F, Kochhan L, Budde U. Die hereditäre Thrombophilie. Fortschritte in der Diagnostik. Hamostaseologie 1999; 19 : 77–85.
7.Harenberg J, Huhle G, Hoffmann U. Antithrombotische Therapie, Moderne Behandlungsstrategien. Internist 1999; 8 : 885–893.
8.Jaenecke J. Indikationsgebiete fur Antikoagulantien. Post – und praeoperative Antikoagulantienprophylaxe Antikoagulanzien – und Fibrinolzsetherapie. New York: Georg Thieme 1996 : 142–175.
9.Khamashta M, Cuadrado M, Mujic E et al. The management of thrombosis in the antiphospholipid syndrome. N Engl J Med 1995; 332 : 993–997.
10.Menajovsky LB. Long–term Treatment of Venous Thromboembolism. Treatment of Venous Thromboembolism. Continuing Medical Education Series 2006 : 39–47.
11.Matýšková M, Penka M. Interakce antikoagulačních léků s potravinami a potravinovými doplňky. Inter Med Prax 2005; 5 : 29–33.
12.Ansell J, Hirsh J, Poller L et al. The Pharmacology and Management of the vitamin K Antagonists. The Seventh ACCP Konference on Antithrombotick and Thrombolytic therapy. Chest 2004; 126 : 204–233.
13.van Aken H, Bode C, Darius H et al. Anticoagulation: The Present and Future. State–of–the–Art Review. Clin Appl Thromb Hemost 2001; 7(3): 195–204.
14.Hettiarachchi T, Lok J, Prins MH et al. Undiagnosed Malignancy in Patients with Deep Vein Thrombosis, Incidence, Risk factors, and Diagnosis. Cancer 1998; 83(1): 180–185.
15.Sbarouni E, Oakley C. Outcome of pregnancy in women with valve protheses. Br Heart J 1994; 71 : 196–201.
16.Levine MN, Raskob G, Betty RJ et al. Hemorrhagic Complications of Anticoagulant Treatment. The 7th ACCP Conference on Antithrombotick and Thrombolytic therapy. Chest 2004; 126 : 287–310.
17.Utilisation des Traitements antithrombotiques en pratique médicale courante, Recommandations du Groupe d°études sur l°hémostase et la thrombose (GEHT). Sang Thrombose Vasseaux 1996; 8(Numéro special): 1–43.
18.Bick RL. Therapy for Venous Thrombosis: Guidelines for a Competent and Cost – effective Approach. Unresolved Issues and Proposed Gudelines. Clin Appl Thromb Hemost 1999; 5(1): 2–9.
19.Laffan M, Tuddenham E. Assessing thrombotic risk. BMJ 1998; 317 : 520–523.
20.Schulman S, Wahlander K, Lindstrom T et al. For the THRIVE III Investigators. Secondary prevention of venous thromboembolism with oral direct trombin inhibitor ximelagatran. N Engl J Med 2003; 349 : 1813–1721.
21.Makris M, Greaves M, Philips W et al. Emergency oral anticoagulant reversal: the relative efficacy of infusions of fresh frozen plasma and clotting factor concentrate on correction of the coagulopathy. Thromb Haemost 1996; 77 : 477–480.
22.Kakkar VV, Lorenzo F. Prevention of venous thromboembolism in general surgery. Clin Haematol 1998; 11(2): 605–619.
23.Kearon C, Hirsh J. Management of anticoagulation before and after elective surgery. N Engl J Med 1997; 336 : 1506–1511.
24.Bulik O. Problematika stomatochirurgického ošetření v průběhu antikoagulační terapie. Čes Stomat 2003; 103(3): 102–106.
25.Bulik O. Extrakce zubů a antikoagulační terapie – srovnání různých postupů. Prakt Zub Lék 2004; 52(3): 68–77.
26.Schellong SM, Halbritter K. Management of anticoagulation before and after surgery in patiens receiving longterm VKA therapy – oral presentation. GSK Thrombosis Masterclass, Berlin 2005.
27.Dunn A, Turpie AGG. Perioperative management of patients on oral anticoagulants: a systematic rewiev. Arch Intern Med 2003; 163 : 901–908.
28.Kearon C, Lindmarker P, Weitz JI. A Time – Limited or an Indefinite–Duration Approach to Anticoagulant Therapy? Controversies in Antithrombotic Therapy. Symposium to the 42nd Annual Meeting of ASH. San Francisco 2000.
29.Penka M, Matýšková M, Buliková A et al. Příprava nemocného s dlouhodobou antikoagulační léčbou v ambulantní praxi k chirurgickému výkonu. Inter Med Prax 2000; 5 : 20–23.
30.Witt DM, Adler MA, Shanahan RL et al. Effect of a centralised clinical pharmacy anticoagulation service on the outcomes of anticoagulant service. Chest 2005; 127 : 1515–1522.
Štítky
Detská kardiológia Interné lekárstvo Kardiochirurgia Kardiológia
Článok vyšiel v časopiseKardiologická revue – Interní medicína
Najčítanejšie tento týždeň
2007 Číslo 3- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
- Intermitentní hladovění v prevenci a léčbě chorob
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Plicní arteriální hypertenze
- Přínos stanovení B-natriuretického peptidu pro monitoraci léčby chronického srdečního selhání
- Monitorování perorální antikoagulační léčby v ambulantní praxi
- Deprese u kardiovaskulárního onemocnění
- Metody nukleární medicíny v diagnostice kardiovaskulárních onemocnění
- Význam implantabilní monitorovací jednotky u pacientů s neobjasněnou synkopou
- Fallotova tetralogie
- Prof. Paul Wood a jeho kardiologie
- Klinické studie ACC 2007 – I.
- Studie ADVANCE – významný pokrok v předcházení kardiovaskulárním komplikacím u DM 2. typu
- Klinické studie ukončené, přednesené nebo publikované v nedávné době
- Kardiologická revue – Interní medicína
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Monitorování perorální antikoagulační léčby v ambulantní praxi
- Význam implantabilní monitorovací jednotky u pacientů s neobjasněnou synkopou
- Fallotova tetralogie
- Plicní arteriální hypertenze
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



