-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Angiogeneze jako součást nádorového „ekosystému“ a možnosti jejího ovlivnění
Angiogenesis as Part of the Tumor „Ecosystem“ and Possibilities to Influence It
Angiogenesis is a complex process which is critical for the growth, invasion and metastasis of tumors. In the past ten years numerous new agents have been developed as angiogenesis inhibitors. In the review, angiogenesis inhibitors are classified by their targeted area of the angiogenic process. The role of VEGF and its receptors is described in detail, but other antiangiogenic strategies such as inhibition of endothelial proliferation, inhibition of matrix metalloproteinases and use of vascular disrupting agents are also reviewed.
Key words:
vasculogenesis – angiogenesis – lymphangiogenesis – angiogenesis inhibitors – strategy of antiangiogenic therapy
Autoři: P. Klener
Působiště autorů: 1. interní hemato‑ onkologická klinika 1. LF a VFN a ÚHKT, Praha
Vyšlo v časopise: Klin Onkol 2010; 23(1): 14-20
Kategorie: Přehledy
Souhrn
Angiogeneze je komplexní proces, který má zásadní význam pro růst nádoru, invazivitu a metastazování. V posledních deseti letech byl připraven větší počet látek působících inhibici angiogeneze. V tomto sdělení jsou angiogenní inhibitory roztříděny podle cílového místa zásahu do procesu angiogeneze. Podrobně je popsána úloha VEGF a jeho receptorů, ale jsou uvedeny i další antiangiogenní strategie, jako je inhibice endoteliální proliferace, inhibice matrixmetaloproteáz nebo použití látek působících disrupci nádorových cév.
Klíčová slova:
vaskulogeneze – angiogeneze – lymfangiogeneze – inhibitory angiogeneze – antiangiogenní strategieÚvod
Poznatky o významu nádorového mikroprostředí („ekosystému“) pro biologické chování nádoru (invazivita, angiogeneze, metastazování) vedly k zásadní proměně nazírání na povahu nádorového onemocnění od redukcionistického pohledu až k pohledu vysoce komplexnímu (obr. 1). Právě angiogeneze může být modelovým příkladem vzájemných interakcí nádorových buněk a nádorového mikroprostředí.
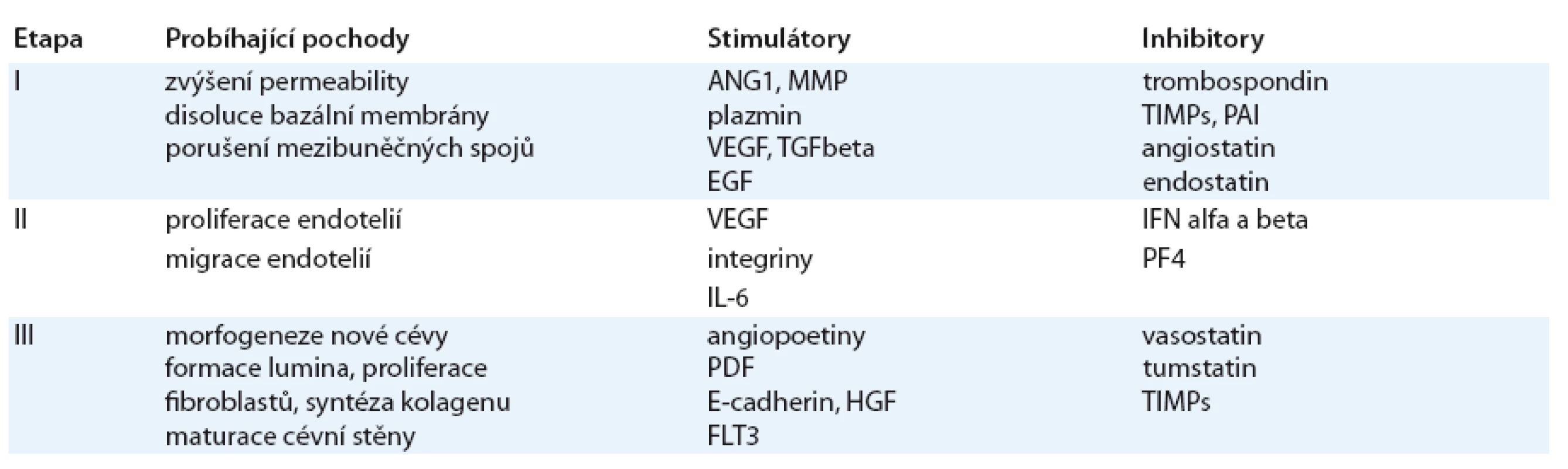
Obr. 1. Redukcionistický a komplexní pohled na nádor. ECM – extracelulární matrix, F – fibroblast, M – makrofág, NB – nádorová buňka, DB – dendritická buňka, L – lymfocyt, C – céva. 
Mechanizmy vaskulogenze a angiogeneze
Nádor z počátku roste v poměrně hostilním prostředí kompaktní tkáňové architektury pod vlivem specifické směsi různých extracelulárních působků v silně hypoxickém a kyselém prostředí a pod imunologickým dozorem. V průběhu růstu nádor často kooptuje rozličné typy nemaligních buněk (fibroblasty, osteoblasty, osteoklasty, stromální buňky, makrofágy, endotelie, lymfocyty aj.), které pak namísto inhibice vytvářejí permisivní mikroprostředí pro přežití nebo pro další růst a šíření nádoru [1]. Je tedy zcela evidentní, že tyto nové poznatky nacházejí odezvu i v pokusech o nové přístupy v léčebných strategiích, které mohou být cíleny, kromě samotných nádorových buněk, také na nejvýznamnější faktory, jež se na invazivitě a šíření nádoru podílejí. Jedním z možných terapeutických cílů je i novotvorba cév – vaskulogeneze a angiogeneze.
Vaskulogeneze je proces vývoje cév z endoteliálních prekurzorů, nezávislý na preexistujících cévách, který se uplatňuje zejména při tvorbě primitivních embryonálních cév a nepochybně má svou roli i při novotvorbě cév nádoru. Jsou za ni odpovědné cirkulující endoteliální prekurzory, jejichž mobilizaci působí stejné faktory, jaké hrají klíčovou roli i v angiogenezi [2]. Angiogeneze, tj. neovaskularizace v širším slova smyslu, následuje vaskulogenezi [3]. Za fyziologických okolností se uplatňuje nejen při embryogenezi, ale též např. při hojení ran nebo ovulaci. Je regulována humorálními faktory angiogenními a antiangiogenními, které jsou za normálních okolností v rovnováze. Jejich přehled je uveden v tab. 1 a podrobněji jsou popsány níže.
Tab. 1. Přehled mediátorů angiogeneze. 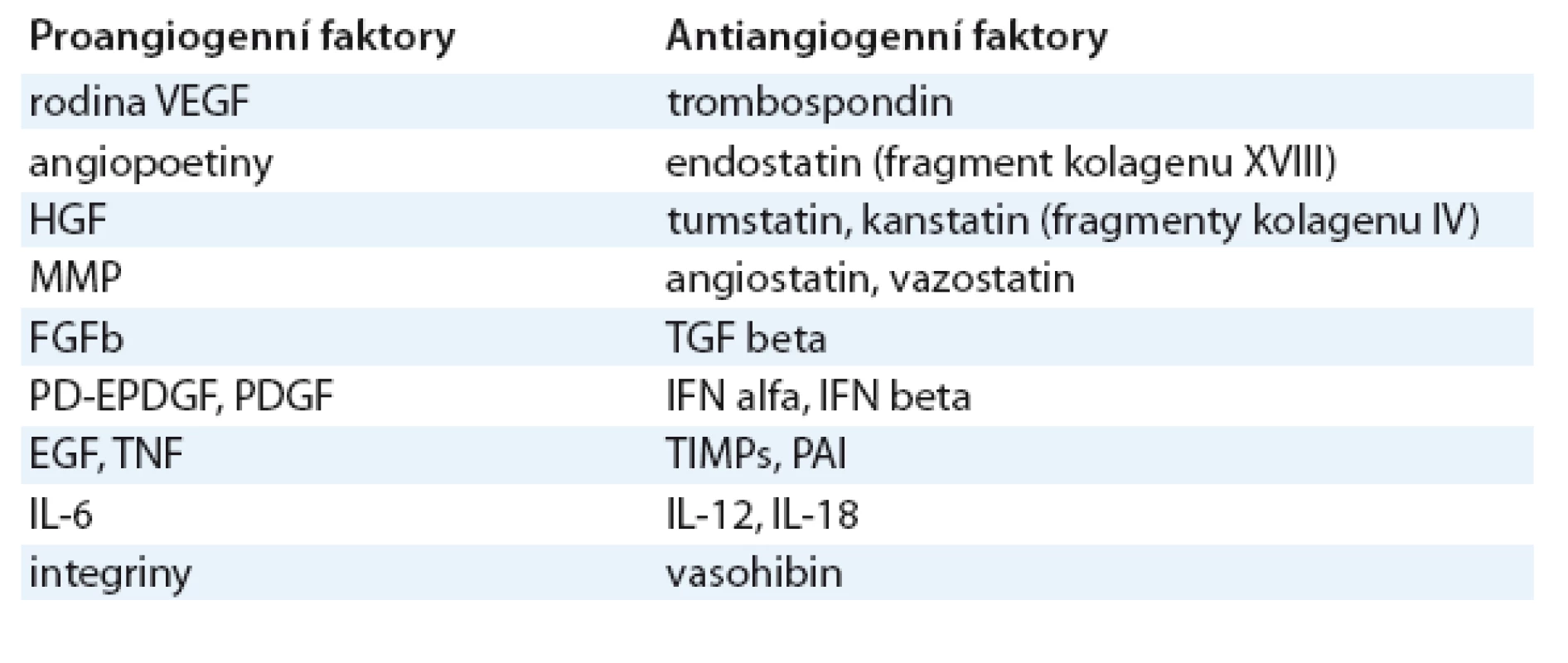
Význam angiogeneze pro růst a šíření nádoru byl poznán již na sklonku minulého století. Ukázalo se, že nádor (metastáza) potřebuje ke svému růstu přísun živin a kyslíku. Pokud nádor nezíská schopnost novotvořit cévy, nemůže po dosažení určité velikosti cca 100 µm (což je difuzní limit pro kyslík) dále růst [4]. Dochází k deregulaci angiogenního procesu a k převaze angiogenních faktorů, jež vyústí v tzv. angiogenní přepnutí (angiogenní switch), a začnou se vytvářet nové cévy vyživující rostoucí nádor [5]. Impulzy pro výdej angiogenních faktorů jsou jednak epigenetické, jednak genetické, jak ukazuje obr. 2. Z epigenetických faktorů je nejvýznamnější hypoxie. Regulace výdeje VEGF v závislosti na tenzi kyslíku se zúčastní tumor supresorový gen VHL (von Hippel Lindau), který za normoxie potlačuje výdej VEGF degradací transkripčního faktoru HIF1alfa (hypoxia inducible factor alpha). Za hypoxie dochází naopak ke stabilizaci HIF1alfa a k jeho transportu do jádra, kde se váže na specifickou sekvenci HRE (hypoxia response element) a stimuluje transkripci a následnou expresi VEGF. Angiogeneze se pak uskutečňuje různými mechanizmy [6–7]. Nejvýznamnější je tzv. angiogeneze pučením („sprouting angiogenesis“), která probíhá v několika etapách označovaných jako angiogenní kaskáda (tab. 2).
Obr. 2. Indukce angiogenních faktorů. 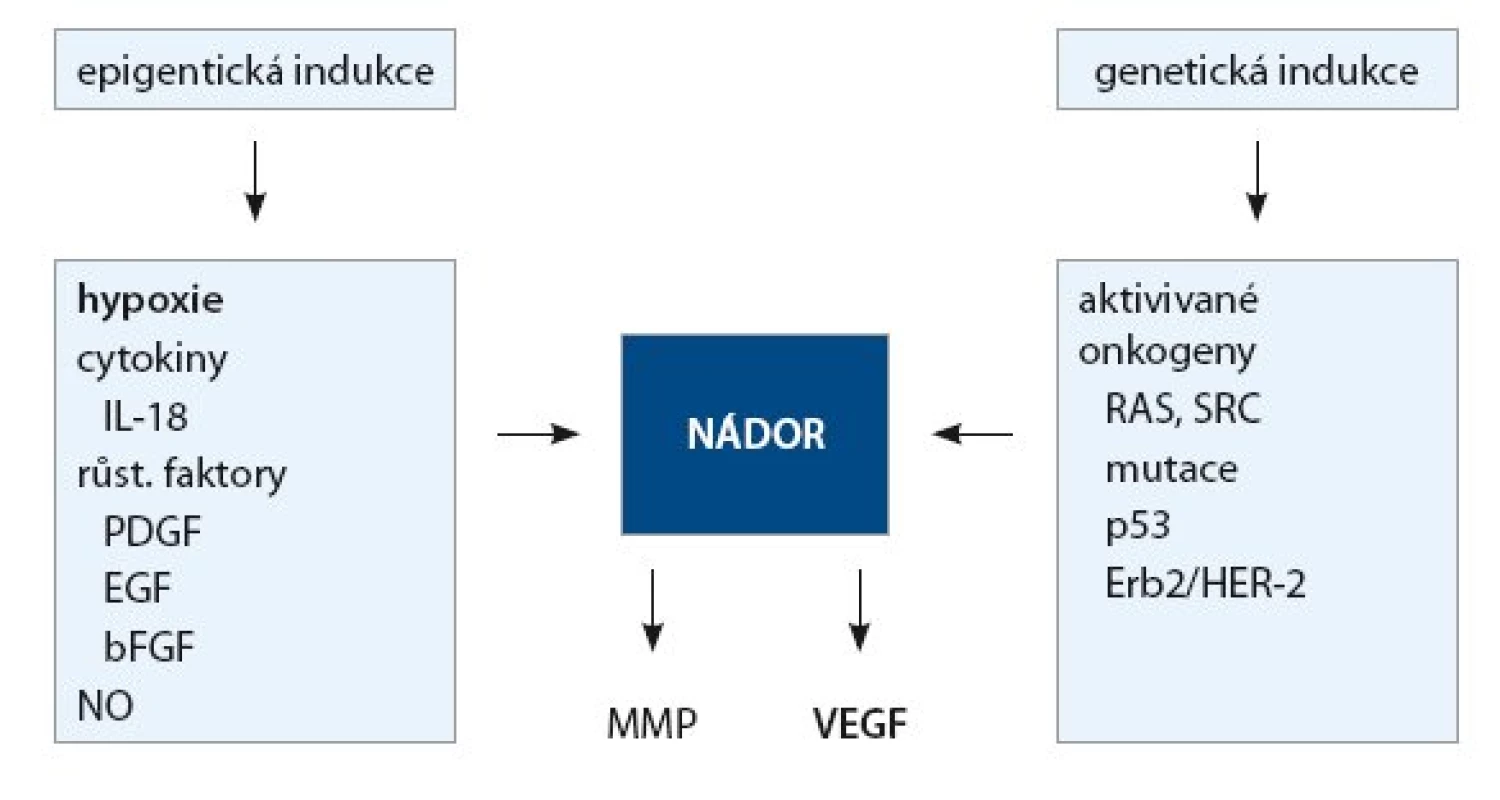
Kromě toho může krev protékat avaskulárními kanály tvořenými nádorovými buňkami (vaskulogenní mimikry) nebo jsou stěny cévy částečně tvořeny nádorovými buňkami (tzv. mozaikové cévy), popřípadě roste nádor podél již vytvořených cév (tzv. koopce cév).
Zmíněné alternativy angiogeneze pučením jsou předmětem intezivního studia, neboť se těmto mechanizmům připisuje významný podíl na invazivitě a metastazování pokročilých nádorů. Vaskulogenní mimikry byly již počátkem minulého desetiletí popsány jako důležitý faktor progrese a metastazování vysoce agresivních forem maligního melanomu [8]. Vytváření mikrovaskulárních kanálů se děje bez účasti endoteliální proliferace a připisuje se plasticitě geneticky dysregulovaných nádorových buněk stimulovaných hypoxií [9]. To znamená, že standardní antiangiogenní léčba nemusí být za těchto okolností účinná. Podíl vaskulogenních mimikrů na agresivitě a šíření nádoru byl následně prokázán též u karcinomu ovaria, prostaty, inflamatorního karcinomu prsu a u sarkomů měkkých tkání. Terapeutické postupy k omezení vaskulogenních mimikrů se dosud hledají.
Novotvořené cévy jsou nevyzrálé, chaotické, strukturálně defektní, bez souvislé bazální membrány a téměř bez podpůrných stabilizačních buněk pericytů a hladkých svalových buněk. To vede k vysokému průniku plazmy do intersticia (leakage) a ke zvyšování intratumorózního tlaku. Důsledkem toho dochází ke špatnému průtoku krve nádorem, k hypoxickým nekrózám, a tím k další stimulaci angiogeneze. Významně klesá také průnik cytostatik do nádoru.
Angiogenní faktory
Nejvýznamnějším a nejprozkoumanějším angiogenním faktorem je VEGF (vascular endothelial growth factor), resp. rodina VEGF a jejich příslušných receptorů (obr. 3). Členové rodiny VEGF významným způsobem stimulují proliferaci, migraci a přežití aktivovaných endotelových buněk. Existuje šest variant VEGF (VEGF A E a PIGF (placenta induced growth factor), který je homologní s VEGF A. Faktory VEGF jsou dimerické glykoproteiny, které se za patologických okolností uvolňují především z nádorových buněk. VEGF A, VEGF B a VEGF E mají podobné biologické účinky. Stimulují proliferaci a migraci endotelií a zvyšují cévní permeabilitu. Naproti tomu VEGF C a VEGF D hrají významnou roli při stimulaci lymfangiogeneze. Jejich zvýšená exprese byla nalezena zejména u nádorů metastazujících lymfatickou cestou. Vazbou VEGF na VEGFR se spustí transdukční kaskáda, jejímž výsledkem je zvýšená proliferace endotelových buněk, stimulace jejich migrace a zvýšení permeability cév [10].
Obr. 3. Rodina VEGF a receptory pro VEGF. 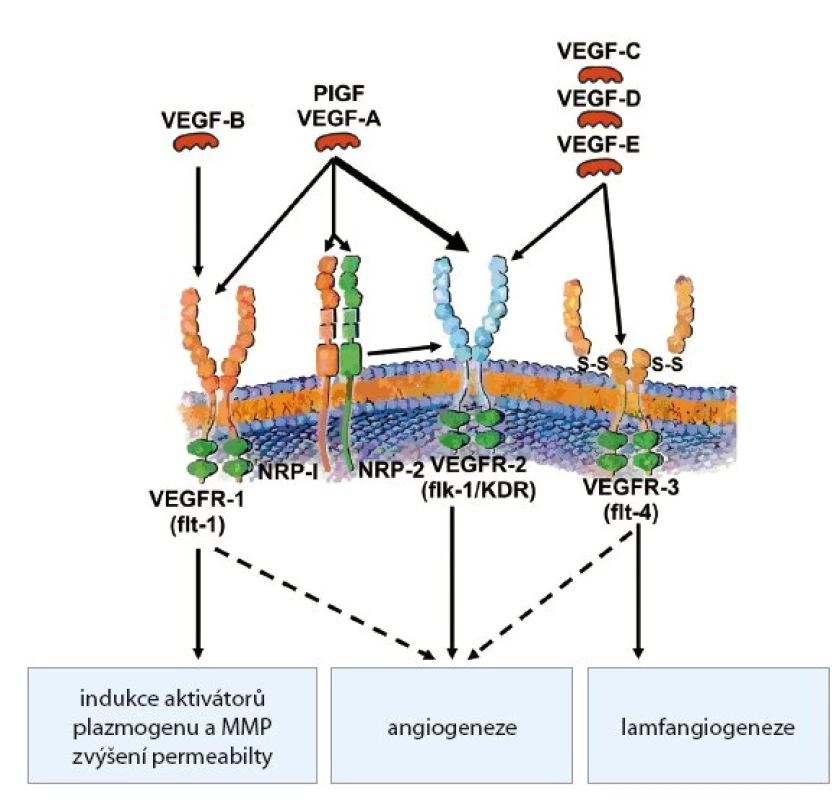
Receptory pro VEGF (VEGFR) mají intracytoplazmatickou tyrozinkinázovou aktivitu, která zprostředkovává přenos signálu do buňky. Existují tři receptory pro VEGF: VEGFR1/FLT1 (FMS like tyrosinkinasae 1), VEGFR 2/KDR/FLK1 (kinase domain receptor/fetal liver kinase 1) a VEFR3/FLT4 (FMS like tyrosinkinase 4). VEGFR1 a VEGFR2 indukují proliferaci a migraci endotelií, snižují jejich citlivost k apoptóze a zvyšují cévní permeabilitu. VEGFR2 je nejčastěji zvýšeně exprimovaným receptorem na nádorových endoteliích, a byl proto logicky jedním z prvních cílů antiangiogenní terapie. VEGFR3 je exprimován zejména na lymfatických cévách.
VEGF A je ligandem ještě pro neuropilinové receptory NP 1 (neuropilin 1). Mají roli koreceptorů pro VEGFR2 a jejich stimulace podporuje angiogenezi [11].
Mezi regulátory angiogeneze patří též angiopoetiny (angiopoetin 1-ANG1 a angiopoetin 2-ANG2), které mají pleiotropní a zdánlivě protichůdné účinky. Na rozdíl od VEGF nepůsobí mitogenně na endotelie, ale regulují především integritu endotelových buněk a pericytů (perivaskulárních buněk) a působí maturaci cév. ANG1 je produkován hlavně hladkými svalovými buňkami, destabilizuje endotelie a usnadňuje angiogenezi, kdežto ANG2 produkovaný endoteliemi je důležitý pro maturaci a remodelaci nově vzniklé cévy. Oba angiopoetiny se vážou na společný receptor označovaný jako TIE 2 [12–13]. Zvýšená exprese TIE 2 byla prokázána zejména na lymfatických cévách.
Kromě toho se na rozvoji angiogeneze mohou podílet i buňky mikroprostředí, které sekretují jednak různé angiogenní substance (VEGF, FGF2, IL 8) a jednak proteázy uvolňující z extracelulární matrix růstové faktory [14–15].
Antiangiogenní faktory
Antiangiogenní faktory lze dělit na štěpné produkty extracelulární matrix (ECM) a na „non ECM faktory“ vznikající štěpením proteinů mimo ECM. Trombospondin (TSP1) patří mezi nejdéle známé přirozené inhibitory angiogeneze [16]. Je to glykoprotein ECM s výrazně pleitropními účinky. Reguluje adhezi, proliferaci a přežití endotelových buněk a inhibuje růst a metastazování nádorů. Endostatin je štěpný fragment kolagenu XVIII. Podobné účinky mají štěpné produkty kolagenu IV tumstatin, kanstatin či arresten. Mezi „non ECM faktory“ patří angiostatin, štěpný produkt plazminogenu. Blokuje migraci a proliferaci endotelových buněk a vyvolává u nich apoptózu. Podobné účinky má i vazostatin. K sekretovaným antiangiogenním faktorům patří dále destičkový faktor 4 (PF4), interferony (IFN alfa a beta), některé interleukiny (IL 12, IL 18), TGFbeta a dále inhibitory proteáz TIMP (tissue inhibitor of matrixmetalloproteinase) a PAI (plasminogen activation inhibitor).
Kromě těchto „zevních“ inhibitorů existuje též vnitřní inhibitor vazohibin (VASH1), exprimovaný endoteliemi účinkem VEGF (VEGFR2) [17]. Mechanizmem zpětné vazby potlačuje VEGFR transkripci [18–19].
Léčebné strategie zaměřené na angiogenezi
K inhibici angiogeneze slouží různé způsoby. Je to použití přirozených antagonistů angiogeneze nebo blokáda angiogenních faktorů.
Použití přirozených antagonistů angiogeneze
Aplikace antiangiogenních faktorů se zatím v klinické praxi příliš neuplatňuje, i když pilotní studie s některými antiangiogenními faktory přinášely slibné výsledky. Nejvíce klinických studií bylo věnováno přípravku ABT 510, což je substituovaný nonapeptid s vlastnostmi přirozeného trombospondinu 1. Blokuje odpověď na angiogenní podněty a podporuje apoptózu endotelií [20]. V experimentu byla prokázána jeho schopnost potlačit růst transplantovaných nádorů, ale v klinické praxi se jeho použití nerozšířilo. Rovněž rekombinantně připravený angiostatin a endostatin nenašly praktické uplatnění. Rekombinantně připravený destičkový faktor 4 (rhPF4) se zkoušel u Kaposiho sarkomu a u maligního melanomu, ale výsledky nebyly jednoznačně pozitivní.
Nejvíce prověřená je blokáda angiogenní kaskády, zaměřená především na inhibici signální dráhy VEGF VEGFR, inhibici endoteliální proliferace a stabilizaci bazální membrány.
Inhibice signální dráhy VEGF VEGFR
Angiogenní účinek VEGF lze blokovat na několika úrovních (obr. 4). Blokádou ligandu, blokádou vazebné domény receptoru nebo blokádou tyrozinkinázové domény receptoru. Nejvíce zkušeností je zatím s neutralizací ligandu VEGF humanizovanou monoklonální protilátkou bevacizumabem (Avastin). Bevacizumab váže volný VEGF A, VEGF B i VEGF C, a účinně tak blokuje novotvorbu cév [21]. Používá se výhradně v kombinaci s chemoterapií. Další možností je eliminace VEGF ligandu použitím solubilního „decoy“ VEGF receptoru (decoy = návnada, vějička) s názvem VEGF trap (aflibercept), který působí jako kompetitivní inhibitor VEGF receptorů [22]. Jinou, dosud v praxi nevyužívanou možností by bylo použití blokační monoklonální protilátky proti vazebné doméně příslušných receptorů.
Obr. 4. Signální dráha VEGF a možnosti její inhibice. 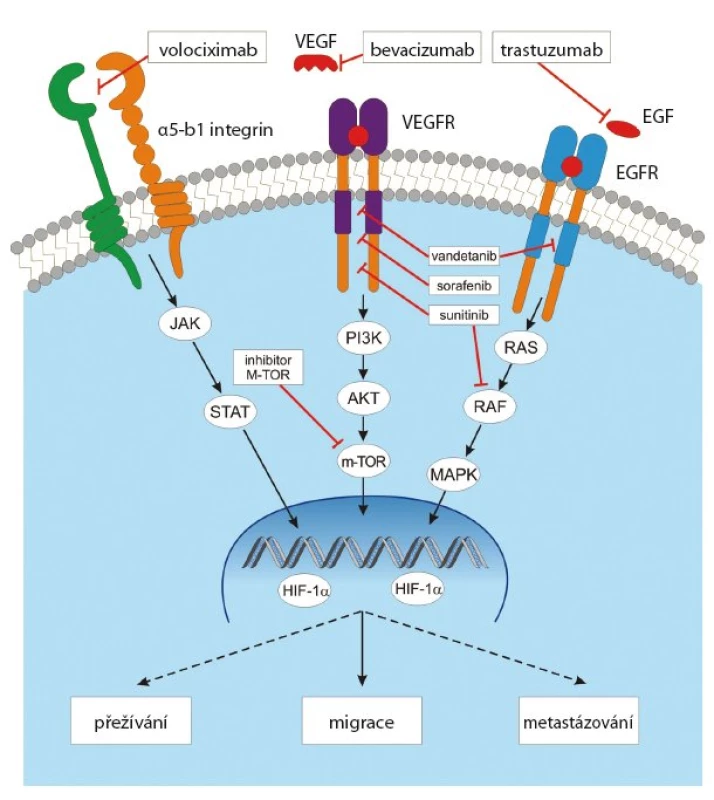
Slibnou strategii představuje blokáda tyrozinkinázové domény intracelulární části receptorů pro angiogenní faktory (VEGF, FGF2 aj.) použitím tyrozinkinázových inhibitorů (TKI). Výhodou většiny používaných TKI je jejich účinek proti většímu počtu receptorových tyrozinkináz (multikinázové inhibitory). Vzhledem k tomu, že novotvorba cév je vysoce komplexní proces, na kterém se účastní mnoho angiogenních faktorů současně, zdá se logické, že multikinázové TKI mají výhodu proti vysoce selektivnímu účinku bevacizumabu [23]. Přehled TKI je v tab. 3. Signální kaskády většiny RTK účastnících se angiogeneze (VEGFR, PDGFR, FGFR, EGFR apod.) vedou k aktivaci PI3K AKT mTOR dráhy. Inhibitorym TOR proto také vykazují výrazný antiangiogenní účinek a představují vhodné látky pro kombinovanou antiangiogenní léčbu.
Tab. 3. Inhibitory receptorových tyrozinkináz s antiangiogenní aktivitou. 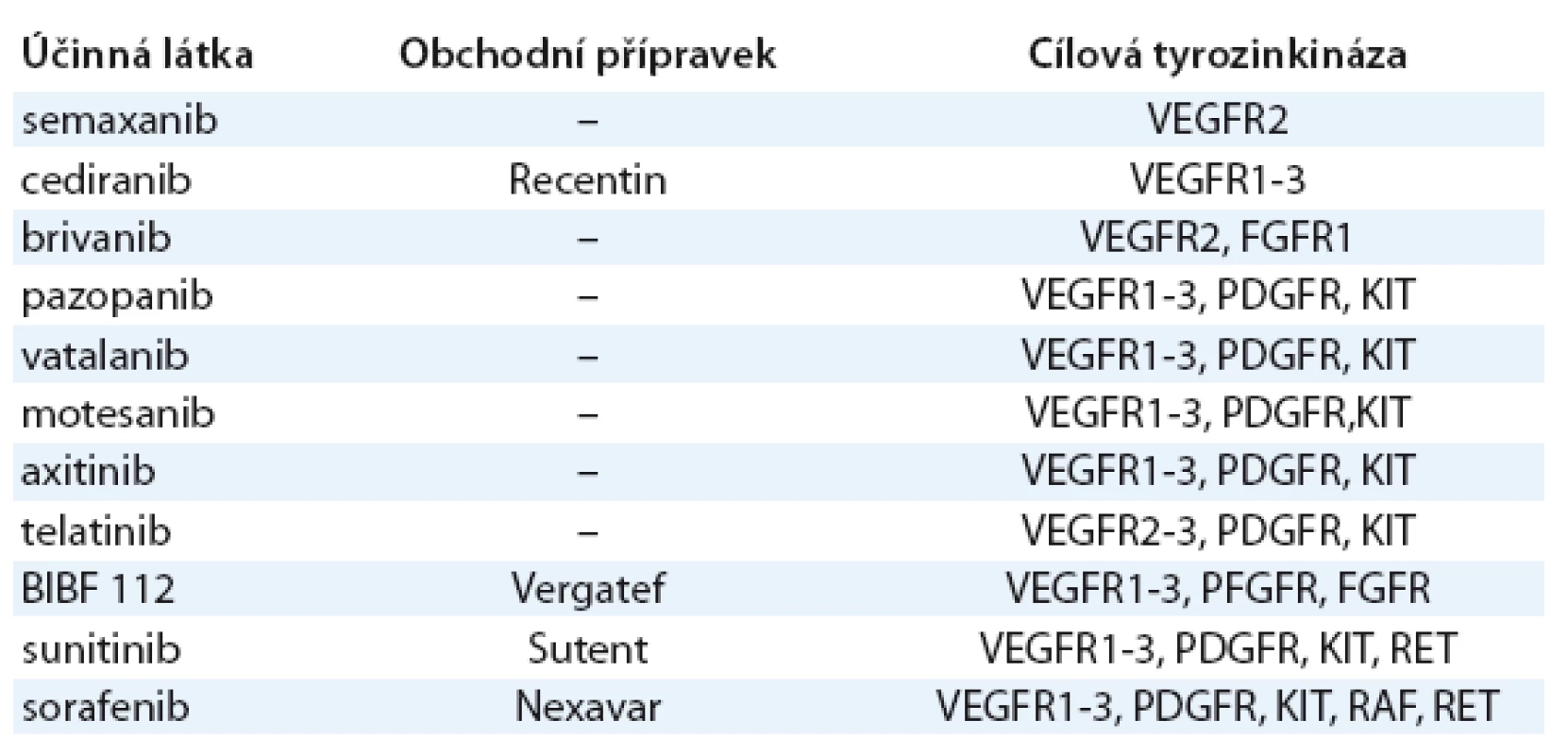
Kromě inhibice signální dráhy VEGF VEGFR se testuje též inhibice dalších relevantních proangiogenních kaskád (inhibicí receptorů pro EGF, pro integriny). Zkouší se též potlačení angiogenní aktivity neutralizací angiopoetinů. Rekombinantně připravený fúzní protein s vysokou afinitou vůči angiopoetinům AGM 386 se zdá být efektivní v léčbě solidních nádorů (v kombinaci s chemoterapií). Zabrání stimulaci receptorů TIE 2, a tím omezí angiogenní aktivitu angiopoetinů [24].
Inhibice proliferace endotelových buněk
Blokádou proliferace endotelií účinkuje fumagilin, extrakt z houby Aspergillus fumigatus, který se však pro výraznou toxicitu v klinické praxi neuplatnil. Využití méně toxického syntetického analoga AGM 1410 bránila značná neurotoxicita. Naproti tomu pegylovaná forma TNP 470 (Lodamin) je netoxická, jeví efekt u jaterních metastáz, a protože proniká hematoencefalickou bariérou, zkouší se i v léčbě mozkových nádorů [25].
Interferony alfa a beta tlumí proliferaci endotelií a používají se s dílčími úspěchy k omezení angiogeneze u progredujících angiomů [26]. Inhibice endoteliální proliferace se předpokládá jako jeden z mechanizmů antiangiogenního účinku imunomodulačních látek (IMIDs), mezi něž patří talidomid, pomalidomid a lenalidomid [27].
Stabilizace bazální membrány
Stabilizace bazální membrány znesnadňuje pučení endotelií mimo cévu. Inhibice enzymů, které bazální membránu rozrušují, může mít proto významný antiangiogenní účinek. K prostředkům cíleným na stabilizaci bazální membrány patří zejména inhibitory matrixmetaloproteáz (marimastat, batimastat, prinomastat) [28]. Výsledky klinických studií však nebyly přesvědčivé.
Disrupce nádorových buněk (VDA)
VDA (vascular disruption agents) vykazují cytotoxický účinek vůči již vytvořené nádorové vaskulatuře, a představují tak alternativní přístup směřující k blokádě cévního zásobení nádoru [29]. Mezi VDA látky patří kombrestatiny, výtažky z africké rostliny Combretum caffrum, které indukují apoptózu endotelií a destabilizují mikrotubuly (většinou působí jejich depolymeraci). Vyvolají následně kolaps a nekrózu vaskulatury nádoru [30]. Mezi nejúčinnější VDA patří ketopiperazinový analog NPI 2358 (plinabulin) nebo combrestatin A4-fosfát (fosbretabulin – Zybrestat), který vyvolá až stonásobné snížení průtoku krve nádorem s minimálním ovlivněním perfuze zdravých tkání. Zybrestat je „prodrug“, v endotelových buňkách se konvertuje na kombrestatin. K dalším VDA ve stadiu klinického testování patří soblidotin (TZT 1027), derivát dolastatinu 10. Také flavonoidy vykazují účinky podobné VDA. Mezi klinicky prověřované látky patří např. vadimezan – DMXAA (5,6-dimethylxanthenon 4-acetic acid), který v kombinaci s chemoterapií prodloužil dobu přežití u nemocných s NSCLC průměrně o 5 měsíců, ve srovnání se samotnou chemoterapií [31].
Další antiangiogenní strategie
V procesu angiogeneze se uplatňují ještě další procesy, které rovněž představují terapeutické cíle. Uplatňuje se stimulační vliv extracelulární matrix prostřednictvím integrinových receptorů. Proto monoklonální protilátky proti integrinům, jako např. volociximab, mohou tento proangiogenní účinek úspěšně blokovat (obr. 4). Za specifický inhibitor angiogeneze se považuje selektivní antagonista alfa v beta5 integrinu cilengitid [32]. Jde o cyklický peptid, který kromě antiangiogenního účinku blokuje též proliferaci a migraci CD133+ endotelových progenitorových buněk. Inhibitory HSP90 (heat shock proteins) působí antiangiogenně tím, že destabilizují HIF1alfa, významný transkripční faktor angiogeneze. Destabilizaci vazby HIF1alfa na HSP90 působí také hyperacetylace HSP90 způsobená účinkem inhibitorů histiondeacetyláz. Komplexní antiangiogenní účinek se uplatňuje u imunomodulačních látek (IMIDs).
Antiangiogenní účinky byly prokázány též u inhibitorů antiapoptotického proteinu BCL2. VEGF podněcuje expresi BCL2 jak v nádorových, tak i v endotelových buňkách. Upregulace BCL2 stimuluje výdej proapoptotických chemokinů CXCL1 a CXCL8 a aktivuje signální dráhu nukleárního faktoru kappa B (NFkB). Aplikace inhibitorů BCL2 (gossypol, obatoclax, ABT 737) působí zvýšenou apoptózu endotelových buněk a omezí proces angiogeneze [33].
Jako efektivní antiangiogenní léčba se jeví opakovaná aplikace velmi nízkých dávek cytostatik (např. cyklofosfamid 50mg denně nebo etopozid 50mg denně). Tato metoda se nazývá metronomická chemoterapie. Nevykazuje toxické účinky na nádorové buňky, ale je schopna ničit a inhibovat endotelové buňky včetně cirkulujících endotelových prekurzorů, a tím omezovat angiogenezi [34]. Kromě toho nízké dávky cytostatik indukují výdej antiangiogenního trombospondinu [35–36]. Za výhodu metronomické chemoterapie lze považovat i skutečnost, že k této léčbě nevzniká rezistence, neboť je cílena na normální, geneticky stabilní endotelie, které rezistenci nepodléhají. Současně aplikovaná antiangiogenní léčba potencuje účinnost metronomické chemoterapie [37]. Rozdíly mezi konvenční a metronomickou chemoterapií uvádí v přehledu tab. 4.
Tab. 4. Rozdíly mezi konvenční a metronomickou chemoterapií. 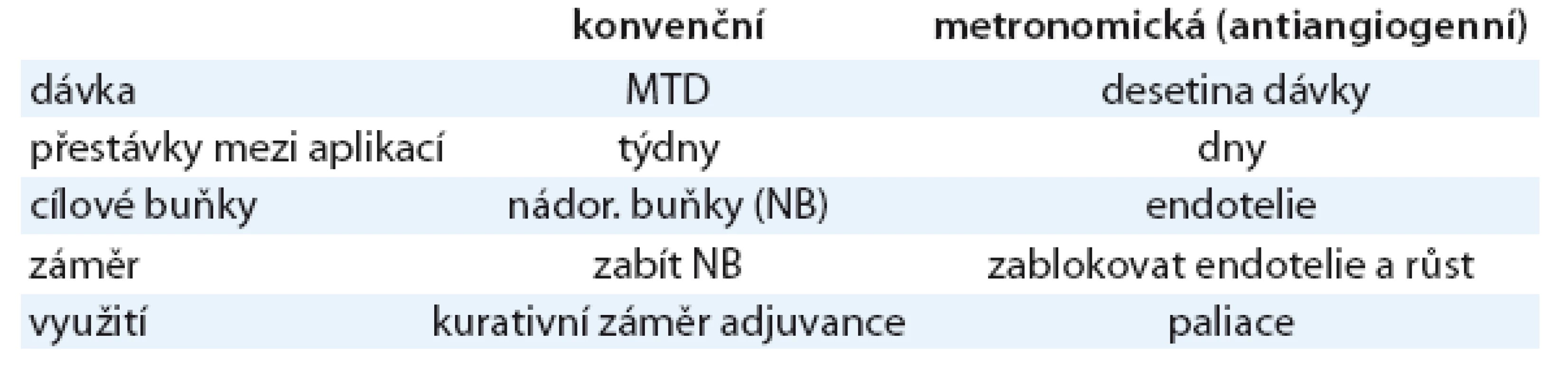
K antiangiogenní léčbě lze použít též protisměrné (antisense) oligonukleotidy proti mRNA pro VEGF (např. veglin) nebo specifické ribozymy (např. antiangiogenní ribozym angiozym). Dílčí antiangiogenní účinky byly zaznamenány také u většího počtu konvenčních chemoterapeutik (např. doxorubicin, taxany, 2-metoxyestradiol aj.).
Inhibice lymfangiogeneze
Novotvorba lymfatických cév je proces podobný novotvorbě krevních cév, nicméně lze uvést určitá specifika [38–39]. Lymfatické kapiláry vznikají slepě ve tkáních, jsou silně fenestrované a prakticky postrádají podpůrné buňky (pericyty či hladké svalové buňky). V průběhu embryonálního vývoje vznikají lymfatické cévy transdiferenciací z venózního systému vlivem traskripčního faktoru PROX1 (prospero related homeobox 1), který se považuje za marker lymfatických cév. Mezi specifické markery lymfatických cév patří dále VEGFR3, LYVE1 (lymphatic vessel endothelial receptor 1) a podoplanin (PDPN) [40–41]. Membránově exprimovaný podoplanin navíc oslabuje mezibuněčné adheze a stimuluje transendoteliální migraci maligních elementů do systémového řečiště a usnadňuje vznik metastáz [42]. Také hustota lymfatických cév v nádoru a v perinádorové tkáni je spojena s vyšším metastatickým potenciálem.
K potlačení novotvorby či destrukci lymfatických cév se používají obdobné strategie jako k inhibici krevních cév [43]. Z preklinicky a klinicky testovaných látek cíleně zaměřených na lymfangiogenezi lze uvést protilátky proti VEGFR3 či chimérické VGFR3 receptory (VGFR3-trap). Jako nadějná se jeví i cílená inhibice podoplaninu, který je zvýšeně exprimován nejen na lymfatických cévách, ale i na mnoha typech nádorových buněk.
K jeho inhibici lze použít monoklonální protilátku DM 3501. Klinicky se zkouší také rekombinantní neutralizační peptibody AMG 386 blokující interakci angiopoetinů ANG1 a ANG2 s TIE2 receptory. Tím se blokuje nejen lymfangiogeneze, ale též vaskulární angiogeneze. Látka je účinná zejména v kombinaci s chemoterapií [44].
Závěr
Angiogeneze je významná součást nádorového mikroprostředí (,,ekosystému“), která se podílí na růstu nádoru a jeho metastazování. Inhibice angiogeneze představuje významný přínos k protinádorové léčbě. Nabývá větší účinnosti v kombinaci s chemoterapií nebo s jinými modalitami cílené léčby.
Práce podpořena Výzkumným záměrem MSM 0021620808.
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
The author declares he has no potential conflicts of interest concerning drugs, pruducts, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.prof. MUDr. Pavel Klener, DrSc.
1. interní klinika 1. LF a VFN
U nemocnice 2
128 08 Praha 2
e-mail: pavel.klener@ruk.cuni.cz
Zdroje
1. Witz IP. The tumor microenvironment: the making of paradigm. Cancer Microenviron 2009 (Suppl 1) 9 – 17.
2. Goldie LC, Nix MK, Hirschi KK. Embryonic vasculogenesis and hematopoietic specification. Organogenesis 2008, 4 : 257 – 263.
3. Kerbel RS. Tumor angiogenesis. New Engl J Med 2008; 358 : 2039 – 2049.
4. Folkman J. Tumour angiogenesis: therapeutic implications. New Engl J Med 1971; 285 : 1182 – 1188.
5. Baeriswyl V, Christofori G. The angiogenic switch in carcinogenesis. Semin Cancer Biol 2009; 19: Epub ahead of print.
6. Naňka O, Grim M. Utváření cévního řečiště: přehled molekulárních mechanismů a možnosti terapeutického ovlivnění. Čas Lék Čes 2009; 148 : 158 – 163.
7. Klener P. Význam inhibice angiogeneze v protinádorové léčbě. Remedia 2005; 15 : 384 – 389.
8. Folberg R, Hendrix MU, Maniotis AJ. Vasculogenic mimicry and tumor angiogenesis. Am J Pathol 2000; 156 : 361 – 381.
9. Monzani E, La Porta CA. Targeting cancer stem cells to modulate aalternative vascularization mechanisms. Srem Cell Rev 2008; 4 : 51 – 56.
10. Shinkaruk B, Bayle M, Lain G et al. Vascular endothelial cell growth factor (VEGF), an emerging target for cancer chemotherapy. Curr Med Chem Anticancer Agents 2003; 2 : 95 – 117.
11. Favier B, Alam A, Barron P et al. Neuropilin‑2 interacts with VEGFR ‑ 2 and VEGFR ‑ 3 promotes human endothelial cell survival and migration. Blood 2006; 108 : 1243 – 1250.
12. Morisada T, Oike Y, Yamada Y et al. Angiopoetin‑1 promotes LYVE ‑ 1 - positive lymphatic vessel formation. Blood 2005; 105 : 4649 – 4656.
13. Scharpfenecker M, Fiedler U, Reiss Y et al. The Tie ‑ 2 ligand angiopoetin‑2 destabilizes quiescent endothelium through an internal autocrine loop mechanism. J Cell Science 2005; 118 : 771 – 780.
14. Zumsteg A, Gerhard C. Corrupt policeman: inflamatory cells promote tumor angiogenesis. Curr Opin Oncol 2009; 21 : 60 – 70.
15. Christensen J, Anderes K. Beyond VEGF: Targeting tumor growth and angiogenesis via alternative mechanisms. Adv Exp Med Biol 2008; 610 : 43 – 53.
16. Bornstein P. Thrombospondins function as regulators of angiogenesis. J Cell Commun Signal 2009; Epub ahead of print.
17. Hosaka T, Kimura H, Heishi T et al. Vasohibin‑1 expression in endothelium of tumor blood vessels regulates angiogenesis. Am J Pathol 2009; 175 : 430 – 439.
18. Watanabe K, Hasegavwa Y, Yamashito H et al. Vasohibin as an endothelium ‑ derived negative feedback regulator of angiogenesis. J Clin Invest 2004; 114 : 898 – 907.
19. Kern J, Steurer M, Gasti G et al. Vasohibin inhibits angiogenic sprouting in vitro and supports vascular maturation processes in vivo. BMC Cancer 2009; 9 : 284 – 287.
20. Rusk A, McKeegan E, Haviv F et al. Preclinical evaluation of antiangiogenic thrombospondin‑1 peptide mimetics, ABT ‑ 526 and ABT ‑ 510, in companion dog with naturally occuring cancers. Clin Cancer Res 2006; 12 : 7444 – 7455.
21. Klener P. Nové možnosti využití bevacizumabu v protinádorové léčbě. Remedia 2008; 18 : 57 – 62.
22. Chu QS. Aflibercept (AVE 0005): an alternative strategy for inhibiting tumour angiogenesis by vascular endothelial growth factors. Expert Opin Biol Ther 2009; 9 : 263 – 271.
23. Fujita Y, Abe R, Shimizu H. Clinical approaches toward tumor angiogenesis: past, present and future. Curr Pharm Des 2008; 14 : 3820 – 3834.
24. Mita AC, Wang D, Takimoto CH et al. AMG 386, a selective angiopoetin 1/ 2 neutralizing peptibody, in combination with chemotherapy in adult patients with advanced solid tumors. J Clin Oncol 2007; 25 : 14033.
25. Benny O, Fainaru O, Adini A et al. An orally small‑molecule formulation with antiangiogenic and anticancer activity. Nat Biotechnol 2008; 7 : 799 – 807.
26. Jimenéz ‑ Hernández E, Dueňas ‑ González MT, Quintero‑Curiel JL et al. Treatment with interferon‑alpha ‑ 2b in children with life ‑ threatening hemangiomas. Dermatol Surg 2008; 34 : 640 – 647.
27. Dredge K, Marriott JB, Macdonald CD et al. Novel thalidomide analogues display anti‑angiogenic activity independently of immunomodulatory effects. Br J Cancer 2002; 87 : 1166 – 1172.
28. Rýdlová M, Holubec L jr, Ludvíková M jr et al. Biological activity and clinical implications of matrix metalloproteinases. Anticancer Res 2008; 28 : 1389 – 1397.
29. Gridelli CM, Rossi A, Maione P et al. Vascular disrupting agents: a novel mechanism of action in the battle against non‑small cell lung cancer. Oncologist 2009; 14 : 612 – 620.
30. Hinnen P, Eskens FA. Vascular disrupting agents in clinical development. Br J Cancer 2007; 96 : 1159 – 1165.
31. McKeage MJ, Reck M, Jameson MB et al. Phase II study of ASA404 (vadimezan, 5,6 - dimethylxanthenone ‑ 4 - acetic ‑ acid/ DMXAA) 1800 mg/ m2 combined with carboplatin and paclitaxel in previously untreated advanced non‑small cell lung cancer. Lung Cancer 2009; 65 : 192 – 197.
32. Cai W, Chen X. Anti angiogenic cancer therapy based on integrin alphavbeta3 antagonism. Anticancer Agents Med Chem 2006; 5 : 407 – 428.
33. Zeitlin BD, Zeitlin IJ, Nor JE. Expanding circle of inhibition: small‑molecule inhibitors of Bcl ‑ 2 as anticancer and antiangiogenic agents. J Clin Oncol 2008; 26 : 4180 – 4188.
34. Scharovsky OG, Mainetti LE, Rozados VR. Metronomic chemotherapy: changing the paradigm that more is better. Curr Oncol 2009; 16 : 7 – 15.
35. Bertolini F, Paul S, Manusco P et al. Maximum tolerable dose and low‑dose metronomic chemotherapy have opposite effects on the mobilization and viability of circulating endothelial progenitor cells. Cancer Res 2003; 63 : 4342 – 4346.
36. Kerbel RS. Improving conventional or low dose metronomic chemotherapy with targeted antiangiogenic drugs. Cancer Treat Rep 2007; 39 : 150 – 159.
37. Sarmiento R, Gasparini G. Antiangiogenic metronomic chemotherapy. Onkologie 2008; 31 : 161 – 162
38. Plate KH. From angiogenesis to lymphangiogenesis. Nature Med 2001; 7 : 151 – 152.
39. Karpanen T, Alitalo K. Molecular biology and pathology of lymphangiogenesis. Ann Rev Pathol 2008; 4 : 367 – 397.
40. Humprecht V, Detmar M. Lymphangiogenesis and cancer metastasis. J Cell Mol Med 2009; 13 : 1405 – 1416.
41. Pilka R, Dzvinčuk P, Kudela M. Lymfangiogeneze a nové markery lymfatického endotelu. Čes Gynek 2003; 68 : 427 – 431.
42. Griffioen AW. Lymhangiogenesis factors: a target for therapy? Blood 2009; 113 : 4135 – 4136.
43. Thiele W, Sleeman JP. Tumor‑induced lymfangiogenesis : a target for cancer rherapy? J Biotechnol 2006; 124 : 224 – 241.
44. Herbst RS, Hong D, Chap L et al. Safety, pharmacokinetics, and antitumor activity of AMG 386, a selective angiopoietin inhibitor in adult patients with advanced solid tumors. J Clin Oncol 2009; 27 : 3557 – 3565.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2010 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Nejasný stín na plicích – kazuistika
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Nové pohledy moderní medicíny na léčbu pomocí kmenových buněk, její praktické a etické důsledky
- Angiogeneze jako součást nádorového „ekosystému“ a možnosti jejího ovlivnění
- Velmi malé karcinomy prsu, HER2-pozitivní a léčba trastuzumabem v adjuvanci
- Průkaz vlivu estrogenových a progesteronových receptorů na přežití u karcinomu prsu bez cytostatické a hormonální léčby v malém souboru pacientek
- Dlouhodobé výsledky léčby Hodgkinovy choroby: zkušenosti z univerzitní nemocnice v Sofii
- Malobunkový karcinóm vaječníkov s metastázami do prsníku: kazuistika
- Dlouhodobá odpověď jaterních metastáz karcinomu prsu na léčbu kapecitabinem – kazuistické sdělení
- Přidání bevacizumabu k chemoterapii vede ke zlepšení celkového přežití žen s pokročilým karcinomem prsu
- NK buňky, chemokiny a chemokinové receptory
- Klinický registr AVASTIN
- Zápis ze schůze výboru České onkologické společnosti dne 22. 12. 2009 ve VFN Praha
- Zápis ze schůze výboru České onkologické společnosti dne 19. 1. 2010 ve VFN Praha
-
Klener P., Klener P. jr.
Nová protinádorová léčiva a léčebné strategie v onkologii.
Praha: Grada Publishing 2010. 232 str. ISBN: 978- 80- 247- 2808- 7.
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Velmi malé karcinomy prsu, HER2-pozitivní a léčba trastuzumabem v adjuvanci
- NK buňky, chemokiny a chemokinové receptory
- Průkaz vlivu estrogenových a progesteronových receptorů na přežití u karcinomu prsu bez cytostatické a hormonální léčby v malém souboru pacientek
- Dlouhodobá odpověď jaterních metastáz karcinomu prsu na léčbu kapecitabinem – kazuistické sdělení
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy