-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
NK buňky, chemokiny a chemokinové receptory
NK Cells, Chemokines and Chemokine Receptors
NK cells are an important component of natural immunity, which provides a defence response against viruses, bacterial and parasitic intracellular pathogens and tumour cells. NK cells are capable of rapid responses without prior sensitization and cytotoxic response is independent of the presence of the antigens of the major histocompatibility system. NK cells produce a number of cytokines (e. g. INF ‑ γ, GM‑CSF and TNF‑β) and chemokines and in this way they regulate both the natural and acquired immune response. By contrast, NK cells are regulated both positively and negatively by cytokines and chemokines produced by other immune cells. Attention is focused on the possibility of influencing the tumour process by using cytokine ‑ and chemokine‑activated NK cells. In studies in mice models as well as in several clinical trials, it has been shown that the presence of cytotoxic cells in tumour stroma is associated with a more favourable prognosis of cancer. There is also plenty of evidence that in tumour stroma a number of cytokines and chemokines are produced which may have ambivalent effects.
Key words:
natural killer cells – chemokines – chemokine receptors – cytokines
Autoři: J. Kopecký 1; O. Kopecký 2,3
Působiště autorů: Klinika onkologie a radioterapie, FN Hradec Králové 1; II. interní klinika, FN Hradec Králové 2; Oddělení klinické onkologie, Oblastní nemocnice Náchod, a. s. 3
Vyšlo v časopise: Klin Onkol 2010; 23(1): 5-9
Kategorie: Přehledy
Souhrn
NK buňky jsou důležitou komponentou přirozené imunity, která zajišťuje obranné reakce proti virům, bakteriálním a parazitárním intracelulárním patogenům a nádorově změněným buňkám. NK buňky jsou schopny rychlé odpovědi bez předchozí senzibilizace a cytotoxická reakce není závislá na přítomnosti antigenů hlavního histokompatibilního systému. NK buňky produkují řadu cytokinů (např. INF ‑ γ, GM‑CSF a TNF‑β) a chemokinů a touto cestou regulují jak přirozenou, tak získanou imunitní odpověď. Naproti tomu jsou pozitivně i negativně regulovány cytokiny a chemokiny produkovanými dalšími buňkami imunitního systému. Pozornost je zaměřena na možnost ovlivnění nádorového procesu pomocí NK buněk aktivovaných cytokiny a chemokiny. Ve studiích prováděných na myších modelech, ale i v několika klinických studiích bylo prokázáno, že přítomnost cytotoxických buněk v nádorovém stromatu je asociována s příznivější prognózou nádorového onemocnění. Existuje ale i množství dokladů, že v nádorovém stromatu dochází k produkci řady cytokinů a chemokinů, z nichž mnohé mají ambivalentní efekt.
Klíčová slova:
NK buňky – chemokiny – chemokinové receptory – cytokinyÚvod
NK buňky jsou důležitou komponentou přirozené imunity, která zajišťuje obranné reakce proti virům, bakteriálním a parazitárním intracelulárním patogenům a nádorově změněným buňkám. Po kontaktu s poškozenou buňkou jsou NK buňky schopny rychlé odpovědi bez předchozí senzibilizace a cytotoxická reakce není závislá na přítomnosti antigenů hlavního histokompatibilního systému [1–2]). NK buňky tvoří pouze 5–10% mononukleárních buněk v periferní krvi. Přesto jsou důležitou složkou přirozené imunity. NK buňky se nacházejí ve všech tělních kompartmentech, jejich zastoupení je však v některých orgánech odlišné. Například v lymfatických orgánech je počet NK buněk až 10krát vyšší než v periferní krvi [3]. Zvýšené počty NK buněk jsou nacházeny i v plicích, játrech nebo slezině [4].
Aktivované NK buňky produkují řadu cytokinů (např. INF γ, GM CSF a TNF β) a chemokinů, které vedou k autokrinní a parakrinní aktivaci buněk podílejících se na imunitní reakci. Touto cestou jsou NK buňky schopny regulovat přirozenou i získanou imunitní odpověď [5–6]. Naproti tomu jsou pozitivně i negativně regulovány jak dalšími buňkami imunitního systému, tak poškozenými anebo nádorově transformovanými buňkami. V experimentálních studiích zabývajících se možností využití NK buněk v protinádorové terapii je zaměřena pozornost na roli chemokinů a jejich receptorů.
Ve studiích prováděných na myších modelech, ale i v několika klinických studiích bylo prokázáno, že průkaz cytotoxických buněk v nádorovém stromatu je asociován s příznivější prognózou onemocnění [7–9]. Přítomnost NK buněk v nádorovém stromatu je považována za jedno z prognostických znamení [10–13]. Naproti tomu existuje řada dokladů, že v nádorovém stromatu dochází také k produkci řady cytokinů a chemokinů, z nichž mnohé mají ambivalentní efekt. Nádorové stroma je z velké části tvořeno makrofágy, které jsou pod regulačním vlivem nádorových buněk a samy produkují mediátory, jež podporují proliferaci nádorových buněk, s nádorem spojenou angiogenezi a metastazování. Navíc chemokiny produkované v místě rostoucího nádoru jsou odpovědny za vstup neutrofilních segmentů. Tyto leukocyty pak po vstupu do stromatu uvolňují další angiogenní faktory, mitogeny a proteolytické enzymy. Tímto mechanizmem vzniká mikroprostředí příznivé pro nádorový růst a založení vzdálených metastáz [14].
NK buňky CD56+dim a CD56+bright
Na povrchu NK buněk můžeme prokazovat řadu molekul, které mají funkci receptoru pro cytokiny, chemokiny, a adhezivní molekuly, pomocí nichž je možné NK buňky identifikovat a určovat jejich subpopulace (obr. 1). NK buňky nemají vyjádřen receptor pro T lymfocyty (T cell receptor – TCR), jsou CD3 negativní [15]. Naopak, všechny NK buňky nesou membránovou molekulu CD7. Hlavní pan NK membránovou molekulou je neurální buněčná adhezivní molekula (neural cell adhesion molecule – NCAM) nesoucí označení CD56 [16]. Další povrchovou molekulou vyjádřenou na většině NK buněk je FcRγIII receptor označovaný jako CD16. Na základě exprese těchto dvou molekul rozlišujeme dvě hlavní subpopulace NK buněk, CD56+dimCD16+ a CD56+brightCD16dim/–. Tyto subpopulace NK buněk vykazují funkční odlišnosti v odpovědi na stimulaci IL 2, v zastoupení NKR (natural killer receptors), adhezivních molekul a v cytotoxické kapacitě [17–18].
NK buňky CD56+bright exprimují na svém povrchu vysokoafinní receptor pro IL 2 tvořený řetězci α, β,γ (IL 2Rαβγ) (CD 25, CD122 a CD132) a expandují v in vitro a in vivo podmínkách i po nízkých dávkách IL 2. Naopak CD56+dim exprimují nízkoafinní receptory pro IL 2 tvořený řetězci α, β a jejich proliferační odpověď je nízká i na vysoké dávky IL 2. Schopnost usmrcovat terčové buňky je u CD56+dim buněk vyšší než u CD56+bright. Tato vlastnost CD56+dim buněk je dána přítomností velkého počtu cytoplazmatických granul obsahujících perforiny a granzimy a vyšší denzitou membránových receptorů pro Fc fragment IgG.
Subpopulace NK buněk mají odlišné zastoupení v jednotlivých tělních kompartmentech, CD56+bright buňky se nalézají v největším počtu v lymfatických uzlinách, zatímco CD56+dim jsou většinovou populací v periferní krvi a slezině [3]. Všechny NK buňky CD56+bright mají vyjádřen s vysokou denzitou membránový receptor CD94/NKG2, který náleží do C typ lecitinové rodiny, a jen malý počet (méně než 10%) těchto buněk exprimuje KIR (killer cell imunoglobulin like receptor). Buňky CD56+bright mají na svém povrchu přítomny CC chemokinový receptor 7 (CCR7) a s vysokou denzitou CXC receptor 3 (CXCR3). CD56+bright exprimují také adhezivní molekuly z rodiny L selektinů, které zajišťují vazbu s cévním endotelem a umožňují přesun těchto buněk do sekundárních lymfatických orgánů, kde následně vstupují do interakcí s T lymfocyty [19].
CD56+dim NK buňky mají v naprosté většině (až 85%) vysoce vyjádřeny KIR receptory a naopak nízkou denzitu CD94/NKG2. Povrchový CCR7 není přítomen, ale silně jsou vyjádřeny CXCR1 a CX3CR1.
Subpopulace NK buněk se liší i v produkci cytokinů, CD56+bright produkují mnohonásobně vyšší množství IFN γ, TNF β, GM CSF, IL 10, a IL 13 než CD56+dim [17–18,20–21].
Chemokiny a chemokinové receptory
Chemokiny jsou jednou z nejpočetnějších cytokinových rodin, která čítá okolo 50 navzájem si podobných proteinů [22–23]. Jejich současná klasifikace je založena na rozdílném počtu aminokyselin oddělujících cysteinová rezidua na N konci. Rozeznává čtyři skupiny chemokinů: CXC (alfa chemokiny) CC (beta chemokiny), CX3C (delta chemokiny) a C (gama chemokiny). Skupiny CXC a CC se dále dělí na další podskupiny podle strukturálních homologií a biologických aktivit [24].
Za označením CC, CXC, CX3C a C následuje označení písmeny L pro ligandy či R pro receptor a na konci je uvedeno číslo, které odpovídá pořadí jeho objevení. Např. chemokin v literatuře často označován jako stromal derived factor 1 je dle klasifikace CXCL12 a jeho receptor je CXCR4 [25–27].
Klasifikace chemokinových receptorů kopíruje dělení chemokinových ligandů. Chemokinové receptory náleží do rodiny receptorů asociovaných s G proteinem tvořeným sedmi transmembránově probíhajícími doménami. G protein je heterotrimerická molekula složená z podjednotek α, β, γ. Prostřednictvím chemokinových receptorů a jejich ligand je uplatňován chemotaktický gradient vedoucí k polarizaci a migraci NK buněk do poškozených tkání.
V experimentálních pracích bylo doloženo, že se jeden chemokinový ligand může vázat na několik receptorů a naopak, jeden receptor může vázat různé chemokiny stejné skupiny. Dosud bylo rozpoznáno téměř 50 chemokinů a bylo popsáno nejméně 18 chemokinových receptorů [25].
Chemokiny hrají důležitou roli v koordinaci přirozené i získané imunitní odpovědi. Regulují pohyb nezralých progenitorových lymfoidních buněk, recirkulaci zralých naivních T a B lymfocytů. Chemokiny zajišťují i migraci antigen prezentujících buněk zahrnující jak dendritické buňky, tak i buňky z linií monocytů/mikrofágů. Chemokiny navíc zvyšují afinitu a aviditu β1 a β2 integrinů na povrchů leukocytů k endoteliálním receptorům zahrnující intracelulární adhezivní molekulu 1 a 2 a vaskulární buněčnou adhezivní molekulu 1 [28].
Řada studií prokázala inhibiční efekt chemokinů na růst nádorů. Chemokiny CCL3 CCL21 CCL27 CX3CL1 uvolňované v místě nádoru přitahují cytotoxické T lymfocyty, NK buňky a dendritické buňky, které se podílejí na účinné protinádorové odpovědi [29–33]. Chemokin CCL2 navíc reguluje vstup monocytů/makrofágů do nádorového stromatu a potencuje jejich cytotoxický protinádorový efekt [34]. CX3CL1 zesiluje protinádorovou aktivitu NK buněk [35]. Chemokin CCL5 je široce exprimován na různých imunokompetentních buňkách, včetně aktivovaných NK buňkách, které se podílejí na inhibici nádorového růstu [36].
Chemokinové receptory na NK buňkách
Podle Cambella et al většina NK buněk silně exprimuje receptory CXCR1, CXCR4 a CX3CR1, naopak receptory CXCR2 a CXCR3 jsou podle jejich pozorování vyjádřeny slabě [37]. Práce jiných autorů však popisuje nález pouze receptoru CXCR4, a ne CXCR1, CX3CR1, CXCR2 a CXCR3 [38].
Naopak v případě receptorů pro CC chemokiny se shodují závěry dvou studií v absenci receptorů CCR1, CCR2, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8 a CCR9 na povrchu klidových NK buněk. K zvýšení exprese receptorů CCR2, CCR4, CCR5 a CCR8 dochází až po in vitro aktivaci IL 2 nebo IL 15 [37–38].
Přítomnost povrchových receptorů pro chemokiny se u NK buněk liší podle exprese CD16 molekuly. NK buňky CD16+ mají silně vyjádřené molekuly CX3CR1, CXCR1 a CXCR4, slabě exprimované CXCR2 a CXCR3 molekuly, receptory CCR1–7, CCR9 a CXCR5 nejsou přítomny. Na NK buňkách CD16– není membránový receptor pro CXCR1 detekován a receptor pro CX3CR1 je přítomen v nízké denzitně, zatímco receptory CCR5, CCR7, CXCR3 a CXCR4 jsou silně vyjádřeny. Membránové molekuly CCR1–4, CCR6, CCR9 a CXCR2 nejsou na CD16– NK buňkách detekovány [37].
Vliv chemokinů na chemotaxi NK buněk
Nádorová tkáň je tvořena nejen nádorovými buňkami, ale i buňkami stromálními. Zatímco makrofágy a fibroblasty jsou nalézány v nádorovém stromatu konstantně, přítomnost ostatních populací imunokompetentních buněk je proměnlivá. Je prokázáno, že zánětlivá reakce a nádorový růst jsou úzce spojeny a v řadě případů mají i prognostický význam. Nález lymfocytárního infiltrátu v melanomové tkáni je spojen s příznivou prognózou, zatímco v případě karcinomu prsu je přítomnost zánětlivého infiltrátu spojena s horší prognózou.
Nádorové mikroprostředí určované interferony, interleukiny a zvláště chemokiny je rozhodující pro charakter zánětlivé reakce. Vlivem chemotaktického gradientu nádorového mikroprostředí jsou přitahovány T lymfocyty, dendritické buňky, granulocyty, makrofágy i NK buňky. Všechny uvedené buňky mohou produkovat chemokiny a spolu s chemokiny tvořenými nádorovými buňkami mají určující vliv na charakter zánětlivé reakce. Rozhodují o tom, zda imunitní odpověď povede jako v případě melanomu k rejekci nádoru, nebo naopak zvýší invazivitu a metastazování tumoru pozorované u infiltrativního nádoru prsu [39].
Intracelulární signální cesty indukované chemokiny v NK buňkách
Přenos signálu zprostředkovaným chemokinem lze rozdělit do tří kroků: 1. navázání chemokinu na receptor a interakce s G proteinem, 2. aktivace intracelulární efektorové molekuly, 3. inaktivace receptoru [40] (obr. 1).
Obr. 1. Membránové molekuly, aktivace a deaktivace receptoru NK buněk. A – Hlavní rozdíly exprese povrchových receptorů u NK bright a NK dim. Míra exprese membránových molekul je vyznačena pomocí znaménka +. B – Po stimulaci receptoru dochází ke konformačním změnám receptoru, které umožní změnu GDP na GTP vedoucí k disociaci βγ podjednotky s α podjednotkou. Existují dvě cesty, jak docílit deaktivace receptorů. První je pomocí GTPázy urychlení hydrolýzy αGTP na αGDP. Druhou možností je zapojení G-protein-coupled-receptor kinázy (GRK), která je po navázání na βγ podjednotku schopna fosforylace receptoru. Fosforylovaný receptor se dále váže s β-arestinem, nereceptorovou tyrozin kinázou c-Src a dyaminem, který usnadňuje endocytózu receptoru pomocí clatrinu. 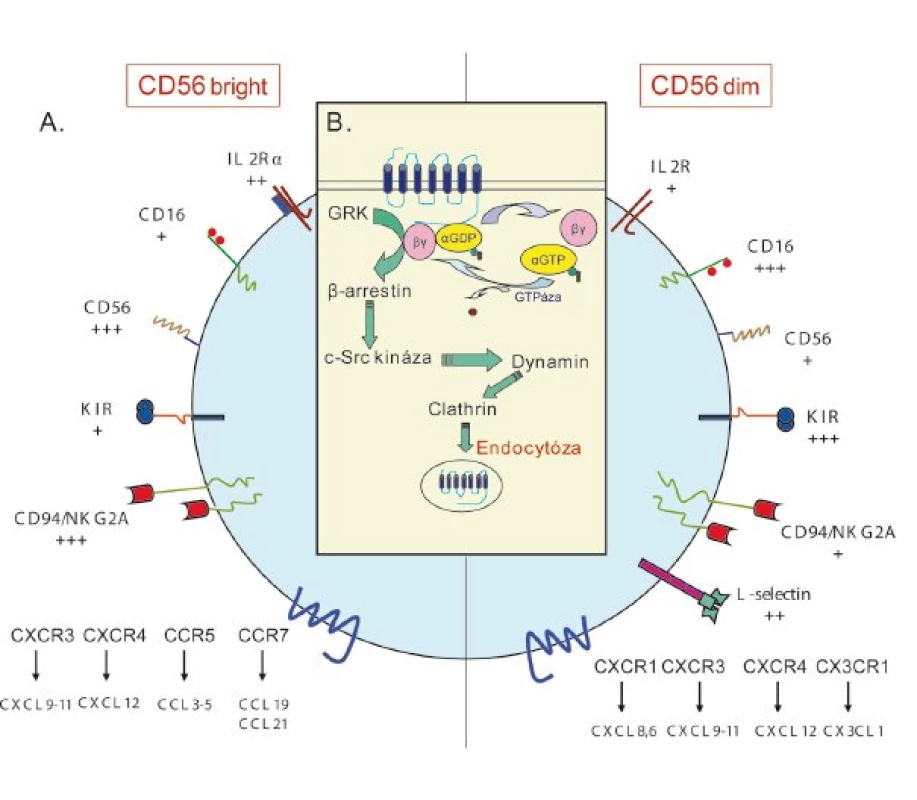
Receptory pro chemokiny náleží do rodiny molekul tvořených sedmi transmembránovými doménami, které jsou na COOH konci asociovány s G proteinem. Mezi N koncem (extracytoplazmatický) a COOH koncem (intracytoplazmatický) je sedm transmembránových hydrofobních oblastí receptoru. Vně membrány se nachází tři extracelulární domény a uvnitř tři intracelulární hydrofilní domény. COOH konec je bohatý na serin/treonin, které jsou po navázání ligandu fosforylovány.
Protein G je tvořen třemi podjednotkami α, β, γ. Po navázání ligandu na extracelulární část molekuly dojde ke konformačním změnám hydrofobních oblastí, což je důležité pro zvýšení vazebné afinity k alfa podjednotce heterotrimerického G proteinu. Následně, alfa podjednotka změní svou konformaci, což umožní navázání GTP. Po této vazbě nastane odštěpení b,g podjednotky od a podjednotky. Prostřednictvím GTP a podjednotky dochází k aktivaci fosfolipázy C a adenylát cyklázy [41]. Adenylát cykláza je aktivována Gas proteinem a inhibován Gai, zatímco fosfolipáza C je aktivována Gaq. Jako sekundární messengery jsou uplatněny v případě adenylát cyklázy cAMP a v případě fosfolipázy C diacylglycerol a inositol 1,4,5 trifosfát. Zpětnovazebná regulace chemokinových receptorů probíhá dvěma způsoby. První možností je hydrolýza GTP a na GDP a GTPázou, s následnou rekonstitucí heterotrimerického Gαβγ proteinu. Druhou cestou je inaktivace zprostředkovaná kinázou vázající se na b,g podjednotku G proteinu. Tato kináza fosforyluje COOH konec receptoru vázaného s G proteinem a způsobí cestou b arrestinu, c Src kinázou, dynaminu a clathrinu endocytózu receptoru [40,42].
Závěr
V průběhu nádorového onemocnění jsou aktivovány jak cytotoxické buňky (cytotoxické T lymfocyty a NK buňky), tak další buněčné populace (makrofágy, dendritické buňky, B lymfocyty), které mají společně s nádorovými buňkami zásadní vliv na charakter protinádorové imunitní odpovědi. Přítomnost aktivovaných NK buněk ještě není důkazem účinné protinádorové odpovědi. Pro klinické využití NK buněk jsou nezbytné detailní znalosti biologických vlastností chemokinů a jejich receptorů a jejich vlivu na nádorové mikroprostředí.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, pruducts, or services used in the study.Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.MUDr. Jindřich Kopecký
Klinika onkologie a radioterapie
FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: kopecjin@fnhk.cz
Zdroje
1. French AR, Yokoyama WM. Natural killer cells and viral infections. Curr Opin Immunol 2003; 15 : 45–51.
2. Smyth MJ, Godfrey DI, Trapani JA. A fresh look at tumor immunosurveillance and immunotherapy. Nat Immunol 2001; 2 : 293–299.
3. Gregoire C, Chasson L, Luci C et al. The trafficking of natural killer cells. Immunol Rev 2007; 220 : 169–182.
4. Ferlazzo G, Thomas D, Lin SL et al. The abundant NK cells in human secondary lymphoid tissues require activation to express killer cell Ig like receptors and become cytolytic. J Immunol 2004; 172 : 1455–1462.
5. Biron CA, Nguyen KB, Pien GC et al. Natural killer cells in antiviral defense: function and regulation by innate cytokines. Annu Rev Immunol 1999; 17 : 189–220.
6. Taub DD. Natural killer cell chemokine interactions. Biologic effects on natural killer cell trafficking and cytolysis. In: Rollins BJ. Chemokines and cancer. Totowa: Humana Press Inc. 1999 : 73–93.
7. Jass JR. Lymphocitic infiltration and survival in rectal cancer. J Clin Pathol 1986; 39 : 585–589.
8. Zhang L, Conejo Garcia JR, Katsaros D et al. Intratumoral T cells, recurrence, and survival in epithelial ovarian cancer. N Engl J Med 2003; 348 : 203–213.
9. Sato E, Olson SH, Ahn J et al. Intraepithelial CD8+ tumor infiltrating lymphocytes and a high CD8+/regulatory T cell ratio are associated with favorable prognosis in ovarian cancer. Proc Natl Acad Sci USA 2005; 102 : 18538–18543.
10. Coca S, Perez Piqueras J, Martinez D et al. The prognostic significance of intratumoral natural killer cells in patients with colorectal carcinoma. Cancer 1997; 79 : 2320–2328.
11. Hsia JY, Chen JT, Chen CY et al. Prognostic significance of intratumoral natural killer cells in primary resected esophageal squamous cell carcinoma. Chang Gung Med J 2005; 28 : 335–340.
12. Villegas FR, Coca S, Villarrubia VG et al. Prognostic significance of tumor infiltrating natural killer cells subset CD57 in patients with squamous cell lung cancer. Lung Cancer 2002; 35 : 23–28.
13. Beano A, Signorino E, Evangelista A et al. Correlation between NK function and response to trastuzumab in metastatic breast cancer patiens. J Translat Med 2008; 6 : 25.
14. Yan L, Anderson GM, DeWitte M et al. Therapeutic potential of cytokine and chemokine antagonists in cancer therapy. Eur J Cancer 2006; 42 : 793–802.
15. Robertson MJ, Ritz J. Biology and clinical relevance of human natural killer cells. Blood 1990; 76 : 2421–2438.
16. Lanier LL, Le AM, Civin CI et al. The relationship of CD16 (Leu 11) and Leu 19 (NKH 1) antigen expression on human peripheral blood NK cells and cytotoxic T lymphocytes. J Immunol 1986; 136 : 4480–4486.
17. Cooper MA, Fehniger TA, Caligiuri MA. The biology of human natural killer cell subsets. Trends Immunol 2001; 22 : 633–640.
18. Cooper MA, Fehniger TA, Turner SC. Human natural killer cells: a unique innate immunoregulatory role for the CD56bright subset. Blood 2001; 97 : 3146–3151.
19. André P, Spertini O, Guia S et al. Modification of P selectin glykoprotein ligandy 1 with natural killer cell restricted sulfated lactosamine creates n alternace ligandy for L selectin. Proc Natl Acad Sci USA 2000; 97 : 3400–3405.
20. Jacobs R, Hintzen G, Kemper A et al. CD56bright cells differ in their KIR repertoire and cytotoxic features from CD56dim NK cells. Eur J Immunol 2001; 31 : 3121–3126.
21. Fehniger TA, Cooper MA, Nuovo GJ et al. CD56bright natural killer cells are present in human lymph nodes and are activated by T cell derived IL 2: a potential new link between adaptive and innate immunity. Blood 2003; 101 : 3052–3057.
22. Rollins BJ. Chemokines. Blood 1990; 90 : 909–928.
23. Rossi D, Zlotnik A. The biology of chemokines and their receptors. Annu Rev Immunol 2000; 18 : 217–242.
24. Rot A, von Andrian UH. Chemokines in innate and adaptive host defense: basic chemokinese grammar for immune cells. Annu Rev Immunol 2004; 22 : 891–928.
25. Zlotnik A, Yoshie O. Chemokines: a new classification system and their role in immunity. Imunity 2000; 12 : 121–127.
26. Bacon K, Baggiolini M, Broxmeyer H et al. Chemokine/chemokine receptor nomenclature. J Interferon Cytokine Res 2002; 22 : 1067–1068.
27. Muchy PM, Baggiolini M, Charo IF et al. International Union of Pharmacology. XXII. Nomenclature for chemokine receptors. Pharmacol Rev 2000; 52 : 145–176.
28. Constantin G, Majeed M, Giagulli C et al. Chemokines trigger immediate β2 integrin affinity and mobility changes: differential regulation and roles in lymfocyte arrest under flow. Imunity 2000; 13 : 759–769.
29. van Deventer HW, Serody JS, McKinnon et al. Transfection of macrophage inflammatory protein 1α into B16, F10 melanoma cells inhibits growth of pulmonary metastases but not subcutaneous tumors. J Immunol 2002; 169 : 1634–1639.
30. Vicari AP, Ait Yahia S, Chemin K et al. Antitumor effects of the mouse chemokine 6Ckine/SLC through angiostatic and immunological mechanisms. J Immunol 2000; 165 : 1992–2000.
31. Gao JQ, Tsuda Y, Katayama K et al. Antitumor effect by interleukin 11 receptor α locus chemokine/CCL27, introduced into tumor cells through a recombinant adenovirus vector. Cancer Res 2003; 63 : 4420–4425.
32. Guo J, Chen T, Wang B et al. Chemoattraction, adhesion and activation of natural killer cells are involved in the antitumor immune response induced by fractalkine/CX3CL1. Immunol Lett 2003; 89 : 1–7.
33. Xin H, Kikuchi T, Andarini S et al. Antitumor immune response by CX3CL1 fractalkine gene transfer depends on both NK and T cells. Eur J Immunol 2005; 35 : 1371–1380.
34. Ueno T, Toi M, Saji H et al. Significance of macrophage chemoattractant protein 1 in macrophage recruitment, angiogenesis, and survival in human breast cancer. Clin Cancer Res 2000; 6 : 3282.
35. Lavergne E, Combadiere B, Bonduelle O et al. Fractalkine mediates natural killer dependent antitumor responses in vivo. Cancer Res 2003; 63 : 7468.
36. Lavergne E, Combadiere C, Iga M et al. Intratumoral CC Chemokine Ligand 5 Overexpression Delays Tumor Growth and Increases Tumor Cell Infiltration. J Immunol 2004; 173 : 3755–3762.
37. Campbell JJ, Qin S, Unutmaz D et al. Unique subpopulations of CD56+NK and NK T peripheral blood lymphocytes identified by chemokine receptor expression. J. Immunol 2001; 166 : 6477–6482.
38. Inngjerdingen M, Damaj B, Maghazachi AA. Expression and regulation of chemokine receptors in human natural killer cells. Blood 2001; 97 : 367–375.
39. Balkwill F. Cancer and the chemokine network. Nat Rev Cancer 2004; 4 : 540–550.
40. Maghazachi AA. Intracellular Signalling Pathways Induced by Chemokines in Natural Killer Cells. Cell Signal 1999; 11 : 385–390.
41. Ji TH, Grossmann M, Ji I. G Protein coupled Receptors., J Biol Chem 1998; 273 : 17299–17302.
42. Maghazachi AA. Insights into seven and single transmembrane spanning domain receptors and their signaling pathways in human natural killer cells. Pharmacol Rev 2005; 57 : 339–357.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2010 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Nové pohledy moderní medicíny na léčbu pomocí kmenových buněk, její praktické a etické důsledky
- Angiogeneze jako součást nádorového „ekosystému“ a možnosti jejího ovlivnění
- Velmi malé karcinomy prsu, HER2-pozitivní a léčba trastuzumabem v adjuvanci
- Průkaz vlivu estrogenových a progesteronových receptorů na přežití u karcinomu prsu bez cytostatické a hormonální léčby v malém souboru pacientek
- Dlouhodobé výsledky léčby Hodgkinovy choroby: zkušenosti z univerzitní nemocnice v Sofii
- Malobunkový karcinóm vaječníkov s metastázami do prsníku: kazuistika
- Dlouhodobá odpověď jaterních metastáz karcinomu prsu na léčbu kapecitabinem – kazuistické sdělení
- Přidání bevacizumabu k chemoterapii vede ke zlepšení celkového přežití žen s pokročilým karcinomem prsu
- NK buňky, chemokiny a chemokinové receptory
- Klinický registr AVASTIN
- Zápis ze schůze výboru České onkologické společnosti dne 22. 12. 2009 ve VFN Praha
- Zápis ze schůze výboru České onkologické společnosti dne 19. 1. 2010 ve VFN Praha
-
Klener P., Klener P. jr.
Nová protinádorová léčiva a léčebné strategie v onkologii.
Praha: Grada Publishing 2010. 232 str. ISBN: 978- 80- 247- 2808- 7.
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Velmi malé karcinomy prsu, HER2-pozitivní a léčba trastuzumabem v adjuvanci
- NK buňky, chemokiny a chemokinové receptory
- Průkaz vlivu estrogenových a progesteronových receptorů na přežití u karcinomu prsu bez cytostatické a hormonální léčby v malém souboru pacientek
- Dlouhodobá odpověď jaterních metastáz karcinomu prsu na léčbu kapecitabinem – kazuistické sdělení
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



