-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Proteiny rezistence a chemorezistence u pacientek s karcinomem ovaria
Proteins of Resistence and Drug Resistence in Ovarian Carcinoma Patients
Background:
To evaluate the correlation of resistance proteins LRP (Lung Resistance Protein), Pgp (P-glycoprotein), MRP (Multidrug Resistance-Associated Protein), MRP3 a MRP5 with stage, grade and histological type. To asses correlation of these resistance proteins with drug resistance/drug sensitivity in vitro by means of the MTT assay in ovarian cancer patients. To find the clinical outcome of these data.Patients and Methods:
64 women with epithelial ovarian cancer who underwent primary surgery in 2006–2010 had specimens stained with imunohistochemistry for LRP, MRP, MRP3, MRP5 and Pgp and MTT assay (MTT-(3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyl-tetrazolium bromide).Results:
Patients with late ovarian cancer had a higher Pgp, MRP, MRP3 and MRP5 level compared to ovarian cancer patients with early stage ovarian cancer. No correlation of resistance proteins with grading was found. Patients with high Pgp and MRP expression had significantly shorter progression-free survival. Patients with drug resistance in vitro by means of the MTT assay had higher Pgp and MRP expression.Conclusion:
P-glycoprotein and MRP may be useful predictor for outcome of primary chemotherapy in patients with ovarian cancer.Key words:
ovarian cancer – p170-glycoprotein – Lrp-Lung resistance protein – MRP1 protein – Drug Resistance – MTT test
Autoři: I. Sedláková 1; J. Laco 2; J. Tošner 1; K. Caltová 3; M. Červinka 3; A. Řezáč 1; J. Špaček 1; P. Škapinec 1
Působiště autorů: Porodnická a gynekologická klinika LF UK a Fakultní nemocnice Hradec Králové, přednosta doc. MUDr. Jindřich Tošner, CSc. 1; Fingerlandův ústav patologie Fakultní nemocnice Hradec Králové, přednosta prof. MUDr. Aleš Ryška, PhD. 2; Ústav biologie a lékařské genetiky Lékařské fakulty Hradec Králové UK v Praze, přednosta prof. MUDr. RNDr. Miroslav Červinka, CSc. 3
Vyšlo v časopise: Klin Onkol 2012; 25(6): 457-463
Kategorie: Původní práce
Práce byla podpořena grantem IGA MZ ČR NS 9737-3.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
Souhrn
Východiska:
Cílem této práce je stanovení proteinů rezistence LRP (Lung Resistance Protein), Pgp (P-glykoprotein), MRP (Multidrug Resistance-Associated Protein), MRP3 a MRP5 a zjištění jejich závislosti na stadiu, stupni diferenciace a histologickém typu ovariálního karcinomu a zhodnocení vztahu proteinů rezistence s chemorezistencí/chemosenzitivitou in vitro stanovenou MTT testem.Soubor pacientek a metodika:
Stanovení proteinů rezistence (LRP, Pgp, MRP, MRP3, MRP5) jsme provedli u 64 vzorků ovariálních karcinomů u pacientek operovaných na Porodnické a gynekologické klinice FN HK v letech 2006–2010. Proteiny rezistence jsme stanovili metodou dvoustupňové imunohistochemie. Chemorezistenci/chemosenzitivitu in vitro jsme zhodnotili MTT testem.Výsledky:
Prokázali jsme vyšší hodnoty Pgp, MRP, MRP3 a MRP5 u pacientek s pokročilým karcinomem ovaria (st. III + IV) v porovnání s pacientkami s časným stadiem onemocnění (st. I + II). Nejnižší hodnoty LRP, Pgp, MRP jsme zjistili u endometroidního ovariálního karcinomu. Vztah proteinů rezistence se stupněm diferenciace jsme neprokázali. Zaznamenali jsme vyšší hodnoty Pgp, MRP, MRP3 a MRP5 u pacientek s recidivou onemocnění. Prokázali jsme vyšší hodnoty Pgp a MRP u pacientek chemorezistentních in vitro dle MTT testu.Závěr:
Ze stanovených proteinů rezistence se nejperspektivněji u karcinomu ovaria jeví Pgp a MRP. Stanovení Pgp a MRP by mohlo přispět k predikci léčebné odpovědi na primární chemoterapii u pacientek s karcinomem ovaria.Klíčová slova:
karcinom ovaria – p170 – LRP – MRP – chemorezistence – MTT testVýchodiska
Karcinom ovaria je nejčastější příčinou úmrtí na gynekologické malignity (47 % úmrtí). Je zastoupen 5 % mezi všemi nádory u žen. Přestože byla léčbě zhoubných nádorů ovaria věnována velká pozornost, výsledky přežití pacientek se za posledních 20 let zlepšily minimálně, a to spíše v důsledku centralizace péče do center [1]. Hlavním klinickým problémem současné cytostatické léčby ovariálního karcinomu je léková rezistence na cytostatika (chemorezistence). Jejím následkem je selhání léčby [2]. Kompletní odpověď na primární chemoterapii je vysoká, mezi 50 a 70 %. Přesto 50–75 % pacientek s pokročilým ovariálním karcinomem onemocnění relabuje a dochází k rozvoji lékové rezistence, a to zejména mnohočetné (MDR) [3].
Maligní buněčné populace mohou být vůči chemoterapii rezistentní již během primární léčby. V tomto případě jde o tzv. přirozenou (primární) rezistenci. Získaná (sekundární) rezistence vzniká až v průběhu cytostatické léčby, kdy se původně citlivé buňky stávají rezistentními a účinnost cytostatické léčby se snižuje. Pokud při ztrátě citlivosti k jednomu přípravku vzniká současně rezistence na jiné, většinou strukturálně příbuzné cytostatikum, hovoříme o rezistenci zkřížené. Byly však popsány případy zkřížené rezistence mezi protinádorovými léčivy lišícími se jak strukturálně, tak mechanizmem účinku. Takové případy rezistence pak nazýváme mnohočetná léková rezistence (MultiDrug Resistance, MDR). MDR vysvětluje případy necitlivosti některých nádorů k alternativním léčebným režimům obsahujícím nové druhy cytostatik nepoužitých v původní léčbě. Typická (klasická) MDR je zapříčiněna membránovým P-glykoproteinem (Pgp), který je produktem MDR1 genu. Jako atypická MDR jsou souhrnně označovány všechny mechanizmy mnohočetné lékové rezistence, kterých se neúčastní Pgp [4].
Jedním ze základních mechanizmů vzniku MDR je transportní funkce některých transmembránových proteinů ze skupiny tzv. ABC-transportérů (ATP binding cassette proteins). Jedním z nejvýznamnějších ABC-transportérů přispívajících k rozvoji MDR je P-glykoprotein (Pgp). Jedná se o transmembránový glykoprotein o velikosti 170 kDa tvořený 1 280 aminokyselinami [5]. Tato ATP řízená effluxní pumpa využívá pro svou transportní funkci energii z hydrolýzy ATP [6]. MDR1 je běžně exprimován v játrech, ledvinách, střevech, mozku, děloze, varlatech a placentě [7]. Z toho vyplývá i jeho fyziologická funkce, kterou je především řízení absorpce, distribuce a exkrece celé řady xenobiotik včetně řady klinicky významných léčiv. Brání také průniku xenobiotik do mozku či reprodukčních orgánů [8]. Substráty Pgp je přitom řada protinádorových léčiv jako vinka-alkaloidy, antracykliny, taxany, kolchicin a actinomycin D [7]. Taxany jsou standardní součástí chemoterapie první linie pokročilého ovariálního karcinomu.
Cílem této práce je stanovení proteinů rezistence LRP (Lung Resistance Protein) (obr. 1), PgP (P-glykoprotein) (obr. 2), MRP (Multidrug Resistance-Associated Protein) (obr. 3, 4), MRP3 a MRP5 a zjištění vztahu se stadiem, stupněm diferenciace a histologickým typem ovariálního karcinomu. Dále pak zhodnocení vztahu proteinů rezistence s chemorezistencí/chemosenzitivitou in vitro stanovenou MTT testem.
Obr. 1. Obraz difuzní cytoplazmatické pozitivity LRP. 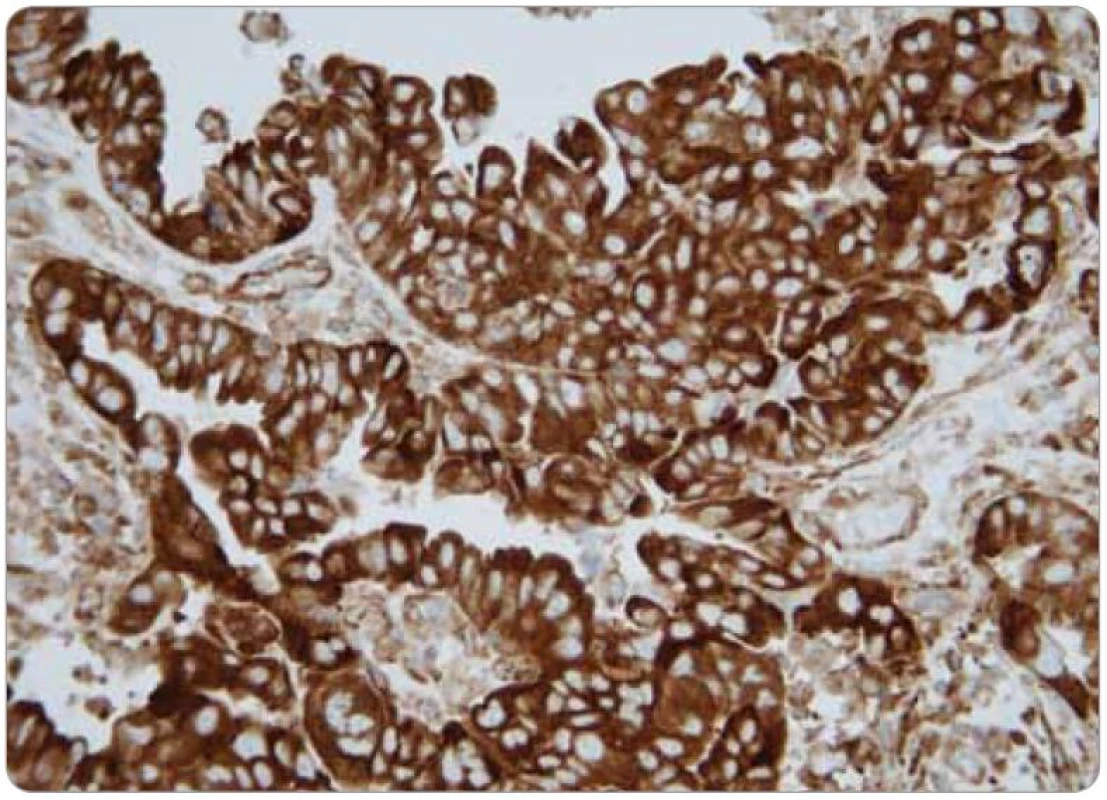
Obr. 2. Obraz difuzní pozitivity Pgp. 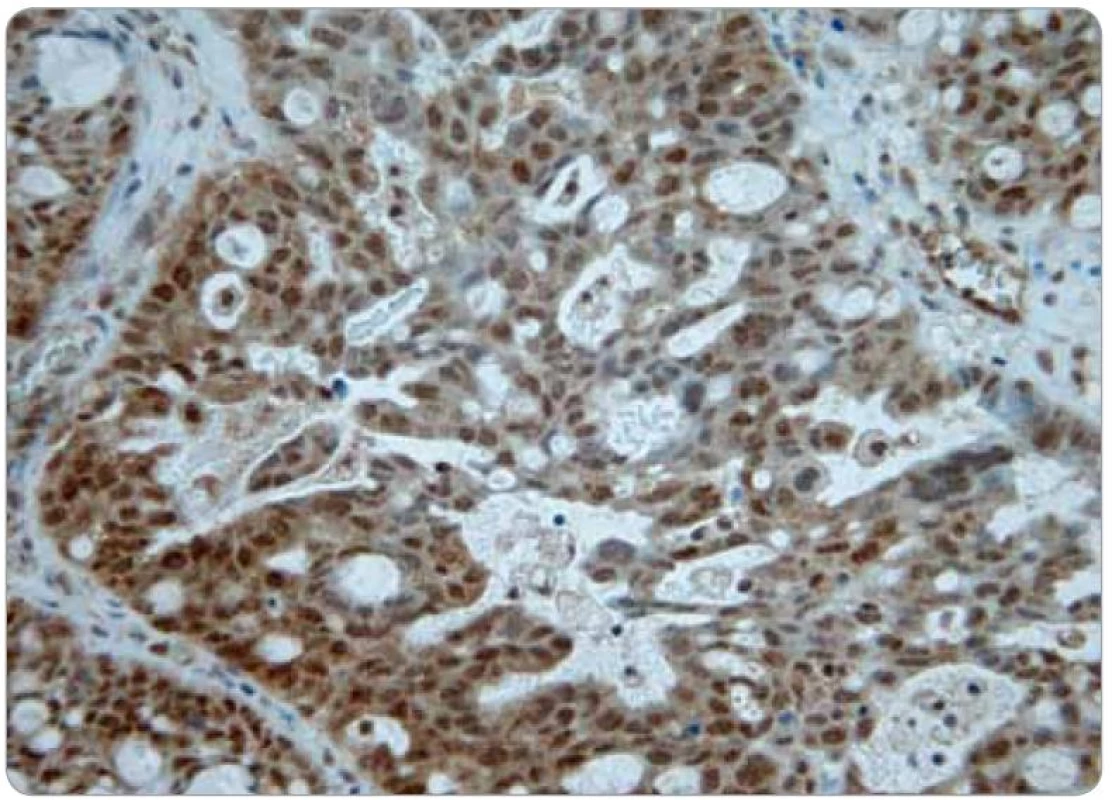
Obr. 3. Obraz fokální cytoplazmatické pozitivity MRP3. 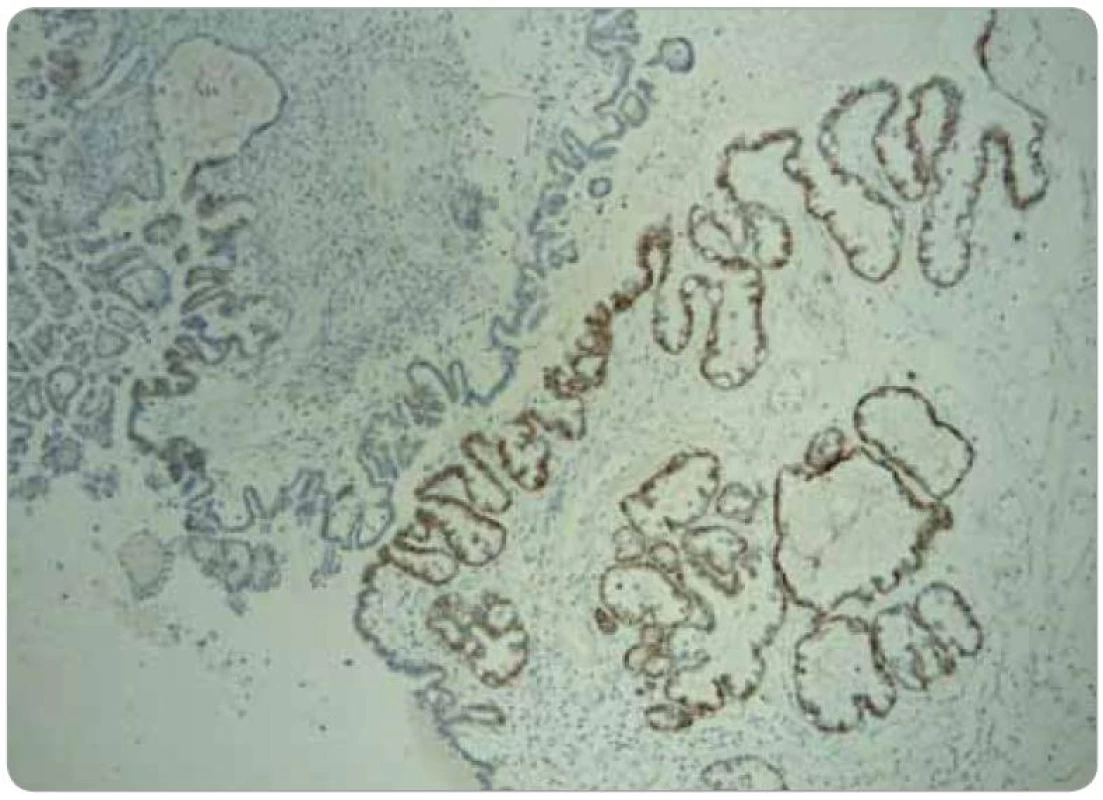
Obr. 4. Obraz negativity MRP5. 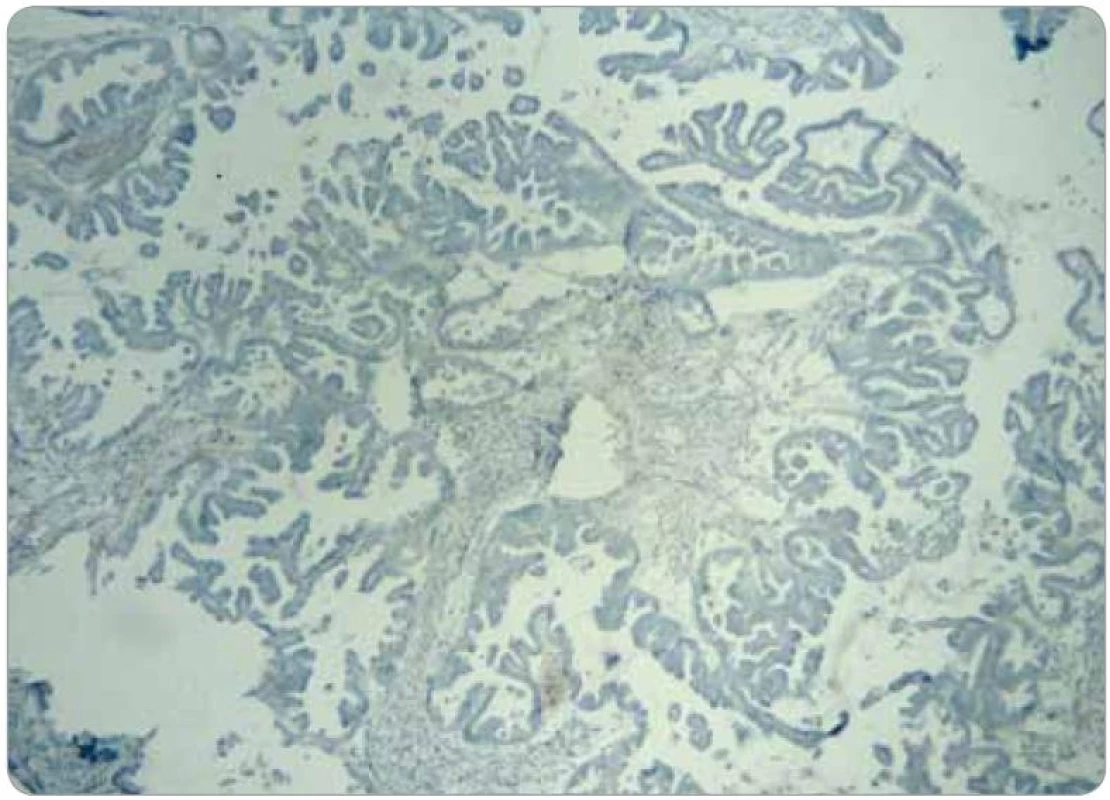
Soubor pacientek a metodika
Soubor pacientek
Stanovení proteinů rezistence (LRP, Pgp, MRP, MRP3, MRP5) jsme provedli u 64 vzorků ovariálních karcinomů u pacientek operovaných na Porodnické a gynekologické klinice FN HK v letech 2006–2010. Primární chemorezistenci/chemosenzitivitu in vitro pomocí MTT testu jsme zhodnotili u 54 žen z tohoto souboru. Odběry vzorků na stanovení MTT testu byly prováděny během primární operace pro karcinom ovaria u pacientek, které před danou operací neprodělaly chemoterapii ani žádnou jinou léčbu pro ovariální karcinom. Jednalo se o pacientky s nově zjištěným karcinomem ovaria – chemonaivní. Žádná z těchto pacientek nebyla v minulosti léčena pro jiný karcinom. Všechny pacientky měly před operací podepsaný informovaný souhlas s odběrem vzorků tkáně, schválený Etickou komisí FN HK. Průměrný věk testovaných pacientek byl 63 let. Všechny pacientky z tohoto souboru dostaly dle současných doporučených standardů v rámci adjuvantní chemoterapie první linie kombinaci paklitaxel a karboplatina.
Jednalo se o 8 pacientek se stadiem I (12,5 %), 1 pacientku se stadiem II (1,6 %), 45 pacientek se stadiem III (70,3 %) a 10 pacientek se stadiem IV (15,6 %). Dobře diferencovaný ovariální karcinom v tomto souboru mělo 6 pacientek (9,8 %), 14 pacientek středně diferencovaný ovariální karcinom (23 %) a 41 pacientek špatně diferencovaný karcinom ovaria (67,2 %). U 3 pacientek nebyl stupeň diferenciace určen. Serózní ovariální karcinom mělo 45 žen (77,6 %), mucinózní ovariální karcinom 5 pacientek (8,6 %), endometroidní ovariální karcinom mělo 8 pacientek (13,8 %). Pacientky s jinými histologickými typy ovariálního karcinomu ani borderline tumory jsme do této práce nezahrnuli.
Stanovení proteinů rezistence LRP, Pgp, MRP, MRP3, MRP5
Proteiny rezistence LRP (Lung Resistance Protein), Pgp (P-glykoprotein), MRP (Multidrug Resistance-Associated Protein), MRP3 a MRP5 jsme stanovili standardním postupem dvoustupňovou imunohistochemií ve Fingerlandově ústavu patologie ve Fakultní nemocnici Hradec Králové. Materiál získaný při operaci byl po odběru rutinně fixován v 10% formalinu. Ve všech případech byl proveden standardizovaný odběr tkáně na histologické (a následné imunohistochemické) vyšetření. Byly odebrány vždy nejméně tři vzorky z nádoru (zpravidla 1 bloček na 1 cm nádoru) se zaměřením na pouzdro, případně periferii tumoru. Tkáňové bločky byly dále zpracovány standardní histologickou technikou a zality do parafinu. Z každého bločku byly krájeny řezy o tloušťce 2–3 µm. Tyto řezy byly použity jednak k rutinnímu barvení hematoxylinem-eozinem, jednak k imunohistochemickému vyšetření. Stanoven byl histologický typ nádoru a stupeň jeho diferenciace.
Parafinové bločky byly imunohistochemicky vyšetřeny za použití těchto primárních protilátek: Pgp (klon C494, LabVision, Fremont, USA, ředění 1 : 50), LRP (klon 9D6, LabVision, ředění 1 : 20), MRP (klon 33A6, Novocastra, Newcastle upon Tyne, United Kingdom, ředění 1 : 100), MRP3 (klon DTX 1, Novocastra, ředění 1 : 100) a MRP5 (klon 69, Novocastra, ředění 1 : 50). Antigeny Pgp, LRP, MRP a MRP5 byly demaskovány inkubací v citrátovém pufru (pH 6) při teplotě 95 °C po dobu 30 min (Pgp a LRP), resp. 60 min (MRP a MRP5). Protein MRP3 byl demaskován v pufru S 3308 (DakoCytomation, Glostrup, Dánsko), pH 6, při teplotě 95 °C po dobu 60 min. K imunohistochemickému vyšetření byla použita nepřímá imunohistochemická metoda s použitím avidin-biotinového vizualizačního systému EnVision+ (DakoCytomation).
Ve světelném mikroskopu pak byla kvantitativně hodnocena pozitivita reakce, tj. procento pozitivních (hnědě zbarvených) nádorových buněk: Pgp – membránová, popř. i cytoplazmatická pozitivita, LRP – cytoplazmatická pozitivita, MRP – membránová, případně i cytoplazmatická pozitivita, MRP3 – membránová, případně i cytoplazmatická pozitivita, MRP5 – membránová a cytoplazmatická pozitivita.
Stanovení chemorezistence/chemosenzitivity in vitro MTT testem
Vzorky ovariálních karcinomů odebrané peroperačně na Porodnické a gynekologické klinice Fakultní nemocnice Hradec Králové byly zpracovány v Ústavu lékařské biologie a genetiky Lékařské fakulty Hradec Králové. Suspenze nádorových buněk byla získána z dodaných vzorků použitím enzymatického trávení a gradientovou centrifugací na hustotním gradientu Ficoll-Metatrizoát. Na začátku studie byl ověřován způsob enzymatického rozvolňování a optimální složení kultivačního média. Buňky byly dvakrát promyty v RPMI 1 640 [(2 mM glutamin, bikarbonát sodný, penicilin (100 U/ml) a streptomycin (100 mg/ml)]. Po druhém promytí byla buněčná paleta suspendována v kultivačním médiu [RPMI 1 640 s 2mM glutaminem bikarbonátem sodným, penicilinem (100 U/ml) a streptomycinem (100 mg/ml), 15% fetální hovězí sérum, 5 mg/ml inzulinu a 5 mg/ml transferinu)] v konečné koncentraci 1–2 miliony buněk na mililitr. Na začátku studie byla také ověřována heterogenita buněčné populace. Buňky byly nasazeny 6 hod v kultivační lahvi. Po 6 hod bylo médium odsáto, neadherované buňky byly shromážděny centrifugací při 500 ot./min a využity pro pararelní stanovení. Při hodnocení senzitivity bylo použito třídenního MTT (WST-1) testu. Buněčná suspenze byla pipetována do 96jamkových destiček v koncentraci 6 000–10 000 buněk na jamku a ponechána přes noc v inkubátoru. Druhý den bylo k buňkám přidáno médium s naředěným cytostatikem. Rezistence/senzitivita byla testována u cisplatiny (Ebewe Pharma, Rakousko), paklitaxelu (Pliva-Lachema, Česká republika), karboplatiny (Ebewe Pharma, Rakousko), topotekanu (GlaxoSmithKline, Velká Británie), gemcitabinu (Eli Lilly, Česká republika) a etoposidu (Teva Pharm, Česká republika). Aby bylo možné stanovit inhibiční koncentraci IC50, byly nádorové buňky vystaveny působení každého cytostatika v šesti různých koncentracích po dobu tří dnů při 37 °C, 5 % CO2 a pokusy byly nejméně dvakrát opakovány. Kontrolní nádorové buňky byly kultivovány bez použití cytostatik. Na závěr kultivace bylo ke každé jamce přidáno 100 mikrolitrů WST-1 rozpuštěného v kultivačním médiu a bylo inkubováno další dvě hodiny. V případě živých buněk je tetrazóliová sůl redukována mitochondriálními dehydrogenázami na formazan. Tato kolorimetrická reakce byla sledována fotometrickým měřením při 450 nm s referenční vlnovou délkou 690 nm. Přežívání nádorových buněk (Tumor Cell Survival – TCS) jsme vypočítali pomocí následujícího vzorce:
absorbance v jamkách s cytostatiky
TCS = --------------------------------------------- - × 100
absorbance v kontrolních jamkáchTCS50 (EC50) hodnota je koncentrace daného cytostatika, která je letální pro 50 % nádorových buněk a byla vypočítána ze získaných křivek dávkové závislosti (tab. 1).
Tab. 1. Hodnoty EC 50 pro jednotlivá cytostatika. 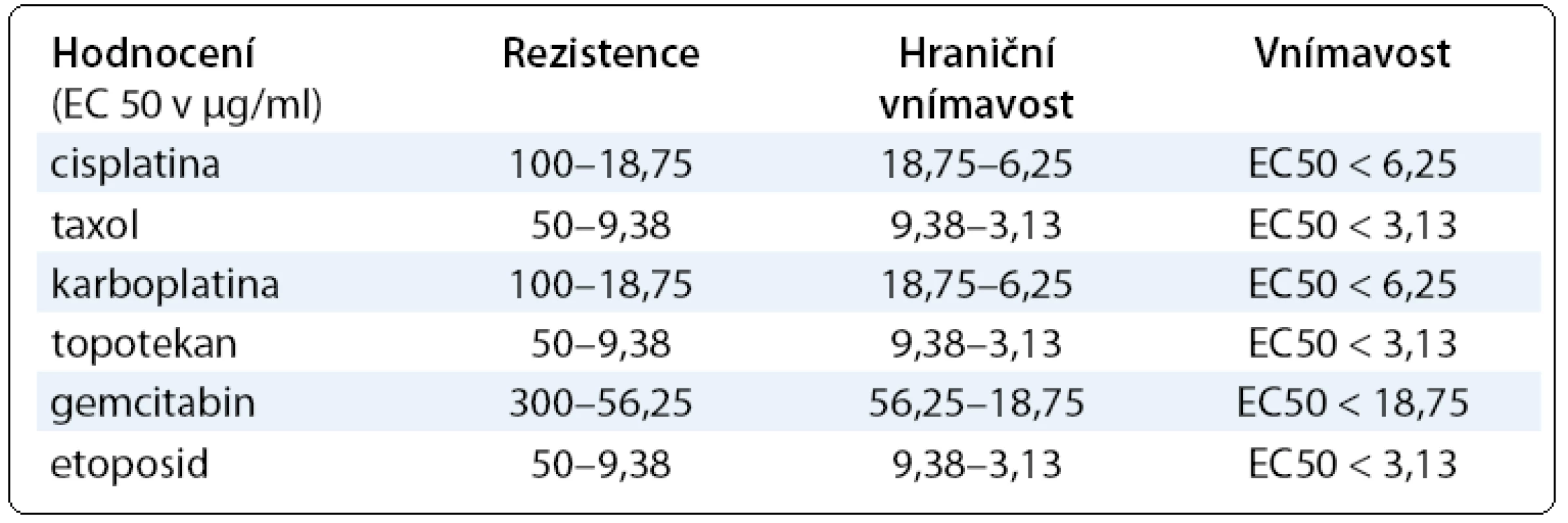
Statistické zpracování
Pro základní charakteristiku souboru jsme použili deskriptivní metody statistiky. Pro vztahy kvalitativních parametrů se testovala hypotéza nezávislosti v kontingenční tabulce vůči alternativě závislosti. Byl použit Fischerův přesný test nezávislosti.
Výsledky
Při sledování vztahu proteinů rezistence se stadiem onemocnění jsme zaznamenali u všech proteinů rezistence mimo LRP nárůst průměrných hodnot směrem od časných stadií k pokročilým. Pacientky s pokročilým ovariálním karcinomem (III + IV) měly vyšší hodnoty Pgp, MRP, MRP3, MRP5 než pacientky s časným onemocněním (I + II), viz tab. 2. V případě hodnocení vztahu proteinů rezistence vůči histologickému typu ovariálního karcinomu nejvyšší hodnoty všech proteinů rezistence mimo MRP5 vykazoval mucinózní ovariální karcinom, i když zde je nutné zohlednit nízký počet pacientek. Nejnižší hodnoty LRP, Pgp, MRP jsme zaznamenali u endometroidního karcinomu ovaria (tab. 3). Při hodnocení klinické odpovědi, tedy výskytu recidivy a délky PFS (Progression Free Survival), jsme počítali pouze s pacientkami s dostatečným follow-up (min. 12 měsíců od ukončení primární léčby). Získané výsledky opět směřují k potvrzení vztahu chemorezistence in vitro s klinickým průběhem onemocnění. Zaznamenali jsme vyšší hodnoty všech proteinů rezistence (mimo LRP) u pacientek s prokázanou recidivou v porovnání s pacientkami bez recidivy ovariálního karcinomu (tab. 4).
Tab. 2. Hodnoty proteinů rezistence LRP, Pgp, MRP1, MRP3, MRP5 v závislosti na stadiu onemocnění (I + II) a (II + IV). 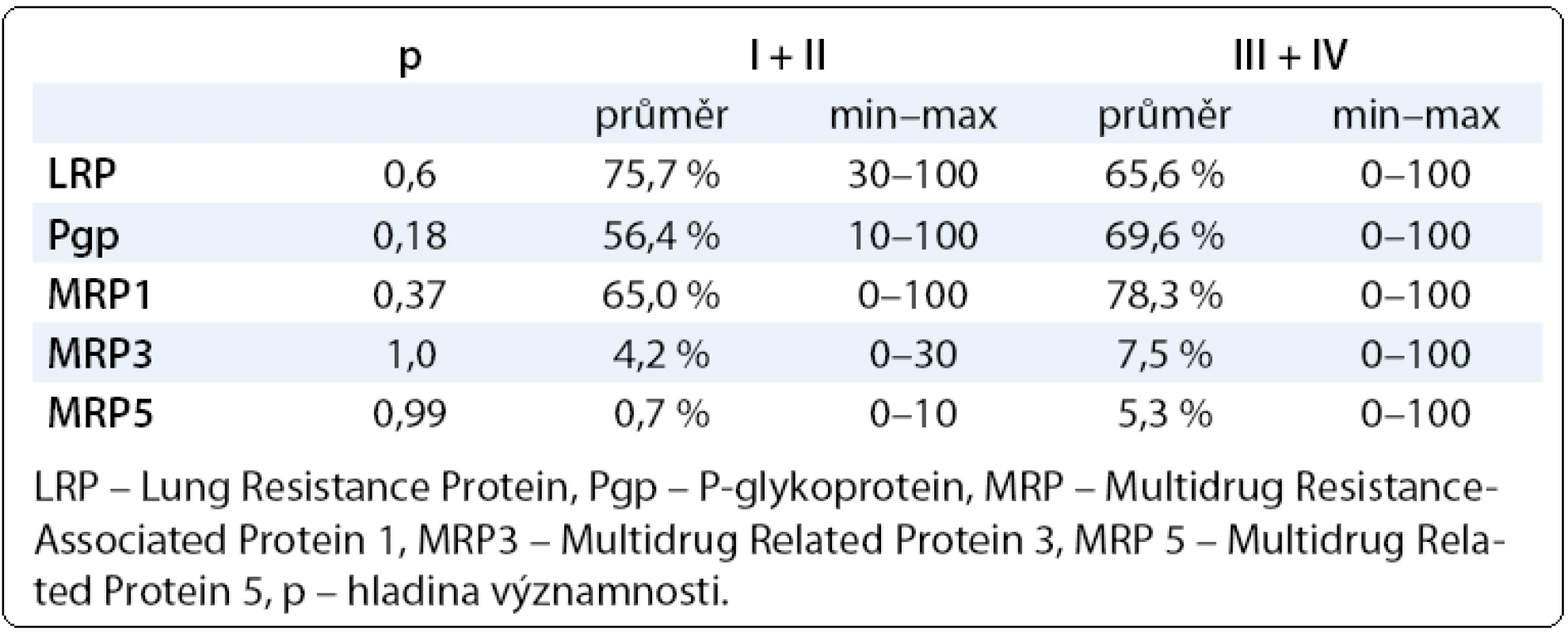
Tab. 3. Hodnoty proteinů rezistence LRP, Pgp, MRP1, MRP3, MRP5 v závislosti na histologickém typu ovariálního karcinomu. 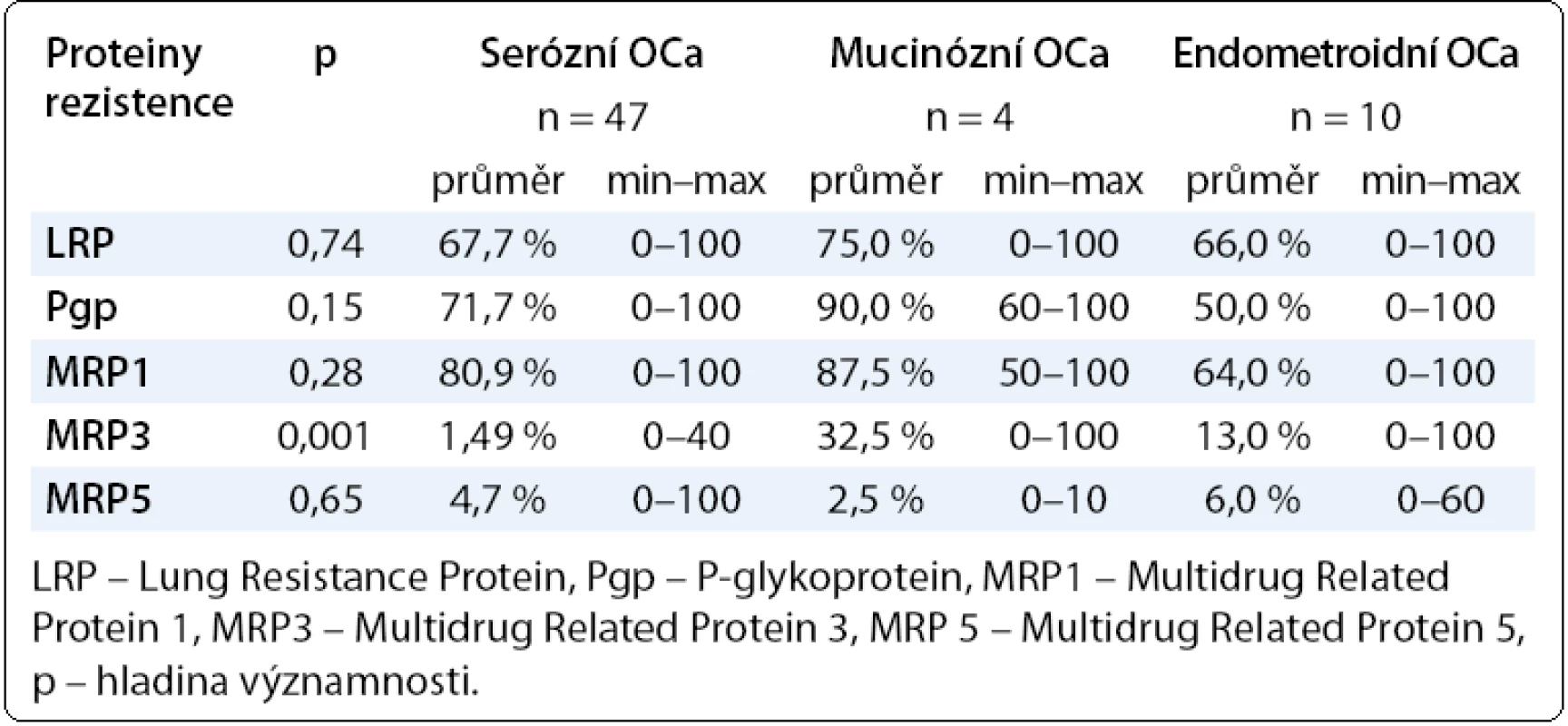
Tab. 4. Hodnoty proteinů rezistence LRP, Pgp, MRP1, MRP3, MRP5 v závislosti na výskytu recidivy onemocnění. 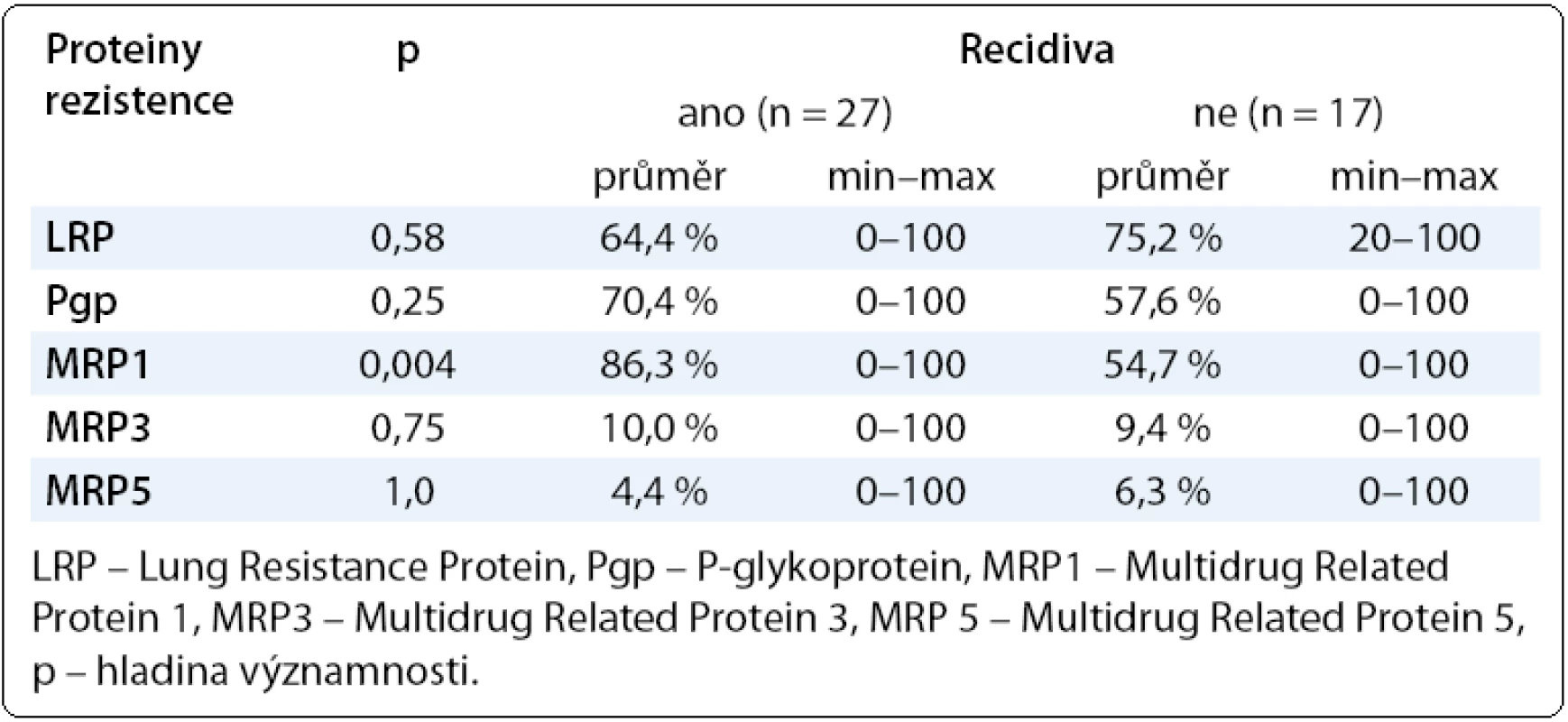
Dále jsme hodnotili vztah chemorezistence/chemosenzitivity in vitro stanovené MTT testem k proteinům rezistence LRP, Pgp, MRP, MRP3, MRP5 stanoveným imunohistochemicky. Zjistili jsme jednoznačný nárůst průměrných hodnot Pgp a MRP směrem od chemosenzitivity k chemorezistenci in vitro stanovené MTT testem. Chemorezistence/chemosenzitivita stanovená in vitro MTT testem dle našich výsledků tedy koreluje s hodnotami proteinů rezistence Pgp a MRP. Pacientky chemorezistentní in vitro dle MTT testu měly vyšší hodnoty proteinů rezistence Pgp a MRP, přičemž významnější vztah byl patrný u Pgp. Vyšší hodnoty tohoto proteinu rezistence jsme zjistili u pacientek dle MTT testu rezistentních in vitro, a to v případě všech testovaných cytostatik (tab. 5). Pro další proteiny rezistence LRP a MRP jsme prokázali vztah s chemorezistencí/chemosenzitivitou stanovenou in vitro MTT testem u karboplatiny a cisplatiny. MRP3 a MRP5 s chemorezistencí in vitro stanovenou MTT testem dle našich výsledků nekoreluje. Ani ve vztahu k ostatním sledovaným parametrům jsme význam MRP3 a MRP5 u pacientek s karcinomem ovaria nenalezli. I zde jsme prokázali největší význam Pgp a MRP u pacientek s karcinomem ovaria.
Tab. 5. Vztah proteinů rezistence LRP, Pgp, MRP1, MRP3, MRP5 s primární hemorezistencí/chemosenzitivitou <em>in vitro</em> stanovenou MTT testem na jednotlivá cytostatika. 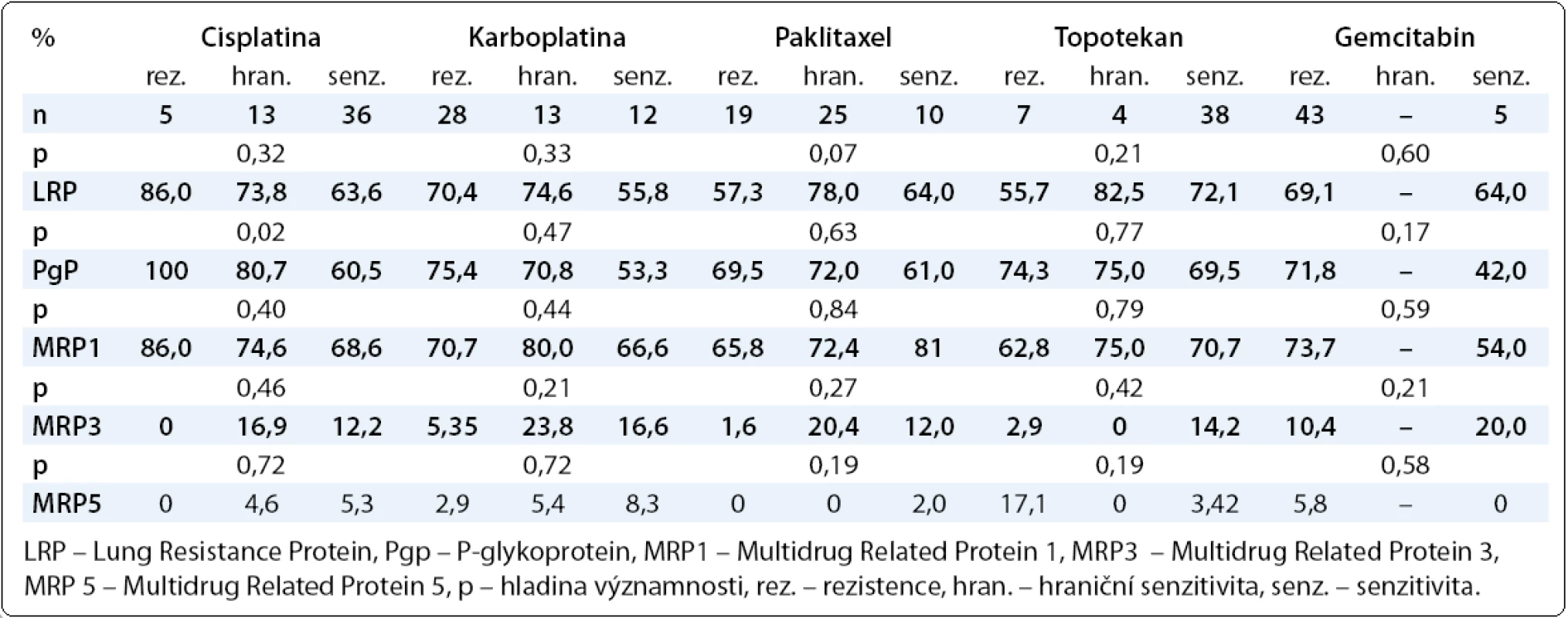
Diskuze
Z literárních údajů se zatím jako nejperspektivnější z proteinů rezistence u ovariálního karcinomu jeví P-glykoprotein. Jsou publikovány studie ukazující jasnou souvislost mezi expresí Pgp a klinicko-patologickými údaji pacientek s karcinomem prsu [9,10]. Naproti tomu existují studie, jež vliv exprese Pgp na rozvoj a průběh terapie karcinomu prsu neprokázaly [11]. Pacientky s karcinomem prsu s vysokou expresí MDR1 léčené antracykliny nebo taxany přežívaly kratší dobu než pacientky léčené jinými režimy [5]. P-glykoprotein významně ovlivňuje rezistenci určitých maligních nádorů. Význam proteinů rezistence u ovariálního karcinomu je zatím kontroverzní a výsledky nejsou jednoznačné. Izquierdo et al sledovali expresi LRP, MRP a Pgp u ovariálních karcinomů a pouze LRP prokázali jako independentní prognostický faktor odpovědi na chemoterapii a přežití [12]. Goff et al naopak nezaznamenali rozdíl hodnot LRP a MRP u pacientek chemosenzitivních a chemorezistentních [13]. Další studie u ovariálního karcinomu taktéž neprokázala význam exprese LRP ve vztahu k léčebné odpovědi u pacientek s karcinomem ovaria [14]. Materna et al prokázali prognostický význam Pgp a MRP2 u pacientek s karcinomem ovaria [15]. Pro posouzení významu míry exprese Pgp pro predikci úspěšnosti chemoterapie je rozhodujícím faktorem výběr cytostatika. V případě použití cytostatik, která jsou substráty Pgp, např. taxany, existuje předpoklad, že terapie může vést ke vzniku mnohočetné lékové rezistence. Díky případně zvýšené expresi Pgp mohou být taková léčiva za účasti transportní funkce Pgp předčasně vylučována z nádorových buněk, což může způsobit pokles účinku léčby [5]. To potvrzuje i naše práce: zjistili jsme vyšší hodnoty Pgp a MRP u pacientek s chemorezistencí in vitro stanovenou MTT testem. U těchto pacientek jsme zároveň zaznamenali častější výskyt recidivy ve sledovaném období. Vztah chemorezistence in vitro stanovené MTT testem s horší odpovědí na primární léčbu jsme prokázali již dříve [16]. Vyšší hodnoty P-glykoproteinu jsme prokázali u pacientek chemorezistentních in vitro v porovnání s pacientkami chemosenzitivními in vitro dle MTT testu, a to pro všechna testovaná cytostatika včetně platinových preparátů. V současnosti se uvádí souvislost hodnot Pgp především s chemorezistencí na taxany [17,18]. To může být dáno skutečností, že většina prací věnovaných proteinům rezistence u ovariálního karcinomu je prováděna na buněčných liniích [18–20]. V naší práci jsme hodnotili proteiny rezistence z jednotlivých vzorků ovariálních karcinomů a stanovení chemorezistence/chemosenzitivity MTT testem jsme zahajovali do dvou hodin od vlastního odběru vzorků.
Kavallaris et al prokázali kratší bezpříznakové období i celkovou dobu přežití u pacientek s vyššími hodnotami Pgp [21]. Stejné výsledky prokázali i Baekelandt et al [22]. Raspolini et al zaznamenali korelaci Pgp s odpovědí na chemoterapii [23]. Z velké variability zvěřejněných výsledků vyplývá potřeba individuálního stanovení míry exprese Pgp a jejího vlivu na úspěšnost terapie karcinomu ovaria u konkrétních pacientek a nutnost dalších studií zejména s využitím tkáně jednotlivých ovariálních karcinomů. Teprve potom se můžeme přiblížit ke skutečnému poznání vlivu proteinů rezistence na klinický průběh onemocnění a jeho využití v klinické praxi.
Závěr
Zjistili jsme vztah proteinů rezistence s histologickým typem a stadiem ovariálního karcinomu. Nalezli jsme změny hodnot P-glykoproteinu a MRP v závislosti na klinickém průběhu onemocnění. Zaznamenali jsme vztah P-glykoproteinu a MRP s chemorezistencí/chemosenzitivitou in vitro stanovenou MTT testem. Prokázali jsme vyšší hodnoty P-glykoproteinu u pacientek rezistentních in vitro dle MTT testu, a to pro všechna testovaná cytostatika. Vyšší hodnoty MRP a LRP jsme zjistili pro platinové preparáty u pacientek rezistentních in vitro dle MTT testu. Dle našich výsledků by stanovení Pgp a MRP mohlo přispět k predikci léčebné odpovědi na primární chemoterapii u pacientek s karcinomem ovaria.
MUDr. Iva Sedláková, Ph.D.
Porodnická a gynekologická klinika
Fakultní nemocnice
Sokolská 581
500 05 Hradec Králové
e-mail: sedlakiva@seznam.cz
Obdrženo: 18. 5. 2012
Přijato: 30. 8. 2012
Zdroje
1. Cibula D, Petruželka L et al. Onkogynekologie. Praha: Grada Publishing 2009.
2. Fruehauf PJ, Alberts DS. In vitro drug resistance versus chemosensitivity: two sides of different coins. J Clin Oncol 2005; 23(15): 3641–3643.
3. Ozols RF, Schwartz PE, Eifel PJ. Ovarian cancer, fallopian tube carcinoma and peritoneal carcinoma. In: DeVita VT Jr, Hellman S, Rosenberg SA (eds). Cancer: principles and practice of oncology. 6th ed. Philadelphia: Lippincott-Raven 2001 : 597–632.
4. Nosková V, Hajdúch M, Mihál V et al. Mechanismy mnohočetné lékové rezistence a jejich význam pro klinickou praxi I. typická MDR. Klin Onkol 2000; 13(2): 4–9.
5. Václavíková R, Hubáčková M, Kubala E et al. Exprese genu mnohočetné lékové rezistence 1 (MDR1) a její význam v rozvoji a terapii karcinomu prsu. Klin Onkol 2007; 20(3): 253–259.
6. Zhang JT. The multi-structural feature of the multidrug resistance gene product P-glycoprotein: implications for its mechanism of action (hypothesis). Mol Membr Biol 2001; 18(2): 145–152.
7. Kuwano M, Uchiumi T, Hayakawa H et al. The basic and clinical implications of ABC transporters, Y-box-binding protein-1 (YB-1) and angiogenesis-related factors in human malignancies. Cancer Sci 2003; 94(1): 9–14.
8. Schinkel AH. P-Glycoprotein, a gatekeeper in the blood-brain barier. Adv Drug Deliv Rev 1999; 36(2–3): 179–194.
9. Larkin A, O’Driscoll L, Kennedy S et al. Investigation of MRP-1 protein and MDR-1 P-glycoprotein expression in invasive breast cancer: a prognostic study. Int J Cancer 2004; 112(2): 286–294.
10. Schneider J, Gonzales-Roces S, Pollán M et al. Expression of LRP and MDR1 in locally advanced breast cancer predicts axillary node invasion at the time of rescue mastectomy after induction chemotherapy. Breast Cancer Res 2001; 3(3): 183–191.
11. Seymour L, Bezwoda WR, Dansey RD. P-glycoprotein immunostaining correlates with ER and with high Ki67 expression but fails to predict anthracycline resistance in patients with advanced breast cancer. Breast Cancer Res Treat 1995; 36(1): 61–69.
12. Izquirerdo MA, van der Zee AG, Vermorken JB et al. Drug resistance-associated marker Lrp for prediction of response to chemotherapy and prognoses in advanced ovarian carcinoma. J Natl Cancer Inst 1995; 87(16): 1230–1237.
13. Goff BA, Paley PJ, Greer BE et al. Evaluation of chemoresistance markers in woman with epithelial ovarian carcinoma. Gynecol Oncol 2001; 81(1): 18–24.
14. Arts HJ, Katsaros D, de Vries EG et al. Drug resistance-associated markers P-glycoprotein, multidrug resistance-associated protein 1, multidrug resistance-associated proetin 2, and lung resistance protein as prognostic factors in ovarian carcinoma. Clin Cancer Res 1999; 5(10): 2798–2805.
15. Materna V, Pleger J, Hoffman U et al. RNA expression of MDR1/P-glycoprotein, DNA-topoisomerase I, and MRP2 in ovarian carcinoma patients: correlation with chemotherapeutic response. Gynecol Oncol 2004; 94(1): 152–160.
16. Sedláková I, Tošner J, Řezáč A et al. Rezistence/sensitivita in vitro u pacientek s karcinomem ovaria. Česk Gynekol 2011; 76(3): 184–189.
17. Xing H, Wang S, Weng D et al. Knock-down of P-glycoprotein reverses taxol resistance in ovarian cancer multicellular spheroids. Oncol Rep 200; 17(1): 117–122.
18. Kamazawa S, Kigawa J, Kanamori Y et al. Multidrug resistance gene-1 is a useful predictor of Paclitaxel-based chemotherapy for patients with ovarian cancer. Gynecol Oncol 2002; 86(2): 171–176.
19. Scheffer GL, Kool M, Heijn M et al. Specific detection of multidrug resistance proteins MRP, MRP2, MRP3, MRP5, and MDR3 P-glycoprotein with a panel of monoclonal antibodies. Cancer Res 2000; 60(18): 5269–5277.
20. Odening KE, Rutz R, Laufs S et al. Enhanced complement resistance in drug-selected P-glycoprotein expressing multi-drug-resistant ovarian carcinoma cells. Clin Exp Immunol 2008; 155(2): 239–248.
21. Kavallaris M, Leary JA, Barrett JA et al. MDR1 and multidrug resistance-associated protein (MRP) gene expression in epithelial ovarian tumors. Cancer Lett 1996; 102(1–2): 7–16.
22. Baekelandt MM, Holm R, Nesland JM et al. P-glycoprotein expression is a marker for chemotherapy resistance and prognosis in advanced ovarian cancer. Anticancer Res 2000; 20(2B): 1061–1067.
23. Raspollini MR, Amunni G, Villanucci A et al. Prognostic significance of microvessel density and vascular endothelial growth factor expression in advanced ovarian serous carcinoma. Int J Gynecol Cancer 2004; 14(5): 815–823.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článek Klinický registr CORECT
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2012 Číslo 6- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Klinická onkologie slaví 25. výročí
- Molekulární podstata Waldenströmovy makroglobulinemie
- Prečo sú mitochondrie vhodné ciele pre liečbu rakoviny
- Hodnocení jaterní funkce v onkologické praxi
- EML4-ALK fúzní gen u pacientů s plicním karcinomem: biologie, diagnostika a cílená terapie
- Porovnání nákladů u režimů XELOX a FOLFOX-4 v léčbě kolorektálního karcinomu
- Výsledky léčby mozkových tumorů stereotaktickou radioterapií a radiochirurgií
- Profil pacientů s nádory léčených na pohotovosti referenčního střediska nádorové péče v jižní Brazílii
- Proteiny rezistence a chemorezistence u pacientek s karcinomem ovaria
- Kazuistika: Podpůrná léčba u pacientky s rozsáhlým tumorem ovaria
- Bílé subkapsulární jaterní uzly objevené náhodně během laparoskopické operace: žlučové hamartomy a peribiliární žlázový hamartom
- Paraneoplastický neurologický syndrom u 64letého pacienta s malobuněčným karcinomem plic – kazuistika
- Vzpomínka na MUDr. Vladimíra Spurného, CSc.
- Prof. MUDr. Rostislav Vyzula, CSc., již a teprve šedesátiletý
- Klinický registr CORECT
- Možnosti překonání rezistence k hormonální léčbě u pacientek s hormonálně dependentním metastatickým karcinomem prsu
- Aprepitant a pruritus – komentář k článku
- Informace z České onkologické společnosti
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Hodnocení jaterní funkce v onkologické praxi
- Porovnání nákladů u režimů XELOX a FOLFOX-4 v léčbě kolorektálního karcinomu
- Bílé subkapsulární jaterní uzly objevené náhodně během laparoskopické operace: žlučové hamartomy a peribiliární žlázový hamartom
- Kazuistika: Podpůrná léčba u pacientky s rozsáhlým tumorem ovaria
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



