-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Pacientka s metastatickým karcinoidem z pohárkových buněk
A Case Report: Patient with Metastatic Goblet Cell Carcinoid
Background:
Goblet cell carcinoid represents a unique entity of appendiceal neoplasia. Its pathological features and clinical behavior are distinct from the classic carcinoid tumor as well as primary adenocarcinoma of the appendix. Correct histopathological classification and diagnosis provide guidelines for treatment and prognosis. Morphological transformation of the Goblet cell carcinoid from typical Goblet cell carcinoid to adenocarcinoma morphology is likely associated with accumulation of additional genetic changes that is why subclassification of this group of tumors is needed. Investigation of molecular genetic changes could increase our understanding of this exotic but clinically important group of tumors.Case:
We present the case of a patient with metastatic goblet cell carcinoid involving terminal ileum, ascendent colon, ovary, omentum and peritoneal spreading, treated with debulking surgery and chemotherapy (FOLFOX4 regimen) with good response, reduction of disease on CT and PET complete remission. Improvement of clinical symptoms as well as quality of life was reached by combined palliative treatment.Conclusion:
Correct diagnostics and therapeutic efforts bring patient benefit even in metastatic setting. Better knowledge of rare tumors and understanding of their biology help improve therapeutic approaches.Key words:
goblet cell carcinoid – appendiceal neoplasm – chemotherapy
Autori: B. Bencsiková 1; A. Jurečková 1; E. Lžičařová 2; P. Karásek 1; R. Vyzula 1
Pôsobisko autorov: Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno 1; Oddělení onkologické patologie, Masarykův onkologický ústav, Brno 2
Vyšlo v časopise: Klin Onkol 2013; 26(3): 208-212
Kategória: Kazuistika
Súhrn
Východiska:
Karcinoid z pohárkových buněk (goblet cell carcinoid) představuje zvláštní podskupinu apendikálních neoplazií. Jejich patologické charakteristiky a klinické projevy jsou jiné než u klasických karcinoidů a primárních adenokarcinomů apendixu. Správná histopatologická klasifikace a diagnostika jsou základem pro léčbu a prognózu. Morfologická transformace typického karcinoidu z pohárkových buněk na morfologii adenokarcinomu je pravděpodobně spojena s přídatnými genetickými změnami, proto je nutná subklasifikace této skupiny nádorů. Výzkum molekulárně genetických změn vede k lepšímu chápání této exotické, ale klinicky důležité skupiny nádorů a jejich správné léčbě.Kazuistika:
Uvádíme případ pacientky s metastatickým karcinoidem z pohárkových buněk s postižením terminálního ilea, colon ascendens, ovaria, omenta a masivní peritoneální diseminací, po debulking operaci a paliativní chemoterapii režimem FOLFOX4 s velmi dobrým léčebným efektem, s regresí onemocnění na CT a PET kompletní remisí. Kombinovaná paliativní léčba vedla ke zmírnění klinických symptomů a zlepšení kvality i délky života.Závěr:
Správná diagnostika a léčebné úsilí i u rozsáhlého metastatického onemocnění přinášejí prospěch pacientovi. Poznání vzácných nádorů a porozumění jejich biologii vede ke zlepšení léčebných přístupů.Klíčová slova:
karcinoid z pohárkových buněk – nádory apendixu – chemoterapieÚvod
Karcinoid z pohárkových buněk (goblet cell carcinoid – GCC) představuje zvláštní entitu, subtyp MANEC (mixed adeno‑neuroendocrine carcinomas).
Incidence apendikálních karcinoidů z pohárkových buněk (GCC) je 0,01 – 0,05/ 100 000/ rok a patří mezi velmi vzácné epiteliální neoplazie s maligním chováním [1,2]. Patologické charakteristiky a klinické chování jsou jiné než u klasických neuroendokrinních nádorů (neuroendocrine neoplasm – NEN) či adenokarcinomů apendixu (tab. 1). Průměrný věk v době stanovení diagnózy je 50 let. Morfologicky vznikají karcinoidy z pohárkových buněk (GCC) v mukóze bez předcházejících dysplastických změn apendikálního epitelu. Zásadní morfologickou charakteristikou je přítomnost epiteliálních buněk pohárkového tvaru obsahujících hlen, přítomna je fokální pozitivita neuroendokrinních markerů (chromograninu A nebo synaptophysinu), exprese CEA [3,4]. V patogenezi GCC, podobně jako u jejuno ‑ ileálních NEN, se předpokládají změny chromozomů 11q, 16q a 18q [5].
Tab. 1. Srovnání klinicko-patologických znaků karcinoidu z pohárkových buněk, apendikálních NEN a adenokarcinomu (volně upraveno podle Roy P et al [14]). ![Srovnání klinicko-patologických znaků karcinoidu z pohárkových buněk, apendikálních NEN a adenokarcinomu (volně upraveno podle Roy P et al [14]).](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/7aa72f954ddba603a2f0808fd0fd36e5.png)
V této skupině nádorů se vyskytuje časté metastatické onemocnění, asi u 10 % případů jsou v době diagnózy přítomny již uzlinové nebo vzdálené metastázy. Častá je diseminace peritoneální a na omentu, s agresivním růstem. TNM klasifikace je stejná jako pro adenokarcinomy apendixu.
Diagnóza je stanovena často náhodně na základě nespecifických břišních symptomů (příznaky akutní apendicitidy v 50 – 60 %, peritonitidy v 10 – 20 %, bolesti břicha v pravém dolním kvadrantu, střevní obstrukce ve 20 % případů). Často jde o vedlejší nález při gynekologické operaci nebo apendektomii. Prezentovat se může také jako Krukenbergův tumor ovarií [6,7].
Zobrazovací metody prokazují nejčastěji léze distálního ilea nebo apendixu. Vstupní staging po stanovení diagnózy je stejný jako u apendikálních nádorů s vysokým rizikem. Doporučuje se CT hrudníku, břicha a pánve, případně magnetická rezonance. V případech negativního octreoscanu je ke zvážení doplnění FDG ‑ PET, který však v diagnostice GCC nemusí být validní [8].
Léčba karcinoidů z pohárkových buněk je chirurgická. Metastatické onemocnění se léčí chemoterapií jako kolorektální karcinom.
V laboratorních testech nemá význam měřit chromogranin A (CgA), častěji jsou elevované CEA, CA 19-9 a CA ‑ 125.
Prognóza závisí na histopatologickém typu GCC. Nejbenignější skupina má 5leté přežívání 100 %, nejhorší subtyp s vysokým proliferačním indexem vykazuje 3leté přežívání pouze 17 % [9].
Kazuistika
V naší kazuistice prezentujeme případ 67leté pacientky po operaci břicha pro ileózní stav v lednu 2010. Peroperačně byl zjištěn nádor lokalizovaný v oblasti terminálního ilea a colon ascendens, proto byla provedena pravostranná hemikolektomie, resekce terminálního ilea, resekce pravého ovaria a exstirpace jedné z mnohočetných drobných metastáz mezenteria. Histologicky byl verifikován GCC v primárním tumoru a metastázy v ovariu a mezenteriu. Klinicky bez známek karcinoidového syndromu. Pacientka byla dále sledována.
Karnofského index pacientky v době stanovení diagnózy a následného sledování odpovídal 90 %. V rodinné anamnéze je udávána leukemie u bratra. V osobní anamnéze nemocné pak hypertenze, chronická ischemická nemoc srdeční, diabetes mellitus II. typu, obezita, hyperlipidemie, chronická venózní insuficience.
Druhé čtení histologie bylo provedeno v MOÚ, s mikroskopickým nálezem infiltrace stěny tenkého střeva trabekulárním a tubulárním tumorem s fokálně výraznou příměsí pohárkových buněk, ložiskově s intra ‑ i extracelulární mukosekrecí. Sliznice infiltrována sekundárně, bez přítomnosti dysplazie. Nádorový infiltrát exprimuje CEA v pohárkových buňkách, dispergovaně v menší části populace pozitivní chromogranin a CD56. Závěr nálezu: infiltrace ilea karcinoidem z pohárkových buněk, origo pravděpodobně v apendixu (obr. 1–3).
Obr. 1. Nádorová infi ltrace prostupující muskulární vrstvu střevní stěny. Barvení hematoxylin-eozin, zvětšení 200krát. 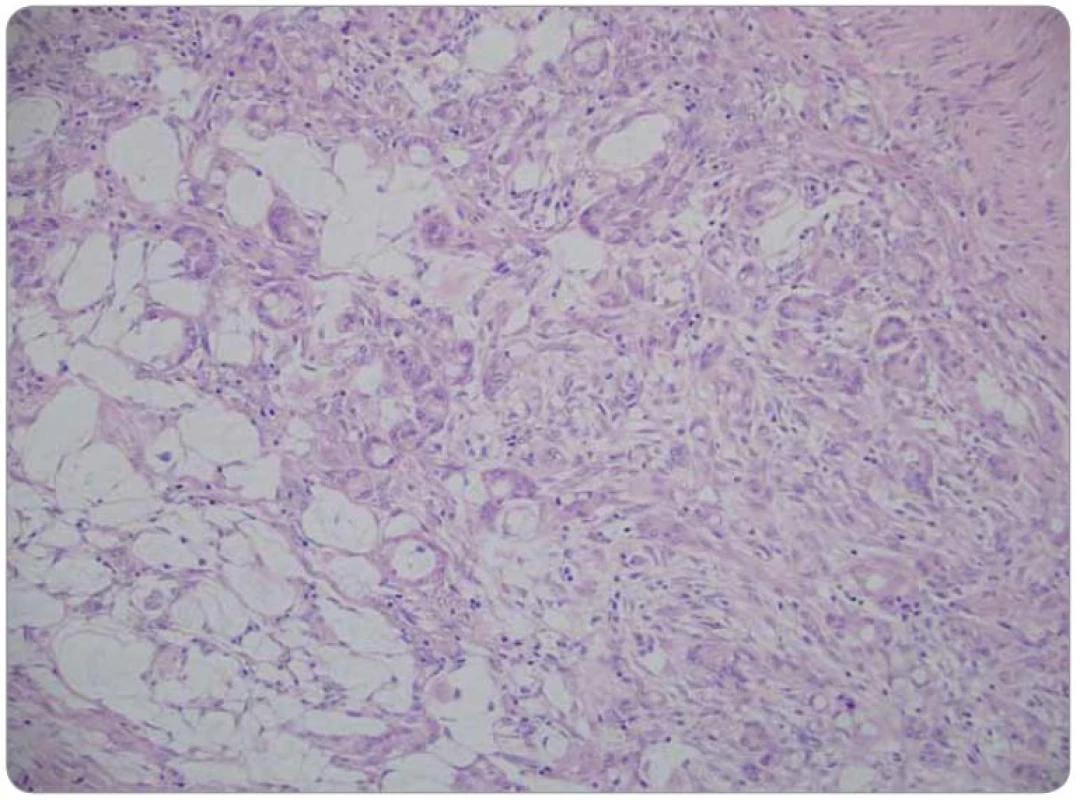
Obr. 2. Přítomnost intracelulárního hlenu ve vakuolizovaných nádorových buňkách, metodika na průkaz kyselých mukopolysacharidů. Barvení alciánová zeleň, zvětšení 400krát. 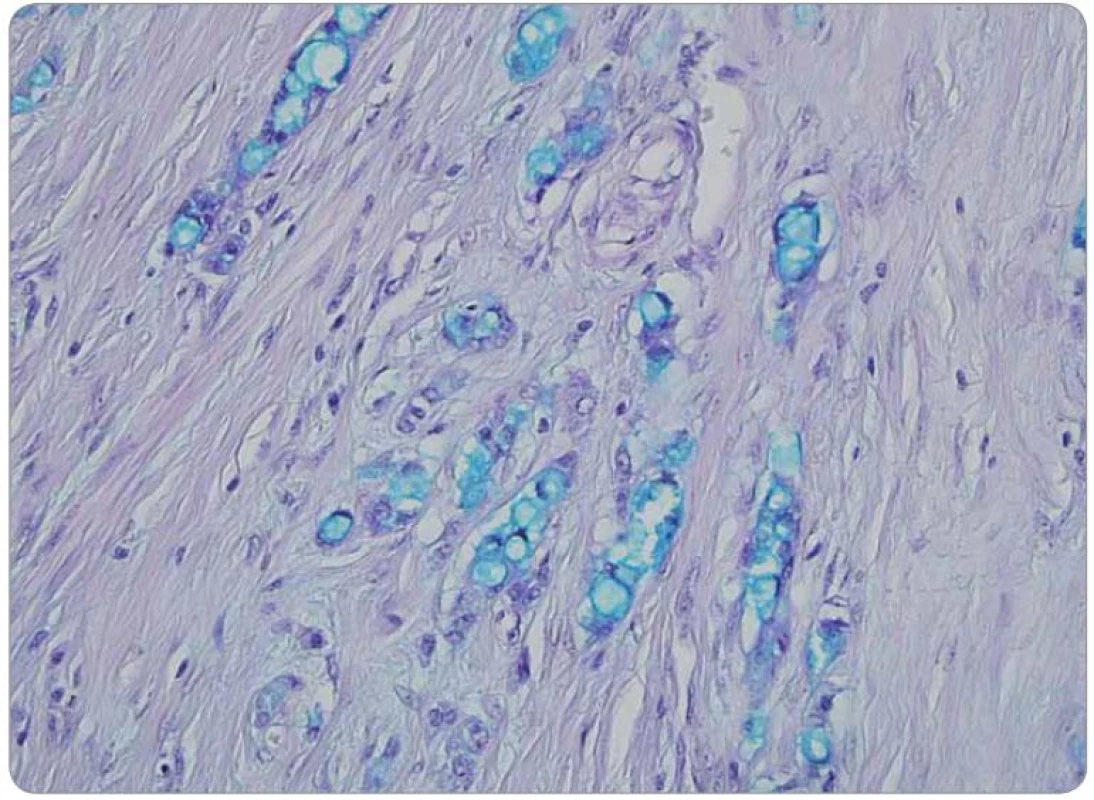
Obr. 3. Detekce neuroendokrinní diferenciace v nádorových buňkách prokazující fokální silnou granulární pozitivitu. Imunohistochemická reakce s protilátkou proti chromograninu (Chromogranin, Biogenex), zvětšení 400krát. 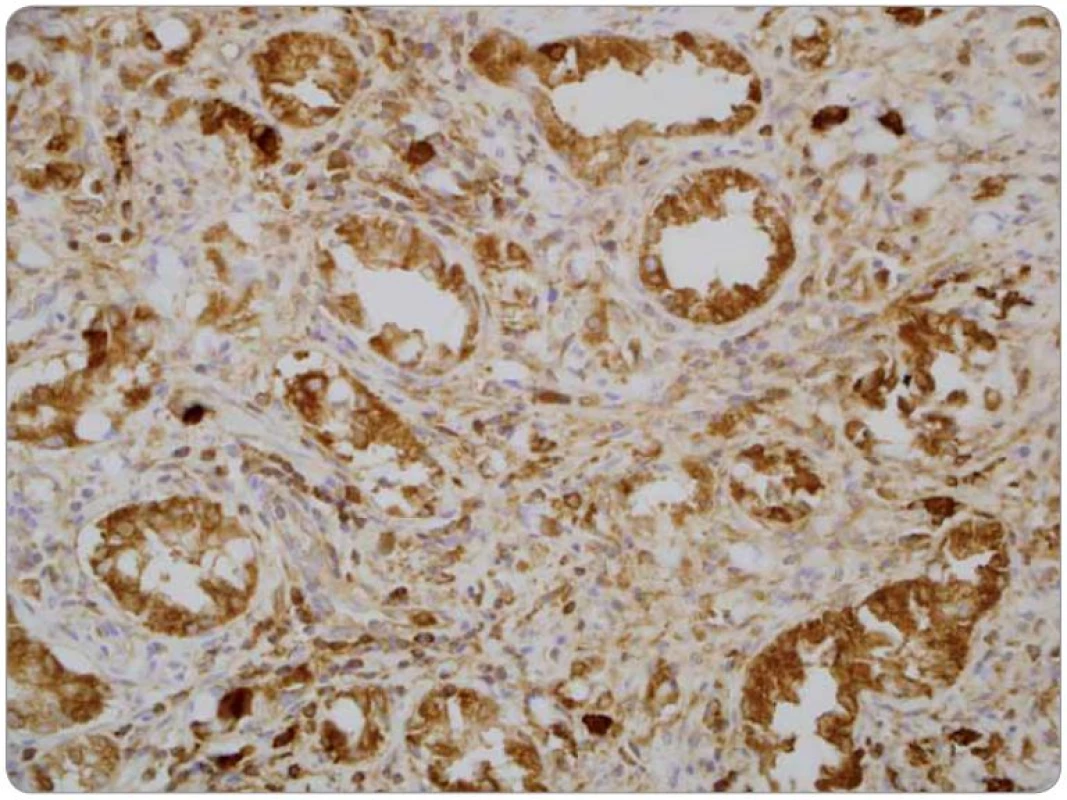
Pooperační CT hrudníku, břicha a pánve v dubnu 2010 bez průkazu patologické expanze v dutině břišní. Kontrolní CT v říjnu 2010 s podezřením na počínající metastatickou diseminaci mezenteria. Další CT v lednu 2011 již s infiltráty v dutině břišní, při přední stěně břišní, MTS peritoneální, nepatrný ascites.
Pacientka byla odeslána k další léčbě do MOÚ. Octreoscan byl negativní, nádor nevykazoval expresi somatostatinových receptorů.
Další léčebný plán byl projednán v komisi pro digestivní onkologii a naplánován debulking. V dubnu 2011 operační revize, provedena částečná omentektomie ve smyslu cytoreduktivního výkonu při peroperačním nálezu mnohočetných infiltrátů dutiny břišní v omentu, na peritoneu a na serózách. Dále byla indikována paliativní systémová chemoterapie režimem FOLFOX4.
Výsledky
Efekt léčby po 6 cyklech FOLFOX4 byl výborný, na CT přetrvává pouze drobné reziduum metastáz na peritoneu vpravo v mezogastriu velikosti 8 mm.
V říjnu 2011 po 10 cyklech FOLFOX4 v dutině břišní bez známek metastáz, nově nález trombembolu v pravé hlavní větvi plicnice. Byla zahájena antikoagulační léčba a pokračovala chemoterapie režimem FU/ FA DeGramont – od 11. cyklu bez oxaliplatiny z důvodu neurotoxicity.
Přešetření v listopadu 2011 bez známek metastáz, na PET a CT kompletní remise. Léčebný efekt trval až do srpna 2012, kdy byla na CT prokázána progrese metastáz v pánvi. V říjnu 2012 provedena explorativní laparotomie. Pokus o debulking však nebyl úspěšný vzhledem k rozsahu a lokalizaci metastáz převážně v pánvi.
Histologický nález byl verifikován při každé operační revizi, ve shodě s primární diagnózou karcinoidu z pohárkových buněk.
Podání další chemoterapie nebylo možné z důvodu rozvoje ileózního stavu. V prosinci 2012 revize dutiny břišní pro ileus, uvolněny srůsty, vyšita axiální ileostomie.
Nyní pacientka vzhledem k celkovému stavu a interkurencím již není schopna další chemoterapie, tudíž pokračuje léčba symptomatická. Stav nemocné však zůstává stabilní, nezhoršuje se. Na nastavené analgetické a další podpůrné medikaci je klinicky minimálně symptomatická, drží si stabilní hmotnost a péči o ileostomii zvládá velmi dobře.
Diskuze
Chirurgická léčba je základem léčby karcinoidů z pohárkových buněk (GCC). Iniciální apendektomie jako standardní chirurgická intervence převážné většiny GCC není z hlediska onkologické radikality dostatečná. Většinou musí být doplněna pravostranná hemikolektomie z důvodu vysokého metastatického potenciálu onemocnění. Doporučuje se provést nejpozději do tří měsíců po apendektomii. Strategie chirurgické léčby je také podobná léčbě kolorektálních karcinomů. U žen s GCC apendixu se doporučuje provést bilaterální salpingo ‑ ooforektomii, zatím však není potvrzen vliv na přežívání.
Cytoreduktivní chirurgie a adjuvantní intraperitoneální chemoterapie může prodloužit přežívání u případů s pokročilou peritoneální diseminací onemocnění, je však potřeba prospektivních studií k potvrzení těchto dat. V případě jaterních metastáz chybějí údaje, jak postupovat. Tato klinická situace je však vzácná. Ke zvážení je chirurgická léčba analogická s léčbou kolorektálního karcinomu (tab. 2).
Tab. 2. Publikované soubory pacientů s karcinoidem z pohárkových buněk a jejich léčba (převzato podle Pahlavan PS et al [11], WJSO 3/2005). ![Publikované soubory pacientů s karcinoidem z pohárkových buněk a jejich léčba (převzato podle Pahlavan PS et al [11], WJSO 3/2005).](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/73ee63c8fd0f8c2add80f170caf9c10d.png)
Neresekabilní nebo metastické onemocnění GCC se léčí chemoterapií. Terapeutického efektu je dosaženo až u 50 % pacientů, popsána stabilizace onemocnění minimálně po dobu 8 – 12 měsíců [10 – 12]. U naší pacientky byla dosažena kompletní remise dle zobrazovacích metod a stabilizace onemocnění po dobu 15 měsíců. Nejefektivnější je režim na bázi 5 - fluorouracilu (FOLFOX).
V individuálních případech lze zvážit jiné léčebné strategie: ablativní léčbu jaterních metastáz. PRRT (peptide receptor radionuclide therapy) nelze doporučit z důvodu nepřítomnosti exprese somatostatinových receptorů a menší efektivity u nádorů s vysokým proliferačním indexem Ki ‑ 67.
Sledování pacientů probíhá analogicky jako u nemocných s kolorektálním karcinomem. U pacientů s metastatickým onemocněním se doporučuje přešetřování à tři měsíce k detekci progrese onemocnění a zahájení léčby. Častý je výskyt duplicitních malignit (až 48 %), např. kolorektálního karcinomu, tudíž je nutné dlouhodobé sledování [13].
Závěr
Správná diagnostika a léčebné úsilí i u rozsáhlého metastatického onemocnění přinášejí prospěch pacientovi. Poznání vzácných nádorů a porozumění jejich biologii vede ke zlepšení léčebných přístupů. Zásadní význam má léčba v onkologických centrech se zaměřením na léčbu neuroendokrinních nádorů, s možností multidisciplinárního řešení.
Práce byla podpořena prostředky institucionální podpory výzkumné organizace poskytnuté Ministerstvem zdravotnictví ČR v roce 2013.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
MUDr. Beatrix Bencsiková
Klinika komplexní onkologické péče
Masarykův onkologický ústav
Žlutý kopec 7
65653 Brno
e-mail: bencsikova@mou.cz
Obdrženo: 8. 2. 2013
Přijato: 16. 5. 2013
Zdroje
1. McGory ML, Maggard MA, Kang H et al. Malignancies of the appendix: beyond case series reports. Dis Colon Rectum 2005; 48(12): 2264 – 2271.
2. McCusker ME, Coté TR, Clegg LX et al. Primary malignant neoplasms of the appendix: a population‑based study from the surveillance, epidemiology and end‑results program, 1973 – 1998. Cancer 2002; 94(12): 307 – 3312.
3. Landry CS, Woodall C, Scoggins et al. Analysis of 900 appendiceal carcinoid tumors for a proposed predictive staging system. Arch Surg 2008; 143(7): 664 – 670.
4. Tang LH, Shia J, Soslow RA et al. Pathologic classification and clinical behavior of the spectrum of goblet cell carcinoid tumors of the appendix. Am J Surg Pathol 2008; 32(10): 1429 – 1443.
5. Tönnies H, Toliat MR, Ramel C et al. Analysis of sporadic neuroendocrine tumours of the enteropancreatic system by komparative genomic hybridisation. Gut 2001; 48(4): 536 – 541.
6. Mandai M, Konishi I, Tsuruta Y et al. Krukenberg tumor from an occult appendiceal adenocarcinoid: a case report and review of the literature. Eur J Obstet Gynecol Reprod Biol 2001; 97(1): 90 – 95.
7. Hristov AC, Young RH, Vang R et al. Ovaria metastases of appendiceal tumors with goblet cell carcinoid‑like and signet ring cell patterns: a report of 30 cases. Am J Surg Pathol 2007; 31(10): 1502 – 1511.
8. Modlin IM, Öberg K. A Century of Advances in Neuroendocrine Tumor Biology and Treatment. Felsenstein C. C. C. P. 2007; 116 – 123.
9. Bergestuen DS, Aabakken L, Holm K et al. Small intestinal neuroendocrine tumors: prognostic factors and survival. Scand J Gastroenterol 2009; 44(9): 1084 – 1091.
10. Pham TH, Wolff B, Abraham SC et al. Surgical and chemotherapy treatment outcomes of goblet cell carcinoid: a tertiary cancer center experience. Ann Surg Oncol 2006; 13(3): 370 – 376.
11. Pahlavan PS, Kanthan R. Goblet cell carcinoid of the appendix. World J Surg Oncol 2005; 3(36): 157.
12. Garin L, Corbinais S, Boucher E et al. Adenocarcinoid of the appendix vermiformis complete and persistent remission after chemotherapy (FOLFOX) of a metastatic case. Dig Dis Sci 2002; 47 : 2760 – 2762.
13. Pape UF, Perren A, Niederle B et al. ENETS Consensus Guidelines for the management of patients with neuroendocrine neoplasms from the jejuno ‑ ileum and the appendix including goblet cell carcinomas. Neuroendocrinology 2012; 95(2): 135 – 156.
14. Roy P, Chetty R. Goblet cell carcinoid tumors of the appendix: An Overview. World J Gastrointest Oncol 2010; 2(6): 251 – 258.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2013 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Editorial
- Thalidomid v léčbě mnohočetného myelomu se zaměřením na kombinaci s bortezomibem
- Karcinom prostaty, aktuální dilema uroonkologie. Jak prospět ohroženým pacientům a neuškodit těm ostatním
- Erratum
- Inhibice signalizace B buněčným receptorem: první cílená léčba u chronické lymfocytární leukemie a dalších B buněčných lymfomů
- Udržiavacia liečba lenalidomidom u pacientov s mnohopočetným myelómom
- Léčba průlomové bolesti u onkologických pacientů
- Komunikácia ako súčasť suportívnej terapie v onkológii
- Výsledky kurativní chemoradioterapie u pacientů s karcinomy anu
- Pacientka s metastatickým karcinoidem z pohárkových buněk
- Karcinom prsu u monozygotních dvojčat
- Informace z České onkologické společnosti
- Zajímavé případy z nutriční péče v onkologii
- Léčba závislosti na tabáku
-
Onkologie v obrazech
Rozměrná regionální metastáza melanomu - Prof. MU Dr. Ľudovít Milan Jurga, DrSc. – významné jubileum
- Jubileum pana profesora MU Dr. Dalibora Ondruše, DrSc.
- Jaroslav Bakeš (1871–1930): lékař, na něhož se zapomnělo / Gustav Novotný
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Karcinom prostaty, aktuální dilema uroonkologie. Jak prospět ohroženým pacientům a neuškodit těm ostatním
- Výsledky kurativní chemoradioterapie u pacientů s karcinomy anu
- Komunikácia ako súčasť suportívnej terapie v onkológii
- Udržiavacia liečba lenalidomidom u pacientov s mnohopočetným myelómom
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



