-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Udržiavacia liečba lenalidomidom u pacientov s mnohopočetným myelómom
Lenalidomide Maintenance Therapy in Patients with Multiple Myeloma
Maintenance therapy was recently defined as any treatment administered after the completion of induction therapy in patients whose disease is either responsive or nonprogressive at the time, with the goal of prolonging survival. Several studies have evaluated the use of novel agents as part of posttransplantation maintenance to improve progression free survival and overall survival. As shown by recent clinical trials, thalidomide and bortezomib are more indicated as consolidation agents, increasing the response rates. In contrast, lenalidomide showed a low toxicity profile and a benefit from prolonged treatment, making the drug one of the best choices for maintenance treatment. The role of lenalidomide in the maintenance therapy was evaluated in three randomized clinical trials. Lenalidomide was associated with a significantly increased progression free survival and in one study with a significant survival benefit. An unexpected finding from these trials was a modest increase in the incidence of secondary cancers. Whether lenalidomide maintenance should be routinely offered to patients is controversial among experts. For now, lenalidomide maintenance should be considered standard for patients not achieving a complete remission after stem cell transplantation, and for high‑risk patients. For patients with low ‑ risk disease, the risk/ benefits of lenalidomide maintenance versus watchful waiting should be discussed until we have more data regarding survival benefits. Further analysis of lenalidomide maintenance therapy to determine the long‑term risk of secondary malignancies and longer follow‑up to assess the impact on overall survival is required.
Key words:
multiple myeloma – lenalidomide – maintenance
Autoři: Ľ. Roziaková 1; M. Mistrík 2
Působiště autorů: Oddelenie klinickej patofyziológie, Klinika hematológie a transfuziológie LF UK a UN Bratislava 1; Klinika hematológie a transfuziológie LF UK a UN Bratislava 2
Vyšlo v časopise: Klin Onkol 2013; 26(3): 186-190
Kategorie: Přehled
Souhrn
Udržiavacia liečba bola definovaná ako akákoľvek liečba podávaná po ukončení indukčnej liečby u pacientov s buď odpovedajúcim, alebo neprogredujúcim ochorením, s cieľom predĺžiť prežívanie pacientov. Viacero štúdií sledovalo použitie nových liekov v udržiavacej liečbe po transplantácii so snahou zlepšiť interval prežitia bez progresie a celkového prežívania. Ako ukázali nedávne štúdie, thalidomid a bortezomib sú vhodnejšie lieky na konsolidáciu, s efektom prehĺbenia liečebnej odpovede. Na druhej strane, lenalidomid je doposiaľ najúčinnejším liekom v udržiavacej liečbe, s nízkou toxicitou a benefitom z predĺženého podávania. Úloha lenalidomidu v udržiavacej liečbe bola posudzovaná v troch randomizovaných klinických štúdiách. U pacientov s lenalidomidom došlo k predĺženiu prežívania bez progresie a v jednej štúdii aj k zlepšenému prežívaniu. Neočakávaným zistením bol zvýšený výskyt sekundárnych malignít v tejto skupine pacientov. Otázne ostáva, či udržiavacia liečba sa má zahájiť u každého pacienta. Zatiaľ sa odporúča udržiavacia liečba lenalidomidom pacientom, ktorí nedosiahli kompletnú remisiu po transplantácii, a vysokorizikovým pacientom. U pacientov so štandardným rizikom by sa malo zvážiť riziko/ benefit udržiavacej liečby oproti sledovaniu pacientov, pokiaľ nebudú dostupné údaje o zlepšenom prežívaní u týchto pacientov. V súčasnosti sú teda potrebné ešte ďalšie analýzy udržiavacej terapie lenalidomidom na určenie rizikových pacientov z hľadiska možného rozvoja sekundárnych malignít a dlhšie sledovanie pacientov na zistenie vplyvu takejto liečby na celkové prežívanie.
Kľúčové slová:
mnohopočetný myelóm – lenalidomid – udržiavacia liečbaÚvod
Mnohopočetný myelóm (MM) je malígne lymfoproliferatívne ochorenie charakterizované infiltráciou kostnej drene patologickými plazmatickými bunkami, osteolytickými léziami v skelete a prítomnosťou monoklonálneho imunoglobulínu v sére a/ alebo moči [1]. Donedávna sa o ňom hovorilo ako o nevyliečiteľnom ochorení. V súčasnosti za priaznivých prognostických podmienok a použitia komplexnej intenzívnej vstupnej liečby vrátane udržiavacej liečby možno vyliečiť asi 10 % pacientov s MM [2]. Prítomnosť minimálnej reziduálnej choroby je však zodpovedná za relaps ochorenia. Medián trvania odpovede po najnovších indukčných režimoch s následnou vysokodávkovanou chemoterapiou a autológnou transplantáciou periférnych krvotvorných buniek (autologous stem cell transplantation – ASCT) väčšinou nepresahuje 36 mesiacov [3]. Preto sa hľadajú ďalšie možnosti predĺženia mediánu trvania odpovede a oddialenia relapsu ochorenia, a to buď v podobe krátkotrvajúcej konsolidačnej, alebo prolongovanej udržiavacej liečby. Kým úlohou konsolidačnej liečby je prehĺbenie odpovede po indukčnej liečbe s následnou redukciou reziduálnej choroby, úlohou udržiavacej liečby je udržanie odpovede, a tým kontrola reziduálnej choroby s oddialením progresie ochorenia. Doteraz neboli publikované žiadne klinické štúdie, ktoré by porovnávali výhody a superioritu konsolidácie verzus udržiavacej liečby.
Udržiavacia liečba po ASCT bola navrhnutá ako stratégia pre zlepšenie liečebných výsledkov [4]. Prvé štúdie skúmali úlohu melfalanu a prednizonu v udržiavacej liečbe. Hoci sa zaznamenal vplyv na prolongáciu trvania remisie, nezistil sa ich vplyv na prežívanie [5,6]. Použitie interferónu v udržiavacej liečbe tiež nevyústilo do zlepšeného intervalu prežitia bez progresie (progression free survival – PFS) alebo celkového prežívania (overall survival – OS) [4,7]. Navyše ich dlhodobé použitie bolo limitované toxicitou liečby. Výsledky klinických štúdií s bortezomibom sú tiež povzbudivé. Pozitívne výsledky boli dosiahnuté aj u prognosticky vysoko rizikových pacientov [8]. Imunomodulačné látky, ako sú thalidomid a lenalidomid, boli najviac študované v udržiavacej liečbe, jednak pre ich perorálne podávanie a jednak pre ich antitumorózny efekt. Účinnosť thalidomidu bola potvrdená vo viacerých randomizovaných štúdiách. Hoci vo viacerých štúdiách došlo k predĺženiu PFS a OS, jeho dlhodobé použitie bolo limitované jeho výraznou neurotoxicitou [9 – 14].
Lenalidomid v udržiavacej liečbe
Lenalidomid je imunomodulačná látka s duálnym mechanizmom účinku. Jeho protinádorový účinok vedie priamo k usmrteniu nádorových buniek a jeho imunomodulačný účinok môže udržať nádor v remisii. Aktuálny prehľad možných kombinovaných režimov s lenalidomidom spracúvajú viaceré prehľadové články [15,16]. V súčasnosti je v Slovenskej republike registrovaný v liečbe relabujúceho alebo refraktérneho mnohopočetného myelómu spolu s glukokortikoidom. Nakoľko však dexametazon síce posilňuje protimyelómový účinok lenalidomidu, na druhej strane antagonizuje jeho imunomodulačný efekt, preto sa odporúča v udržiavacej liečbe monoterapia lenalidomidom [17]. V súčasnosti viaceré práce sumarizujú použitie lenalidomidu nielen v liečbe relabujúceho a refraktérneho mnohopočetného myelómu, ale aj jeho použitie v rámci konsolidačnej a udržiavacej liečby novodiagnostikovaných pacientov [18,19]. Účinnosť a bezpečnosť lenalidomidu v udržiavacej liečbe bola skúmaná vo fáze III v troch veľkých randomizovaných štúdiách a vo viacerých menších štúdiách (tab. 1). Dve nezávislé randomizované štúdie (CALGB 100104 a IFM 2005 - 02) hodnotili účinnosť a bezpečnosť lenalidomidu v udržiavacej liečbe u pacientov po ASCT a jedna randomizovaná štúdia (MM ‑ 015) u seniorov nevhodných pre ASCT [20 – 22].
Tab. 1. Prehľad najdôležitejších klinických štúdií s lenalidomidom v udržiavacej liečbe. 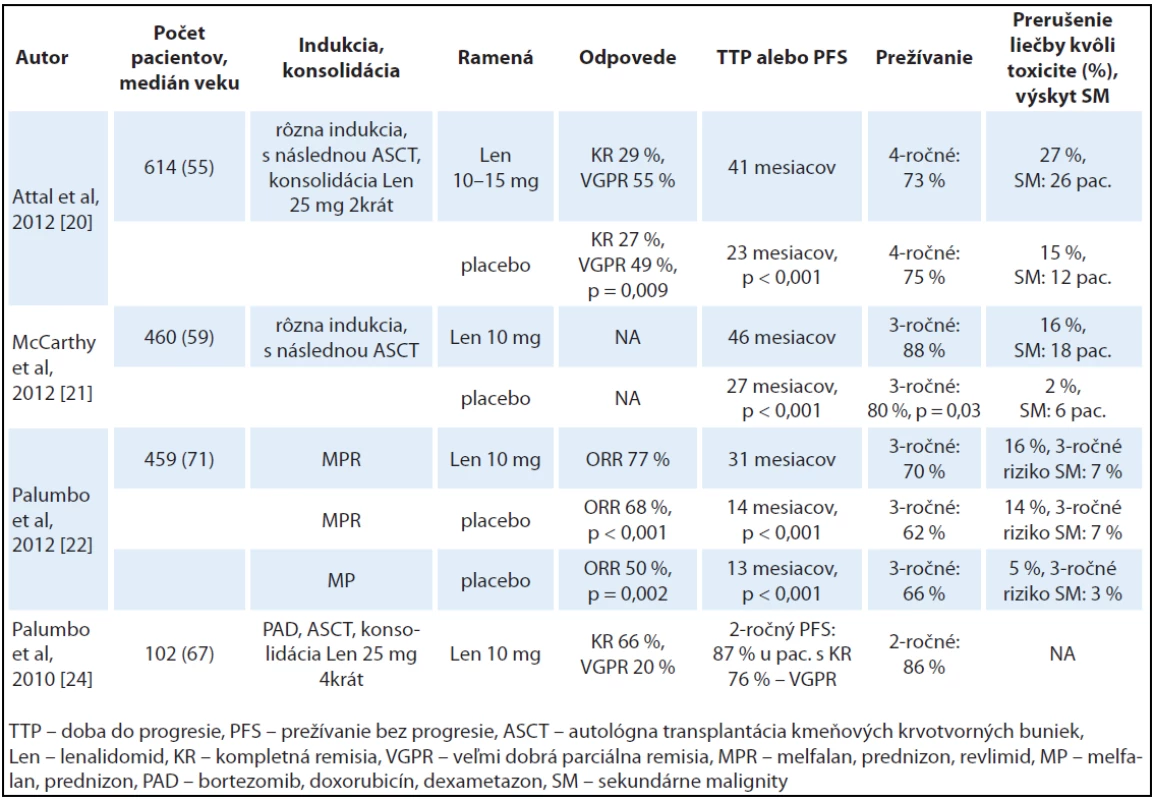
Fáza III klinickej štúdie IFM 2005-02 zistila s mediánom sledovania 45 mesiacov zlepšenú liečebnú odpoveď po ASCT a predĺženie PFS. V štúdii bolo sledovaných 614 pacientov mladších ako 65 rokov, ktorí podstúpili ASCT s konsolidáciou 2 cyklami lenalidomidu 25 mg v deň 1 – 21. Následne bolo 307 pacientov randomizovaných v rámci udržiavacej liečby do ramena s lenalidomidom 10 – 15 mg až do relapsu ochorenia a 307 pacientov do ramena s placebom. Konsolidácia s lenalidomidom vyústila do prehĺbenia počtu odpovedí. Počet kompletných remisií (KR) a veľmi dobrých odpovedí (VGPR) stúpol z 58 % pred konsolidáciou na 69 % po konsolidácii (p < 0,001). Následná udržiavacia liečba lenalidomidom viedla k signifikantnému zlepšeniu počtu odpovedí v porovnaní s placebom. Až 84 % pacientov na udržiavacej liečbe lenalidomidom dosiahlo KR alebo VGPR v porovnaní so 76 % pacientov v skupine s placebom (p = 0,009). Súčasne došlo v skupine pacientov na udržiavacej liečbe lenalidomidom k signifikantnému predĺženiu PFS o 18 mesiacov v porovnaní so skupinou s placebom (41 mesiacov vs 23 mesiacov, HR = 0,5, p < 0,001). Tento prínos sa pozoroval aj v rôznych podskupinách pacientov na základe hladiny B2 - mikroglobulínu, cytogenetického profilu (prítomnosť del13q) alebo liečebných odpovedí po ASCT. Trojročné celkové prežívanie (OS) od randomizácie bolo podobné v skupine s lenalidomidom oproti placebu (80 % vs 84 %, p = 0,29). Na hodnotenie vplyvu udržiavacej liečby na OS je však potrebné dlhšie pozorovanie pacientov. Udržiavacia liečba lenalidomidom bola dobre tolerovaná, 27 % pacientov na lenalidomide a 15 % pacientov užívajúcich placebo muselo prerušiť liečbu kvôli toxicite. Vyššia toxicita u pacientov na udržiavacej liečbe lenalidomidom sa zaznamenala až po 2 rokoch liečby. Neurotoxicita 3. a 4. stupňa bola podobná v oboch ramenách, tromboembolické komplikácie boli zaznamenané častejšie v skupine pacientov s lenalidomidom (6 % vs 2 %, p = 0,01) a hematologická toxicita 3. a 4. stupňa bola tiež vyššia u pacientov s lenalidomidom (58 % vs 23 %, p < 0,001). Neočakávaným zistením bol mierny vzostup sekundárnych malignít u pacientov v ramene s lenalidomidom oproti ramenu s placebom (26 vs 12 prípadov). Po štyroch rokoch sledovania v oboch skupinách prežíva viac ako 70 % pacientov [20].
Primárnym cieľom ďalšej veľkej randomizovanej štúdie CALGB 100104 bolo zistiť, či lenalidomid v udržiavacej liečbe predlžuje dobu do progresie (time to progression – TTP) po ASCT. Do štúdie bolo randomizovaných 460 pacientov mladších ako 70 rokov s časovým odstupom 100 – 110 dní po autológnej transplantácii. Pri mediáne sledovania 34 mesiacov v skupine s lenalidomidom progredovalo alebo zomrelo 37 % pacientov v porovnaní s 58 % pacientov v skupine s placebom. Pacienti v ramene s lenalidomidom mali až 66% zníženie rizika progresie ochorenia alebo úmrtia v porovnaní s placebom. Medián doby do progresie (TTP) bol signifikantne dlhší v ramene s lenalidomidom oproti placebu (46 vs 27 mesiacov, p < 0,001). Celkový počet úmrtí bol významne nižší u pacientov na udržiavacej liečbe lenalidomidom oproti pacientom užívajúcim placebo (35 vs 53, p = 0,03), teda 85 % pacientov v skupine s lenalidomidom a 77 % pacientov v skupine s placebom žilo v čase analýzy. Súčasne bolo dosiahnuté štatisticky významné celkové prežívanie v skupine pacientov s lenalidomidom (88 % vs 80 %, p = 0,03). Celkové prežívanie, ako aj doba do progresie sa signifikantne neodlišovali v ramene s lenalidomidom a v ramene s placebom, keď sa pacienti stratifikovali na základe hodnoty B2 - mikroglobulínu a použitia thalidomidu v rámci indukčnej liečby. Avšak berúc do úvahy použitie lenalidomidu v indukčnej liečbe, sa pozorovali o niečo dlhšia doba do progresie a zlepšené celkové prežívanie v ramene s lenalidomidom oproti placebu. Pacienti na udržiavacej liečbe lenalidomidom mali signifikantne vyššiu hematologickú toxicitu Gr 3 – 4: neutropénia (45 % vs 15 %, p < 0,001), anémia (5 % vs 1 %, p = 0,006), trombocytopénia (14 % vs 4 %, p = 0,001). Z nehematologickej toxicity Gr 3 bol signifikantný vzostup v ramene s lenalidomidom oproti placebu, avšak nebol signifikantný rozdiel v toxicite Gr 4 medzi oboma ramenami. Podobne ako v predchádzajúcej štúdii bol zaznamenaný vzostup sekundárnych malignít oproti placebu (18 v ramene s lenalidomidom a 6 v ramene s placebom) [21].
U starších pacientov, nevhodných pre ASCT, prebehla III. fáza randomizovanej klinickej štúdie (MM ‑ 015) s melfalanom, prednizonom a lenalidomidom (MPR). Do štúdie bolo zaradených 459 pacientov randomizovaných do troch skupín, ktorí po indukčnej chemoterapii MPR dostávali udržiavaciu liečbu lenalidomidom 10 mg (MPR ‑ R) alebo po režime MPR a MP dostávali len placebo. Analýza s mediánom sledovania 30 mesiacov sa zamerala na pacientov vo veku 65 až 75 rokov, nakoľko u týchto pacientov bol pozorovaný najväčší prínos. Režim MPR ‑ R vyústil do signifikantne vyššieho počtu liečebných odpovedí oproti režimu MP (77 % vs 47 %, p < 0,001) a zároveň aj lepšej kvality odpovedí (32,9 % vs 12,3 % odpovedí bolo aspoň VGPR, p < 0,001). Liečebná odpoveď bola dosiahnutá rýchlejšie u pacientov s režimom MPR ‑ R oproti režimu MP (dva mesiace vs tri mesiace, p < 0,001). Iba u 6 % pacientov s režimom MPR ‑ R v porovnaní s 19 % pacientov s režimom MPR a 31 % s MP bol zaznamenaný relaps ochorenia. S mediánom sledovania 30 mesiacov, režim MPR ‑ R redukoval riziko progresie ochorenia o 68 % a signifikantne predĺžil medián PFS oproti režimu MP (31 vs 13 mesiacov, HR 0,4, p < 0,001) a súčasne aj oproti MPR (31 vs 14 mesiacov, HR 0,49, p < 0,001). Na druhej strane, očakávané 3 - ročné celkové prežívanie bolo podobné vo všetkých troch skupinách (70 % v režime MPR ‑ R, 62 % – MPR a 66 % – MP). Udržiavacia liečba lenalidomidom bola celkovo dobre tolerovaná, bez známok kumulatívnej toxicity na rozdiel od thalidomidu. Liečbu muselo prerušiť 13 % pacientov vo veku 65 – 75 rokov a 22 % pacientov vo veku nad 75 rokov. Medzi najčastejšie nežiaduce účinky patrila hematologická toxicita. Neutropénia 4. stupňa bola pozorovaná u 35 % pacientov s režimom MPR ‑ R, 32 % pacientov s MPR a 8 % pacientov s režimom MP. Incidencia febrilnej neutropénie však neprekročila hranicu 5 % ani v jednej skupine. Hlboká žilová trombóza sa objavila u 3 % pacientov liečených lenalidomidom a u 1 % pacientov liečených režimom MP. Súčasne bol zistený zvýšený výskyt sekundárnych malignít v skupine pacientov s lenalidomidom. Trojročné riziko sekundárnych malignít bolo 7% u pacientov s režimom MPR ‑ R, 7% s MPR a 3% s MP. Hoci je výskyt sekundárnych malignít pri použití lenalidomidu o niečo vyšší, toto riziko jednoznačne prevažuje riziko progresie ochorenia alebo úmrtia na MM [22].
Falco et al (2012) nedávno v časopise Blood publikovali II. fázu multicentrickej štúdie sledujúcej účinnosť a bezpečnosť lenalidomidu u starších pacientov, nevhodných pre ASCT. Do štúdie bolo zaradených 46 pacientov s mediánom veku 75 rokov. Lenalidomid s prednizonom bol podávaný v rámci indukčnej liečby s následnou konsolidáciou melfalanom, lenalidomidom a prednizonom a udržiavacou liečbou lenalidomidom a prednizonom. Až 80 % pacientov dosiahlo aspoň PR s 29% VGPR. Medián doby do progresie bol 19,4 mesiacov. Toxicita režimu bola akceptovateľná [23].
Účinnosť bortezomibu v indukčnej terapii pred ASCT a lenalidomidu v konsolidačnej a udržiavacej liečbe bola hodnotená vo fáze II multicentrickej, neporovnávajúcej a otvorenej štúdie [24]. Celkovo bolo zaradených 102 pacientov liečených bortezomibom, doxorubicínom a dexametazonom (PAD schéma) v rámci indukcie pred ASCT s následnou konsolidačnou liečbou lenalidomidom 25 mg a prednizonom (4 cykly) a pokračovaním v udržiavacej liečbe lenalidomidom 10 mg až do progresie ochorenia. Doba do dosiahnutia PR bola pomerne krátka (medián 21 dní). Počet liečebných odpovedí lepších ako VGPR bol vyšší po konsolidačnej a udržiavacej liečbe lenalidomidom oproti odpovediam po skončení režimu PAD a ASCT (86 % vs 58 % vs 82 %). Súčasne sa zvýšil aj počet ,,stringent“ KR (66 % vs 13 % vs 38 %). Z uvedenej liečby profitovali aj pacienti so zlými prognostickými ukazovateľmi. V skupine pacientov mladších ako 70 rokov boli dosiahnuté o niečo lepšie liečebné odpovede. S mediánom sledovania 21 mesiacov bolo očakávané 2 - ročné celkové prežívanie 86 %. Počas sledovania progredovalo alebo relabovalo 12 % a zomrelo 11 % pacientov. Dvojročné PFS bolo 87 % u pacientov s dosiahnutou KR, 76 % u pacientov s VGPR a 43 % u pacientov s PR. Liečba lenalidomidom bola pomerne dobre tolerovaná, bez kumulatívnej toxicity. Z hematologickej toxicity 3. a 4.stupňa prevládala neutropénia (16 %), trombocytopénia (6 %), a z nehematologickej toxicity to boli pneumónia (5 %) a kožné vyrážky (4 %).
Autori Roussel et al (2010) sledovali účinnosť nových liekov (bortezomibu a lenalidomidu) v indukčnej a konsolidačnej liečbe s následnou udržiavacou liečbou lenalidomidom u novodiagnostikovaných pacientov s MM vhodných pre ASCT. Do súboru bolo zaradených 31 pacientov s mediánom veku 58 rokov (rozhranie: 33 – 65). Počet liečebných odpovedí lepších ako VGPR bol vyšší po konsolidačnej liečbe oproti odpovediam po ASCT a po skončení indukčného režimu (89 % vs 68 % vs 54 %). Medzi časté nežiaduce účinky patrila senzitívna neuropatia 1. a 2. stupňa (45 %), neuropatická bolesť (13 %) a gastrointestinálne ťažkosti (42 %). Z hematologickej toxicity 3. a 4. stupňa bola prítomná neutropénia (26 %) a trombocytopénia (6 %). Nebola zaznamenaná žiadna tromboembolická komplikácia [25].
Použitie a efektívnosť lenalidomidu v udržiavacej liečbe po nemyeloablatívnej alogénnej transplantácii krvotvorných buniek (TKB) bola hodnotená u 30 pacientov s mediánom veku 53 rokov v čase zahájenia udržiavacej liečby. Liečba lenalidomidom 10 mg p.o. podávaná v deň 1 – 21 bola zahájená 1 – 6 mesiacov od alogénnej TKB, s plánovaným podaním 24 cyklov. Už po dvoch cykloch muselo liečbu prerušiť 14 (47 %) pacientov, a to z dôvodu rozvoja akútnej reakcie štepu proti hostiteľovi (GvHD), 5 (17 %) pacientov kvôli iným nežiaducim účinkom a 5 (17%) pacientov kvôli progresii základného ochorenia. Počet odpovedí sa zlepšil u 37 % pacientov a očakávané 1 - ročné obdobie bez progresie ochorenia (PFS) od začiatku liečby lenalidomidom bolo 69 %. Vyšetrením imunologického profilu sa zistilo, že lenalidomid zvyšuje expresiu HLA‑DR na CD4+ a CD8+ T ‑ bunkách už v prvých 15 dňoch od zahájenia liečby, čo indikuje aktiváciu T‑lymfocytov. Na základe týchto zistení autori Kneppers et al (2011) neodporúčajú udržiavaciu liečbu lenalidomidom po nemyeloablatívnej alogénnej TKB, hlavne kvôli indukcii rozvoja akútnej GVHD [26].
Výskyt sekundárnych malignít po liečbe lenalidomidom
Viaceré práce popísali zvýšený výskyt sekundárnych malignít po liečbe lenalidomidom. Najnovšia analýza 11 klinických štúdií s lenalidomidom hodnotila 3 846 pacientov. Iba 263 pacientov (7 %) bolo liečených lenalidomidom v monoterapii, zvyšní pacienti dostávali lenalidomid v kombinácii s dexametazonom. Medián dĺžky liečby lenalidomidom bol päť mesiacov. Celková relatívna incidencia sekundárnych malignít, vrátane nádorov kože, bola 3,62. V analýze zahŕňajúcej 313 pacientov, ktorí dostávali lenalidomid dlhšie ako 24 mesiacov, autori zistili celkovú relatívnu incidenciu 2,35, čo bolo porovnateľné s pacientmi dostávajúcimi lenalidomid v kratšom časovom intervale [27]. Podobne aj veľké randomizované štúdie s lenalidomidom v udržiavacej liečbe popísali zvýšený výskyt sekundárnych malignít, či už hematologických alebo solídnych tumorov [20 – 22].
V súčasnosti sú však potrebné ďalšie štúdie na zistenie skutočného rizika týchto komplikácií, identifikovanie rizikových faktorov a poznanie možnej prevencie týchto potenciálne život ohrozujúcich komplikácií. Európska lieková agentúra (EMA) došla však k záveru, že pomer prínosu a rizika liečby lenalidomidom u relabovaného/ refraktérneho MM v schválenej indikácii ostáva pozitívny v prospech prínosu. Podobne aj v štúdiách s lenalidomidom v udržiavacej liečbe prínos z predĺženia PFS presahuje riziko vzniku sekundárnych malignít. Z tohto dôvodu však bude ale pravdepodobne nutné obmedzenie dĺžky podávania.
Záver a odporúčania pre prax
Účinnosť lenalidomidu bola potvrdená v troch veľkých randomizovaných štúdiách. Dve štúdie u pacientov po ASCT a jedna štúdia u pacientov nevhodných pre transplantáciu potvrdili zlepšené PFS u pacientov s udržiavacou liečbou lenalidomidom. Jedna štúdia dokonca zistila zlepšené OS oproti pacientom užívajúcim placebo. Lenalidomid v udržiavacej liečbe bol veľmi dobre tolerovaný a s akceptovateľnou toxicitou. Úvodná dávka by mala byť 10 mg, s úpravou dávky v závislosti od tolerancie na 5 – 15 mg.
Lenalidomid na základe prebehnutých štúdií ostáva najúčinnejším liekom v udržiavacej liečbe. Použitie lenalidomidu zatiaľ limituje fakt, že doposiaľ nie je v primoliečbe v krajinách EU registrovaný ani v indukcii, ani v udržiavacej liečbe.
Jednou z nevyriešených otázok zostáva dĺžka podávania udržiavacej liečby. V klinických štúdiách bola doporučená až do relapsu alebo progresie ochorenia. Z dôvodu zvýšeného výskytu sekundárnych malignít pravdepodobne dôjde k obmedzeniu dĺžky podávania. V prevencii sekundárnych malignít sa odporúčajú pravidelné kontroly hemogramu a štandardný skríning malignít. Otázne ostáva ďalej zistiť, či pacienti na udržiavacej liečbe lenalidomidom budú odpovedať na eskalované dávky lenalidomidu a pridanie dexametazonu v prípade relapsu ochorenia. Medzi ďalšie otázky, ktoré je potrebné zodpovedať, je spektrum pacientov, ktorí by mohli profitovať z udržiavacej liečby lenalidomidom, nakoľko ešte neboli publikované práce porovnávajúce účinnosť lenalidomidu v jednotlivých rizikových skupinách. Autori Giralt et al (2011) odporúčajú zahájiť udržiavaciu liečbu u pacientov, ktorí nedosiahli KR po ASCT a vysoko rizikových pacientov aj napriek KR. U pacientov s nízkym rizikom a dosiahnutou KR po ASCT treba zvážiť riziko/ benefit z tejto liečby [28].
Na presné určenie pacientov, ktorí by mohli profitovať z tejto udržiavacej liečby, ako aj na zodpovedanie daných otázok sú potrebné ešte ďalšie analýzy a dlhšie sledovanie pacientov.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
MUDr. Ľubica Roziaková, Ph.D.
Oddelenie klinickej patofyziológie
Klinika hematológie a transfuziológie
LF UK a UN Bratislava
Nemocnica sv. Cyrila a Metoda
Antolská 11
851 07 Bratislava-Petržalka
Slovenská republika
e-mail: lubica.roziakova@gmail.com
Obdrženo: 13. 1. 2013
Přijato: 7. 3. 2013
Zdroje
1. Hájek R, Krejčí M, Pour L et al. Multiple Myeloma. Klin Onkol 2011; 24 (Suppl): S10 – S13.
2. Hájek R, Zahradová L. Možnosti a limitace farmakoterapie mnohopočetného myelomu. Farmakoterapie 2012; 3 : 25 – 28.
3. Ludwig H, Durie BG, McCarthy P et al. IMWG consensus on maintenance therapy in multiple myeloma. Blood 2012; 119(13): 3003 – 3015.
4. Badros AZ. The role of maintenance therapy in the treatment of multiple myeloma. J Natl Compr Center Netw 2010; 8 (Suppl 1): S21 – S27.
5. Alexanian R, Balcerzak S, Haut A et al. Remission maintenance therapy for multiple myeloma. Arch Intern Med 1975; 135(1): 147 – 152.
6. Belch A, Shelley W, Bergsagel D et al. A randomized trial of maintenance versus no maintenance melphalan and prednisone in responding multiple myeloma patients. Br J Cancer 1988; 57(1): 94 – 99.
7. Fritz E, Ludwig H. Interferon‑alpha treatment in multiple myeloma: meta‑analysis of 30 randomized trials among 3948 patients. Ann Oncol 2000; 11(11): 1427 – 1436.
8. Sonneveld P, Schmidt ‑ Wolf IG, van der Holt B et al. Bortezomib induction and maintenance treament in patients with newly diagnosed multiple myeloma: results of the randomized phase III HOVON ‑ 65/ CMMG ‑ HD4 trial. J Clin Oncol 2012; 30(24): 2946 – 2955.
9. Attal M, Harousseau JL, Leyvraz S et al. Maintenance therapy with thalidomide improves survival in patients with multiple myeloma. Blood 2006; 108(10): 3289 – 3294.
10. Spencer A, Prince HM, Roberts AW et al. Consolidation therapy with low‑dose thalidomid and prednisolone prolongs the survival of multiple myeloma patients undergoing a single autologous stem ‑ cell transplantation procedure. J Clin Oncol 2009; 27(11): 1788 – 1793.
11. Barlogie B, Pineda ‑ Roman M, van Rhee F et al. Thalidomide arm of total therapy 2 improves complete remission duration and survival in myeloma patients with metaphase cytogenetic abnormalities. Blood 2008; 112(8): 3115 – 3121.
12. Lokhorst HM, van der Holt B, Zweegman S et al. A randomized phase 3 study on the effect of thalidomide combined with adriamycin, dexamethasone, and high‑dose melphalan, followed by thalidomide maintenance in patients with multiple myeloma. Blood 2010; 115(6): 1113 – 1120.
13. Morgan GJ, Gregory WM, Davies FE et al. The role of maintenance thalidomide therapy in multiple myeloma: MRC Myeloma IX results and meta‑analysis. Blood 2012; 119(1): 7 – 15.
14. Krishnan A, Pasquinin MC, Logan B et al. Autologous hematopietic stem ‑ cell transplantation followed by allogeneic or autologous hematopoietic stem ‑ cell transplantation in patients with multiple myeloma (BMT CTN 0102): a phase 3 biological assignment trial. Lancet Oncol 2011; 12(13): 1195 – 1203.
15. Cives M, Simone V, Brunetti O et al. Novel lenalidomide‑based combinations for treatment of multiple myeloma. Crit Rev Oncol Hematol 2013; 85(1): 9 – 20.
16. Holánek M, Hájek R. The use of lenalidomide in the treatment of multiple myeloma. Klin Onkol 2010; 23(2): 67 – 72.
17. Gandhi AK, Kang J, Capone L et al. Dexamethasone synergizes with lenalidomide to inhibit multiple myeloma tumor growth, but reduces lenalidomide‑induced immunomodulation of T and NK cell function. Curr Cancer Drug Targets 2010; 10(2): 155 – 167.
18. Cives M, Milano A, Dammacco F et al. Lenalidomide in multiple myeloma: current experimental and clinical data. Eur J Haematol 2012; 88(4): 279 – 291.
19. Lupo B, Palumbo A. Lenalidomide in the treatment of young patients with multiple myeloma: from induction to consolidation/ maintenance therapy. Adv Hematol. In press 2012.
20. Attal M, Lauwers ‑ Cances V, Marit G et al. Lenalidomide maintenance after stem ‑ cell transplantation for multiple myeloma. N Engl J Med 2012; 366(19): 1782 – 1791.
21. McCarthy PL, Owzar K, Hofmeister CC et al. Lenalidomide after stem ‑ cell transplantation for multiple myeloma. N Engl J Med 2012; 366(19): 1770 – 1781.
22. Palumbo A, Hajek R, Delforge M et al. Continuous lenalidomide treatment for newly diagnosed multiple myeloma. N Engl J Med 2012; 366(19): 1759 – 1769.
23. Falco P, Cavallo F, Larocca A et al. Lenalidomide ‑ prednisone induction followed by lenalidomide ‑ melphalan ‑ prednisone consolidation and lenalidomide ‑ prednisone maintenance in newly diagnosed elderly unfit myeloma patients. Leukemia. In press 2012.
24. Palumbo A, Gay F, Falco P et al. Bortezomib as induction before autologous transplantation, followed by lenelidomide as consolidation ‑ maintenance in untreated multiple myeloma patients. J Clin Oncol 2010; 28(5): 800 – 807.
25. Roussel M, Avet ‑ Loiseau H, Moreau P et al. Frontline therapy with bortezomib, lenalidomide, and dexamethasone (VRD) induction followed by autologous stem cell transplantation, VRD consolidation and lenalidomide maintenance in newly diagnosed multiple myeloma patients: primary results of the IFM 2008 Phase II Study. Blood 2010; 116(21): 274 – 275.
26. Kneppers E, van der Holt B, Kersten MJ et al. Lenalidomide maintenance after nonmyeloablative allogeneic stem ‑ cell transplantation in multiple myeloma is not feasible: results of the HOVON 76 Trial. Blood 2011; 118(9): 2413 – 2419.
27. Dimopoulos MA, Richardson PG, Brandenburg N et al. A review of second primary malignancy in patients with relapsed or refractory multiple myeloma treated with lenalidomide. Blood 2012; 119(12): 2764 – 2767.
28. Giralt S, Stadtmauer E, McCarthy P. What did we learn in 2010 from the phase III trials? Is maintenance therapy the new standard for myeloma? Biol Blood Marrow Transplant 2011; 17 (Suppl 1): S30 – S32.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2013 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Editorial
- Thalidomid v léčbě mnohočetného myelomu se zaměřením na kombinaci s bortezomibem
- Karcinom prostaty, aktuální dilema uroonkologie. Jak prospět ohroženým pacientům a neuškodit těm ostatním
- Erratum
- Inhibice signalizace B buněčným receptorem: první cílená léčba u chronické lymfocytární leukemie a dalších B buněčných lymfomů
- Udržiavacia liečba lenalidomidom u pacientov s mnohopočetným myelómom
- Léčba průlomové bolesti u onkologických pacientů
- Komunikácia ako súčasť suportívnej terapie v onkológii
- Výsledky kurativní chemoradioterapie u pacientů s karcinomy anu
- Pacientka s metastatickým karcinoidem z pohárkových buněk
- Karcinom prsu u monozygotních dvojčat
- Informace z České onkologické společnosti
- Zajímavé případy z nutriční péče v onkologii
- Léčba závislosti na tabáku
-
Onkologie v obrazech
Rozměrná regionální metastáza melanomu - Prof. MU Dr. Ľudovít Milan Jurga, DrSc. – významné jubileum
- Jubileum pana profesora MU Dr. Dalibora Ondruše, DrSc.
- Jaroslav Bakeš (1871–1930): lékař, na něhož se zapomnělo / Gustav Novotný
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Karcinom prostaty, aktuální dilema uroonkologie. Jak prospět ohroženým pacientům a neuškodit těm ostatním
- Výsledky kurativní chemoradioterapie u pacientů s karcinomy anu
- Komunikácia ako súčasť suportívnej terapie v onkológii
- Udržiavacia liečba lenalidomidom u pacientov s mnohopočetným myelómom
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



