-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Karcinom prostaty, aktuální dilema uroonkologie. Jak prospět ohroženým pacientům a neuškodit těm ostatním
Prostate Carcinoma. Current Dilemma of Urooncology. How to Help the Needed and not to Harm the Others
There is a remarkably rising incidence of histologically proven prostate cancer since the introduction of prostatic specific antigen (PSA) test into clinical practice. TNM classification of these tumors in about 50% of cases is in categories T1,2 N0M0, Gleason score ≤ 7 and PSA level under 10 ug/ l (Graph 1). Such tumors are considered low risk and therefore conservative approach seems to be acceptable therapeutic variant. In spite of non‑surgical approach, patients with the so ‑ called early stage diagnosed disease have been almost only indicated for radical prostatectomy with a therapeutic approach. More than 2,100 men underwent radical prostatectomy (RP) in the Czech Republic in 2009 but mortality curve remained unchanged for years (Graph 2). The largest study (ERSPC) looking for influence of PSA screening on mortality, involving 182,000 men, of which 162,000 were valuable for analysis, really lowered mortality. After 11 years, in the screened arm (PCA arm) mortality decreased by more than 20% in the screened arm (PCA arm) when compared with unscreened arm. But to save one life, 1,410 patients had to be screened and 48 of them underwent RP. But ERSPC results (and those similar from eg. PLCO study) gave a rise of speculation if all early detected tumors are indeed candidates for surgery (overtreatment), even if such intensive PSA screening is reasonable (overdiagnosis). In last decades, results of several studies support an opinion that low risk tumors diagnosed in men over 68 years, with several co ‑ morbidities and in less favorite health status would not be proper candidates for conservative approach (active surveillance or watchful waiting). As a consequence of these considerations, a question arises whether selected PSA test should not be more reasonable. In such a case, a patient should thoroughly discuss what profit the PSA test brings to him with his doctor.
Key words:
urogenital neoplasms – prostatic neoplasms – prostate cancer – prostate-specific antigen – PSA screening – conservative approaches
Autoři: M. Hanuš 1; M. Matoušková 1; L. Dušek 2
Působiště autorů: Urocentrum Praha 1; Institut biostatistiky a analýz MU, Brno 2
Vyšlo v časopise: Klin Onkol 2013; 26(3): 170-178
Kategorie: Přehled
Souhrn
Od širšího zavedení detekce sérové hladiny prostatického speciálního antigenu (PSA) do klinické praxe koncem 90. let minulého století dochází k významnému nárůstu incidence biopticky diagnostikovaných karcinomů prostaty. Více než polovina těchto nálezů je klasifikována jako T1 a T2 N0M0 s Gleason skóre ≤ 7, s hladinou PSA pod 10 ug/ l (graf 1). Tyto nálezy jsou považovány za prognosticky příznivé. V naprosté většině jsou však tito muži dosud indikováni k retropubické radikální prostatektomii jako k výkonu terapeutickému. V roce 2009 bylo v ČR provedeno přes 2 100 radikálních prostatektomií. Přes tento tzv. časný záchyt karcinomu a následnou operativu mortalita na CAP ovlivněna nebyla (graf 2). Snaha ověřit přínos plošného vyhledávání vedla k realizaci rozsáhlé Evropské randomizované screeningové studie (ERSPC), zahrnující 182 000 mužů, z nichž 162 000 mělo validní data pro analýzu. Průběžné závěry studie po 11 letech prokázaly snížení mortality o více než 20 %, avšak k zachránění života jednoho pacienta muselo být provedeno 48 radikálních prostatektomií a 1 410 pacientů prošlo screeningem. Tyto závěry a některé z dalších studií (PLCO) vedly k úvahám, zda je nezbytné všechny časně diagnostikované nádory operovat (overtreatment), či dokonce zda je tak usilovně vyhledávat (overdiagnosis). Studie z posledních deseti let přinášejí doklady o tom, že nálezy karcinomů ohraničených na prostatu, s Gleason skóre pod 7 a PSA pod 10 ug/ l lze hodnotit jako nízkorizikové. U mužů nad 68 let pak vážit jako alternativu konzervativní postup pečlivým sledováním (watchful waiting) nebo aktivnější formou sledování (active surveillance). V posledních letech je nověji diskutován přínos plošného zjišťování hladiny PSA, jehož zvýšená hladina iniciuje spirálu vyšetření, počínaje opakovanými biopsiemi a konče radikální prostatektomií. Objevují se názory, že test by bylo vhodné provádět až po důkladném zvážení indikace lékařem i pacientem.
Klíčová slova:
urogenitální nádory – nádory prostaty – karcinom prostaty – prostatický specifický antigen – screening PSA – konzervativní léčbaTrvalý alarmující vzestup incidence karcinomu prostaty
Od širšího zavedení zjišťování sérové hladiny PSA do klinické praxe koncem 90. let minulého století zaznamenáváme trvalý nárůst incidence biopticky diagnostikovaných karcinomů prostaty (prostate cancer – CAP).
Z detailnější analýzy dostupných dat Národního onkologického registru ČR (NOR) vyplynulo, že v roce 2009 bylo z nově diagnostikovaných CAP klasifikováno 54,6 % jako nízkorizikových (GS ≤ 6) a ve stadiích I a II (T1 – 2 N0M0) 61,9 %. V této skupině bylo 61,4 % pacientů mladších 70 let. Tento vzestupný trend potvrzují i predikce provedené Českou onkologickou společností pro rok 2013 [1], kde je očekáván další, až exponenciální nárůst ve srovnání s posledními roky (8 340 nových případů) (tab. 1). Relativní podíl nádorů ohraničených na prostatu v celkové incidenci se přitom za posledních 10 let až zdvojnásobil, z 36 % (2000) na 67 % (2009). S tímto vysokým podílem časně diagnostikovaných nádorů počítají i predikce do dalších let. Přitom věk mužů diagnostikovaných s časným karcinomem prostaty se v posledních letech staticky významně nemění, i když je patrná mírně klesající tendence (2009 – medián věku 68 let).
Tab. 1. Predikce incidence ZN prostaty s ohledem na pokročilost onemocnění (bodové odhady jsou doplněny 90% intervaly spolehlivosti). 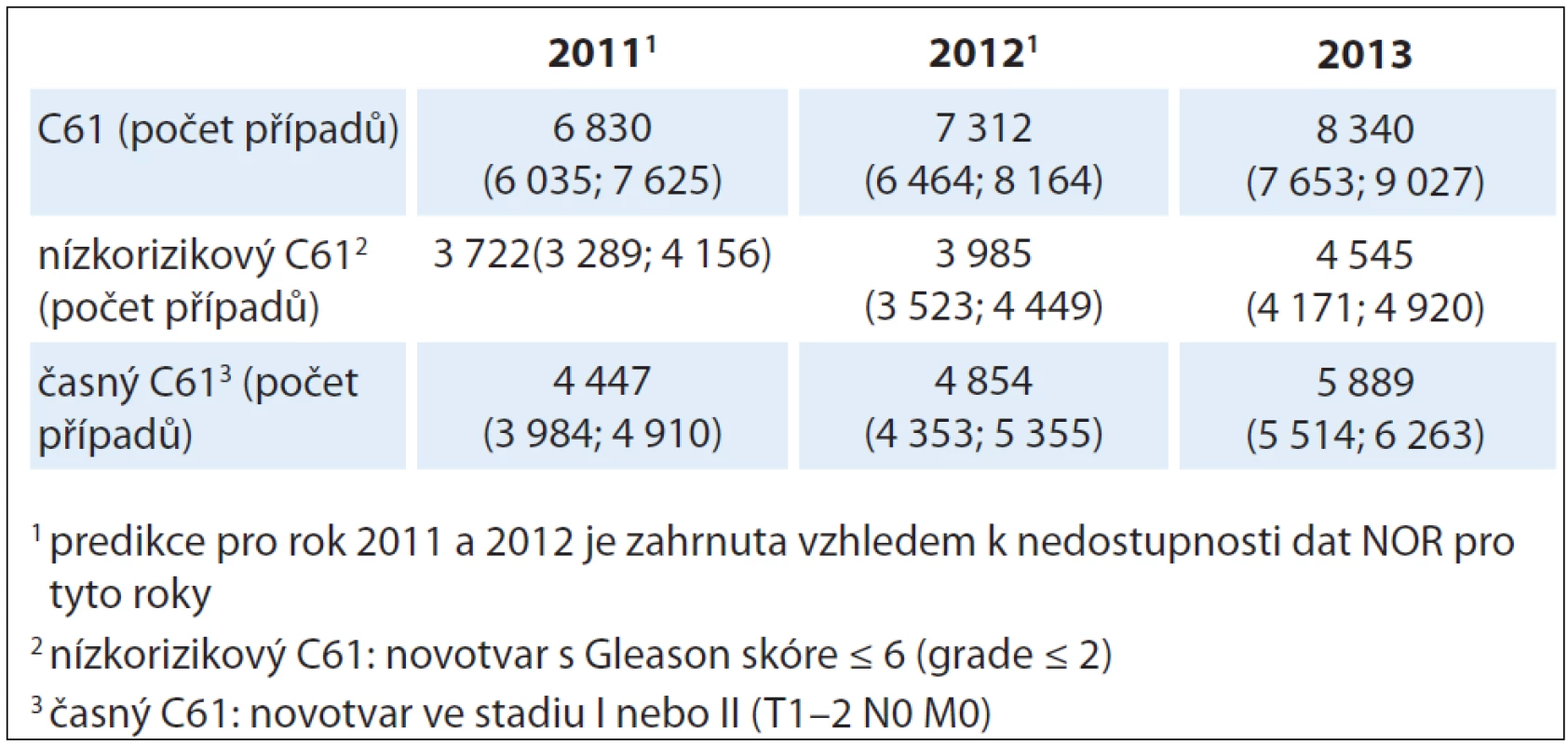
Graf 1. Změna zastoupení stadií ZN prostaty. 
Predikce počtu časných zhoubných nádorů prostaty (stadium 1 a 2, T1 – 2 N0M0) v použitém modelu zohledňuje recentní rozdílný trend v zastoupení jednotlivých stadií u nově diagnostikovaných C61. Přes strmý nárůst incidence a s tím související prevalence se křivka úmrtnosti na karcinom prostaty nezměnila (graf 2).
Graf 2. Vývoj incidence a mortality ZN prostaty v ČR. 
Statistická data předkládaná NOR a IBA (Institut biostatistiky a analýz – IBA) jsou nepochybně profesionálně zpracovaná a čísla správná. Vycházejí ale z údajů, jejichž klinická a histopatologická relevance je v posledních letech relativizována na podkladě výsledků velkých studií. Jde jednak o změnu histologického hodnocení, jednak o pozměněný pohled na maligní potenciál diagnostikovaných nálezů (viz dále). Snaha ověřit přínos plošného vyhledávání CAP vedla k realizaci rozsáhlé Evropské randomizované screeningové studie (ERSPC), zahrnující 182 000 mužů, z nichž 162 000 mělo validní data pro analýzu [2].
Průběžné závěry studie takto plošného vyhledávání po 11 letech skutečně prokázaly snížení mortality o více než 20 %, avšak k zachránění jednoho pacienta muselo být provedeno 48 radikálních prostatektomií (RP) a 1 410 mužů podstoupilo screening. Tyto závěry a některé z dalších studií byly důvodem k úvahám, zda všechny časně diagnostikované nádory je nezbytné operovat (overtreatment), či zda u mnoha případů nepostupovat pečlivým sledováním [3], zvláště když výsledky analýzy studie PLCO (Prostate Lung Colorectal and Ovaria Cancer Screening trial) se souborem přes 76 000 mužů po 13 letech neprokázaly signifikantní ovlivnění mortality [4].
Celý vyhledávací, diagnostický i léčebný proces začíná odběrem krve na PSA.
PSA – validní i zavádějící marker?
PSA je dnes v povědomí praktických lékařů i specialistů chápán jako velmi spolehlivý uroonkologický marker a jeho zjišťování je od určitého věku prakticky automaticky indikováno. Výsledkem je velký počet biopsií prostaty, mnohdy několikrát opakovaných, se záchytem histologicky verifikovaných karcinomů prostaty. Tento trend přetrvává do dnešních dnů [5]. Avšak dlouhodobé výsledky rozsáhlých randomizovaných studií vyvolávají jisté pochybnosti, zda hektické pátrání po karcinomu prostaty by nemělo být podrobeno revizi a stanovena nová diagnostická kritéria. Již pouhá absolutní hodnota PSA, jakési rozhraní indikující biopsii, je velmi nespolehlivá, vlastně stanovená empiricky. Obvyklá hodnota rozhraní kolem 4 ug/ l by měla být pouze jedním z aspektů ovlivňujících indikaci biopsie. Již před více než 20 lety, v době před érou široké aplikace PSA, Sakr et al [6] publikovali nálezy z autopsií, které prokazovaly ložiska intraepiteliální neoplazie u mladých mužů, jež jsou považována za prekurzory karcinomu, a také vlastní karcinomy. Muži ve třetí, čtvrté a páté životní dekádě měli intraepiteliální neoplazii v 9 %, 20 % a 44 % a histologicky verifikovaný karcinom v 0 %, 27 % a 34 %. Soubor tvoří 152 případů. Autoři uzavírají, že nálezy předcházejí o desítky let klinické příznaky.
Vlastní hodnota PSA (celkové PSA, tPSA) a hodnota volného PSA (free PSA – fPSA) jsou doplňovány procentuálním poměrem fPSA/ tPSA (f/ t PSA index), kdy hodnota 18 % je považována za hraniční, nižší pak za signalizující přítomnost karcinomu. Dalším pomocným vodítkem je obvykle výpočet denzity, který je poměrem celkového PSA a hmotnosti žlázy. Hodnota 0,15 a vyšší značí suspekci na karcinom. Kombinace těchto a dalších hodnot PSA vedly k matematickému hledání spolehlivějšího ukazatele. Catalona et al publikovali užitečnost indexu phi (prostate health index), který je výsledkem poměru p2PSA (izomeru PSA) k fPSA násobeném tPSA. Hodnota nad 25zvyšuje pravděpodobnost CAP. Autoři dokládají na podkladě výsledků studie s téměř 900 muži, že stanovení phi umožní oddálit interval rebiopsií prostaty [7]. Jistým vodítkem je i dynamika elevace PSA v čase (velocita) nebo doba do zdvojení hodnoty PSA (doubling time). Jde opět o orientační parametr.
Podobně se nabízí využití PCA3, též označovaného jako DD3 (gen kódující specifickou mRNA). Tento marker je ve vysoké koncentraci produkován v nádorové prostatické tkáni. Stanovení PCA3 má pomoci při správném výběru pacientů pro biopsii, event. rebiopsii prostaty, zejména v případě hodnot PSA 2,5 – 10 ug/ l. Vyšetřuje se z moče po masáži prostaty. Podle GDL EAU (Guidelines European Association of Urology) [8] může hodnota PCA3 pomoci v indikaci rebiopsie. Přínos v monitorování CAP zatím potvrzen nebyl.
Tedy pomocných ukazatelů je řada, což svědčí o absenci průkazného parametru. Nicméně ve svém komplexu nám v rozhodování pomoci mohou.
Sumární analýza validních publikovaných randomizovaných studií zahrnujících více než čtvrt milionu mužů dochází k závěrům, že screening PSA může označit skupinu skutečně ohrožených nemocných až několik dekád před klinickou manifestací, a tím prokazatelně snížit mortalitu, pokud je ovšem následná léčba – ať chirurgická, nebo radiační – kvalifikovaně provedena. Křivky mortaliy se ale významněji rozcházejí až po více než 10 letech. Screening je však spojen s nezanedbatelným počtem nadbytečných diagnóz. Téměř tři čtvrtiny z uvedeného gigantického počtu pacientů měly biopsii do Gl 3 + 3. Pokud tito muži byli starší 60 let, pak varianta pečlivého sledování (nejlépe formou active surveillance – AS) by byla medicínskou alernativou. Statisticky lze předpokládat, že většina z nich se nedožije klinické manifestace karcinomu a konzervativní přístup jim zajistí lepší kvalitu života [9].
Podobně Vickers et al [10] v analýze studií ERSPC a PLCO připomínají, že dosud přetrvávající plošné vyhledávání karcinomu prostaty testováním PSA v USA minimalizuje benefit screeningu, avšak bohužel maximalizuje škody způsobené pacientům. Zmiňují, že 80 % chirurgů v USA provádí RP v počtu do 10 ročně, což průkazně zhoršuje kurativní výsledek operace a je doprovázeno zvýšeným počtem komplikací. I když v malém, situace v České republice je podobná.
Po zkušenostech vyplývajících z nadměrného počtu diagnóz (overdiagnosis) se nabízí otázka, zda mechanicky každému muži po padesátce odběr krve na PSA vůbec ordinovat. Zde je namístě uvést recentní doporučení prof. F. Schrodera, tvůrce a realizátora studie ERSPC, zveřejněné na webu Světové urologické organizace (SIU) pod titulkem: The three documents for PSA testing: To test or not to test [11], kde je navrhováno provedení testu PSA až po zvážení vhodnosti odběru pacientem s jeho lékařem.
Víme, že specifita PSA se pohybuje mezi 70 a 90 % [12 – 14]. Elevace může být důsledkem velké benigní hyperplazie, iritace žlázy po sexu, přítomnosti zánětu nebo mechanického podráždění. Automatické náběry bez rozumné indikace jsou nejen medicínsky neopodstatněné, ale i významně zavádějící, pacienta zbytečně stresující psychicky a ovšem též neekonomické.
V této souvislosti je nutno připomenout, že v posledních letech v mnoha zemích světa a také v ČR je propagována prevence karcinomu prostaty hnutím Movember (http:/ / cz.movember.com/ en). Hnutí nepochybně založené s dobrým úmyslem pomoci v aktuální podobě informačně zaostává. Web Movember v češtině propaguje boj proti rakovině prostaty, bohužel nepřesnými statistickými údaji, a z dnešního pohledu trochu nekriticky zdůrazňuje plošné odběry. Zřejmě nejde o specifitu České republiky, protože na stránkách SIU prof. Schroder uvádí, že po dohodě s centrálou Movember v Austrálii SIU zavázala hnutí ke zveřejnění obsahu The three documents v celé šíři a v jazyce dané země. Na českých stránkách toto není ani zmíněno, stejně jako i na stránkách spolupracující nadace Muži pro zdraví, na které Movember Czech Republic odkazuje. Právě uvedené dokumenty by měly v češtině v plné šíři objektivně informovat pacienty, jaký je skutečný přínos PSA a kdy je to vhodné vědět. Také zde statistické údaje o mortalitě na karcinom prostaty jsou nadsazené a strašící čtenáře.
Před indikací testu PSA je nezbytné fundovaně informovat pacienta o tom, jaký přínos hodnota testu v jeho případě má, zvážit jeho věk, zdravotní stav, hereditární zatížení, komorbidity, psychickou odolnost, rodinné zázemí, fyzikální, laboratorní a přístrojové nálezy. Po zvážení všech těchto aspektů je možno ve spolupráci s pacientem rozhodnout o vhodnosti odběru.
Po obdržení výsledku testu je nutné zvážit zjištěnou hodnotu z hlediska navržení biopsie prostaty. Jde o intervenční diagnostický výkon. Největším problémem je indikace v případě hodnot v šedé zóně, 4 – 10 ug/ l. U určité části nemocných (cca do 10 % i více) nacházíme elevaci nebo oboustranné kolísání PSA, někdy i významně vyšší, aniž bychom potvrdili přítomnost karcinomu opakovanými biopsiemi [10]. Důležitá je korekce hodnocení s přihlédnutím k aspektům výše uvedeným a zcela zásadní je pravidlo ověřit elevaci minimálně třikrát při vyloučení všech negativních vlivů, alespoň jednou s aplikací antimikrobiálních přípravků s dobrou penetrací do prostatické tkáně, např. fluorochinolonů, den před odběrem. Intervaly odběrů mohou být dvou ‑ i tříměsíční. Pokud hodnota nestoupá nebo nacházíme její oscilace až 20 % kolem prvotní hodnoty bez trvalé elevace, je vhodné s biopsií vyčkat. A to někdy i přes významně zvýšenou hladinu PSA, která ale nemá elevační dynamiku. Odběry a zpracování mají probíhat za stejných podmínek a ve stejné laboratoři. To je dlouholetá zkušenost autorů článku.
DRE, TRUS
Pro rozhodnutí k biopsii jsou důležitá i další vyšetření. Posouzení prostaty per rektum, běžně prováděné, nemá zdaleka tak velkou vypovídací hodnotu, jak je v obecném povědomí. I zkušený urolog v mnoha případech hodnotí nález jako normální (tvar, elasticita, konzistence, ohraničení, citlivost a další), a přesto je karcinom přítomen. Je‑li významná elevace PSA, pak suspektní nález zjištěný zkušeným urologem významně zvyšuje pravděpodobnost karcinomu. Naopak při nízkém PSA je pozitivní prediktivní hodnota mezi 4 a 11 % [15]. Nedostatečnou vypovídací hodnotu, především z digitálního vyšetření (DRE), připomínají i Schröder et al [16].
Transrektální sonografie (TRUS) dokáže poměrně věrně vykreslit zonální anatomii prostaty, avšak není výrazněji přínosná pro průkaz karcinomu. Mnoho karcinomů prostaty je izodenzních nebo hyperdenzních. Hypodenzních je jen něco přes 50 %, a to ještě nevýrazně, bez jasné demarkace [17]. I novější zobrazovací techniky snažící se lépe zviditelnit karcinom, a tím lépe nasměrovat bioptickou jehlu, nejsou zatím dostatečně průkazné [18]. Proto jsou v GDL EAU jmenovány jako testované, avšak dle EBM (Evidence Based Medicine) neverifikované (NMR, transrektální CT, histoscanning, elastografie a jiné).
Biopsie prostaty
Histologický průkaz karcinomu je bezpodmínečně nutný pro zahájení léčby. Odběr tkáně k získání validních preparátů je prováděn v naprosté většině transrektálně, automatickým odběrovým zařízením (biopty gun). Jehla (obvykle 16 – 18 G) je vedena ultrazvukovou transrektální sondou. Dnes je považováno 6 vzorků jako minimum, lépe 8 – 12. Při negativním nálezu je počet vyšší, i přes 20 (saturační biopsie). V tomto případě je vhodné provést odběr na lůžku, jinak jde o výkon ambulantní. Jsou však prováděny i transperineální (aseptické) biopsie se 40 až 100 vzorky, s mnohem vyšší diagnostickou výtěžností [19,20].
Vzhledem k transrektálnímu odběru přes vysoce infekční prostředí rekta pacienty zajišťujeme obvykle fluorochinolony. Přesto je odběr provázen až 10 % febrilit septického charakteru (tab. 2). Téměř pravidelná jsou krvácení z konečníku, hemospermie a hematurie. Může se vyvinout akutní prostatitis nebo perzistovat močová infekce [21].
Tab. 2. Komplikace biopsií bez ohledu na počet odebraných vzorků podle GDL EAU [29]. ![Komplikace biopsií bez ohledu na počet odebraných vzorků podle GDL EAU [29].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/da4fdd7ebb7bcfb9aaa5c447a9dd61b6.png)
Indikace je třeba provádět uvážlivě a individuálně. Opakování biopsie při negativním nálezu není vhodné dříve než za půl roku, spíše později, pokud nás k tomu nenutí naléhavé okolnosti. Vždy je povinností lékaře situaci s pacientem probrat, protože v této fázi se již vyskytují anxiózní karcinofobie s velmi negativním dopadem na kvalitu života pacienta. V případě pozitivní biopsie je rozhodování o dalším postupu složité a v poslední době s rozdílnými přístupy. Empiricky stanovená hladina 4 ug/ l určuje pomyslné rozmezí, od kterého se lékař obvykle rozhoduje pro biopsii prostaty. Publikované práce však dokládají, že použitím tohoto rozmezí stále nezachytíme významný počet nositelů karcinomu prostaty. Pravděpodobnost výskytu karcinomu prostaty u nízkých hladin PSA sumarizuje tab. 3.
Tab. 3. Riziko karcinomu prostaty v závislosti na hladině PSA podle GDL EAU [29]. ![Riziko karcinomu prostaty v závislosti na hladině PSA podle GDL EAU [29].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/f9b83b8617262c7c5f975b1fb8b67cde.png)
Punglia et al [14] uvádějí, že ve své PSA screeningové studii zahrnující 6 691 mužů podstoupilo biopsii 702 mužů (věkem < 60 let) s PSA již od 2,6 ug/ l a z nich 182 mělo prokázán karcinom prostaty. Zdůrazňují, že při tomto rozhraní stoupl detection rate (DR) z 18 na 36 %, tedy pravděpodobnost záchytu se zdvojnásobila. Tudíž doporučují u mužů pod 60 let věku indikační bioptické rozhraní 2,5 ug/ l. Při posuzování nálezů je však důležitý individuální přístup.
Vývoj klinické a histologické klasifikace biopsií prostaty
V průběhu posledních tří dekád 20. století postupně narůstala zjevná potřeba uvést do souladu klinický průběh onemocnění a histologický popis stanovující diagnózu karcinomu prostaty. Recentní práce upozorňují na velmi mírný až stacionární klinický průběh onemocnění u nálezů Gleason Gr 1 a Gr 2. I z řad urologů bylo voláno po revizi popisů karcinomu, který někteří klinikové hodnotili spíše jako buněčné atypie [22,23].
V praxi ovšem tyto nálezy byly a jsou v ČR dosud v naprosté většině indikací k radikální prostatektomii. Např. Čapoun et al [24] uvádějí v souboru 471 nemocných v definitivních nálezech Gl skóre vyšší než 6 pouze u 20 % operovaných. Doležel et al [25] ve skupině 153 robotických RP mají téměř 80 % pacientů s Gl skóre 6 a dalších 20 % s Gl skóre 7. Autoři z Hradce Králové [26] uvádějí ve skupině 252 RP medián Gl skóre 7.
Problémem hodnocení stupně anaplazie a rozsahu postižení prostaty se zabývala konference amerických urogenitálních patologů ISUP v San Antoniu v roce 2005. Výsledkem byla podstatná revize původní stupnice tkáňové dediferenciace grade 1 – 5, navržená Donaldem Gleasonem v roce 1966. Nálezy Gleason grade 1 a 2 (tedy Gl skóre ≤ 4) byly označeny jako atypická hyperplazie prostaty (Gr 1) nebo high grade pin (Gr 2), tudíž prognosticky příznivé. Stěžejním problémem na konferenci byla revize nálezů Gr 3 a Gr 4, tedy v součtu Gl skóre 7, neboť tento nález je téměř zásadním vodítkem pro rozhodování klinika o volbě léčebného postupu. Zde bylo dosaženo mezi odborníky pouze převažujícího konsenzu [27]. Histolog při stanovování Gleason skóre sečítá dva nejčastěji se vyskytující stupně (patern, stupeň buněčné anaplazie, Gr) ze škály 1 – 5 v pořadí podle rozsahu výskytu. Někdy může být ještě udáván terciální nález, jsou‑li v nízkém procentu (< 5 %) nalezena vysoce anaplastická místa. Dále je (již ne vždy) histologem samostatně udáván stupeň tkáňové anaplazie, grade, podle Mostofiho, ve škále Gr I – III (event. zcela anaplastický Gr IV). Mostofi Gr II odpovídá Gl skóre 5 – 7 [22,28]. Publikované práce dokládají, že Gleason grade 3 má biologickou charakteristiku odlišnou od nálezů Gr 4, a Gleason skóre 6 řadí mezi karcinomy nízkorizikové, s nízkým maligním potenciálem. Odlišně nutno posuzovat skóre 7, kde lze očekávat větší onkologickou agresivitu. Je však třeba u skóre 7 pečlivě vážit podíl Gr 4 v celkovém objemu zaslaných vzorků, především u skóre 3 + 4 (též označovaných jako 7a), které je ještě řazeno spíše k nízkorizikovým, zatímco GS 4 + 3 (7b) a vyšší představují i významně vyšší ohrožení života nositele [22,23].
Operovat, nebo sledovat?
Uvedená data by měla vést k zamyšlení, zda více nezvažovat doporučení konzervativního postupu u mužů blížících se sedmdesátce, s nízkorizikovým karcinomem prostaty, zvláště s více komorbiditami [29]. K této zásadní otázce shromáždil Klotz [30] silné argumenty podporující implementaci konzervativního postupu u vybraných případů. Zdůrazňuje, že dosud širší uplatnění AS negativně ovlivňují: 1. obtížná identifikace vhodných pacientů, 2. potřeba výchovou zklidňovat atmosféru nekriticky medializované kancerofobie z karcinomu prostaty, 3. pečlivé sledování nálezů v čase, včetně PSA a rebiopsií a 4. navržení příslušné léčby u případů vykazujících progresi. Klotz [30] v tab. 4 rozebírá data sedmi velkých studií s AS, která dovolují následující závěry: v průběhu sledovaných období byla asi jedna třetina pacientů reklasifikována na vyšší stadium a léčena, v průběhu sledovaných 5 – 10 let byla úmrtnost na karcinom velmi nízká, ve skupině Toronto 10leté přežití s karcinomem bylo 97 % a po 8 letech sledování byla pravděpodobnost na neonkologické úmrtí 19krát vyšší než na vlastní karcinom prostaty. Konečně v celém souboru s více než 2 000 případy muži po 70 letech byli ohroženi úmrtím na karcinom v poměru 1 : 9 proti jiným příčinám.
Tab. 4. Sumarizace dat klinických studií s AS [30]. ![Sumarizace dat klinických studií s AS [30].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/a57bde9e0b4e0372e8375b386441573c.png)
Ve skupině 141 pacientů s karcinomem prostaty konzervativně sledovaných (watchful waiting – WW) průměrně 60 měsíců prezentovali Hanuš et al [31] podobné výsledky. Čtyřicet jedna pacientů bylo konvertováno na aktivní léčbu, ze zbývajících 100 jich zemřelo 32 : 22 z neonkologických příčin, 8 na nádorovou duplicitu a pouze 2 na vlastní karcinom prostaty. Ostatní jsou v dobrém stavu. Průměrný vstupní věk byl 70 let.
Již v roce 2002 D‘Amico et al zastávali názor, že nálezy Gleson ≤ 6, PSA ≤ 10, T1c ‑ 2a lze označit za nízkorizikové [32]. Na podkladě výsledků rozsáhlých PSA screeningových studií vedoucích k migraci stadií pak docházejí Cooperberg et al [33] k závěru, že až 50 % nově diagnostikovaných CAP spadá do skupiny nízkorizikových karcinomů.
V roce 2009 bylo u nás provedeno dle výkazů na ÚZIS celkem 1 975 výkonů (ÚZIS osobní sdělení 5/ 2012), z dotazníků vyplněných všemi urologickými lůžkovými odděleními byl hlášený počet vyšší, 2 111 RP. NOR obdržel hlášení o 6 154 nových případů (incidence), z nich > 70 % uvádí stadium I a II (> 4 300 případů). Predikce IBA (tab. 1) pro rok 2013 předpokládá 8 340 nových záchytů karcinomů prostaty, z nichž bude 4 545 nízkorizikových karcinomů stadií I a II (T1 – 2 N0M0). Pokud by naprostá většina těchto mužů podstoupila RP (tedy přetrvával dnešní indikační trend v ČR), pak ve smyslu výše uvedeného bude minimálně každý 48. nemocný ušetřen úmrtí na karcinom prostaty, zatímco ostatní se budou ve vysokém procentu potýkat s erektilní dysfunkcí (30 – 50 %) a nemalý počet s různým stupněm močové inkontinence. GDL EAU uvádějí lehkou inkontinenci až v 50 % a závažnou inkontinenci až v 15,4 % [8]. Všichni nemocní projdou operační zátěží a dlouhodobým psychickým i fyzickým snížením kvality života (quality of life – QoL). V dnešní době významných úspěchů onkologické léčby tato čísla představují až neúměrně vysokou daň za jeden zachráněný život. Klotz logicky dovozuje, že pokud se na podkladě EBM argumentů nepodaří zmírnit tempo usilovného pátrání po karcinomu prostaty, může až polovina nízkorizikových nálezů být zbytečně operována [30]. Narůstající počet publikovaných dat podporujících oprávněnost konzervativního přístupu WW a AS dokládá, že se zvětšuje počet urologů, kteří tyto nechirurgické modality indikují [18].
V současné době jsou jmenovány dvě varianty odložené léčby. První možností je pečlivé sledování (WW), někdy označované jako odložená léčba určovaná závažností symptomů, ať již lokálních, nebo systémových. V případě progrese je možná léčba jen paliativní (desobstrukce při mikčních retenčních obtížích, hormonální léčba a radioterapie při generalizaci). V tomto smyslu bylo WW používáno na konci minulého století.
Druhou možností je aktivní vyčkávání (AS, též active monitoring – AM), který je založen na zhodnocení nálezu jako nízkorizikového, a zvolené pozorné sledování s opakovanými biopsiemi. Ty by měly prokázat progresi histologickou (vyšší dediferenciaci) ještě v době, kdy můžeme přistoupit k radikální operaci (event. radioterapii). To je aktuální doporučení z GDL EAU, jež se též mimo jiné opírá o skutečnost, že pouze u 15 – 20 % mužů je karcinom prostaty za života diagnostikován a jen 3 % z nich karcinom na životě skutečně může ohrozit [8].
V literatuře jsou publikovány názory, že přínos opakovaných biopsií není zcela spolehlivý vzhledem k malé zobrazitelnosti karcinomu potřebné pro zaměření rebiopsie. Validitu rebiopsií diskutují autoři z MSKCC, když ve skupině 104 pacientů s prokázaným CAP v rebiopsiích po třech měsících u 26 % karcinom vůbec nezjistili [34]. Nicméně pozdější analýza na větším souboru 238 pacientů prokázala v opakovaných rebiopsiích v 27 % vyšší stupeň anaplazie, což opravňuje rebiopsie provádět. Avšak i tam byl velký počet negativních biopsií [35].
Domníváme se, že i další parametry mají indikační hodnotu (dynamika PSA, denzita, symptomy, lokální vyšetření) a také letitá zkušenost urologa může být dostatečným zdrojem informací pro rozhodování a dalším postupu, který by měl terapeutický cíl. Tedy modernější varianta WW, pečlivého sledování bez rebiopsií, kterou můžeme označit jako wachful monitoring (WM).
Na jaře 2012 se v Praze konalo mezinárodní sympozium na téma karcinom prostaty, obsazené více než 350 špičkovými odborníky z celého světa. Zde R. Valdagni, koordinátor ESO (European School of Oncology), uvedl podnětný příklad: na klinice v Miláně [36] léta pracuje multidisciplinární tým složený z klinického onkologa, psychologa, dvou zkušených radiačních onkologů, dvou zkušených urologů a uropatologa. Tým analyzuje všechny případy ze spádové 300 000. populace a zatímco v roce 2006 indikoval k AS 43 % nemocných, pak v roce 2010 to bylo již 73 %. V tomto časovém rozpětí klesl počet RP nebo radioterapií o 50 %. Rozhodnutí týmu zajišťuje vyvážený přístup k nálezům a významně eliminuje užší zájmy jednotlivých profesí. Trend konzervativního postupu podpořila řada přednášejících na kongresu v Tel Avivu v červenci 2012 [37].
Autoři Rider et al zcela recentně publikovali v European Urology Rider [38] dlouhodobé výsledky švédské studie sledující průběh onemocnění karcinomem prostaty u 76 437 mužů rozdělených do pěti rizikových kategorií, z nichž první dvě představovaly nízko a středně rizikové karcinomy. Přežití v těchto skupinách se ve srovnání s lokální léčbou neliší. Komorbidita byla hodnocena podle Charlsonova indexu komorbidit (Charlson comorbidity index – CCI). Analýza potvrdila předpokládané skutečnosti, že prognóza pacientů závisí na klasifikaci karcinomu a závažnosti souběžných onemocnění, a to i u mužů mladších 65 let. Studer et al [39] v editorialu ke článku upozorňují na nedostatky studie: především se jedná o fakt, že v průběhu studie byla pozměněna histopatologická klasifikace (San Antonio 2005), což komplikovalo hodnocení jednotlivých případů, a také medián sledování byl relativně krátký (4,4 roku). Nicméně název editorialu It‘s time to change the treatment paradigm for prostate cancer! dokládá, že je třeba otevřít širokou diskuzi s cílem přehodnotit léčebné přístupy k nově diagnostikovaným karcinomům.
Volba WW a AS bude nepochybně znamenat větší zátěž ambulantních urologů spočívající především v nutnosti četnějších kontrol, podrobnějších rozhovorů s pacientem. Bude vyžadovat i více osobní odvahy lékaře podstoupit riziko indikace konzervativního sledování z obavy možných stížností v případě nekontrolované progrese nemoci. Naše více než 10leté zkušenosti potvrzují, že při dodržení všech zásad je ale riziko pro lékaře velmi malé. Na straně druhé tak mnoha pacientům umožníme život v nezměněné kvalitě. A to je velmi silný medicínský argument. Důsledkem dosavadního extenzivního přístupu jsou také požadavky nákupu dalších robotů nebo moderních ozařovacích přístrojů. Navíc si vyrábíme nositele inkontinenčních pomůcek a dlouhé řady uživatelů nehrazených sildenafilů apod. Samozřejmě že výrobci přístrojů a farmaceutické firmy i distributoři z tohoto chaotického stavu profitují. I v médiích je populace zkresleně informována o rizicích karcinomu prostaty a možnostech trvalého vyléčení. Především urologové by se měli odpovědně zamyslet nad indikacemi PSA, následně biopsií a konečně operací. Při velmi střízlivém přístupu, se znalostí problematiky bychom možná až polovinu pacientů ušetřili zbytečné diagnostiky i především léčby a uchovali jim nezměněnou QoL [30]. Samozřejmě bychom ušetřili velké finanční prostředky a pracovní síly s možností využití jinde v onkologii.
Závěr
Pro definovanou část pacientů představuje AS, WW (event. WM) medicínsky zdůvodněnou nechirurgickou variantu. Lékař musí provést klasifikaci onemocnění s maximální pečlivostí a s nemocným probrat současné trendy léčebného přístupu k onemocnění klasifikovanému jako nízkorizikové. Je třeba vážit individualitu každého případu s ohledem na dynamiku onemocnění, věk, zdravotní stav, změnu kvality života i preference nositele. Přihlédnout k pravděpodobnosti náležité spolupráce. Pacient své rozhodnutí musí potvrdit informovaným souhlasem a je povinen dodržovat stanovený režim kontrol. V Urocentru v posledních 20 letech zaznamenáváme zvyšující se počet žádosti o druhý názor (second opinion) právě s cílem vysvětlení navržené varianty léčby u nově diagnostikovaných karcinomů prostaty a možností jiné volby. Je to důsledek prohlubujících se znalostí populace týkajících se této problematiky. Podle našich zkušeností řada pacientů je schopna velmi racionálně vážit všechny aspekty konzervativního postupu a po vysvětlení přínosu i rizik přijmout možnost pečlivého sledování jako přijatelně únosnou.
I když mezi odbornou (urologickou) veřejností převažuje názor propagující aktivní vyhledávání a následnou operativu i u příznivých nálezů, je nezbytné přihlédnout k novým publikovaným faktům a zahájit diskuzi na téma „místa konzervativních postupů v léčbě karcinomu prostaty“. Jednou z možností vyváženějších návrhů léčby by bylo vytvoření multidisciplinárních týmů garantujících komplexní indikační přístup.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
doc. MUDr. Miroslav Hanuš, CSc.
Urocentrum Praha
Karlovo nám. 3
120 00 Praha 2
e-mail: hanus@urocentrum.cz
Obdrženo 2. 4. 2013
Přijato: 12. 5. 2013
Zdroje
1. Uroweb.cz [internetová stránka]. Uroweb – webový portál pro analýzu a vizualizaci epidemiologie, diagnostiky a léčby urologických malignit. Masarykova univerzita, Česká republika. [citováno 2013]. Dostupné z: http:/ / www.uroweb.cz.
2. Schröder FH, Hugosson J, Roobol MJ et al. Screening and prostate ‑ cancer mortality in a randomized European study. N Engl J Med 2009; 360(13): 1320 – 1328.
3. Schröder FH. Landmarks in prostate cancer screening. BJU Int 2012; 110 (Suppl 1): 3 – 7.
4. Andriole GL, Crawford ED, Grubb RL 3rd et al. Prostate cancer screening in the randomized Prostate, Lung, Colorectal, and Ovarian Cancer Screening Trial: mortality results after 13 years of follow‑up. J Natl Cancer Inst 2012; 104(2): 125 – 132.
5. Dušek L, Mužík J, Gelnarová E et al. Cancer incidence and mortality in the Czech Republic. Klin Onkol 2010; 23(5): 311 – 324.
6. Sakr WA, Haas GP, Cassin BF et al. The frequency of carcinoma and intraepithelial neoplasia of the prostate in young male patients. J Urol 1993; 150(2 Pt 1): 379 – 385.
7. Catalona WJ, Partin AW, Sanda MG et al. A multicenter study of [ - 2]pro‑prostate specific antigen combined with prostate specific antigen and free prostate specific antigen for prostate cancer detection in the 2.0 to 10.0 ng/ ml prostate specific antigen range. J Urol 2011; 185(5): 1650 – 1655.
8. Heidenreich A, Bastion PJ, Bellmunt J et al (eds). In: Guidelines on Prostate Cancer. European Association of Urology 2012. Available from: http:/ / www.uroweb.org/ gls/ pdf/ 08%20Prostate%20Cancer_LR%20March%2013th%202012.pdf.
9. Vickers AJ, Cronin AM, Bjork T et al. Prostate specific antigen concentration at age 60 and death or metastasis from prostate cancer: case ‑ control study. BMJ 2010; 341: c4521.
10. Vickers AJ, Roobol MJ, Lilja H. Screening for prostate cancer: early detection or overdetection? Annu Rev Med 2012; 63 : 161 – 170.
11. Siu ‑ urology.org [homepage on the internet]. Société Internationale d’Urologie. The three documents for PSA testing: To test or not to test. Available from: http:/ / www.siu ‑ urology.org/ psa ‑ aid.aspx.
12. Punglia RS, Kuntz KM, Catalona WJ et al. Operating characteristics of prostate ‑ specific antigen and verification bias. JAMA 2005; 294(21): 2698 – 2699.
13. Määttänen L, Hakama M, Tammela TLJ et al. Specificity of serum prostate ‑ specific antigen determination in the Finnish prostate cancer screening trial. Br J Cancer 2007; 96(1): 56 – 60.
14. Punglia RS, D’Amico AV, Catalona WJ et al. Effect of verification bias on screening for prostate cancer by measurement of prostate ‑ specific antigen. N Engl J Med 2003; 349(4): 335 – 342.
15. Vickers A, Cronin A, Roobol M et al. Reducing unnecessary biopsy during prostate cancer screening using a four ‑ kallikrein panel: an independent replication. J Clin Oncol 2010; 28(15): 2493 – 2498.
16. Schröder FH, van der Maas P, Beemsterboer P et al. Evaluation of the digital rectal examination as a screening test for prostate cancer. Rotterdam section of the European Randomized Study of Screening for Prostate Cancer. J Natl Cancer Inst 1998; 90(23): 1817 – 1823.
17. Washington SL, Bonham M, Whitson JM et al. Transrectal ultrasonography ‑ guided biopsy does not reliably identify dominant cancer location in men with low ‑ risk prostate cancer. BJU Int 2012; 110(1): 50 – 55.
18. Dall‘Era MA, Albertsen PC, Bangma C et al. Active surveillance for prostate cancer: a systematic review of the literature. Eur Urol 2012; 62(6): 976 – 983.
19. Taira AV, Merrick GS, Bennett A et al. Transperineal template ‑ guided mapping biopsy as a staging procedure to select patients best suited for active surveillance. Am J Clin Oncol 2013; 36(2): 116 – 120.
20. Bittner N, Merrick GS, Butler WM et al. Incidence and pathologic features of prostate cancer detected on transperineal template ‑ guided mapping biopsy following negative transrectal ultrasound ‑ guided biopsy. J Urol. In press 2013.
21. McCormack M, Duclos A, Latour M et al. Effect of needle size on cancer detection, pain, bleeding and infection in TRUS ‑ guided prostate biopsies: A prospective trial. Can Urol Assoc J 2012; 6(2): 97 – 101.
22. Lavery HJ, Droler MJ. Do Gleason patterns 3 and 4 prostate cancer represent separate disease States? J Urol 2012; 188(5): 1667 – 1675.
23. Ross HM, Kryvenko ON, Cowan JE et al. Do adenocarcinomas of the prostate with Gleason score (GS) ≤6 have the potential to metastasize to lymph nodes? Am J Surg Pathol 2012; 36(9): 1346 – 1352.
24. Čapoun O, Babjuk M, Dvořáček J et al. Predikce patologické klasifikace karcinomu prostaty. Ces Urol 2008; 12(1): 31 – 36.
25. Doležel J, Tvarůžek J, Staník M et al. Časné zkušenosti s roboticky asistovanou laparoskopickou radikální prostatektomií – prvních 153 pacientů. Ces Urol 2009; 13(2): 168 – 177.
26. Broďák M, Košina J, Hušek P et al. Srovnání laparoskopické a retropubické radikální prostatektomie – zkušenosti z jednoho centra. Ces Urol 2012; 16(4): 222 – 229.
27. Epstein JI, Allsbrook WC Jr, Amin MB et al. The 2005 International Society of Urological Patology (ISUP) Consensus Conference on Gleason Trading of Prostatic Carcinoma. Am J Surg Pathol 2005; 29(9): 1228 – 1242.
28. Helpap B, Egeved L. Modified gleason grading. An updated review. Histol Histopathol 2009; 24(5): 661 – 666.
29. Hanuš M, Králová V, Jarkovský J et al. Analýza uroonkologické chirurgické péče lůžkových urologických oddělení v ČR. In: Sborník abstrakt. XXXV. Brněnské onkologické dny a XXV. Konference pro nelékařské zdravotnické pracovníky. Brno, 21. – 23. dubna 2011. Brno: Masarykův onkologický ústav 2011 : 51 – 52.
30. Klotz L. Active surveillance for prostate cancer: review. Arch Esp Urol 2011; 64(8): 806 – 814.
31. Hanuš M, Matoušková M. Trendy diagnostiky a léčby CaP v České republice – vlastní výsledky konzervativního postupu. Ces Urol 2012; 16 (Suppl 1): 73.
32. D’Amico AV, Whittington R, Malkowicz SB et al. Biochemical outcome after radical prostatectomy or external beam radiation therapy for patients with clinically localized prostate carcinoma in the prostate specific antigen era. Cancer 2002; 95(2): 281 – 286.
33. Cooperberg MR, Broering JM, Kantoff PW et al. Contemporary trends in low risk prostate cancer: risk assessment and treatment. J Urol 2007; 178 (3 Pt 2): S14–S1 9.
34. Berglund RK, Masterson TA, Vora KC et al. Pathological upgrading and up staging with immediate repeat biopsy in patients eligible for active surveillance. J Urol 2008; 180(5): 1964 – 1967.
35. Adamy A, Yee DS, Matsushita K et al. Role of prostate specific antigen and immediate confirmatory biopsy in predicting progression during active surveillance for low risk prostate cancer. J Urol 2011; 185(2): 477 – 482.
36. Magnani T, Valdagni R, Salvioni R et al. The 6‑year attendance of a multidisciplinary prostate cancer clinic in Italy: incidence of management ganges BJU Int 2012; 110(7): 998 – 1003.
37. The Friends of Israel – Urology Symposium (FOIU), Tel Aviv, Israel, July 3 – 5, 2012.
38. Rider JR, Sandin F, Andrén O et al. Long‑term outcomes among noncuratively treated men according to prostate cancer risk category in a nationwide, population‑based study. Eur Urol 2013; 63(1): 88 – 96.
39. Studer UE, Albertsen PC. It‘s time to change the treatment paradigm for prostate cancer! Eur Urol 2013; 63(1): 97 – 99.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2013 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Editorial
- Thalidomid v léčbě mnohočetného myelomu se zaměřením na kombinaci s bortezomibem
- Karcinom prostaty, aktuální dilema uroonkologie. Jak prospět ohroženým pacientům a neuškodit těm ostatním
- Erratum
- Inhibice signalizace B buněčným receptorem: první cílená léčba u chronické lymfocytární leukemie a dalších B buněčných lymfomů
- Udržiavacia liečba lenalidomidom u pacientov s mnohopočetným myelómom
- Léčba průlomové bolesti u onkologických pacientů
- Komunikácia ako súčasť suportívnej terapie v onkológii
- Výsledky kurativní chemoradioterapie u pacientů s karcinomy anu
- Pacientka s metastatickým karcinoidem z pohárkových buněk
- Karcinom prsu u monozygotních dvojčat
- Informace z České onkologické společnosti
- Zajímavé případy z nutriční péče v onkologii
- Léčba závislosti na tabáku
-
Onkologie v obrazech
Rozměrná regionální metastáza melanomu - Prof. MU Dr. Ľudovít Milan Jurga, DrSc. – významné jubileum
- Jubileum pana profesora MU Dr. Dalibora Ondruše, DrSc.
- Jaroslav Bakeš (1871–1930): lékař, na něhož se zapomnělo / Gustav Novotný
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Karcinom prostaty, aktuální dilema uroonkologie. Jak prospět ohroženým pacientům a neuškodit těm ostatním
- Výsledky kurativní chemoradioterapie u pacientů s karcinomy anu
- Komunikácia ako súčasť suportívnej terapie v onkológii
- Udržiavacia liečba lenalidomidom u pacientov s mnohopočetným myelómom
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



