-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Karcinom prsu u monozygotních dvojčat
Breast Cancer in Monozygotic Twins
Summary:
Breast cancer is a multifactorial disease. Twin studies comparing the disease concordance rate in identical twin pairs serve to differentiate the influence of genetic and environmental factors in the disease development.Aim of the study:
To assess breast cancer risk for an identical twin sister of a patient with breast cancer.Patients and Methods:
Five monozygotic twin families were examined during 2005 – 2011 in which at least one of the monozygotic sisters developed breast cancer.In 4 breast cancer women from 4 families, molecular genetic analysis of BRCA1 and BRCA2 genes was performed.Results:
The median follow‑up period was 12.6 years (7 to 24 years). No pair of monozygotic sisters was concordant for breast cancer. Familial breast/ ovarian cancer syndrome due to BRCA1 gene mutation was confirmed in one pair. These twins were phenotypically discordant, the first one developing breast cancer at the age of 54 years, her co ‑ sister suffering from ovarian cancer at the age of 43 years. In the other 4 non‑BRCA families, breast cancer was diagnosed at the age of 38 – 50 years (median 44 years) in one of the sisters; the other twins remain healthy through the follow‑up period.Conclusion:
We did not observe concordance for breast cancer in 5 pairs of monozygotic twins. Based on results of published studies, the life ‑ time breast cancer risk for a healthy identical twin of a breast cancer non‑BRCA woman is around 20 – 30 %. Other non‑hereditary risk factors must exist to explain the discordant phenotype. This highlights that environmental factors play an important role in breast cancer development. In case of BRCA‑associated breast cancer, breast cancer risk for the healthy co ‑ twin is the same as that for other BRCA mutation carriers, i.e. 45 – 85%.Key words:
breast cancer – BRCA1 gene – BRCA2 gene – monozygotic twins – risk factors
Autoři: A. Hladíková 1; P. Plevová 1; E. Macháčková 2
Působiště autorů: Oddělení lékařské genetiky, FN Ostrava 1; Oddělení epidemiologie a genetiky nádorů, Masarykův onkologický ústav, Brno 2
Vyšlo v časopise: Klin Onkol 2013; 26(3): 213-217
Kategorie: Kazuistika
Souhrn
Východiska:
Karcinom prsu je multifaktoriálně podmíněné onemocnění. Studie sledující výskyt sledovaného znaku (konkordanci) u monozygotních dvojčat slouží ke zjištění, zda jsou za vznik určitého onemocnění odpovědné převážně genetické faktory a jaký je podíl faktorů zevního prostředí.Cíl práce:
Na základě analýzy rodin žen s monozygotními dvojčaty stanovit, jaké je riziko onemocnění nádorem prsu pro monozygotní sestru pacientky s karcinomem prsu.Soubor pacientů a metodika:
V průběhu let 2005 – 2011 bylo vyšetřeno 5 rodin s monozygotními sestrami, kde minimálně 1 z nich onemocněla karcinomem prsu. U 4 žen s karcinomem prsu ze 4 rodin byla provedena molekulárně‑genetická analýza genů BRCA1 a BRCA2.Výsledky:
Průměrná doba sledování rodin byla 12,6 roku (7 až 24 let). Ani jedna dvojice nebyla pro karcinom prsu konkordantní. V jedné dvojici sester s mutací v genu BRCA1 onemocněly nádorovým onemocněním obě sestry, avšak různým nádorem – jedna karcinomem prsu v 54 letech, druhá karcinomem vaječníků ve 43 letech. Ve 4 rodinách bez mutace BRCA genů onemocnělo jedno dvojče karcinomem prsu ve věku 38 – 50 let (průměrně ve 44 letech), druhé dvojče zůstává po dobu sledování z onkologického hlediska zdravé.Závěr:
V našem souboru pacientů jsme nepozorovali konkordanci pro karcinom prsu u 5 párů monozygotních dvojčat – sester. Na základě literárních údajů lze stanovit riziko onemocnění karcinomem prsu u zdravé monozygotní sestry ženy s karcinomem prsu na 20 – 30 % v případě, že se nenajde mutace v BRCA genech. Musejí zde tedy existovat jiné, nedědičné faktory, které by vysvětlovaly diskordantní fenotyp. Svědčí to o významném vlivu faktorů zevního prostředí na etiopatogenezi vzniku karcinomu prsu. V případě potvrzeného hereditárního syndromu karcinomu prsu/ vaječníků způsobeného zárodečnými mutacemi v BRCA genech je riziko exprese nemoci u zdravé monozygotní sestry stejné jako u jiných nositelek mutace, tj. 45 – 85 %.Klíčová slova:
karcinom prsu – gen BRCA1 – gen BRCA2 – monozygotní dvojčata – rizikové faktoryÚvod
Běžné populační riziko pro karcinom prsu se pro každou ženu v České republice pohybuje v rozmezí 6 – 7 % [1].5 – 10 % ze všech karcinomů prsu představuje jeho hereditární forma [2], přibližně za 5 % všech karcinomů prsu jsou odpovědné mutace genů BRCA1 a BRCA2 a TP53 [3,4]. 10 – 15 % karcinomů prsu je tzv. familiárních (nejsou splněna kritéria k testování žádné ze známých nádorových predispozic). Za jejich příčinu se považují mutace kodominantních genů střední a nízké penetrance, které regulují hormonální pochody a jiné buněčné mechanizmy [5,6]. Největší skupinu žen s karcinomem prsu, cca 75 – 80 %, tvoří sporadické formy (tj. ojedinělý výskyt onemocnění v rodině). Většina nádorových onemocnění prsu jsou náhodně vzniklá onemocnění bez dědičné etiologie a dosud byla identifikována celá řada faktorů, které modifikují relativní riziko vzniku těchto nádorů u jednotlivých členů rodiny [7].
Mezi zevní rizikové faktory uplatňující se v patogenezi karcinomu prsu patří věk nástupu menarché, věk a počet těhotenství, užívání hormonální antikoncepce, hormonální léčba (příprava k umělému oplodnění, substituční léčba v klimakteriu), záněty prsu, úrazy prsu, kouření a abúzus alkoholu, expozice škodlivým vlivům prostředí, nízká fyzická aktivita, dieta – stravovací zvyklosti a životní styl [7].
Pro odlišení, zda jsou za vznik určitého onemocnění (nebo sledovaného znaku) odpovědné zejména genetické faktory, nebo zda jsou rozhodující zevní faktory, a pro zjištění, jaký je podíl zevních (sdílených) faktorů životního prostředí, slouží studie jednovaječných, tedy monozygotních (MZ) dvojčat a porovnání s nálezy u dizygotních (DZ) dvojčat. Nález shodného (stejného) výskytu určitého fenotypového znaku u obou MZ dvojčat znamená, že jsou MZ dvojčata pro sledovaný znak (nemoc) konkordantní. V případě diskordance MZ dvojčat jedno dvojče onemocní, druhé nikoliv [8]. Podstatným zjištěním je, že ani MZ dvojčata nejsou geneticky identická. Bylo publikováno mnoho prací, kde autoři uvádějí diskordanci MZ dvojčat, např. pro Turnerův syndrom [9], Downův syndrom [10], Huntingtonovou choreu [11], syndrom fragilního X chromozomu [12], Duchennovu svalovou dystrofii a další [10]. Příčinou těchto nálezů jsou nové genetické změny, které vznikají v průběhu již samostatného vývoje jednoho z dvojčat. Podle některých prací se mohou pravděpodobně uplatňovat také změny v CNV (copy number variation – jedná se o chybění určitých genetických oblastí nebo jejich mnohočetné kopie) [8]. Uvažuje se také o epigenetických mechanizmech jako důležitém faktoru v rozdílné fenotypové expresi znaku [13].
Cíl práce
Na základě analýzy rodin žen – monozygotních dvojčat – stanovit, jaké je riziko onemocnění nádorem prsu u MZ dvojčete pacientky s karcinomem prsu. Cílem studie bylo zjistit, zda se jedná o hereditární formu onemocnění způsobenou mutacemi v BRCA genech, nebo zda se jedná o sporadické onemocnění. V obou případech pak stanovit míru rizika pro druhé monozygotní dvojče na základě literatury.
Soubor pacientů a metodika
V průběhu let 2005 – 2011 jsme vyšetřili 5 rodin, ve kterých se vyskytla monozygotní dvojčata – ženy, z nichž minimálně jedna onemocněla karcinomem prsu. U 4 žen s karcinomem prsu ze 4 rodin byla provedena molekulárně‑genetická analýza genů BRCA1 a BRCA2 z genomické DNA izolované z periferní krve metodou analýzy křivek tání s vysokým rozlišením (HRM) na přístroji LightScanner (Idaho Technology). Úseky s abnormálním profilem křivek byly následně sekvenovány na genetickém analyzátoru 3130 (Applied Biosystems).
Výsledky
Průměrná doba sledování rodin byla 12,6 roku (7 až 24 let). Ani jedna dvojice nebyla pro karcinom prsu konkordantní. V jedné dvojici sester s mutací v genu BRCA1 onemocněly nádorovým onemocněním obě sestry, avšak různým nádorem – jedna karcinomem prsu v 54 letech, druhá karcinomem vaječníků ve 43 letech. Ve 4 rodinách (1 rodina z těchto 4 nebyla testována) bez mutace BRCA genů onemocnělo jedno dvojče karcinomem prsu ve věku 38 – 50 let (průměrně ve 44 letech), druhé dvojče zůstává po dobu sledování z onkologického hlediska zdravé ve věku 51 – 71 let (průměrně 59 let).
Podrobné záznamy rodokmenů MZ dvojčat dokumentují obr. 1 – 5. V prvním případě (obr. 1) byl u MZ dvojčat potvrzen hereditární syndrom karcinomu prsu/ vaječníků, u jednoho dvojčete s karcinomem prsu byla nalezena mutace aktivující kryptické místo sestřihu v genu BRCA1 v intronu 5 c.213 - 12A>G v heterozygotním stavu. Rozdíl v expresi nemoci mezi oběma MZ sestrami byl 11 let. První ze sester onemocněla ve věku 43 let karcinomem vaječníků, druhá onemocněla karcinomem prsu o 11 let později, tedy ve věku 54 let. Nemocná s karcinomem vaječníků zemřela, a nemohla být proto testována na přítomnost familiární mutace v genu BRCA1.
Obr. 1. Rodina ženy s duktálním karcinomem prsu v 54 letech a její monozygotní sestra s nádorem vaječníků ve 43 letech; časový interval sledování 11 let; nalezena familiární mutace c.213-12A>G v genu <i>BRCA1</i>. 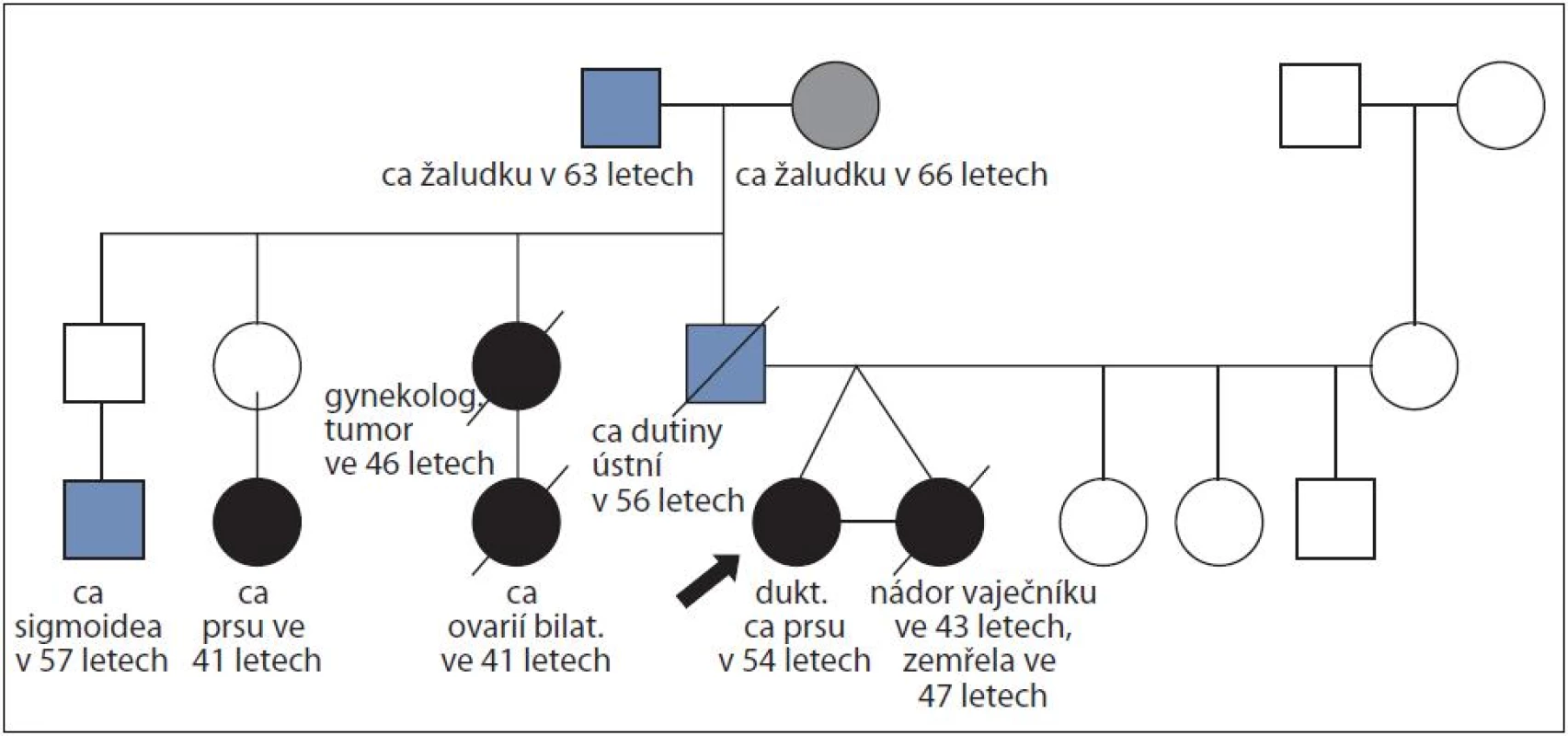
Podrobnosti o dalších rodinách jsou uvedeny na obr. 2 – 5.
Obr. 2. Rodina ženy s duktálním karcinomem prsu ve 38 letech a její monozygotní sestry, která zemřela na diagnózu nenádorového původu; časový interval sledování 24 let; mutace v <i>BRCA</i> genech nenalezena. 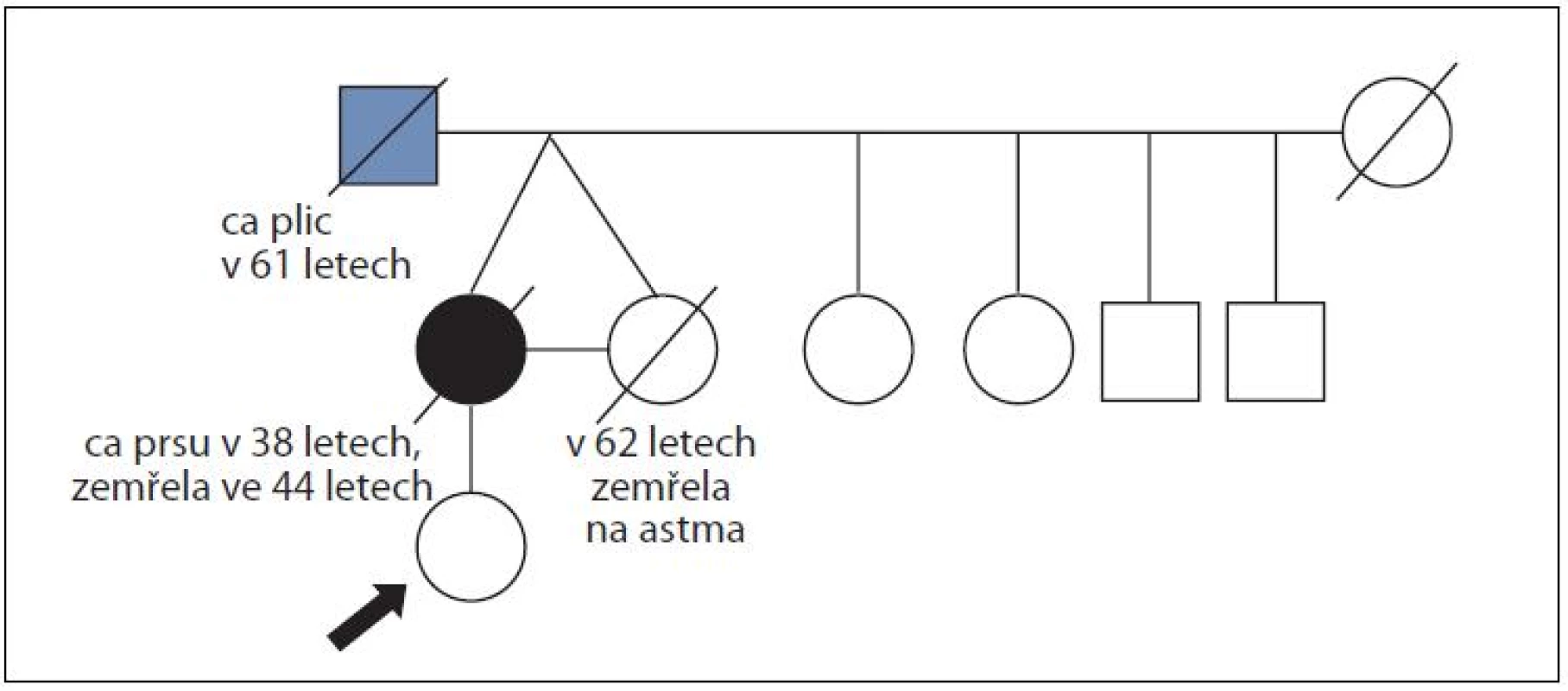
Obr. 3. Rodina ženy s duktálním karcinomem prsu ve 43 letech a její monozygotní sestry, která nádorem prsu neonemocněla do věku 51 let; časový interval sledování 8 let; mutace v <i>BRCAL</i> genech nenalezena. 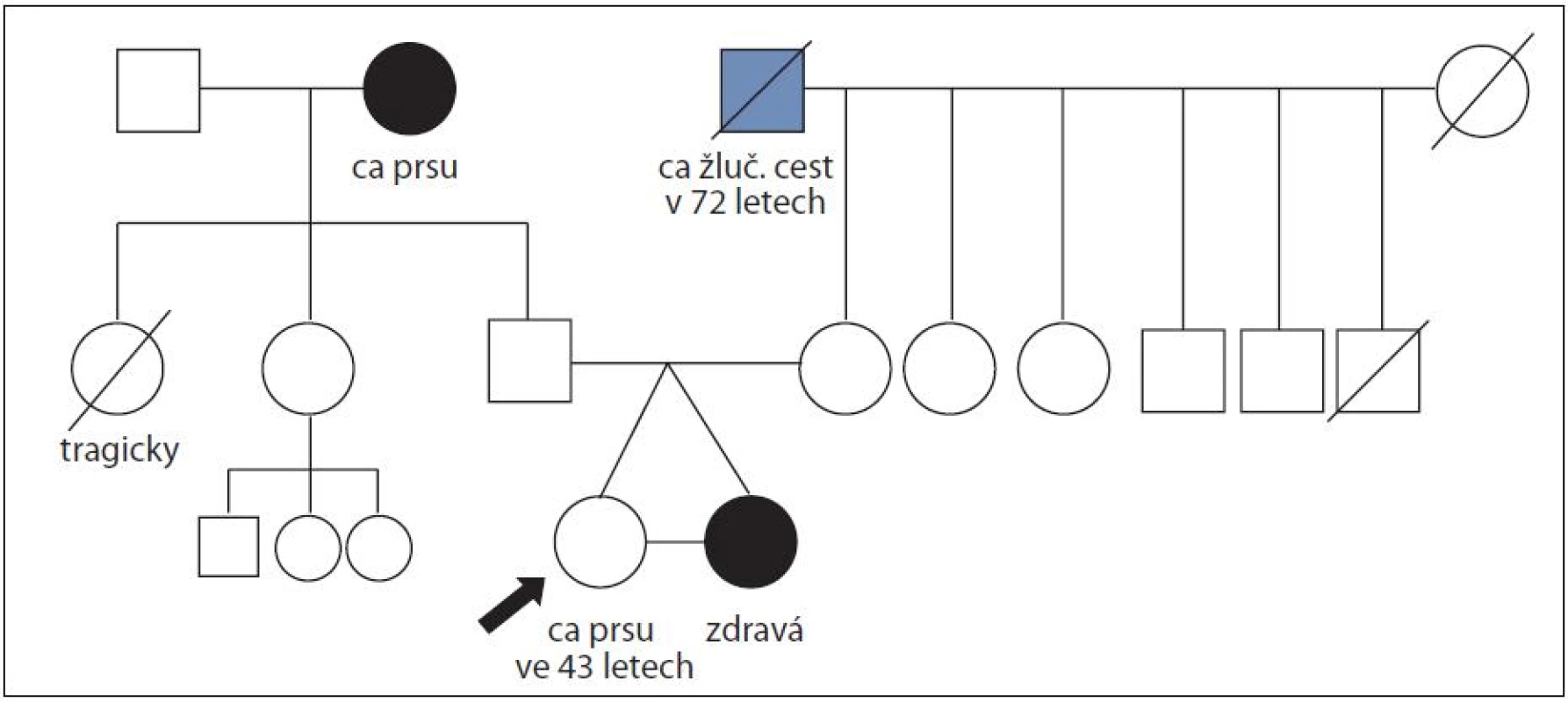
Obr. 4. Rodina ženy s duktálním karcinomem prsu ve 45 letech a její monozygotní sestry, která nádorem prsu neonemocněla do věku 52 let; časový interval sledování 7 let; mutace v <i>BRCA</i> genech nenalezena. 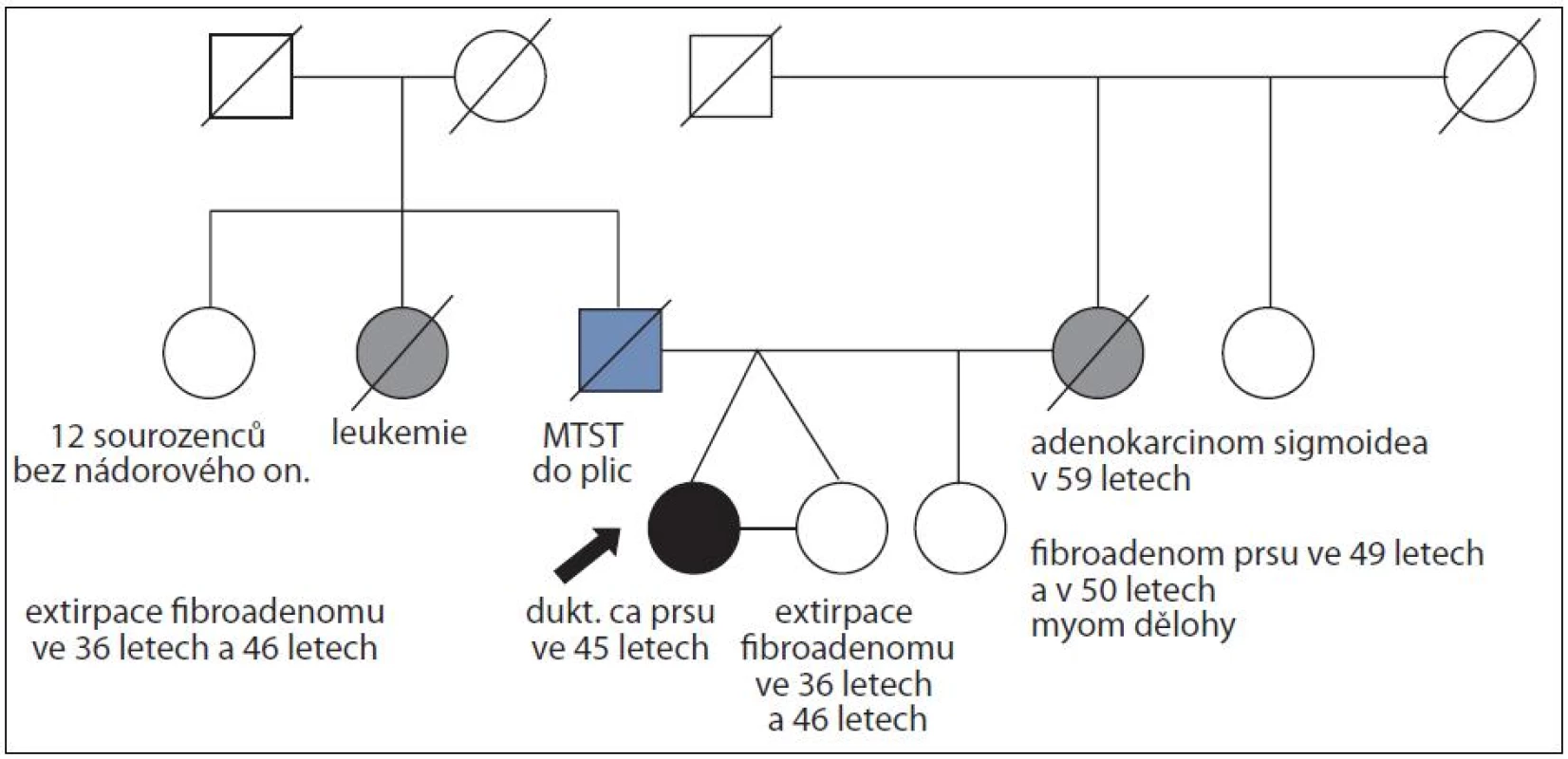
Obr. 5. Rodina ženy s duktálním karcinomem prsu v 50 letech a její monozygotní sestry, která nádorem prsu neonemocněla do věku 63 let; časový interval sledování 13 let; molekulárně genetické vyšetření <i>BRCA</i> genů neindikováno, nebyla splněna kritéria pro toto vyšetření. 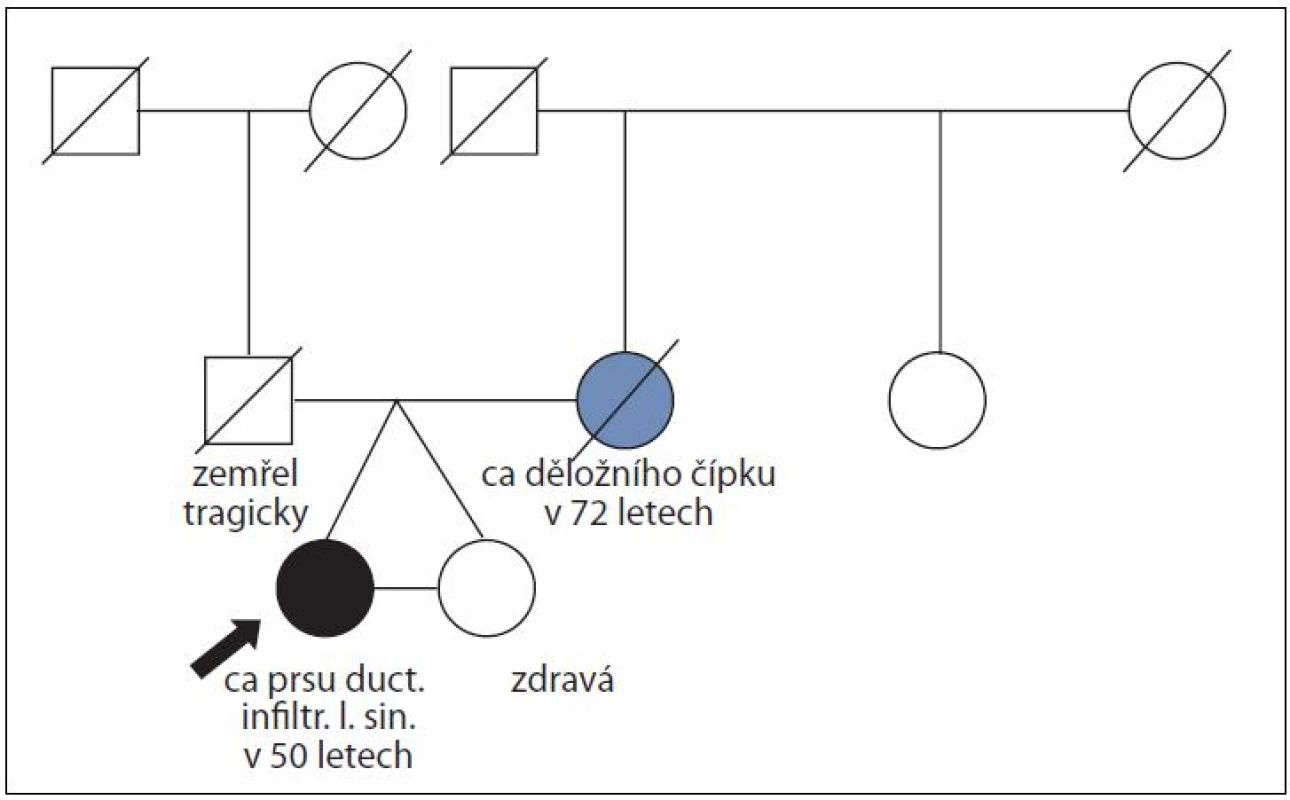
Diskuze
Ani jedna dvojice MZ sester v naší studii nebyla pro karcinom prsu konkordantní. V jedné dvojici sester s mutací v genu BRCA1 onemocněly nádorovým onemocněním obě sestry, avšak různým nádorem – jedna karcinomem prsu, druhá karcinomem vaječníků. Ve 4 případech rodin bez mutace BRCA genů druhé dvojče po dobu sledování karcinomem prsu neonemocnělo.
V literatuře se touto problematikou zabývá několik prací.
Ahlbom et al [14] se zabývali obecně výskytem nádorových onemocnění u dvojčat, o nichž byly informace dostupné ve Švédském registru dvojčat (Swedish Twin and Cancer Register). Z 279 MZ dvojčat, kdy jedno onemocnělo karcinomem prsu, byla pozorována konkordance u druhého dvojčete ve 22 případech (8 %). Relativní riziko bylo stanoveno na 3,8 (95% CI 2,1 – 6,6).
Peto et al [15] studovali 1 300 MZ a 1 000 párů DZ dvojčat v britské a americké populaci – sester, kdy alespoň jedna z nich onemocněla karcinomem prsu. Zjistili, že u jedné třetiny žen (33 %), jejichž sestra onemocněla karcinomem prsu, je rovněž někdy v životě stanovena stejná diagnóza v porovnání s 1/ 9 (11 %) žen v obecné populaci. Jejich výsledky ukazují, že MZ dvojče ženy s karcinomem prsu ve věku < 40 let nemá vyšší riziko rozvoje nemoci ve vyšším věku než dvojče ženy, u níž byl karcinom prsu diagnostikován ve věku > 50 let. DZ dvojčata vykazují signifikantně nižší riziko než monozygotní.
Mack et al [16] vyšetřili 2 310 párů MZ i DZ dvojčat – sester s karcinomem prsu a zjistili, že jejich MZ dvojčata mají výrazně vyšší riziko vzniku nemoci před i po menopauze (SIR = 4,4; CI = 3,6 – 5,6). Karcinom prsu u původně zdravého MZ dvojčete již nemocné sestry se objevoval již během 5 let výrazně častěji, než bylo očekáváno (SIR = 20,0; CI = 7,5 – 3,3), poté incidence onemocnění klesala nepřímo úměrně době sledování. 77 % konkordantních MZ dvojčat neslo mutaci v BRCA genech, což svědčí pro vysoký podíl hereditárních faktorů; kumulativní riziko pro vznik karcinomu prsu do věku 75 let bylo u zdravých sester MZ dvojčete s karcinomem prsu na podkladě mutace BRCA genů 44,5 %, tedy odpovídající běžně uváděnému riziku pro jakoukoli ženu – nositelku mutace v BRCA genech – 45 – 85 % [17 – 20]. Riziko pro dizygotní dvojče ženy s karcinomem prsu nebylo vyšší než pro jiné příbuzné prvního stupně, přestože dvojčata sdílejí v časných fázích života stejné prostředí.
Podle údajů Cancer Research UK je pro MZ dvojče ženy s karcinomem prsu celoživotní riziko asi 3krát vyšší v porovnání s obecným populačním rizikem, tj. přibližně 20 %. Podle onkologického registru USA je toto riziko asi 4krát vyšší v porovnání s obecným populačním rizikem, tj. asi 30 % [21].
Försti et al [22] na základě analýzy údajů ze Švédského registru dvojčat vyšetřili 12 MZ sester, kdy obě sestry byly konkordantní pro karcinom prsu. U žádného páru nebyla prokázána patogenní mutace v genech BRCA1 nebo BRCA2.
Zajímavé jsou rozdíly uváděné v kazuistických sděleních o výskytu nádorových onemocnění a rizicích vzniku karcinomu prsu a vaječníků v souvislosti s mutací BRCA genů u MZ sester. Miesfeldtová et al [23] sledovali dvojici MZ sester, které obě onemocněly nádorem vaječníků po 50. roce života a obě následně zemřely do 10 let od stanovení diagnózy; u obou byla potvrzena mutace v genu BRCA1 (c.2711delA; systematicky c.2592delA). Obdobně Delgado at al [24] sledovali pár MZ dvojčat s karcinomem prsu, kde byla extrémně vysoká konkordance anamnézy, klinického nálezu a dalších onkologických rizikových faktorů. Obě MZ sestry onemocněly ve stejném věku na shodný typ a staging tumoru, s identickým histologickým nálezem. Nápadná podobnost nálezů u těchto identických dvojčat podporuje důležitost úlohy dědičných faktorů pro definování charakteru onemocnění u pacientů – nositelů zárodečných mutací BRCA genů.
K obdobnému závěru došli Wistuba et al [25]. Publikovali kazuistickou práci dvou sester narozených z MZ trojčat, kdy první sestra onemocněla duktálním karcinomem prsu ve věku 22 let, její MZ sestra onemocněla o 2 roky později duktálním karcinomem prsu ve věku 24 let, u obou byla potvrzena mutace v genu BRCA1 (c.5382insC; systematicky 5266dupC). Jejich třetí MZ sestra podstoupila profylaktickou mastektomii ve 24 letech. U obou nemocných sester byla zjištěna konkordance v expresi proteinů p16, HER2/ neu, estrogenových a progesteronových receptorů a diskordance v imunohistochemické expresi proteinů RB a p53 a přítomnosti somatických mutací genu TP53. Byl zjištěn také obdobný profil ztráty heterozygotnosti určitých oblastí genomu v nádorových tkáních. Uvedené výsledky vedly autory k úvaze, že dědičné faktory mohou částečně určovat charakter somatických genetických změn, které vznikají v nádorovém onemocnění.
Naproti tomu Diez et al [26] publikovali kazuistiku 2 MZ sester, kdy jedna onemocněla ve věku 32 let na karcinom prsu a následně ve věku 39 let na karcinom ovarií. Její sestra byla po dobu sledování 17 let z onkologického hlediska zdravá. V době publikace příspěvku měly obě sestry 49 let. Obě dvojčata žila od dětství spolu a sdílela stejné faktory prostředí. Molekulárně‑genetické vyšetření potvrdilo, že obě MZ sestry jsou nositelkami BRCA1 mutace (c.189insTGTC; systematicky c.70_71insTGTC). Stejný kolektiv autorů [27] se vrátil ke sledované dvojici sester s odstupem 12 let. Obě MZ sestry byly v době druhé publikace 61leté, druhá sestra zůstala po celou dobu zdravá, rozdíl od doby stanovení onkologické diagnózy u první sestry byl již 29 let. Vyšetření CNV (copy number variation, tj. variability v počtu kopií určitých oblastí genomu) nebylo shledáno jako příčina diskordance fenotypu u těchto dvojčat.
Závěr
Ač by se mohlo zdát, že monozygotní dvojče ženy s karcinomem prsu bez souvislosti se zárodečnou mutací BRCA genů nutně musí onemocnět týmž onemocněním, skutečnost je jiná. Na základě dostupných studií a údajů z onkologických registrů lze stanovit, že toto riziko se pohybuje mezi 20 až 30 % [21]. Vzhledem k tomu, že po genetické stránce jsou monozygotní dvojčata téměř identická (a mimoto také sdílejí téměř identické zevní prostředí v časných obdobích života), musejí zde existovat jiné, nedědičné modifikující faktory, které by vysvětlovaly diskordantní fenotyp. Uvedené riziko svědčí pro významný vliv faktorů zevního prostředí na etiopatogenezi vzniku karcinomu prsu. Nicméně zvýšení rizika oproti běžnému 6 – 7% populačnímu riziku vzniku karcinomu prsu je dokladem existence genetické predispozice k nádoru prsu (jiné než mutace BRCA genů) ve smyslu kumulace rizikových alel genů s nízkou penetrancí. Výsledky studií monozygotních dvojčat ukazují, že ve většině případů faktory zevního prostředí pravděpodobně hrají při vzniku karcinomu prsu významnější roli než vlastní genetická predispozice.
Ačkoli tedy zevní prostředí hraje důležitou roli při vzniku karcinomu prsu, v každém případě je riziko 20 – 30 % poměrně vysoké, proto je zapotřebí zdravou sestru MZ dvojčete po stanovení diagnózy karcinomu prsu u sestry preventivně sledovat podle platných doporučení.
V případě potvrzeného hereditárního syndromu karcinomu prsu/ vaječníků způsobeného zárodečnými mutacemi v BRCA genech u onkologicky nemocné MZ sestry je riziko exprese nemoci u její zdravé sestry stejné jako u jiných nositelek mutace (45 – 85 %). Tato skutečnost opět svědčí o důležitém vlivu faktorů zevního prostředí. V každém případě sledování těchto žen by se opět mělo řídit platnými doporučeními pro ženy – nositelky mutace v BRCA genech [7].
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
MUDr. Andrea Hladíková, Ph.D.
Oddělení lékařské genetiky
FN Ostrava
17. listopadu 1790
70852 Ostrava
e-mail: andrea.hladikova1@seznam.cz
Obdrženo: 13. 3. 2013
Přijato: 8. 4. 2013
Zdroje
1. Foretová L, Petráková K, Palácová M et al. Genetické testování a prevence hereditárních nádorů v MOÚ – více než desetiletá zkušenost. Klin Onkol 2010; 23(6): 388 – 400.
2. Rowell S, Newman B, Boyd J et al. Inherited predisposition to breast and ovarian cancer. Am J Hum Genet 1994; 55(5): 861 – 865.
3. Peto J, Collins N, Barfoot R et al: Prevalence of BRCA1 and BRCA2 gene mutations in patients with early ‑ onset breast cancer. J Natl Cancer Inst 1999; 91(11): 943 – 949.
4. Cui J, Antoniou AC, Dite GS et al. After BRCA1 and BRCA2 – what next? Multifactorial segregation analyses of three ‑ generation, population‑based Australian families affected by female breast cancer. Am J Hum Genet 2001; 68(2): 420 – 431.
5. Ford D, Easton DF, Peto J et al. Estimates of the gene frequency of BRCA1 and its contribution to breast and ovarian cancer incidence. Am J Hum Genet 1995; 57(6): 1457 – 1462.
6. Feigelson HS, Ross RK, Yu MC et al. Genetic susceptibility to cancer from exogenous and endogenous exposures. J Cell Biochem 1996; 25 (Suppl): 15 – 22.
7. Bartoňková H, Foretová L, Helmichová E et al. Doporučené zásady péče o nemocné s nádory prsu a vaječníků se zárodečnými mutacemi genů BRCA1 nebo BRCA2. Klin Onkol 2003; 16(1): 28 – 34.
8. Bruder CE, Piotrowski A, Gijsbers AA et al. Phenotypically concordant and discordant monozygotic twins display different DNA copy ‑ number ‑ variation profiles. Am J Hum Genet 2008; 82(3): 763 – 771.
9. Machin GA. Some causes of genotypic and phenotypic discordance in monozygotic twin pairs. Am J Med Genet 1996; 61(3): 216 – 228.
10. Kato T, Iwamoto K, Kakiuchi C et al. Genetic or epigenetic difference causing discordance between monozygotic twins as a clue to molecular basis of mental disorders. Mol Psychiatry 2005; 10(7): 622 – 630.
11. Petronis A, Kennedy JL. Unstable genes – unstable mind? Am J Psychiatry 1995; 152(2): 164 – 172.
12. Helderman van den Enden AT, Maaswinkel ‑ Mooij PD, Hoogendoorn E et al. Monozygotic twin brothers with the fragile X syndrome: different CGG repeats and different mental capacities. J Med Genet 1999; 36(3): 253 – 257.
13. Kaminsky ZA, Tang T, Wang SC et al. DNA methylation profiles in monozygotic and dizygotic twins. Nat Genet 2009; 41(2): 240 – 245.
14. Ahlbom A, Lichtenstein P, Malmström H et al. Cancer in twins: Genetic and nongenetic familial risk factors. J Natl Cancer Inst 1997; 89(4): 287 – 293.
15. Peto J, Mack TM. High constant incidence in twins and other relatives of women with breast cancer. Nat Genet 2000; 26(4): 411 – 414.
16. Mack TM, Hamilton AS, Press MF et al. Heritable breast cancer in twins. Br J Cancer 2002; 87(3): 294 – 300.
17. Ford D, Easton DF, Stratton M et al. Genetic heterogeneity and penetrance analysis of the BRCA1 and BRCA2 genes in breast cancer families. The Breast Cancer Linkage Consortium. Am J Hum Genet 1998; 62(3): 676 – 689.
18. Thompson D, Easton DF. Cancer Incidence in BRCA1 mutation carriers. J Natl Cancer Inst 2002; 94(18): 1358 – 1365.
19. Antoniou A, Pharoah PD, Narod S et al. Average risks of breast and ovarian cancer associated with BRCA1 or BRCA2 mutations detected in case Series unselected for family history: a combined analysis of 22 studies. Am J Hum Genet 2003; 72(5): 1117 – 1130.
20. Evans DG, Shenton A, Woodward E et al. Penetrance estimates for BRCA1 and BRCA2 based on genetic testing in a Clinical Cancer Genetics service setting: Risks of breast/ ovarian cancer quoted should reflect the cancer burden in the family. BMC Cancer 2008; 8 : 155.
21. Cancer Research.uk [homepage on the Internet]. Breast cancer risk in twins. Available from: http:/ / www.cancerresearchuk.org/ cancer ‑ help/ about ‑ cancer/ cancer ‑ questions/ breast ‑ cancer ‑ risk‑in‑twins#cancel.
22. Försti A, Luo L, Vorechovsky I et al. Allelic imbalance on chromosomes 13 and 17 mutation analysis of BRCA1 and BRCA2 genes in monozygotic twins concordant for breast cancer. Carcinogenesis 2001; 22(1): 27 – 33.
23. Miesfeldt S, Turner BL, Lovell MA et al. A novel BRCA1 mutation in an identical twin pair with similar clinical histories. Cancer Genet Cytogenet 1998; 100(1): 43 – 48.
24. Delgado L, Fernandéz G, González A et al. Hereditary breast cancer associated with germline BRCA2 mutation in identical female twins with similar disease expression. Cancer Genet Cytogenet 2002; 133(1): 24 – 28.
25. Wistuba II, Tomlison GE, Behrens C et al. Two identical triplet sisters carrying a germline BRCA1 gene mutation acquire very similar breast cancer somatic mutations at multiple other sites throughout the genome. Genes Chromosomes and Cancer 2000; 28(4): 359 – 369.
26. Diez O, Brunet J, Sanz E et al. Differences in phenotypic expression of a new BRCA1 mutation in identical twins. Lancet 1997; 350(9079): 713.
27. Lasa A, Ramón y Cajal T, Llort G et al. Copy number variations are not modifiers of phenotypic expression in pair of identical twins carrying a BRCA1 mutation. Breast Cancer Res Treat 2010; 123(3): 901 – 905.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2013 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- I „pouhé“ doporučení znamená velkou pomoc. Nasměrujte své pacienty pod křídla Dobrých andělů
-
Všetky články tohto čísla
- Editorial
- Thalidomid v léčbě mnohočetného myelomu se zaměřením na kombinaci s bortezomibem
- Karcinom prostaty, aktuální dilema uroonkologie. Jak prospět ohroženým pacientům a neuškodit těm ostatním
- Erratum
- Inhibice signalizace B buněčným receptorem: první cílená léčba u chronické lymfocytární leukemie a dalších B buněčných lymfomů
- Udržiavacia liečba lenalidomidom u pacientov s mnohopočetným myelómom
- Léčba průlomové bolesti u onkologických pacientů
- Komunikácia ako súčasť suportívnej terapie v onkológii
- Výsledky kurativní chemoradioterapie u pacientů s karcinomy anu
- Pacientka s metastatickým karcinoidem z pohárkových buněk
- Karcinom prsu u monozygotních dvojčat
- Informace z České onkologické společnosti
- Zajímavé případy z nutriční péče v onkologii
- Léčba závislosti na tabáku
-
Onkologie v obrazech
Rozměrná regionální metastáza melanomu - Prof. MU Dr. Ľudovít Milan Jurga, DrSc. – významné jubileum
- Jubileum pana profesora MU Dr. Dalibora Ondruše, DrSc.
- Jaroslav Bakeš (1871–1930): lékař, na něhož se zapomnělo / Gustav Novotný
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Karcinom prostaty, aktuální dilema uroonkologie. Jak prospět ohroženým pacientům a neuškodit těm ostatním
- Výsledky kurativní chemoradioterapie u pacientů s karcinomy anu
- Komunikácia ako súčasť suportívnej terapie v onkológii
- Udržiavacia liečba lenalidomidom u pacientov s mnohopočetným myelómom
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



