-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Thalidomid v léčbě mnohočetného myelomu se zaměřením na kombinaci s bortezomibem
Thalidomide in the Treatment of Multiple Myeloma: Focus on Combination with Bortezomib
Thalidomide, the first clinically available immunomodulatory drug, reaches monotherapy treatment response in about 1/ 3 of significantly pretreated patients with multiple myeloma, and in combination with glucocorticoids approximately 50% response rate. After addition of conventional cytostatic into the triple combination, therapeutic response is achieved in 80% of untreated patients or about 60% of pretreated patients. Therapeutic response is achieved even in 1/3 of patients with refractory multiple myeloma resistant to other available treatment. With regard to the frequency of adverse effects, particularly peripheral polyneuropathy, its use as maintenance therapy was nearly abandoned. The combination of thalidomide and bortezomib has a high therapeutic potential that was accompanied by a high frequency of peripheral polyneuropathy in entry studies. After optimizing bortezomib schedule and route of administration, which lead to significant reduction in the frequency of polyneuropathy, this combination is currently a very interesting therapeutic alternative for clinical practice. This is one of the most economically available treatment regimens combining the benefits of two major drug classes in the treatment of multiple myeloma – proteasome inhibitor and imunumodulatory drugs. There is also a renewed interest in thalidomide following sharp decline in its use in recent years in the Czech Republic. Comprehensive work is focused on summarizing the long‑term experience with thalidomide, with special reference to combination with bortezomib.
Key words:
multiple myeloma – thalidomide – bortezomib – immunomodulatory drugs
Autoři: R. Hájek; H. Plonková; J. Gumulec
Působiště autorů: Klinika hematoonkologie LF OU a FN Ostrava
Vyšlo v časopise: Klin Onkol 2013; 26(3): 163-169
Kategorie: Přehled
Souhrn
Thalidomid, první klinicky dostupný imunomodulační lék, dosahuje v monoterapii léčebné odpovědi asi u 1/ 3 významně předléčených nemocných s mnohočetným myelomem, v kombinaci s glukokortikoidy asi 50 % léčebných odpovědí. Po přidání konvenčního cytostatika do trojkombinace dosahují léčebné odpovědi až u 80 % nepředléčených nemocných či asi 60 % u předléčených nemocných. Léčebná odpověď je dosažena i u 1/3 refrakterních nemocných s mnohočetným myelomem s rezistencí na jinou dostupnou léčbu. S ohledem na četnost nežádoucích účinků, zvláště periferní polyneuropatie, bylo jeho používání v udržovací léčbě téměř opuštěno. Kombinace thalidomidu s bortezomibem má vysoký léčebný potenciál, který v proběhlých vstupních studiích provázela právě vysoká četnost periferní polyneuropatie. Optimalizace režimů s bortezomibem a změna způsobu jeho aplikace vedoucí k významnému snížení četnosti periferní polyneuropatie znovu tuto léčebnou kombinaci činí velmi zajímavou léčebnou alternativou pro klinickou praxi. Jde o jeden z nejúčinnějších ekonomicky dostupných léčebných režimů kombinující výhody dvou významných lékových skupin v léčbě mnohočetného myelomu – inhibitoru proteazomu a imunomodulační látky. Obnovuje se tak zájem o thalidomid, jehož použití v České republice v posledních letech výrazně klesalo. Souhrnná práce je zaměřena na shrnutí dlouhodobých zkušeností s thalidomidem se zvláštním zřetelem na kombinovaný režim s bortezomibem.
Klíčová slova:
mnohočetný myelom – thalidomid – bortezomib – imunomodulační látkyÚvod
Thalidomid, derivát kyseliny glutamové, je prvním zástupcem skupiny imunomodulačních léků pro léčbu mnohočetného myelomu (MM). Za objevem účinku thalidomidu u nemocných s MM stojí kolektiv pracovníků Arkansaské univerzity [1,2]. Mechanizmus účinku thalidomidu není doposud plně vysvětlen a je téměř jisté, že se na celkovém efektu podílí hned několik různých zásahů na úrovni nádorové buňky a jejího okolí [3]. Thalidomid je, podobně jako další léky této skupiny, teratogenní lék. V České republice se používal od roku 2000 thalidomid darovaný firmou Grünenthal. Od roku 2007, kdy byl registrován v EU, je plně hrazen v primoléčbě nemocných s MM. Cena thalidomidu je oproti jiným novým lékům akceptovatelná (asi 3 000 Kč měsíčně při dávce 100 mg denně). Po zavedení prvního inhibitoru proteazomu, bortezomibu do primoléčby MM a lenalidomidu (účinnější imunomodulační látky bez nežádoucího účinku periferní polyneuropatie – PN) do léčby relapsu onemocnění došlo k redukci spotřeby a použití thalidomidu v České republice. Důvodem byla především řada vedlejších účinků thalidomidu. Nicméně několik studií, včetně randomizovaných, prokázalo vysokou účinnost kombinace bortezomibu s thalidomidem. Vedlejší účinky, zvláště četnost PN, však byly při standardním podání velké. Další optimalizace této kombinace a především možnost podkožního použití bortezomibu s významně nižší četností vedlejších účinků znovu tuto kombinaci činí zajímavou pro klinické použití. Navíc díky nízké ceně thalidomidu můžeme v reálné praxi používat poprvé kombinovaný režim se zástupci obou klíčových skupin léků účinných u MM – imunomodulační lék (thalidomid) s inhibitorem proteazomu (bortezomib). To nám dává možnost léčit MM podle nejnovějších znalostí, neboť na základě klonální teorie může existovat u jednoho nemocného s MM již vstupně při stanovení diagnózy více klonů plazmocytů s rozdílnými charakteristikami včetně senzitivity na léčbu. Jejich poměr se u daného nemocného mění v čase a v závislosti na léčbě [4]. Toto zjištění zcela zásadně změnilo náš pohled na účinnost jednoduché kombinované léčby postavené na bázi jednoho nového léku. Naopak jsou dnes upřednostněny kombinace se dvěma novými léky, což je v souladu s významnými úspěchy léčby, včetně vyléčení nemocných léčených intenzivními sekvenčními léčebnými postupy sestávajícími z nejúčinnějších léků [5]. Ve stávající době je optimalizace použití thalidomidu ukončena. Toto review je věnováno vývoji role thalidomidu v léčbě MM, zvláště pak stávající nové roli v kombinaci s bortezomibem.
Thalidomid u nově diagnostikovaných mnohočetných myelomů
Z etických důvodů nejsou k dispozici klinické studie hodnotící efekt thalidomidu u nově diagnostikovaných mnohočetných myelomů (NDMM). Dnes se používá thalidomid především v kombinovaných režimech, které dnes patří mezi standardní postupy současnosti u nově diagnostikovaných nemocných s MM. U juniorů, nemocných indikovaných k autologní transplantaci, vedlo retrospektivní srovnání indukčních předtransplantačních režimů 4krát VAD (vinkristin, doxorubicin, dexametazon) a 4krát TD (thalidomid, dexametazon) italských autorů [6] vždy u 100 pacientů k přesvědčivě lepším výsledkům skupiny TD (celková léčebná odpověď 76 % vs 52 %, p < 0,001). Podobně dopadlo srovnání TAD (thalidomid, adriamycin, dexametazon) vs VAD ve stejné indikaci v randomizované studii HOVON 50/ GMMG ‑ HD3, ve které celková léčebná odpověď byla po 4krát TAD 80 % a po 4krát VAD 63 %. Tyto výsledky se navíc promítly i do lepší léčebné odpovědi po provedení autologní transplantace [7]. Morgan et al prokázali ve studii MRC IX signifikantní zvýšení léčebných odpovědí pomocí režimu CTD (cyklofosfamid, thalidomid, dexametazon) oproti konvenčnímu indukčnímu režimu (82,5 % vs 71,2 %; OR 1,91; 95% CI 1,44 – 2,55; p < 0,0001) a tyto rozdíly v léčebné odpovědi byly sledovatelné i po následném provedení autologní transplantace (CR po transplantaci 50,0 % vs 37,2 %; p = 0,00052). Nebyl prokázán statisticky významný rozdíl v přežití bez progrese (progression-free survival – PFS) a v celkovém přežití (overall survival – OS), třebaže byl pozorovaný trend pro lepší OS při použití režimu CTD [8].
Ještě pozitivnější jsou výsledky pro seniory. K dispozici jsou dnes výsledky celkem osmi velkých randomizovaných klinických studií, v šesti z nich byl srovnáván a potvrzen zásadní přínos přidání thalidomidu k původnímu standardu léčby, kombinaci melfalanu s prednisonem (MPT vs MP) [9 – 14]. Přehled randomizovaných klinických studií je uveden v tab. 1. Kromě významně lepší celkové léčebné odpovědi (5 z 6 studií) a prodloužení doby do relapsu onemocnění (4 ze 6 studií) bylo zlepšeno i celkové přežití ve 2 francouzských studiích (IFM 99 – 06 a IFM 01 – 01). Ve francouzské studii IFM 99 – 06 dosáhl režim MPT (melfalan, prednison, thalidomid) lepších výsledků nejen oproti standardnímu režimu MP (melfalan, prednison) (PFS 17,8 vs 27,5 měsíce, p < 0,0001), ale i oproti režimu s využitím 2 × 100 mg/ m2 melfalanu s podporou periferních kmenových buněk (PFS 19,9 vs 27,5 měsíce; p < 0,0001) [10]. Dvě metaanalýzy jednoznačně potvrdily přínos MPT režimu v primoléčbě [15,16]. Přínos přidání thalidomidu k režimu MP statisticky významně zlepšil celkové přežití (HR = 0,83; 95% CI 0,73 – 0,94; p = 0,004), což v reálné praxi znamená prodloužení mediánu celkového přežití o 6,6 měsíce (32,7 vs 39,3 měsíce pro MPT), respektive o 20 % oproti režimu MP [15]. Podobné závěry platily pro PFS (20,3 vs 14,9 měsíce, HR = 0,68; 95% CI 0,61 – 0,76; p < 0,0001). Nebylo pozorováno, že by výsledky léčby ovlivňovaly známé prognostické faktory. Nebyl pozorovaný rozdíl v přežití od následné progrese v závislosti na typu léčby [15]. Morgan et al porovnali v randomizované klinické studii režim CTD (cyklofosfamid, thalidomid a dexametazon) oproti MP režimu [17]. I v této studii byla léčebná odpověď signifikantně lepší ve skupině CTD (63,8 % vs 32,6 %; p < 0,0001) s vyšším počtem CR (13,1 % vs 2,4 %) a celkové přežití korelovalo s hloubkou léčebné odpovědi (p < 0,0001) a příznivým nálezem chromozomálních abnormalit (p < 0,001), třebaže rozdíly v PFS a OS nebyly celkově pozorovány [17]. Příliš intenzivní nebo nesprávné používání kombinace léků a jejich dávek mohou být pro seniory nadměrnou zátěží a toxicita režimu negativně ovlivní celkové výsledky. Příkladem je randomizovaná klinická studie srovnávající režim MP oproti režimu thalidomid-dexametazon (TD). Kombinace vstupní dávky thalidomidu 400 mg s vyšší dávkou glukokortikoidu vedla k vysoké toxicitě zvláště u starších věkových skupin. To mělo negativní dopad na dobu do relapsu a celkové přežití v rameni TD, takže celkové výsledky režimu TD byly horší než výsledky standardně používaného režimu MP [18]. I tato studie napomohla k optimalizaci dávkování thalidomidu, které je v podstatě ukončeno. Původní startovací dávky 400 – 800 mg byly přehodnoceny, neboť toxicita (PN, spavost a zácpa) byla extrémní [2]. Optimální startovací dávkou je 200 mg v monoterapii a 100 – 200 mg v kombinovaných režimech pro indukční léčbu a 100 mg pro konsolidační nebo udržovací léčbu [19,20]. I když je zjevné, že rychlost a hloubka léčebné odpovědi souvisí s použitou dávkou, i minimální dávky (25 – 50 mg) mohou být u určitých nemocných velmi účinné [21,22].
Tab. 1. První linie léčby u nově diagnostikovaného mnohočetného myelomu (klinické studie fáze III). 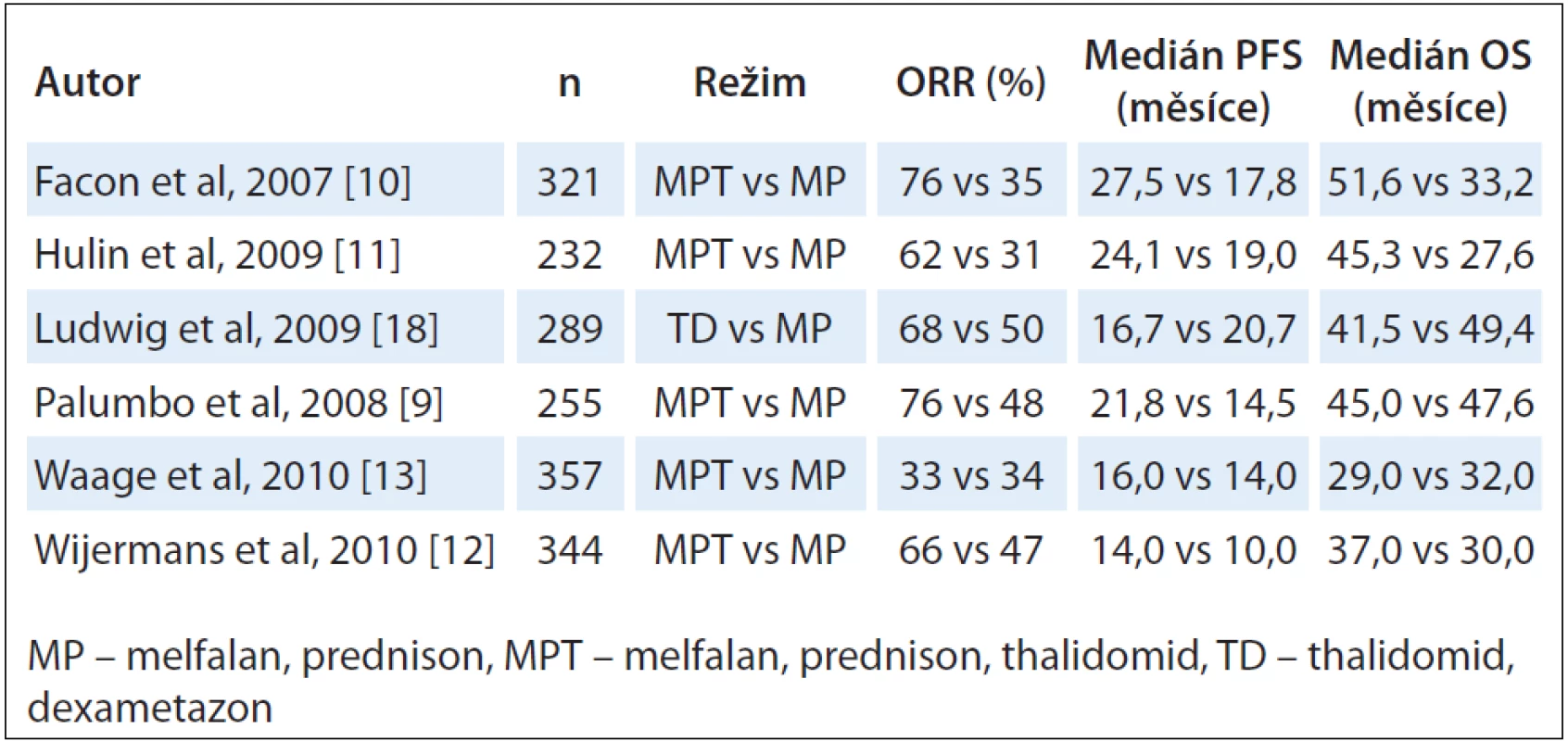
Thalidomid v udržovací léčbě MM v rámci primoléčby
Metaanalýza randomizovaných klinických studií fáze III s udržovací léčbou thalidomidem potvrzuje přínos po provedení autologní transplantace. Došlo k statisticky významnému prodloužení PFS v šesti studiích a prodloužení celkového přežití ve třech studiích. Naopak je problematické hodnocení udržovací léčby po standardním režimu melfalan-prednison s thalidomidem nebo bez thalidomidu. Problémem udržovací léčby je toxicita thalidomidu, zvláště pak PN. Déle než rok toleruje léčbu thalidomidem méně než jedna třetina nemocných. V této fázi, kdy jsou pro udržovací léčbu dostupné méně toxické léky, je thalidomid doporučen jako součást krátkodobých intenzivních konsolidací [23,24]. To je doporučeno i v guidelines České myelomové skupiny [20]. Oproti bortezomibu měl thalidomid hodnocený v udržovací léčbě po provedení autologní transplantace horší výsledek (PFS 36 vs 27 měsíců, p = 0,002) [25].
Thalidomid u relabujících a refrakterních MM (RRMM)
V monoterapii dosahuje thalidomid léčebné odpovědi u asi 30 % nemocných s mediánem přežití 14 (5 – 58) měsíců, což jsou podobné výsledky jako pro monoterapii dexametazonu [26,27]. Nejcennější srovnání a ujasnění významu thalidomidu u RRMM poskytla randomizovaná klinická studie Optimum srovnávající monoterapii thalidomidu (100 mg vs 200 mg vs 400 mg) s dexametazonem RRMM [28]. Celková léčebná odpověď byla v ramenech DEX, THAL 100, THAL 200 a THAL 400 25 %, 21 %, 18 % a 21 %, s minimem kompletních remisí (2 – 3 %) a mediánem doby do progrese (time to progression – TTP) 6,1, 7,0, 7,6 a 9,1 měsíce. Celkové přežití bylo podobné, ale medián trvání léčebné odpovědi (duration of response – DOR) byl signifikantně prodloužen v ramenech s thalidomidem. Ve studii byly pozorovány všechny obvyklé nežádoucí účinky thalidomidu, které byly jasně závislé na kumulativní dávce. Studie Optimum tak potvrdila, že dávka 100 – 200 mg je optimální z pohledu vyváženosti účinnosti a nežádoucích účinků. Podobné výsledky přinesla francouzská studie, která jasně prokázala, že 400 mg oproti 100 mg denně nepřináší žádné zlepšení výsledků léčby, jen vyšší toxicitu léčby [29].
Vyšší počet léčebných odpovědí 46 % (95% CI 42 – 51 %) byl pozorován při analýze studií u RRMM s použitím thalidomidu s dexametazonem [30]. Byla publikována řada studií s využitím troj ‑ a čtyřkombinací včetně prací českých autorů [31,32]. Recentní analýza České myelomové skupiny u 1 156 nemocných léčených thalidomidem v letech 2000 – 2011 potvrdila účinnost thalidomidových režimů jak v primoléčbě, tak v léčbě relabujícího MM. Celková léčebná odpověď (overall response rate – ORR) byla 63,6 % včetně 13,6 % kompletní remise (CR) a 22,0 % velmi dobré parciální remise (VGPR). Celkové přežití od zahájení léčby (se zahrnutím nemocných v primoléčbě včetně transplantovaných jedinců) činilo 41,9 měsíce a interval TTP 16,6 měsíce. Byla potvrzena vyšší účinnost v kombinovaných režimech (CTD, MPT, VTD, CVTD) oproti režimu TD i monoterapii thalidomidem (TTP 18,1 vs 12,2 vs 9,1 měsíce). Lepších výsledků bylo dosaženo u nemocných léčených thalidomidem v primoléčbě ve srovnání s léčbou progrese onemocnění. Významný efekt (ORR 33,3 %) byl potvrzen též při opakované léčbě thalidomidem v pozdních fázích onemocnění [33].
Kombinované režimy s thalidomidem a bortezomibem
V několika klinických studiích byla potvrzena lepší léčebná účinnost kombinovaného režimu s imunomodulačním lékem a inhibitorem proteazomu. Randomizovaná klinická studie italských autorů zhodnotila efekt kombinace thalidomidu, bortezomibu a dexametazonu v indukční léčbě před autologní transplantací kmenových buněk (autologous stem cell transplantation – ASCT) a konsolidační léčbě po druhé ASCT u nově diagnostikovaných nemocných s mnohočetným myelomem. Režim VTD (bortezomib, thalidomid, dexametazon) oproti TD signifikantně zvýšil počet celkových léčebných odpovědí po indukci (93 % vs 79 %, p < 0,0001; CR ‑ nCR 31 % vs 11 %, p < 0,0001; ≥ VGPR 62 % vs 28 %, p < 0,0001). Po druhé ASCT a konsolidační léčbě vliv režimu VTD na lepší celkovou léčebnou odpověď přetrvával (93 % vs 84 %, p = 0,001). Interval PFS při 3letém sledování byl významně prodloužen u skupiny nemocných, kteří byli léčeni režimem VTD a double ASCT (68 % vs 56 %, p < 0,006). Četnost nežádoucích účinků stupně 3 a 4 byla však významně vyšší ve skupině léčené VTD s konvenčním intenzivním podáním bortezomibu (56 % vs 33 %, p < 0,0001) včetně PN (10 % vs 2 %, p = 0,0004) [34]. Španělská myelomová skupina prokázala efekt VTD vs TD vs VBMCP/ VBAD/ B (vinkristin, BCNU, melfalan, cyklofosfamid, prednison/ vinkristin, BCNU, doxorubicin, dexametazon/ bortezomib) rovněž u nemocných s NDMM zařazených k autologní transplantaci. Počet kompletních remisí po indukci a ASCT byl vyšší v rameni VTD oproti TD (46 % vs 24 %, p = 0,004) nebo VBMCP/ VBAD/ B (46 % vs 38 %, p = 0,1). Medián PFS byl statisticky významně prodloužen ve skupině léčené VTD (56,2 vs 28,2 vs 35,5 měsíce, p = 0,01). Četnost PN stupně ≥ 3 byla nejvyšší ve skupině VTD (14 % vs 5 % vs 9 %) [35]. Studie prokázaly, že kombinovaný režim VTD je jedním z nejúčinnějších indukčních režimů v kombinaci s ASCT. Vede k vysokému procentu dosažených léčebných odpovědí, které přetrvávají i po provedení ASCT a následně vedou k prodloužení intervalů doby do progrese onemocnění. Režim je však zatížen vyšší četností (10 – 14 %) závažné PN stupně ≥ 3.
V rámci indukční léčby před ASCT u nemocných s nově diagnostikovaným mnohočetným myelomem porovnala randomizovaná studie IFM2007 - 02 režim vTD s redukovanou dávkou bortezomibu s režimem VD. Podány byly čtyři 21denní cykly vTD (redukce bortezomibu na 1 mg/ m2, den 1, 4, 8 a 11; thalidomid 100 mg/ den, den 1 – 21; dexametazon 40 mg, den 1 – 4 a 8 – 11) nebo VD (bortezomib v konvenčním intenzifikovaném podání 1,3 mg/ m2, den 1, 4, 8 a 11; dexametazon ve stejném dávkování jako v rameni vTD). Výsledky léčebných odpovědí byly následovné: režim vTD zvýšil nesignifikantně celkový počet léčebných odpovědí po indukci (90 % vs 81 %; p = 0,096, ≥ near CR 31 % vs 22 %; p = 0,15). Pozitivní výsledky přetrvávaly i v hodnocení celkové léčebné odpovědi po ASCT (92 % vs 84 %; p = 0,33). Podstatným nálezem bylo výrazné snížení výskytu PN stupně ≥ 2 v rameni vTD z 28 % na 16 % (p = 0,04). Četnost PN stupně ≥ 3 byla v obou ramenech nízká (3 % vs 6 %). Kombinace vTD je novou alternativou indukční léčby před autologní transplantací, která vykazuje vysokou účinnost při velmi dobré toleranci [36].
U nově diagnostikovaných nemocných s MM, kteří nebyli vhodní k vysokodávkované chemoterapii, byla provedena randomizovaná klinická studie porovnávající trojkombinaci VMP (bortezomib, melfalan, prednison) s režimem VTP (bortezomib, thalidomid, prednison). Nebyly zaznamenány statisticky významné rozdíly ORR, OS a PFS mezi oběma rameny (ORR 80 % vs 81 %; p = 0,9), celkové přežití při 3letém sledování bylo 74 % vs 65 %; p = 0,3, PFS 34 vs 25 měsíců; p = 0,1. Výskyt PN stupně 3 a 4 byl podobný (9 % ve skupině VMP vs 7 % ve skupině VPT) [37]. Při srovnání léčebné účinnosti VMPT (bortezomib, melfalan, prednison, thalidomid v dávce 50 mg) vs VMP (bortezomib, melfalan, prednison) u seniorů bylo dosaženo vyššího zastoupení CR (38 % vs 24 %; p < 0,001) a 3letého intervalu doby do progrese (56 % vs 41 %; HR 0,67; 95% CI: 0,50 – 0,90; p = 0,008) při léčbě VMPT. Zásadní v této studii bylo zjištění, že změna v podávání bortezomibu z 2krát týdně na 1krát týdně signifikantně redukovala četnost těžké PN z 16 % na 3 % (p < 0,001) bez snížení efektu léčby [38].
Efekt kombinované léčby thalidomidu s bortezomibem byl potvrzen i u nemocných s progredujícím mnohočetným myelomem po autologní transplantaci. Garderet et al v analýze s použitím VTD a TD u relabujícího MM po ASCT zaznamenali signifikantně vyšší počet CR a nCR ve skupině léčené VTD (45 % vs 25 %; p = 0,001). V rameni VTD byl po dvou letech pozorován trend k prodloužení celkového přežití (71 % vs 65 %; p = 0,093). Četnost PN stupně ≥ 3 ve skupině VTD při konvenčním podání bortezomibu však dosáhla 31 % vs 14 % při TD, p = 0,001 [39].
Přehled randomizovaných klinických studií hodnotících efekt kombinované léčby thalidomidu a bortezomibu u NDMM a v relapsu onemocnění je uveden v tab. 2.
Tab. 2. Kombinované režimy s thalidomidem a bortezomibem (klinické studie fáze III). 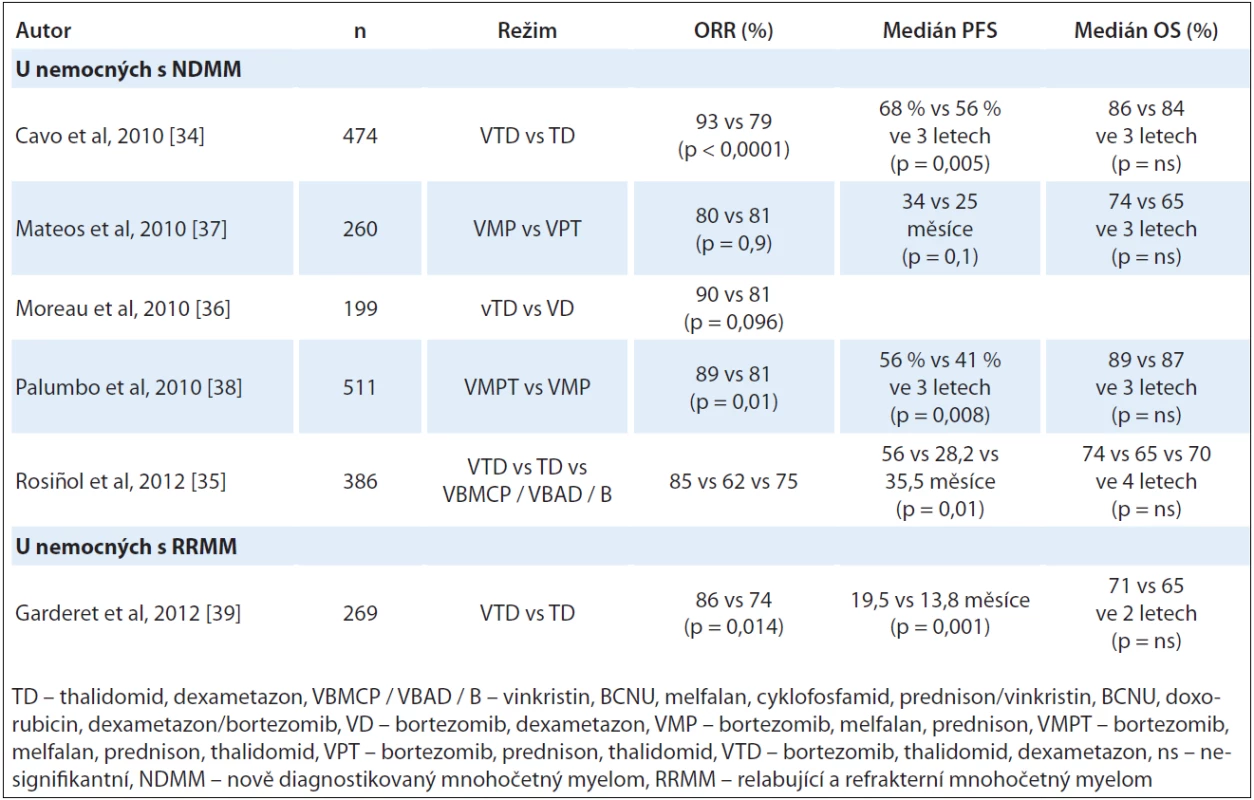
Kombinace thalidomidu s jinými inhibitory proteazomu
Nově jsou prezentovány výsledky kombinované léčby thalidomidu s inhibitorem proteazomu druhé generace – carfilzomibem. Ve studii fáze II holandských autorů bylo režimem CTD (carfilzomib, thalidomid, dexametazon) v indukční léčbě před ASCT a konsolidační léčbě po ASCT dosaženo celkových léčebných odpovědí v 90 % (≥ CR 35 %, ≥ VGPR 70 %). Medián PFS byl 97 % ve 12 měsících, celkové přežití 100 % v 10,4 měsíce. Režim byl velmi dobře tolerován. Periferní polyneuropatie stupně 2 a 3 byla zaznamenána v 17 % [40]. K dispozici je tak nově v rámci klinických studií další, vysoce účinný režim na bázi kombinace imunomodulačního léku a inhibitoru proteazomu, klinicky velmi dobře tolerabilní díky absenci nežádoucího účinku PN při použití carfilzomibu.
Vedlejší účinky thalidomidu
Použití thalidomidu má svá rizika a je provázeno řadou vedlejších účinků a řadou profylaktických opatření. Mezi časté léčbu komplikující nežádoucí účinky thalidomidu patří senzomotorická PN, tromboembolizmus, zácpa, ospalost, třes, suchá kůže a sliznice, alergický exantém. Thalidomid je teratogenní lék a při jeho použití je nezbytné dodržet přesně stanovený bezpečnostní program [19]. Vzhledem ke zvýšené četnosti tromboembolických komplikací, zejména při použití kombinovaných režimů, existuje doporučení povinné profylaxe tromboembolické nemoci, nejčastěji s využitím nízkomolekulárního heparinu nebo kyseliny acetylsalicylové u méně rizikových nemocných [20].
Nejzávažnějším z nežádoucích účinků je senzomotorická PN, jejíž vznik je závislý na kumulativní dávce thalidomidu. Neexistuje prevence a jediným správným krokem je velmi včasné zastavení léčby thalidomidem. Redukční kroky jsou možné, ale v řadě případů se jen zpomalí zhoršování PN. Reverzibilita thalidomidové PN je malá a ke zlepšení stavu dochází po dlouhé době.
Studie srovnávající nejen efekt, ale i bezpečnost jednoduché kombinované léčby postavené na bázi thalidomidu oproti režimům se začleněním bortezomibu jako dalšího léku s neurotoxickým potenciálem potvrdily lepší léčebné výsledky, avšak i další zvýšení četnosti PN při kombinované léčbě thalidomidu s bortezomibem. Výskyt PN stupně ≥ 3 ve studii GIMEMA VTD vs TD v indukční léčbě před ASCT a konsolidační léčbě po druhé ASCT u nemocných s nově diagnostikovaným MM byl významně vyšší v trojkombinaci VTD (10 % vs 2 %; p = 0,0004) [34]. Signifikantně vyšší četnost PN stupně ≥ 3 při použití režimů v této kombinaci byla zaznamenána i dalšími klinickými studiemi [35].
Naproti tomu však stojí pozitivní výsledky analýz s kombinovanými režimy thalidomidu a bortezomibu, ve kterých redukce dávky bortezomibu (režim vTD vs VD ve studii IFM2007 - 02) [36] nebo podávání bortezomibu jednou týdně (VMPT vs VMP u seniorů) [38] signifikantně redukovaly četnost těžké PN bez snížení efektu léčby. K zásadnímu snížení výskytu PN přispívá i varianta s podkožním podáním bortezomibu [41]. Četnost PN stupně ≥ 3 při léčbě režimy s thalidomidem a bortezomibem je uvedena v tab. 3.
Tab. 3. Četnost PN stupně ≥ 3 při léčbě režimy s thalidomidem a bortezomibem i.v. a bortezomibem s.c. 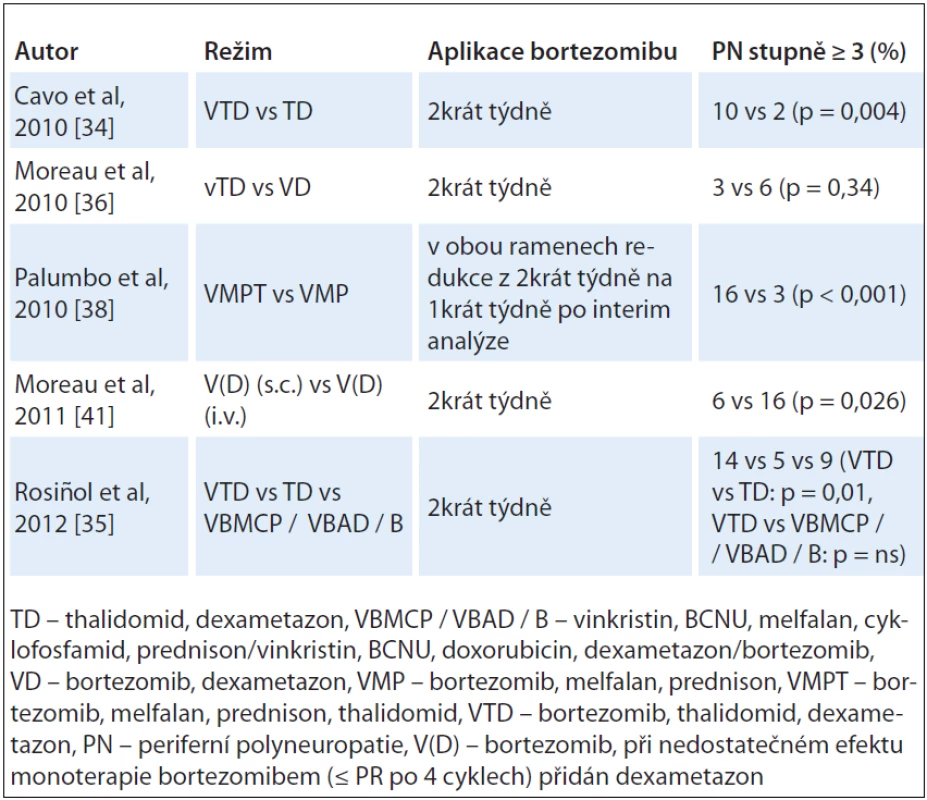
Závěr
Thalidomid je nový účinný lék zavedený do léčby mnohočetného myelomu v první dekádě tohoto století. Vysokou účinnost prokázal u všech věkových skupin pacientů, v primoléčbě i v léčbě relabujících forem mnohočetného myelomu. Kombinace thalidomidu s glukokortikoidy a konvenčním cytostatikem významně zlepšila léčebné výsledky, které se promítly i do prodloužení přežití nemocných. Tyto kombinované režimy se zastoupením thalidomidu jako jednoho nového léku však nevedou k vyléčení.
Léčba thalidomidem je provázena řadou vedlejších účinků. Původní relativně vysoké startovací dávky 400 – 800 mgbyly s ohledem na extrémní toxicitu přehodnoceny na 100 – 200 mg v kombinovaných režimech pro indukční léčbu a 100 mg pro konsolidační léčbu. Z důvodu nežádoucích účinků, zvláště PN, je také v současné době od použití thalidomidu v udržovací léčbě téměř upuštěno, respektive je vhodná a přínosná jen u nemocných bez doprovodných závažnějších nežádoucích účinků.
Recentní výsledky klinických studií potvrzují vysoký léčebný potenciál kombinace thalidomidu a bortezomibu v primoléčbě i v léčbě relapsu mnohočetného myelomu. Podání bortezomibu v týdenním intervalu a podkožně zvyšuje bezpečnost léčby při zachování jejího efektu a umožňuje lépe kombinovat dva léky s neurotoxickým potenciálem, v tomto případě s thalidomidem. Nemocným se takto otevírá nová perspektiva léčby režimem založeným na kombinaci dvou vysoce účinných léků při akceptovatelné toxicitě a ekonomické zátěži zdravotnictví.
Poděkování:
Děkujeme Ing. Ondruschové za administrativní podporu při úpravě publikace, tvorbě tabulek a formátování textu a literatury.
Práce byla podpořena prostředky institucionální podpory MZ ČR č. 1 RVO-FNOs/2012. Projekt byl rovněž financován v rámci Institucionálního rozvojového plánu OU v Ostravě v roce 2012. Finanční prostředky přiděluje MŠMT.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
prof. MUDr. Roman Hájek, CSc.
Klinika hematoonkologie
LF OU a FN Ostrava
17. listopadu 1790
708 52 Ostrava-Poruba
e-mail: roman.hajek@fno.cz
Obdrženo: 15. 1. 2013
Přijato: 3. 3. 2013
Zdroje
1. Barlogie B, Tricot G, Anaissie E. Thalidomide in the management of multiple myeloma. Semin Oncol 2001; 28(6): 577 – 582.
2. Singhal S, Mehta J, Desikan R et al. Antitumor activity of thalidomide in refractory multiple myeloma. N Engl J Med 1999; 341(21): 1565 – 1571.
3. Davies FE, Raje N, Hideshima T et al. Thalidomide and immunomodulatory derivatives augment natural killer cell cytotoxicity in multiple myeloma. Blood 2001; 98(1): 210 – 216.
4. Keats JJ, Chesi M, Egan JB et al. Clonal competition with alternating dominance in multiple myeloma. Blood 2012; 120(5): 1067 – 1076.
5. Usmani SZ, Crowley J, Hoering A et al. Improvement in long‑term outcomes with successive Total Therapy trials for multiple myeloma: are patients now being cured? Leukemia 2013; 27(1): 226 – 232.
6. Cavo M, Zamagni E, Tosi P et al. Superiority of thalidomide and dexamethasone over vincristine ‑ doxorubicindexamethasone (VAD) as primary therapy in preparation for autologous transplantation for mulitple myeloma. Blood 2005; (106)1 : 35 – 39.
7. Lokhorst HM, Breitkreuz B, van der Holt E et al. First intermin analysis of the joint HOVON ‑ 50/ GMMG ‑ HD3 randomized study effect of thalidomide combined with adriamycin, dexamethasone and HD melphalan in patients wit multiple myeloma. Haematologica 2005; 90 (Suppl 1): PL10.06.
8. Morgan GJ, Davies FE, Gregory WM et al. National Cancer Research Institute (NCRI) Haematological Oncology Clinical Studies Group. Cyclophosphamide, thalidomide, and dexamethasone as induction therapy for newly diagnosed multiple myeloma patients destined for autologous stem ‑ cell transplantation: MRC Myeloma IX randomized trial results. Haematologica 2012; 97(3): 442 – 450.
9. Palumbo A, Bringhen S, Liberati AM et al. Oral melphalan, prednisone, and thalidomide in elderly patients with multiple myeloma: updated results of a randomized controlled trial. Blood 2008; 112(8): 3107 – 3114.
10. Facon T, Mary JY, Hulin C et al. Intergroupe Francophone du Myélome. Melphalan and prednisone plus thalidomide versus melphalan and prednisone alone or reduced ‑ intensity autologous stem cell transplantation in elderly patients with multiple myeloma (IFM 99 - 06): a randomised trial. Lancet 2007; 370(9594): 1209 – 1218.
11. Hulin C, Facon T, Rodon P et al. Efficacy of melphalan and prednisone plus thalidomide in patients older than 75 years with newly diagnosed multiple myeloma: IFM 01/ 01 trial. J Clin Oncol 2009; 27(22): 3664 – 3670.
12. Wijermans P, Schaafsma M, Termorshuizen F et al. Phase III study of the value of thalidomide added to melphalan plus prednisone in elderly patients with newly diagnosed multiple myeloma: the HOVON 49 Study. J Clin Oncol 2010; 28(19): 3160 – 3166.
13. Waage A, Gimsing P, Fayers P et al. Melphalan and prednisone plus thalidomide or placebo in elderly patients with multiple myeloma. Blood 2010; 116(9): 1405 – 1412.
14. Beksac M, Haznedar R, Firatli ‑ Tuglular T et al. Addition of thalidomide to oral melphalan/ prednisone in patients with multiple myeloma not eligible for transplantation: results of a randomized trial from the Turkish Myeloma Study Group. Eur J Haematol 2011; 86(1): 16 – 22.
15. Fayers PM, Palumbo A, Hulin C et al. Thalidomide for previously untreated elderly patients with multiple myeloma: meta‑analysis of 1685 individual patient data from 6 randomized clinical trials. Blood 2011; 118(5): 1239 – 1247.
16. Kapoor P, Rajkumar SV, Dispenzieri A et al. Melphalan and prednisone versus melphalan, prednisone and thalidomide for elderly and/ or transplant ineligible patients with multiple myeloma: a meta‑analysis. Leukemia 2011; 25(4): 689 – 696.
17. Morgan GJ, Davies FE, Gregory WM et al. Cyclophosphamide, thalidomide, and dexamethasone (CTD) as initial therapy for patients with multiple myeloma unsuitable for autologous transplantation. Blood 2011; 118(5): 1231 – 1238.
18. Ludwig H, Hajek R, Tóthová E et al. Thalidomide ‑ dexamethasone compared with melphalan ‑ prednisolone in elderly patients with multiple myeloma. Blood 2009; 11315 : 3435 – 3442.
19. Hájek R, Maisnar V, Krejčí M. Thalidomid. Klinická farmakologie a farmacie. 2005; 19(1): 43 – 46.
20. Hájek R, Adam Z, Ščudla V et al. Doporučení vypracované Českou myelomovou skupinou, Myelomovou sekcí České hematologické společnosti a Slovenskou Myelómovou Spoločností pro diagnostiku a léčbu mnohočetného myelomu. Transfuze a hematologie dnes 2012; 18 (Suppl 1): 31 – 49.
21. Durie BG. Low‑dose thalidomide in myeloma: efficacy and biologic significance. Semin Oncol 2002; 29 (6 Suppl 17): 34 – 38.
22. Maisnar V, Radocha J, Büchler T et al. Monotherapy with low‑dose thalidomide for relapsed or refractory multiple myeloma: better response rate with earlier treatment. Eur J Haematol 2007; 79(4): 305 – 309.
23. Ludwig H, Durie BG, McCarthy P et al. IMWG consensus on maintenance therapy in multiple myeloma. Blood 2012; 119(13): 3003 – 3015.
24. van Rhee F, Szymonifka J, Anaissie E et al. Total therapy 3 for multiple myeloma: prognostic implications of cumulative dosing and premature discontinuation of VTD maintenance components, bortezomib, thalidomide, and dexamethasone, relevant to all phases of therapy. Blood 2010; 116(8): 1220 – 1227.
25. Sonneveld P, Schmidt ‑ Wolf IG , van der Holt B et al. Bortezomib induction and maintenance treatment in patients with newly diagnosed multiple myeloma: results of the randomized phase III HOVON ‑ 65/ GMMG ‑ HD4 trial. J Clin Oncol 2012; 30(24): 2946 – 2955.
26. Glasmacher A, Hahn C, Hoffmann F et al. A systematic review of phase ‑ II trials of thalidomide monotherapy in patients with relapsed or refractory multiple myeloma. Br J Haematol 2006; 132(5): 584 – 593.
27. Prince HM, Schenkel B, Mileshkin L. An analysis of clinical trials assessing the efficacy and safety of single‑agent thalidomide in patients with relapsed or refractory multiple myeloma. Leuk Lymphoma 2007; 48(1): 46 – 55.
28. Kropff M, Baylon HG, Hillengass J et al. Thalidomide versus dexamethasone for the treatment of relapsed and/ or refractory multiple myeloma: results from OPTIMUM, a randomized trial. Haematologica 2012; 97(5): 784 – 791.
29. Yakoub ‑ Agha I, Mary JY, Hulin C et al. Low‑dose vs high‑dose thalidomide for advanced multiple myeloma: a prospective trial from the Intergroupe Francophone du Myélome. Eur J Haematol 2012; 88(3): 249 – 259.
30. von Lilienfeld ‑ Toal M, Hahn ‑ Ast C, Furkert K et al. A systematic review of phase II trials of thalidomide/ dexamethasone combination therapy in patients with relapsed or refractory multiple myeloma. Eur J Haematol 2008; 81(4): 247 – 252.
31. Zemanova M, Scudla V, Adam Z et al. Low‑dose thalidomide regimens in therapy of relapsed or refractory multiple myeloma. Neoplasma 2008; 55(4): 345 – 349.
32. Krejci M, Gregora E, Straub J et al. Similar efficacy of thalidomide ‑ and bortezomib‑based regimens for first relapse of multiple myeloma. Ann Hematol 2011; 90(12): 1441 – 1447.
33. Minařík J, Pika T, Bačovský J et al. Thalidomid v léčbě mnohočetného myelomu po 10 letech – může nás ještě překvapit? In: Sborník abstrakt. XXVI. Olomoucké hematologické dny. Olomouc, 24. – 26. června 2012. Olomouc.
34. Cavo M, Tacchetti P, Patriarca F et al. Bortezomib with thalidomide plus dexamethasone compared with thalidomide plus dexamethasone as induction therapy before, and consolidation therapy after, double autologous stem ‑ cell transplantation in newly diagnosed multiple myeloma: a randomised phase 3 study. Lancet 2010; 376(9758): 2075 – 2085.
35. Rosiñol L, Oriol A, Teruel AI et al. Superiority of bortezomib, thalidomide, and dexamethasone (VTD) as induction pretransplantation therapy in multiple myeloma: a randomized phase 3 PETHEMA/ GEM study. Blood 2012; 120(8): 1589 – 1596.
36. Moreau P, Facon T, Attal M et al. Comparison of reduced‑dose bortezomib plus thalidomide plus dexamethasone (vTD) to bortezomib plus dexamethasone (VD) as induction treatment prior to ASCT in de novo multiple myeloma (MM): Results of IFM2007 - 02 study. ASCO Meeting Abstracts 2010 : 8014.
37. Mateos MV, Oriol A, Martinez ‑ Lopez J et al. Bortezomib, melphalan, and prednisone versus bortezomib, thalidomide, and prednisone as induction therapy followed by maintenance treatment with bortezomib and thalidomide versus bortezomib and prednisone in elderly patients with untreated multiple myeloma: a randomised trial. Lancet Oncol 2010; 11(10): 934 – 941.
38. Palumbo A, Bringhen S, Rossi D et al. Bortezomib ‑ melphalan ‑ prednisone ‑ thalidomide followed by maintenance with bortezomib ‑ thalidomide compared with bortezomib ‑ melphalan ‑ prednisone for initial treatment of multiple myeloma: a randomized controlled trial. J Clin Oncol 2010; 28(34): 5101 – 5109.
39. Garderet L, Iacobelli S, Moreau P et al. Superiority of the triple combination of bortezomib ‑ thalidomide ‑ dexamethasone over the dual combination of thalidomide ‑ dexamethasone in patients with multiple myeloma progressing or relapsing after autologous transplantation: the MMVAR/ IFM 2005 - 04 Randomized Phase III Trial from the Chronic Leukemia Working Party of the European Group for Blood and Marrow Transplantation. J Clin Oncol 2012; 30(20): 2475 – 2482.
40. Sonneveld P, Asselbergs E, Zweegman S et al. Carfilzomib combined with thalidomide and dexamethasone (CTD) is an highly effective induction and consolidation treatment in newly diagnosed patients with multiple myeloma (MM) who are transplant candidate. ASH Annual Meeting Abstracts, 2012.
41. Moreau P, Pylypenko H, Grosicki S et al. Subcutaneous versus intravenous administration of bortezomib in patients with relapsed multiple myeloma: a randomised, phase 3, non‑inferiority study. Lancet Oncol 2011; 12(5): 431 – 440.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2013 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Srovnání analgetické účinnosti metamizolu s ibuprofenem po extrakci třetí stoličky
-
Všetky články tohto čísla
- Editorial
- Thalidomid v léčbě mnohočetného myelomu se zaměřením na kombinaci s bortezomibem
- Karcinom prostaty, aktuální dilema uroonkologie. Jak prospět ohroženým pacientům a neuškodit těm ostatním
- Erratum
- Inhibice signalizace B buněčným receptorem: první cílená léčba u chronické lymfocytární leukemie a dalších B buněčných lymfomů
- Udržiavacia liečba lenalidomidom u pacientov s mnohopočetným myelómom
- Léčba průlomové bolesti u onkologických pacientů
- Komunikácia ako súčasť suportívnej terapie v onkológii
- Výsledky kurativní chemoradioterapie u pacientů s karcinomy anu
- Pacientka s metastatickým karcinoidem z pohárkových buněk
- Karcinom prsu u monozygotních dvojčat
- Informace z České onkologické společnosti
- Zajímavé případy z nutriční péče v onkologii
- Léčba závislosti na tabáku
-
Onkologie v obrazech
Rozměrná regionální metastáza melanomu - Prof. MU Dr. Ľudovít Milan Jurga, DrSc. – významné jubileum
- Jubileum pana profesora MU Dr. Dalibora Ondruše, DrSc.
- Jaroslav Bakeš (1871–1930): lékař, na něhož se zapomnělo / Gustav Novotný
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Karcinom prostaty, aktuální dilema uroonkologie. Jak prospět ohroženým pacientům a neuškodit těm ostatním
- Výsledky kurativní chemoradioterapie u pacientů s karcinomy anu
- Komunikácia ako súčasť suportívnej terapie v onkológii
- Udržiavacia liečba lenalidomidom u pacientov s mnohopočetným myelómom
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



