-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Výsledky kurativní chemoradioterapie u pacientů s karcinomy anu
Results of Curative Chemoradiotherapy in Patients with Carcinomas of the Anus
Background:
Anal carcinoma is a rare cancer. Surgical treatment is applied for small superficial tumors of the anal margin, the more advanced disease is treated with concomitant chemoradiotherapy. The aim of our study was to evaluate treatment outcomes in patients treated at the Masaryk Memorial Cancer Institute in 2006 – 2010.Patients and Metods:
We reviewed the clinical data of 29 newly diagnosed adult patients (aged 40 – 84, average 60.7, median 60.6 years) treated between 2006 – 2010. Demographic parameters, tumor‑related variables, toxicity of treatment, overall survival were analyzed.Results:
Acute dermal toxicity G4 was observed in two patients, G3 in nine patients. Acute intestinal toxicity G4 was not observed in any patient, G3 in four patients. Acute urologic toxicity G3 – 4 was not observed in any patient. Acute hematologic toxicity was observed: leukopenia G3/ G4 in 7/ 1 patients, neutropenia G3/ 4 in 9/ 4 patients, anemia G3/ 4 in no patient and thrombocytopenia G3/ 4 in 10/ 0 patients. Severe acute toxicity G3 – 4 was observed more frequently in patients treated with concurrent chemoradiotherapy. Chronic dermal toxicity G2 was observed in two patients, G1 in four patients, chronic intestinal toxicity G1 was observed in four patients. One patient had urethral stenosis and three patients had stenosis of anus without invasive solutions. One patient had osteoradionecrosis of the left pubic bone. The 5‑year overall survival of all patients was 76%. We failed to demonstrate improved survival due to the small and heterogeneous file in the group of patients in clinical stage I and II compared with patients with clinical stage III disease, or better survival in the group of patients who received concomitant chemoradiotherapy compared with patients treated only with radiotherapy.Conclusion:
Conservative treatment of locally advanced anal cancer is relatively well tolerated and safe treatment. Efficiency is comparable to surgical therapy, is also advantageous in terms of quality of life of patients due to the sphincter preservation.Key words:
anal carcinoma – chemoradiotherapy – radiotherapy – survival analysis
Autoři: J. Gombošová 1; P. Pospíšil 1
; H. Tichá 2; P. Šlampa 1
Působiště autorů: Klinika radiační onkologie LF MU, Masarykův onkologický ústav, Brno 1; Oddělení radiologické fyziky, Masarykův onkologický ústav, Brno 2
Vyšlo v časopise: Klin Onkol 2013; 26(3): 201-207
Kategorie: Původní práce
Souhrn
Východiska:
Karcinom anu je vzácně se vyskytující nádorové onemocnění. Chirurgická léčba se uplatňuje u malých povrchových tumorů análního okraje, pokročilejší onemocnění je léčeno konkomitantní chemoradioterapií. Cílem naší práce bylo zhodnotit výsledky léčby u pacientů léčených v Masarykově onkologickém ústavu v letech 2006 – 2010.Soubor pacientů a metody:
Byla vyhodnocena klinická data 29 pacientů (věkové rozmezí 40 – 84 let, průměr 60,7 roku, medián 60,6), kteří byli nově diagnostikováni a léčeni v letech 2006 – 2010. Analýza se týkala demografických dat, velikosti a rozsahu onemocnění, byla hodnocena toxicita léčby, celkové přežití.Výsledky:
Akutní kožní toxicita G4 byla zaznamenána u dvou pacientů, G3 u devíti pacientů. Akutní intestinální toxicita G4 nebyla pozorována u žádného pacienta, G3 u čtyř pacientů. Akutní urologická toxicita G3 – 4 nebyla u žádného pacienta. Z akutní hematologické toxicity byla zaznamenána leukopenie G3/ 4 u 7/ 1 pacientů, neutropenie G3/ 4 u 9/ 4 pacientů, anémie G3/ 4 u žádného pacienta a trombocytopenie G3/ 4 u 10/ 0 pacientů. Závažná akutní toxicita G3 – 4 byla pozorována častěji u pacientů léčených konkomitantní chemoradioterapií. Chronická toxicita kožní G2 byla pozorována u dvou pacientů, G1 u čtyř pacientů, chronická intestinální toxicita G1 byla zaznamenána u čtyř pacientů. U jednoho pacienta byla zaznamenána stenóza uretry a u tří pacientů stenóza anu bez nutnosti invazivního řešení. Jedna pacientka měla osteoradionekrózu levé stydké kosti. V celém souboru 29 pacientů bylo zaznamenáno 5leté přežití 76 %. Vzhledem k malému a heterogennímu souboru se nám nepodařilo prokázat lepší přežívání ve skupině pacientů klinického stadia I a II oproti skupině pacientů s nemocí klinického stadia III, ani lepší přežívání ve skupině pacientů, kteří absolvovali konkomitantní chemoradioterapii oproti skupině pacientů léčených pouze radioterapií.Závěr:
Konzervativní terapie lokálně pokročilého karcinomu anu je poměrně dobře tolerovaná a při adekvátní podpůrné terapii i bezpečná léčba. Účinností je srovnatelná s chirurgickou terapií, navíc je výhodnější z hlediska kvality života pacientů vzhledem k zachování funkce svěrače.Klíčová slova:
karcinom anu – chemoradioterapie – radioterapie – analýza přežitíÚvod
Karcinom anu patří mezi poměrně vzácně se vyskytující tumory. Podíl karcinomu anu na celkovém počtu nově diagnostikovaných tumorů dosahuje ročně asi 0,1 – 0,2 % a představuje asi 2 % ze všech karcinomů gastrointestinálního traktu. V současnosti má výskyt onemocnění mírně stoupající tendenci, která souvisí s koincidencí infekcí HIV (human immunodeficiency virus), HPV (human papillomavirus) [1,2].
Karcinom anu je souhrnný název používaný pro nádory análního okraje a nádory análního kanálu, rozhodující je anatomický vztah k linea dentata, karcinomy análního okraje jsou lokalizovány aborálně od linea dentata a karcinomy análního kanálu orálně od linea dentata. Proximální část análního kanálu nad linea dentata drénují lymfatické uzliny oblasti anorektální, perirektální, presakrální, obturatorní, vnitřní a zevní ilické. Část distálně od linea dentata pak navíc lymfatické uzliny ingvinální. Karcinomy análního okraje tvoří přibližně 15 % všech análních karcinomů [2].
Tumory anu metastazují nejčastěji lymfatickou cestou do regionálních lymfatických uzlin v závislosti na své lokalizaci. Tumory lokalizované nad linea dentata se šíří do anorektálních, perirektálních a interních ilických uzlin, tumory lokalizované pod linea dentata a tumory análního okraje se šíří hlavně do povrchových ingvinálních lymfatických uzlin [3,4]. Hematogenní diseminace je u análních karcinomů vzácná, častější je u nádorů análního kanálu. Metastazuje nejčastěji do jater v 5 – 8 %, do plic ve 2 – 4 % a do kostí ve 2 % [2].
Rizikové faktory jsou četné. Příčinná souvislost byla prokázána u herpetických virů (HSV 2), papilomavirů (HPV 16, 18), viru HIV. Onemocnění se vyskytuje zpravidla ve věku nad 50 let, častěji u žen [2,5]. Dalšími rizikovými faktory jsou anální pohlavní styk v anamnéze, pohlavní přenosné nemoci, u žen předchozí výskyt gynekologické malignity (karcinom hrdla děložního, karcinom vulvy, karcinom pochvy), imunosuprese po orgánové transplantaci, autoimunitní onemocnění, hematologické malignity, kouření [6 – 8]. Predisponujícím faktorem pro vznik análního karcinomu jsou chronické perianální léze (anální fistuly a píštěle) a intraepiteliální anální neoplazie [9,10].
Histologicky se nejčastěji vyskytuje spinocelulární karcinom (asi 75 – 80 %). Čtvrtá klasifikace dle WHO (World Health Organization) zařazuje pod spinocelulární karcinom anu další subtypy jako kloakogenní, velkobuněčný keratinizující, velkobuněčný nekeratinizující a bazaloidní [3,11]. Mezi vzácnější typy análního karcinomu patří adenokarcinomy, malobuněčný karcinom, nediferencovaný karcinom a melanom. Velmi vzácný je Kaposiho sarkom, který se vyskytuje u imunosuprimovaných pacientů [4].U špatně diferencovaných tumorů se předpokládala horší prognóza, tento předpoklad ale nebyl potvrzen [12].
Pro určení strategie léčby je rozhodující stupeň pokročilosti onemocnění. Léčebný postup vychází ze zhodnocení výsledků provedených vyšetření, prognostických faktorů a individuálních charakteristik pacienta (performance status, komorbidity).
V léčbě se uplatňují jak chirurgické, tak konzervativní postupy. Chirurgická terapie je rezervována pro malé povrchové tumory v oblasti análního okraje do velikosti 2 cm v největším rozměru a bez postižení svodných lymfatických uzlin. Nemá být provedena při postižení sfinkteru nebo při postižení obvodu nad 40 %, neboť chirurgický zákrok může způsobit ztrátu kontinence. Pro lokálně pokročilejší onemocnění (T2 – T4 anebo v případě pozitivních uzlin bez detekce vzdálených metastáz) je doporučena konkomitantní chemoradioterapie [13]. V případě lokálně progredujícího onemocnění nebo lokální recidivy po primární chemoradioterapii je doporučena záchranná chirurgická léčba – abdominoperineální resekce a kolostomie. Individuální postup je volen u pacientů s onemocněním klinického stadia IV. Obvykle jsou užity chemoterapeutické režimy na bázi cisplatiny nebo paliativní radioterapie [13,14].
U pacientů v kompletní remisi jsou prováděny každých 3 – 6 měsíců po dobu 5 let anoskopie a klinická vyšetření zahrnující vyšetření per rectum a palpační vyšetření ingvin. Při perzistenci nemoci je nutné pečlivé sledování pacienta, běžná je pomalá regrese tumoru a dosažení kompletní odpovědi může trvat i 12 měsíců. Proto je doporučeno s případnou biopsií perzistující, ale neprogredující léze vyčkat. Při progredující lézi je nutná bioptická verifikace, při jejím pozitivním výsledku je doporučena abdominoperineální resekce [13].
Soubor a metody
V letech 2006 – 2010 bylo v Masarykově onkologickém ústavu léčeno s kurativním záměrem 29 pacientů s diagnostikovaným karcinomem anu (tab. 1). Poměr mužů a žen byl 7 : 22. Věk pacientů se pohyboval v rozmezí 40 – 84 let, průměrný věk pacientů v době diagnózy byl 60,7 roku, medián 60,0 roku. Histologicky se nejčastěji jednalo o spinocelulární karcinom bez určení gradingu (11 pacientů), spinocelulární karcinom G1 byl zachycen u 3 pacientů, G2 u 8 pacientů a G3 u 7 pacientů. U 6 pacientů byla nejdříve provedena chirurgická excize pro benigní afekci s histologickým nálezem spinocelulárního karcinomu s pozitivními okraji, reexcize nebyla indikována, proto byli odesláni ke konzervativní terapii. U dvou z těchto pacientů bylo stanoveno klinické stadium pTx N0 M0 po absolvování diagnostických vyšetření v rámci stagingu. U ostatních pacientů bylo stanoveno klinické stadium I u 2 pacientů, II u 18 pacientů, IIIA u 2 a IIIB u 5 pacientů.
Tab. 1. Charakteristika souboru. 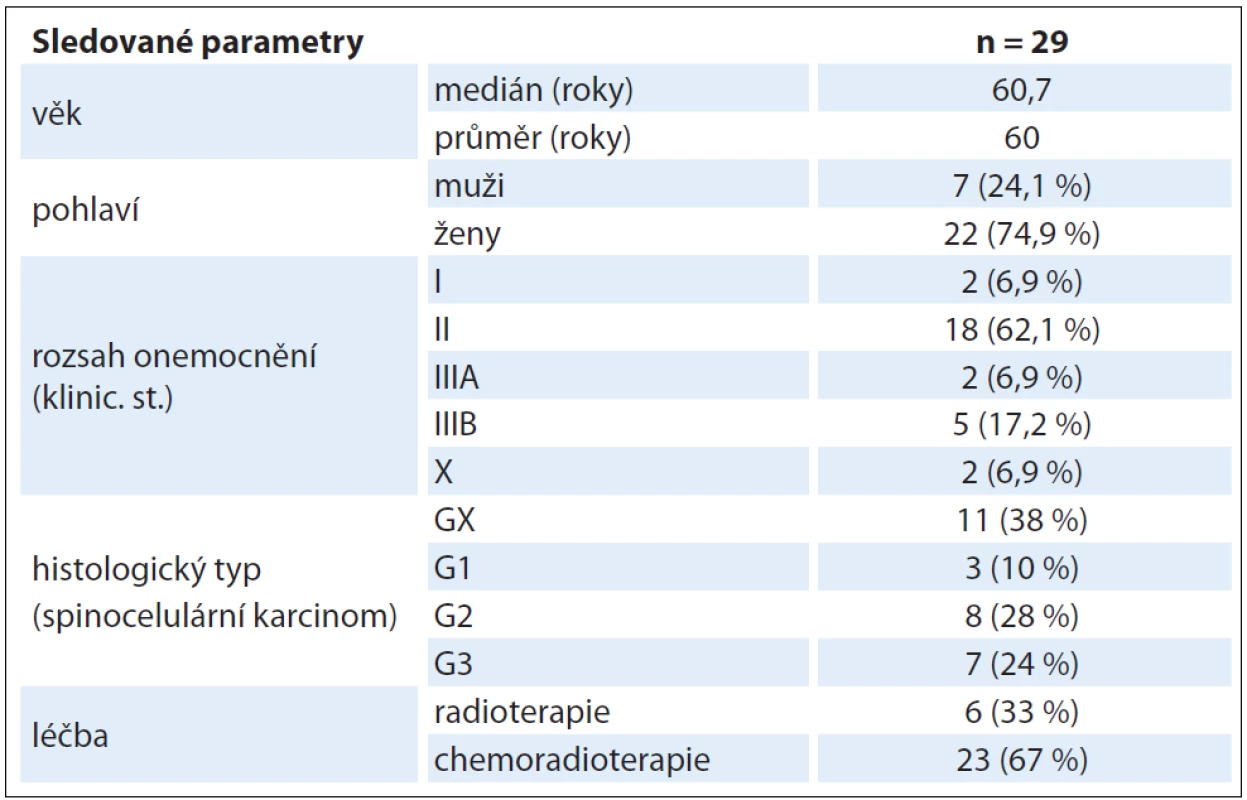
Před započetím léčby byli všichni pacienti náležitě poučeni a podepsali informovaný souhlas s navrhovaným léčebným postupem. Šest pacientů podstoupilo samostatnou radioterapii bez konkomitantní chemoterapie, ta nebyla podána z důvodu interkurentních závažných nemocí. Konkomitantní chemoradioterapii absolvovalo 23 pacientů, z toho 21 pacientů mělo dva cykly chemoterapie, 1 pacient dostal pouze jeden cyklus (pro toxicitu nebyl druhý cyklus podán) a 1 pacient absolvoval celkem tři cykly chemoterapie (třetí cyklus chemoterapie byl podán po ukončení konkomitance). U všech pacientů se systémovou terapií byl aplikován chemoterapeutický režim s 5 - fluorouracilem a mitomycinem C konkomitantně s radioterapií (mitomycin C v 10 mg/ m², den 1 v 1. a 5. týdnu; 5 - fluorouracil v dávce 1 000 mg/ m² den 1 – 4 v 1. a 5. týdnu).
Ozáření bylo provedeno 3D konformní radioterapií za pomoci plánovacího CT vyšetření na oblast tumoru a svodných lymfatických uzlin. Nejčastěji použitou technikou byla BOX, 3T, u 3 pacientů byl doplněn boost na reziduální tumor pomocí HDR BRT – rektálním válcem. U pacientů léčených pouze samostatnou radioterapií (6 pacientů) byla aplikována dávka do tumoru v rozmezí 51 – 65 Gy, medián aplikované dávky byl 58 Gy při frakcionaci 1,8 – 2,0 Gy/ den. U pacientů léčených konkomitantní chemoradioterapií (23 pacientů) byla aplikována dávka do tumoru v rozmezí 55 – 67 Gy, medián aplikované dávky byl 59,4 Gy při frakcionaci 1,8 – 2,0 Gy/ den. U aplikace HDR brachyradioterapie byla použita frakcionace 5,0 Gy/ den/ 1krát týdně, celkem 1 – 2 frakce, zdrojem záření bylo iridium 192Ir. Toxicita léčby byla hodnocena dle kritérií RTOG.
Výsledky
Ve skupině pacientů léčených pouze radioterapií (n = 6) byla pozorována akutní kožní toxicita G4 u jednoho pacienta (celková aplikovaná dávka 60 Gy; píštěl v oblasti skrota, která se po konzervativní terapii zhojila), G3 u dvou pacientů a G2 u tří pacientů. Intestinální a urologická toxicita G2 – 4 nebyla pozorována u žádného pacienta. Po hematologické stránce byla radioterapie velmi dobře tolerována, toxicita G3 – 4 nebyla zaznamenána u žádného pacienta, pouze u jednoho pacienta byla pozorována neutropenie G2. U žádného pacienta nebyla pozorována chronická toxicita kůže a podkoží G2 – 4.
K červnu 2012 žijí čtyři pacienti (67 %, medián doby sledování 45 měsíců, rozmezí 10 – 56 měsíců) v kompletní remisi onemocnění, na progresi onemocnění (1krát lokální, 1krát vzdálená) zemřeli dva pacienti (33 %).
Ve druhé skupině pacientů (n = 23), která byla léčená konkomitantní chemoradioterapií, byla pozorována závažnější akutní toxicita lokální i systémová. Akutní kožní toxicita G4 byla zaznamenána u 1 pacienta (4 %), G3 u 7 pacientů (30 %) a G2 u 15 pacientů (66 %) (graf 1). Akutní intestinální toxicita G4 nebyla pozorována u žádného pacienta, G3 u čtyř pacientů (17 %) a G2 u šesti pacientů (26 %) (graf 2). Akutní urologická toxicita G2 – 4 nebyla u žádného pacienta. Z akutní hematologické toxicity byla zaznamenána leukopenie G2/ G3/ G4 u 6/ 8/ 4 pacientů (26/ 35/ 17 %), neutropenie G2/ 3/ 4 u 2/ 9/ 4 pacientů (9/ 40/ 17 %), anémie G2/ 3/ 4 u 6/ 0/ 0 pacientů (26/ 0/ 0 %) a trombocytopenie G2/ 3/ 4 u 3/ 10/ 0 pacientů (13/ 44/ 0 %) (graf 3).
Graf 1. Akutní toxicita kožní. Hodnoceno dle kritérií RTOG. 
Graf 2. Akutní toxicita intestinální. Hodnoceno dle kritérií RTOG. 
Graf 3. Akutní toxicita hematologická. Hodnoceno dle kritérií RTOG. 
Chronická toxicita kožní G2 byla pozorována u dvou pacientů, G1 u čtyř pacientů, chronická intestinální toxicita G1 byla zaznamenána u čtyř pacientů. U jednoho pacienta byla zaznamenána stenóza uretry a u tří pacientů stenóza anu bez nutnosti invazivního řešení. U jedné pacientky byla při CT vyšetření popsána osteoporóza skeletu pánve a osteoradionekróza levé stydké kosti. K červnu 2012 žije 21 pacientů (91 %, medián doby sledování 35 měsíců, rozmezí 19 – 79 měsíců) v kompletní remisi onemocnění, na progresi onemocnění umřeli dva pacienti (9 %).
V celém souboru 29 pacientů bylo zaznamenáno 5leté přežití 76 % (graf 4). Nepodařilo se nám prokázat lepší 5leté přežívání u pacientů s onemocněním klinického stadia I a II oproti skupině pacientů s nemocí klinického stadia III (p = 0,62) (graf 5). Také jsme neprokázali lepší 5leté přežívání u pacientů, kteří absolvovali konkomitantní chemoradioterapii oproti skupině pacientů léčených pouze radioterapií (p = 0,26) (graf 6).
Graf 4. Kaplan-Meierova analýza – celkové přežití pro celý soubor. 
Graf 5. Kaplan-Meierova analýza – celkové přežití (OS) v závislosti na stadiu onemocnění (p = 0,62). 
Graf 6. Kaplan-Meierova analýza – celkové přežití (OS) v závislosti na typu léčby (p = 0,26). 
Diskuze
V minulosti dominovala v léčbě tumorů anu léčba chirurgická. Lokální excize se prováděla u malých tumorů análního okraje. Tento postup se ale neukázal jako efektivní u malých tumorů análního kanálu. Pro ostatní tumory byla doporučována abdominoperineální amputace anorekta s trvalou kolostomií. Přibližně u poloviny případů byla chirurgická léčba spojená s lokální rekurencí nemoci a pětileté přežívání bylo mezi 40 – 70 % [15].Lokální excize se udržela jako standard pouze u tumorů T1 v oblasti análního okraje. V roce 1974 byla publikována zpráva o kompletní regresi análního karcinomu u několika pacientů léčených radioterapií v konkomitanci s chemoterapií založenou na 5 - fluorouracilu s mitomycinem nebo porfiromycinem [16].Další publikované studie, ve kterých byly použity podobné režimy chemoterapie v konkomitanci s radioterapií, tyto výsledky podpořily [17,18]. Evropská organizace pro výzkum a léčbu rakoviny (EORTC) srovnávala ve studii fáze III radioterapii samotnou s radioterapií v konkomitanci s 5 - fluorouracilem a mitomycinem C. Výsledky studie prokázaly benefit konkomitantní chemoradioterapie; pacienti v této skupině měli pětiletou lokální kontrolu nemoci vyšší o 18 % a o 32 % delší interval bez kolostomie [19]. Nové studie se zaměřují na použití novějších cytostatik jako capecitabin, oxaliplatina a cetuximab v kombinaci s radioterapií v léčbě análních tumorů [13].
Četné studie se také zabývaly optimální aplikovanou dávkou záření. Podle studie, která se soustředila na časná stadia onemocnění (T1 nebo Tis) byly dostatečné dávky 40 – 50 Gy pro Tis tumory a dávky 50 – 60 Gy pro T1 tumory [20]. U klinického stadia II a III byla vyšší lokální kontrola prokázána u dávek vyšších než 50 Gy [21]. Studie, která zahrnovala pacienty s tumory T3, T4 nebo s postižením svodných lymfatických uzlin, prokázala další zlepšení lokální kontroly při aplikované dávce nad 54 Gy [22]. Zvyšování dávky nad 59 Gy už nepřineslo další zlepšení výsledků [23].
Přerušení léčby chemoradioterapiínení vhodné, může zhoršit výsledky léčby. Tento závěr potvrdila studie fáze II RTOG 92 - 08, kde u pacientů s plánovaným dvoutýdenním přerušením byla zhoršena lokální kontrola onemocnění ve srovnání s pacienty, kteří měli pouze nezbytné přerušení v léčbě pro těžkou kožní toxicitu [24]. Ve studii ACT II, kde léčba probíhala bez plánovaného přerušení, byl pozorován delší čas bez relapsu (75 % po 3 letech) [25]. I přes tyto výsledky došlo ale u více než 80 % pacientů k přerušení léčby v důsledku toxicity konkomitantní chemoradioterapie [26].
S nástupem nových technik se i u plánování radioterapie karcinomů anu stále více začíná uplatňovat technika IMRT. Na četných studiích bylo prokázáno, že pomocí této techniky dochází k výraznému šetření zdravých tkání bez zhoršení výsledků léčby a je výhodná pro detailní tvarování svazku u komplikovanějších cílových objemů [27,28]. V multicentrické studii RTOG 98-11 byla stran toxicity srovnávána 3D radioterapie a technika IMRT. Kožní toxicita G3 byla prokázána ve 38 % a G4 v 0 % u techniky IMRT, u 3D radioterapie byla toxicita G3 ve 43 % a G4 v 5 % [27,29]. V retrospektivní studii nebyl mezi IMRT a 3D konformní radioterapií rozdíl při srovnání času do lokální rekurence nemoci, času bez vzdálených metastáz, času bez kolostomie a dvouletého celkového přežití navzdory tomu, že pacienti v IMRT skupině měli vyšší N stadium nemoci [28].
Dle zahraničních doporučení není jednoznačná indikace brachyterapie u reziduální choroby po provedené chemoradioterapii zevním svazkem. Podle některých prací bylo při použití této metody pozorováno vyšší riziko nekrózy [30].
Stadium onemocnění je nejvýznamnějším prognostickým faktorem (se stoupajícím rozsahem tumoru a s pozitivními uzlinami se prognóza zhoršuje) [15].Pacienti s tumorem T1, T2 mají lepší prognózu. Posouzení regrese tumoru (> 80 %) po chemoradioterapii má prediktivní význam pro hodnocení přežití bez nemoci a přežití bez kolostomie [12].Pětileté přežití u pacientů s tumorem T1, T2 bez infiltrace svěrače je asi 80 %. Pacienti s tumorem T3, T4 nebo s postižením lymfatických uzlin mají pětileté přežití přibližně 50 %. Pacienti klinického stadia IV mají pětileté přežití asi 20 % [2].
Závěr
V souboru našich pacientů byla závažná akutní toxicita G3 – 4 pozorována častěji u pacientů léčených konkomitantní chemoradioterapií. Závažná chronická toxicita G3 – 4 nebyla pozorována u žádného pacienta. U jedné pacientky byla zaznamenána osteoradionekróza levé stydké kosti, rizikovým faktorem byla zřejmě osteoporóza skeletu. V celém souboru 29 pacientů bylo zaznamenáno 5leté přežití 76 %, které je srovnatelné s čísly uváděnými v literatuře. Vzhledem k malému a značně heterogennímu souboru se nám nepodařilo prokázat statistickou významnost ve smyslu lepšího 5letého přežívání v závislosti na klinickém stadiu onemocnění (I + II vs III, p = 0,62) ani v závislosti na typu absolvované léčby (chemoradioterapie vs radioterapie, p = 0,26).
Konzervativní terapie lokálně pokročilého karcinomu anu je poměrně dobře tolerovaná a při adekvátní podpůrné terapii i bezpečná léčba. Účinností je srovnatelná s chirurgickou terapií, navíc je výhodnější z hlediska kvality života pacientů vzhledem k zachování funkce svěrače bez mutilující abdominoperineální resekce. Při využití moderních metod radioterapie (IMRT) je možné zlepšit toleranci léčby při výraznějším šetření zdravých tkání a snížení jak akutní, tak chronické toxicity terapie. V rámci systémové léčby může být dalším přínosem využití novějších cytostatik nebo biologické léčby v konkomitaci s radioterapií. V prevenci análního karcinomu by se v budoucnu mohla uplatnit kvadrivalentní HPV vakcína (HPV 6, 11, 16 nebo 18), která je již v praxi zavedena v prevenci karcinomu děložního hrdla u žen [31].
Podpořeno MZ ČR – RVO (MOÚ, 00209805).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
MUDr. Jana Gombošová
Klinika radiační onkologie LF MU
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: gombosova@mou.cz
Obdrženo: 21. 1. 2013
Přijato: 27. 2. 2013
Zdroje
1. Siegel R, Ward E, Brawley O et al. Cancer statistics, 2011: The impact of eliminating socioeconomic and racial disparities on premature cancer deaths. CA Cancer J Clin 2011; 61(14): 212 – 236.
2. Šlampa P, Vošmik M, Přibylová O et al. Zhoubné nádory anu. In: Šlampa P, Petera J et al (eds). Radiační onkologie. Praha: Galén Karolinum 2007 : 145 – 152.
3. Edge SBB, Compton CC, Fritz AG et al. AJCC Cancer Staging Manual. 7th ed. New York: Springer 2010.
4. Cummings BJ, Ajani JA, Swallow CJ. Cancer of the anal region. In: DeVita Jr. VT, Lawrence TS, Rosenberg SA et al (eds). Cancer: Principles & Practice of Oncology, Eighth Edition. Philadelphia, PA: Lippincott, Williams & Wilkins 2008.
5. Patel P, Hanson DL, Sullivan PS et al. Incidence of types of cancer among HIV ‑ infected persons compared with the general population in the United States, 1992 – 2003. Ann Intern Med 2008; 148(10): 728 – 736.
6. Daling JR, Madeleine MM, Johnson LG et al. Human papillomavirus, smoking, and sexual practices in the etiology of anal cancer. Cancer 2004; 101(2): 270 – 280.
7. Frisch M, Glimelius B, van den Brule AJ et al. Sexually transmitted infection as a cause of anal cancer. N Engl J Med 1997; 337(19): 1350 – 1358.
8. Jimenez W, Paszat L, Kupets R et al. Presumed previous human papillomavirus (HPV) related gynecological cancer in women diagnosed with anal cancer in the province of Ontario. Gynecol Oncol 2009; 114(3): 395 – 398.
9. Scholefield JH, Castle MT, Watson NF. Malignant transformation of high‑grade anal intraepithelial neoplasia. Br J Surg 2005; 92(9): 1133 – 1136.
10. Watson AJ, Smith BB, Whitehead MR et al. Malignant progression of anal intraepithelial neoplasia. ANZ J Surg 2006; 76(8): 715 – 717.
11. Fenger C, Frisch M, Marti MC et al. Tumours of the anal canal. In: Hamilton SR, Aaltonen LA (eds). WHO Classification of Tumours, Volume 2: Pathology and Genetics. Tumours of the Digestive System. Lyon: IARC Press 2000 : 145 – 155.
12. Glynne ‑ Jones R, Northover JM, Cervantes A et al. Anal cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow‑up. Ann Oncology 2010; 21 (Suppl 5): v87 – v92.
13. NCCN.org [homepage on the Internet]. National Comprehensice Cancer Network, verze 2.2012. Available from: http:/ / www.nccn.org/ professionals/ physician_gls/ pdf/ anal.pdf.
14. Faivre C, Rougier P, Ducreux M et al. [5-fluorouracile and cisplatinum combination chemotherapy for metastatic squamous ‑ cell anal cancer]. Bull Cancer 1999; 86(10): 861 – 865.
15. Ryan DP, Compton CC, Mayer RJ. Carcinoma of the anal canal. N Engl J Med 2000; 342(11): 792 – 800.
16. Nigro ND, Vaitkevicius VK, Considine B. Combined therapy for cancer of the anal canal: a preliminary report. Dis Colon Rectum 1974; 17(3): 354 – 356.
17. Cummings BJ, Keane TJ, O‘Sullivan B et al. Epidermoid anal 54. In: Ajani JA, Winter KA, Gunderson LL et al (eds). Fluorouracil, mitomycin, cancer: treatment by radiation alone or by radiation and 5 - fluorouracil and radiotherapy vs fluorouracil, cisplatin, and radiotherapy for with and without mitomycin C. Int J Radiat Oncol Biol Phys carcinoma of the anal canal: a randomized controlled trial. JAMA 1991; 21 : 1115 – 1125.
18. Papillon J, Chassard JL. Respective roles of radiotherapy and surgery in the management of epidermoid carcinoma of the anal margin. Series of 57 patients. Dis Colon Rectum 1992; 35(5): 422 – 429.
19. Bartelink H, Roelofsen F, Eschwege F et al. Concomitant radiotherapy and chemotherapy is superior to radiotherapy alone in the treatment of locally advanced anal cancer: results of a phase III randomized trial of the European Organization for Research and Treatment of Cancer Radiotherapy and Gastrointestinal Cooperative Groups. J Clin Oncol 1997; 15 : 2040 – 2049.
20. Ortholan C, Ramaioli A, Peiffert D et al. Anal canal carcinoma: early‑stage tumors < or = 10 mm (T1 or Tis): therapeutic options and original pattern of local failure after radiotherapy. Int J Radiat Oncol Biol Phys 2005; 62(2): 479 – 485.
21. Ferrigno R, Nakamura RA, Dos Santos Novaes PE et al. Radiochemotherapy in the conservative treatment of anal canal carcinoma: retrospective analysis of results and radiation dose effectiveness. Int J Radiat Oncol Biol Phys 2005; 61(4): 1136 – 1142.
22. Huang K, Haas ‑ Kogan D, Weinberg V et al. Higher radiation dose with a shorter treatment duration improves outcome for locally advanced carcinoma of anal canal. World J Gastroenterol 2007; 13(6): 895 – 900.
23. John M, Pajak T, Flam M et al. Dose escalation in chemoradiation for anal cancer: preliminary results of RTOG 92-08. Cancer J Sci Am 1996; 2(4): 205 – 211.
24. Konski A, Garcia M Jr, John M et al. Evaluation of planned treatment breaks during radiation therapy for anal cancer: update of RTOG 92 - 08. Int J Radiat Oncol Biol Phys 2008; 72(1): 114 – 118.
25. James R, Wan S, Glynne ‑ Jones R et al. A randomized trial of chemoradiation using mitomycin or cisplatin, with or without maintenance cisplatin/ 5FU in squamous cell carcinoma of the anus (ACT II). J Clin Oncol 2009; 27(18) (Suppl): LBA4009.
26. Roohipour R, Patil S, Goodman KA et al. Squamous ‑ cell carcinoma of the anal canal: predictors of treatment outcome. Dis Colon Rectum 2008; 51(2): 147 – 153.
27. Salama JK, Mell LK, Schomas DA et al. Concurrent chemotherapy and intensity ‑ modulated radiation therapy for anal canal cancer patients: a multicenter experience. J Clin Oncol 2007; 25(29): 4581 – 4586.
28. Rothenstein DA, Dasgupta T, Chou JF et al. Comparison of outcomes of intensity ‑ modulated radiotherapy and 3 - D conformal radiotherapy for anal squamous cell carcinoma using a propensity score analysis. J Clin Oncol 2011; 29 (Suppl): 3555.
29. Ajani JA, Winter KA, Gunderson LL et al. Fluorouracil, mitomycin, and radiotherapy vs fluorouracil, cisplatin, and radiotherapy for carcinoma of the anal canal: a randomized controlled trial. JAMA 2008; 299(16): 1914 – 1921.
30. Sandhu AP, Symonds RP, Robertson AG et al. Interstitial Iridium ‑ 192 implantation combined with external radiotherapy in anal cancer: ten years experience. Int J Radiat Oncol Biol Phys 1998; 40(3): 575 – 581.
31. Palefsky JM, Giuliano AR, Goldstone S et al. HPV vaccine against anal HPV infection and anal intraepithelial neoplasia. N Engl J Med 2011; 365(17): 1576 – 1585.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2013 Číslo 3- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Editorial
- Thalidomid v léčbě mnohočetného myelomu se zaměřením na kombinaci s bortezomibem
- Karcinom prostaty, aktuální dilema uroonkologie. Jak prospět ohroženým pacientům a neuškodit těm ostatním
- Erratum
- Inhibice signalizace B buněčným receptorem: první cílená léčba u chronické lymfocytární leukemie a dalších B buněčných lymfomů
- Udržiavacia liečba lenalidomidom u pacientov s mnohopočetným myelómom
- Léčba průlomové bolesti u onkologických pacientů
- Komunikácia ako súčasť suportívnej terapie v onkológii
- Výsledky kurativní chemoradioterapie u pacientů s karcinomy anu
- Pacientka s metastatickým karcinoidem z pohárkových buněk
- Karcinom prsu u monozygotních dvojčat
- Informace z České onkologické společnosti
- Zajímavé případy z nutriční péče v onkologii
- Léčba závislosti na tabáku
-
Onkologie v obrazech
Rozměrná regionální metastáza melanomu - Prof. MU Dr. Ľudovít Milan Jurga, DrSc. – významné jubileum
- Jubileum pana profesora MU Dr. Dalibora Ondruše, DrSc.
- Jaroslav Bakeš (1871–1930): lékař, na něhož se zapomnělo / Gustav Novotný
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Karcinom prostaty, aktuální dilema uroonkologie. Jak prospět ohroženým pacientům a neuškodit těm ostatním
- Výsledky kurativní chemoradioterapie u pacientů s karcinomy anu
- Komunikácia ako súčasť suportívnej terapie v onkológii
- Udržiavacia liečba lenalidomidom u pacientov s mnohopočetným myelómom
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



