-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Chylózní ascites jako závažná komplikace neuroendokrinního tumoru ilea – kazuistika
Chylous Ascites as a Serious Complication of the Neuroendocrine Tumor of Ileum – Case Report
Background:
Chylous ascites is a rare complication of the gastrointestinal neuroendocrine tumor. There are two mechanisms of its origin: mechanical obstruction by the tumor mass and fibrosis of the surrounding tissue due to overproduction of serotonin. Its presence restricts treatment options.Case:
We report a case of 66‑year old man suffering from recurrent diarrhoea and ascites. We found elevated tumor marker Chromogranin A and elevation of hydroxyindoleacetic acid (5 - HIAA) in the urine. A subsequent whole ‑ body scintigraphy scan by octreoscan confirmed multinodal process with increased somatostatin receptors activity in the wall of the ileum, rectosigmoideum, lymph nodes of the retroperitoneum and mesenterium and left supraclavicular area. We performed biopsy from the lymph node of supraclavicular area, and there was metastasis of the neuroendocrine tumor. Start of cytostatic therapy was repeatedly complicated by recurrent massive chylous ascites. The patient underwent only one series of palliative chemotherapy. Another procedure was again complicated by chylous ascites that caused hospitalization at the internal department, and the patient died four months after diagnosis.Conclusion:
Chylous ascites is a very rare complication of gastrointestinal neuroendocrine tumor. It is not only a marker of poor prognosis, but also a complication that makes systemic treatment very difficult.Key words:
case report – neuroendocrine tumors – chylous ascites – malignant carcinoid syndrome
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
25. 5. 2013Accepted:
27. 6. 2013
Autoři: V. M. Matějka 1; O. Fiala 1; R. Tupý 2; L. Holubec 1; J. Fínek 1
Působiště autorů: Onkologické a radioterapeutické oddělení, FN Plzeň 1; Klinika zobrazovacích metod LF UK a FN Plzeň 2
Vyšlo v časopise: Klin Onkol 2013; 26(5): 358-361
Kategorie: Kazuistika
Souhrn
Východiska:
Chylózní ascites je velmi vzácná komplikace neuroendokrinního tumoru gastrointestinálního traktu. Mechanizmus jeho vzniku je dvojí. Jednak mechanickou obstrukcí nádorovými hmotami a jednak fibrotizací okolní tkáně z důvodu nadprodukce serotoninu. Jeho přítomnost velmi omezuje léčebné možnosti.Případ:
Popisujeme případ 66letého muže trpícího recidivujícími průjmy a ascitem. V rámci diagnostiky byla zjištěna elevace nádorového markeru chromograninu A a odpadu kyseliny hydroxyindoloctové (5 - HIOK) do moči. Následně provedená celotělová scintigrafie octreoscanem potvrdila mnoholožiskový proces se zvýšenou hustotou somatostatinových receptorů ve stěně ilea, rektosigmatu, lymfatických uzlin retroperitonea, mezenteria a levého nadklíčku. V lymfatické uzlině nadklíčku, která byla exstirpována, byla zastižena metastáza neuroendokrinního tumoru. Zahájení cytostatické léčby bylo opakovaně komplikované recidivou masivního chylózního ascitu. Pacient podstoupil pouze jednu sérii paliativní chemoterapie. Další postup byl opět komplikován chylózním ascitem, pro který byl hospitalizován na spádovém interním oddělení, a pacient umírá čtyři měsíce od stanovení diagnózy.Závěr:
Chylózní ascites je velmi raritní komplikací neuroendokrinního tumoru gastrointestinálního traktu. Je nejen známkou špatné prognózy pacienta, ale také komplikací, která ztěžuje podání systémové léčby.Klíčová slova:
kazuistika – neuroendokrinní tumory – chylózní ascites – karcinoidový syndromÚvod
Neuroendokrinní tumory jsou zhoubné nádory vycházející z buněk difuzního neuroendokrinního systému (DNES), dříve také nazývaného APUD ‑ systém (amine precursor uptake and decarboxylation system). Přestože se vyskytují v různých lokalizacích, nejčastějším místem jejich nálezu je gastrointestinální trakt. V této lokalizaci postihují cca 75 – 80 % pacientů. Incidence neuroendokrinního tumoru GITu se udává kolem 2 případů/ 100 000 obyvatel/ rok, což tuto patologickou jednotku řadí mezi velmi vzácná nádorová onemocnění [1].
Ojedinělé případy nádorových onemocnění GITu, která se vyznačovala odlišnou morfologickou i klinickou charakteristikou od převážné většiny, byly poprvé popsány již v 19. století. Název karcinoid (karcinomu podobné) byl poprvé použit německým patologem Oberndorferem roku 1907 v souborné práci popisující nezvyklé nádory střeva [2]. Hlavními znaky odlišujícími tyto nálezy od převážné většiny malignit GIT jsou solidní, trabekulární, popřípadě pentlicovité formace buněk a relativně neagresivní růst tumoru [1,3]. Dnes je používána klasifikace WHO 2010, která dělí neuroendokrinní tumory takto: 1. neuroendokrinní tumor (G1, G2), 2. neuroendokrinní karcinom (G3) a 3. smíšený adenoneuroendokrinní karcinom (MANEC) [3,4].
Mezi hlavní komplikace neuroendokrinních tumorů patří karcinoidový syndrom způsobený nadprodukcí biogenních aminů (zejména serotoninu). Typickými příznaky tohoto syndromu jsou flush, průjmy, astmatické záchvaty a srdeční selhávání jako důsledek postižení endokardu a chlopenního systému srdce. Ascites je u neuroendokrinních tumorů relativně častou komplikací hlavně při lokálně pokročilém onemocnění či vzdálené generalizaci. V drtivé většině jde o ascites serózní [5,6]. Naproti tomu chylózní forma ascitu je komplikací velice vzácnou. Ve světové literatuře bylo doposud popsáno pouze 17 případů [7 – 21]. V této kazuistice popisujeme případ pacienta s neuroendokrinním tumorem ilea komplikovaným masivním recidivujícím chylózním ascitem, který byl léčen na našem pracovišti.
Popis případu
Pacient, 66letý muž, byl v červenci 2012 přijat na interní oddělení k vyšetření asi rok trvajících průjmů a hmotnostního úbytku cca 8 kg za posledních šest měsíců. V rodinné anamnéze byl stran nádorových onemocnění pozitivní pouze nález otce, který zemřel na karcinom plic ve věku 50 let. V osobní anamnéze dominoval infarkt myokardu (10/ 2004) a léčená arteriální hypertenze. Pacient udával tři roky abstinenci, do té doby pil pravidelně několik piv denně a stále, přes 40 let, kouřil asi 20 cigaret denně.
Ve vstupní laboratoři byla zachycena mírná leukocytóza a elevace CRP. Screeningové RTG vyšetření plic neprokázalo významný patologický nález, ale USG břicha potvrdilo klinicky suspektní ascites, bez patologického korelátu na nitrobřišních orgánech. Při neznámé etiologii ascitu bylo doplněno CT vyšetření břicha (19. 7. 2012), které konfirmovalo nález ascitu a dále zachytilo zesílení stěny žaludku a rekta a hyperdenzní uzel ve stěně kličky ilea. Dalším nálezem byly zvětšené uzliny v retroperitoneu patologického vzhledu.
Po vyloučení infekční etiologie přetrvávajících vodnatých průjmů bylo provedeno kolonoskopické vyšetření (23. 7. 2012), které nepotvrdilo patologický korelát klinických obtíží. Při vyšetření byly nalezeny a odstraněny dva polypy rektosigmatu (histologicky hyperplastický polyp a tubulární adenom s nízkým stupněm dysplazie). Během hospitalizace byla provedena jednorázová punkce ascitu v celkovém množství 5 000 ml. Jednalo se o mléčně zakalenou tekutinu charakteru chylózního transudátu (protein ve výpotku: 21,3 g/ l, serum ‑ ascites albumin gradient / SAAG/ : 24 g/ l), cytologicky bez průkazu maligních elementů.
Následně byl doplněn laboratorní screening nádorových markerů, který ukázal elevaci chromograninu A (145,7 ng/ ml) a odpadu kyseliny hydroxyindoloctové v moči (5 - HIOK v moči; 180,8 umol/ d). Tento nález spolu s klinickými obtížemi pacienta vedl k podezření na neuroendokrinní nádor. Dále proto následovalo celotělové vyšetření scintigrafií 111In octreoscanem (15. 8. 2012). Ten zachytil vícečetný ložiskový proces se zvýšenou hustotou somatostatinových receptorů ve stěně ilea (obr. 1) a rektosigmatu (obr. 2) a dále pak postižení lymfatických uzlin retroperitonea (obr. 3), mezenteria (obr. 4) a levého nadklíčku (obr. 5).
Obr. 1. <sup>111</sup>In octreoscan – zvýšená hustota somatostatinových receptorů ve stěně ilea. 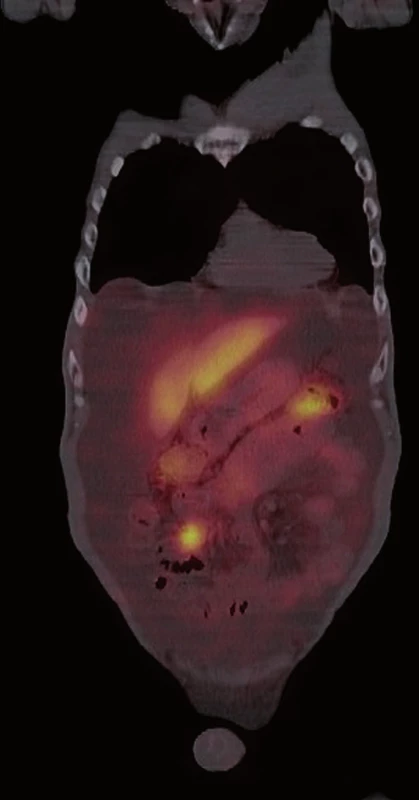
Obr. 2. <sup>111</sup>In octreoscan – zvýšená hustota somatostatinových receptorů ve stěně rektosigmatu. 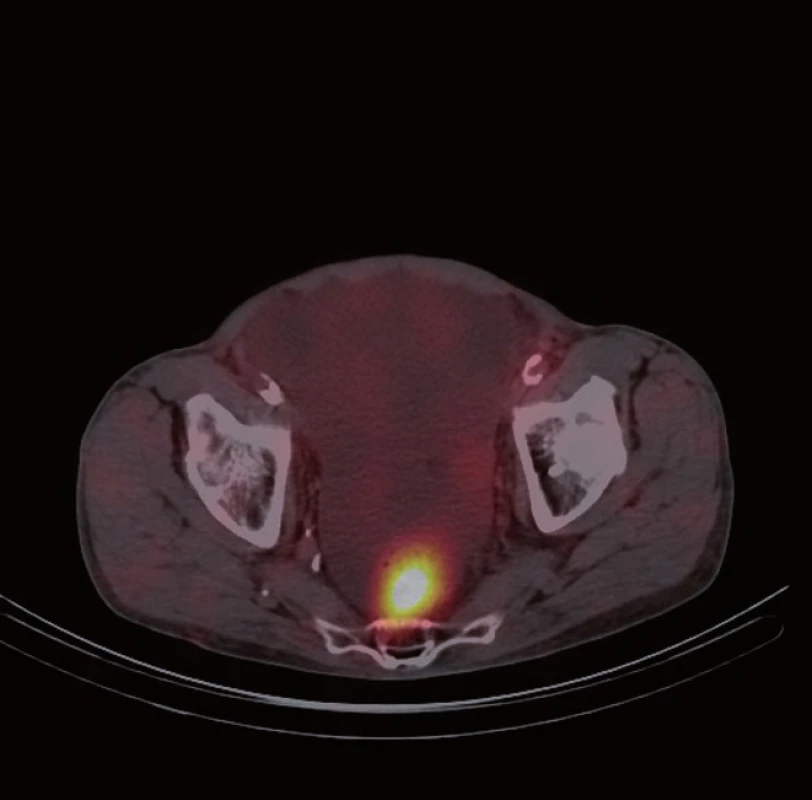
Obr. 3. <sup>111</sup>In octreoscan – zvýšená hustota somatostatinových receptorů v lymfatických uzlinách retroperitonea. 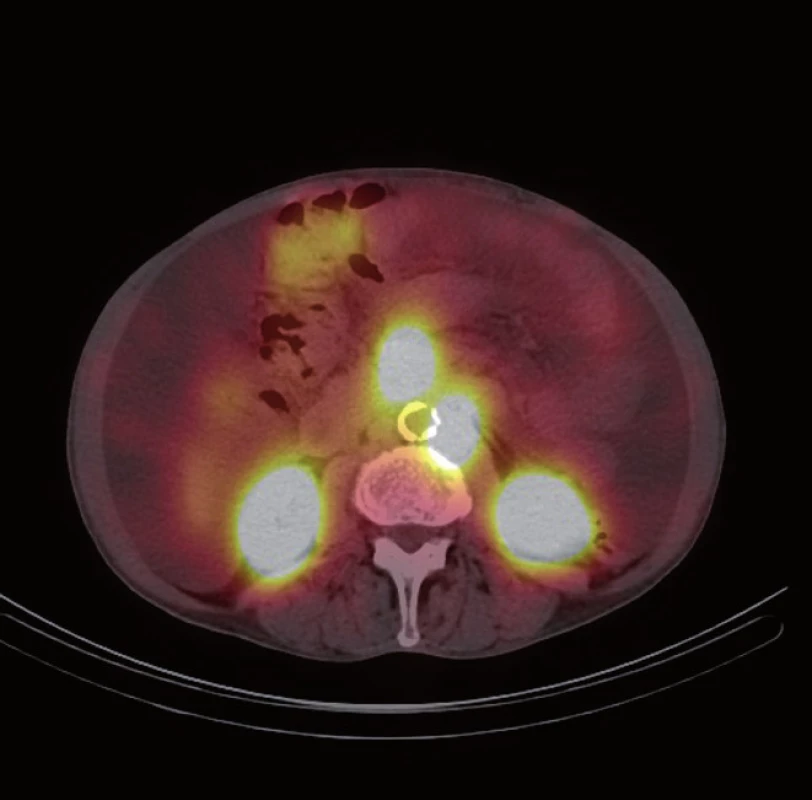
Obr. 4. <sup>111</sup>In octreoscan – zvýšená hustota somatostatinových receptorů v lymfatických uzlinách mesenteria. 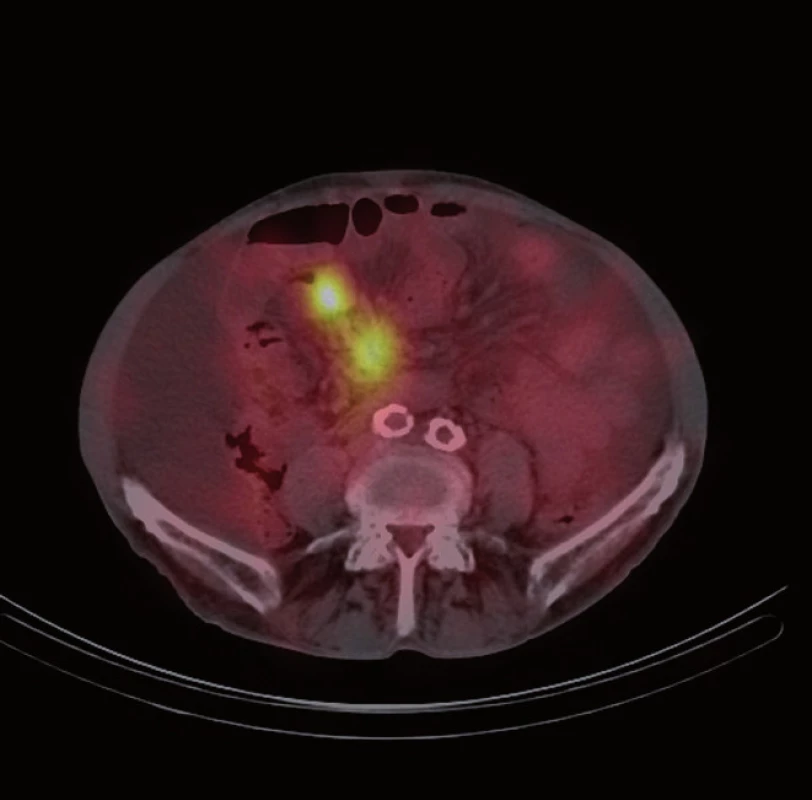
Obr. 5. <sup>111</sup>In octreoscan – zvýšená hustota somatostatinových receptorů v lymfatické uzlině levého nadklíčku. 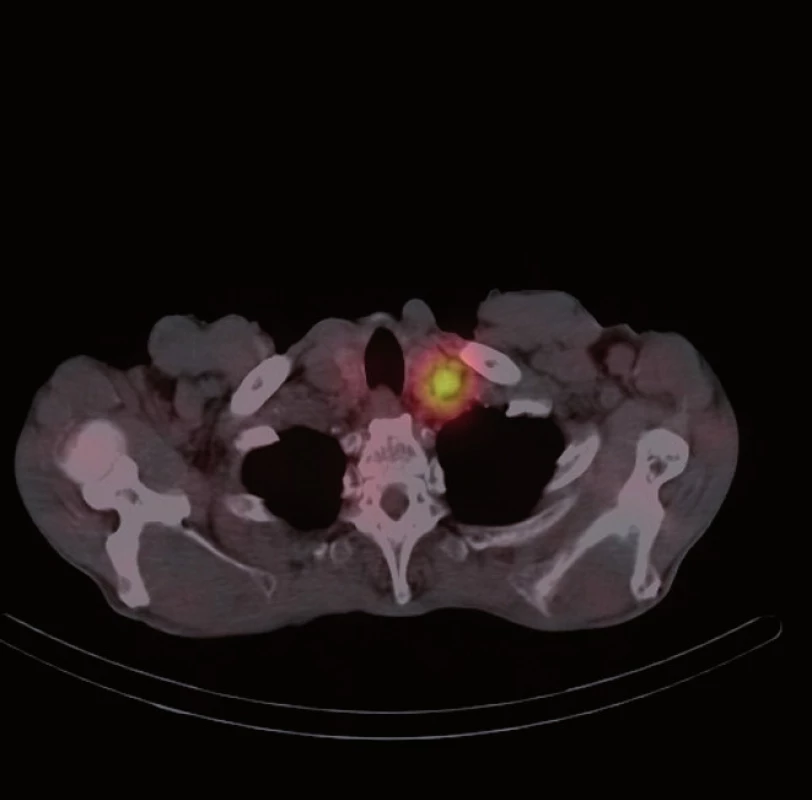
Při následné ambulantní kontrole opět recidiva ascitu s nutností punkce v množství 6 l (protein ve výpotku: 18,1 g/ l, SAAG 20,7). Cytologické vyšetření opět negativní na nález maligních buněk. Na ORL klinice FN Plzeň byla provedena exstirpace maligně změněné lymfatické uzliny z levého nadklíčku (11. 9. 2012), ve které byla histologicky prokázána metastáza neuroendokrinního tumoru. U pacienta byla při inoperabilním rozsahu onemocnění indikována systémová léčba cytostatiky.
Zahájení chemoterapie se zkomplikovalo recidivou ascitu, pro kterou musela být přechodně zavedena drenáž s odsátím tekutiny v celkovém množství 12,5 l (protein ve výpotku: 11,8 g/ l, SAAG 24). Následně jsme aplikovali intraperitoneálně cytostatikum carboplatin v celkové dávce 400 mg. Perzistující průjmy byly vyhodnoceny jako karcinoidový syndrom, což potvrdil okamžitý ústup potíží po zahájení léčby lanreotidem (60 mg i. m.). Systémovou léčbu jsme pro i.p. aplikaci cytostatika odložili o 14 dní.
Při další hospitalizaci pacient opět trpěl obtížemi spojenými s recidivou ascitu. Byla provedena přechodná drenáž s vydrenováním cca 13 l výpotku a následně jsme intraperitoneálně aplikovali hydrocortison v celkové dávce 200 mg. Kontrolní vyšetření ascitu potvrdilo charakter chylózního transudátu, cytologické vyšetření bylo opět bez záchytu maligních elementů. Progresi základního onemocnění potvrdila elevace sérových hladin chromograninu A(390,2 ng/ ml) a CA ‑ 125 (249,0 IU/ ml). Markery NSE a TPS vykazovaly fyziologické hodnoty. Ihned byla zahájena I. série pal. chemoterapie podle schématu Etoposid (130 mg/ m2 i.v. 1. – 3. den) a CisDDP (45 mg/ m2 i.v. 2. – 3. den). Vlastní podání chemoterapie pacient toleroval bez komplikací.
Přes provedenou léčbu si pacientův stav vyžádal dva týdny po propuštění z našeho oddělení hospitalizaci na spádovém interním oddělení. Důvodem byla recidiva chylózního ascitu komplikovaná zhoršením stavu pacienta ve smyslu těžké podvýživy a celkového vyčerpání organizmu. S ohledem na infaustní prognózu bylo dále postupováno symptomaticky a pacient zemřel čtyři měsíce od stanovení diagnózy (8. 11. 2012).
Diskuze
Příčinou chylózního ascitu může být trauma, obstrukce střeva, infekce nebo postinfekční komplikace a v neposlední řadě také nádorového onemocnění. Chylózní ascites u pacientů s neuroendokrinním tumorem gastrointestinálního traktu je velmi raritní komplikace. Dosud byly v literatuře popsány pouze necelé dvě desítky případů [7 – 21].
Mechanizmus vzniku chylózního ascitu je u nádorových onemocnění dvojí. Jednak mechanickým postižením lymfatické drenáže na úrovni lymfatické uzliny, nejčastěji z důvodu její infiltrace nádorem. Při druhém mechanizmu se uplatňují molekulární působky, které způsobují desmoplastickou přestavbu okolí. Fibrózně změněná okolní tkáň je potom příčinou obstrukce lymfatické drenáže. Dle posledních poznatků ovlivňuje nejvíce biologickou aktivitu ve smyslu stimulace fibrotické přestavby serotonin [14,15].
V našem případě se s největší pravděpodobností uplatnily oba výše zmíněné mechanizmy. Tuto domněnku potvrzuje jednak typická opakovaně cytologicky negativní charakteristika ascitu a jednak přítomnost zvýšeného odpadu 5 - HIOK do moči svědčící pro nadměrnou produkci serotoninu [22].
Diagnóza základního onemocnění byla provedena histologicky na základě vyšetření uzliny zasažené nádorem. První podezření na tuto patologickou jednotku však bylo vysloveno při záchytu elevace jednak odpadu 5 - HIOK do moči a hlavně chromograninu A. Tento peptid, známý též pod názvem parathyriodální sekreční protein 1, se nachází v sekrečních granulech neuronů a endokrinních buněk. Je prekurzorem množství funkčních proteinů jako vasostatin, pankreastatin, catestatin a parastatin. Jeho hladina je běžně zvýšena téměř u všech pacientů s endokrinními a neuroendokrinními nádory [23]. V rámci diagnostiky v případě potíží charakteru karcinoidového syndromu má nezastupitelnou roli pro svou relativně vysokou senzitivitu [23,24].
Izolovaná elevace nádorového markeru CA ‑ 125 je popsána již u několika předchozích případů chylózního ascitu u neuroendokrinního tumoru [25]. CA ‑ 125 je senzitivní, ale nespecifický onkomarker užívaný zejména pro diagnostiku a monitoring léčebného efektu u karcinomu ovaria. Jeho elevace byly popsány i u jiných patologických jednotek, např. u intraperitoneálních a plicních nádorů, endometriózy, jaterní cirhózy a fyziologicky pak i v průběhu těhotenství. K elevaci sérové hladiny CA ‑ 125 však dochází často u pacientů s ascitem nebo pleurálním výpotkem maligní i nemaligní etiologie v důsledku afekce mezotelu [25 – 28]. Na podkladě řady dostupných publikací se zdá, že hlavním producentem CA ‑ 125 jsou mezotelie, nikoli buňky vlastního tumoru. Míra elevace CA ‑ 125 pak velmi dobře koreluje s množstvím výpotku.
Závěr
Ve výše uvedené kazuistice je popsán případ pacienta s generalizovaným neuroendokrinním tumorem ilea, jehož stav byl komplikován masivním recidivujícím chylózním ascitem. Jak je patrné nejen z našeho případu, ale i z dostupné literatury (pro raritnost onemocnění a této komplikace pouze ve formě kazuistik), jedná se prakticky vždy o známku velmi špatné prognózy pacienta a navíc komplikaci, která ztěžuje jakoukoli léčebnou modalitu.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Vít Martin Matějka
Onkologické a radioterapeutické oddělení
FN Plzeň
alej Svobody 80
340 60 Plzeň
e-mail: matejkavm@fnplzen.cz
Obdrženo: 25. 5. 2013
Přijato: 27. 6. 2013
Zdroje
1. Modlin IM, Sandor A. An analysis of 8 305 cases of carcinoid tumors. Cancer 1997; 79(4): 813 – 829.
2. Oberndorfer S. Karzinoide Tumoren des Dunndarms. Frankfurter Z Pathol 1907; 1 : 426 – 430.
3. Bosman FT, Carneiro F, Hruban RH et al (eds). WHO Classification of Tumours of the Digestive System. 4th ed. World Health Organization classification of tumours. IARC: Lyon 2010.
4. Mandys V. Neuroendokrinní nádory trávícího ústrojí – histologická klasifikace. Farmakoterapie 2011; 7 (Spec. příl.): 8 – 11.
5.Thorson AH. Heamodynamic changes during flush in carcinoidosis; the carcinoid syndrome. Am Heart J 1956; 52(3): 444 – 461.
6. Feldman JM. Carcinoide tumors and the carcinoid syndrome. Curr Probl Surg 1989; 26(12): 835 – 885.
7. Makridis C, Oberg K, Juhlin C et al. Surgical treatment of mid ‑ gut carcinoid tumors. World J Surg 1990; 14(3): 377 – 385.
8. Varma JS. Acute chylous ascites with carcinoid of the pancreas. Scott Med J 1985; 30(2): 111.
9. Mortensen RM, Medoff J, Feldman JM. Case report: chylous ascites and carcinoid tumors: possible association of 2 rare disorders. Am J Med Sci 1988; 296(4): 272 – 274.
10. Dumont AE, Libby N. Thoracic duct lymph in a patient with chylous ascites and carcinoid tumor. Lymphology 1989; 22(4): 199 – 201.
11. Scully RE, Mark EJ, McNeely BU. Case records of the Massachusetts General Hospital; case 20 – 1986. A 68 year old man with malabsorption, chylous ascites and amesenteric mass. N Engl J Med 1986; 314(21): 1369 – 1378.
12. Sherry S. Clinical pathologic conference: diarrhea, abdominal pain, gastrointestinal bleeding, chylous ascites and an intra ‑ abdominal tumor. Am J Med 1959; 26(6): 919 – 928.
13. Hodgson HJF, Sharp EJ, Waxman J et al. Grand Rounds ‑ Hammersmith Hospital. A case of chylous ascites. BMJ 1993; 307 : 495 – 497.
14. Kelly ML Jr, Butt HR. Chylous ascites: an analysis of its etiology. Gastroenterology 1960; 39 : 161 – 170.
15. Bigler D, Lublin HK. Chylous ascites. Ugresk Laeger 1981; 143(9): 551.
16. Feldman JM. Carcinoid tumor and the carcinoid syndrome. Curr Probl Surg 1989; 26(12): 831 – 898.
17. Aliaga L, Herrera F, Sarmiento C et al. Chylousascites secondary to a carcinoid tumor. An Med Interna 1990; 7(8): 419 – 421.
18. Kypson AP, Onaitis MW, Feldman JM et al. Carcinoid and chylous ascites: an unusual association. J Gastrointest Surg 2002; 6(5): 781 – 783.
19. Ayers R. Chylous ascites and jejunal carcinoid: a diagnostic challenge. ANZ J Surg 2005; 75(7): 618 – 619.
20. Warner RR, Croen EC, Zaveri K et al. A carcinoid tumor associated with chylous ascites and elevated tumor markers. Int J Colorectal Dis 2002; 17(3): 156 – 160.
21. Portale TR, Mosca F, Minona E et al. Gastrointestinal carcinoid tumor and chylous ascites, a rare association with a poor prognosis. A case report. Tumori 2008; 94(3): 419 – 421.
22. Modlin IM, Moss SF, Oberg K et al. Gastrointestinal neuroendocrine (carcinoid) tumours: current diagnosis and managment. Med J Aust 2010; 193(1): 46 – 52.
23. Deftos LJ. Chromogranin‑A: its role in endocrine function as an endocrine and non‑endocrine tumor marker. Endocr Rev 1991; 12(2): 181 – 187.
24. Modlin IM, Gustafsson BI, Moss SF et al. Chromagranin A ‑ biological fiction and clinical utility in neuro endocrine tumor dinase. Ann Surg Oncol 2010; 17(9): 2427 – 2443.
25. Bergmann JF, Beaugrand M, Labadie H et al. CA 125 (ovarian tumour‑associated antigen) in ascitic liver diseases. Clin Chim Acta 1986; 155(2): 163 – 165.
26. Sevinc A, Buyukberber S, Sari R et al. Elevated serum CA ‑ 125 levels in patients with nephrotic syndrome‑induced ascites. Anticancer Res 2000; 20(2B): 1201 – 1203.
27. Sevinc A, Buyukberber S, Sari R et al. Elevated serum CA ‑ 125 levels in hemodialysis patients with peritoneal, pleural, or pericardial fluids. Gynecol Oncol 2000; 77(2): 254 – 257.
28. Buamah P. Benign conditions associated with raised serum CA ‑ 125 concentration. J Surg Oncol 2000; 75(4): 264 – 265.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2013 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Editorial – k důvodům změn ve stagingu karcinomu vulvy
- Cykliny D v regulaci a dysregulaci buněčného cyklu u mnohočetného myelomu
- Důvody změn ve stagingu karcinomu vulvy
- Léčba infekcí u pacientů v paliativní symptomatické a terminální fázi onkologického onemocnění
- Proliferačná aktivita v dospelom mozgu potkana po expozícii ionizujúcim žiarením
- Nefroblastom – 30 let léčby ve Fakultní nemocnici v Motole
- Dosažení kompletní hematologické remise je zásadní pro prodloužení přežití nemocných s AL amyloidózou a srdečním postižením
- Klinické, histopatologické a zobrazovací charakteristiky non‑hodgkinských lymfomů u pacientů s postižením mozku
- Léčba polyneuropatické bolesti u nemocného s generalizovaným, kastračně rezistentním karcinomem prostaty – klinická kazuistika
- Chylózní ascites jako závažná komplikace neuroendokrinního tumoru ilea – kazuistika
- Informace z České onkologické společnosti
- Pacientka s atypickým neurocytomem – kazuistika
- Aktuality v onkologii
- Onkogeny RAS – prediktivní molekulární marker u kolorektálního karcinomu
-
Onkologie v obrazech
Spinocellulární karcinom v terénu jizvy po extravasaci cytostatika - ESMO
- 2. NÁRODNÍ KONGRES O KOLOREKTÁLNÍM KARCINOMU
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Léčba infekcí u pacientů v paliativní symptomatické a terminální fázi onkologického onemocnění
- Chylózní ascites jako závažná komplikace neuroendokrinního tumoru ilea – kazuistika
- Nefroblastom – 30 let léčby ve Fakultní nemocnici v Motole
- Důvody změn ve stagingu karcinomu vulvy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



