-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Klinické, histopatologické a zobrazovací charakteristiky non‑hodgkinských lymfomů u pacientů s postižením mozku
The Clinical, Histopathological and Imaging Methods Characteristics of Non ‑ Hodgkin Lymphomas in Patients with Brain Involvement
Background:
The Non ‑ Hodgkin‑lymphoma (NHL) brain infiltration carries a poor prognosis. Because of relatively rare incidence, we decided to share our experience.Patients and Methods:
Retrospective analysis of patients with NHL brain infiltration diagnosed in 2001 – 2011 at our university hospital.Results:
Twenty ‑ seven patients with median age of 61 (range 42 – 82) years were analyzed. The primary diffuse large cell B ‑ cell lymphoma of CNS was defined in 22/ 27 (81%) patients, in the others systemic NHL was present. Median positivity of the proliferative marker Ki ‑ 67 was 80%, the number of NHL lesions 1 (1 – 8), diameter 28 × 30 × 29 (11 × 16 × 20 to 85 × 76 × 65) mm. The fundamental finding in brain lymphoma MRI imaging was lesion with predominantly homogenous contrast enhancement, diffusion restriction and collateral edema. Thirteen out of 27 (48%) patients underwent lumbar puncture, and lymphoma presence in fluid was detected in only two of them. The most frequent symptoms were limb paresis or hemiparesis (55%), bradypsichysm (22%), expressive aphasia (22%), cephalea (18%). Corticosteroid therapy, as a primary treatment option, was indicated in 15% of patients with a median overall survival of one month, CNS radiotherapy in 37% with a median survival of three months, and chemotherapy in 48% patients with a median overall survival 10 (2 – 45) months.Conclusion:
The brain lymphomas are rare and prognostically very unfavorable affection. When specifying brain focal lesions on MRI, it is necessary to consider this etiology and to elect imaging protocols with contrast agents and diffusion weighted sequence. Biopsy should be performed prior to start of corticosteroid therapy. Intensive chemotherapy or radiotherapy indication must be individually considered, and proposed treatment should be initiated immediately with a potential for somewhat prolonged survival.Key words:
lymphoma – brain – magnetic resonance imaging – neurosurgical procedures – cranial irradiation – chemotherapy
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
29. 2. 2013Accepted:
11. 7. 2013
Autoři: S. Vokurka 1; R. Tupý 2; L. Boudová 3; J. Mraček 4; P. Jindra 1; J. Ferda 2
; M. Hrabětová 1
Působiště autorů: Hematologicko‑onkologické oddělení LF UK a FN Plzeň 1; Klinika zobrazovacích metod LF UK a FN Plzeň 2; Patologicko‑anatomický ústav LF UK a FN Plzeň 3; Neurochirurgické oddělení LF UK a FN Plzeň 4
Vyšlo v časopise: Klin Onkol 2013; 26(5): 348-353
Kategorie: Původní práce
Souhrn
Východiska:
Non ‑ hodgkinské lymfomy (NHL) mozku je možno pokládat za závažná postižení. Pro relativně vzácný výskyt jsme zpracovali naše zkušenosti.Soubor a metody:
Retrospektivní analýza pacientů s ložiskovým postižením mozku NHL diagnostikovaným v období 2001 až 2011 v naší fakultní nemocnici.Výsledky:
Analyzováno 27 pacientů, medián věku 61 (42 – 82) let. Primární difuzní velkobuněčný lymfom CNS byl zastižen u 22/ 27 (81 %), u ostatních se jednalo o NHL se systémovým postižením. Medián pozitivity proliferačního markeru Ki ‑ 67 byl 80 %, počet NHL ložisek 1 (1 – 8), velikost 28 × 30 × 29 (11 × 16 × 20 – 85 × 76 × 65) mm. Zásadní vlastností NHL mozku při MRI vyšetření byl nález ložiskového procesu s výrazným, převážně homogenním kontrastním sycením, restrikcí difuze a koleterálním edémem. U 13/ 27 (48 %) pacientů byla provedena lumbální punkce a pouze u dvou byla zastižena přítomnost NHL v likvoru. Nejčastějšími symptomy byla paréza končetiny nebo hemiparéza (55 %), bradypsychismus (22 %), expresivní afázie (22 %) a cefalea (18 %). Jako primární léčba byla indikována kortikoterapie u 15 % pacientů s mediánem celkového přežití 1 měsíc, aktinoterapie CNS u 37 % s mediánem přežití 3 měsíce, chemoterapie u 48 % pacientů s mediánem celkového přežití 10 (2 – 45) měsíců.Závěr:
NHL mozku jsou relativně vzácné a prognosticky nepříznivé. Při specifikaci ložiskového postižení mozku pomocí MRI je nutno myslet na tuto etiologii a zvolit protokol vyšetření s kontrastní látkou a difuzně váženými sekvencemi. Biopsie by měla být provedena před zahájením kortikoterapie. Musí být individuálně zvážena únosnost k intenzivní chemoterapii nebo radioterapii, přičemž navržená léčba by měla být zahájena obratem s potenciálem i dlouhodobějšího přežití.Klíčová slova:
lymfom – mozek – magnetická rezonance – neurochirurgické výkony – radioterapie – chemoterapieÚvod
Lymfom mozku popsal poprvé Bailey v roce 1929 pod názvem peritheliální sarkom, ale až do roku 1975, kdy bylo prokázáno, že se jedná o malignitu lymfomové řady, se používala také řada jiných názvů, jako např. mikrogliom nebo sarkom z retikulinových buněk [1].
Postižení mozku non‑hodgkinským lymfomem (NHL) je poměrně vzácné, nikoliv však překvapivé postižení. Primární lymfomy centrální nervové soustavy (primary CNS lymphoma – PCNSL), resp. primární difuzní velkobuněčný lymfom CNS (diffuse large B ‑ cell lymphoma of CNS – DLBCL CNS) podle aktuální WHO klasifikace 2008 představuje přibližně 2 – 5 % všech intrakraniálních tumorů a méně než 1 % všech NHL a častější výskyt v posledních 25 letech je dáván do souvislosti s AIDS a zvyšujícím se počtem nemocných léčených imunosupresivy po transplantacích [2]. Sérologické vyšetření na pozitivitu HIV1/ 2 by mělo být součástí vyšetřovacího plánu pacientů s PCNSL. Další případy NHL mozku pak mohou být projevem a součástí systémového lymfomového postižení. Zhruba 95 % všech primárních lymfomů jsou histologicky DLBCL (diffuse large B ‑ cell lymphoma), zbytek pak periferní T lymfom (peripheral T ‑ cell lymphoma – PTCL), Burkittův lymfom a nízce maligní B lymfom. U imunodeficitních pacientů s AIDS je to prakticky vždy infiltrát DLBCL [3].
Problematice diagnostiky a léčby lymfomů se v naší zemi přehledně věnuje Kooperativní lymfomová skupina – KLS [4,5]. Podle aktuálních doporučení má být součástí standardního zobrazovacího vyšetření CT a MRI mozku, resp. MRI páteře a páteřního kanálu při postižení mozkomíšního moku, dále v rámci kompletního stagingu CT hrudníku, břicha a pánve (alternativně PET ‑ CT), dále kompletní oftalmologické vyšetření, vyšetření likvoru (cytologicky, průtokovou cytometrií), vyšetření klonality lehkých řetězců a klonality přestavby genu pro těžký řetězec imunoglobulinu IgH (IgH přestavba), neurologické vyšetření k objektivizaci vstupního stavu a alespoň bazální vyšetření kognitivních funkcí. K doplňujícím vyšetřením patří histologie kostní dřeně a USG varlat. Podle KLS by měl být neurochirurgický zákrok omezen jen na odběr biopsie, základem terapie jsou protokoly s vysokodávkovaným metotrexátem. Význam intratékálního, resp. intraventrikulárního podávání cytostatik u nemocných bez postižení mening je sporný. Radioterapie zvyšuje toxicitu intenzivní chemoterapie zejména u pacientů nad 60 let a může se vynechat, nebo naopak aplikovat zcela samostatně. Není‑li chemoterapie indikována, podání steroidů je indikované, pokud má pacient zvýšený intrakraniální tlak a je riziko vzniku edému mozku [5].
Prognóza pacientů je obecně nepříznivá s ohledem na přítomnost rizikových faktorů, věk, celkový stav a přidružená onemocnění, ale při intenzivních postupech léčby kombinujících chemoterapii a radioterapii lze u selektovaných pacientů zajistit dva roky celkového přežití u 82 % pacientů do 60 let [6].
S ohledem na to, že v českém písemnictví je nedostatek původních prací zaměřených na analýzy souborů pacientů s lymfomy mozku [7,8], obzvláště pak z multidisciplinárního pohledu a bez jakékoliv další selekce pacientů, rozhodli jsme se zpracovat naše zkušenosti.
Metodika
Retrospektivní analýza pacientů s NHL diagnostikovaných v rámci naší fakultní nemocnice v období let 2001 – 2011 a s průkazným postižením mozku. Vyloučeni byli pacienti, u kterých byla prokázána pouze infiltrace mozkových plen. Jednotlivé nozologické jednotky NHL byly klasifikovány podle aktuální WHO 2008 klasifikace [2]. Biopsie patologických vzorků byly odečteny zkušenými patology spolupracujícími s českou KLS [4,9]. Analýza byla zaměřena na charakteristiky NHL z pohledu patologie, zobrazovacích metod a kliniky a dále na ověření využití léčebných postupů a jejich výsledků.
Byla hodnocena doba celkového přežití (overall survival – OS) stanovená jako počet měsíců od stanovení diagnózy do úmrtí. S ohledem na malý soubor pacientů byly využity pouze základní deskriptivní metody statistické analýzy bez potřeby využití speciálních programů.
Výsledky
Z celkového počtu 715 NHL evidovaných na našem pracovišti v období let 2001 – 2011 bylo zastiženo 27 (4 %) případů pacientů s postižením mozku, s mediánem věku 61 (42 – 82) let a se zastoupením mužského pohlaví 13/ 27 (48 %).
U 25/ 27 (93 %) pacientů byl NHL prokázán histologickým a imunohistochemickým vyšetřením přímo patologické tkáně mozku, u dvou zbylých pacientů se jednalo o nepřímé potvrzení na základě klinické souvislosti, výsledků vyšetření zobrazovacích metodik a na podkladě výsledku histologie uzliny v rámci systémového NHL se současným postižením mozku.
Podle aktuální WHO 2008 klasifikace byly v souboru definovány tyto nozologické jednotky: primární difuzní velkobuněčný lymfom (DLBCL) CNS – 22/ 27 (81 %), difuzní velkobuněčný B lymfom (DLBCL) systémový s postižením CNS – 3/ 27, mantle cell lymfom (MCL) systémový s postižením CNS v rámci relapsu malignity – 2/ 27.
Histologie
Histologicky byly z patologické tkáně mozku odečteny infiltráty DLBCL u 24 a MCL u jednoho pacienta. U dvou pacientů pak byla histologická diagnóza stanovena vyšetřením uzliny a odpovídala postižení MCL a DLBCL. U 17 pacientů s primárním DLBCL CNS vyšetřeným na přítomnost povrchového antigenu CD20 bylo pozitivních všech 17 vzorků, u 15 pak byl dostupný údaj o proliferačním markeru Ki ‑ 67 s mediánem pozitivity 80 % (30 – 90 %), přičemž pouze dva vzorky měly hodnotu pod 70 %.
Makroskopicky bylo možné alespoň zčásti posoudit nádorový infiltrát u devíti případů s většími vzorky pro histologické vyšetření (lobektomie, tumorektomie, parciální resekce). Okraje tumoru byly podle makroskopického vzhledu často neostré, a i když se u některých případů zdály jasně vymezené, při mikroskopickém vyšetření byly pak často i zde nádorové buňky daleko za hranicemi makroskopicky viditelného infiltrátu. Makroskopicky i mikroskopicky byly často patrny nekrózy a hemoragie, u některých pacientů i šíření lymfomu mezi měkkými plenami. Histologicky byly v případech DLBCL difuzní infiltráty s typickými výraznými perivaskulárními manžetami nádorových B buněk, někdy obzvláště nápadné na periferii infiltrátu. Cytologicky odpovídaly nádorové buňky nejčastěji centroblastům, případně imunoblastům.
Zobrazovací metody
Vyšetření MRI bylo provedeno u 20/ 27 pacientů, CT vyšetření u 21/ 27 a obojí metodiky byly využity u 15/ 27 pacientů. Medián počtu zobrazených lymfomových ložisek byl 1 (1 – 8), přičemž jedno ložisko bylo zastiženo u 17/ 27 (64 %) pacientů a více než tři ložiska pak u 7/ 27 (26 %). Medián velikosti ložiska byl 28 × 30 × 29 (11 × 16 × 20 – 85 × 76 × 65) mm.
V případě MRI bylo v originálním popisu a závěru zvažováno diferenciálně diagnosticky na prvním místě postižení lymfomem u 10/ 20 vyšetření, u 7/ 20 byla uvedena širší diferenciální diagnóza tumorů, u 3/ 20 bylo chybně na prvním místě dif. dg. uvažováno o gliovém tumoru a metastázách. V rámci zpětné revize dostupné obrazové MRI dokumentace u 15 případů a se znalostí diagnózy bylo u 13 pacientů konstatováno, že v diferenciální diagnóze mohl být NHL zvažován na prvním místě. Nálezy zahrnovaly tyto charakteristiky: koleterální edém 15/ 15 (100 %), homogenní kontrastní sycení 12/ 15 (80 %), supratentoriální výskyt ložisek 11/ 15 (73 %), infratentoriální výskyt ložisek 2/ 15 (13 %), kombinovaný výskyt 2/ 15 (13 %), čistě plazivá infiltrace 7/ 15 (46 %), čistě ovoidní ložiska 5/ 15 (33 %), kombinace obou typů ložisek 3/ 15 (20 %), postižení corpus callosum 4/ 15 (26 %).
V současném metodologickém trendu MR zobrazování ložiskových lézí mozku (tzn. součástí vyšetření jsou difuzně vážené sekvence a podání kontrastní látky) bylo kompletně vyšetřeno 11 pacientů a nález pak navíc zahrnoval restrikce difuze u 11/ 11 (100 %) případů.
Obrázky 1 – 6 demonstrují konkrétní nálezy při MR zobrazení lymfomového postižení CNS.
Obr. 1. Magnetická rezonance, FLASH T1 s kontrastní látkou i.v. Pacientka K. A. 1941, koronární řez, kontrastně se sytící infiltrát lymfomu v corpus callosum a periventrikulárně, hyposignální vazogenní edém v okolí. 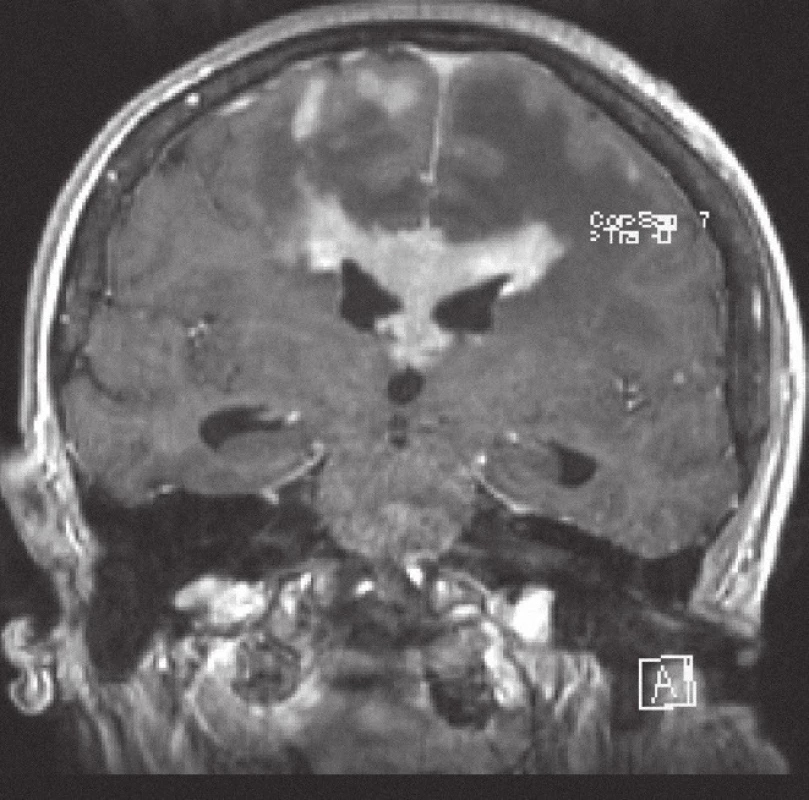
Obr. 2. Magnetická rezonance, SE MTC T1 s kontrastní látkou i.v. Pacientka K. A. 1941, transverzální řez, kontrastně se sytící infiltrát lymfomu v corpus callosum a periventrikulárně, hyposignální vazogenní edém v okolí. 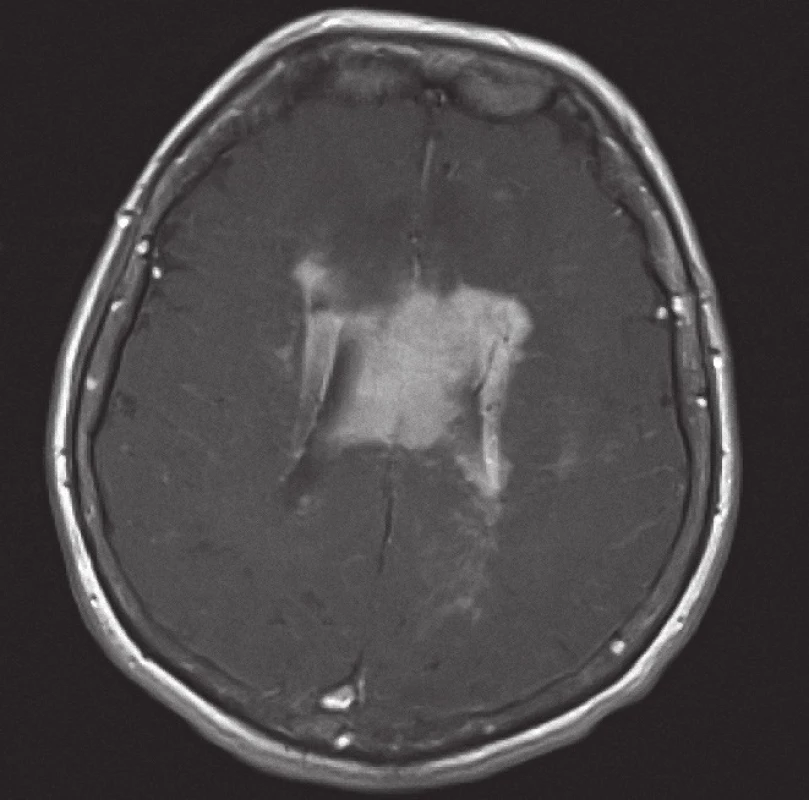
Obr. 3. Magnetická rezonance, mapa ADC (aparentní difuzní koeficient). Pacientka K. A. 1941, transverzální řez – restrikce difuze v infiltrátu lymfomu a facilitace difuze v rozsahu vazogenníhoedému. 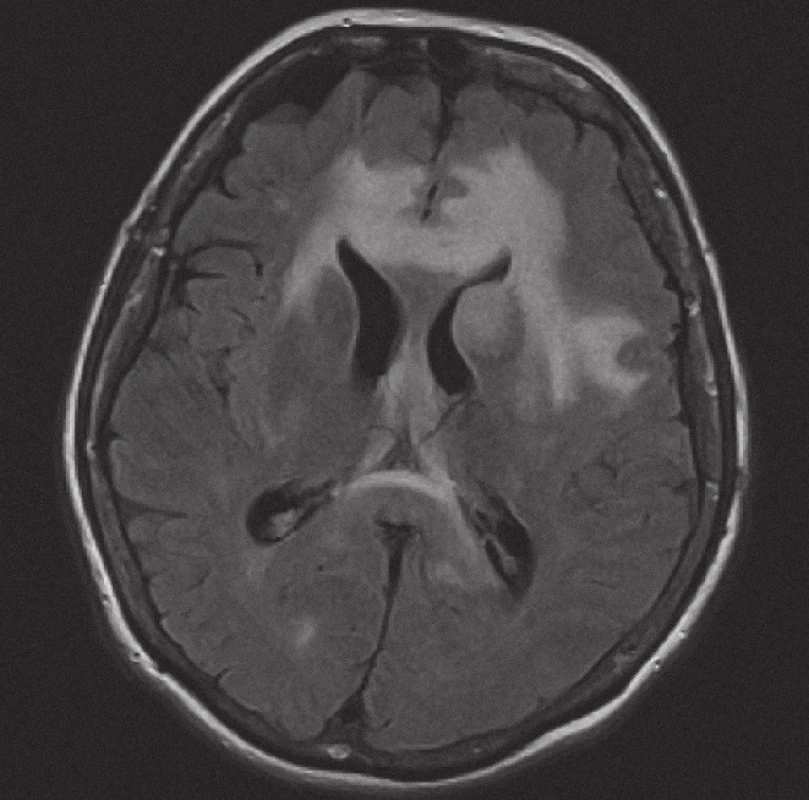
Obr. 4. Magnetická rezonance, spektroskopie. Pacientka K. A. 1941, vzestup cholinu a pokles N-acetylaspartátu v infiltrátu lymfomu. 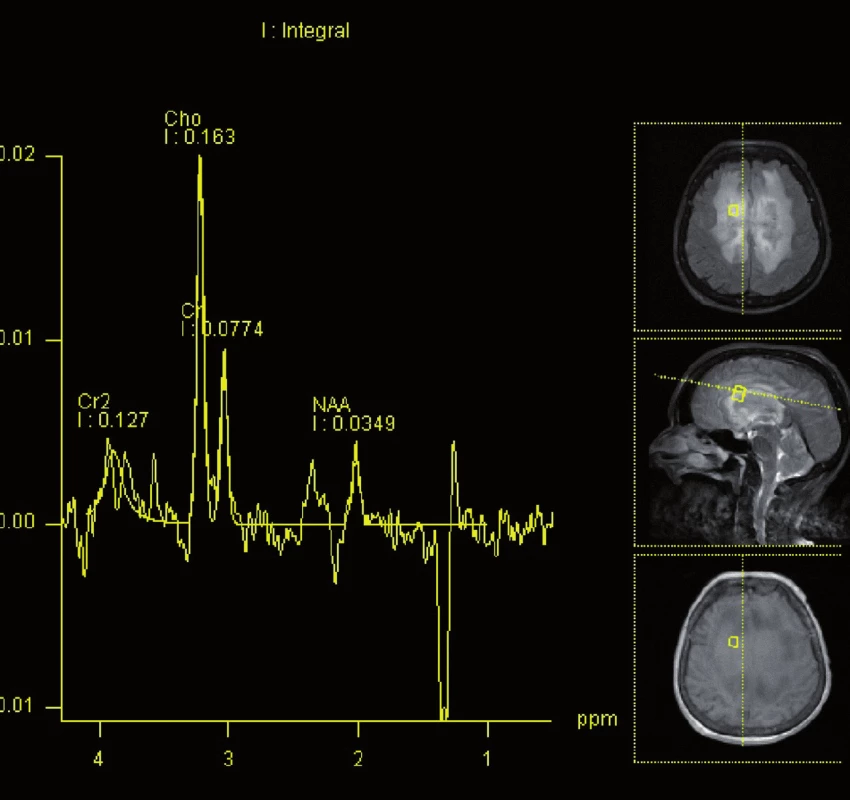
Obr. 5. Magnetická rezonance, SE MTC T1 s kontrastní látkou i.v. Pacientka C. R. 1934, kontrastně se sytící infiltrát v mozkovém kmeni při záchytu lymfomu. 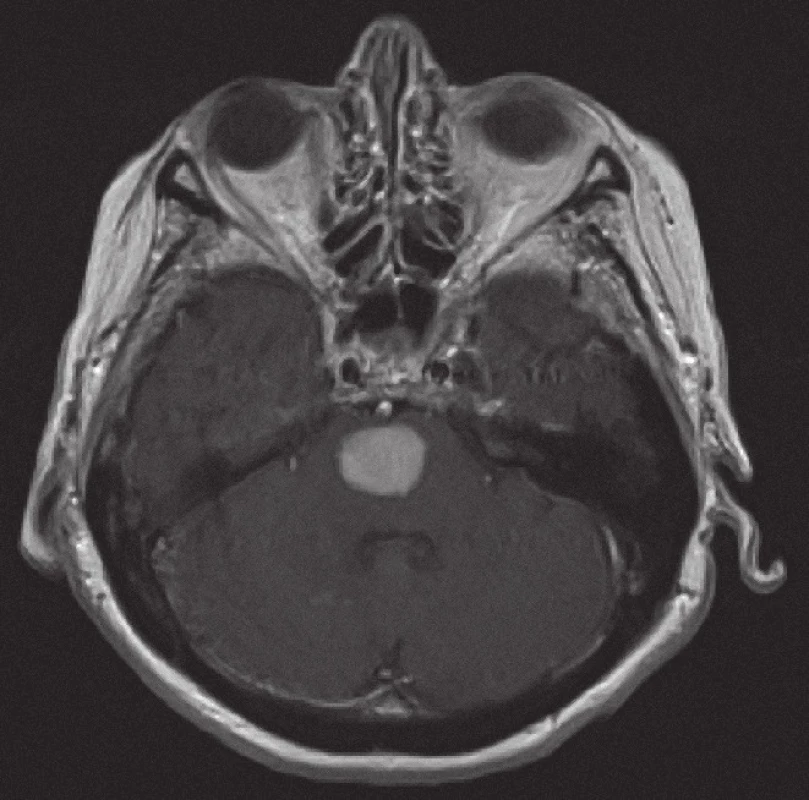
Obr. 6. Magnetická rezonance, SE MTC T1 s kontrastní látkou. Pacientka C. R. 1934, kontrastně se sytící infiltrát lymfomu v mozkovém kmeni zřetelně zmenšený po 10 dnech kortikoterapie ve srovnání se vstupním stavem na obr. 5. 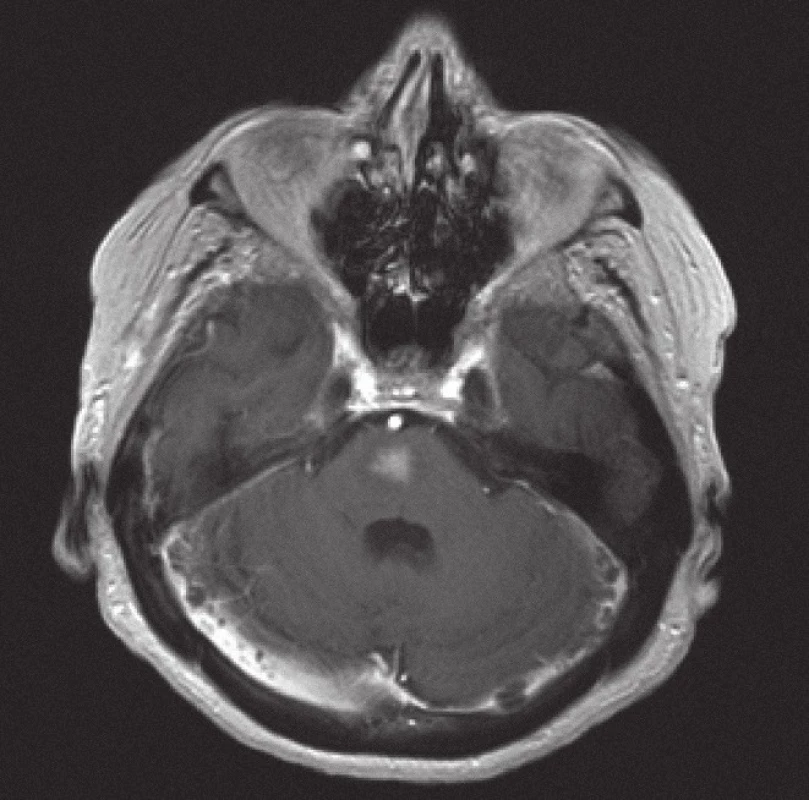
Neurochirurgický výkon
Neurochirurgický výkon byl indikován u 25/ 27 pacientů souboru. Provedena byla navigovaná biopsie u 16/ 25 (64 %) pacientů, tumorektomie u 4/ 25 (16 %), parciální resekce tumoru u 2/ 25 (8 %) a lobektomie u 3/ 25 (12 %) – frontální 2krát, temporální 1krát. Výkon nebyl proveden u dvou pacientů se zřejmým systémovým postižením, histologií odečtenou z lymfatické uzliny a jasnou klinicko‑zobrazovací korelací.
U celkem 13/ 27 (48 %) pacientů byla provedena lumbální punkce a pouze u dvou byl zastižen pozitivní nález v likvoru s průkazem patologické infiltrace dle cytologie, průtokové cytometrie a molekulárně‑geneticky detekované klonality přestavby genu pro těžký řetězec imunoglobulinu IgH (IgH přestavba).
Neurologická symptomatologie
Symptomy pacientů v době záchytu zahrnovaly: paréza končetiny nebo hemiparéza 15/ 27 (55 %), bradypsychizmus 6/ 27 (22 %), expresivní afázie 6/ 27 (22 %), cefalea 5/ 27 (18 %), dezorientace 5/ 27 (18 %), vertigo 5/ 29 (18 %), paréza hlavového nervu 4/ 27 (15 %), dysartrie 4/ 27 (15 %), epileptický paroxyzmus 3/ 27 (11 %), psychická porucha 3/ 27 (11 %), hemianopsie 2/ 27 (7 %), kvadruparéza s poruchou vědomí 1/ 27 (4 %).
Terapie
Kortikoterapie byla indikována samostatně a jako jediná léčba u celkem 4/ 27 (15 %) pacientů s mediánem věku 66 (56 – 76) let, v celkově nepříznivém stavu a s významnými komorbiditami. Medián celkového přežití byl 1 měsíc s maximem přežití 4 měsíce. U všech pacientů byla příčinou úmrtí progrese malignity nebo dekompenzace komorbidit a komplikací.
Radioterapie CNS byla indikována samostatně u celkem 10/ 27 (37 %) pacientů s mediánem věku 73 (54 – 82) let, a u kterých bylo považováno riziko systémové chemoterapie za velmi vysoké. Dávky aplikované radiace se pohybovaly v rozmezí 36 – 56 Gy, s mediánem 43 Gy. Medián celkového přežití byl 3 měsíce s maximem přežití 19 měsíců. Polovina pacientů zemřela v souvislosti s progresí nebo relapsem malignity, polovina pak z důvodů dekompenzací přidružených komorbidit a komplikací.
Chemoterapie jako primární léčba byla indikována u 13/ 27 (48 %) pacientů s mediánem věku 57 (42 – 74) let a aktinoterapie mozku byla doplněna ještě v rámci 1. linie léčby u 6/ 13 pacientů a u 3/ 13 pak v rámci léčby relapsu. Medián celkového přežití byl 10 (2 – 45) měsíců a 10/ 13 pacientů zemřelo na relaps/ progresi lymfomu. Dlouhodobé přežívání bez nemoci 52 měsíců je pouze u jednoho pacienta s původně systémovým DLBCL a se současným postižením mozku, který byl léčen protokolem DHAP s následnou konsolidací vysokodávkovanou chemoterapií s autologní transplantací krvetvorných buněk. V protokolech chemoterapie jinak dominovala cyklická aplikace metotrexátu dle EORTC u osmi pacientů, u čtyř mladších do věku 60 let byla navíc po dvou cyklech doplněna konsolidace vysokodávkovanou chemoterapií protokolu BEAM s autologní transplantací krvetvorných buněk, přičemž u jednoho pacienta nadále trvá první remise 52 měsíců, u třech pacientů pak bylo přežití bez relapsu/ progrese 6, 11 a 44 měsíců a celkové přežití 10, 13 a 45 měsíců.
Diskuze
Uvedená práce představuje multioborové zkušenosti u neselektovaných pacientů s lymfomovým postižením mozku v rámci jedné instituce. Přes limitaci v podobě velikosti souboru a své metodiky se domníváme, že téma práce zaměřené na specifickou a úzkou oblast hematoonkologie a mezioborovou spolupráci má svůj význam, obzvláště v kontextu s faktem, že v české literatuře není lymfomovému postižení mozku věnováno příliš primárních prací [7,8,10]. S ohledem na malý a nehomogenní soubor pacientů a s ohledem na krátkou dobu celkového přežívání nebyla hodnocena léčebná odpověď ve smyslu výsledku efektu chemoterapie nebo radioterapie a ani ve smyslu doby přežití do progrese (progression free survival – PFS). Hodnocena byla pouze doba celkového přežití (OS) a byly použity pouze základní statistické deskriptivní metodiky.
Svojí incidencí patří postižení mozku lymfomem (včetně primárního DLBCL CNS a systémových lymfomů) k vzácnějším afekcím. Zde činily tyto případy 4 % všech lymfomů u nás v dané době evidovaných, resp. každoročně byly zastiženy tři nové případy pacientů. V této souvislosti je třeba upozornit, že jsou zde zařazeni pouze nemocní s NHL postižením mozku, a nikoliv např. mozkových plen hematologickou malignitou obecně (např. leptomeningeální infiltrace mantle cell lymfomem, akutní lymfoblastickou leukemií atp.) a současně také platí, že někteří pacienti nemuseli být do celkové databáze pacientů s lymfomem zařazeni a tedy incidence lymfomů mozku a primárního DLBCL CNS bude reálně spíše o něco nižší, přibližně 3 %. V případě, že by do statistiky lymfomů byla započítána také chronická lymfatická leukemie (chronic lymphocytic leukemia – CLL), byla by incidence ještě nižší. Bohužel naše data není možné srovnat s českými daty, jelikož publikace české Kooperativní lymfomové skupiny údaje o lymfomech mozku neuvádí [11]. Obecně platí, že zhruba 95 % všech primárních lymfomů CNS odpovídá histologicky DLBCL, zbytek pak perifernímu T lymfomu (PTCL), Burkittovu lymfomu a nízce maligním B lymfomům. U imunodeficitních pacientů s AIDS je to prakticky vždy infiltrát DLBCL [3].
Histologická vyšetření provedená v rámci našeho souboru nepřinesla zásadnější překvapení ve smyslu zastoupení jednotlivých entit s jasnou dominancí DLBCL, nicméně jistě zajímavým faktem je častá a vysoká proliferační aktivita markeru Ki ‑ 67. Důležitá je také pozitivita přítomnosti povrchového CD20 antigenu, který vytváří potenciál pro využití protilátky anti‑CD20 rituximab v léčbě i přes omezený prostup přes hemato ‑ encefalickou bariéru. Praktický přínos léku však dokládají zkušenosti s jeho samostatným podáváním [12] nebo v rámci intenzivních protokolů, jako je např. LNHCP93 kombinující rituximab s vysokými dávkami metotrexátu a cytarabinu, dále s aplikací doxorubicinu, vinkristinu, prednisonu, s depotním lyposomálním intratekálním cytarabinem a radioterapií u pacientů do 60 let, kdy je dosahováno 2leté PFS 67 % a 2leté OS 82 % [6].
Z patologického hlediska je třeba diferenciálně diagnosticky odlišit CNS infiltraci lymfomem od zánětlivých lézí a jiných nádorů. Nejčastěji jde v diferenciální diagnóze o odlišení metastáz, obvykle karcinomů, ale i jiných nádorů, např. gliálních, melanomu nebo primitivních neuroektodermálních nádorů. Problémem může být v menší biopsii i přítomnost gliální reakce kolem lymfomového infiltrátu, která napodobuje astrocytom. Je nutné zdůraznit, že biopsie by měla být provedena, pokud je to jen trochu možné, před zahájením kortikoidní terapie, při které se může lymfom výrazně zmenšit (obr. 5, 6) a případně až dočasně zmizet (tzv. mizející lymfom – „vanishing lymphoma“), což značně ztíží a vzácně až zcela znemožní spolehlivě stanovit diagnózu. Nádorové buňky po aplikaci kortikoidů vykazují výraznou apoptózu, případně zcela zmizí, zároveň dojde k velké infiltraci makrofágy a k reaktivní glióze. Reakce na kortikoidy není specifická pro lymfomy CNS, obdobné změny jsou patrny i u dalších nádorů, případně také u reaktivních stavů. Domníváme se, že správně vedená metodologie zobrazovacích vyšetření je pro pacienta klíčová. Zobrazovací metody doporučené KLS pro detekci a stážování lymfomů byly rovněž využívány u našich pacientů a obzvláště pak v posledních letech se zastoupení současně provedeného MRI a CT zvýšilo, resp. se stalo standardně zavedeným postupem. CT vyšetření je však nutno považovat za velmi nespecifické vyšetření sloužící zde pouze k primární detekci ložiskového postižení mozku obecně. Za validní MRI vyšetření by podle našeho názoru mělo být v současné době považováno pouze to, jehož součástí jsou difuzně vážené sekvence, podání kontrastní látky a nejlépe i MRI spektroskopie (obr. 1 – 4). Takto provedené grafické vyšetření má aktuálně nejvyšší výpovědní hodnotu a v případě realizace neurochirurgického zákroku může vést k větší zdrženlivosti operatéra v radikalitě výkonu. Chirurgický zákrok většího rozsahu než biopsie postrádá v případě lymfomu CNS smysl, pakliže není jiná možnost pro stanovení přesné diagnózy nebo hrozí‑li jinak u pacienta neurologické komplikace. Pouze na podkladě nálezu zobrazovacích metod však nelze diagnózu lymfomu spolehlivě určit. Diferenciálně diagnosticky je na prvním místě stále třeba pomýšlet na glioblastom. Obrazová data MRI vyšetření neurochirurg používá k navigované cílené biopsii. Resekční výkony uvedené v našem souboru byly indikovány v případech, kdy progredoval neurologický deficit na podkladě expanzivních projevů tumoru, který v té době ještě nebyl histologicky verifikován. Před realizací případné biopsie mozku při podezření na lymfom by mělo být ještě v úvodu doplněno ideálně PET ‑ CT trupu k ověření případného systémového rozsahu malignity a možnosti realizovat odběr patologické tkáně z dostupnější a méně rizikové oblasti.
Léčebné postupy zvolené u jednotlivých pacientů v souboru odrážely především věk a celkový stav pacienta s komorbiditami, když u mladších nemocných byla více zastoupena intenzivnější léčba využívající chemoterapii s vysokodávkovaným metotrexátem a případně pak ještě konsolidaci s autologní transplantací periferních krvetvorných buněk a případně také radioterapii mozku. S ohledem na velikost a heterogenitu našeho souboru a retrospektivní charakter práce není možné objektivně hodnotit efekt a přesný důvod indikace jednotlivých léčebných modalit. Současně není možné na základě našich pozorování ani objektivně komentovat jejich význam a účinnost. Závěrem však můžeme shrnout, že čistě kortikoterapie byla indikována u pacientů v celkově nepříznivém stavu ve snaze zajistit alespoň krátkodobé ovlivnění nemoci, případně byla zajištěna u pacientů, kde sice byla plánována intenzivnější léčba, ale nebyla realizována z důvodu prudké progrese nemoci či jiné závažné komplikace. Na druhé straně je třeba opět zdůraznit, že kortikoterapie by neměla být podávána před plánovanou biopsií, neboť dočasnou regresí procesu znesnadní spolehlivý histologický odečet lymfomu. Radioterapie jako samostatná léčba byla rovněž indikována u pacientů starších či u pacientů s předpokladem obtížné tolerance intenzivní chemoterapie a přinesla rovněž jen krátkodobou kontrolu nemoci. Chemoterapie s využitím vysokodávkovaného metotrexátu i.v. a s plánem podání alespoň dvou cyklů léčby byla zahájena jen u poloviny pacientů souboru s obecně nižším věkem. Téměř u poloviny z nich bylo pro špatnou toleranci nebo progresi možno podat cyklus léčby jen jeden, u menší části pacientů pak bylo možné doplnění autologní transplantace periferních krvetvorných buněk. U našich pacientů léčených chemoterapií bylo patrné delší přežívání, nicméně u nikoho, krom jednoho, nedošlo k dlouhodobé remisi nebo vyléčení. Intenzivní indukční chemoterapie s dominantním zastoupením vysokodávkovaného metotrexátu a doplnění vysokodávkované chemoterapie za účelem dosažení lepších léčebných výsledků jsou však všeobecně doporučovány [13].
Závěr
Lymfomové postižení mozku je vzácnější, prakticky lze ale na větších pracovištích přepokládat pravidelný záchyt takových pacientů. Mezioborová spolupráce je nezbytná. Při specifikaci ložiskového postižení mozku pomocí MRI je nutno myslet na tuto etiologii a zvolit protokol vyšetření s kontrastní látkou a difuzně váženými sekvencemi. Biopsie by měla být provedena před zahájením kortikoterapie. Musí být individuálně zvážena únosnost k intenzivní chemoterapii nebo radioterapii, přičemž navržená léčba by pak měla být zahájena obratem.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. MUDr. Samuel Vokurka, Ph.D.
Hematologicko-onkologické oddělení
LF UK a FN Plzeň
alej Svobody 80
304 60 Plzeň
e-mail: vokurka@fnplzen.cz
Obdrženo: 29. 2. 2013
Přijato: 11. 7. 2013
Zdroje
1. Kozler P, Beneš V, Chytka T et al (eds). Intrakraniální nádory, 1. vyd. Praha: Galén 2007.
2. Swerdlow SH, Campo E, Harris NL et al (eds). WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. 4th ed. World Health Organization 2008.
3. Ferry JA. Lymphomas of the Nervous system and the Meninges. In: Ferry JA (ed.). Extranodal Lymphomas. Philadelphia, USA: Elsevier Saunders 2011 : 7 – 33.
4. Lymphoma.cz [internetová stránka]. Czech Lymphoma Study Group – Kooperativní Lymfomová Skupina, Česká republika; c2013. Dostupné z: http:/ / www.lymphoma.cz/ intro.php.
5. Belada D, Trněný M, Kooperativní lymfomová skupina (eds). Diagnostické a léčebné postupy u nemocných s maligními lymfomy. 4. vyd. Hradec Králové: CREDIT s.r.o. 2011 : 72 – 74.
6. Ghesquieres H, Tilly H, Sonet A et al. A Multicentric Prospective Phase 2 Study of Intravenous Rituximab and Intrathecal Liposomal Cytarabine in Combination with C5R Protocol Followed by Brain Radiotherapy for Immunocompetent Patients with Primary CNS Lymphoma: A Lymphoma Study Association (LYSA) Trial. Blood 2012; 120: abstr. 796.
7. Pánková J, Benešová E, Klener P et al. Primární lymfom centrální nervové soustavy. Klin Onkol 1998; 11(4): 112 – 115.
8. Boudová L, Fakan F, Škůci I et al. Lymfomy centrálního nervového systému. Klinickopatologická studie 70 případů. Abstrakt 004. In: Sborník abstrakt. XII. Jihočeské onkologické dny. Český Krumlov, 13. – 15. října 2005.
9. Fabian P, Boudová L. Poznámky ke 4. vydání klasifikace lymfomů WHO. Klin Onkol 2009; 22(3): 121 – 122.
10. Kopal A, Ehler E, Kerekes Z et al. Primární lymfom mozku. Neurol Prax 2010; 11(2): 129 – 132.
11. Trněný M, Vášová I, Pytlík R et al. Distribuce podtypů non‑hodgkinského lymfomu v České republice a jejich přežití. Klin Onkol 2007; 20(5): 341 – 348.
12. Batchelor T, Lesser G, Grossman S et al. Rituximab monotherapy for relapsed or refractory primary central nervous system lymphoma. Annual meeting of the American Society of Clinical Oncology. Chicago, USA: May 30–June 1, 2008: abstr. 2043.
13. Reddy N, Savani BN. Primary central nervous system lymphoma: implication of high‑dose chemotherapy followed by auto ‑ SCT. Bone Marrow Transplant 2012; 47(10): 1265 – 1268.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2013 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Editorial – k důvodům změn ve stagingu karcinomu vulvy
- Cykliny D v regulaci a dysregulaci buněčného cyklu u mnohočetného myelomu
- Důvody změn ve stagingu karcinomu vulvy
- Léčba infekcí u pacientů v paliativní symptomatické a terminální fázi onkologického onemocnění
- Proliferačná aktivita v dospelom mozgu potkana po expozícii ionizujúcim žiarením
- Nefroblastom – 30 let léčby ve Fakultní nemocnici v Motole
- Dosažení kompletní hematologické remise je zásadní pro prodloužení přežití nemocných s AL amyloidózou a srdečním postižením
- Klinické, histopatologické a zobrazovací charakteristiky non‑hodgkinských lymfomů u pacientů s postižením mozku
- Léčba polyneuropatické bolesti u nemocného s generalizovaným, kastračně rezistentním karcinomem prostaty – klinická kazuistika
- Chylózní ascites jako závažná komplikace neuroendokrinního tumoru ilea – kazuistika
- Informace z České onkologické společnosti
- Pacientka s atypickým neurocytomem – kazuistika
- Aktuality v onkologii
- Onkogeny RAS – prediktivní molekulární marker u kolorektálního karcinomu
-
Onkologie v obrazech
Spinocellulární karcinom v terénu jizvy po extravasaci cytostatika - ESMO
- 2. NÁRODNÍ KONGRES O KOLOREKTÁLNÍM KARCINOMU
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Léčba infekcí u pacientů v paliativní symptomatické a terminální fázi onkologického onemocnění
- Chylózní ascites jako závažná komplikace neuroendokrinního tumoru ilea – kazuistika
- Nefroblastom – 30 let léčby ve Fakultní nemocnici v Motole
- Důvody změn ve stagingu karcinomu vulvy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



