-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Nefroblastom – 30 let léčby ve Fakultní nemocnici v Motole
Nephroblastoma – 30-Years Period of its Treatment in the University Hospital Motol, Prague
Introduction:
Nephroblastoma (Wilms’ tumor – WT) is the most common solid tumor of kidney in children. We present treatment development of WT at the Department of Pediatric Hematology and Oncology, Charles University in Prague, 2nd Faculty of Medicine and University Hospital Motol (KDHO) in the Czech Republic over 30 years. Patients that were treated prior to access to the International Society of Pediatric Oncology (SIOP) protocols are considered to be the historical group, then we have patients treated according to SIOP 9, SIOP 93–01 and SIOP 2001 protocols as full participants of SIOP studies.Patients and Methods:
Between January 1980 and April 2009, we treated 330 patients with WT at KDHO: 91 patients in historical group (1980–1988), 94 pts in SIOP 9 (1988–1993), 80 pts in SIOP 93–01 (1994–2001) and 65 pts in SIOP 2001 (2002–2009). Overall survival (OS) and event-free survival (EFS) were analyzed by Kaplan-Meier test.Results:
The overall ten-year EFS was 81.2% and OS 87.6%. Fifty-eight patients from the 330 (17.6%) had metastases at diagnosis, EFS without metastatic process was 84.6% compared to 65.4% with metastasis presented at diagnosis (p = 0.0003), OS was 70.7% compared to 91.2% (p < 0.0001). One hundred and seventy patients (51.5%) were treated with preoperative chemotherapy and/or radiotherapy, whereas 158 patients (47.5%) underwent primary nephrectomy; EFS and OS did not differ: neoadjuvant vs primary nephrectomy EFS was 81.2% vs 80.9% (p = 0.85), OS 89.4% vs 85.4% (p = 0.38). Sixty (18%) patients experienced disease recurrence; OS after relapse was 33%. In the historical group, EFS and OS were 85.7% and 91.2%. In patients treated according to the SIOP 9 protocol, EFS and OS were 68.1% and 74.5%, resp. In patients treated according to SIOP 93–01, it was 83.6% and 93.7%, resp. and in patients treated according to 87 SIOP 2001, it was 7% and 95.4% (p = 0.001 and p = 0.0008), resp.Conclusion:
WT is a well treatable disease. The aim for the future is to maintain the current very good survival while minimizing the treatment intensity.Key words:
nephroblastoma – Wilms’ tumor – treatment – prognosis
This study was supported by project of the Czech Ministry of Health – DRO, University Hospital Motol No. 00064203.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
29. 3. 2013Accepted:
23. 5. 2013
Autori: J. Mališ 1; K. Švojgr 1; K. Pýcha 2; V. Jeřábková 1; S. Cyprová 1; M. Churáčková 1; V. Šmelhaus 1; J. Radvanský 3; M. Zítková 4; R. Kodet 5; D. Kodetová 5; B. Malinová 6; J. Koutecký 1; J. Šnajdauf 2; J. Starý 1
Pôsobisko autorov: Klinika dětské hematologie a onkologie 2. LF UK a FN v Motole, Praha 1; Klinika dětské chirurgie 2. LF UK a FN v Motole, Praha 2; Oddělení tělovýchovného lékařství, FN v Motole, Praha 3; Klinika zobrazovacích metod 2. LF UK a FN v Motole, Praha 4; Ústav patologie a molekulární medicíny 2. LF UK a FN v Motole, Praha 5; Radioterapeuticko‑onkologické oddělení, FN v Motole, Praha 6
Vyšlo v časopise: Klin Onkol 2013; 26(5): 336-342
Kategória: Původní práce
Súhrn
Úvod:
Nefroblastom (Wilmsův tumor – WT) je nejčastějším solidním nádorem ledvin u dětí. V naší práci představujeme cestu k moderní léčbě WT v České republice na Klinice dětské hematologie a onkologie (KDHO) 2. LF UK a FN v Motole za 30 let. Pacienti zařazení do historické skupiny byli léčeni před přistoupením k mezinárodní léčebné skupině International Society of Pediatric Oncology (SIOP), po přistoupení byli dále léčeni podle léčebných protokolů SIOP 9, SIOP 93 - 01 a SIOP 2001.Soubor pacientů a metody:
Mezi lednem 1980 a dubnem 2009 jsme na KDHO léčili 330 pacientů s WT. V historické skupině (1980 – 1988) bylo 91 pacientů, podle protokolu SIOP 9 (1988 – 1993) bylo léčeno 94, SIOP 93–01 (1994 – 2001) 80 a SIOP 2001 (2002 – 2009) 65 pacientů. Pomocí Kaplan ‑ Meierova testu jsme hodnotili celkové přežití (overall survival – OS) a přežití bez události (event‑free survival – EFS).Výsledky:
V celém souboru je 10leté EFS 81,2 %, OS 87,6 %. Z 330 pacientů mělo 58 (17,6 %) přítomny metastázy v době diagnózy, EFS bez metastatického procesu je 84,6 % oproti 65,4 % u pacientů s metastázami (p = 0,0003), OS je 70,7 % oproti 91,2 % (p < 0,0001). Ze všech pacientů bylo 170 (51,5 %) léčeno předoperační chemoterapií a/ nebo radioterapií. 158 pacientů (47,5 %) podstoupilo primární nefrektomii. EFS a OS se mezi těmito skupinami neliší: neoadjuvantně vs primátní nefrektomie – EFS 81,2 % vs 80,9 % (p = 0,85), OS 89,4 % vs 85,4% (p = 0,38). Šedesát (18 %) pacientů prodělalo recidivu onemocnění, OS po relapsu je 33 %. EFS a OS historické skupiny je 85,7 % a 91,2 %, u pacientů léčených podle protokolu SIOP 9 68,1 % a 74,5 %, SIOP 93 – 01 83,6 % a 93,7 % a SIOP 2001 87,7 % a 95,4 % (p = 0,001 a p = 0,0008).Závěr:
Naše data potvrzují, že WT je již od 80. let minulého století dobře léčitelné onemocnění. Cílem do budoucna je zachovat současné velmi dobré přežití pacientů s WT a zároveň minimalizovat pozdní následky náročné onkologické léčby.Klíčová slova:
nefroblastom – Wilmsův nádor – terapie – prognózaÚvod
Nefroblastom (Wilmsův tumor – WT) tvoří 6 % až 7 % všech zhoubných nádorů postihujících děti a dospívající a je nejčastějším nádorem ledvin v této věkové kategorii. V současnosti patří mezi nejlépe léčitelné nádory – více než 90 % nemocných s nefroblastomem se podaří trvale vyléčit. Cílem moderních léčebných postupů u WT je minimalizovat léčbu (a snížit tak riziko pozdních následků) především u typů s dobrou prognózou, a naopak používat intenzivnější terapii u vysoce maligních a agresivních podtypů (variant).
Cesta k současným velmi dobrým léčebným výsledkům byla velmi dlouhá a pozoruhodná. První zmínky o maligních nádorech ledvin u dětí sahají až do počátku 19. století, kdy pod rozličnými názvy byl popisován stejný typ nádoru. Tyto společné rysy vyzvedl a vlastní zkušeností doplnil německý chirurg Max Wilms (1899), který tento nádor kategorizoval jako smíšený nádor ledvin [1]. Na počátku 20. století bylo možné nádor pouze operovat, z dnešního pohledu s velmi mizivými výsledky: 10 % uzdravených dětí. Záhy po objevu paprsků X (Roentgenova záření) v roce 1905 použil Frielinger v Mnichově poprvé ozařování při léčbě maligního nádoru ledviny u 4letého dítěte, ale teprve na konci 1. čtvrtiny 20. století se začaly tyto dvě metody (operace a ozařování) používat v kombinaci, kdy radioterapie byla použita jako metoda přípravy před nefrektomií. Diagnostické a léčebné postupy vznikaly na podkladě dostupných výsledků jednotlivých léčebných postupů. Ladd v době, kdy chemoterapie nebyla k dispozici, doložil, že tento nádor je možné odstranit i přes jeho často enormní rozměry [2]. Zařazení pooperační radioterapie umožnilo vyléčit již 50 % nemocných s WT [3]. Chemoterapie jako další léčebná modalita se začala používat ve 40. letech 20. století. Z mnoha testovaných léků vykazoval nejlepší účinnost aktinomycin, posléze doplněný v 60. letech vinkristinem a antracykliny [4]. Stanovení optimálního léčebného postupu, řazení jednotlivých léčebných modalit a určení nejúčinnější kombinace cytostatik představovaly cíle nově ustavené National Wilms Tumor Study (NWTS), založené v roce 1969 v USA [5]. V Evropě vznikla na konci 60. let 20. století nadnárodní skupina SIOP (Societé Internationale d‘Oncologie Pédiatrique, International Society of Pediatric Oncology) a v roce 1972 byla zahájena první evropská studie pro léčbu nefroblastomů. Obě skupiny jsou aktivní do současnosti a závěry jejich klinických studií vedly k dramatickému zlepšení léčebných výsledků, precizní stratifikaci léčby podle rizikových faktorů, racionalizaci používání diagnostických metod a vyčlenění nádorů ledvin odlišných od nefroblastomu (mezoblastický nefrom – benigní varianta nefroblastomu, vysoce agresivní rabdoidní nádor, do kostí metastazující nádor ledviny – sarkom z jasných buněk). Základním rozdílem mezi oběma pracovními skupinami je řazení nefrektomie ve sledu jednotlivých léčebných modalit. Severoamerická NWTS (je součástí Children‘s Oncology Group – COG) provádí iniciální nefrektomii, SIOP operuje až po několikatýdenní předoperační chemoterapii. Nemocní s WT byli již v prvních studiích rozděleni podle rozsahu postižení do pěti klinických skupin – základ v současnosti používaných klinických stadií nefroblastomu.
Tab. 1. Klinická stadia nefroblastomu. V průběhu studie SIOP Nephroblastoma Study 2001 se začal používat upravený staging, kde jakákoliv infi ltrovaná intraabdominální uzlina řadí nemocné do stadia III. Do té doby platilo, že postižení hilových uzlin bylo ještě stadium II, teprve postižení paraaortálních uzlin znamenalo III. klinické stadium [25]. ![Klinická stadia nefroblastomu. V průběhu studie SIOP Nephroblastoma Study 2001 se začal používat upravený staging, kde jakákoliv infi ltrovaná intraabdominální uzlina řadí nemocné do stadia III. Do té doby platilo, že postižení hilových uzlin bylo ještě stadium II, teprve postižení paraaortálních uzlin znamenalo III. klinické stadium [25].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/04c242933560900ab4897d4715d1dc8c.png)
Histopatologie
Klasický nefroblastom se skládá ze tří základních buněčných typů – blastémový, stromální a epiteliální, jednotlivé typy jsou zastoupeny v různých poměrech v nádorové tkáni. SIOP studie hodnotí histologický obraz po předoperační chemoterapii a podle stupně regresivních změn se pak nefroblastomy dělí na: a) nízkého rizika (kompletně nekrotický nefroblastom), b) průměrného rizika (regresivní epiteliální, stromální, smíšený nebo fokálně anaplastický nefroblastom) a c) vysokého rizika (blastémový nebo difuzně anaplastický nefroblastom) [6 – 8].
Cíle práce
Ukázat složitou cestu k moderní léčbě nefroblastomů v podmínkách Československa a později České republiky od 80. let minulého století.
Přehled diagnostických a léčebných postupů na Klinice dětské hematologie a onkologie FN v Motole.
1. etapa 1980 – 86/ 1988
Historická skupina zahrnuje děti s nefroblastomem, které byly vyšetřovány a léčeny podle tehdy dostupných informací, bez jakékoliv aktivní spolupráce nebo členství v mezinárodních studiích.
Vstupní vyšetření: břišní angiografie, dolní kavografie (u pravostranných nádorů k vyloučení intrakaválního šíření), lineární tomografie k vyšetření plicních metastáz.
Terapie: zpočátku paušální multimodální terapie s použitím všech léčebných modalit – radioterapie, chemoterapie a operace. Radioterapie: většinou rozdělena na dvě části předoperační a pooperační na oblast lůžka ledviny, v případě metastáz v plicích radioterapie na obě plicní křídla. Chemoterapie pro lokalizované formy: dvojkombinace vinkristinu a aktinomycinu, u pokročilejších forem kombinace rozšířena o adriamycin. Celková doba léčby byla dva roky. Na podkladě publikovaných výsledků v té době probíhajících nadnárodních studií (SIOP a NWTS) se v průběhu 80. let postupně ustoupilo od radioterapie u lokalizovaných forem a délka chemoterapie se postupně zkrátila na dobu jednoho roku. Operačním přístupem byl už tehdy abdominální přístup z širokého transperitoneálního řezu, který umožňoval nekomplikovanou nefrektomii a revizi druhostranné ledviny. Nebyla samozřejmostí biopsie nezvětšených paraaortálních uzlin, odstraňovaly se pouze zcela zřetelně zvětšené uzliny. Přesná histopatologická diagnostika byla značně omezená především v době, kdy se používala předoperační radioterapie, protože v převažující části se dostávaly k patologům ke zpracování již nekroticky změněné tkáně nádoru. Operace plicních metastáz se v té době neprováděly, na chemoterapii nereagující metastázy byly léčeny radioterapií.
2. etapa – aktivní začlenění do studií SIOP Nephroblastoma Study (1988 – 1993)
V roce 1988 se naše pracoviště poprvé zařadilo do celoevropské nadnárodní studie a začalo vyšetřovat a léčit nemocné s nefroblastomem podle tehdy probíhajícího protokolu SIOP 9 (studie vedena 1987 – 1991, registrovala 852 pacientů, z toho bylo 382 případů lokalizovaných pouze v ledvině). Cílem této studie bylo zhodnotit vliv trvání předoperační chemoterapie na stupeň odpovědi nádorové tkáně, možné operační komplikace (především peroperační ruptura nádoru) a celkové přežití. Předchozí studie totiž prokázaly jednoznačný efekt předoperační chemoterapie na snížení počtu ruptur v průběhu operace. Děti s nefroblastomem byly v průběhu neoadjuvantní chemoterapie randomizovány do dvou skupin – první byla léčena jako v předchozích studiích čtyři týdny a druhá skupina dostávala tuto předoperační léčbu po dobu osmi týdnů.
Vstupní vyšetření: základem stanovení diagnózy nefroblastomu začalo být ultrazvukové vyšetření, které dokáže s přihlédnutím k ostatním laboratorním metodám odlišit nefroblastom od jiných nádorových, případně nenádorových afekcí v retroperitoneu. Nejednoznačný ultrazvukový nález byl indikací k vyšetření počítačovou tomografií (CT). Plicní metastázy se diagnostikovaly předozadním a bočním snímkem plic, indikace k CT vyšetření plic byla ponechána na zvážení a zvyklostech jednotlivých center. Posléze bylo prokázáno, že děti, které mají negativní prostý snímek plic, ale na CT jsou patrné drobné metastázy, nemají horší prognózu. Za průkaz diseminace nefroblastomu do plic je považován jen nález metastáz na rentgenovém snímku plic [9].
3. etapa: SIOP 93 – 01 (1994 – 2001)
Cílem této studie bylo ověřit, zda další redukce pooperační chemoterapie u dětí s nefroblastomem I. klinického stadia neovlivní jejich přežití, a to posouzením dvou skupin – první, léčené podle dosavadního protokolu v rámci pooperační chemoterapie 18 týdnů, a druhé, léčené pouze čtyři týdny [10].
4. etapa: SIOP Nephroblastoma Study 2001 (2002 – 2009)
Představuje současný diagnostický a stratifikovaný terapeutický přístup k nemocným s nefroblastomem. Do randomizace je zařazena relativně úzká skupina nemocných střední rizikové skupiny nefroblastomů II. a III. klinického stadia, kde se hodnotí, zda je možné tyto nemocné léčit bez podávání kardiotoxických antracyklinů a dosáhnout stejných léčebných výsledků.
Vstupní vyšetření: základním vyšetřením je ultrazvukové vyšetření břicha, při nejednoznačném nálezu je upřednostňována magnetická rezonance před vyšetřením CT. Metastatické postižení plic lze dostatečně posoudit zadopředním a laterálním snímkem plic. Všechny děti jsou léčeny předoperační chemoterapií, po které následuje operace, jejíž součástí (kromě nefrektomie) je revize paraaortálních uzlin a odebrání 2 – 3 uzlin i v situaci, kdy nejeví makroskopické známky infiltrace. Vizuální nebo palpační vyšetření druhostranné ledviny již není vyžadováno, moderní vyšetření zobrazovacími metodami by event. druhostranné postižení mělo odhalit. Reziduální plicní, případně jaterní metastázy se řeší chirurgicky, pouze inoperabilní ložiska je nezbytné ozářit. U oboustranných nefroblastomů se upustilo od dřívějších postupů, kdy se prováděla nefrektomie závažněji postižené ledviny a případně parciální resekce zbývající ledviny. V současnosti se podává chemoterapie bez histologické verifikace po dobu několika týdnů, dokud se nádor, resp. nádorová ložiska, zmenšují, teprve pak se přistupuje k operaci, pokud možno parciální oboustranné resekci. Pooperační chemoterapie je přísně stratifikována podle podílů jednotlivých složek nefroblastomu – od velmi krátké 4týdenní chemoterapie dvojkombinací aktinomycinu a vinkristinu až po intenzivní kombinace čtyř cytostatik (karboplatina, cyklofosfamid, adriamycin a etoposid) včetně radioterapie. Základní ideou současného přístupu je minimalizovat intenzitu a délku chemoterapie u příznivých typů nefroblastomů, a naopak poskytnout dostatečně účinnou léčbu agresivnějším formám tohoto nádoru.
Metody
Kaplan ‑ Meierův test byl použit k hodnocení celkového přežití (overall survival – OS) a přežití bez události (event free survival – EFS) pomocí statistického programu StatView (SAS Institute, Cary, NC, USA). Fisherův exaktní test byl použit k porovnání dvou skupin s rozdílnou prognózou.
Soubor pacientů a výsledky
Na Klinice dětské hematologie a onkologie (do roku 2004 Klinika dětské onkologie) 2. LF UK a FN v Motole jsme mezi rokem 1980 až do dubna roku 2009 léčili 330 pacientů s nefroblastomem. I. klinického stadia (KS) bylo 196 pacientů, II. KS bylo 23, III. KS 40, IV. KS 46 a V. KS 25. Medián věku při diagnóze byl 3,28 roku (rozmezí 1 den až17,17 roku), chlapců bylo 156, dívek 174. Roční medián nově diagnostikovaných pacientů byl 10 pacientů za rok. Velká většina dětí s nefroblastomem (88 %) měla standardní histologii, low ‑ risk histologii mělo 4 % a high‑risk (přítomnost difuzní anaplazie či perzistence blastému po předoperační chemoterapii) mělo 8 % pacientů. Desetileté přežití bez události (EFS) všech pacientů léčených na KDHO je 81,2 %, celkové přežití (OS) je 87,6 % při mediánu sledování 15,5 roku (rozmezí 31,1 – 3,1 roku) (graf 1). EFS a OS podle jednotlivých klinických stadií ukazuje tab. 2. Rozdíl mezi křivkami je statisticky signifikantní (EFS p = 0,003, OS p = 0,0001). Z 330 pacientů mělo 58 (17,6 %) přítomny metastázy v době diagnózy, většina z nich (46 pacientů) byla IV. KS, čtyři pacienti byli V. KS, šest pacientů III. KS – ti měli metastatický proces lokalizován v dutině břišní (lymfatické uzliny – LU a/ nebo implantační metastázy na omentu). Dva pacienti II. KS, kteří měli metastázu v hilové LU, by byli v současné době hodnoceni jako III. KS.EFS pacientů s přítomností jakékoliv metastázy je 65,5 % oproti 84,6 %, které mají pacienti bez metastáz v době diagnózy (p = 0,0003). Rozdíl v OS je 70,7 % oproti 91,2 % (p < 0,0001). Podle lokalizace metastáz při diagnóze mají nejlepší přežití (OS) pacienti s plicními metastázami (76 %) oproti nemocným, kteří mají metastázy lokalizované v dutině břišní (62,5 %). Ze čtyř pacientů, kteří měli metastázu lokalizovanou v játrech, žije pouze jediný (p = 0,02) (graf 2).
Tab. 2. EFS a OS podle jednotlivých klinických stadií. 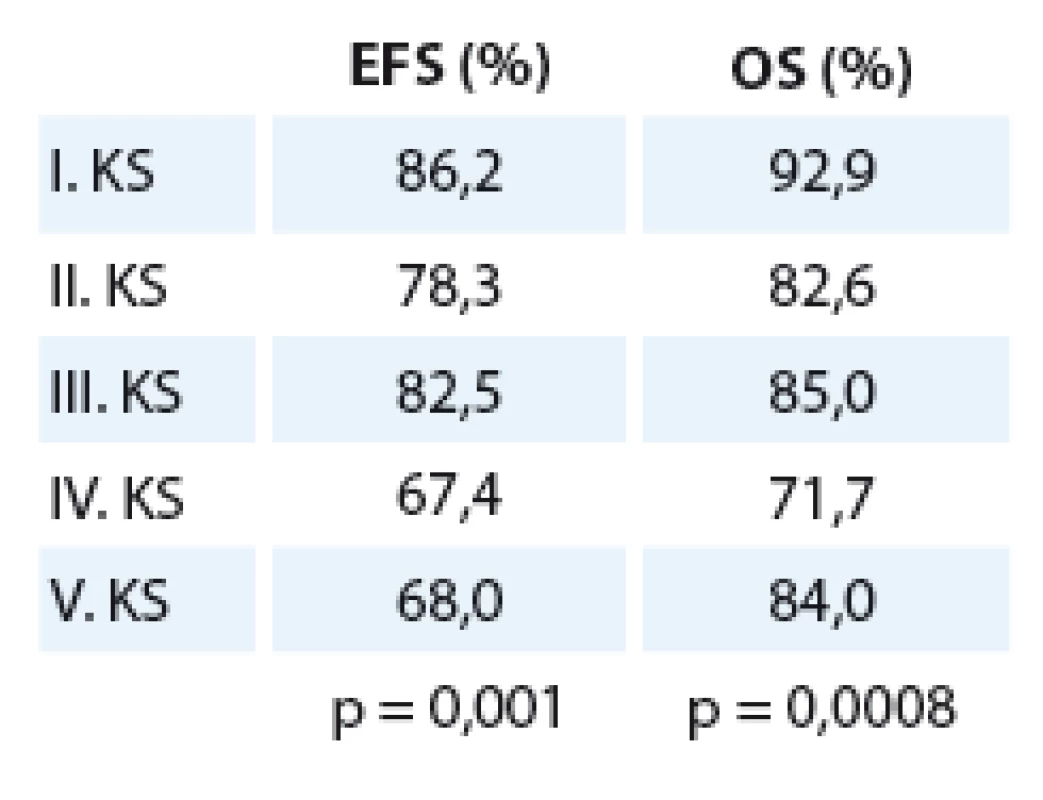
Graf 1. EFS a OS – celý soubor pacientů. 
Graf 2. OS podle typu metastáz při diagnóze. 
Z celkového počtu 330 pacientů bylo 170 (51,5 %) léčeno předoperační chemoterapií a/ nebo radioterapií. 158 pacientů (47,5 %) podstoupilo primární nefrektomii a chemo ‑ či radioterapií byli léčeni pouze adjuvantně. U dvou pacientů není údaj k dispozici, jedna pacientka nepodstoupila operační výkon z důvodu odmítnutí rodiči. Nejčastějším důvodem primární nefrektomie byla diagnostická nejistota ohledně etiologie maligního procesu v retroperitoneu, neobvyklý věk při diagnóze (pod 1/ 2 roku a nad 5 let) a dále známky náhlé příhody břišní (ruptura tumoru, masivní hematurie, krvácení do tumoru apod.). EFS a OS pacientů léčených primární chemoterapií či radioterapií jsou oproti pacientům léčeným primární nefrektomií téměř stejné: EFS 81,2 % vs 80,9 % (p = 0,85), OS 89,4 % vs 85,4 % (p = 0,38). Pouze v jednom případě ze 120 pacientů (u kterých jsme měli údaj k dispozici) léčených předoperační chemoterapií došlo k ruptuře tumoru v průběhu operace (0,8 %), z 98 pacientů léčených primární nefrektomií (u kterých jsme opět měli údaj k dispozici) došlo k perioperační ruptuře tumoru pouze 7krát (7 %) (p = 0,01).
Z celkového počtu 330 pacientů 60 (18 %) prodělalo recidivu onemocnění. Medián času od diagnózy do relapsu je 9,9 měsíce (rozmezí 1,8 – 48,5 měsíce). Relaps byl nejčastěji lokalizován metastatický – v plicích (30krát) a lokalizovaný v lůžku po nefrektomii (10krát), metachronní relaps v druhostranné ledvině (6krát), játra (2krát), mozek (2krát) a v 11 případech byl relaps kombinovaný (plíce, lymfatické uzliny, mozek či játra). Dvacet dva pacientů (36 %) nedosáhlo 2. kompletní remise onemocnění, 40 z 60 pacientů zemřelo. OS po prodělaném relapsu je 33 %. Z 12 pacientů, kteří měli relaps lokalizovaný izolovaně či kombinovaně v mozku či játrech, žije pouze jediný s mozkovou metastázou (8 %). Z 32 pacientů, kteří měli recidivu v plicích, jich žije 11 (34,4 %), nejlepší přežití má 16 pacientů, kteří prodělali relaps v lůžku tumoru či měli metachronní recidivu v druhostranné ledvině (50 %) (graf 3). Lepší výsledky přežití mají pacienti, kteří byli léčeni pro recidivu onemocnění po roce 1995 (52 %) oproti pacientům léčeným před rokem 1995 (25 %), byť rozdíl nedosahuje hranice statistické významnosti (p = 0,09).
Graf 3. OS pacienti s recidivou onemocnění. 
Dva pacienti byli léčeni pro sekundární malignitu (melanom a Ewingův sarkom), jedna pacientka zemřela na meningitidu v průběhu intenzivní chemoterapie.
Srovnání jednotlivých léčebných protokolů
Historická skupina KDO 86 a KDO 88
Mezi 1/ 1980 a 6/ 1988 jsme na KDHO FN v Motole léčili 91 pacientů s nefroblastomem. Medián sledování je 23,5 roku (16,6 – 31,2), EFS je 85,7 %, OS 91,2 % (graf 4).
Graf 4. EFS a OS podle jednotlivých protokolů. 
SIOP 9 Nephroblastoma Study
Mezi léty 7/ 1988 a 12/ 1993 bylo léčeno 94 dětí, medián sledování 17,86 roku (12,6 – 22,8), EFS 68,1 %, OS 74,5 % (graf 4).
SIOP 93 – 01 Nephroblastoma Study
Mezi léty 1/ 1994 a 12/ 2001 bylo léčeno 80 dětí s nefroblastomem, medián sledování 12,4 roku (5,9 – 17,4), EFS 83,6 %, OS 93,7 % (graf 4).
SIOP 2001 Nephroblastoma Study
Mezi roky 1/ 2002 a 4/ 2009 jsme léčili 65 pacientů s nefroblastomem, medián sledování 5,9 roku (3,1 – 9,9), EFS 87,7 %, OS 95,4 % (graf 4).
Diskuze
Naše výsledky potvrzují, že nefroblastom je již od 80. let minulého století dobře léčitelné onkologické onemocnění. Celkové přežití naší historické skupiny (1980 – 1988), kdy jsme nebyli zapojeni do mezinárodních léčebných protokolů, je na tehdejší dobu velmi dobré, EFS 86 %, OS 91 %. Chemoterapie trvala dva roky, paušální byla radioterapie na oblast lůžka nádoru (bez ohledu na klinické stadium), případně ozařování plic při metastatickém procesu, protože chirurgové v té době neoperovali plicní metastázy. Stejně tak nebylo možné stratifikovat léčbu podle histopatologické odpovědi na předoperační léčbu, protože radioterapie používaná i předoperačně znemožnila odlišení jednotlivých podtypů nefroblastomu. Důsledkem této velmi intenzivní terapie byly nejenom na tehdejší dobu naprosto excelentní výsledky přežití, ale na druhou stranu i závažné pozdní následky léčby, např. hypertenze u 8,6 % pacientů, těžká skolióza v důsledku radioterapie vyvíjející se páteře u 46 % pacientů a podobně [11].
Výsledky historické skupiny jsou tedy srovnatelné s výsledky tehdy používaných léčebných postupů [5]. První NWTS studie prokázala, že kombinace vinkristinu s aktinomycinem je u lokalizovaných nefroblastomů výrazně účinnější než podání obou cytostatik jednotlivě (3leté přežití AMD 67 %, VCR 70 %, AMD + VCR 85 %) [12]. Paralelně vznikla první evropská studie SIOP, která hodnotila nutnost předoperační radioterapie a na souboru 398 dětí s nefroblastomem prokázala, že předoperační radioterapie není nutná [13 – 15]. Na základě těchto prvních studií je kombinace vinkristinu a aktinomycinu D základním léčebným kamenem léčby nefroblastomů jak v Evropě, tak i v Severní Americe [16]. Součástí terapie u III. a IV. klinických stadií byl adriamycin, jehož účinnost u nefroblastomů dokázala 2. studie NWTS [15]. V historické skupině u vyšších klinických stadií byly používány kardiotoxické antracykliny v kumulativní dávce až do 300 mg/ m2. V polovině 80. let 20. století jsme předoperační radioterapii vyřadili z léčebného schématu a pooperační ozáření rezervovali jen pro rozsáhlé intraabdominální formy – stadium III.
2. etapa: SIOP 9 (1988 – 1993)
První SIOP studie (1, 2, 5) nejprve doložily, že předoperační radioterapie není nutná ke snížení rizika perioperační ruptury, posléze také, že u lokalizovaných forem není nutná ani pooperační radioterapie, a významně se začala zkracovat délka chemoterapie [13,14]. Podobně NWTS 3 a 4 redukovala nejen intenzitu chemoterapie, ale také dávku ozáření, jestliže byla radioterapie nutná [12].
Na přelomu 80. a 90. let se naše klinika začala aktivně účastnit probíhající SIOP studie SIOP Nephroblastoma Study 9, která hodnotila případný benefit prodloužení předoperační chemoterapie ze čtyř na osm týdnů formou randomizované studie. Vyhodnocením téměř 400 dětí s nefroblastomem se neprokázala výhoda prodloužení předoperační chemoterapie (ruptura nádoru 1 % vs 3 %, EFS 2leté bezpříznakové období 84 % vs 83 % a 5leté celkové přežití 92 % vs 87 %) [17].
V této etapě naší léčby jsme zaznamenali horší výsledky způsobené vyšším počtem především intraabdominálních relapsů (EFS 68 %), z nichž se významnou část podařilo vyléčit. V tomto období ještě nebyla samozřejmostí biopsie i nezvětšených paraaortálních uzlin a mohlo tak uniknout mikroskopické postižení uzlin [18]. Zároveň v tomto období byl mimořádně vysoký počet prognosticky nepříznivých lokalizací recidiv onemocnění (játra, mozek).
3. etapa: SIOP 93 – 01 (1994 – 2001)
Pokračuje redukce délky adjuvantní chemoterapie – u I. klinického stadia z 18 na čtyři týdny bez vlivu na EFS a OS [10]. Naše výsledky (EFS 83 %, OS 93 % všech klinických stadií) se podobají výsledkům celé studie [8,10]. Podobnou redukci chemoterapie lze vidět i ve NWTS studiích – úplné vyřazení chemoterapie u příznivých histologických typů I. klinického stadia [19].
4. etapa: SIOP Nephroblastoma Study 2001 (2002 – 2009)
Studie ještě není definitivně vyhodnocena, ale již se začínají rýsovat histopatologicky příznivé typy, např. stromální a epiteliální typy jsou prognosticky velmi příznivé [20].
Předoperační chemoterapie nebo iniciální nefrektomie představují hlavní rozdíl mezi SIOP a severoamerickými NWTS studiemi. Iniciální nefrektomie poskytuje chemoterapií neovlivněnou nádorovou tkáň pro případná vyšetření genetických prognostických markerů. Předoperační chemoterapie dokáže zmenšit nádor, „downstaging“ SIOP přes 50 % stadií I, snížit riziko peroperační ruptury (COG 20 %, SIOP 6 %, v naší sestavě 1 %) a ukáže citlivost nádorové tkáně na podávanou chemoterapii. Rizikem je však možnost mylných diagnóz, které však na zkušených pracovištích nepřesahuje 2 % [21]. Incidence našich mylných diagnóz u dětí s předoperační chemoterapií je mizivá a pohybuje se v řádech desetin procent (např. extrémně vzácný případ neuroblastomu ledviny). V situacích diagnostické nejistoty jsme spíše volili iniciální nefrektomii. Obecnou výhodou iniciální nefrektomie je možnost vyšetření nativní nádorové tkáně, která nebyla ovlivněna cytostatickou léčbou, což umožňuje detailní vyšetření moderními molekulárně biologickými metodami. NWTS rutinně vyšetřuje tkáň nefroblastomu na event. přítomnost ztráty heterozygozity 1. nebo 16. chromozomu (loss of heterozygozity – LOH), což znamená horší prognózu, a proto severoamerické studie tyto pacienty léčí intenzivnější chemoterapií [22]. Určitým přechodem mezi těmito dvěma přístupy je perkutánní biopsie tenkou jehlou prováděná v britských studiích, která dokáže odhalit benigní nádorové léze nebo jiné typy nádorů ledvin před zahájením chemoterapie [23].
Indikací pro iniciální nefrektomii byly diagnostické rozpaky, masivní hematurie, neobvyklý věk nebo spontánní perforace nádoru. Výsledky obou skupin, SIOP a NWTS, se podstatněji neliší, i přes odlišné řazení jednotlivých léčebných modalit [24]. Obdobně i naše výsledky pacientů primárně nefrektomovaných či léčených předoperační chemoterapií se přežitím bez události či celkovým přežitím v podstatě vůbec neliší. Perioperační ruptury tumoru byly v rukou našich velmi zkušených chirurgů zcela raritní záležitostí.
Léčba nefroblastomu nadále zůstává klinickou výzvou. V budoucích léčebných protokolech bychom chtěli zohlednit molekulární genetické prognostické markery z nádorové tkáně, aby nízce rizikoví pacienti nebyli přeléčováni, ale zároveň abychom agresivně léčili pacienty rizikové. Cílem je zachovat současné velmi dobré přežití pacientů s nefroblastomem a zároveň minimalizovat pozdní nežádoucí účinky léčby. Samostatnou kapitolou jsou pacienti s refrakterním onemocněním, u kterých dojde k recidivě nefroblastomu. Jejich léčebné výsledky jsou nadále neuspokojivé a tyto děti jsou kandidáty experimentální léčby.
Práce byla podpořena projektem MZ ČR - RVO, FN v Motole č. 00064203.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
as. MUDr. Josef Mališ
Klinika dětské hematologie a onkologie
2. LF UK a FN v Motole
V Úvalu 84
150 06 Praha 5
e-mail: josef.malis@fnmotol.cz
Obdrženo: 29. 3. 2013
Přijato: 23. 5. 2013
Zdroje
1. Wilms M. Die Mischgeschwulste der Niere. Leipzig: Verlag von Arthur Georgi 1899.
2. Ladd WE. Embryoma of the Kidney (Wilms‘ Tumor). Ann Surg 1938; 108(5): 885 – 902.
3. Gross RE, Neuhauser EB. Treatment of mixed tumors of the kidney in childhood. Pediatrics 1950; 6(6): 843 – 852.
4. Farber S, Pinkel D, Sears EM et al. Advances in chemotherapy of cancer in man. Adv Cancer Res 1956; 4 : 1 – 71.
5. D‘Angio GJ, Beckwith JB, Bishop HC et al. Proceedings: The national Wilms‘ tumor study: a progress report. Proc Natl Cancer Conf 1972; 7 : 627 – 636.
6. Boccon ‑ Gibod L, Rey A, Sandstedt B et al. Complete necrosis induced by preoperative chemotherapy in Wilms tumor as an indicator of low risk: report of the international society of paediatric oncology (SIOP) nephroblastoma trial and study 9. Med Pediatr Oncol 2000; 34(3): 183 – 190.
7. Weirich A, Leuschner I, Harms D et al. Clinical impact of histologic subtypes in localized non‑anaplastic nephroblastoma treated according to the trial and study SIOP ‑ 9/ GPOH. Ann Oncol 2001; 12(3): 311 – 319.
8. Graf N, van Tinteren H, Bergeron C et al. Characteristics and outcome of stage II and III non‑anaplastic Wilms‘ tumour treated according to the SIOP trial and study 93 – 01. Eur J Cancer 2012; 48(17): 3240 – 3248.
9. Owens CM, Veys PA, Pritchard J et al. Role of chest computed tomography at diagnosis in the management of Wilms‘ tumor: a study by the United Kingdom Children‘s Cancer Study Group. J Clin Oncol 2002; 20(12): 2768 – 2773.
10. de Kraker J, Graf N, van Tinteren H et al. Reduction of postoperative chemotherapy in children with stage Iintermediate ‑ risk and anaplastic Wilms‘ tumour (SIOP 93 – 01 trial): a randomised controlled trial. Lancet 2004; 364(9441): 1229 – 1235.
11. Radvanský J, Slabý K, Radvanská J et al. Pozdní následky Wilmsova tumoru a jeho léčby u pacientů léčených v letech 1980 – 2001 na jediném pracovišti. Klin Onkol 2010; 23(4): 245 – 255.
12. D‘Angio GJ, Breslow N, Beckwith JB et al. Treatment of Wilms‘ tumor. Results of the Third National Wilms‘ Tumor Study. Cancer 1989; 64(2): 349 – 360.
13. Lemerle J, Voute PA, Tournade MF et al. Preoperative versus postoperative radiotherapy, single versus multiple courses of actinomycin D, in the treatment of Wilms‘ tumor. Preliminary results of a controlled clinical trial conducted by the International Society of Paediatric Oncology (S.I.O.P.). Cancer 1976; 38(2): 647 – 654.
14. Lemerle J, Voute PA, Tournade MF et al. Effectiveness of preoperative chemotherapy in Wilms‘ tumor: results of an International Society of Paediatric Oncology (SIOP) clinical trial. J Clin Oncol 1983; 1(10): 604 – 609.
15. D‘Angio GJ, Evans A, Breslow N et al. The treatment of Wilms‘ tumor: results of the Second National Wilms‘ Tumor Study. Cancer 1981; 47(9): 2302 – 2311.
16. D‘Angio GJ, Evans AE, Breslow N et al. The treatment of Wilms‘ tumor: Results of the national Wilms‘ tumor study. Cancer 1976; 38(2): 633 – 646.
17. Tournade MF, Com ‑ Nougué C, Voûte PA et al. Results of the Sixth International Society of Pediatric Oncology Wilms‘ Tumor Trial and Study: a risk‑adapted therapeutic approach in Wilms‘ tumor. J Clin Oncol 1993; 11(16): 1014 – 1023.
18. Mališ J, Radvanská J, Slabý K et al. Treatment results in patients treated from 1980 to 2004 for Wilms‘ tumour in a single centre. Klin Onkol 2010; 23(5): 332 – 342.
19. Green DM, Breslow NE, Beckwith JB et al. Effect of duration of treatment on treatment outcome and cost of treatment for Wilms‘ tumor: a report from the National Wilms‘ Tumor Study Group. J Clin Oncol 1998; 16(12): 3744 – 3751.
20. Verschuur AC, Vujanic GM, Van Tinteren H et al. Stromal and epithelial predominant Wilms tumours have an excellent outcome: the SIOP 93 01 experience. Pediatr Blood Cancer 2010; 55(2): 233 – 238.
21. Zoeller G, Pekrun A, Lakomek M et al. Wilms tumor: the problem of diagnostic accuracy in children undergoing preoperative chemotherapy without histological tumor verification. J Urol 1994; 151(1): 169 – 171.
22. Grundy PE, Breslow NE, Li S et al. Loss of heterozygosity for chromosomes 1p and 16q is an adverse prognostic factor in favorable ‑ histology Wilms tumor: a report from the National Wilms Tumor Study Group. J Clin Oncol 2005; 23(29): 7312 – 7321.
23. Vujanić GM, Kelsey A, Mitchell C et al. The role of biopsy in the diagnosis of renal tumors of childhood: Results of the UKCCSG Wilms tumor study 3. Med Pediatr Oncol 2003; 40(1): 18 – 22.
24. D‘Angio GJ. The National Wilms Tumor Study: a 40 year perspective. Lifetime Data Anal 2007; 13(4): 463 – 470.
25. Vujanić GM, Sandstedt B, Harms D et al. Revised International Society of Paediatric Oncology (SIOP) working classification of renal tumors of childhood. Med Pediatr Oncol 2002; 38(2): 79 – 82.
Štítky
Detská onkológia Chirurgia všeobecná Onkológia
Článok vyšiel v časopiseKlinická onkologie
Najčítanejšie tento týždeň
2013 Číslo 5- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Kombinace metamizol/paracetamol v léčbě pooperační bolesti u zákroků v rámci jednodenní chirurgie
- Antidepresivní efekt kombinovaného analgetika tramadolu s paracetamolem
- Fixní kombinace paracetamol/kodein nabízí synergické analgetické účinky
-
Všetky články tohto čísla
- Editorial – k důvodům změn ve stagingu karcinomu vulvy
- Cykliny D v regulaci a dysregulaci buněčného cyklu u mnohočetného myelomu
- Důvody změn ve stagingu karcinomu vulvy
- Léčba infekcí u pacientů v paliativní symptomatické a terminální fázi onkologického onemocnění
- Proliferačná aktivita v dospelom mozgu potkana po expozícii ionizujúcim žiarením
- Nefroblastom – 30 let léčby ve Fakultní nemocnici v Motole
- Dosažení kompletní hematologické remise je zásadní pro prodloužení přežití nemocných s AL amyloidózou a srdečním postižením
- Klinické, histopatologické a zobrazovací charakteristiky non‑hodgkinských lymfomů u pacientů s postižením mozku
- Léčba polyneuropatické bolesti u nemocného s generalizovaným, kastračně rezistentním karcinomem prostaty – klinická kazuistika
- Chylózní ascites jako závažná komplikace neuroendokrinního tumoru ilea – kazuistika
- Informace z České onkologické společnosti
- Pacientka s atypickým neurocytomem – kazuistika
- Aktuality v onkologii
- Onkogeny RAS – prediktivní molekulární marker u kolorektálního karcinomu
-
Onkologie v obrazech
Spinocellulární karcinom v terénu jizvy po extravasaci cytostatika - ESMO
- 2. NÁRODNÍ KONGRES O KOLOREKTÁLNÍM KARCINOMU
- Klinická onkologie
- Archív čísel
- Aktuálne číslo
- Informácie o časopise
Najčítanejšie v tomto čísle- Léčba infekcí u pacientů v paliativní symptomatické a terminální fázi onkologického onemocnění
- Chylózní ascites jako závažná komplikace neuroendokrinního tumoru ilea – kazuistika
- Nefroblastom – 30 let léčby ve Fakultní nemocnici v Motole
- Důvody změn ve stagingu karcinomu vulvy
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



